Ester (Carbonsäureester)
Werbung

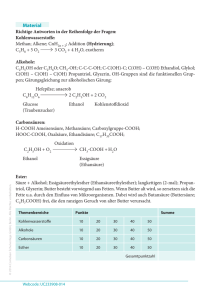
10. Klasse Ester (Carbonsäureester) Unterrichtsreihe: Ester Seite im Hefter: ....... Datum: .................. www.chemiezauber.de Funktionelle Gruppen sind reaktionsfähige Stellen organischer Moleküle, die entscheidend die Eigenschaften und das Reaktionsverhalten der Stoffe beeinflussen. Durch Reaktionen zwischen Molekülen mit verschiedenen funktionellen Gruppen lässt sich eine Vielzahl neuer Stoffe synthetisieren. Als eine mögliche Kombination betrachten wir die Reaktion einer Carbonsäure mit einem Alkohol am Beispiel von Ethansäure und Ethanol. Dieses Prinzip der organischen Synthese lässt sich auch auf andere Stoffgruppen anwenden. Vorüberlegung: Wasserlöslichkeit von Ethanol und Ethansäure Lehrerversuch: Zu Ethansäure wird Ethanol gegeben. Danach werden einige Tropfen konzentrierter Schwefelsäure (Vorsicht! Schutzbrille) zugegeben und das Reagenzglas geschüttelt und anschließend im Wasserbad erwärmt. Die Schwefelsäure wirkt hier als Katalysator, nimmt also nicht direkt am Reaktionsgeschehen teil, beschleunigt aber die Reaktion. Dann wird zum Gemisch Wasser zugegeben. Beobachtungen: Ethansäure und Ethanol reagieren unter dem katalytischen Einfluss von konzentrierter Schwefelsäure zu Ethansäureethylester und Wasser. Auch andere Alkohole und Carbonsäuren reagieren unter dem katalytischen Einfluss von konzentrierter Schwefelsäure zu Estern und Wasser. Dieser Vorgang wird Veresterung genannt. Die Bildung von Estern kann man sich formal durch Abspaltung von Wassermolekülen aus den beiden funktionellen Gruppen vorstellen. Reaktionen, bei denen Wasser abgespalten wird, nennt man auch Kondensationsreaktionen. Carbonsäure + Ethansäure + Alkohol Ethanol Wasser + Wasser + Ester Ethansäureethylester Eigenschaften und Verwendung von Carbonsäureestern Ester aus niederen Carbonsäuren und niederen Alkoholen werden wegen ihres fruchtartigen Geruchs als Duft- und Aromastoffe verwendet und deshalb auch Fruchtester genannt. Daneben sind diese Ester wichtige Lösemittel für Lacke, Farben und Klebstoffe. Wachse (z.B. Bienenwachs) sind Ester höherer Carbonsäuren und höherer Alkohole. Fette sind Ester höherer Carbonsäuren und des Glycerins. Ester sind im Allgemeinen nur wenig wasserlöslich. Die niederen Alkansäurealkylester weisen eine etwas bessere Löslichkeit auf. Begründe! Alle Ester besitzen eine gute Löslichkeit in Benzin. Die Siedetemperaturen der Ester liegen tiefer als die von Alkoholen bzw. Carbonsäuren ähnlicher Molekülmasse und Oberfläche. Begründe! Ester anorganischer Säuren Alkohole können auch mit anorganischen Säuren Ester bilden. So ist der Sprengstoff „Nitroglycerin“1, die explosive Komponente von Dynamit, der Trisalpetersäureester des Glycerins. Auch „Schießbaumwolle“ (Nitrocellulose) ist ein Salpetersäureester. Glycerin 1 + Salpetersäure → Trisalpetersäureester + Wasser Diese ölige Flüssigkeit explodiert schon bei geringen Erschütterungen. Durch Aufsaugen in Kieselgur konnte A. Nobel 1867 daraus den „Sicherheitssprengstoff“ Dynamit herstellen, der erst durch Initialzündung zur Explosion zu bringen ist.