Folie 1 - Extras Springer
Werbung

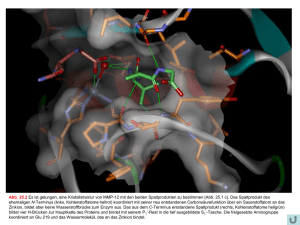
Abb. 26.26 Farnesyldiphosphat 26.63 bindet an FTase und besetzt einen Teil des großen katalytischen Zentrums. Es gelang, die Kristallstruktur des Enzyms mit diesem Substrat zu bestimmen (links, Farnesyldiphosphat grün). In GGTase werden Geranylgeranylreste 26.64 übertragen, die eine verlängerte Isoprenylkette besitzen (rot gezeichnete Isoprenylkette statt schwarzer Kette in 26.23). In der FTase begrenzen Trp 102β und Tyr 365β die Bindetasche und sorgen für eine Substratselektivität. Nach Bindung des Farnesylsubstrats diffundiert das Substratpeptid 26.65 (grau) mit seinem CAAX-Terminus in die Bindetasche. Katalysiert über ein benachbartes Zinkion, das den Cysteinrest des Substrats koordiniert, erfolgt die Übertragung des Farnesylrests auf die Thiolgruppe des Cysteins. Die Diphosphatgruppe wird nucleophil verdrängt. Auch mit dem entstandenen Produkt 26.66 (graugrün) konnte eine Kristallstruktur bestimmt werden. Sie ist links überlagert mit dem binären Komplex gezeigt. Der Farnesylrest bewegt sich in der Tasche (Pfeil). Das entstandene Produkt koordiniert an das Zinkion. Mit seinen beiden aliphatischen Resten A1 und A2 des CAAX-Motivs wird die Tetrapeptideinheit von dem Enzym erkannt. Das endständige Methionin (X) bildet mit seiner Carboxylatgruppe eine Wasserstoffbrücke zu Glu 167α.










![Die Kristallstruktur der ferroischen Verbindung Pb3[OI Ge04]](http://s1.studylibde.com/store/data/009338950_1-d1dafceb44d9863d6a66c68326bdb0ca-300x300.png)