Das Humangenomprojekt - theopenunderground.de
Werbung

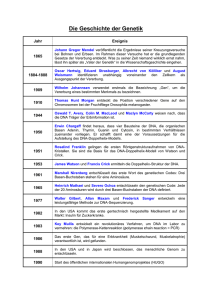
Das Humangenomprojekt Die 46 Chromosomen einer jeden Körperzelle des Menschen, hier sichtbar gemacht durch die Anfärbung mit Fluoreszenz-Farbstoffen, enthalten die komplette genetische Information in Form der Erbsubstanz DNA. Von der Grundlagenforschung zur Anwendung in der modernen Medizin H.-J. Hecht, Gesellschaft für Biotechnologische Forschung, Braunschweig Dieses 1990 gestartete, international koordinierte Projekt ist mit einem Umfang von ca. 3 Milliarden US-Dollar das größte, das jemals in der Biologie begonnen wurde. Ziel dieser gewaltigen Anstrengung ist es, das komplette „genetische Buch“, also alle 3 Milliarden „Buchstaben“ mit denen dieser Grundplan geschrieben ist, bis zum Jahr 2005 zu entschlüsseln und alle ca. 100.000 menschlichen Gene (die „Blaupausen“ für unsere stoffliche Grundlage) zu identifizieren. Seit 1995 beteiligt sich auch Deutschland mit jährlich ca. 40 Millionen DM an diesem Unternehmen. P. Ginter / Bilderberg, Hamburg Das Verständnis all unserer Erbinformation, des sogenannten menschlichen Genoms, verspricht, die Medizin auf eine völlig neue Basis zu stellen, weil dadurch zielgerichtete Ansätze für Vorbeugung, Diagnose und Behandlung einer Großzahl von Erkrankungen ermöglicht werden. Genetisch bedingte Erkrankungen sind zwar im allgemeinen relativ selten, doch ihre Auswirkungen sind oft dramatisch. Dies zeigt sich z.B. an der Mukoviszidose (Cystische Fibrose), einer Krankheit, bei der sich ein zäher Schleim in der Lunge ansammelt, welcher das Atmen langsam unmöglich macht. Die Bedeutung des Humangenomprojekts geht jedoch weit über den Bereich der genetisch bedingten Erkrankungen hinaus. So wird die Kenntnis aller molekularen Grundbausteine des menschlichen Organismus z.B. auch der pharmakologischen Forschung helfen, neue Zielmoleküle für eine gerichtetere Medikamentenentwicklung zu finden. Zudem werden vom Humangenomprojekt auch wichtige Impulse für das Verständnis der Krebsentstehung und die Behandlung dieser Erkrankungen ausgehen. Die Erbsubstanz DNA liegt in Form langer fadenförmiger Moleküle vor, die im Inneren unserer Zellen im Zellkern in einzelnen Chromosomen aufgespult sind. Jede menschliche Körperzelle enthält 23 Chromosomenpaare. Die DNA eines jeden Chromosoms wiederum trägt Tausende von Informationseinheiten, die sogenannten Gene. Gene bestehen aus kurzen DNA-Abschnitten und enthalten die Anweisung für die Herstellung bestimmter Eiweißstoffe, der Proteine. Die Proteine werden sowohl als Stütz- und Baumaterial für das menschliche Gewebe als auch für den Ablauf der Stoffwechselprozesse des Körpers benötigt. Diese vererbbaren Bauanleitungen sind in einem „4-Buchstaben-Kode“ geschrieben, bei dem jeder Buchstabe einem der chemischen Bausteine der DNA, den Nukleobasen, entspricht. Sie werden durch die vier Buchstaben A, G, C und T symbolisiert. Ähnlich wie die Buchstaben eines Buches in Worten und Kapiteln zusammengefaßt sind, reihen sich auch die Bausteine der DNA zu Informationseinheiten aneinander. In der „DNA-Sprache“ stellt eine bestimmte Abfolge von A, G, C und T ein Rezept für ein bestimmtes Protein dar. Wenn im genetischen Text ein Wort falsch „buchstabiert“ wird, so produziert die Zelle nicht das korrekte Protein oder aber eine falsche Menge des Proteins. Solche Fehler können das sensible Gleichgewicht unseres Organismus durcheinander bringen und deshalb zu einer Krankheit führen. In manchen Fällen, wie beispielsweise bei der Sichelzellenanämie, genügt schon ein einziger falscher Durch Mikroinjektion von DNA in embryonale Zellen von Mäusen kann die Funktion der durch diese Erbsubstanz kodierten Gene untersucht werden. Schon lange vor seinem Abschluß verspricht das Humangenomprojekt, Biologie und Medizin zu revolutionieren. In den nächsten Jahren wird es möglich werden, sämtliche Gene zu identifizieren, die an der Entstehung verschiedener Erkrankungen beteiligt sind. Solche Entdeckungen werden in vielen Fällen verbesserte Möglichkeiten zum frühzeitigen Nachweis und neue Ansätze für die Krankheitsvorbeugung mit sich bringen. Das Verständnis der molekularen Basis einer Krankheit ist die Voraussetzung für eine gezieltere Behandlung. Mäuse besitzen in etwa die gleiche Anzahl an Genen wie Menschen. Auch viele Körperfunktionen laufen ganz ähnlich ab. Daher können Mäuse mit einer entsprechenden Genveränderung oft auch die entsprechenden Krankheiten entwickeln, die man dann studieren kann. P. Ginter / Bilderberg, Hamburg Die eigentliche Trägerin der Erbinformation, die DNA, kann durch ihre einzigartige Struktur Information speichern und weitergeben. Bestimmte Abschnitte des Moleküls enthalten durch die Abfolge ihrer einzelnen Bausteine die Bauanleitung für ein bestimmtes Protein. Ein solcher Abschnitt der DNA wird als Gen bezeichnet. Unsere Gene steuern nicht nur das komplizierte Zusammenspiel, das die Entwicklung von einer befruchteten Eizelle zum erwachsenen Menschen bewirkt, sie beeinflussen auch unser Aussehen und viele unserer Eigenschaften. Wenn die Gene ihre Funktion nicht korrekt ausführen, kann dies schwere Krankheiten verursachen oder manche Menschen für bestimmte Erkrankungen extrem empfänglich machen. Baustein im Buchstabenkode der DNA, um die Krankheit auszulösen. Solche Abweichungen in unseren Genen sind verantwortlich für die geschätzten 3.000 - 4.000 eindeutig genetisch bedingten Erkrankungen, zu denen auch Morbus Huntington (Veitstanz), Mukoviszidose, Muskelschwund und viele andere gehören. Zudem weiß man inzwischen, daß veränderte Gene eine Rolle bei Krebs, Herz-Kreislauf-Erkrankungen, Diabetes mellitus und vielen anderen häufigen Erkrankungen spielen können. Bei diesen weit verbreiteten sogenannten komplexen Erkrankungen vergrößern genetische Veränderungen das Risiko einer Person, eine bestimmte Krankheit zu entwickeln. Die Krankheit selbst resultiert aus der Wechselwirkung genetischer Veranlagung und Umweltfaktoren, wie z.B. Ernährungsgewohnheiten, Streß oder Infektionen. Ein sich daraus ergebender Ansatz ist die Entwicklung neuer, hochspezifischer Medikamente, die die eigentlichen Ursachen einer Erkrankung und nicht nur deren Symptome bekämpfen. Beispielsweise kann man den Patienten das Genprodukt, das ihr Körper selbst nicht bilden kann, von außen zuführen, wie dies schon lange bei bestimmten Formen des Diabetes mellitus oder der Bluterkrankheit möglich ist. Inzwischen können eine ganze Reihe weiterer körpereigener Substanzen hergestellt werden, z.B. Interferone für die Krebs- und Virustherapie, Somatotropin für hormonbedingte Wachstumsstörungen oder Adenosin-Desaminase zur Behandlung schwerer, angeborener Immunschwäche bei Kindern. Ein weiterer Ansatz, an dem international geforscht wird, ist die Korrektur oder der Ersatz des veränderten Gens mit Hilfe der Gentherapie. Eine breite Anwendung dieser Möglichkeit bedarf jedoch noch intensiver Forschungsarbeit. Hat man eine krankheitsauslösende Genveränderung identifiziert, so ist die Entwicklung eines Tests möglich, der Patienten und ratsuchenden Menschen Gewißheit geben kann, ob sie dieses veränderte Gen besitzen oder nicht. Auch die Wahrscheinlichkeit, mit der eine solche Genveränderung an ihre Kinder weitergegeben wird, läßt sich berechnen. Bei bestimmten Leiden kann durch eine entsprechende frühzeitige Therapie der Krankheitsausbruch ganz vermieden werden. In anderen Fällen kann die Erkrankung so früh nachgewiesen werden, daß eine Behandlung mit großer Wahrscheinlichkeit zum Erfolg führt. Allerdings kann die Identifizierung eines bislang unbekannten Gens schwieriger sein als die sprichwörtliche Suche nach der „Nadel im Heuhaufen“. Dies trifft insbesondere dann zu, wenn bei Beginn der Suche der Krankheitsmechanismus noch nicht verstanden ist, wie es z.B. bei der Mukoviszidose der Fall war. Das Problem liegt in der riesigen Größe des menschlichen Genoms, das aus 3 Milliarden chemischen Bausteinen besteht. Wenn man jeden Baustein durch einen Buchstaben symbolisiert, so würde das menschliche Genom ausgedruckt 1.000 tausendseitige Bücher füllen. Irgendwo in diesem Meer von Buchstaben ist das verantwortliche Gen versteckt. Ohne einen Hinweis auf eine bestimmte Richtung müßte man Chromosom für Chromosom das gesamte Genom durchsuchen. Es ist nicht überraschend, daß vor Beginn des Humangenomprojekts mit dieser Methode nicht mehr als ca. ein Dutzend Gene gefunden wurden. Im Rahmen des Humangenomprojekts werden systematisch nach und nach neue Instrumente und Techniken entwickelt, durch die bislang unbekannte Gene immer schneller und effizienter identifiziert werden können. Doch wie findet man sich in dieser unübersichtlichen Welt der genetischen Information zurecht? Die ersten Hilfsmittel sind, wie bei der Orientierung in einer neuen Umgebung, Karten – in diesem speziellen Fall aber Chromosomen-Karten. Durch hochempfindliche Techniken kann man die Lage eines Gens an einem einzigen DNA-Molekülfaden zeigen. S. Stilgenbauer / P. Lichter, Deutsches Krebsforschungszentrum, Heidelberg Das Humangenomprojekt hat das Ziel, die vollständige „Bauanleitung“ des Menschen zu entziffern, d.h. die in seinem Erbmaterial, dem Genom, niedergelegte genetische Information in allen Einzelheiten zu verstehen. Diese bildet die individuelle genetische Grundlage jedes einzelnen von uns. S. Müller / J. Wienberg, Ludwig-Maximillians-Universität, München Eine besondere Art solcher Karten - die sogenannten genetischen Karten - nutzen Tausende von kurzen DNA-Abschnitten, die zwischen verschiedenen Menschen kleine Unterschiede aufweisen können und die mehr oder weniger gleichmäßig über die Chromosomen verteilt sind, als „Wegweiser“, mit deren Hilfe man sich bei der Untersuchung des Genoms zurechtfinden kann. Bei diesen Karten macht man sich zunutze, daß die beiden Chromosomen eines Chromosomenpaares meist nicht als Ganzes von einer Generation auf die nächste übertragen werden, sondern mit Ihrem Schwesterchromosom Stücke austauschen. Daß zwei Orte auf einem Chromosom gemeinsam an die nächste Generation weitergegeben werden, ist um so wahrscheinlicher, je näher sie beieinander liegen. Wenn wir bei dem Beispiel des „Buchs“ bleiben, so sind die Chancen, daß beim Zerreißen einer Seite der Riß zwei Worte trennt, die auf dieser Seite weit voneinander entfernt stehen, viel größer, als daß zwei benachbarte Worte getrennt werden. Die statistische Häufigkeit, mit der zwei Orte gemeinsam vererbt werden, kann also als Maß für ihre Entfernung zueinander dienen. So ist es über statistische Methoden in einem ersten Schritt oft möglich, die Distanz eines krankheitsauslösenden Gens zu einem bereits bekannten DNA-Abschnitt zu bestimmen. Der nächste wichtige Schritt ist die Schaffung sogenannter physikalischer Karten eines jeden Chromosoms. Der Name „physikalisch“ soll hier den Gegensatz zu genetischen Karten betonen. Damit sind Karten gemeint, die echte räumliche, also „physikalische“ Distanzen, im Gegensatz zu den oben erwähnten statistischen Distanzen, angeben. Physikalische Karten bestehen aus überlappenden Stücken von DNA, die große Teile eines Chromosoms abdecken. Die Entwicklung dieser Karten ist inzwischen sehr weit fortgeschritten. So kann man ein Gen zuerst durch eine genetische Karte einer bestimmten Region eines Chromosoms zuordnen und das DNA-Fragment dann genauer untersuchen, das dieser Region entspricht, anstatt alle Chromosomen durchsuchen zu müssen. Das letztendliche Ziel des Humangenomprojekts ist es, die Sequenz, also Buchstabe für Buchstabe die exakte Abfolge aller 3 Milliarden Bausteine, des menschlichen Genoms zu entschlüsseln und dabei jedes der ca. 100.000 darin enthaltenen Gene zu identifizieren. Zur Bewältigung dieser gigantischen Aufgabe kann man jedoch nicht einfach irgendwo mit der Bestimmung der Basenabfolge, der sogenannten Sequenzierung, beginnen. Das wäre momentan ein hoffnungsloses Unterfangen. Wissenschaftler aus verschiedenen Forschungsgebieten - Biologie, Medizin, Physik, Ingenieurs- und Computerwissenschaften, um nur einige zu nennen arbeiten gemeinsam an Techniken, um Zeit und Kosten des Sequenzierens zu reduzieren. Sobald die Sequenz des menschlichen Genoms vollständig bekannt ist, kann man die Aufmerksamkeit von der Suche nach den Genen, auf die viel spannendere Frage nach ihrer Funktion richten. Zu diesem Zweck werden auch andere Organismen als Modelle untersucht, wie beispielsweise die Fruchtfliege Drosophila, deren Gene den unseren zum Teil ähnlicher sind, als dies das so unterschiedliche Aussehen zunächst vermuten ließe. Schon in seinen ersten 8 Jahren hatte das Humangenomprojekt beträchtliche Erfolge vorzuweisen. Dank der Möglichkeiten, die sich aus dem Projekt entwickelt haben, hat sich die Geschwindigkeit der Entdeckung neuer Gene mehr als verfünffacht. Das Gen, das an der Entstehung der Mukoviszidose, der häufigsten tödlichen genetisch bedingten Erkrankung bei Europäern, beteiligt ist, wurde bereits 1989 identifiziert. In Deutschland trägt ca. jeder 25ste ein solches Krankheitsgen in sich, die Krankheit bricht jedoch nur aus, wenn ein Kind vom Vater und von der Mutter je eine veränderte Kopie des Gens erhält. Inzwischen steht ein diagnostischer Test zur Verfügung, durch den das veränderte Gen nachgewiesen werden kann, und die ersten klinischen Versuche zur Gentherapie haben begonnen. 1994 und 1995 wurden zwei Gene entdeckt, die bei seltenen erblichen Formen von Brustkrebs eine Rolle spielen. Trägerinnen eines solchen veränderten Gens haben ein stark erhöhtes Risiko, Brustkrebs zu entwickeln. Jetzt, da die Gene bekannt sind, ist es durch einen Test möglich, das veränderte Gen nachzuweisen. Frauen, die ein solches potentiell gefährliches Gen tragen, können sich dann durch verstärkte Kontrolluntersuchungen, aber auch durch bestimmte Verhaltensmaßnahmen, wie vitaminreiche Ernährung, Nichtrauchen und Verzicht auf Alkohol, besser vor der drohenden Gefahr schützen, wodurch die Todesrate der Erkrankung gesenkt werden kann. Außerdem hat die genaue Analyse der Genfunktion bereits erste Hinweise für eine gezieltere Therapie ergeben. Durch eine spezielle Präparationstechnik kann man die Chromosomen einer Zelle mit mehreren Farbstoffen gleichzeitig behandeln. Hierdurch kann man relativ einfach die Anzahl oder Strukturveränderungen der einzelnen Chromosomen kontrollieren. Solche mikroskopisch sichtbaren Veränderungen können oft schwerwiegende Erkrankungen zur Folge haben, verraten aber auch die Lage bestimmter Gene auf den Chromosomen. Am rechten oberen Bildrand erkennt man einen noch intakten Zellkern. Grafiken: Studio Wood Ronsaville Harlin, Inc., Annapolis, USA Wie kann man 1 Ein Kind wird mit einer derzeit nicht heilbaren genetisch bedingten Erkrankung geboren. Um eine spezifische Behandlung oder ein Mittel zur Verhinderung der Erkrankung bei anderen Kindern zu finden, muß die Ursache, ein verändertes Gen, gefunden werden. die Ursache für eine genetisch bedingte 2 Erkrankung finden? Eine kurze Einführung in die Grundlagen der Genetik: Eine menschliche Zelle: Jeder Mensch besteht aus der fast unvorstellbaren Anzahl von ca. 100 Billionen Zellen (das ist eine Eins mit 14 Nullen!). Jede dieser Zellen, mit Ausnahme der roten Blutkörperchen, enthält in Ihrem Zellkern das vollständige menschliche Genom – den vollständigen genetischen Bauplan, der jedem Menschen zugrunde liegt. Diese Information ist in ca. 3 Milliarden Nukleobasen, den Bausteinen der Erbsubstanz DNA, verschlüsselt. Jede gewöhnliche Zelle enthält diese Erbinformation zweifach: eine Kopie von der Mutter und eine Kopie vom Vater. Der Zellkern: Im Innern eines jeden Zellkerns ist das Erbmaterial, die DNA, die eine Länge von fast zwei Meter hat, in 23 Chromosomenpaaren verpackt. Ein Chromosomenpaar besteht aus je zwei Chromosomen, von denen jeweils eines von der Mutter und eines vom Vater stammt. Ein Chromosom: Jedes der 46 menschlichen Chromosomen im Zellkern enthält dicht zusammengepackt die Erbsubstanz DNA für Hunderte oder Tausende verschiedener Gene, den Einheiten der Vererbung. Die DNA: DNA steht für das englische Wort deoxyribonucleic acid, zu deutsch Desoxyribonukleinsäure oder DNS. Die DNA ist die chemische Substanz, die durch ihre einzigartige Struktur Information über den Bauplan des Lebens speichern und weitergeben kann. Die Information ist durch die Abfolge („Sequenz“) von vier verschiedenen Bausteinen, den Nukleobasen Adenin (A), Guanin (G), Cytosin (C) und Thymin (T) entlang des fadenförmigen DNAMoleküls verschlüsselt. Die DNA besteht eigentlich aus zwei einzelnen Molekülen, die sich wie ein Reißverschluß zu einem Doppelstrang zusammenlagern. Die Basen der beiden Einzelstränge bilden dabei sich gegenüberstehende Paare. Dabei kann A immer nur T und C immer nur G gegenüberstehen. Ein Gen: Jedes Gen entspricht einem bestimmten Abschnitt des doppelsträngigen DNA-Moleküls. Es enthält die Anleitung zur Herstellung eines spezifischen Moleküls, normalerweise eines Proteins. Diese Anleitung ist durch die unterschiedliche Abfolge der vier Nukleobasen A, G, C und T festgelegt. Dabei bestimmt die Kombination aus jeweils drei aufeinanderfolgenden Nukleobasen der Erbsubstanz einen Baustein eines Proteins. Ein Protein: Die Bausteine der Proteine sind Aminosäuren. Die Proteine bilden nicht nur das Grundgerüst der einzelnen Zellen, sie sind lebenswichtige Komponenten aller Organe und an allen chemischen Abläufen im Körper beteiligt. Aufgrund der in der Erbsubstanz DNA festgeschriebenen Bauanleitung werden die verschiedenen Aminosäuren wie Perlen an einer Kette aneinandergereiht. Die Funktion der Proteine wird durch ihre Form bestimmt, die ihrerseits durch die Abfolge der Aminosäuren bestimmt ist. Nahezu 4.000 genetisch bedingte Erkrankungen des Menschen sind bekannt. Mit der Zeit können wir durch intensive Forschungsarbeit viele dieser Erkrankungen behandeln oder ihren Ausbruch verhindern. Dazu müssen jedoch drei Fragen beantwortet werden: • • • Welches veränderte Gen verursacht die Erkrankung? Welches Protein wird normalerweise durch das Gen hergestellt? Kann das veränderte Protein korrigiert oder ersetzt werden? Dazu können zwei unterschiedliche Strategien verfolgt werden: Vielleicht kann das veränderte Protein aufgespürt werden (falls es sich in dem von der Krankheit betroffenen Gewebe nachweisen läßt). Davon ausgehend kann man dann das Gen finden, das für dieses Protein kodiert. Falls das nicht möglich ist, wird eine Methode angewendet, die als Positionsklonierung bezeichnet wird. Dabei wird zuerst das Gen isoliert, indem man den DNAAbschnitt, der zusammen mit der Erkrankung vererbt wird, immer weiter eingrenzt und dann das Protein, das von ihm kodiert wird, identifiziert. Der hier gezeigte Ablauf stellt vereinfacht die Positionsklonierung dar. Diese Strategie hat in neuerer Zeit zu spektakulären Durchbrüchen bei der Diagnose und z.T. auch bei der Behandlung verschiedener genetisch bedingter Erkrankungen geführt, z. B. von Mukoviszidose (Cystischer Fibrose), Duchenne-Muskeldystrophie, Morbus Huntington (Veitstanz), erblichem Brustkrebs und anderen. Welches Gen ist für die Erkrankung verantwortlich? Verschiedene Hinweise, wie z.B. das im Mikroskop sichtbare Fehlen eines Stückes in einem Chromosom, können die ungefähre Lage des Gens auf dem Chromosom verraten. Wenn es keine solche Hinweise gibt, suchen Wissenschaftler nach „Markern“ der Erkrankung, indem sie bestimmte Abschnitte der DNA des erkrankten Kindes mit der seiner Eltern, Verwandten und Mitgliedern anderer Familien vergleichen. Solche Marker, die gehäuft zusammen mit der Erkrankung weitergegeben werden, können durch die Identifizierung ihrer Lage Aufschluß darüber geben, auf welchem Chromosom das veränderte Gen liegt. Auf diese Art kann nach und nach die Lage eines Gens zwischen zwei bekannten Markern bestimmt werden. 3 Das Ergebnis: Die Lage des veränderten Gens kann identifiziert werden, indem die Vererbung der Marker in der betroffenen Familie verfolgt wird. Dabei können auch gesunde Träger des veränderten Gens diagnostiziert werden, was für Ehepaare mit Kinderwunsch wichtig sein kann, um das Risiko weiterer betroffener Nachkommen abzuschätzen. In der hier gezeigten Familie tritt eine rezessive Erkrankung auf, d.h. die Krankheit bricht nur aus, wenn ein Kind das veränderte Gen von beiden Elternteilen erhält. 4 Diese Marker können dazu benutzt werden, überlappende Teilstücke der DNA, die den Bereich zwischen den begrenzenden genetischen Markern repräsentieren, zu isolieren. Eines dieser Teilstücke muß das veränderte Gen enthalten. 10 Um eine genetische Veränderung auszugleichen, kann versucht werden, das fehlende oder nicht funktionsfähige Protein durch ein Medikament oder das normale Protein zu ersetzten. Dies geschieht schon seit langer Zeit mit großem Erfolg z.B. mit Insulin bei bestimmten Formen von Diabetes mellitus, mit dem Blutgerinnungsfaktor VIII bei bestimmten Bluterkrankheiten oder mit Erythropoietin bei Blutarmut. 7 Wenn die Basenabfolge des Gens bekannt ist, kann über den genetischen Kode die Zusammensetzung des Proteins bestimmt werden. Das genaue Studium des Proteins kann dann seine normale Funktion aufklären. Die Zehntausende von Proteinen des Körpers haben alle verschieden Formen und Funktionen, abhängig von ihrem Bauplan, der wiederum in den Genen festgelegt ist. 8 Produziert das veränderte Gen des erkrankten Kindes zuwenig Protein, ein defektes Protein oder aber überhaupt kein Protein? Wir können lernen, wie die Veränderung im Protein zu der Erkrankung führen kann. 9 Ergebnis: Sowie der Mechanismus, der zur Erkrankung führt, verstanden ist, kann an neue Ansätze zur Behandlung – gerichtet entweder auf das Protein oder das Gen – gedacht werden. Das Verständnis auch relativ seltener genetisch bedingter Erkrankungen kann – wie schon oft geschehen – wichtige Einblicke in häufig vorkommende oder komplexe Erkrankungen liefern. Für welches Protein 5 Nachdem das veränderte Gen eingekreist ist, wird jeder DNA-Abschnitt genau untersucht: Unterscheidet es sich von der DNA eines Menschen, der diese Erkrankung nicht hat? Schließlich kann so das verantwortliche Gen gefunden und die Veränderung in seiner Basenabfolge bestimmt werden. Der häufigste Defekt im Gen für die Mukoviszidose ist das Fehlen von drei seiner insgesamt über 250.000 DNA-Basen. 6 Ergebnis: Patienten können direkt auf die Erkrankung getestet werden. Auch gesunde Träger des veränderten Gens können diagnostiziert werden, was in betroffenen Familien wichtig für die Risikoabschätzung ist. Für die Entwicklung neuer Behandlungsmethoden können Krankheitsprozesse in Zellkulturen oder an Tieren studiert werden. kodiert es? 11 Kann das Protein oder das Gen Eine weitere Option bietet künftig die Gentherapie. Mit Hilfe eines Virus, in das ein funktionstüchtiges Gen eingesetzt wurde, kann dieses in die betroffenen Körperzellen eingeschleust werden. Auch an Methoden, die ohne Viren auskommen, z.B. der direkten Injektion von DNA in die Zellen oder der Übertragung von DNA über feinste Fetttröpfchen wird gearbeitet. Methoden, die in Zellkultur erfolgreich angewendet wurden, werden zunächst auf Tiere und dann erst auf Menschen im Rahmen einer streng kontrollierten klinischen Prüfung übertragen. Zum Beispiel können die Knochenmarkszellen eines Patienten isoliert, mit der korrekten Version eines Gens behandelt und anschließend dem Patienten zurückgegeben werden. ersetzt werden? 12 Ergebnis: Für manche genetisch bedingte Erkrankungen werden sich Behandlungsmöglichkeiten entwickeln lassen. Menschen werden jedoch immer genetische Veränderungen in sich tragen, es gibt keine genetisch „perfekten“ Menschen. In Zukunft werden Vorbeugungsprogramme, frühzeitiges Erkennen einer Erkrankung und verbesserte Behandlungsmöglichkeiten die Leiden, die durch genetische Erkrankungen verursacht werden, erheblich verringern können. So kann erreicht werden, daß auch Menschen mit genetisch bedingten Erkrankungen oder Prädispositionen für solche Leiden eine unbeschwerte Lebensperspektive erhalten. Brustkrebs: Rechtlich und gesellschaftlich muß sichergestellt sein, daß genetische Daten nur mit Zustimmung des Betroffenen erhoben werden. Diese Informationen dürfen keinesfalls zum Nachteil der getesteten Person sein und nicht unerlaubt an Dritte weitergegeben werden. Es muß ausgeschlossen sein, daß ein Mensch aufgrund einer Veranlagung für eine bestimmte Erkrankung gegenüber Versicherungen oder auf dem Arbeitsmarkt benachteiligt wird. Zur Erforschung und Lösung ethischer, rechtlicher und sozialer Fragen, die durch die Genomforschung aufgeworfen werden, hat das Humangenomprojekt seit seinem Start ca. 5% des Budgets eingesetzt. Durch sorgfältige Beachtung der ethischen Problematik, adäquater Gesetzgebung sowie einer umfassenden Aufklärung der Gesellschaft sollten so aus dem Humangenomprojekt alle Vorteile für Erkrankte, Risikopersonen wie auch für die Forschung gezogen werden können. Bei einem Mäuseembryo kann die Funktion bestimmter Gene im Laufe der Entwicklung der einzelnen Gewebe studiert werden. Dr. Tom Shakesperare, Soziologe an der Universität Leeds, leidet an Achondroplasie, einer genetisch bedingten Form der Kleinwüchsigkeit. Er setzt sich aktiv für die Rechte von Behinderten ein. Zusammen mit Prof. John Burn, Genetiker an der Universität Newcastle, engagiert er sich in der Diskussion um die ethischen Aspekte der Humangenomforschung. Eine breite gesellschaftliche Diskussion aller Gruppen kann dafür sorgen, daß die sich aus dem Humangenomprojekt ergebenden Möglichkeiten zum Wohl aller genutzt werden. Die Fruchtfliege Drosophila ist einer der am besten untersuchten Organismen. Vor allem zu der Frage, wie aus einem Ei ein komplexer Organismus entstehen kann, hat die Drosophila-Forschung viel beigetragen, da man über bestimmte Techniken zeigen kann, welche Gene zu bestimmten Zeiten in verschiedenen Bereichen des sich entwickelnden Embryos aktiv werden. Gegenwärtig wird auch das Drosophila-Genom, das ca. 1/20 des menschlichen Genoms umfaßt, sequenziert. Neue Erkenntnisse der Genetik lassen auf verbesserte Prävention und Behandlung hoffen Brustkrebs ist die häufigste Krebserkrankung bei Frauen. Das Risiko, im Laufe des Lebens daran zu erkranken, liegt in der westlichen Welt bei ca. 10 %. Bei Männern kommt Brustkrebs dagegen nur in ganz vereinzelten Fällen vor. Brustkrebs ist eine sehr gefährliche Krebsform, bei der der Behandlungserfolg ganz entscheidend vom Zeitpunkt der Diagnose abhängt. Die meisten Brustkrebsfälle entstehen sporadisch, d.h. die Erkrankung wird durch bestimmte Genveränderungen ausgelöst, die erst im Laufe des Lebens in einzelnen Zellen des Brustgewebes entstehen. Diese Veränderungen werden nicht an die Kinder vererbt. Daher gibt es in den Familien betroffener Frauen keine Häufung der Erkrankung. Liegt jedoch eine Genveränderung vor, die von einem Elternteil auf eine Tochter übertragen wurde, so ist ihr Risiko, im Laufe des Lebens an Brustkrebs zu erkranken, um ein vielfaches erhöht. Krebs entsteht in mehreren Schritten durch ein Zusammenspiel von verschiedenen Veränderungen (Mutationen) in unterschiedlichen Genen im Wechselspiel mit Umweltfaktoren, wie z.B. Ernährungsgewohnheiten oder anderen Formen des Lebensstils (Rauchen, Alkohol, Streß u.a.). Bei den häufigsten, den nicht-erblichen Formen von Krebs, treten die genetischen Veränderungen erst nach der Geburt auf. Personen, die ein vererbtes Risiko für Krebs haben, sind dagegen mit einem veränderten Gen geboren worden - mit anderen Worten, sie sind von Geburt an einen Schritt näher an der Krebsentstehung. Bei Brustkrebs haben z.B. Frauen, die ein verändertes Gen von einem ihrer Eltern vererbt bekommen, ein ca. 70%iges Risiko, diese Krankheit zu entwickeln. Vor allem bei Frauen, die schon in frühen Jahren an Brustkrebs erkranken, ist der Anteil derer, die erblich belastet sind, erheblich. Obwohl Wissenschaftler schon seit Jahren vermuteten, daß ein verändertes Gen für die familiäre Form des Brustkrebses verantwortlich ist, war es schwierig, es aufzuspüren, da es wenig Hinweise gab, auf welchem der 23 Chromosomenpaare es zu finden sei. Schließlich gelang es einem Forscherteam mit Hilfsmitteln und Techniken, die im Genomprojekt entwickelt worden waren, Chromosom 17 als Genort ausfindig zu machen. Einige Zeit später konnte das verantwortliche Gen gefunden werden. Es wurde BRCA1 genannt*. Kurz darauf wurde ein zweites Gen, BRCA2, auf Chromosom 13 gefunden, das ebenfalls einen Einfluß auf die Entstehung von Brustkrebs haben kann. Diese Entdeckungen geben eine erste Vorstellung, welchen Einfluß das Humangenomprojekt auf die Medizin haben wird, indem es neue Wege zur Prävention aufzeigt. Die ersten Nutznießer sind diejenigen Familien, die ein hohes Risiko haben, an Brustkrebs zu erkranken. Derzeit wird an der Entwicklung eines einfachen Bluttests gearbeitet, der in den krebsgefährdeten Familien feststellen kann, wer das veränderte Gen trägt und wer nicht. Personen, bei denen das veränderte Gen festgestellt worden ist, wird dann geraten, durch Manche Genprodukte lassen sich sogar an einzelnen Zellen nachweisen (hier eine Zelle des Nervengewebes der Fruchtfliege). Dies läßt wichtige Rückschlüsse auf deren Funktion zu. Die Mammographie ermöglicht die genaue Untersuchung der weiblichen Brust und gegebenenfalls die möglichst frühe Diagnose von Brustkrebs. In diesem Fall ist, durch eine spezielle Untersuchungsmethode dargestellt, ein invasives Karzinom, also ein bösartiger Tumor, als weißer Bereich in der rechten Brust erkennbar. *BRCA, für breast cancer, zu deutsch Brustkrebs M. Knopp, Deutsches Krebsforschungszentrum, Heidelberg Manche Erkrankungen werden sicher auch in Zukunft nur schwer zu behandeln sein. Für viele eröffnet sich jedoch durch das Verständnis des Mechanismus, das man mit der Kenntnis des entsprechenden Gens erhält, durch intensive weitere Forschung mittelfristig eine Perspektive auf eine Therapie. Solange jedoch nur eine genetische Diagnostik möglich ist, muß von Seiten der Ärzte und des Gesetzgebers darauf geachtet werden, daß die betroffenen Personen auch sinnvoll beraten und psychologisch begleitet werden. H. Jäckle, Max-Planck-Institut für Biophysikalische Chemie, Göttingen Die neue Möglichkeit, unsere Gene zu untersuchen, kann jedoch ein zweischneidiges Schwert sein. Bei vielen Erkrankungen sind unsere Möglichkeiten, das defekte Gen nachzuweisen, unseren Fähigkeiten, etwas gegen die Erkrankung zu tun, weit voraus. Morbus Huntington (Veitstanz) ist das Paradebeispiel hierfür. Bei dieser Erkrankung scheinen die Betroffenen in den ersten Lebensjahrzehnten völlig gesund. Dann kommt es zu Veränderungen im Gehirn, die zum Zusammenbruch aller geistigen Fähigkeiten führen und die innerhalb weniger Jahre mit dem Tod enden. Obwohl ein exakter Test für Morbus Huntington schon seit 1993 zur Verfügung steht, hat sich nur eine Minderheit der Personen, bei denen diese Krankheit in der Familie auftrat, dazu entschieden, sich testen zu lassen. Der Grund: Es gibt bislang noch keine Möglichkeit, Morbus Huntington zu heilen oder auch nur den Ausbruch der Erkrankung zu verhindern. Viele Menschen möchten verständlicherweise lieber mit der Unsicherheit leben als mit der Gewißheit, im Laufe ihres Lebens von einer tödlichen Krankheit eingeholt zu werden. Wellcome Trust Medical Photographic Library, London K. Wunsch / M. Hrabe de Angelis, GSF Forschungszentrum für Umwelt und Gesundheit, Oberschleißheim H. Jäckle, Max-Planck-Institut für Biophysikalische Chemie, Göttingen J. Maurer, DHGP / A. Förster, MDC Mikrosatellitenzentrum, Berlin Trotz der vielleicht lebensrettenden Möglichkeiten solcher diagnostischer Tests muß in der allgemeinen medizinischen Praxis sehr behutsam damit umgegangen werden. Schon für die Entscheidung einen solchen Test durchführen zu lassen oder nicht, benötigen die Betroffenen umfassende Informationen, nicht nur über die Krankheit und ihre Risiken, sondern auch über den Test und seine Grenzen. Genauso wichtig ist es, daß der Test bei seiner Durchführung von einer kompetenten Beratung begleitet wird, damit die Menschen mit den Informationen über ihr Risiko umgehen können, wie auch immer das Resultat ausfallen mag. Bereits bevor sich der Betroffene für einen Test entscheidet, sollte er wissen, ob und welche Strategien für Risikopersonen zur Verfügung stehen und wie ihre Erfolgsaussichten nach den neusten Erkenntnissen eingeschätzt werden. Es ergeben sich hierdurch auch allgemeine gesellschaftliche Fragen, z.B. wie die Vertraulichkeit genetischer Information gewahrt wird und wie man sicherstellt, daß sie nicht dazu benutzt wird, Personen im Berufsleben oder bei Versicherungen zu benachteiligen. Herausgegeben von der Geschäftsstelle des Wissenschaftlichen Koordinierungskomitees des Deutschen Humangenomprojekts. Heubnerweg 6 D-14059 Berlin Dr. Johannes Maurer Tel.: 030-32639 171 Fax: 030-32639 181 E-mail: [email protected] Gefördert aus Mitteln des Bundesministeriums für Bildung, Wissenschaft, Forschung und Technologie Die Identifizierung der Gene, die für eine Prädisposition für Brustkrebs verantwortlich sind, ist nur eine von vielen Erkenntnissen, die im Verlaufe des Humangenomprojekts bereits gewonnen wurden und die noch erwartet werden. Wenn wir die ethischen und sozialen Aspekte jetzt sorgfältig prüfen, so wird dies helfen, Politik, Öffentlichkeit und alle, die in medizinischen Berufen tätig sind, auf die Möglichkeiten vorzubereiten, die vor uns liegen. K. Saar, MDC Mikrosatellitenzentrum, Berlin entsprechende Lebensführung zusätzliche Risiken zu reduzieren, mit dem Ziel, auf diese Weise den Ausbruch der Erkrankung zu verhindern. Außerdem sollten sie von einem möglichst frühen Zeitpunkt an eine regelmäßige Brustuntersuchung durchführen lassen. Speziell für die engmaschige Kontrolle von Frauen mit erhöhtem Brustkrebsrisiko wurden von Fachärzten wenig belastende Untersuchungsprogramme ausgearbeitet, die dabei helfen sollen, Knoten in der Brust, die auf eine beginnende Tumorentstehung hinweisen können, früh im Krankheitsprozeß zu erkennen und zu behandeln, bevor sie bösartig werden können. Für diejenigen Frauen, bei denen festgestellt wird, daß sie kein verändertes Gen tragen, kann der diagnostische Test eine große Erleichterung sein, indem er die Angst, unter der sie vielleicht gelebt haben, beseitigt und die Notwendigkeit der häufigen Untersuchungen erspart. DNA wird normalerweise aus einer kleinen Blutprobe isoliert. Die Abfolge der Einzelbausteine der DNA wird dann über sogenannte DNASequencer bestimmt. Solche Geräte werden sowohl für die Grundlagenforschung im Humangenomprojekt als auch in manchen Fällen zur Diagnose bestimmter Erkrankungen, z.B. für genetisch bedingten Brustkrebs, eingesetzt. Zum Auffinden eines bisher unbekannten krankheitsauslösenden Gens werden bestimmte Stellen (sogenannte Marker) in der Erbsubstanz gesunder und erkrankter Mitglieder einer Familie, in der eine genetische Erkrankung auftritt, miteinander verglichen. Jede erkennbare senkrechte Spur beinhaltet die Erbsubstanz eines einzigen Familienmitglieds. Mit dieser Methode werden die unterschiedlichen Größen der einzelnen Marker (gelb, grün, blau) bestimmt. Marker, die gehäuft bei Erkrankten auftreten, geben einen Hinweis auf die Lage des Gens auf den Chromosomen. Ein beigefügter Größenstandard erscheint rot. http://www.dhgp.de Teile dieser Broschüre wurden mit freundlicher Genehmigung vom National Institute of Health, Bethesda, MD, USA und vom Howard Hughes Medical Institute, Bethesda, MD, USA, übernommen (NIH Publication No. 96-3897). Wir danken Dr. Barbara Hobom für die Durchsicht des Textes. Graphiken: Studio Wood Ronsaville Harlin, Inc., Annapolis, MD, USA Gestaltung: HOCH3, Berlin Druck: movimento network, Berlin Titelbild: J. Tajbakhsh / P. Lichter, Deutsches Krebsforschungszentrum, Heidelberg