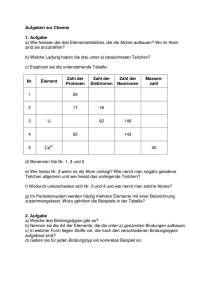
Dokument_1. - KLUEDO
Werbung

Zum Stoffübergang bei der Flüssig-Flüssig Extraktion im elektrischen Hochspannungsfeld vom Fachbereich Maschinenbau und Verfahrenstechnik der Technischen Universität Kaiserslautern zur Verleihung des akademischen Grades Doktor-Ingenieur (Dr.-Ing.) genehmigte Dissertation von Dipl. Chem. Andreas Wildberger aus Ludwigshafen a. Rh. Eingereicht am: 17. Februar 2004 Tag der mündlichen Prüfung: 15. Juli 2004 Dekan: Prof. Dr.-Ing. P. Steinmann Vorsitzender: Prof. Dr.-Ing. D. Wüstenberg Referenten: Prof. Dipl.-Ing. Dr. techn. H.-J. Bart Prof. Dr.-Ing. K.-H. Baumann Kaiserslautern, im Mai 2005 D 386 Vorwort Die vorliegende Arbeit entstand während meiner Tätigkeit als wissenschaftlicher Mitarbeiter am Lehrstuhl für Thermische Verfahrenstechnik der Technischen Universität Kaiserslautern in der Zeit von 01.04.1999 bis 30.09.2003. Danksagung Mein besonderer Dank gilt meinem Doktorvater, Herrn Prof. Dipl.-Ing. Dr. techn. HansJörg Bart, für sein mir entgegengebrachtes Vertrauen, die fachliche Unterstützung und Diskussionsbereitschaft. Seine konstruktiven Anregungen und der mir gewährte Freiraum haben wesentlich zum Gelingen dieser Arbeit beigetragen. Weiterhin danke ich Herrn Prof. Dr.-Ing. Karl-Heinrich Baumann von der Martin Luther Universität Halle-Wittenberg für sein großes Interesse an meiner Forschungsarbeit und die Übernahme des Koreferates, sowie Herrn Prof. Dr.-Ing. Dieter Wüstenberg für die Übernahme des Prüfungsvorsitzes. Allen jetzigen und ehemaligen Mitarbeitern des Lehrstuhls danke ich für die gute Zusammenarbeit und die vielseitigen und angeregten Diskussionen, die mir in besonderer Erinnerung bleiben werden. Ein besonderer Dank gebührt auch Herrn Prof. Dr.-Ing. Paul Weiß vom Lehrstuhl für Hochspannungstechnik und Elektromagnetische Verträglichkeit (EMV) sowie den Mitarbeitern Herrn Dipl.-Ing. Michael Renner, Karsten Glöser und Markus Faller, die entscheidend bei der Entwicklung der Hochspannungsmesstechnik, sowie der Feldmodellierung mitgewirkt haben. Herrn Prof. Baumann, sowie den Mitarbeiterinnen Frau Dr.-Ing. Karin Mühlfriedel und Frau Dipl.-Ing. Andrea Grimm danke ich zusätzlich für die angenehme Arbeitsatmosphäre und Diskussionsbereitschaft beim gemeinsam in Halle durchgeführten Kooperationsprojekt zur laseroptischen Determination der feldinduzierten Grenzflächenprofile beim Stoffübergang, sowie den Herren Dr.-Ing. habil. Reinhard Miller und Dr.-Ing. Jürgen Krägel vom Max-Planck Institut in Golm für die durchgeführten Kooperationsarbeiten zur Bestimmung der Grenzflächenspannung im elektrischen Hochspannungsfeld. Darüber hinaus danke ich den Diplom-Ingenieuren Jörg Schenkel und Stefan Anton Schmidt, sowie den Herren Laroui Abelatif, Michael Hoogen, Steffen Stenger, Eduard Skrivanek, Gabriel Quapp und Sven Anspach, die im Rahmen von Studien- und Diplomarbeiten, oder in ihrer Funktion als wissenschaftliche Hilfskräfte einen wesentlichen Beitrag zu dieser Arbeit geleistet haben. Auch danke ich unserem Chemotechniker, Herrn Lothar Drumm, für die tatkräftige Unterstützung bei allen Laborarbeiten, sowie der Glastechnikerin Frau Carmen Eckard und dem Leiter der Metallwerkstätten, Herrn Dipl.-Ing. Wilfried Harder für die Diskussionsbereitschaft und Mithilfe bei den sehr aufwendigen Konstruktions- und Fertigungsarbeiten am Taylor-Couette Extraktor, sowie allen weiteren technischen und nichttechnischen Mitarbeitern, die zum Gelingen dieses Projektes beigetragen haben. Ein weiterer Dank geht an dieser Stelle an Frau Ingrid Behrendt für die organisatorische Hilfe im Sekretariat. Nicht zuletzt danke ich der Deutschen Forschungsgemeinschaft für die finanzielle Unterstützung des Forschungsprojektes, sowie allen Teilnehmern des DFG- Forschungsschwerpunktes SPP 1105 für die gute Zusammenarbeit und Diskussionsbereitschaft. Kaiserslautern, im Mai 2005 Andreas Wildberger Kurzzusammenfassung Im Rahmen dieser Arbeit wurde der Einfluss starker elektrischer Gleichspannungsfelder auf den Stoffübergang bei der Flüssig-Flüssig Extraktion untersucht. Es konnte dabei gezeigt werden, dass sowohl der reaktive, als auch der rein physikalische Stoffaustausch durch die Applikation elektrischer Gleichspannungsfelder gesteigert werden kann. Dies konnte durch feldinduzierte Migrationswechselwirkungen, feldbedingte Grenzflächenspannungsänderungen und im Feld gesteigerte Grenzflächenturbulenzen erklärt und experimentell nachgewiesen werden. Auch gelang zumindest im Miniplantmaßstab die verfahrenstechnische Umsetzung dieser Feldextraktion unter effizienter Ausnutzung der Feldkraft. Zudem wurden im Rahmen dieser Arbeit Stoffübergangsmodelle entwickelt, mit welchen die theoretische Beschreibung des Extraktionsprozesses in guter Übereinstimmung mit den experimentellen Daten gelang und somit die getroffenen Modellannahmen bestätigt werden konnten. Abstract The influence of externally applied electric DC-fields (DC: direct current) on mass transfer in solvent extraction was experimentally and theoretically investigated. The focus was on reactive mass transfer considering organic acids as the mass transfer components. Also, the physical mass transfer was considered when using acetone as a solute. The influence of the applied electric fields on mass transfer kinetics, equilibrium, and the polarisation of the liquid-liquid interface was investigated in discontinuously (stirred vessel of Lewis type) as well as in continuously (drop column, centrifugal extractor) operating extraction processes. Mass transfer was investigated across planar and spherical interfaces and the mass transfer models developed were compared to experimentally obtained data. It was shown that electric fields significantly influence the chemically controlled as well as the physical mass transfer. Both can be accelerated and enhanced by the applied field. This can be explained by the increased interfacial turbulence caused by the electric field and the field-induced polarisation at the liquid-liquid interface, which is caused by migration. The electric field does not shift the chemical equilibrium either in single or in multi component systems. Also the selectivity of separation is not affected by the field and has its maximal value at the chemical equilibrium. The selectivity primarily depends on the concentration and the type of the extracted acid. With weak acids, the field is able to shift the chemical equilibrium to the product side, thus generating more ions. This mass transfer enhancement in case of weak acids is explained by the increased dissociation of the solute in succession of the field force according to Wien’s second law. Also, the field direction strongly affects mass transfer. The maximum mass transfer rate is obtained when the electrostatic field is applied in the direction of mass transfer. This is realised in case of stationary interfaces. An enhancement of mass transfer in the order of 1000 % was obtained at stationary interfaces in a planar Lewis cell or at hanging drops. In case of moving drops, mass transfer was not significantly enhanced. This can be explained by different polarisation effects at moving interfaces inside the stationary electric field. On the one hand, the strength of the field effects decrease enormously without direct and permanent contact of the droplets to the electrode (compared to the hanging drop). On the other hand, the droplets are differently polarised compared to the hanging drop. The electric field polarises the droplets not only in mass transfer direction because of their movement between the plate electrodes and their spherical interfacial geometry; thus the field can not significantly amplify mass transfer in case of moving drops. Hence it follows that a continuously operating high voltage extraction process can not be efficiently realized in conventional extraction equipment using dispersions of droplets. In contrast to this, the efficient utilization of the field force is realised in a special centrifugal extractor, which is the Taylor-Couette electro-extractor. This device mainly consists of two concentric cylinders which act as the electrodes. By the rotary motion of the cylinders, a cylindrical interface is formed in the annulus. The field, which is applied between both cylinders, is perpendicular to the interface and acts in direction of mass transfer which results in mass transfer enhancement. An additional enhancement of mass transfer follows from Taylor vortices which are built at the liquid-liquid interface as a result of the rotation. The simulation of the reactive mass transfer was realized by a electrostatically expanded kinetic model which considers the kinetics of the chemical reaction, the adsorption of the ion exchanger at the liquid-liquid interface, equilibrium information, migration effects by the Nernst Planck equation as well as electro dissociation effects according to Wien’s second law after a method by Onsager. The consideration of the enhanced interfacial turbulence at the liquid-liquid interface, caused by the electric field, succeeds by using an electrostatically modified method based on Maroudas and Sawistowski. Furthermore, a mass transfer model to describe the process in the Taylor-Couette electro-extractor is presented. The applied electric fields were computed numerically using the finite element method based on Maxwell’s equations as well as by the simplified method using the Laplace equation. It was shown by mass transfer simulation, that the (calculated) potential at the liquid-liquid interface directly determines mass transfer and not the externally applied potential. Inhaltsverzeichnis 1 Einleitung und Problemstellung ......................................................... 1 2 Ziele ....................................................................................................... 6 3 Theoretische Grundlagen .................................................................... 8 3.1 Extraktion und Reaktivextraktion .......................................................... 8 3.2 Feldbegriffsdefinition und elektrisches Potential .................................. 12 4 Stand des Wissens ................................................................................ 15 4.1 Stoffaustausch bei der Flüssig-Flüssig Extraktion im elektrischen Feld 15 4.2 Grenzflächenvorgänge beim Stoffübergang .......................................... 19 4.3 Grenzflächenvorgänge im elektrischen Feld ......................................... 23 4.4 Der Taylor-Couette Extraktor ................................................................ 29 5 Versuchsergebnisse und Diskussion ................................................... 34 5.1 Gleichgewichtsuntersuchungen im elektrischen Feld ........................... 34 5.2 Rührzellen- und Kinetikexperimente im elektrischen Feld ................... 37 5.3 Untersuchung des Stoffübergangs am Einzeltropfen und Grenzflächeninstabilitäten im elektrischen Feld ............................................. 56 5.4 Untersuchung von Grenzflächenprofilen beim Stoffübergang im elektrischen Feld .................................................................................... 68 5.5 Kontinuierlich betriebene Extraktion im elektrischen Hochspannungsfeld ........................................................................................ 71 6 Modellierung und Simulation ............................................................. 76 6.1 Kinetikmodell ........................................................................................ 76 6.2 Berechnung elektrostatischer Felder ...................................................... 83 6.3 Berechnung der Migration ..................................................................... 85 6.4 Berechnung der Elektrodissoziation ...................................................... 85 6.5 Berechnung des reaktiven Stoffübergangs im elektrischen Feld ........... 86 6.6 Berechnung des Stoffübergangs unter Berücksichtigung der Berücksichtigung der Marangonikonvektion im elektrischen Feld ....... 90 6.7 Berechnung des Stoffübergangs im Taylor-Couette Extraktor im elektrischen Feld .................................................................................... 93 7 Zusammenfassung und Ausblick ....................................................... 97 7.1 Abschließende Stellungnahme und Anwendungspotential ................... 97 7.2 Zusammenfassung ................................................................................. 97 8 Literaturverzeichnis ............................................................................ 100 Anhang A Formelzeichen und Indizes .................................................................... I B Stoffsysteme und Analytik .................................................................... IX C Konstruktive Ergänzungen .................................................................... XXIV D Elektrotechnische Ergänzungen ............................................................. XXVI E Ergänzungen zur Modellierung und Simulation .................................... XXIX F Experimentelle Daten ............................................................................ XXXVI G Sonstiges ................................................................................................ LXVII EINLEITUNG UND PROBLEMSTELLUNG 1 Einleitung und Problemstellung Elektrische Felder haben seit jeher den Menschen nicht nur beeindruckt und beschäftigt, sowie die Entwicklung und den Fortschritt in fast allen Lebensbereichen in signifikanter Weise geprägt, sondern sind auch ein essentieller Bestandteil unseres Lebens. Auch in der Religion waren meist die oberen der Götter jene, welche über Blitz und Donner geboten und diese auch als Waffen verwendeten, wie z. B. Zeus, Jupiter oder der Germanengott Donar (auch Thor genannt), nach welchem noch heute Wochentage (Donnerstag, Thursday) und Berge (Donnersberg) benannt sind. Spannungsentladungserscheinungen, wie sie in Abb. 1 dargestellt sind, stellten für die Menschen noch bis weit in die Neuzeit hinein eine bedrohliche Gefahr dar und galten als eine Art Gottesstrafe. Abb. 1 Naturschauspiel über den schottischen Highlands bei Fort William (U. K.) Erst als mit dem auslaufenden 17. Jahrhundert der kirchliche Machteinfluss auf die Wissenschaft schwand und nicht mehr, wie noch zu Galileis (1564-1642) Zeit, das Inquisitionsgericht die Qualität und Sinnigkeit der Forschung beurteilte, gewann mit zunehmender Aufklärung auch die Erforschung der Elektrizität durch die Arbeiten von Coulomb (1736-1806) und Volta (1745-1827) im 18. Jh., sowie durch Ampere (17751836), Ohm (1789-1854) und Kirchhoff (1824-1887) im 19. Jh. wissenschaftlich an 1 EINLEITUNG UND PROBLEMSTELLUNG Bedeutung. Bahnbrechende Erkenntnisse auf dem Gebiet der Feldtheorie gehen auf Oersted (1777-1851), Faraday (1791-1867) und Maxwell (1831-1879) zurück. Mit der Erfindung der Glühbirne durch Goebel im Jahre 1854 und deren Weiterentwicklung durch Edison (Kohlenfadenlampe, 1879) begann auch die zunehmende industrielle Bedeutung der Elektrizität. Neben der Stromversorgung und der Produktion von Elektrobauteilen vertreiben Firmen, wie beispielsweise die von Edison gegründete Firma General Electric oder die SIEMENS AG, zudem Elektromotoren, Telekommunikations- und Multimediaprodukte, die heute ein wichtiger Lebensbestandteil sind. Selbst innerhalb des menschlichen Körpers sind elektrische Feld- und Ladungsprozesse für die Signalübertragung und die zentrale Steuerung der Körperfunktion verantwortlich. Elektrische Felder haben auch in der heutigen Verfahrenstechnik bereits ein breites Anwendungsfeld. Schon im Jahre 1990 betrug allein in den USA die elektrische Energie, die für verfahrenstechnische Grundoperationen aufgewendet wurde, welche sich des elektrischen Potentials bedienten, 35,6 Mrd. kWh (≈ 128 PJ). Davon beträgt der Anteil der Elektrolyse 89 %, Strahlungstrocknung 7 %, und die restlichen 4 % verteilen sich auf Elektrodialyse, Elektrophorese, elektrisch betriebenes Entsalzen, elektrostatisches Beschichten, etc. Die Anwendung der Elektrizität für verfahrenstechnische Applikationen erweist sich als vorteilhaft, da diese gleichbleibend an Qualität und Erhältlichkeit ist, keine Lager- und Transportprobleme entstehen, keine Toxizität bzw. Brennbarkeit vorliegt und nur minimale Verluste sowie keine Abfallprobleme zu erwarten sind. Hinzu kommen die Möglichkeit einer kleinvolumigen Bauweise sowie geringe Kosten zur Energiedissipation, was die gesamte Effizienz vieler verfahrenstechnischer Prozesse in der Chemie und Biochemie bis hin zur Feinstpartikelherstellung im Nanobereich beeinflusst. Auch lassen sich feldgetriebene Prozesse sicherheitsoptimiert durchführen. Elektrische bzw. elektromagnetische Felder können dafür benutzt werden, um chemische oder physikalische Trennvorgänge zu beschleunigen oder gar erst möglich zu machen [Byers & Amarnath 1995, Moore 1973, Bailes & Larkai 1981]. Dies trifft besonders auf Prozesse zu, die auf Feldern basieren (Magnetisierung, dielektrische Filter, Strahlungstrocknung, etc.), auf feldbeschleunigte Transportprozesse (Elektrozerstäubung, Elektroosmose, Elektrokoaleszenz, etc. [Tsuda 1995a, 1995b, 1995c, Yamaguchi 1994, Iwata 1995, Yamaguchi 1995a, 1995b]) und auf die Stabilisierung von Mehrphasenströmungen 2 EINLEITUNG UND PROBLEMSTELLUNG (Wirbelbett, etc.) im elektrischen Feld [Ptasinski & Kerkhoff 1992]. Auch auf dem Gebiet der Elektroextraktion organischer Säuren konnte nachgewiesen werden, dass durch äußere elektrische Felder der physikalische Stoffübergang (Elektrophorese zweiter Art) gesteigert werden kann [Stichlmair et al. 1992]. Gerade im Bereich der Flüssig-Flüssig Extraktion wurden zahlreiche Untersuchungen unter dem Einfluss elektrischer Felder durchgeführt und sind nach wie vor Gegenstand der aktuellen Forschung [Thornton 1968, Iyer & Sawistowski 1974, Bailes 1981, Weatherley et al. 1984, Bailes & Stitt 1987, Yamaguchi 1994, Daikhin et al. 1999, Lu et al. 2000, Kuipa & Hughes 2002, Bart 2002, Gneist 2004]. Es konnte dabei gezeigt werden, dass der Feldeinfluss bei der Verwendung klassischer Gleichspannungsfelder (DC) am stärksten ausgeprägt war im Vergleich zur gepulsten DC-Variante oder zu angelegten Wechselspannungsfeldern (AC) [Efimov et al. 1974]. Thornton konnte zeigen, dass zur enormen Steigerung der Extraktionsrate starke Hochspannungsfelder notwendig sind. Erst ab einer Feldstärke von 1500 V/cm konnte er eine Erhöhung des Stoffaustausches beobachten. Bei einer Feldstärke von 3250 V/cm konnte die Extraktion von Benzoesäure sogar um 300 % erhöht werden [Thornton 1968]. Scott und Wham konnten im elektrischen Hochspannungsfeld eine feldinduzierte Steigerung des Stoffaustausches von 1700 % in einer York-Scheibel Kolonne und von 1000 % in einem Zentrifugalextraktor, dem Podbielniakextraktor, erzielen [Scott & Wham 1989]. Auch der reaktive Stoffübergang von Zink mittels des Kationenaustauschers D2EHPA konnte im elektrischen Gleichspannungsfeld bei einer angelegten Spannung von 50 000 V um 175 % gesteigert werden, wie durch Untersuchungen in einer im Gegenstrom betriebenen Elektroextraktionskolonne gezeigt werden konnte [Yamaguchi & Kanno 1996]. Die meisten dieser Untersuchungen wurden an rein physikalischen Stoffaustauschsystemen durchgeführt. Den Schwerpunkt dieser Untersuchungen bilden neben wenigen Stoffaustauschuntersuchungen vor allem die Untersuchung der Hydrodynamik im elektrischen Feld. Es konnte zwar gezeigt werden, dass elektrische Felder hydrodynamische Betriebsgrößen, wie die Tropfengestalt, die Koaleszenz, den Tropfenzerfall, die Tropfenaufstiegsgeschwindigkeit, die Grenzflächenspannung, die Verweilzeit, den Hold-Up, die Tropfengröße oder Fluktuationen und Turbulenzen im Phasengrenzbereich beeinflussen können, und der Stoffaustausch somit geändert wird, doch existieren bislang nur wenige 3 EINLEITUNG UND PROBLEMSTELLUNG Modelle mit welchen die Vorausberechnung des Stoffübergangs im elektrischen Hochspannungsfeld gelingt. Diese Modelle korrelieren den Stoffübergang allerdings nur für bestimmte Extraktionsapparate, Stoffsysteme und Betriebsbedingungen. Dies ist darin begründet, dass zu wenig über die eigentliche Ursache der Feldwirkung auf molekularer Ebene bei der Extraktion bekannt ist und somit auch wichtige Informationen und mathematische Parameter zur Beschreibung und zur Problemlösung fehlen. Lediglich in einigen speziellen Fällen, bei welchen nur wenige Größen den Stoffaustausch signifikant beeinflussen, wie beispielsweise bei Elektrophoreseprozessen lässt sich die Ionenwanderung, und somit der Stoffübergang in einfachen Extraktionsapparaten über geeignete Gleichungssysteme berechnen [Proplesch 1994]. Über den rein reaktiven Stoffübergang im elektrischen Feld sind allerdings nur sehr wenige Untersuchungen bekannt. Auch wurden bislang keinerlei Versuche unternommen, um den Stoffübergang unter kinetisch kontrollierten Bedingungen, d. h. im Reaktionsplateau, im elektrischen Gleichspannungsfeld zu untersuchen, um somit eine Aussage über die Feldwirkung auf die Stoffübergangskinetik zu erhalten und den Wirkmechanismus der Feldbeschleunigung bestimmen und quantifizieren zu können. Primäres Ziel dieser Arbeit ist die systematische Untersuchung des Einflusses starker, elektrischer Gleichspannungsfelder auf die Reaktivextraktion. Dabei ist zu untersuchen, inwieweit elektrische Hochspannungsfelder das Reaktionsgleichgewicht in Einzel- und auch in Mehrkomponentensystemen beeinflussen können und sich auf die reaktive Stoffübergangskinetik auswirken, um den Wirkmechanismus bestimmen und quantifizieren zu können. Basierend auf den ermittelten Informationen und Parameterdaten soll ein Stoffübergangsmodell entwickelt werden, mit welchem die Vorausberechnung des reaktiven Stoffübergangs sowohl in Einals auch in Mehrkomponentensystemen im elektrischen Feld gelingt. Des Weiteren soll der Feldeinfluss elektrischer Felder auf den rein physikalischen Stoffübergang untersucht werden. Den Schwerpunkt dieser Forschungen bildet die Untersuchung der Auswirkung elektrischer Felder auf beim Stoffübergang auftretende Grenzflächenturbulenzen vom Marangoni-Typ. Ziel dabei ist es das Stoffübergangsmodell nach Maroudas und Sawistowski [Maroudas & Sawistowski 1964] elektrostatisch zu erweitern, um den Stoffübergang bei feldinduzierter Grenzflächenturbulenz berechnen zu können. 4 EINLEITUNG UND PROBLEMSTELLUNG Ein abschließendes Ziel der Arbeit ist die Verfahrensumsetzung der kontinuierlich betriebenen Extraktion im elektrischen Hochspannungsfeld. Dabei wird zum einen die Extraktion in einer klassischen Tropfenkolonne untersucht, in welcher das elektrische Feld nicht definiert in Stoffübergangsrichtung, d. h. orthogonal zur Phasengrenzfläche, angelegt werden kann. Dem gegenüberstellend wird die Extraktion in einem speziellen Zentrifugalextraktor, dem im Rahmen dieser Arbeit neuentwickelten Taylor-Couette Elektroextraktor, bei welchem das elektrische Feld orthogonal zur Phasengrenzfläche angelegt werden und somit direkt und definiert in Stoffübergangsrichtung wirken kann, durchgeführt. Dabei soll untersucht und gezeigt werden, dass auch die Feldwirkrichtung einen signifikanten Einfluss auf den Extraktionsprozess hat und bei der Verfahrensentwicklung mit berücksichtigt werden muss. Zudem lässt sich in diesem als Zylinderkondensator fungierenden Extraktionsapparat eine sehr hohe Feldliniendichte erzeugen, was die Feldwirkung auf die Extraktion zusätzlich verstärkt. Abschließend wird ein Stoffübergangsmodell zur Berechnung des Stoffübergangs im Taylor-Couette Elektroextraktor vorgestellt und mit experimentellen Daten verglichen. 5 ZIELE 2 Ziele Hauptziel des durchgeführten Projektes war es den Einfluss äußerer, elektrischer Hochspannungsfelder auf den Stoffübergang der Flüssig-Flüssig Extraktion systematisch zu untersuchen, sowie Stoffübergangsmodelle zu entwickeln, um den Stoffübergang unter Feldeinfluss berechenbar zu machen. Dabei galt es folgende Teilprojekte durchzuführen und folgende Teilziele zu erreichen: 1.) Untersuchung des Feldeinflusses auf das Verteilungsgleichgewicht und Ermittlung der Gleichgewichtsparameter. Dabei galt es zu untersuchen, ob ein extern angelegtes elektrisches Feld, durch Beeinflussung der Stoffübergangsreaktion beispielsweise, die Gleichgewichtslage verändern kann. 2.) Untersuchung der Stoffübergangskinetik und der Stoffübergangsreaktion unter kinetisch kontrollierten Bedingungen in einer für den Feldbetrieb modifizierten Stoffübergangszelle nach Nitsch. Dabei galt es Feldeffekte experimentell zu untersuchen und im Vergleich zum feldfreien System zu quantifizieren und zur Modellierung notwendige Parameter zu bestimmen. Die Studie sollte primär an verschiedenen Anionenaustauschsystemen (Säure, Wasser // Trioctylamin (TOA), Toluol), sowie vergleichsweise am Kationenaustauschersystem (Zink, Wasser // Phosphorsäure-2ethylhexyl-diester (D2EHPA), Isododecan) durchgeführt werden. Dabei wurden Säuren verschiedener Stärke und Wertigkeit untersucht. Tabelle 1: Überblick über die untersuchten Anionenaustauschsysteme (Säuren) Nr. Bezeichnung Kürzel Wertigkeit pKS (25 °C) und Säurestärke 1 p-Toluolsulfonsäure PTS 1 Stufe 1: -5,74 [a] (sehr stark) 2 Pyrazindicarbonsäure PDS 2 Stufe 1: 1,52 [b] (stark) Stufe 2: 5,25 (schwach) 3 Salzsäure HCl 1 Stufe 1: -6 [c] (sehr stark) 4 Schwefelsäure H2SO4 2 Stufe 1: -3 [d] (sehr stark) Stufe 2: 1,96 (stark) 5 Essigsäure HAc 1 Stufe 1: 4,77 [e] (schwach) 6 Zitronensäure H3Cit 3 Stufe 1: 6,39 [e] (schwach) Stufe 2: 11,15 (sehr schwach) Stufe 3: 14,28 (sehr schwach) Datenquellen: [a] Kozolov et al. 1981, [b] Proplesch 1994, [c] Christen 1988, [d] Riedel 1994, [e] Roos 2000 6 ZIELE 3.) Entwicklung und Modifizierung eines Stoffübergangsmodells für die reaktive Säureextraktion unter Berücksichtigung von Gleichgewichts- und Kinetikparametern, der Grenzflächenadsorption des Ionenaustauschers, der Dissoziation der reaktiven Stoffübergangskomponente, sowie der Wertigkeit der Säure zur Simulation des reaktiven Stoffübergangs im feldfreien System. 4.) Numerische Berechnung des Potentialverlaufs des an der Messzelle anliegenden elektrischen Feldes über die finite Elementemethode im Vergleich zur analytischen Lösung unter vereinfachten Bedingungen über die Laplace Gleichung. 5.) Elektrostatische Erweiterung des Kinetikmodells im Hinblick auf Migration (über die Nernst-Plancksche Gleichung) und Elektrodissoziation (2. Wien’scher Effekt) und Simulation der Stoffübergangskinetik im elektrischen Feld. 6.) Untersuchung des Stoffaustausches im Mischsystem (mehrere Stoffübergangskomponenten bei simultanem Stoffübergang) im Hinblick auf Feldeffekte, Einfluss der Säurestärke und Selektivität. 7.) Modellierung und Simulation der Stoffübergangskinetik im Mehrkomponentensystem. 8.) Stoffübergangsversuche an sphärischen Grenzflächen (Tropfen) im elektrischen Feld in einer für die Feldapplikation modifizierten Tropfensäule. 9.) Untersuchung und Quantifizierung des Feldeinflusses auf Grenzflächeninstabilitäten und Bestimmung der kritischen Marangonikonzentrationen am hängenden Tropfen, als auch bei planarer Grenzflächengeometrie. 10.) Experimentelle Bestimmung des Feldeinflusses auf die Grenzflächenspannung. 11.) Modellierung und Simulation des Stoffaustausches unter Berücksichtigung der Grenzflächeninstabilitäten im elektrischen Feld über einen modifizierten Ansatz nach Maroudas und Sawistowski. 12.) Untersuchung von Grenzflächenprofilen beim Stoffübergang im elektrischen Feld mittels Laser Induzierter Fluoreszenz (LIF) am Stoffsystem Sulforhodamin, Wasser // TOA, Toluol bei planarer Grenzflächengeometrie. 13.) Abschließend war die Konstruktion und Inbetriebnahme eines zur Hochspannungsapplikation geeigneten Miniplant-Extraktors geplant, bei welchem sich die Feldkräfte effizient ausnutzen lassen, und welcher auch kontinuierlich betrieben werden kann. 7 THEORETISCHE GRUNDLAGEN 3 Theoretische Grundlagen 3.1 Extraktion und Reaktivextraktion „Unter Extraktion versteht man das selektive Herauslösen, Auswaschen oder Auslaugen bestimmter Substanzen als Übergangskomponenten aus festen oder flüssigen Stoffgemischen mit Hilfe flüssiger Lösungsmittel. Aus einer Abgeberphase werden Wertstoffe (bzw. bei Reinigungsverfahren Schadstoffe) durch ein aufnehmendes Lösungsmittel in eine Aufnehmerphase überführt. Die Extraktion zählt somit zu den Sorptionsverfahren, bei denen ein Hilfsstoff die Funktion des selektiv wirkenden Aufnehmers erfüllt“ [Sattler 1995]. Die Flüssig-Flüssig-Extraktion, (solvent extraction) bei der zwei Flüssigkeitsphasen beteiligt sind, kommt vor allem dann zum Einsatz, wenn Komponenten zu trennen sind, die zum Beispiel Azeotrope bilden, die thermisch instabil sind, nur in geringen Konzentrationen vorliegen oder geringe Siedepunktsdifferenzen aufweisen. Besonders im zuletzt genannten Fall wäre eine Rektifikation mit einem hohen Aufwand verbunden, da sehr viele Trennstufen realisiert werden müssen. Bei der Extraktion wird der Wertstoff aus der Trägerphase in die Extraktphase überführt, beide Phasen, das heißt Träger- als auch Extraktphase, sollten dabei ineinander möglichst unlöslich sein. Zwischen beiden Phasen stellt sich ein Phasengleichgewicht bezüglich der Wertstoffkonzentration nach dem Nernst´schen Verteilungsgesetz ein. D= co cw (1) mit: D: Nernst`scher Verteilungskoeffizient co : Konzentration organische Phase cw : Konzentration wässrige Phase Auf diese Weise ergibt sich eine an Wertstoff verarmte Trägerphase, das Raffinat und eine mit Wertstoff angereicherte Extraktphase. Um jetzt den reinen Wertstoff zu erhalten, kann man im Anschluss an diese Extraktion z. B. eine Destillation (oder auch andere UnitOperations) durchführen und erhält somit aus der Extraktphase den reinen Wertstoff. 8 THEORETISCHE GRUNDLAGEN Ein wichtiges Anwendungsgebiet ist die Hydrometallurgie, bei der man Metalle aus wässrigen Lösungen gewinnt. Dabei wird im Extraktionsschritt das jeweilige Metall aus zumeist verdünnter Lösung zunächst selektiv gewonnen. Bei der nachgeschalteten Reextraktion wird das Extrakt (Metallkomponente) in die wässrige Phase zurückextrahiert. Hierbei erfolgt eine Aufkonzentrierung so, dass die Konzentration des Metalls höher ist, als in der ursprünglichen Ausgangslösung. Zur Gewinnung des Metalls in elementarer Form lässt sich nun eine Elektrolyse nachschalten, welche sich aus der aufkonzentrierten Lösung effizient betreiben lässt. Erfolgt die Extraktion über eine chemische Reaktion oder ist der Stoffübergang mit einer chemischen Reaktion gekoppelt, bezeichnet man diesen speziellen Extraktionsprozess als Reaktivextraktion. Die Reaktivextraktion, bei der die Gleichgewichtskonstante des Reaktionssystems das Extraktionsgleichgewicht beschreibt, unterscheidet sich hierbei im wesentlichen durch die höhere Selektivität und eine größere Aufnahmekapazität des Extraktionsmittels für die Übergangskomponente von der physikalischen Extraktion. ORGANISCH ORGANISCH LM + IT LM + KOMPLEX REAKTION WÄSSRIG WÄSSRIG SCHADSTOFF Reaktionsgeschehen: SCHADSTOFF + IT Abb. 2 KOMPLEX Prinzip der Reaktivextraktion, LM: Lösungsmittel, IT: Ionenaustauscher Bei der Reaktivextraktion erfolgt die Extraktion über einen Ionenaustauscher, welcher in der organischen Phase gelöst ist. Dieser ist grenzflächenaktiv und lagert sich deshalb an der Phasengrenzfläche an, wo auch die folgende Extraktionsreaktion abläuft [Bart 2001]. 9 THEORETISCHE GRUNDLAGEN Das über die Reaktion gebildete Reaktionsprodukt (z. B. ein Metallkomplex oder SäureBase Komplex) ist bevorzugt (fast ausschließlich) in organischer Phase löslich, worauf der Stoffübergang (von der wässrigen in die organische Phase) basiert. Auf diese Weise können unter anderem Schwermetallionen, organische sowie anorganische Säuren und biochemische Verbindungen extrahiert werden. Das bei dieser Art der Extraktion eingesetzte Extraktionsmittel (Ionenaustauscher) wird hierzu in einem Verdünnungsmittel gelöst, um die für den Betrieb wichtigen hydrodynamischen Eigenschaften wie Viskosität, Grenzflächenspannung und Dichtedifferenz zu optimieren. Die organische Phase setzt sich somit aus Extraktions- und Verdünnungsmittel zusammen. Sie kann ebenfalls einen Modifier (Lösungsvermittler) enthalten, welcher die Löslichkeit der zu extrahierenden Komponente in der organischen Phase erhöht und so die Ausbildung einer dritten Phase verhindert. Das Extraktionsmittelmolekül verfügt über einen hydrophoben und einen hydrophilen Teil, wie in Abb. 3 am Beispiel des Ionenaustauschers TOA gezeigt. Der hydrophile Teil geht die Bindung mit der Wertkomponente ein, während der hydrophobe Teil, in der Regel ein langkettiger Kohlenwasserstoffrest, die Löslichkeit in der organischen Phase ermöglicht. hydrophiler Teil N hydrophober Teil Abb. 3 Räumliche Struktur des Ionenaustauschers Trioctylamin (TOA), Ellipse: Lokalisierung des freies Elektronenpaars des Stickstoffatoms, Punktgruppe: C3v In der Praxis kommen vier Arten von Extraktionsmittel zum Einsatz. Es wird dabei zwischen Kationenaustauschern, Anionenaustauschern, Chelatbildnern und solvatisieren- 10 THEORETISCHE GRUNDLAGEN den Extraktionsmitteln unterschieden. Tabelle 2 zeigt für jeden der genannten Ionenaustauschertypen eine wichtige Anwendungsmöglichkeit. Tabelle 2: Anwendungsmöglichkeiten verschiedener Extraktionsmittel Extraktionsmitteltyp Extraktionsmittel Wertstoffe Kationenaustauscher Di(2-ethylhexyl)phosphorsäurediester Zink, Kupfer (D2EHPA) Octylpyrophosphorsäure (H2OPPA) Uran Anionenaustauscher Sekundäre und tertiäre Amine Mineralsäuren (Alamine 300) anionische Metallkomplexe solvatisierende Extraktionsmittel Tributylphosphat (TBP) (Acorga ClX 50) Salpetersäure Kupfersalze Chelatbildner (LIX 65) Kupfer Kationenaustauscher werden in der Industrie häufig zur Extraktion von Metallkationen verwendet. Diese Extraktionsmittel sind in der Lage, Kationen gegeneinander auszutauschen. Bei den austauschbaren Kationen handelt es sich meist um H+- Ionen. Die Extraktion von Metallen lässt sich über den pH-Wert steuern, da die Ionenaustauschreaktion vom pH-Wert abhängt, wie aus Gleichung 2 ersichtlich ist. Me n + + 1 m(RH) x 2 Reextraktion Extraktion nH + + MeR n ⋅ (RH)1/2⋅m⋅x − n (2) Der Parameter x steht für die Aggregationszahl. Sie wird verwendet, da die meisten Kationenaustauscher als Dimere oder in Form höherer Aggregate vorliegen. Die Ladungszahl des Metalls wird mit n gekennzeichnet und m steht für den Stöchiometriefaktor. Im Rahmen dieser Arbeit wurde für die Reaktivextraktion von Zink der Kationenaustauscher Di-(2-ethylhexyl)-phosphorsäurediester (D2EHPA) verwendet und als Verdünnungsmittel Isododekan (IDD) eingesetzt. Anionenaustauscher finden Verwendung zur Extraktion organischer Säuren, Mineralsäuren und anionischen Metallkomplexen. Vorwiegend werden als Anionentauscher sekundäre oder tertiäre Amine, sowie auch quartäre Ammoniumsalze eingesetzt. Primäre Amine sind in der Regel weniger gut geeignet, da diese eine zu hohe Wasserlöslichkeit besitzen. Für die Extraktion organischer Säuren aus wässriger Lösung sind tertiäre Amine sehr gut 11 THEORETISCHE GRUNDLAGEN geeignet. Auch sind diese einfacher zu regenerieren und besitzen eine geringe Löslichkeit in der wässrigen Phase [Ross 2000]. Im Rahmen dieser Arbeit wurde für die Extraktion organischer Säuren, wie z. B. der organischen p-Toluolsulfonsäure, der Ionenaustauscher Tri-n-octylamin (TOA), ein tertiäres Amin (R)3N, verwendet (s. Abb. 3). Die reaktive Säureextraktion verläuft im Falle tertiärer Amine als Extraktionsmittel über Gleichung 3. H + X − + (R) 3 N (R) 3 NHX (3) Solvatisierende Extraktionsmittel sind Elektronendonatoren (Lewis Basen), die sich unstöchiometrisch mittels einer koordinativen Bindung an den Wertstoff binden, wobei sich zwischen Extraktionsmittel und der Wertkomponente Lewis-Säure/Lewis-Base Wechselwirkungen ausbilden [Czapla 2000a]. Organische Phosphorschwefelverbindungen, Phosphorsauerstoffverbindungen und Carbonsauerstoffverbindungen bilden hauptsächlich die Gruppe der solvatisierenden Extraktionsmittel. Chelatbildener sind hoch selektiv wirkende Extraktionsmittel. Sie besitzen die Eigenschaft eines Kationenaustauschers und eines solvatisierenden Extraktionsmittels. Zusätzlich zur Funktion eines Kationenaustauschers sind Koordinationsstellen vorhanden an denen sich das zu extrahierende Metallion spezifisch komplexiert. 3.2 Feldbegriffsdefinition und elektrisches Potential Ein elektrisches Feld ist die Eigenschaft des Raumes in der Umgebung elektrischer Ladungen. Das elektrische Feld ist ein Vektorfeld, d. h. jedem Raumpunkt lässt sich eine gerichtete Größe zuordnen, aus der sich die Kraftwirkung auf elektrische Ladungen ergibt. Diese gerichtete Größe, deren Richtung der Richtung entspricht, in die eine positive Ladung beschleunigt wird, nennt man die elektrische Feldstärke E . Somit wird die elektrische Feldstärke E bestimmt durch die Kraft F , die eine Probeladung Q in einem elektrischen Feld erfährt, bezogen auf die Größe der Probeladung, wie aus Gleichung 4 hervorgeht. E= F Q (4) 12 THEORETISCHE GRUNDLAGEN Die Stärke eines elektrischen Feldes wird durch den Betrag E der elektrischen Feldstärke E beschrieben. Ist das elektrische Feld homogen, ist dessen Feldstärke in jedem Punkt des betrachteten Raumbereichs nach Betrag und Richtung konstant, so dass auf eine Probeladung in jedem Punkt dieses Raumbereichs die gleiche Kraft wirkt. Zur Veranschaulichung des elektrischen Feldes im Raum dienen Feldlinien. Die Richtung der Feldlinien in einem Punkt entspricht der Richtung der elektrischen Feldstärke, d. h. der Kraftwirkung, in diesem Punkt. Da deren Richtung in jedem Punkt eindeutig ist, können sich die Feldlinien nicht schneiden. Feldlinien zeigen immer von einer positiven Punktladung weg und zu einer negativen Punktladung hin. Zur Darstellung der Feldlinien werden Pfeile verwendet. Ein solches Feldliniendiagramm ist in Abbildung 4 dargestellt. Je höher dabei die Feldliniendichte ist, um so höher ist die Feldstärke. Abb. 4 Feldliniendiagramme: a) einer positiven Punktladung, b) einer negativen Punktladung, c) eines Dipols, d) eines Plattenkondensators [Stöcker 1993] Das elektrische Feld eines Plattenkondensators ist abgesehen von den Plattenrändern beispielsweise homogen (s. Abb. 4), wenn der Plattenabstand klein gegen die Plattenfläche 13 THEORETISCHE GRUNDLAGEN ist. Die Stärke dieses Feldes errechnet sich nach Gleichung 5, wobei U die elektrische Spannung und d den Plattenabstand darstellen. E= U d (5) Unter einer elektrischen Spannung U, welche zwischen zwei Punkten A und B anliegt, versteht man die Differenz zweier elektrischer Potentiale. Das elektrische Potential ϕ A eines Punktes A im elektrischen Feld gibt die Arbeit WA an, die notwendig ist, um eine Probeladung von einem festen Bezugspunkt P zum Punkt A zu verschieben. Das elektrische Potential ϕ A eines Punktes A definiert sich somit nach Gleichung 6 wie folgt: ϕA = WA Q (6) 14 STAND DES WISSENS 4 Stand des Wissens 4.1 Stoffaustausch bei der Flüssig-Flüssig Extraktion im elektrischen Feld Die Flüssig-Flüssig-Extraktion ist eine etablierte verfahrenstechnische Grundoperation in der chemischen, pharmazeutischen und Metallindustrie (ca. 80 % der Primärkupfergewinnung erfolgt mittels Reaktivextraktion). In der technischen Realisation ist es dazu notwendig, zwei unmischbare Phasen zu dispergieren, um entsprechenden Stoffaustausch zu induzieren. Energie ist dazu notwendig, um die erforderliche Austauschfläche zu erzeugen, Translation der Phasen und eine Konvektion innerhalb der Phasen zu ermöglichen. Um den Wirkungsgrad eines solchen technischen Systems zu erhöhen, gibt es mehrere Optionen, wie beispielsweise die Erhöhung des chemischen Potentials (neue Extraktionschemikalien, Temperatur etc.) oder auch die Überlagerung durch weitere Kräfte, wie Zentrifugalkraft (Zentrifugalextraktion) oder elektrische Felder (Elektroextration). Gerade die Feldextraktion erwies sich als effiziente Methode. So konnte zum Beispiel in einer Sprühkolonne, welche aufgrund der starken Axialvermischung bezüglich der Flüssig-Flüssig-Extraktion nur geringe Stoffübergangskoeffizienten liefert, durch Anlegen elektrischer Felder der Stoffübergang drastisch verbessert werden [Yamaguchi et al. 1992, Hibiki et al.1993, Yamaguchi 1994, 1995a]. Durch den Einfluss des elektrischen Feldes (Spannung 10,7 kV) wird zudem auch bereits bei geringeren Flussraten (0,1 cm/s) eine 10-fach höhere Extraktionsausbeute erhalten als im stromlosen Zustand, was anhand der Extraktion von Essigsäure aus kontinuierlicher Xylol-haltiger Phase in eine wässrige, disperse Phase gezeigt werden konnte [Kowalski & Ziolkowski 1981]. Man findet in einer Sprühkolonne im System H2O/Essigsäure/CCl4 eine Stofftransportbeschleunigung um den Faktor 2 – 3,5, wenn ein elektrisches Feld angelegt wird. Thornton [Thornton 1968] erzielte einen dreifach höheren Stoffaustausch im System H2O/Aceton/Toluol in einer Siebbodenkolonne bei einer Feldstärke von 2 kV/cm. [Agaiev et al. 1969] verbessert mit einem Feld von 5 kV/cm die Petroleumraffination mittels Furfurol in einem RDC, einer Sprühkolonne und einer Füllkörperkolonne. Auch sind Untersuchungen zum Einfluss von Rührerdrehzahl und Elektrodenspannung auf den Stoffaustausch bei Cumol-Extraktion aus Ethylenglykol mit ISOPAR M bekannt [Bailes & Stitt 1987]. Man [Scott & Wham 1989] findet bis zu 10 - 20 mal höhere Transferraten und 15 STAND DES WISSENS HETS-Werte im cm-Bereich bei der Elektroextraktion. In einer Pilotanlage konnte der HETP-Wert auf 1/10 durch den Feldeinfluss gesenkt und die Prozesswaschwassermenge durch den verbesserten Stofftransfer deutlich reduziert werden [Schwartz et al. 1992]. Bei starren Tropfen bewirkt demnach eine Erhöhung der Austauschfläche bei effizienter Zerstäubung einen verbesserten Stofftransfer. Bei zirkulierenden Tropfen wird das interne und externe Strömungsregime [Hadamard 1911, Rybczynski 1911] durch elektrische Felder massiv modifiziert [Melcher & Taylor 1969], was wiederum zu verbesserten Transferraten führt. Auch [He et al. 1996] führten die im elektrischen Feld an einer Tropfensäule erzielte Stoffaustauscherhöhung auf elektrohydrodynamische Phänomene, wie gesteigerte innere Zirkulation und Oszillation, sowie auf feldinduzierte Fluktuationen zurück. Weatherley und Mitarbeiter sehen in der Beschleunigung des Stoffaustausches durch elektrische Felder im Wesentlichen zwei Erklärungen. Einerseits ist ein verbesserter Stoffübergang durch eine größere Oberfläche bedingt, welche durch kleinere Tropfengrößenverteilungen (beispielsweise in einer Tropfensäule) resultiert, die sich beim Anlegen sehr hoher Feldstärken einstellt. Zum anderen wird der Stoffaustausch auch durch elektrostatische Wechselwirkungen, die von der durch das elektrische Feld induzierten elektrischen Aufladung der Tropfen ausgehen, beeinflusst [Weatherley et al. 1984]. Zuvor beobachtete auch Thornton einen verbesserten Stoffübergang bei der Elektroextraktion, welcher nur auf elektrostatische Wechselwirkungen zurückgeführt werden konnte. So fand er bei elektroextraktiven Untersuchungen am Stoffsystem Wasser, Benzoesäure, Toluol, dass die relative Extraktionsrate Rm (diese entspricht dem Verhältnis der Extraktionsrate unter Anlegung eines äußeren elektrischen Feldes zur Extraktionsrate ohne äußeres angelegtes Feld) erst bei einer Feldstärke von 1,5 kV/cm stark ansteigt und bei einer Feldstärke von 3,25 kV/cm eine um den Faktor 3 verbesserte Extraktionsrate erhalten wird [Thornton 1968, Thornton & Porter 1971]. Die Applikation elektrischer Felder bei der Flüssig-Flüssig-Extraktion und bei anderen Trenntechniken wurde detto rezensiert [Scott 1989, Baird 1991, Yamaguchi 1995a]. Von bis zu einer 50 %igen Erhöhung des Stoffaustauschs durch das elektrische Feld wurde berichtet [Rose & Knitner 1966, Wham & Byers 1987, Scott 1992, Martin et al. 1983]. Kuipa und Hughes fanden eine immense Erhöhung der Stoffübergangsrate von bis zu 250 % bei Verwendung des reaktiven Stoffsystems Kupfersulfat/Di-2-ethylhexylphosphor- 16 STAND DES WISSENS säurediester (D2EHPA) durch die Applikation elektrischer Felder. Diese Erhöhung erklärten sie durch lokale Veränderungen der Grenzflächenspannung und der Oberflächenbelegung [Kuipa & Hughes 1999]. Auch konnte in unterschiedlichen Apparaturen gezeigt werden, dass die Applikation elektrischer Felder auf ein kontinuierliches Verfahrenskonzept übertragbar ist, wobei sich im Gegenstrombetrieb der störende diffusive Rücktransport der abgetrennten Komponente unterdrücken lässt [Schmidt 1990, Proplesch 1994, Stichlmair et al. 1992]. Im Vergleich zu den zahlreichen, oben genannten, Stoffübergangsuntersuchungen bei sphärischer Grenzflächengeometrie (Kolonnen, Tropfensäulen, Einzeltropfen- experimenten, ect.) ist nur eine vergleichsweise geringe Anzahl an Stoffübergangsuntersuchungen an planaren Grenzflächen im elektrischen Hochspannungsfeld bekannt. Die meisten dieser Arbeiten betrachten einen Elektrophoreseeffekt 2-ter Art, bei welchem eine in beiden Phasen lösliche, elektrisch geladene Komponente über die Phasengrenze neben dem Konzentrationsgradient, vor allem entlang des Potentialgradienten transportiert wird. Diese Art der Stoffübertragung wird dabei als Elektroextraktion bezeichnet. Es konnte anhand von Carbon- und Hydroxycarbonsäuren gezeigt werden, dass es bei der Elektroextraktion möglich ist, einen Extraktstoff über das natürliche Verteilungsgleichgewicht hinaus in einer Phase aufzukonzentrieren [Stichlmair & Proplesch 1993, Proplesch 1994] und die Stoffübergangskinetik im elektrischen Feld zu beschleunigen [Schmidt 1990]. Bei dieser rein physikalischen Stoffübertragung ionogener Extraktstoffe ist die Leitfähigkeit von entscheidender Bedeutung [Proplesch 1994]. Deshalb erweisen sich unpolare, oder nur leicht polare Lösungsmittel, wie beispielsweise aromatische Hydrocarbone, auf Grund ihrer sehr geringen Leitfähigkeit (selbst bei sehr hohen Feldstärken) als eher für die Elektroextraktion ungeeignete Solventien [Brouche et al. 1993, Brouche & Gosse 1996]. Auch Sawistowski konnte bei der Untersuchung des physikalischen Stoffübergangs von Propionsäure an einer planaren Stoffübergangszelle unter Verwendung verschiedener, organischer Solventien zeigen, dass sich im elektrischen Feld mit stärker polaren Lösungsmitteln deutlich höhere Stoffübergangskoeffizienten erzielen lassen. So beobachtete er bei Verwendung von Essigsäureethylester oder Isobutanol eine Stoffaustauscherhöhung von ca. 1000 %. Bei Verwendung des schwach polaren Lösungs- 17 STAND DES WISSENS mittels Toluol dagegen konnte er lediglich einen um den Faktor 3 erhöhten Stoffübergangskoeffizienten, unter sonst gleichen Bedingungen, feststellen [Sawistowski 1973a]. Untersuchungen an einem im Gegenstrom betriebenen Elektroströmungsrohrextraktor zeigten, dass der Stoffübergang und die Trennung von Farbstoffen bei Verwendung von Butanol als organisches Solvent mit zunehmender Feldstärke signifikant, d. h. um über 100 %, gesteigert werden kann [Luo et al. 1999a, Luo et al. 1999b, Lu et al. 2000]. Diese Steigerung konnte durch die starke Migrationsbewegung in beiden, gut leitfähigen Phasen erklärt werden. Auch im Bereich der Mikrobiologie sind elektroextraktive Anwendungen bekannt. So gelang Polson die Separation und Isolierung der Mosaikviren TMV und TYMV mittels Elektroextraktion [Polson 1977]. Der reaktive Stoffübergang im elektrischen Feld bei planarer Grenzflächengeometrie jedoch blieb bisher kaum erforscht. Den Hauptforschungsgegenstand hierbei stellen wenige, experimentelle Untersuchungen zur Kupferextraktion im elektrischen Feld dar. So zeigten [Hund & Lancelot 1986] an einer gerührten Planarzelle, dass die Applikation eines negativen Potentialgradienten (0, -) eine Stoffaustauscherhöhung bewirkt, ein positiver Potentialgradient (0, +) eine Verlangsamung des Stoffaustausches mit sich bringt. Sie machen für die Änderung der Stoffübergangsrate Grenzflächenturbulenzen, sowie Variationen der Grenzflächenspannung, welche sie zusammenfassend als elektrohydrodynamische Faktoren bezeichnen, und elektrostatische Dipolwechselwirkungen verantwortlich. Elektromigrative Überlegungen ließen sie jedoch außer Acht. [Martin et al. 1983] beobachteten unter Verwendung des gleichen Ionenaustauschers LIX65N im gleichen Verdünnungsmittel Escaid 100 dagegen, dass die Kupferextraktion sowohl unter Einwirkung eines negativen Potentialgradienten (0, -), als auch eines positiven Potentialgradienten (0, +) gegenüber dem feldfreien System gesteigert werden konnte, wobei im Falle des positiven Gradienten sogar eine noch höhere Stoffaustauschbeschleunigung erzielt werden konnte. Erklären konnten sie diese Beobachtung jedoch nicht. Auch [Kuipa & Hughes 1999] untersuchten in einer rotierenden Diffusionszelle den reaktiven Stoffübergang von Kupferionen mittels LIX 65 N im elektrischen Feld unter Variation des Verdünnungsmittels (Octanol-Heptan-Gemische). Generell fanden sie dabei gesteigerte Stoffübergangsraten mit zunehmender Feldstärke und bei bestimmten Verdünnungsmittelzusammensetzungen (z. B. 50:50) eine überproportional starke Stoffaus- 18 STAND DES WISSENS tauschsteigerung. Sie erklärten die beobachteten Stoffaustauschbeschleunigungen mit einer ebenfalls experimentell bestätigten feldbedingten Abnahme der (effektiven) Grenzflächenspannung. Diese feldbedingte Abnahme ist ebenfalls abhängig von der Verdünnungsmittelzusammensetzung und zeigte bei der Mischung von 50:50, Heptan: Octanol, ebenfalls eine besonders starke Abnahme. Jedoch wurden bislang keinerlei Untersuchungen zum reaktiven Stoffaustausch und der Stoffaustauschkinetik unter kinetisch kontrollierten Bedingungen im elektrischen Feld durchgeführt. Auch existieren bislang keine adäquaten Ansätze und Stoffübergangsmodelle, welche die Stoffaustauscherhöhung beschreiben und erklären können. 4.2 Grenzflächenvorgänge beim Stoffübergang Es wurden zahlreiche Untersuchungen bezüglich der Vorgänge beim Stoffübergang oder anderen Erscheinungen an der Phasengrenze zweier flüssiger Phasen im feldfreien Zustand durchgeführt. So wurden vor allem bei sphärischer Grenzflächenstruktur (Tropfen), aber auch an planaren Grenzflächen, Grenzfächeninstabilitäten vom Marangoni-Typ, Einflüsse von durch Tensiden induzierten Grenzflächenladungen und Konzentrationsprofile beim Stoffübergang im Phasengrenzflächenbereich untersucht. Im Falle tensidinduzierter Grenzflächenladungen konnte nachgewiesen werden, dass induzierte Grenzflächenladungen einen starken Einfluss auf den Stoffaustausch der Reaktivextraktion haben. So konnte gezeigt werden, dass durch den Einsatz kationischer Tenside (DTACl), welche die Grenzfläche auf wässriger Seite positiv aufladen, die Extraktionskinetik von Essigsäure mittels Tri-n-octylamin (TOA) stark verbessert wird. Die Verwendung von neutralen Tensiden (TX 100) dagegen zeigte keinen Einfluss auf das Extraktionsgeschehen, während sich die Extraktionsgeschwindigkeit bei Verwendung anionischer Tenside (NaLS, NaDdS) durch abstoßende Wechselwirkungen deutlich verschlechtert [Czapla 2000a, 2000b]. Diese Ergebnisse wurden im Reaktionsplateau bei jeweils gleicher Grenzflächenbelegung erhalten, auch konnte die Tensidladung über die Messung des Zeta-Potentials quantifiziert werden. Nach dem Modell von Stern [Stern 1924] lässt sich das Zeta-Potential mit der elektrischen Doppelschicht [Schwuger 1996] 19 STAND DES WISSENS korrelieren und das Konzentrationsprofil innerhalb der Doppelschicht über die PoissonBoltzmann-Gleichung berechnen (s. Abb. 5) [Czapla 2000a, Bart 2001]. 1.0E+00 DTACl - H+ DTACl - ACNaDdS - H+ NaDdS - Actensidfrei - H+ tensidfrei - AC- mi (x,t) [mol/kg] 1.0E-01 1.0E-02 1.0E-03 1.0E-04 1.0E-05 1.0E-06 0 10 20 30 40 50 60 x [nm] Abb. 5 Berechnete Ionenmolalitäten m für das System 0.2 w-% HAc/H2O//10 w-% TOA/Toluol in der elektrischen Doppelschicht x, x0: Phasengrenzfläche, Simulationszeit 60 min [Czapla 2000a] Die durch die Tenside induzierten, elektrischen Doppelschichten bewirken, dass sich die Bulkkonzentrationen und Konzentrationen an der Phasengrenzfläche um Größenordnungen unterscheiden können (s. Abb. 5), wodurch eine Beschleunigung oder Verlangsamung des Stofftransfers resultiert (s. Abb. 6) [Czapla 2000a, Czapla & Bart 2001, Jesberger 1998, Bart 2001]. 0.006 Molalität HA,org. [mol/kg] 0.005 TX 100 DTACl 0.004 NaLS, NaDdS 0.003 0.002 0.001 0 0 20 40 60 80 100 120 140 Zeit [min] Abb. 6 Vergleich der experimentellen und simulierten Konzentrationszeitverläufe im System 0.2 w-% HAc/H2O//10 w-% TOA/TOL bei einer Belegung Γ=7.5*10-7 mol/m² [Czapla 2000a] 20 STAND DES WISSENS Auch von anderen Autoren konnten derartige Änderungen der Grenzflächenkonzentration und Stoffübergangsraten beobachtet werden. [Chen & Lee 1999] und [Lee et al. 1998] stellten einen bei Tensidzugabe erhöhten Stoffübergang an einer Extraktionskolonne fest, auch [Nitsch & Roth 1978] beobachteten an einer Rührzelle eine geänderte Transferrate bei der reaktiven Zinkextraktion unter Zugabe von Tensiden (NaDds). Weitere Korrelationen zur Estimierung der geänderten Grenzflächenkonzentration an geladenen Grenzflächen wurden von [Cox & Flett 1979] und [Kuzmin et al. 1999] publiziert. Auch sind molekulardynamische Berechnungen zu Grenzflächenvorgängen an geladenen Grenzflächen und elektrischen Doppelschichten, basierend auf der Lennard-JonesGleichung, mit Coulombscher Erweiterung, Gegenstand der aktuellen Grenzflächenforschung [Lyklema 1999]. Durch auftretende Grenzflächeneruptionen kann der Stoffübergang in Flüssig-Flüssig Systemen ebenfalls signifikant gesteigert werden. Abbildung 7 zeigt solche beim Stoffübergang auftretenden Grenzflächenturbulenzen. Abb. 7 Bei einem gleichzeitigen Übergang von Propionsäure von der oberen organischen Phase (CCl4) in die untere Wasserphase und von Phenol von wässrig nach organisch auftretende Grenzflächenturbulenzen [Sawistowski 1971] Slater berichtet in seinem Übersichtsartikel von derartigen Erhöhungen des Stoffübergangskoeffizienten von bis zu 300 % [Slater 1994]. Die Ursachen für solche, nach Marangoni benannten [Marangoni 1871], Konvektionen beim Stoffübergang in FlüssigFlüssig Systemen sind örtliche Inhomogenitäten und Fluktuationen in der Zusammensetzung und Temperatur entlang der Phasengrenze [Hampe 1980, 1981]. Diese Temperatur- bzw. Konzentrationsschwankungen entlang der Phasengrenze führen zu Grenzflächenspannungsgradienten [Grahn 1997]. Auch [Maroudas & Sawistowski 1964] 21 STAND DES WISSENS machen für das Auftreten von Grenzflächeneruptionen (lokale) Änderungen der Grenzflächenspannung verantwortlich. Marangonikonvektionen konnten sowohl beim physikalischen, als auch beim rein reaktiven Stoffaustausch in verschiedenen Apparaturen (Strömungskanal, Rührzelle, Diffusionszelle, Tropfensäule, Extraktionskolonne, ect.) sowohl an planaren, als auch an sphärischen Grenzflächen nachgewiesen werden [Olander & Reddy 1964, Slater 1994]. Für das Stoffsystem Aceton, Wasser (dispers) // Toluol (konti) wurde die kritische Marangonikonzentration, das ist die Konzentration ab welcher die Konvektionen feststellbar sind, am hängenden Tropfen zu 0,5 mol/l bestimmt [Reden 1998]. Es konnte weiterhin, im feldfreien Zustand, gezeigt werden, dass grenzflächenaktive Substanzen (Tenside) die Grenzflächenturbulenzen minimieren oder ganz unterdrücken können. Dies liegt darin, dass diese zum einen die Grenzfläche bezüglich des Stoffaustausches blockieren und andererseits die Grenzfläche quasi starr machen und somit bezüglich der Turbulenzeffekte stabilisieren [Reden 1998]. In manchen Systemen z. B. Anilin // Wasser oder Hexanol // Wasser konnten durch Tensidzugabe (LDS und auch DTAB) anhand von Einzeltropfenexperimenten sogar verstärkte Grenzflächenturbulenzen mittels Schlierenoptik visualisiert und mittels Mach-Zehnder Interferometrie quantifiziert werden. Auch konnte im Rahmen dieser Untersuchungen beobachtet werden, dass sowohl kat- als auch anionische Tenside im Vergleich zum tensidfreien System stärkere Konvektionen hervorrufen, neutrale Tenside dagegen keinen signifikanten Effekt zeigen [Agble & MendesTatsis 2000a, 2000b, 2001]. Auch beim rein reaktiven Stoffaustausch von Cu2+ Ionen mit dem Natriumsalz des Ionenaustauschers Di-2-ethylhexylphosphorsäurediester konnten Marangonikonvektionen im ungerührten System beim Stoffübergang in einer planaren Lewiszelle nachgewiesen werden. Durch die an der Grenzfläche auftretenden Turbulenzen wird nach Angaben des Autors selbst im ungerührten System eine wesentlich bessere Durchmischung der Phasen erzielt, wozu unter Abwesenheit der Marangonikonvektionen mechanische Energiezufuhr in der Größenordnung von 60 Rührerumdrehungen pro Minute notwendig wären [Raharimalala et al. 1995]. Untersuchungen der Marangonikonvektion während des Stoffübergangs mittels holographischer Interferometrie und Laser Doppler Anemometrie an ebenen ruhenden, als auch 22 STAND DES WISSENS bewegten Phasengrenzen im Stoffsystem Aceton, Toluol, Wasser zeigten, dass das Auftreten der Konvektionen neben der Konzentrationsdifferenz der Bulkphasen vor allem von den Flowbedingungen der Bulkphasen abhängig sind. Die Untersuchungen an ruhenden Phasengrenzen standen im Einklang mit der Theorie nach Hampe [Hampe 1980, Pertler et al. 1995]. Zur Vorausberechnung der einsetzenden Konvektion an bewegten Phasengrenzflächen konnten die Kriterien nach Sternling und Scriven [Scriven & Sternling 1960], welche für ruhende Phasengrenzen aufgestellt wurden, allerdings nicht herangezogen werden. Zur Modellierung des Stofftransports konnte, da gezeigt werden konnte, dass der Stoffübergang durch den Transport in den Bulkphasen begrenzt war, ein einfaches Stoffübergangsmodell, wie das Zwei Film Modell, welches Gleichgewicht an der Phasengrenze voraussetzt und den Stofftransportwiderstand vernachlässigt, zur Modellierung des Stoffübergangs herangezogen werden [Wolf & Stichlmair 1998, Wolf 1999]. Mittels Laser Induzierter Fluoreszenzspektroskopie (LIF) ist es möglich unter Verwendung einer fluoreszierenden Stoffübergangskomponente Konzentrationsprofile beim Stoffübergang in der Nähe der Phasengrenze im Tropfen [Mörters & Bart 1999, 2000, Mörters 2001] oder an ebenen Grenzflächen [Baumann & Mühlfriedel 2001a, 2001b] zu untersuchen. Dieses optische Analyseverfahren erlaubt die quantitative Ermittlung der sowohl örtlich, als auch zeitlich aufgelösten Konzentrationsverläufe, sowie eine qualitative Visualisierung der makroskopischen Bewegungsvorgänge während des Stoffübergangs. Messungen des Stoffübergangs im System Rhodamin B, Butanol // Wasser im feldfreien Zustand zeigten, dass sich die erhaltenen Konzentrationsprofile nicht mittels konventioneller Stoffübergangstheorien vorausberechnen lassen. Auch konnte die erwartete Gleichgewichtsverteilung im Phasengrenzbereich experimentell nicht bestätigt werden [Mühlfriedel & Baumann 2000a, 2000b]. 4.3 Grenzflächenvorgänge im elektrischen Feld Bezüglich der Grenzflächenvorgänge im elektrischen Feld beim Stoffübergang in FlüssigFlüssig Systemen sind kaum Untersuchungen bekannt. Einige wenige Autoren beschäftigen sich mit feldinduzierten (oder verstärkten) Turbulenzerscheinungen im Bereich der Flüssig-Flüssig Phasengrenzfläche [Daikhin et al. 1999, Iyer & Sawistowski 1974] 23 STAND DES WISSENS oder mit feldbedingten Änderungen der Grenzflächenspannung [Schweighofer & Benjamin 1995, Kuipa & Hughes 2002, Shchipunov & Kopakov 1991]. Auch sind weitere Studien auf dem Gebiet der feldinduzierten Tropfendeformation oder Tropfengrößenänderung [Byers & Perona 1988, Dong & Tsouris 2001, Vu & Carleson 1986, Gneist & Bart 2002], sowie zur Migration im Potentialfeld (bzw. an geladenen Grenzflächen) bei Elektrophorese- oder Membranprozessen bekannt [Theos & Clark 1995, Taky et al. 1992a]. So ist bekannt, dass elektrische Felder die Grenzflächenstruktur und Grenzflächenverhältnisse eines Tropfens signifikant verändern können. Ab einer kritischen Feldstärke von ca. 1 kV/cm konnte eine einsetzende Ellipsoiddeformation beobachtet und in Form der Exzentrizitätszahl quantifiziert werden [Wham & Byers 1987]. Derartige Effekte konnten von [Ha & Yang 1998] auch bei verschiedenen, an der Phasengrenze adsorbierten, nichtionischen Tensiden im elektrischen Feld über einen weiten Tensidkonzentrationsbereich (0,1 µM – 10 mM) hinweg beobachtet werden. Ab einer kritischen elektrischen Weberzahl, welche sich aus dem Verhältnis zwischen Feld- und Grenzflächenspannungskraft definiert, konnte ein signifikanter Anstieg der Deformation beobachtet werden. Auch konnte bei sehr hohen Feldstärken der Zerfall in kleinere Tochtertropfen, sowie verstärkte Tropfenzirkulation und Oszillation beobachtet werden. Dabei wurde von um bis zu 200 % gesteigerten Stoffübergangskoeffizienten berichtet [Wham & Byers 1987, Scott et al. 1990]. Wird der Tropfen direkt an einer elektrisch geladenen Kapillare erzeugt, so wird dieser durch Polarisationsprozesse elektrisch aufgeladen. Durch diese Ladungseffekte ändert sich das Koaleszenzverhalten, die Tropfenaufstiegsgeschwindigkeit und vor allem die Tropfengröße [Byers & Perona 1988, Dong & Tsouris 2001, Vu & Carleson 1986]. So konnte gezeigt werden, dass durch die an der Grenzfläche auftretenden, feldinduzierten Polarisationseffekte die Tropfengröße enorm (über 10 000 %) reduziert werden kann und sich somit Feinsttröpfchen (d < 10-6 m) herstellen lassen [Gneist & Bart 2002, Gneist 2004]. Auch konnten an ruhenden Flüssig-Flüssig Phasengrenzen (ungerührtes System) feldinduzierte Turbulenzerscheinungen in Form von wellenartigen Grenzflächenfluktuationen beobachtet werden. Gründe für diese im elektrischen Feld auftretenden Turbulenzeffekte sind die Aufladung der Phasengrenze durch Polarisations- und Migrationsvorgänge, sowie die feldbedingte Änderung der Grenzflächenspannung [Daikhin et al. 1999]. Koulova- 24 STAND DES WISSENS Nenova et al. konnten ebenfalls bei planarer Grenzflächengeometrie im ungerührten Stoffsystem Cyclohexan / Propylencarbonat (4-Methyl-1,3-dioxolan-2-on) elektrohydrodynamische Instabilitäten ab einer kritischen Feldstärke von 9,5 kV/cm an der FlüssigFlüssig Phasengrenze beobachten. Weiterhin konnten sie zeigen, dass die kritische Feldstärke durch Salzzugabe (in der unteren Propylencarbonatphase um 30-40 % herabgesetzt werden kann [Koulova-Nenova et al. 1995]. Das et al. konnten durch Simulationsrechnungen mittels der Monte Carlo Methode und der Dichtefunktionalitätstheorie zeigen, dass Polarisationseffekte an der Phasengrenzfläche die Fluktuationen bewirken. Die auftretende Aufladung der Phasengrenzfläche wurde vor allem auf Dipol-Dipol Wechselwirkungen im elektrischen Feld (Orientierungspolarisation) zurückgeführt [Das et al. 1999]. Andere Autoren berichten, dass Grenzflächenladungen sogar stabilisierend gegenüber der Fluktuation wirken können, wie von Mohamed et al. über numerische Berechnungen, basierend auf einer modifizierten nicht linearen Schrödinger Gleichung mit komplexen Koeffizienten, diskutiert wurde. Die dennoch auftretenden Fluktuationen seien dabei in ihrer Intensität gegenüber einem theoretischen System, welches keinerlei Grenzflächenladung aufweist, gemindert [Mohamed et al. 1986, El Dib 1999]. Weitere Autoren sehen, wie auch Daikhin, in der feldbedingten Abnahme der Grenzflächenspannung die eigentliche Ursache für im elektrischen Feld auftretende elektrohydrodynamische Turbulenzvorgänge. So konnten Iyer und Sawistowski zeigen, dass als Schlieren visualisierte Grenzflächenturbulenzen vom Marangonityp bei planarer Grenzflächenstruktur im Stoffsystem Wasser / Isobutanol im elektrischen Feld, vor allem auf organischer Seite, stark erhöht waren. Sie führten diese feldinduzierten Turbulenzerscheinungen auf eine durch das elektrische Feld herabgesetzte Grenzflächenspannung zurück [Iyer & Sawistowski 1974]. Auch andere Autoren zeigten, dass die im elektrischen Feld resultierende, effektive Grenzflächenspannung quadratisch vom angelegten Potential, bzw. der anliegenden Feldstärke, abhängig ist [Daikhin et al. 1999, Kuipa & Hughes 2002, Higgins & Corn 1993]. Einige Autoren berichten von einem Abfall der Grenzflächenspannung zwischen Öl / Wasser Grenzflächen von bis zu 30 mN/m bei einer Feldstärke von 10 kV/m. Dabei wurde gezeigt, dass die Grenzflächenspannung durch das elektrische Feld im Fall bei Anwesenheit grenzflächenaktiver Substanzen stärker abgesenkt werden 25 STAND DES WISSENS kann, als im tensidfreien System. [Shchipunov & Kolpakov 1991]. Auch wurde unabhängig von der Polarität des angelegten Feldes stets eine Abnahme der Grenzflächenspannung beobachtet [Iyer & Sawistowski 1974]. Basierend auf der Gibbs-DuhemGleichung lässt sich folgender Zusammenhang zwischen der Grenzflächenspannung γ und der elektrischen Feldstärke E herleiten (s. Gl. 7): dγ = −q i dE p,T ,µi (7) Die Ladungsdichte qi lässt sich über die Kapazität C und der Differenz der Feldstärke ∆E nach Gleichung 8 beschreiben. q i = C ⋅ ∆E (8) Daraus resultiert nach Kombination von Gleichung 7 und 8 und anschließender Integration die Parabelgleichung 9, welche den quadratischen Einfluss der Feldstärke auf die Grenzflächenspannungsänderung ∆γ beschreibt [Dörfler 1994]. ∆γ = 1 2 C (∆E ) 2 (9) Auch durch molekulardynamische Simulationsrechnungen zur Dynamik einer Wasser/1,2Dichlorethan Grenzfläche konnte gezeigt werden, dass zum einem die Phasengrenze unter Einfluss eines elektrischen Feldes stark verbreitert ist (stärkere Ausdehnung der x, y-Ebene in z-Richtung) und somit auch eine verstärkte Fluktuationsbewegung erkennbar ist. Zum zweiten konnte ein starker Abfall der Grenzflächenspannung (von über 50 % bei einer Feldstärke von 3 V/nm) im elektrischen Feld beobachtet werden [Schweighofer & Benjamin 1995]. Die auftretenden Effekte wurden durch im elektrischen Feld verstärkte Dipol-Dipol Wechselwirkungen begründet. Auch Schmid et al. sahen für die feldbedingten Änderungen der Grenzflächenspannung gesteigerte Polarisationseffekte in Form von Dipolwechselwirkungen der Wassermoleküle als Hauptursache [Schmid et al. 1962]. Auch andere Polarisationseffekte, wie migrativ bedingte Konzentrationsänderungen können die Grenzflächenspannung signifikant beeinflussen. So konnte gezeigt werden, dass durch unterschiedliches Sorptionsverhalten verschiedener Elektrolyte (Na+, K+, I-) an der 26 STAND DES WISSENS Phasengrenzfläche im elektrischen Feld auch die Grenzflächenspannung unterschiedlich stark herabgesetzt werden konnte [Dörfler 1994, Schmid et al. 1962]. Auch ist die Art des Feldes selbst von entscheidender Bedeutung. So konnten im angelegten AC Feld (50 Hz) keinerlei Änderungen der Grenzflächenspannung an geladenen Benzintropfen trotz angelegter Spannungen von 20 000 V ermittelt werden. Auch im hochfrequenten AC Feld (Kiloherzbereich) konnten keinerlei Änderungen der Grenzflächenspannung beobachtet werden. Im DC Feld dagegen wurde eine signifikante Abnahme der Grenzflächenspannung determiniert. Je nach Art der eingesetzten Gleichspannung waren die auftretenden Effekte unterschiedlich. Der stärkste Einfluss wurde im klassischen DC Feld beobachtet. Die Grenzflächenspannung konnte dabei um fast 76 % reduziert werden. Die gepulste DC Variante (4 kHz) zeigte eine fast gleich hohe Abnahme (72 %). Selbst die niederfrequente DC Half Wave Variante zeigte immerhin noch eine feldbedingte Abnahme der Grenzflächenspannung von über 58 % [Efimov et al. 1974]. Wird die Grenzflächenspannung durch das elektrische Feld (Gleichspannungsfeld) entsprechend stark abgesenkt, also unterhalb der kritischen (und stoffsystemspezifischen) Marangonigrenzflächenspannung, treten nach dem Modell von Maroudas und Sawistowski auch verstärkte Phasengrenzflächenturbulenzen in Form von Marangonikonvektionen auf. Dies konnte von Iyer und Sawistowski bei Stoffübergangsuntersuchungen bei planarer Grenzflächengeometrie mit binären und ternären Extraktionssystemen auch experimentell bestätigt werden. Neben im elektrischen Feld verstärkten Grenzflächenturbulenzen wurden dabei auch erhöhte Stoffübergangskoeffizienten (je nach Stoffsystem von 20 % bis 1000 %) beobachtet [Iyer & Sawistowski 1974]. Maekawa et al. untersuchten das Problem der konvektiven Instabilität in elektrischen Gleich- und Wechselstromfeldern theoretisch auf Basis linearisierter Störungsgleichungen mittels der Galerkinmethode. Sie berichteten, dass die kritische Marangonizahl im AC Feld mit zunehmender Feldstärker kleiner wird. Im DC Feld dagegen wird nur bei großen Temperaturgradienten eine Abnahme der kritischen Marangonizahl, bei kleineren Gradienten dagegen wurde sogar eine Steigerung der kritischen Marangonizahl ermittelt [Maekawa et al. 1991, 1992]. Carleson und Berg konnten dagegen über numerische Berechnungen (mittels der LSODI Routine) bei sphärischer Grenzflächengeometrie zeigen, dass die Marangonikonvektion im elektrischen Feld (DC) mit zunehmender Feldstärke gesteigert wird. Dadurch erhöht sich auch der 27 STAND DES WISSENS Stoffübergangskoeffizient. Es konnte weiterhin gezeigt werden, dass die feldbedingte Stoffaustauscherhöhung und die gesteigerte Marangonikonvektion bereits nach sehr kurzer Zeit erreicht werden [Carleson & Berg 1984]. In Extraktionssystemen, in welchen Ladungsträger in Form von Ionen enthalten sind (wie z. B. in Kat- oder Anionenaustauschsystemen), beeinflusst vor allem die elektrophoretische Wanderung der Ionen im elektrischen Feld, neben den bereits beschriebenen feldinduzierten Grenzflächenpolarisations- und Turbulenzeffekten, den Stoffaustausch im elektrischen Feld in signifikanter Weise. Die ionogenen Komponenten migrieren in Abhängigkeit ihrer Landung entlang (oder entgegen) des Potentialgradienten in Wirkrichtung des Feldes. Die Beschreibung der Migration der jeweiligen Komponente i gelingt über die Nernst-Planck’sche Gleichung (Gl. 10) [Bart 2001, Proplesch 1994], Ni = − zi F Di ci ∇ϕ − Di ∇ci + ci v RT (10) mit Ni: molarer Fluss, zi: elektrische Ladungszahl, F: Faradaykonstante, R: allgemeine Gaskonstante, T: Temperatur, ci: Konzentration, Di: Diffusionskoeffizient, ∇φ : Potentialgradient, v: Geschwindigkeit. Durch diese auftretenden Migrationsvorgänge erfolgt eine Konzentrationspolarisation (feldbedingte Konzentrationsänderung) an der Flüssig-Flüssig Phasengrenzfläche, welche bei orthogonaler Wirkrichtung des Feldes zur Phasengrenzfläche maximal wird. Derartige Konzentrationsprofile können orts- und zeitaufgelöst über die Nernst Planck Gleichung ermittelt werden. Im vielen feldgetriebenen oder potentialabhängigen verfahrenstechnischen Prozessen konnten die auftretenden Elektrophoresevorgänge, Stofftransport und konzentrationsbedingte Polarisierungserscheinungen über die Nernst Planck Gleichung berechnet werden. Vor allem im Bereich der Membranverfahren (Elektrodialyse, Elektroosmose, elektrisch geladene Ionenaustauschermembranen) [Maes et al. 1998, Mafe et al. 1990, Verbrugge & Hill 1990, Chen & Chou 1993, Dukhin 1991, Andrade et al. 1994], Ionenaustauschverfahren (geladene Polymerharze, induzierte Grenzflächenladungen) [Franzreb et al. 1993, Tunison & Chapman 1976], Elektrolyseprozessen [Baker et al. 1992] und der klassischen Elektroextraktion [Theos & Clark 1995, Melroy & Buck 1983, Proplesch 28 STAND DES WISSENS 1994] konnten potentialinduzierte Grenzflächenkonzentrationsänderungen über die Nernst Planck Gleichung kalkuliert werden. Die Verwendung analytischer Lösungen der Nernst Planck Gleichung unter vereinfachten Modellannahmen zeigten sich oft in guter Übereinstimmung mit der wesentlich aufwendigeren numerischen Berechnung [Taky et al. 1992b]. 4.4 Der Taylor-Couette Extraktor Die zur Flüssig-Flüssig Extraktion einsetzbaren Extraktionsapparate lassen sich, nach der Gliederung von Lo und Baird (s. Abb. 8), grob in zwei Hauptgruppen unterteilen. Die erste Gruppe (Schwerkraftkolonnen) fasst diejenigen Extraktoren zusammen, bei welchen die Phasentrennung (und Phasenführung) durch Gravitationskräfte erzielt wird. Gängige Vertreter dieser Gruppe sind gerührte Kolonnensysteme (z. B. RDC oder die Kühnikolonne), ungerührte Kolonnen (z. B. Sprühkolonne) oder pulsierende Kolonnen (wie z. B. pulsierende Füllkörperkolonnen). Die zweite Gruppe (Zentrigualextraktoren) umfasst diejenigen Extraktoren, bei welchen die Phasentrennung (und Phasenführung) neben dem gravitativen Einfluss vor allem durch zusätzlich wirkende Zentrifugalkräfte gesteuert wird [Lo et al. 1983, Lo 1997]. Zentrifugalextraktoren ermöglichen die Gegenstromführung von flüssigen Phasen mit sehr geringen Dichteunterschieden und bewirken im Vergleich zu den Schwerkraftkolonnen sehr große querschnittsbezogene Phasendurchsätze und sehr kurze Verweilzeiten [Otillinger & Blass 1988, Blass 1994]. Auch gelingt durch die bei der Drehbewegung auftretenden Zentrifugalkräfte eine sehr gute Phasendurchmischung (und auch Phasenseparation, z. B. De Laval Extraktor, wobei sich die leichtere der beiden Flüssigkeiten (geringere Dichte) im Kolonneninneren, die schwerere Phase (größere Dichte) sich im äußeren Bereich des Extraktors ansammelt). Zentrifugalextraktoren finden heute ein breites Anwendungsfeld in der Flüssig-Flüssig Extraktion. Sie werden im Bereich der pharmazeutischen Industrie zur Extraktion von Penicillin und anderer Antibiotika, in der Kerntechnik zur Extraktion von Uran oder in der Petrochemie zur Aromatenextraktion eingesetzt [Blass 1994]. Auch in der Farbstoffindustrie werden zur reaktiven Extraktion von p-Toluolsulfonsäure (PTS), welche 29 STAND DES WISSENS Flüssig-Flüssig Extraktoren Phasentrennung durch Gravitation Phasentrennung durch Zentrifugalkräfte Schwerkraft Kolonnen Zentrifugalextraktoren Podbielniak E. Luwesta E. Robatel E. De Laval E. Taylor Couette E. Klassifikation durch verschiedene Arten der Agitation Ungerührte Kolonnen Sprühk., Gepackte K., Perforierte Bodenk. Pulsierende Kolonnen Pulsierende Füllkörperk., Pulsierende Packungsk., Pulsierende Siebbodenk., Pulsierender Mixer-Settler Mechanisch betriebene Systeme Rotierende Apparate Mixer-Settler, Scheibel K., Kühni-K., ARD-E., RDC Kolbenbetriebene Apparate Kolbenbetriebene Bodenkolonnen Sonstige Apparate Statischer Mixer, Vibrationskolonne, Bodenextraktor, Ultraschall E., Parametrischer Pumpenextraktor, Elektroextraktor Perforierte Bodenkolonne, Siebbodenkolonne mit Fallrohr, Perforierte Schaufelbodenkolonne, K. : Kolonne E. : Extraktor Abb. 8: Klassifikation von Flüssig-Flüssig Extraktoren [Lo 1997] 30 STAND DES WISSENS aus einem Gemisch von Azofarbstoffen und anderen Farbstoffkomponenten zu extrahieren ist, Zentrifugalextraktoren verwendet [Todd & Hopper 1971]. Ein klassischer Zentrifugalextraktor ist der 1945 für die Penicillinherstellung konzipierte Podbielniak Extraktor. Auch der Taylor-Couette Extraktor ist ein spezieller Zentrifugalextraktor. Bislang wurden lediglich Taylor-Couette Extraktoren konstruiert und in Betrieb genommen, die im feldfreien Zustand betrieben werden können [Baier 1999, Zhu et al. 2000]. Abbildung 9 zeigt den von Baier konzipierten Taylor-Couette Extraktor in schematischer Darstellung. Dieser Extraktor besteht aus zwei konzentrischen Zylindern der Länge L (28 cm) mit unterschiedlichen Radien (ri: 8,35 cm und ra: 10,10 cm). Beide Zylinder sind unabhängig voneinander drehbar. In den Zylinderzwischenraum der Dicke d (d = ra - ri) (Ringspalt) werden beide inkompressiblen Flüssigkeiten eingeleitet. Abb. 9: Taylor-Couette Extraktor nach Baier [1999] (A: Aluminiumzylinder, innen; B: Plexiglaszylinder, außen; C: Ringspalt; D: Abstandshalter; E: Zu- bzw. Abfluss; F: Lager des äußeren Zylinders; G: Lagerung des inneren Zylinders; H: Keilriemenscheibe für äußeren Zylinderantrieb; I: Grenzfläche Flüssig-Flüssig; J = Grenzfläche Flüssig-Luft (Entlüftung); M : Motor mit starrer Kupplung für Direktantrieb) Im Taylor-Couette Extraktor gelingt durch die permanente Rotationsbewegung eine kontinuierliche Phasentrennung, wobei sich eine definierte Phasengrenze im Ringspalt ausbildet. Die hier wirkenden Zentrifugalkräfte führen dabei in radialer Richtung quasi zu einer Aufeinanderschichtung der beiden nicht mischbaren Flüssigkeiten. Bewegt sich nun der Innere, der beiden unabhängig voneinander betriebenen Zylinder oberhalb eines bestimmten Drehzahlbereiches (gleichsinnig rotierende Zylinder mit unterschiedlichen 31 STAND DES WISSENS Rotationsgeschwindigkeiten), so formen sich ab der kritischen Taylorzahl in beiden Flüssigkeitsschichten Taylorwirbel. Diese Art der Strömung, die durch Zentrifugalkräfte und Viskositätswechselbeziehungen verursacht wird, bezeichnet man als Taylor-Couette Strömung (s. Abb. 10). Obwohl im Gegensatz zur herkömmlichen Extraktion sich nur ein relativ geringer Phasenkontaktbereich ausbildet, entsteht auf Grund der Wirbelbewegungen beider Schichten eine für den Massentransport hoch aktive Grenzfläche. Bei Anwendung des Gegenstromprinzips ergibt sich somit ein sehr effektiver Prozess, welcher einen kontinuierlichen Betrieb ermöglicht. Taylor Wirbel Zufluss schwere Flüssigkeit Auslass schwere Flüssigkeit Auslass leichte Flüssigkeit Zufluss leichte Flüssigkeit Innerer Zylinder Äußerer Zylinder Abb. 10: Funktionsprinzip und Strömung im Taylor-Couette Extraktor [Baier, 1999] Zur Erzeugung der Taylor-Couette Strömung und zur optimalen Ausnutzung der Zentrifugaleffekte ist die horizontale Bauweise des Extraktors notwendig. Nur in horizontaler Betriebsweise lassen sich Schwingungen und Fluktuationen der Phasengrenzflächen vermeiden beziehungsweise gegenüber der vertikalen Bauweise minimieren [Baier 1999]. 32 STAND DES WISSENS Heute sind sehr viele experimentelle und auch theoretische Abhandlungen und Untersuchungen zur Hydrodynamik von Ein- und Zweifluidsystemen bekannt. Über numerische Simulationsrechnungen, basierend auf der Finiten Differenzenmethode konnte beispielsweise die Bewegung axialsymmetrischer Taylorwirbel im Ringspalt im Einphasensystem bestimmt werden [Howes & Rudman 1998]. Auch konnte das Strömungsprofil beider Fluide im Taylor-Couette Extraktor über CFD Rechnungen mittels FIDAP und FLUENT bestimmt werden und experimentell über photooptische Methoden (unter der Verwendung von Farbstoffen) bestätigt werden [Baier & Graham 1998, Baier 1999, Baier & Graham 2000]. In jeder der Phasen konnten dabei Wirbelbewegungen beobachtet werden. Der Drehsinn der in der organischen Phase auftretenden Wirbel ist dabei dem Drehsinn der in der wässrigen Phase entstehenden Wirbel entgegengesetzt [Baier & Graham 1998]. Weiterhin konnten Baier und Graham zeigen, dass die Wirbelbildung innerhalb des TaylorCouette Extraktors im Gegenstrombetrieb in der geringer viskosen Flüssigkeit stärker ist, als die Theorie von Rayleigh vorhersagt [Baier & Graham 1998]. Die Stärke der Wirbelbildung ist auch von der Rotationsgeschwindigkeit des äußeren Zylinders abhängig, wie Czarny und Mitarbeiter über numerische Simulationsmethoden zeigen konnten. Bei gleicher Drehzahl des inneren Zylinders konnte die Wirbelbildung durch gleichzeitige Rotation des äußeren Zylinders um über 200 % gesteigert werden [Czarny et al. 2003]. Die Rotationsbewegung des äußeren Zylinders hat auch einen signifikanten Einfluss auf den Stoffübergang im Taylor-Couette Extraktor wie anhand von Extraktionsversuchen mit Acetophenon (als Transferkomponente) gezeigt werden konnte. Ab einer Rotationsgeschwindigkeit von ca. 20% des inneren Zylinders steigt der Stoffübergangskoeffizient sprunghaft an. Ebenso konnte ab dieser Rotationsgeschwindigkeit eine verstärkte Wirbelbildung beobachtet werden [Baier et al. 2000, Baier & Graham 2000]. Zhu et al. [Zhu et al. 2000] führten Stoffübergangsexperimente an einem Taylor-Couette Extraktor mit stationärem äußeren Zylinder (mit nur rotierendem Innenzylinder) im Stoffsystem Wasser, Kerosin mit einem in organischer Phase gelösten Feststoff als Stoffübergangskomponente durch. Im Rahmen dieser Studie konnte gezeigt werden, dass bereits innerhalb weniger Minuten ein stationärer Betriebszustand erreicht wird und der Feststoff in hoher Ausbeute extrahiert wurde. 33 VERSUCHSERGEBNISSE UND DISKUSSION 5 Versuchsergebnisse und Diskussion Alle experimentellen Arbeiten wurden isotherm bei 25 °C durchgeführt. Im Rahmen der durchgeführten Extraktionsversuche wurde stets der Stoffübergang von wässriger nach organischer Phase untersucht. Die verwendeten Chemikalien besaßen p. A. Qualität. Als Analyseverfahren zur Raffinat- und Extraktbestimmung kamen vor allem spektroskopische Determinationsverfahren (UV-Spektroskopie), chromatographische Methoden (GC und HPLC) und potentiometrische Analysetechniken (pH-Wertmessung und instrumentelle Titrationsmethoden) zum Einsatz. Notwendige Detailinformationen zu den verwendeten Chemikalien und Geräten, zur Analytik, Fehlerbetrachtung, Versuchsdurchführung und der Versuchsauswertung sind in Anhang B angegeben wie auch die tabellierten Messwerte in Anhang F. Der Feldeinfluss wurde im elektrischen Gleichspannungsfeld (DC) untersucht. Mit dem in Zusammenarbeit mit dem Lehrstuhl für Hochspannungstechnik und Elektromagnetische Verträglichkeit (EMV) entwickelten Hochspannungsgenerator war es möglich äußere Potentialdifferenzen von 0 bis maximal 50 kV bei einem Stromfluss von bis zu 2 mA an die jeweilige Versuchsapparatur anzulegen. Elektrotechnische Detailinformationen sind im Anhang D aufgeführt. 5.1 Gleichgewichtsuntersuchungen im elektrischen Feld Es konnte gezeigt werden, dass durch das Anlegen äußerer elektrischer Felder das Reaktionsgleichgewicht bei der reaktiven Extraktion starker Säuren nicht verschoben wird, sondern im Vergleich zur feldfreien Extraktion der gleiche Gleichgewichtswert erreicht wird, wie hier am Beispiel der reaktiven Sulfonsäureextraktion über mehrere stöchiometrische Reaktionsverhältnisse zwischen Säure und Ionenaustauscher hinweg dargestellt ist (s. Abb. 11). Die auf der Ordinate aufgetragene Extraktion E definiert sich nach Gleichung 11 wie folgt: E = 100 − c wGG ⋅ 100 c wA (11) mit der Gleichgewichtskonzentration der wässrigen Phase c wGG und der Ausgangskonzentration der wässrigen Phase c wA . 34 VERSUCHSERGEBNISSE UND DISKUSSION 140 PTS: 100 mM TOA: 5 % U: 10 kV 120 Feld PTS: 100 mM TOA: 7,5 % Feldfrei U: 5 kV PTS: 100 mM TOA: 10 % U: 5 kV Extraktion E [%] 100 80 60 40 20 1 4 5 15 0 Stoffsystem: PTS, Wasser / TOA, Toluol Abb. 11 Extraktion von p-Toluolsulfonsäure im elektrischen Feld bei verschiedenen Molverhältnissen zwischen Säure und Ionenaustauscher Dies gilt sowohl für einwertige Säuren (HCl, PTS) und mehrwertige Säuren (PDS, Schwefelsäure), als auch für die Extraktion im Mehrkomponentensystem [Hoogen 2003]. So konnte am Beispiel der p-Toluolsulfonsäure (PTS) bei der Extraktion mit dem tertiären Amin TOA der äquimolare Reaktionsmechanismus für den feldfreien Zustand nach [Todd & Hopper 1971] auch für die Extraktion im elektrischen Hochspannungsfeld nach Gleichung 12 bestätigt werden. − H + + R 1 SO3 + (R 2 ) 3 N (R 2 ) 3 NHR 1 SO3 ln KEX : 16,21 (12) Daraus kann geschlossen werden, dass durch das Feld keine weiteren chemischen und elektrochemischen Reaktionen initiiert werden, welche die Extraktionsleistung beeinflussen [Wildberger et al. 2001, Hoogen 2003]. Derartige Verschiebungen der Gleichgewichtswerte, verursacht durch elektrostatische Wechselwirkungen, konnten beispielsweise an flüssig-gasförmigen Extraktionssystemen nachgewiesen werden [Blankenship et al. 1999]. Auch eine feldbedingte Verschiebung der Gleichgewichtslage, welche beispielsweise beim rein physikalischen Stoffübergang bei der Elektroextraktion organischer Säuren (Elektrophorese zweiter Art) auftreten kann [Proplesch 1994], wurde nicht beobachtet. Dies liegt daran, dass die hier untersuchten geladenen Stoffübergangskomponenten (PTS und HCl) in organischer Phase unlöslich sind (im 35 VERSUCHSERGEBNISSE UND DISKUSSION Gegensatz zur klassischen Elektroextraktion) und somit nicht elektrophoretisch, sondern nur über die chemische Reaktion mit dem Ionenaustauscher, in die organische Phase transferiert werden können, wie diese Untersuchungen beweisen. Des Weitern konnte am Beispiel der PTS gezeigt werden, dass die höchsten Verteilungskoeffizienten bei der reaktiven Säureextraktion bei Verwendung aromatischer Lösungsmittel erzielt werden konnten (DToluol > Dp-Xylol > DIsododekan). Bereits bei äquimolaren Reaktionsverhältnis betrug bei Verwendung des schwach polaren (µ: 0,36 Debye), aromatischen Verdünnungsmittel Toluol die Extraktionsleistung nahezu 100 % [Schenkel 2000]. Im Falle der Extraktion der sehr schwachen, dreiwertigen Hydroxycarbonsäure, Citronensäure, konnte dagegen eine feldbedingte Änderung des Extraktionsgleichgewichtes beobachtet werden, wobei im elektrischen Feld eine höhere Extraktion nachgewiesen werden konnte (s. Abb. 12). Allerdings ist der über mehrere stöchiometrische Reaktionsverhältnisse hinweg auftretende Feldeffekt schwach. 60 HCit: 200 mM TOA: 10 % U: 1 kV Feld 50 Feldfrei HCit: 200 mM TOA: 7,5 % U: 1 kV Extraktion E [%] 40 30 HCit: 200 mM TOA: 5 % U: 1,5 kV 20 10 HCit: 200 mM TOA: 0 % U: 2,5 kV 0 Stoffsystem: HCit, Wasser / TOA, Toluol Abb. 12 Extraktion von Citronensäure im elektrischen Feld bei verschiedenen Molverhältnissen zwischen Säure und Ionenaustauscher Betrachtet man nach Abbildung 13 die pKs-Werte der verschiedenen Dissoziationsstufen der Citronensäure wird klar, dass es sich im Falle der Citronensäure um eine sehr schwache bis überaus schwache Säure handelt, welche kaum dissoziiert vorliegt. 36 VERSUCHSERGEBNISSE UND DISKUSSION Abb. 13 Dissoziationsstufen der Citronensäure Auch kann diese nur reaktiv, d. h. in dissoziierter Form extrahiert werden. Unter Einwirkung eines elektrischen Feldes kann diese Säure jedoch nach dem 2. Wien’schen Effekt [Hamann & Vielstich 1998] weiter dissoziiert werden, wodurch sich eine im Feld erhöhte, reaktiv extrahierbare Citronensäureanionenkonzentration einstellt und somit auch mehr extrahiert werden kann. Der Elektrodissoziationseffekt wirkt sich allerdings nur bei sehr schwachen Säuren aus. 5.2 Rührzellen- und Kinetikexperimente im elektrischen Feld Um nun den Einfluss elektrischer Felder auf die Kinetik der Extraktionsreaktion untersuchen zu können, muss gewährleistet sein, dass sich das System im kinetischen Regime befindet, und somit der diffusive Einfluss auf den Stoffübergang vernachlässigt werden kann und die chemische Reaktion den geschwindigkeitsbestimmenden Schritt darstellt. Diese Separation gelingt in einer planaren Stoffübergangszelle nach Nitsch [Nitsch 1989], in welcher sich allein durch Erhöhung der Rührerdrehzahl der diffusive Stofftransport derart beschleunigen lässt, dass der Stofftransport nur mehr durch die chemische Reaktion dominiert wird. Zudem ist in dieser auf dem Prinzip der Lewis-Zelle basierenden Stoffübergangszelle, die sich zwischen beiden fluiden Phasen ausbildende, planare Grenzfläche (A = 44,18 cm2) genau bekannt, so dass sich der Stoffübergang 37 VERSUCHSERGEBNISSE UND DISKUSSION definiert berechnen lässt und zur Modellierung notwendige Kinetikparameter bestimmt werden können. Die für die Anwendung im elektrischen Feld modifizierte Stoffübergangszelle nach Nitsch ist in Abbildung 14 schematisch dargestellt. Vorratsbehälter Rührwerk Elektrode (positiver Pol) c Computer t Rührzelle Meßverstärker HochspannungsGenerator Elektrode (negativer Pol) Thermostat Pumpe UV-Detektor pH Meter Dreiwegehahn Hochspannungsregler Abb. 14: Anlagenschema der Elektrorührzelle mit UV-Online-Analytik Des Weiteren ist bei der Versuchsdurchführung zu beachten, dass die Reynoldszahlen in beiden Phasen gleich sind (Rew = Reo), um in beiden Phasen gleiche hydrodynamische Verhältnisse zu schaffen, so dass die Stoffübergangsmessungen nicht durch differente, hydrodynamische Einflüsse verfälscht werden. Waubke und Nitsch konnten mit Hilfe des Lichtschnittverfahrens, wie in Abbildung 15 dargestellt, zeigen, dass zwar im Bulkbereich beider Phasen turbulente Strömungsverhältnisse herrschen, in Grenzflächenumgebung aber ein laminarer Strömungszustand vorliegt und die planare Phasengrenzfläche ruhig und stabil bleibt [Waubke & Nitsch 1986]. 38 VERSUCHSERGEBNISSE UND DISKUSSION Abb. 15 Sichtbarmachung der grenzflächennahen Strömung mit Hilfe des Lichtschnittverfahrens [Waubke & Nitsch 1986]. Zunächst mussten für jedes zu untersuchende Stoffsystem die geeigneten Betriebsbedingungen (v. a. Konzentration und Rührerdrehzahl) ermittelt werden, um den Stoffaustausch unter kinetisch kontrollierten Bedingungen untersuchen zu können. Am hier dargestellten Beispiel der p-Toluolsulfonsäure konnte das Vorliegen des kinetischen Regimes (s. Abb. 16), auch Plateaugebiet genannt, sogar für eine Konzentration von 0,1 mol/l an PTS unabhängig von der TOA-Konzentration in organischer Phase (5 – 25 %Vol) bei einer Rührerdrehzahl von 120 rpm bestimmt werden [Schmidt 2000, Wildberger et al. 2001]. Im Stoffsystem Essigsäure // TOA / Isododecan konnte dieses Plateaugebiet erst bei 100-fach geringerer Konzentration ermittelt werden [Czapla 2000a, Bart 2001]. Der auf der Ordinate aufgetragene molare Fluss N definiert sich nach Gleichung 13, wie folgt: N (t ) = a dc = aR(t ) dt mit a = Volumen einer Phase Grenzfläche [m3 ] [m 2 ] (13) mit der spezifischen Stoffaustauschfläche a, der Konzentration c und der Zeit t. R(t ) bezeichnet den Stoffstrom. Für die Versuchsauswertung wurde der molare Fluss N zum Zeitpunkt t = 0 herangezogen [Schmidt 2000]. 39 VERSUCHSERGEBNISSE UND DISKUSSION molarer Fluß t=0 [mol/m²s] 2,5E-03 2,0E-03 1,5E-03 Ausgangskonzentration 0,1 mol/l PTS 1,0E-03 5% TOA 10% TOA 5,0E-04 25% TOA 0,0E+00 40 60 80 100 120 Rührerdrehzahl Abb. 16 140 aq 160 180 200 [rpm] Plateaugebiete bei einer PTS Konzentration von 0,1 mol/l mit 5, 10 und 25%Vol TOA Nach der Methode von Kamenski und Dimitrov lässt sich der molare Fluss N (t ) direkt aus den experimentellen Daten über die in Gleichung 14 angegebene, gebrochen rationale Funktion mit der Zeitvariablen t und den stoffsystemspezifischen Parametern a, b und c korrelieren und somit der Konzentrationsverlauf der Stoffübergangskomponente in wässriger Phase berechnen [Kamenski & Dimitrov 1993]. bt f (t ) = a1 − c+t (14) ∂f (t ) = R(t ) ∂t (15) Der Anfangsstoffstrom R0 berechnet sich aus der Ableitung von Gleichung 14 nach Gleichung 15 zum Zeitpunkt t = 0, der molare Fluss nach Gleichung 13. Die Parameter a, b und c wurden direkt aus den experimentellen Daten estimiert. Es konnte experimentell gezeigt werden, dass durch Anlegung äußerer elektrischer Gleichspannungsfelder die Kinetik des Stoffübergangs (kinetisches Regime) organischer Säuren, wie hier am Beispiel der reaktiven Sulfonsäureextraktion dargestellt, stark beschleunigt wird, wobei analog den tensidischen Ladungen [Czapla 2000a] stets der gleiche Gleichgewichtswert erreicht wird (s. Abb. 17). Die obere der Elektroden (vgl. Abb. 14) in organischer Phase trug dabei die positive Ladung, während die Elektrode in wässriger 40 VERSUCHSERGEBNISSE UND DISKUSSION Phase (negative Ladung) auf Erdmasse gelegt war. Der Abstand zwischen oberer Elektrode und Phasengrenzfläche betrug dabei 1 cm [Wildberger et al. 2001, Schmidt 2000]. 0,12 0,1 M PTSStart; 5% TOAStart naq=120; norg 90 RPM PTSaq [mol/l] 0,1 0,08 U= 0 KV U= 12,5 KV U= 25 KV 0,06 0,04 0,02 0 0 50 100 150 200 250 300 Zeit [min] Abb. 17 Beschleunigung der Stoffübergangskinetik von PTS im elektrischen Hochspannungsfeld, isolierte Spiralelektrode Wird unter vergleichbaren Bedingungen (kinetisches Regime) die Stoffaustauschkinetik von Metallkationen untersucht, so lässt sich bei gleicher Polung des Feldes eine Verschlechterung des Stoffübergangs feststellen, wie in Abbildung 18 am Beispiel der reaktiven Zinkextraktion mittels des Kationenaustauschers Mono-phoshorsäure-di-2ethylhexyl-di-esters (D2EHPA) gezeigt [Wildberger et al. 2001, Mörters 2001]. Dieses unterschiedliche Stoffübergangsverhalten konnte durch die unterschiedlichen migrativen Wechselwirkungen der ionogenen Stoffübergangskomponenten und der dadurch geänderten Grenzflächenkonzentrationen erklärt werden (Konzentrationspolarisation der Phasengrenzfläche), wobei anionische Ladungsträger durch das angelegte Feld (+, 0) an der Phasengrenzfläche angereichert, Kationische dagegen abgereichert werden. Durch die Erhöhung der Phasengrenzflächenkonzentration wird auch der Stoffaustausch erhöht, bzw. im umgekehrten Fall verlangsamt [Wildberger & Bart 2002]. Diese Resultate stehen im Einklang zu Untersuchungen mit tensidischen Ladungsträgern, durch welche ebenfalls eine Konzentrationspolarisation der Phasengrenzfläche erfolgt. Im Falle einer positive Grenzflächenladung (durch kationische Tenside) konnte auch eine Stoffaus- 41 VERSUCHSERGEBNISSE UND DISKUSSION tauschbeschleunigung bei der Anionenextraktion (organische Säuren) beobachtet werden, während bei Verwendung negativ geladener, anionischer Tenside eine Verlangsamung der reaktiven Säureextraktion festgestellt worden war [Czapla 2000a, Bart 2001]. 1,0E-02 Znorg [mol/l] 0,005 M Zink Start; 0,01 M HCl Start; 0,06 M D2EHPA n aq=90; n org 150 RPM U= 25 KV 7,0E-03 U= 0 KV 4,0E-03 1,0E-03 0 50 100 150 200 Zeit [min] Abb. 18 Organische Zinkextraktion im elektrischen Hochspannungsfeld, isolierte Spiralelektrode Es konnte für das Stoffsystem PTS // TOA / Toluol des Weiteren gezeigt werden, dass die Erhöhung des Stoffübergangs linear mit zunehmender äußerer Spannung zunimmt (s. Abb. 19). 1,6 1,5 α [1] 1,4 1,3 1,2 y = 0,024x + 1 R2 = 0,995 1,1 1 0 5 10 15 20 25 U [kV] Abb. 19 Abhängigkeit der Stoffaustauscherhöhung von PTS von der äußeren Spannung, isolierte Spiralelektrode, PTS: 100 mM, TOA: 5 % 42 VERSUCHSERGEBNISSE UND DISKUSSION Der auf der Ordinate aufgetragene Erhöhungsfaktor α definiert sich aus dem Verhältnis der molaren Flüsse bei der Spannung U nach Gleichung 16 wie folgt: α= N t =0 (U ) N t =0 (U = 0 ) (16) Auch konnte gezeigt werden, dass durch Optimierung der Elektrodengeometrie der Stoffaustauchvorgang weiter beschleunigt werden kann (s. Abb. 20). Verstärkungsfaktor α 2,5 Spiralelektrode Stabelektrode Ringelektrode Ringgitterelektrode 2 1,5 1 0 10 20 30 Spannung [KV] Stab 7 mm² Abb. 20 Spiral Ring 240 mm² 864 mm² Ringgitter 1082 mm² Einfluss der Elektrodengeometrie auf den Stoffübergang von PTS, Die Stab- und Ringelektroden waren isoliert, die Ring- und Ringgitterelektrode dagegen nicht, untersuchtes Stoffsystem: PTS (0,1 M), Wasser/TOA (5%), Toluol Je größer die Elektrodengrundfläche prozentual zur Grenzfläche ist, desto höher wird der Verstärkungsfaktor α . Dies kann durch die dadurch resultierende Erhöhung der elektrischen Feldstärke E erklärt werden. So kann bei Verwendung einer Elektrode mit einem Flächenverhältnis (Elektrodengrundfläche zu Grenzfläche) von 20 % der Stoffaustausch (Ringgitterelektrode) bereits bei einer äußeren Spannung von 5 kV um ca. 200 % gesteigert werden, wozu es bei einer Elektrode mit einem Flächenanteil von 5 % (Spiralelektrode) einer Spannung von ca. 50 kV bedarf. 43 VERSUCHSERGEBNISSE UND DISKUSSION Im Folgenden galt es nun die Stoffübergangskinetik weiterer organischer Säuren, die sich in ihrer Wertigkeit oder auch in ihrer Säurestärke von der sehr starken, einwertigen p-Toluolsulfonsäure unterscheiden, ebenfalls unter kinetisch kontrollierten Bedingungen (unter sonst gleichen Bedingungen: TOA, Feldpolarität, Lösungsmittel) zu untersuchen, sowie auch die Extraktion im Mehrkomponentensystem (mehrere Säuren gleichzeitig) bezüglich feldinduzierter Selektivitätseinflüsse auf die Kinetik zu untersuchen. Abschließend wurde auch ein ungeladenes, rein physikalisches Stoffaustauschsystem, und zwar das EFCE Standarttestsystem Aceton, Wasser // Toluol auf den Feldeinfluss hin untersucht. Diese Experimente wurden im Elektrorührzellenextraktor unter Verwendung der Ringgitterelektrode, bei welcher unter den verwendeten Elektroden der Feldeinfluss am höchsten ist, in wässriger Phase und einer teflonummantelten Ringelektrode in organischer Phase durchgeführt. Auf diese Weise konnten am Rührzellenextraktor Spannungen bis max. 30 000 V angelegt werden. Auch eine Isolierung der Elektroden war notwendig, um eine Spannungsentladung während der Versuchsdurchführung zu vermeiden. Zusätzlich sorgten ein als Faraday-Käfig fundierendes Metallgerüst, sowie eine Sicherheitsschaltung nach VDE-Norm für optimale Sicherheitsbedingungen während der Experimente. Betrachtet man die Stoffaustauschkinetik bei der Extraktion einer schwachen und einer starken einwertigen Säure im Vergleich, so ist deutlich zu erkennen, dass der Feldeinfluss im Falle der Essigsäure (schwache Säure) stärker ist (s. Abb. 21 und 22). 1,2 c HAc aq. c/c0 [-] 1 0,8 0,6 0,4 HAc ; U: 0 kV 0,2 HAc ; U: 25 kV 0 0 50 100 Zeit [min] Abb. 21 Extraktion von Essigsäure im elektrischen Feld, HAc: 250 mM, TOA: 10 % 44 VERSUCHSERGEBNISSE UND DISKUSSION 1,2 HCl ; U: 0 kV 1 c HCl aq. c/c0 [-] HCl ; U: 20 kV 0,8 0,6 0,4 0,2 0 0 50 100 Zeit [min] Abb. 22 Extraktion von Salzsäure im elektrischen Feld, HCl: 100 mM, TOA: 5 % In beiden Fällen ist aber eine Beschleunigung des Stoffaustausches zu beobachten. Die signifikante Stoffaustauscherhöhung im Falle der Essigsäure (schwache Säure) kann ebenfalls durch eine im elektrischen Feld gesteigerte Dissoziation (2. Wien’scher Effekt) erklärt werden, da dadurch der an der Extraktionsreaktion beteiligte Reaktand (Acetation) in höher Konzentration vorliegt und auch die Phasengrenzfläche durch verstärkte migrative Effekte stärker polarisierbar ist. Auch bei der Extraktion zweiwertiger Säuren wird sowohl im Falle der Schwefelsäure und von Sulforhodamin eine Stoffaustauschbeschleunigung im elektrischen Feld beobachtet (s. Abb. 23 und 24). Beides stellen sehr starke Säuren bezüglich der ersten Dissoziationsstufe dar. Die Dissoziationskonstante der zweiten Stufe ist aber um mehrere Zehnerpotenzen geringer, so dass die Säure vorwiegend in der ersten Dissoziationsstufe vorliegt und auch die Extraktionsreaktion zwischen TOA und dem einwertigen Säureanion (z. B. Hydrogensulfat oder Sulfonation) im stöchiometrischen Verhältnis von 1:1 abläuft, wie durch Gleichgewichtsexperimente gezeigt werden konnte [Hoogen 2003]. Auch der Felddissoziationseffekt ist hier von eher untergeordneter Bedeutung, da beide Säuren bereits fast vollständig dissoziiert vorliegen. Auch bringt eine höhere Wertigkeit der zu extrahierenden Säure keine weitere Stoffaustauschbeschleunigung, da die höherwertige Stufe selbst nicht signifikant an der Reaktion beteiligt ist. Allerdings wird durch den zweiten Dissoziationsschritt die Konzentration der ebenfalls an der Reaktion beteiligten 45 VERSUCHSERGEBNISSE UND DISKUSSION Hydrogeniumionen etwas erhöht. Diese erhöhte Hydrogeniumionenkonzentration könnte die im Vergleich mit der Salzsäure (nach 60 min ca. 10 %) recht starke Stoffaustauschbeschleunigung im Falle der Schwefelsäure (nach 60 min ca. 40 %) erklären. Konz H2SO4, wässrig [mol/l] 0,01 Schwefelsäure 10 mM, U: 0 KV, experimentell 0,01 Schwefelsäure 10 mM, U: 20 kV, experimentell 0,01 0,01 0,00 0,00 0,00 0 10 20 30 40 50 60 Zeit [min] Abb. 23 Extraktion von Schwefelsäure im elektrischen Feld, H2SO4: 10 mM, TOA: 5 % 12 Konz SRA, wässrig [µmol/l] 10 Sulforhodamin 10 µM, U: 0 kV, experimentell Sulforhodamin 10 µM, U: 25 kV, experimentell 8 6 4 2 0 0 50 100 150 200 250 300 Zeit [min] Abb. 24 Extraktion von Sulforhodamin im elektrischen Feld, SRA: 10 µM, HCl: 0,1 M, TOA: 5 % 46 VERSUCHSERGEBNISSE UND DISKUSSION Nicht in allen Stoffsystemen jedoch konnte eine feldbedingte Beschleunigung der Stoffübergangskinetik beobachtet werden. Der Grund dafür ist eine auch ohne Feld sehr schnell ablaufende Kinetik, welche in ihrer Geschwindigkeit auch durch Feldeffekte nicht mehr signifikant gesteigert werden kann (s. Abb. 25). So ist die Extraktion von PDS bereits im feldfreien System sehr viel schneller als die der PTS im starken elektrischen Hochspannungsfeld und der Feldeinfluss von marginalem Ausmaß. 0,1 c Säure, wässrig [mol/l] 0,09 Plateau TOA: 5 % in Toluol ERZ, 90/120 0,08 0,07 0,06 0,05 0,04 100 mM PDS, U: 0 kV 100 mM PTS, U: 0 kV 100 mM PTS, U: 25 kV 100 mM PDS, U: 25 kV 0,03 0,02 0,01 0 0 20 40 60 80 100 Zeit [min] Abb. 25 Extraktion von PTS und PDS im elektrischen Feld, Molverhältnis zwischen TOA und Säure jeweils 1:1 Des Weiteren konnte gezeigt werden, dass die Feldbeschleunigung auch konzentrationsabhängig ist. So konnte bei der Extraktion der dreiwertigen Citronensäure bei äquimolaren Reaktionsverhältnissen und im Überschuss der Säure eine Stoffaustauschbeschleunigung im elektrischen Feld beobachtet werden, bei Überschuss des Ionenaustauschers jedoch nicht (s. Abb. 26). Ein analoger Effekt wurde für die ebenfalls schwache Essigsäure beobachtet. Auch dort war die Feldbeschleunigung um so größer je höher die Stoffmenge an Säure im Verhältnis zum Ionenaustauscher war (s. Abb. 27). Die Konzentration von 166 mmol/l entspricht dabei in etwa dem äquimolaren Reaktionsverhältnis, bei 250 mmol/l liegt die Säure deutlich im Überschuss vor. Daraus lässt sich schließen, dass dieser rein konzentrationsbedingte Effekt von der Wertigkeit der Säure unabhängig ist. 47 VERSUCHSERGEBNISSE UND DISKUSSION Konz HCit, wässrig (normiert) [-] 1 0,9 0,8 0,7 0,6 Säure zu IT 1:2, U: 0 kV 0,5 Säure zu IT 1:2, U: 25 kV 0,4 Säure zu IT 1,25 zu 1, U: 0 kV 0,3 Säure zu IT 1,25 zu 1, U: 20 kV 0,2 0,1 0 0 20 40 60 80 100 120 140 Zeit [min] Abb. 26 Extraktion von Citronensäure bei verschiedenen Molverhältnissen im elektrischen Feld, TOA: 10 %, HCit zu IT 1:2 ist 100 mM, HCit zu IT 1,25:2 ist 250 mM Konz HAc, wässrig (normiert) [-] 1,2 1 0,8 0,6 HAc: 166 mM; U: 0 kV 0,4 HAc: 166 mM; U: 25 kV HAc: 250 mM; U: 0 kV 0,2 HAc: 250 mM; U: 25 kV 0 0 20 40 60 80 100 120 140 Zeit [min] Abb. 27 Extraktion von Essigsäure im elektrischen Feld bei verschiedenen Molverhältnissen zwischen TOA und Säure, Molverhältnis zwischen 166 mM HAc zu 10 % TOA beträgt ca. 1:1, Molverhältnis zwischen 166 mM HAc zu 10 % TOA beträgt ca. 1,25:1 Bei starken Säuren wurde ein gegenläufiger Effekt beobachtet. Dort wurde bei geringerer Säurekonzentration bzw. bei höherem molaren Überschuss des Ionenaustauschers eine stärkere Feldbeschleunigung gefunden (s. Abb. 28). 48 VERSUCHSERGEBNISSE UND DISKUSSION Konz Säure, wässrig (normiert) [-] 1,2 Schwefelsäure: 50 mM; U: 0 kV 1 Schwefelsäure: 50 mM; U: 25 kV Schwefelsäure: 100 mM; U: 0 kV 0,8 Schwefelsäure: 100 mM; U: 25 kV 0,6 0,4 0,2 0 0 20 40 60 80 100 120 140 Zeit [min] Abb. 28 Extraktion von Schwefelsäure bei höheren Molverhältnissen im elektrischen Feld, IT zu S-Atom beträgt: a) 50 mM H2SO4: 2:1, b) 100 mM H2SO4: 1:1, TOA: 5 % Wird bei einem Molverhältnis zwischen Säure und Ionenaustauscher von 1:10 (s. Abb. 23) noch eine Stoffaustauschbeschleunigung von 25 % nach 30 Minuten erreicht, so beträgt diese bei 1:2 (s. Abb. 28) nur noch 8 % und bei bereits äquimolaren Reaktionsverhältnissen lässt sich bereits keine signifikante Stoffaustauschbeschleunigung mehr erkennen. Aus diesen Ergebnissen folgt, dass die Feldbeschleunigung neben der Konzentration auch von der Säurestärke abhängig ist. Dies ist über das unterschiedliche Dissoziationsverhalten erklärbar. Im Falle starker Säuren sind diese bereits (nahezu) vollständig dissoziiert und auch ist die Grenzflächenkonzentration bei hoher Säurebulkkonzentration bereits so hoch, dass der migrative Feldeinfluss geringer ist als bei niedrigerer Säurekonzentration. Im Fall der schwachen Säuren liegt die Säure dagegen nur zu einem untergeordneten Anteil (ca. 1 % , d. h. ca. 1 mM bei 100 mM Essigsäure) vor und selbst bei starker Migration ist die Grenzflächenkonzentration dennoch niedrig. Ist die Bulkkonzentration erhöht, wird auch der Migrationseffekt durch die Konzentrationserhöhung im Phasengrenzflächenbereich verhältnismäßig stärker. Zudem wirkt das Feld auch über die Felddissoziation (zusätzliche Konzentrationserhöhung), woraus in der Summe eine deutlich gesteigerte Grenzflächenkonzentration bei schwachen Säuren im elektrischen Feld resultiert, welche letztlich für die an der Phasengrenzfläche ablaufende Stoffübergangsreaktion entscheidend ist, denn je höher die Phasengrenzflächenkonzentration (der ionogenen Stoffübergangskomponenten), desto 49 VERSUCHSERGEBNISSE UND DISKUSSION schneller ist der Stoffübergang. Auch die durchgeführten Untersuchungen zur Stoffübergangskinetik im kationischen Stoffaustauschsystem Zn2+ // D2EHPA (s. Abb. 18) bestätigten diese Annahmen, da dort bei gleicher Polung des Feldes ein verlangsamter Stoffübergang der Zinkionen beobachtet werden konnte, da durch die Migrationswechselwirkungen die Grenzflächenkonzentration an Zn2+ durch die entgegengesetzte Ionenladung an der Phasengrenzfläche im elektrischen Feld herabgesetzt wurde [Wildberger & Bart 2002]. Des Weiteren wurden Untersuchungen im Mehrkomponentensystemen durchgeführt. Zweck dieser Messungen war es die Selektivität der Stoffübergangsreaktion im elektrischen Feld, als auch im feldfreien Zustand, zu untersuchen, und auch den Feldeinfluss auf die Stoffübergangskinetik im Binärsystem und auf die Trennselektivität beim rein reaktiven Stoffübergang unter kinetisch kontrollierten Bedingungen zu bestimmen. Ein solches Binärsystem bestand jeweils aus zwei reaktiven Stoffübergangskomponenten (Säuren), die simultan mit dem Ionenaustauscher TOA extrahiert wurden. Zunächst wurde Salzsäure unter Zugabe einer weiteren Säure extrahiert. Dabei konnte festgestellt werden, dass mit zunehmender Säurestärke der beigemischten, zweiten Säure die Extraktion an Salzsäure deutlich abnimmt (s. Abb. 29). 60 Minderung [%] 50 40 30 Zitronensäure 20 p-Toluolsulfonsäure 10 Pyridazindicarbonsäure 0 -8 -6 -4 -2 0 2 4 6 8 pKs-Wert Abb. 29 Minderung der Salzsäureextraktion im Mehrkomponentensystem bei Zugabe einer zweiten Säure unter jeweils äquimolaren Reaktionsbedingungen, HCl: 100 mM, PTS: 100 mM, TOA: 5 %, bei HCit: 200 mM und TOA: 10 %, feldfrei (U: 0 kV) 50 VERSUCHSERGEBNISSE UND DISKUSSION Die schwächeren Säuren (PDS und HCit) beeinflussen die Extraktion der sehr starken Salzsäure geringfügiger, da diese weniger dissoziiert vorliegen und somit den Reaktionsmechanismus nur in untergeordneter Rolle beeinflussen können. Im Falle der Simultanextraktion der starken, fast vollständig dissoziierten PTS sind neben der Konkurrenzreaktion zwischen den Chloridionen und den Sulfonationen mit der Ammoniumfunktion des Ionenaustauschers bei der Komplexbildungsreaktion auch Ligandensubstitutionsreaktionen bei den bereits gebildeten Komplexen, welche erst mit zunehmender Umsetzung an Bedeutung gewinnen, Gründe für die Verschlechterung der Salzsäureextraktion. Neben der höheren Stabilität ist auch die bessere Löslichkeit der Ammoniumsulfonatokomplexe gegenüber den Ammoniumchlorokomplexen für die starke Minderung der HCl-Extraktion verantwortlich. Die in Abb. 29 aufgetragenen Werte sind Mittelwerte über die gesamte Versuchsdauer von 180 Minuten. Betrachtet man die Konzentrationsprofile im elektrischen Feld in Abhängigkeit der Zeit, erkennt man, dass die Selektivität stark zeitabhängig ist und sich erst nach und nach die Gleichgewichtsselektivität einstellt (s. Abb. 30). Säure Konz, wässrig [mM] 120 100 80 Reinsystem PTS-Extraktion bei 20 kV Binärsystem PTS-Extraktion bei 20 kV 60 Reinsystem HCl-Extraktion bei 20 kV Binärsystem HCl-Extraktion bei 20 kV 40 20 0 0 20 40 60 80 100 120 140 160 180 200 Zeit [min] Abb. 30 Zeitabhängigkeit der Säureextraktion im System 100 mM PTS / 100 mM HCl // 5 % TOA im elektrischen Feld Ist die Extraktion an PTS nach 60 Minuten im Binärsystem mit HCl gegenüber dem Referenzsystem (reine PTS unter sonst gleichen Bedingungen) um ca. 27 % gemindert, so 51 VERSUCHSERGEBNISSE UND DISKUSSION beträgt der Wert der Minderung nach 180 Minuten nur noch ca. 6 % und im Gleichgewicht lediglich noch 2%. Im Falle der Salzsäure im Binärsystem steigt die Extraktionsminderung mit zunehmender Zeit. Beträgt diese nach 60 Minuten etwa 44 %, so steigt dieser Wert nach 180 auf ca. 65 % und im Gleichgewicht auf 70% im Vergleich zu reiner HCl an. Der gleiche Wert wird allerdings auch im feldfreien Zustand erreicht. Das bedeutet, dass der Extraktionsprozess zwar von Anfang an selektiver für die Komponente PTS verläuft, die maximale Trennwirkung aber erst in der Nähe des Gleichgewichtes erfolgt. Das elektrische Feld ändert aber den Gleichgewichtswert im Falle starker Säuren nicht und somit auch nicht die maximale Trennselektivität. Betrachtet man die Auswirkung des elektrischen Feldes auf die Stoffübergangskinetik in verschiedenen Binärsystemen, so lässt sich unabhängig von der Säurestärke für jede der Säuren eine Beschleunigung des Stoffaustauschs im elektrischen Feld beobachten (s. Abb. 31 und 32). Konz Säure, wässrig (normiert) 1,2 HCL 10 kV HCL 0 kV PTS 10 kV PTS 0 kV 1 0,8 0,6 0,4 0,2 0 0 50 100 150 200 Zeit [min] Abb. 31 Extraktion von Salzsäure und PTS im Binärsystem, 7,5 % TOA; PTS: 100 mM; HCl: 100 mM Vergleicht man aber die Feldbeschleunigung eines Binärsystems mit der Feldbeschleunigung im Reinsystem (nur die zu extrahierende Komponente alleine), so ist kein signifikanter Unterschied zu erkennen. Die Durchschnittswerte der Feldbeschleunigung für beispielsweise die Essigsäure im Binärsystem liegen mit 2,80 % sogar etwas niedriger als im Reinsystem mit 3,22 % unter sonst gleichen Bedingungen (s. Abb. 33). 52 VERSUCHSERGEBNISSE UND DISKUSSION 0,2 0,18 c Säure, wässrig [mol/l] 0,16 0,14 HCl, U: 0 kV 0,12 HCl, U: 20 kV 0,1 HAc, U: 0 kV 0,08 HAc, U: 20 kV 0,06 0,04 0,02 0 0 20 40 60 80 100 120 140 Zeit [min] Abb. 32 Extraktion von Salzsäure und Essigsäure im Binärsystem, TOA: 10 %; HAc: 200 mM; HCl: 200 mM (simultane Extraktion) 0,2 0,18 c HAc, wässrig [mol/l] 0,16 0,14 0,12 0,1 Referenz HAc, U: 0 kV 0,08 Referenz HAc, U: 20 kV 0,06 HAc Binärsystem mit HCl, U: 0 kV 0,04 HAc Binärsystem mit HCl, U: 20 kV 0,02 0 0 20 40 60 80 100 120 140 Zeit [min] Abb. 33 Vergleich der Feldbeschleunigung zwischen Rein- und Binärsystem, TOA: 10 %, HAc: 200 mM, HCl: 200 mM (simultane Extraktion) Auch in diesem Fall wird die Selektivität der Extraktion durch das elektrische Feld nur im Anfangszeitbereich verändert. Nach 25 Minuten lassen sich Salzsäure und Essigsäure um fast 28 % besser voneinander trennen. Nach 50 Minuten beträgt die feldbedingte 53 VERSUCHSERGEBNISSE UND DISKUSSION Selektivitätsverbesserung immerhin noch 17 %. Grund dieser zeitbedingten Selektivitätsdifferenzen sind durch Migration bedingte Konzentrationspolarisationseffekte an der Phasengrenzfläche, die für jede Ionenart unterschiedlicher Natur sind und den Stoffaustausch für jede Ionenart (Chlorid- bzw. Acetationen) unterschiedlich stark erhöhen. Nach 90 Minuten wird allerdings kaum noch eine feldbedingte Selektivitätsdifferenz beobachtet; diese beträgt lediglich noch 0,5 %. Im Gleichgewicht lässt sich analog der Stoffaustauschbeschleunigung auch bezüglich der Selektivität keine feldbedingte Änderung mehr nachweisen. Einen weiteren, wichtigen Einfluss auf die Kinetik der Gesamtreaktion hat die als Teilschritt der Gesamtreaktion ablaufende Protonierung des Anionenaustauschers an der Aminofunktion des TOA-Moleküls. Am Beispiel der Schwefelsäureextraktion wurde untersucht, inwieweit eine Vorprotonierung des Ionenaustauschers (d. h. es wird statt des Amins zur Extraktion bereits die Ammoniumverbindung, hier: TOAHCl, eingesetzt) die Reaktion an sich und auch die im Feld ablaufenden Migrationsprozesse beeinflussen kann (s. Abb. 34). 0,01 Konz H2SO4, wässrig [M] 0,009 0,008 0,007 0,006 0,005 0,004 0,003 10 mM Schwefelsäure, U: 0 kV, TOA 5 % in Tol 10 mM Schwefelsäure, U: 0 kV, TOAHCl 5 % in Toluol 10 mM Schwefelsäure, U: 20 kV, TOAHCl 5 % in Toluol 10 mM Schwefelsäure, U: 20 kV, TOA 5 % in Tol 0,002 0,001 0 0 20 40 60 80 100 120 140 160 180 200 Zeit [min] Abb. 34 Einfluss der TOA Protonierung auf den Stoffübergang im elektrischen Feld, TOAHCl: 5 %, H2SO4: 10 mM und TOA: 5 %, H2SO4: 10 mM Der Stoffübergang wird durch die vorherige HCl-Protonierung signifikant beeinflusst. Die Extraktion an Schwefelsäure wird deutlich durch den Einsatz von TOAHCl minimiert, 54 VERSUCHSERGEBNISSE UND DISKUSSION auch wurde eine starke, mit zunehmender Zeit steigende Reextraktion von Salzsäure (um bis zu 25 % der eingesetzten Stoffmenge nach 180 Minuten) beobachtet. Die Kinetik der Stoffübergangsreaktion läuft bei Einsatz des unprotonierten Ionenaustauschers dennoch schneller ab, obwohl sich der Teilkomplex (TOAH+) erst bilden muss. Dies liegt darin, dass dieser Schritt der Komplexbildung nicht geschwindigkeitsbestimmend ist, sondern die eigentliche Anionenaustauschreaktion der Säureanionen. Auffallend ist jedoch, dass im elektrischen Feld im Anfangszeitintervall (erste 30 Minuten) der Stoffaustausch bei Einsatz der Ammoniumverbindung stärker beschleunigt wird, als beim unprotonierten Ionenaustauscher. Dies ist auf die Beschleunigung der eigentlichen Anionenaustauschreaktion mit dem Säureanion durch Migrationseffekte zurückzuführen. Im feldfreien Betrieb dagegen wird genau der umgekehrte Sachverhalt beobachtet. Dies zeigt eindeutig, dass der zweite Reaktionsschritt (also die Anionenaustauschreaktion) den geschwindigkeitsbestimmenden Schritt darstellt und das elektrische Feld genau diesen Teilschritt beschleunigt. Zusammenfassend ist zu sagen, dass im Falle der Reaktivextraktion das elektrische Feld zwar die Stoffübergangskinetik der Anionen beschleunigt (oder wie im Fall des Zink bei gleicher Polung des angelegten Feldes verlangsamt), aber mit Ausnahme der sehr schwachen Säuren immer die selben Gleichgewichtswerte wie im feldfreien Betrieb erreicht werden. Somit hat das elektrische Feld zwar die Kinetik der ablaufenden Reaktion beeinflusst, die Reaktion an sich aber nicht verändert. Diese Aussage gilt auch für die sehr schwachen Säuren, da die durch das Feld erreichte Stoffaustauscherhöhung auf Elektrodissoziationsprozesse (feldbedingte Konzentrationserhöhung der Reaktanden) zurückzuführen sind und nicht auf die geänderte Extraktionsreaktion an sich. Abschließend wurde auch der Feldeinfluss auf den rein physikalischen Stoffaustausch bei planarer Grenzflächengeometrie im EFCE-Standardtestsystem Wasser, Aceton, Toluol in der Elektrorührzelle untersucht. Auch im Falle des nicht reaktiven Stoffübergangs konnte zumindest für höhere Acetonkonzentrationen eine Beschleunigung des Stoffaustausches beobachtet werden (s. Abb. 35), während für niedrigere Acetonkonzentrationen keinerlei Feldeinfluss, ähnlich wie bei der Extraktion schwacher Säuren (vgl. Abb. 27) zu erkennen ist. Der Feldeffekt ist also auch hier konzentrationsabhängig. Auch im Gleichgewicht wurde im elektrischen Feld ein erhöhter Stoffübergang im Falle höherer Konzentrationen (ab ca. 500 mM) um bis zu 28 % (bei 1000 mM) beobachtet. Migrative Effekte sind in 55 VERSUCHSERGEBNISSE UND DISKUSSION diesem Fall aber auf Grund der geringen Dissoziationskonstante des Acetons (log(kD) ≈ -20, Dissoziation erfolgt dabei über die Enol-Form) als Ursache auszuschließen. 0,5 0,45 Aceton, aq. [mol/l] 0,4 0,35 0,3 0,25 0,2 0,15 100 mM Aceton ; U: 20 kV 100 mM Aceton ; U: 0 kV 500 mM Aceton ; U: 20 kV 500 mM Aceton ; U: 0 kV 0,1 0,05 0 0 10 20 30 40 50 60 70 Zeit [min] Abb. 35 Feldeinfluss auf den physikalischen Stoffübergang im System: Aceton/Toluol/Wasser, SÜ: wässrig nach organisch Derartige Stoffaustauschsteigerungen konnten auch von [Iyer & Sawistowski 1974] beim rein physikalischen Stoffübergang (nicht ionischer Stoffübergangskomponenten) bei planarer Grenzflächengeometrie experimentell bestätigt werden. Sie erklärten die im Feld erhöhten Stoffaustauschkoeffizienten durch im elektrischen Feld gesteigerte, stoffaustauscherhöhende Grenzflächenkonvektionen. 5.3 Untersuchung des Stoffübergangs am Einzeltropfen Grenzflächeninstabilitäten im elektrischen Feld und Anhand der reaktiven Sulfonsäureextraktion wurden im Folgenden Stoffübergangsversuche bei sphärischer Grenzflächengeometrie durchgeführt. Dabei galt es zu untersuchen, inwieweit die an planaren Grenzflächen erzielten Ergebnisse auf den Stoffübergang am Tropfen übertragbar sind und somit eine Aussage über die Verfahrensumsetzung der Feldextraktion in klassischen Extraktionsapparaten, die auf Dispergierung und Tropfenbildung basieren, zu erhalten. 56 VERSUCHSERGEBNISSE UND DISKUSSION Zunächst wurde der Stoffübergang von PTS bei verschiedenen Spannungen in Abhängigkeit von der Zeit am hängenden Tropfen untersucht (s. Abb. 37 und 38), da sich dadurch Konvektions- und innere Zirkulationseffekte minimieren lassen [Mörters 2001], die ebenfalls durch elektrische Felder beeinflusst werden können [He et al. 1996]. Die zur Untersuchung eingesetzte Versuchsapparatur mit schlierenoptischer Detektion ist schematisch in Abb. 36 dargestellt. Abb. 36: Schlierenoptischer Aufbau: 1 – Nanoblitzlampe; 2 – Bi-Konvexlinse; 3 – Schlierenspalt; 4 – PlanKonvexlinse; 5 – Schlierenzelle; 6 – Achromat; 7 – Schlierenkante; 8 – CCD-Kamera [Gneist 2004] Dabei wurde aus Sicherheitsgründen (Durchschlagsgefahr) die nichtleitende Phase als Kontiphase benutzt und die, die Stoffübergangskomponente enthaltende, wässrige Phase dispergiert. Das schlierenoptische Messprinzip beruht auf der Erfassung optischer Unregelmäßigkeiten innerhalb des parallelen Strahlenganges. Diese Unregelmäßigkeiten können z. B. stoffübergangsinduzierte Dichteunterschiede sein. Es kommt zu Verstärkungen und Auslöschungen der parallelen Lichtstrahlen, die in Form von Hell/Dunkel-Mustern sichtbar gemacht werden können. Aus den Abbildungen 37 und 38 ist deutlich zu erkennen, dass der reaktive Stoffaustausch von PTS sowohl im feldfreien System als auch unter dem Einfluss starker elektrischer Felder mit Grenzflächeninhomogenitäten verbunden ist. Auffallend ist, dass die als Schlieren visualisierten Inhomogenitäten vom Marangoni Typ durch das elektrische Feld beeinflusst werden. Die auftretenden Schlieren scheinen sich über ein größeres Volumenintervall auszudehnen und auch geordneterer Natur zu sein, was durch Grenzflächenaufladungseffekte [Gneist & Bart 2001], geänderte Grenzflächenprofile [Daikhin et al. 1999] 57 VERSUCHSERGEBNISSE UND DISKUSSION und die gesteigerte Ordnung der ionischen Ladungsträger erklärbar ist [Kuipa & Hughes 1999]. Auch konnte gezeigt werden, dass der reaktive Stoffaustausch im Stoffsystem PTS // TOA, Toluol durch den Einfluss elektrischer Felder am hängenden Einzeltropfen im elektrischen Feld um ca. 200 % (unter sonst gleichen Bedingungen) beschleunigt wird. Während der Stoffaustauschprozess im feldfreien System erst nach ca. 4 Minuten sichtlich beendet ist, ist der Stoffaustauschvorgang bei einer angelegten Spannung von 5 kV bereits nach unter 2 Minuten abgeschlossen. Die erhaltenen Ergebnisse bestätigen die bereits an planaren Grenzflächen erhaltenen Ergebnisse [Wildberger & Bart 2002] und stehen in Einklang zu früheren Untersuchungen, bei welchen von gesteigerten Stoffübergangsraten und gesteigerten Grenzflächeninstabilitäten an sphärischen Grenzflächen bei der FlüssigFlüssig-Extraktion durch die Applikation elektrischer Felder berichtet wurde [Mohan et al. 1986, Austin et al. 1971, Hund & Lancelot 1986]. 15 s 30 s 1 min 1,5 mm 2 min Abb. 37: 3 min 4 min Stoffübergang von PTS am hängenden Tropfen (d: 1,5 mm), U: 0 kV (Wässrig: 1 N PTS, Organisch: 5 % TOA in Toluol) Kapillaraußendurchmesser: 1,59 mm, SÜ: w (d) → org (k) 58 VERSUCHSERGEBNISSE UND DISKUSSION 15 s 30 s 45 s 1,5 mm 60 s Abb. 38: 75 s 90 s Stoffübergang von PTS am hängenden Tropfen (d: 1,5 mm), U: 5 kV (Wässrig: 1 N PTS, Organisch: 5 % TOA in Toluol) Kapillaraußendurchmesser: 1,59 mm, SÜ: w → org Auf Grund der im reaktiven Stoffsystem PTS/TOA erhaltenen Ergebnisse wurde eine systematische Untersuchung des Feldeinflusses auf die Marangonikonvektion durchgeführt. Dazu wurde das EFCE Standarttestsystem Aceton, Wasser / Toluol verwendet, da zu diesem System bereits eine breite Vergleichsdatenbasis für den feldfreien Zustand verfügbar ist [Reden 1998] und zum anderen auf Grund der in der Planarzelle erhaltenen Ergebnisse (Stoffaustauschbeschleunigung im System Wasser, Aceton / Toluol) weiterer Aufklärungsbedarf bezüglich des Beschleunigungsmechanismus beim rein physikalischen Stoffaustausch bestand. Außerdem stabilisieren die grenzflächenaktiven Ionenaustauscher (Tenside) bei reaktiven Stoffaustauschsystemen die Phasengrenzfläche auch im elektrischen Feld gegenüber Konvektionen, was die Untersuchungen der Grenzflächenturbulenz gerade bei niedriger Konzentration und geringeren Feldstärken erschwert. Der Stoffübergang von Aceton (wässrig, dispers nach organisch) wurde bei verschiedenen Spannungen in Abhängigkeit von der Zeit am hängenden Tropfen untersucht (s. Abb. 39). 59 VERSUCHSERGEBNISSE UND DISKUSSION In Analogie zu den Untersuchungen an der Planarzelle (vgl. Abb. 35) konnte auch bei sphärischer Grenzflächengeometrie ein konzentrationsabhängiger Einfluss des elektrischen Feldes beobachtet werden. Im Falle höherer Acetonkonzentrationen ist eine deutliche Steigerung der Grenzflächenaktivität mit zunehmender Feldstärke zu erkennen, während im Falle niedriger Acetonkonzentrationen wie bei der Planaruntersuchung (auch hier wurde eine 100 mM Acetonlösung verwendet) kein signifikanter Einfluss festzustellen ist. Abb. 39: Feldeinfluss am hängenden Tropfen, d:: 1,5 mm, SÜ: w (d) → org (k) Ebenso wurde die zeitliche Abhängigkeit des Stoffübergangs untersucht. Es konnte einerseits beobachtet werden, dass die auftretenden Marangonikonvektionen im Feld analog dem reaktiven Stoffaustausch nicht nur intensiver sind, sondern auch über einen längeren Zeitraum hinweg zu beobachten sind im Vergleich zum feldfreien System (s. Abb. 40). Bei Zusatz von Tensiden (DTACL und NaLS) unter sonst gleichen Bedingungen konnten selbst bei hohen Feldstärken keine wesentlich gesteigerten Grenzflächenturbulenzen beim physikalischen Stoffübergang des Acetons beobachtet werden, da diese die Phasengrenze zu stark blockieren und somit den Stoffaustausch inhibieren. 60 VERSUCHSERGEBNISSE UND DISKUSSION Abb. 40: Feldkinetik am hängenden Tropfen, d: 1,5 mm, SÜ: w (d) → org (k) Andererseits wird aus den durchgeführten Untersuchungen deutlich, dass der Stoffaustausch im Feld wesentlich schneller abläuft. Betrachtet man die unteren Bilder bei 30 s und 60 s, erkennt man, dass nur noch wenige Schlieren vorhanden ist und der Stoffaustausch im Feld nach einer Zeit von 60 s nahezu abgeschlossen ist, während ohne Feld noch ein dicker Diffusionskranz beobachtet wird (Bild oben, mittig bei 30 s). Im feldfreien System ist der Stoffübergang erst nach 600 s sichtlich abgeschlossen, was eine Beschleunigung durch das DC-Feld um den Faktor 10 bedeutet. Dies steht im Einklang mit den Untersuchungen von Iyer und Sawistowski, die ebenfalls von um über 1000 % gesteigerten Stoffaustausch, verursacht durch gesteigerte Grenzflächenturbulenzen im elektrischen Feld, berichten [Iyer & Sawistowski 1974]. Da gezeigt werden konnte, dass Marangonikonvektionen nicht nur konzentrations- sondern auch feldabhängig sind, war es wichtig nun die kritischen Marangonikonzentrationen in Abhängigkeit der Feldstärke zu bestimmen. Die erhaltenen Ergebnisse sind in Tabelle 3 dargestellt. 61 VERSUCHSERGEBNISSE UND DISKUSSION Tabelle 3: Feldeinfluss auf die Marangoniinstabilität, Tropfen: d: 1,5 mm, SÜ: w (d) → org (k) Im feldfreien System wurde für das Stoffsystem Wasser, Aceton // Toluol, bei Stoffübergangsrichtung von wässrig, dispers nach organisch, die kritische Marangonikonzentration am Tropfen zu 500 mmol/l bestimmt. Auch bei planarer Grenzfläche wurde unter sonst gleichen Bedingungen die gleiche, kritische Marangonikonzentration von 500 mmol/l ermittelt. Dies steht im Einklang zu den Messungen von Reden, der den kritischen Marangonikonzentrationsbereich zwischen 500 mmol/l und 750 mmol/l am Tropfen angab [Reden 1998]. Mit Erhöhung der äußeren Spannung reduziert sich die kritische Marangonikonzentration jedoch deutlich, bei 5 kV beispielsweise bereits um über 50 %. Diese Absenkung der kritischen Marangonikonzentration erklärt die gesteigerte Grenzflächenturbulenz. Nach der Theorie von Sawistowski ergibt sich dieser Abfall der kritischen Marangonikonzentration durch die feldbedingte Abnahme der (effektiven) Grenzflächenspannung, welche auch von anderen Autoren theoretisch und experimentell nachgewiesen werden konnte [Daikhin et al. 1999, Kuipa & Hughes 2002, Higgins & Corn 1993]. Zur weiteren Untersuchung des Feldeinflusses auf den Stoffübergang wurden Studien am bewegten Tropfen in einer Tropfensäule mit einer Fallstrecke von bis zu einem Meter durchgeführt. Die an der Kapillare am Kolonnenkopf erzeugten Tropfen (wässrige Phase) wurden über die gesamte Fallstrecke bis zum Kolonnenboden zwischen zwei als Elektroden fungierenden Platten geleitet. Außer den Elektroden enthielt die Kolonne keine 62 VERSUCHSERGEBNISSE UND DISKUSSION weiteren Einbauten. Die durch die organische Kontiphase fallenden, wässrigen Tropfen konnten an verschiedenen Positionen (also nach verschiedener Fallstrecke) über ein Trichtersystem abgesaugt und bezüglicher ihrer Zusammensetzung mittels HPLC-UV analysiert werden. Die Stoffübergangsrichtung war von wässrig nach organisch und das Feld mit der Polung +, 0 wirkte direkt zwischen den Platten. Abbildung 41 zeigt den Versuchsaufbau. Abb. 42 Einfluss der Spannung auf die Tropfengröße am Wassertropfen, Bildaufnahmen bei 25 °C über CCDKamera beim Abriss, Kapillare AD: 1,59, ID: 0,25 [mm] Tropfenvolumen, normiert [-] 1,2 t3: Tropfenabriss 1 Polynomisch (t3: Tropfenabriss) 0,8 0,6 0,4 0,2 0 0 0,5 1 1,5 2 2,5 Spannung [kV] Abb. 41 Schematische Darstellung der Elektrotropfensäule [Gneist 2004] Abb. 43 Korrelation der Abhängigkeit der Tropfengröße von der angelegten Hochspannung, Wasser (d), Toluol 63 VERSUCHSERGEBNISSE UND DISKUSSION Zunächst wurde im Stoffsystem Wasser // Toluol, die Tropfenerzeugung im elektrischen Hochspannungsfeld untersucht, da eine im Feld geänderte Tropfengröße den Stoffaustausch signifikant beeinflusst und deshalb dieser Feldeinfluss zunächst quantifiziert werden muss. Abbildung 42 zeigt das erhaltene Resultat. Es ist deutlich zu erkennen, dass die erzeugten Wassertropfen unter Einfluss eines elektrischen Gleichspannungsfeldes kleiner werden. Das erhaltene Ergebnis steht in Einklang mit den Untersuchungen von Gneist [Gneist 2004], der ebenfalls eine starke Minimierung der Tropfengröße im elektrischen Feld beobachtete. Diese feldbedingte Tropfengrößenabnahme lässt sich über eine kubische Gleichung, wie in Abbildung 43 gezeigt, korrelieren. Auch Gneist konnte die feldbedingte Abnahme der Tropfengröße über eine Polynomfunktion 3. Grades beschreiben [Gneist 2004]. Da die Tropfengröße stark von der Grenzflächenspannung abhängig ist und bei der Versuchsdurchführung außer der Feldstärke keine weiteren Parameter geändert wurden, lässt sich als Ursache der Tropfenverkleinerung analog Sawitowskis Theorie [Sawistowski 1973a, 1973b] eine durch das Feld herabgesetzte Grenzflächenspannung diskutieren. In Zusammenarbeit mit dem MPI für Kolloid- und Grenzflächenforschung in Golm, Abteilung Grenzflächen, AG Dr. Miller, konnte am Stoffsystem Toluol / Wasser gezeigt werden, dass die Grenzflächenspannung tatsächlich mit zunehmender Feldstärke, im untersuchten Spannungsbereich von 0 bis 1100 V, abnimmt (s. Tabelle 4). Die Grenzflächenspannung γ wurde dabei an Hand von den in Abbildung 42 dargestellten Tropfenbildern basierend auf der Gauss-Laplace Gleichung (Gl. 17) über die Software PAT 1 von SINTERFACE, Berlin ermittelt, 1 1 = ∆P0 + ∆ρgz + R1 R2 γ (17) mit: den Hauptkrümmungsradien R1 und R2 , der Druckdifferenz ∆P0 , der Dichtedifferenz ∆ρ , der vertikalen Tropfenhöhe z und der Erdbeschleunigung g . Die Tropfenaufnahmen wurden in der in Abbildung 36 dargestellten Versuchsapparatur aufgenommen, wobei die obere Kapillarelektrode, an welcher die Tropfen erzeugt wurden, die Hochspannung trug und die ringförmige Gegenelektrode auf Masse gelegt war. 64 VERSUCHSERGEBNISSE UND DISKUSSION Tabelle 4: Feldabhängigkeit der effektiven Grenzflächenspannung im Stoffsystem Toluol (k) / Wasser (d) Angelegte Spannung [kV] 0 0,5 1,0 1,1 Grenzflächenspannung [mN/m] 35,3 13,7 12,9 14,6 Die ermittelte Grenzflächenspannung für den feldfreien Zustand entspricht nahezu dem Literaturwert vom 36,1 mN/m [Dukhin et al. 1995]. Dies zeigt, dass die Methode zuverlässig arbeitet. Die Abweichung vom Literaturwert lässt sich auf die Reinheit des verwendeten Toluols zurückführen. Bei höheren Feldstärken jedoch ist die Auswertung nicht mehr möglich, da das elektrische Feld zudem den Krümmungsradius und somit die Tropfengestalt verändert [Miksis 1981, Wohlhuter & Basaran 1992, Basaran & Wohlhuter 1996] und bei zu hohen Feldstärken die Bedingungen der Gauss-Laplace Gleichung nicht mehr erfüllt sind und somit die Auswertung nicht mehr möglich ist. Die feldinduzierte Tropfenverkleinerung führt (bei gleichem Dispersgesamtvolumen) zu einer Erhöhung der Stoffaustauschfläche und somit zu erhöhten Stoffübergangskoeffizienten, wie bereits von mehreren Autoren gezeigt werden konnte [Weatherley et al. 1984, Yamaguchi 1995a, Gneist & Bart 2001, Gneist & Bart 2002]. Um die um diesen Effekt korrigierte, weitere Wirkung des elektrischen Feldes zu untersuchen, mussten die Stoffübergangsversuche so gestaltet werden, dass sowohl im Feld, als auch im feldfreien System Tropfen gleicher Größe vorliegen. Dies konnte dadurch erreicht werden, indem Kapillaren mit gleichem Außendurchmesser (da: 1,59 mm), aber mit unterschiedlichem Innendurchmesser verwendet wurden (feldfrei di: 0,1 mm, im Feld di: 0,25 mm). An genau definierten Positionen wurden in Abhängigkeit der Kolonnenhöhe Proben entnommen und auf ihre chemische Zusammensetzung hin analysiert. Das erhaltene Ergebnis für die Extraktion von PTS am bewegten Tropfen im elektrischen Feld ist in Abb. 44 dargestellt. Betrachtet man das erhaltene Konzentrationsprofil, so lässt sich zunächst vermuten, dass der Stoffaustausch im Feld stark erhöht ist. Jedoch ist hierbei noch ein weiterer Feldeffekt zu berücksichtigen, denn die durch das Feld polarisierten und somit geladenen Tropfen bewegen sich durch das Elektrodensystem in einem Zick-Zack Kurs (s. Abb. 45), woraus auch eine längere Verweilzeit in der Kolonne resultiert (s. Tab. 5). 65 VERSUCHSERGEBNISSE UND DISKUSSION PTS Konz im Tropfen [mmol/l] 70 Feldfrei, U: 0 kV 60 Feld, U: 6,18 kV 50 40 30 20 10 0 0 10 20 30 40 50 60 70 Fallhöhe [cm] Abb. 44 Stoffübergang von PTS in der Elektrotropfensäule in Abhängigkeit von der Fallhöhe; Messung an jeweils gleicher Position, bei gleicher Tropfengröße d: 1,5 mm, T: 25 °C Abb. 45 Zick-Zack-Kurs eines geladenen Tropfens (w) durch die organische Kontiphase im elektrischen Feld in Zeitrafferdarstellung Trifft der polarisierte Tropfen auf die Elektrode wird er entgegengesetzt geladene Teil entladen und die verbliebene Ladung von der Gegenelektrode angezogen, dort wieder entladen usw., woraus sich die erhöhte Verweilzeit erklärt. Auch andere Autoren 66 VERSUCHSERGEBNISSE UND DISKUSSION berichteten bereits über derartige Zick-Zack Bewegungsverläufe geladener Tropfen im Feld [Gneist 2004, Yamaguchi 1995b]. Tabelle 5: Vergleich des Verweilzeitverhalten in der Kolonne bei unterschiedlichen Feldstärken Feldfrei, U: 0 kV Feld, U: 6,18 kV Position [cm] Verweilzeit [s] 0 5 20 40 60 Position [cm] 0,00 0,70 2,82 5,63 8,45 Verweilzeit [s] 0 5 20 40 60 0,00 0,98 3,92 7,84 11,76 Deshalb ist zum objektiven Vergleich beider Messreihen die Betrachtung über die Zeit notwendig. Abbildung 46 zeigt die ermittelten Tropfenkonzentrationen in Abhängigkeit von der Verweilzeit. PTS Konz im Tropfen, aq. [mol/l] 0,0700 6,18 kV DC 0 kV 0,0600 0,0500 0,0400 0,0300 0,0200 0,0100 0,0000 0,00 2,00 4,00 6,00 8,00 10,00 12,00 14,00 Zeit [s] Abb. 46 Stoffübergang von PTS in der Elektrotropfensäule in Abhängigkeit der Verweilzeit; Messung bei gleicher Tropfengröße d: 1,5 mm, T: 25 °C Bei Betrachtung des reinen, d. h. um elektrohydrodynamische Effekte korrigierten Feldeinflusses auf den Stoffaustausch wird deutlich, dass der Stoffübergang nur an der Position 0 signifikant erhöht ist (s. Abb. 46). Dies entspricht dem Sonderfall des an der Kapillare hängenden Tropfens. In diesem Fall befindet sich die negativ geladene Elektrode (hier: geerdete Kapillarelektrode) direkt inmitten der wässrigen Phase, die positiv geladene 67 VERSUCHSERGEBNISSE UND DISKUSSION Gegenelektrode innerhalb der organischen Phase, wodurch das elektrische Feld analog der Konstellation bei planarer Grenzflächengeometrie direkt in Stoffübergangsrichtung wirkt und die ablaufenden Polarisationseffekte den Stoffaustausch verbessern. Verlässt der Tropfen nach dem Abriss die Elektrode entspricht die Wirkrichtung des Feldes nicht mehr der Stoffübergangsrichtung (s. Abb. 47). Abb. 47 Unterschiedliche Wirkrichtung des Feldes auf den anionischen Stoffaustausch in Abhängigkeit von der Grenzflächengeometrie (PG: Phasengrenzfläche, SÜ: Stoffübergang) Der sich durch den Plattenkondensator bewegende Tropfen wird dabei zwar (analog einem Dilektrikum) polarisiert, doch kompensieren sich die unterschiedlichen Aufladungseffekte gegenseitig so, dass keine signifikante Stoffaustauschbeschleunigung mehr resultiert. Analoge Effekte bezüglich des physikalischen Stoffaustausches konnten auch von Gneist beobachtet werden [Gneist 2004]. 5.4 Untersuchung von Grenzflächenprofilen beim Stoffübergang im elektrischen Feld Im Rahmen eines Kooperationsprojektes (innerhalb des DFG-Forschungsschwerpunktes SPP 1105) mit der Arbeitsgruppe um Prof. Baumann (Martin-Luther Universität, HalleWittenberg) wurden Stoffübergangsuntersuchungen bei planarer Grenzflächengeometrie mittels Laser Induzierter Fluoreszenz (LIF) im elektrischen Feld durchgeführt. Durch die 68 VERSUCHSERGEBNISSE UND DISKUSSION verwendete 2D-Lasertechnik ist es möglich Konzentrationsprofile im Phasengrenzflächenbereich beim Stoffübergang von fluoreszenzaktiven Verbindungen zu ermitteln [Mühlfriedel & Baumann 2000a,b]. Die Feldbedingungen waren analog zur Rührzelle und den Gleichgewichtsuntersuchungen bei planarer Grenzfläche. Auf Grund der starken Streueffekte im Lichtschnitt war die Adaption mechanischer Rührer nicht möglich, so dass die Untersuchungen im ungerührten System durchgeführt wurden. Der Versuchsaufbau ist in Abbildung 48 dargestellt. Abb. 48 Versuchsbau zur Grenzflächenprofilmessung Die Untersuchungen wurden im Stoffsystem Wasser, Sulforhodamin (SRA) // TOA, Toluol durchgeführt. Die zweiwertige, fluoreszenzaktive Sulfonsäure (SRA) fungierte dabei als reaktive Stoffübergangskomponente. Zuvor konnte auch bereits gezeigt werden, dass die Extraktionskinetik im elektrischen Hochspannungsfeld von SRA im untersuchten Spannungs- und Konzentrationsbereich gesteigert werden kann (s. Abb. 24) und somit die Messung auch sinnvoll ist. Abbildung 49 zeigt das Konzentrationsprofil beim Stoffübergang zwischen wässriger Bulkphase und organischem Bulk. Die schwarz gezeichneten Linien sind im feldfreien Zustand aufgenommen, die Roten unter Anlegung des elektrischen Feldes. Der Konzentrationsverlauf ist in beiden Fällen recht ähnlich. Die Konzentration ist im wässrigen Bulkbereich relativ konstant (0-200 Pixel), und fällt dann im Grenzflächenbereich ab (200-800 Pixel), bis sich wiederum eine konstant bleibende 69 VERSUCHSERGEBNISSE UND DISKUSSION Bulkkonzentration auf organischer Seite (800-1000 Pixel) einstellt, die jedoch erwartungsgemäß unter derer der wässrigen Bulkphase liegt. 3500 0 kV, Zeit: 0 min 10 kV, Zeit: 0 min 3000 0 kV, Zeit: 2 min 10 kV, Zeit: 2 min Intensität [GW] 2500 0 kV, Zeit: 5 min 10 kV, Zeit: 5 min 2000 0 kV, Zeit: 10 min 10 kV, Zeit: 10 min 1500 0 kV, Zeit: 15 min 10 kV, Zeit: 15 min 1000 0 kV, Zeit: 30 min 500 10 kV, Zeit: 30 min 0 0 200 400 600 800 1000 1200 Höhe [Pixel] Abb. 49 Konzentrationsprofile beim reaktiven Stoffübergang von Sulforhodamin im elektrischen Feld im Phasengrenzflächenbereich 1 Pixel: 15,9 µm Tabelle 6: Vergleich der Stoffaustauschkinetik von Sulforhodamin im elektrischen Feld in der Rührzelle Sulforhodamin: 10 µmol/l, Salzsäure: 0,1 mol/l // 10 % TOA in Toluol) Zeit [min] 0 0,5 1 2 3 5 15 30 45 60 120 180 240 Extraktion bei U: 0 kV [%] 0 1,72 2,3 3,5 4,7 7,2 17,6 29,7 39,6 48,0 71,3 82,8 85,3 Extraktion bei U: 20 kV [%] 0 5,22 6 7,1 8,5 11,2 23,4 36,8 47,8 56,3 77,9 87,3 89,7 Beschleunigungsfaktor [-] 1 3,03 2,61 2,01 1,81 1,55 1,28 1,20 1,17 1,13 1,08 1,05 1,03 70 VERSUCHSERGEBNISSE UND DISKUSSION Im elektrischen Feld lassen sich jedoch einige Unterschiede erkennen. Zum einen ist der Konzentrationsabfall im Phasengrenzflächenbereich steiler und zum anderen sind im Phasengrenzbereich auftretende Konzentrationsmaxima (Konzentrationssprünge) zumindest im Anfangsbereich (nach 2-5 min) deutlich stärker (bei ca. 600 Pixel). Auch liegt die Konzentration in organischer Bulkphase (zur gleichen Zeit) etwas höher, was auf einen gesteigerten Stoffübergang schließen lässt. Dieser Befund steht in Analogie zu den Kinetikexperimenten an der Rührzelle, bei denen auch gerade im Anfangsbereich (bei 0,5 bis ca. 5 Minuten) die höchste Stoffübergangsbeschleunigung festgestellt wurde, wie Tabelle 6 zeigt. 5.5 Kontinuierlich betriebene Extraktion im elektrischen Hochspannungsfeld Ziel dieser Arbeiten war die Konstruktion und Inbetriebnahme eines modifizierten Horizontalextraktors, der im elektrischen Feld kontinuierlich betrieben werden kann und in welchem sich auf Grund der Zentrifugalkraft eine planaranaloge, zylindrische Grenzflächenstruktur inmitten des Ringspalts ausbildet. In diesem Zylinderkondensator lässt sich eine sehr hohe Feldliniendichte erzeugen, wobei die Wirkrichtung des Feldes auf Grund der Planargeometrie der Grenzfläche der Stoffübergangsrichtung entspricht (s. Abb. 51). Das elektrische Feld wird dabei zwischen beiden Zylindern angelegt. Der entwickelte Apparat ist schematisch in Abbildung 50 dargestellt. Abb. 50 Schematische Ansicht des Flüssig-Flüssig Taylor-Couette Elektroextraktors Der Extraktor besteht aus zwei konzentrisch gelagerten Zylindern der Länge L mit unterschiedlichen Radien. Der innere Zylinder (Welle) mit dem Radius ri ist aus VA-Stahl hergestellt und dient der Übertragung der elektrischen Hochspannung. Die Hochspannung 71 VERSUCHSERGEBNISSE UND DISKUSSION wird dabei über ein Graphitfedersystem auf die rotierende Welle übertragen. Zur Vermeidung eines elektrischen Durchschlags ist die innere Welle mit einen als Isolator fungierenden Polytetrafluorethylenmantel (PTFE) umgeben. Das zylindrische Wellenende wird zur Übertragung des Drehmomentes genutzt. Ein Doppelwellengelenk nach DIN 808 ist zwischen Welle und elektrischem Antrieb gekoppelt und überträgt so die mechanische Arbeit des Motors. Der äußere Zylinder, ein Glasrohr mit dem Radius ra, ermöglicht es aufgrund seiner Transparenz die während der Versuchsdurchführung ablaufenden Vorgänge zu beobachten. Das Glasrohr ist außerhalb des Reaktors mit Metallstangen umgeben, die auf Masse gelegt sind und somit als Gegenelektrode zum inneren Zylinder fungieren [Anspach 2003]. Die Konstruktions- und Zeichnungsarbeiten am Taylor-Couette Extraktor wurden mit dem CAD-Programm mechanical desktop 6 durchgeführt [Anspach 2003]. Der Extraktor wurde in Analogie zu dem von Baier für den feldfreien Betrieb gefertigten Taylor-Couette Extraktor konzipiert [Baier 1999, Baier et al. 2000]. Das schematische Funktionsprinzip des Extraktors ist in den Abbildungen 10 und 51 dargestellt. Beide, d. h. der innere, als auch der äußere Zylinder rotieren gleichsinnig. Ab einer kritischen Drehzahl bilden sich in den beiden, durch Zentrifugalkräfte getrennten Phasen Taylor-Wirbel aus. Auch entspricht die Feldwirkrichtung der Stoffübergangsrichtung. Abb. 51 Feldwirkrichtung im Taylor-Couette Elektroextraktor 72 VERSUCHSERGEBNISSE UND DISKUSSION Eine während der Versuchsdurchführung entstandene Bildaufnahme zeigt den TaylorCouette Extraktor im Feldbetrieb bei 10 000 V (s. Abb. 52). Abb. 52 Kontinuierliche Extraktion im Taylor-Couette Elektroextraktor Die Taylor-Wirbelbildung wurde unter Verwendung des Farbstoffs SRA in Abhängigkeit der Ringspaltgröße untersucht (s. Abb. 53 und 54). Abb. 53 80 rpm Wirbel: 0 107 rpm Wirbel: 12 (Beginn) 110 rpm Wirbel: 18 128 rpm Wirbel: 63 150 rpm Wirbel: 81 175 rpm Wirbel: 99 200 rpm Wirbel: 128 250 rpm Wirbel: 142 300 rpm Wirbel: 180 Taylorwirbelbildung im Taylor-Couette Extraktor, Ringspalt: 0,5 cm 73 VERSUCHSERGEBNISSE UND DISKUSSION Die kritische Drehzahl, ab welcher die Taylorwirbelbildung eintritt, nimmt mit kleinerer Ringspaltgröße ab. Die Anzahl der auftretenden Taylorwirbel steigt mit zunehmender Rotationsgeschwindigkeit. Eine höhere Taylor-Wirbelanzahl bewirkt einen verbesserten Stoffaustausch auf Grund der gesteigerten Turbulenz im Phasengrenzflächenbereich [Baier & Graham 1998, 2000]. 200 180 Ringspalt: 2 cm; Feldfrei, U: 0 kV 160 Ringspalt: 2 cm; Feld, U: 10 kV Ringspalt: 0,5 cm; Feldfrei, U: 0 kV Wirbelanzahl 140 Polynomisch (Ringspalt: 2 cm; Feldfrei, U: 0 kV) 120 Logarithmisch (Ringspalt: 0,5 cm; Feldfrei, U: 0 kV) 100 80 60 40 20 0 0 100 200 300 400 500 600 700 800 900 Drehzahl des Innenzylinders [rpm] Abb. 54 Ringspalt-, Rotations- und Feldeinfluss auf die Taylor-Wirbelbildung Die Taylor-Wirbelbildung wird durch das anliegende Feld nicht beeinflusst (s. Abb. 54), auch ein Feldeinfluss auf die axiale Dispersion im Reaktor konnte selbst bei hohen Spannungen von 40 000 Volt nicht beobachtet werden (s. Abb. 55). 70 Diracimpuls von 10 ml 10000 µM Sulforhodaminlösung (SRA) zur Zeit t = 0 am Kolonnenanfang, Konzentrationsmessung am Kolonnenende, Flow: 100 ml/min, Gegenstrombetrieb, 0 rpm Konz SRA, aus [µmol/l] 60 50 0 kV 40 30 kV 30 40 kV 40 kV, Messung 2 20 0 kV, Messung 2 10 40 kV, Messung 3 0 0 20 40 60 80 100 120 140 Zeit [min] Abb. 55 Axiale Dispersion im elektrischen Feld 74 VERSUCHSERGEBNISSE UND DISKUSSION Untersuchungen zum Stoffaustausch zeigten, dass sowohl der physikalische (s. Abb. 56), als auch reaktive Stoffaustausch (s. Abb. 57) im elektrischen Feld im Taylor-Couette Extraktor bei kontinuierlicher Betriebsweise stark erhöht werden konnte. Auch wird der stationäre Betriebszustand binnen weniger Minuten erreicht. 1,1 Wässrige Phase: 1000 mM Aceton Organische Phase: Toluol (i): 650 rpm, (a): 50 rpm Gegenstrombetrieb c Aceton, wässrig aus [mol/l] 1 0,9 U: 0 kV U: 5 kV 0,8 0,7 0,6 0,5 0,4 0,3 0 20 40 60 80 100 Zeit [min] Abb. 56 Stoffübergang von Aceton im Taylor-Couette Elektroextraktor im elektrischen Feld (physikalischer Stoffübergang), Phasenverhältnis w. zu org. 1:1, Flow: 5 ml/min (w. und org.) Wässrige Phase: 1000 mM Essigsäure Organische Phase: 5 % TOA in Toluol (i): 630 rpm, (a): 0 rpm Gegenstrombetrieb c Essigsäure, wässrig aus [mol/l] 0,96 0,91 U: 10 kV U: 0 kV 0,86 0,81 0,76 0,71 0,66 0,61 0,56 0 10 20 30 40 50 60 70 Zeit [min] Abb. 57 Stoffübergang von Essigsäure im Taylor-Couette Elektroextraktor im elektrischen Feld (reaktiver Stoffübergang), Phasenverhältnis w. zu org. 1:1, Flow: 5 ml/min (w. und org.) 75 MODELLIERUNG UND SIMULATION 6 Modellierung und Simulation 6.1 Kinetikmodell Mit Hilfe des folgenden Kinetikmodells kann der reaktive Stoffaustausch simuliert werden, wenn der Stoffübergang kinetisch kontrolliert ist. Dazu wird die Gesamtreaktion zwischen der dissoziierten, einwertigen Säure (s. Gl. 18) und dem Ionenaustauscher, TOA, (s. Gl. 23) in drei Teilschritte zerlegt (s. Gl. 24-26) [Roos 2000, Bart 2001]. H + + A− HA KD (18) Die Dissoziation der Säure in wässriger Phase wird dabei über die Dissoziationskonstante kD berücksichtigt (s. Gl. 19). Der Dissoziationsgrad α ergibt sich dabei aus der Säurekonzentration cHA nach Gleichung 20. Daraus errechnen sich die Konzentrationen der Protonen und Säureanionen nach den Gleichungen 21 und 22. kD = α= [H ][A ] + − (19) [HA] 1 kD 2 c HA 4c HA − 1 1+ kD (20) c H + = αc HA (21) c A − = αc HA (22) H + + A − + TOA ad H + + TOA ad TOAHA ad + TOAH ad (23) K1 (24) Der Querbalken über dem Symbol steht für die in organischer Phase gelöste Spezies und der Index „ad“ weist auf jene Spezies hin, welche an der Grenzfläche adsorbiert ist. Der erste Reaktionsschritt (Gl. 24) repräsentiert die Protonierung des an der Phasengrenzfläche adsorbierten TOA-Moleküls. + TOAH ad + A− TOAHAad k2; k-2 (25) 76 MODELLIERUNG UND SIMULATION Durch die Extraktion des Säureanions wird im zweiten Reaktionsschritt (Gl. 25) an der Phasengrenze ein Trialkylammoniumsäureanionkomplex gebildet, welcher im dritten Schritt (Gl. 26) dann durch ein frisches TOA-Molekül aus dem Bulk substituiert wird und dabei selbst in die Bulkphase gelangt. TOAHAad + TOA TOAad + TOAHA k3; k-3 (26) Durch Kombination der Gleichungen 23-26 ergibt sich der reaktive Stoffstrom R’ nach Gleichung 27 [Schmidt 2000]. 1 ⋅ [TOAHA] K ex ' R = ⋅ [TOAad ] 1 1 1 − ⋅ [TOA] ⋅ [ A ] + ⋅ [TOA] + k1 K1 ⋅ k 2 K1 ⋅ K 2 ⋅ k3 [TOA] ⋅ [H + ] ⋅ [ A − ] − (27) Anhand von Grenzflächenspannungsmessungen konnte gezeigt werden, dass die Anzahl der Adsorptionsstellen der Ionenaustauscherspezies an der Phasengrenzfläche abhängig von der TOA Konzentration der organischen Bulkphase ist. Deshalb kann die monomolekulare Schichtbelegung der TOA-Derivate mit Hilfe des Langmuir'schen Gesetzes nach Gleichung 28 beschrieben werden [Czapla 2000a, Bart 2001]: [TOA ad ] + [TOAH + ad ] + [TOAHA ad ] = α m ⋅ [TOA] γ m + [TOA] (28) αm und γm sind die Adsorptionskonstanten, welche über Grenzflächenspannungsmessungen zu 8.49×10-4 für αm und zu 2.98×10-2 mol/l für γm (TOA in Toluol) bestimmt werden konnten [Schmidt 2000]. Unter Berücksichtigung der Grenzfächenadsorption des Ionenaustauschers ergibt sich dann der effektive reaktive Stoffstrom R durch Kombination der Gleichungen 27 und 28 [Schmidt 2000] nach Gleichung 29 zu: 1 ⋅ [TOAHA] α ⋅ [TOA] K ex ⋅ m Nenner γ + [ TOA ] m [TOA] ⋅ [H + ] ⋅ [ A − ] − R= (29) 77 MODELLIERUNG UND SIMULATION mit: Nenner = + + K 1 1 ⋅ [TOA] ⋅ [ A − ] + ⋅ [TOAHA] ⋅ [ A − ] + 1 ⋅ [TOAHA] k1 K3 K ex 1 1 1 ⋅ ⋅ [TOA] + [TOA] ⋅ [H + ] + ⋅ [TOAHA] k 2 K1 K1 ⋅ K 3 1 1 1 ⋅ + ⋅ [ H + ] + [H + ] ⋅ [ A − ] k 3 K 1K 2 K 2 (30) Die Gleichgewichtskonstanten der einzelnen Teilreaktionen Ki (Gl. 24-26) ergeben sich aus den Reaktionskonstanten ki (Hinreaktion) und k-i (Rückreaktion) der einzelnen Teilreaktionen Ri nach Gleichungen 31-34. + R1 = k1 ⋅ [TOAad ] ⋅ [H + ] − k −1 ⋅ [TOAH ad ] (31) + R 2 = k 2 ⋅ [TOAH ad ] ⋅ [ A − ] − k −2 ⋅ [TOAHAad ] (32) R 3 = k 3 ⋅ [TOAHAad ] ⋅ [TOA] − k −3 ⋅ [TOAHA] ⋅ [TOAad ] (33) K ex = k1 k 2 k 3 ⋅ ⋅ = K1 ⋅ K 2 ⋅ K 3 k −1 k − 2 k −3 (34) Die Gleichgewichtskonstante der Gesamtreaktion Kex ergibt sich aus den Gleichungen 35-36 für R = 0. R imG.G. = 0 = [TOA ] ⋅ [H + ] ⋅ [A − ] − K ex = 1 ⋅ [TOAHA ] K ex [TOAHA ] G.G. [TOA ] G.G. ⋅ [H + ] G.G. ⋅ [A − ] G.G. (35) (36) Der molare Fluss Nm und die Konzentrationen c ergeben sich in Abhängigkeit der Zeit t aus dem effektiven, reaktiven Stoffstrom R unter Berücksichtigung der spezifischen Stoffaustauschfläche a (Verhältnis aus Phasenvolumen V und Grenzfläche A) nach Gleichungen 37 und 38. N m (t ) = R (t )a = a dc dt (37) 78 MODELLIERUNG UND SIMULATION a= V A (38) Dieses Modell korreliert die experimentellen Daten der Rührzellenversuche und Gleichgewichtsexperimente für verschiedene reaktive Stoffsysteme (starke und schwache Säuren) in guter Übereinstimmung mit den experimentellen Daten (s. Abb. 58-61) über einen weiten Konzentrationsbereich (über eine Zehnerpotenz bezüglich der molaren Reaktionsverhältnisse zwischen dem Ionenaustauscher TOA und der Säure von 0,5 zu 1 (bei 2,5 % TOA) bis 5 zu 1 (bei 25 % TOA) s. Abb. 58), wie anhand der p-Toluolsulfonsäure (PTS) in Abb. 58 gezeigt ist. Die Simulation des Stoffübergangs der Salzsäure bei äquimolarem Reaktionsverhältnis ist in Abb. 59 dargestellt. Die durchgezogenen Linien symbolisieren die simulierten Werte. 0,12 PTS [ mol/l ] 25% TOA 10% TOA 5% TOA 2,5% TOA Konzentration 0,1 M PTS 0,1 0,08 0,06 0,04 0,02 0 0 100 200 300 400 500 Zeit [ min ] Abb. 58 Simulation der Stoffübergangskinetik von PTS im feldfreien Zustand Auch die Extraktion mehrwertiger Säuren, wie in Abbildung 59 am Beispiel der zweiwertigen Schwefelsäure dargestellt, lässt sich, wie auch der simultane Stoffübergang im Mehrkomponentensystem (in Abbildung 60 für das Binärsystem Salzsäure/Essigsäure gezeigt) mit Hilfe dieses Modells in guter Übereinstimmung mit den experimentellen Daten beschreiben. 79 MODELLIERUNG UND SIMULATION Säure, aq. [mol/l] 0,01 Salzsäure, experimentell Salzsäure, Simulation Schwefelsäure, experimentell Schwefelsäure, Simulation 0,0075 0,005 0,0025 0 0 20 40 60 80 100 120 140 Zeit [min] Abb. 59 Simulation der Stoffübergangskinetik verschiedener Säuren (Salzsäure: einwertig, Schwefelsäure: zweiwertig) mit dem Ionenaustauscher TOA, U: 0 V, TOA: 5 %, Säure: 10 mM 0,25 Säure, aq. [mol/l] 0,2 0,15 Simulation 200 mM HCl Mischsystem bei 0 kV Exp. HCL im Mischsystem bei 0 kV 0,1 Exp. HAc im Mischsystem bei 0 kV Simulation 200 mM HAc Mischsystem bei 0 kV 0,05 0 0 50 100 150 200 Zeit [ min ] Abb. 60 Simulation der Stoffübergangskinetik von Salzsäure und Essigsäure im Binärsystem, U: 0 kV, TOA: 10 %, feldfrei Weiterhin konnte gezeigt werden, dass auch die mehrwertigen Säuren, überwiegend über ihre erste Dissoziationsstufe extrahiert werden. Selbst für die sehr starke, mehrwertige Schwefelsäure, die auf Grund ihres niedrigen pKS-Wertes (s. Tabelle 1) wesentlich stärker 80 MODELLIERUNG UND SIMULATION in höherer Dissoziationsstufe im Vergleich zu den schwachen, mehrwertigen Säuren vorliegt, konnte nachgewiesen werden, dass die Reaktion zwischen Säure und dem Ionenaustauscher TOA im molaren Verhältnis von 1:1 verläuft, was die Gleichgewichtsberechnungen über das Kinetikmodell unter Annahme des Hydrogensulfatmechanismus (s. Gl. 39) im Vergleich mit den experimentellen Daten bestätigen (s. Abb. 61). 0,09 Extraktion von Schwefelsäure, experimentelle Daten 0,08 Berechnung für Hydrogensulfatmechanismus GG H2SO4 org. [mol/l] 0,07 0,06 0,05 0,04 0,03 0,02 1:1 Reaktion zwischen Aminofunktion und Schwefelsäure 0,01 0 0 0,01 0,02 0,03 0,04 0,05 GG H2SO4 wässrig [mol/l] Abb. 61 Gleichgewichtsberechnung für die Schwefelsäureextraktion mit TOA, U: 0 kV Der Säure-Base Komplex bildet sich analog der Extraktion einwertiger Säuren nach Gl. 25 über die erste Dissoziationsstufe des Säureanions (bei H2SO4: Hydrogensulfation), wie durch Slope-Analyse und weiteren Mechanismusuntersuchungen gezeigt werden konnte (s. Abb. 62 bis 63) im stöchiometrischen Verhältnis zwischen Säure und Ionenaustauscher von 1:1. Eine Extraktion über Diammoniumkomplexe oder gar höherwertige Ammoniumstufen konnte im Falle der mehrwertigen Säuren nicht beobachtet werden. Es muss jedoch die Dissoziation der zweiten Stufe nach Gleichungen 39 und 40 berücksichtigt werden, da dadurch die Konzentrationen der jeweiligen Spezies (Hydrogeniumionen, Hydrogensulfationen) geändert werden. H 2 AII HAII− + H + kD1 (39) 81 MODELLIERUNG UND SIMULATION HAII− AII2− + H + kD2 (40) In den Gleichungen 20 bis 38 wird im Falle zweiwertiger Säuren A = HAII eingesetzt, für eine dreiwertige Säure in Analogie A = H 2 AIII . 4 3,8 5 % TOA in Toluol 3,6 log R0, t=0 [mol/qm s] Linear (5 % TOA in Toluol) 3,4 3,2 3 2,8 2,6 1 y = 1,0321x + 4,5621 2 R =1 2,4 1 2,2 2 -2,1 -1,9 -1,7 -1,5 -1,3 -1,1 -0,9 -0,7 log c H2SO4, t=0 [mol/l] Abb. 62 Slope-Analyse zur Schwefelsäureextraktion mit TOA, Auswertung für die Säure 3,5 10 mM Schwefelsäure 3 log R0, t=0 [mol/qm s] Linear (10 mM Schwefelsäure) 2,5 2 y = 1,3387x + 3,7645 R 2 = 0,9982 1 1,5 1 1 -1,5 -1,25 -1 -0,75 -0,5 log c TOA, t=0 [mol/l] Abb. 63 Slope-Analyse zur Schwefelsäureextraktion mit TOA, Auswertung für TOA 82 MODELLIERUNG UND SIMULATION 6.2 Berechnung elektrostatischer Felder Um die Feldeinflüsse auf die Stoffübergangskinetik zu berücksichtigen, ist es zunächst erforderlich, das anliegende elektrische Feld zu berechnen. Die Berechnung des in der Planarzelle anliegenden elektrischen Feldes und des Grenzflächenpotentials gelingt numerisch über die Finite Elemente Methode mittels des Computerprogramms EMAS (Firma Ansoft, U. K.) basierend auf den Maxwell’schen Gleichungen (Gl. 41) [Wildberger & Bart 2002]. ∇(εE ) = 0 ∇×E = 0 E = −∇U (41) Die exakte Geometrie des Kondensators (Geometrie der Stoffübergangszelle und der verwendeten Elektroden), die angelegte Spannung U, die Temperatur, die Stoffeigenschaften (Leitfähigkeit, Dielektrizitätskonstante ε ) und auch der Vektorcharakter des Feldes E werden dabei berücksichtigt. Es konnte aber auch gezeigt werden, dass zur Feldberechnung auf Grund der weitgehenden Homogenität des zwischen zwei Gitterelektroden angelegten Feldes ein vereinfachter Feldberechnungsansatz nach Schwab über die Laplace Gleichung (Gl. 42) herangezogen werden kann [Schwab 1993]. ∂ 2φ ∂ 2φ ∂ 2φ ∆φ = 2 + 2 + 2 = 0 ∂x ∂y ∂z (42) Die Laplace Gleichung wurde dabei für ein Dirichlet’sches Problem mit den Randbedingungen φ (0 ) = U und φ (d ) = 0 gelöst und somit die Potentialfunktion φ (x, y , z ) ermittelt. Der berechnete Potentialverlauf zwischen den beiden Elektroden, sowie das ermittelte Potential an der Phasengrenzfläche ist in Abb. 64 dargestellt. Die Abweichung zwischen der aufwendigen und exakteren numerischen Berechnungsmethode und der Näherung mit der Laplace Methode betrug dabei lediglich 4 %, so dass im Folgenden letztere zur Feldberechnung herangezogen wurde. Auch für die Feldberechnung im Taylor-Couette Elektroextraktor, lässt sich zur Feldberechnung die Laplace Gleichung verwenden, da die Länge des Zylinderkondensators um über eine Zehnerpotenz größer als der Durchmesser ist und somit die axiale Feldkomponente gegenüber der Radialen vernachlässigbar klein ist und das Feld homogenen Charakter hat und direkt zwischen beiden Zylindern wirkt [Wolff 1997]. 83 MODELLIERUNG UND SIMULATION 25 Laplace Gleichung, U: 20 kV Potential ϕ [kV] 20 EMAS, U: 20 kV 15 0-1: Organische Phase 1-2: Wässrige Phase 10 5 0 0 0,5 1 1,5 2 2,5 Abstand z [cm] Abb. 64 Potentialverlauf im der modifizierten Rührzelle nach Nitsch (s. Abb. 14) bei einer äußeren Spannung U von 20 kV 30 Welle: Isolierung: Organische Phase: Wässrige Phase: Feldstärke E [kV] 25 0 - 1,5 1,5 - 2,0 2,0 - 3,0 3,0 - 4,0 [cm] [cm] [cm] [cm] 20 15 U: 25 kV U: 25 kV 10 U: 25 kV U: 25 kV 5 U: 25 kV 0 0 0,5 1 1,5 2 2,5 3 3,5 4 4,5 Abstand ρ [cm] Abb. 65 Feldverlauf im Taylor-Couette Elektroextraktor (s. Abb. 50-52) bei einer äußeren Spannung U von 25 kV Mit einem weiteren Ansatz nach Schwab ergibt sich die zu lösende Laplace Gleichung für das elektrische Feld im Taylor-Couette Extraktor nach Gleichung 43 [Schwab 1993]. ∆φ = 1 d dφ ρ =0 ρ dρ dρ (43) 84 MODELLIERUNG UND SIMULATION Analog dem obigen Falle für den Plattenkondensator wird auch diese Gleichung für ein Dirichlet’sches Problem mit den Randbedingungen φ (0 ) = U und φ (ρ ) = 0 gelöst und somit die Potentialfunktion φ (ρ ) ermittelt. Der ermittelte Feldverlauf im Taylor-Couette Extraktor ist in Abhängigkeit des radialen Abstandes ρ in Abbildung 65 dargestellt. 6.3 Berechnung der Migration Die Berücksichtigung des Feldeinflusses auf die Stoffübergangskinetik gelingt über die Nernst-Planck’sche Gleichung (Gl. 44), mit welcher sich die migrativ bedingte Grenzflächenpolarisation der ionogenen Stoffübergangskomponenten unter isothermen Bedingungen beschreiben lässt [Bart 2001]. dc i = N i = N iMigration + N iDiffusion + N iKonvektion dt (44) Im Reaktionsplateau lässt sich die Nernst-Planck’sche Gleichung weiter vereinfachen, da diffusive und konvektive Effekte vernachlässigbar sind (s. Gl. 45), dc i dt = − zi F Di c i ∇φ RT (45) mit: c: Konzentration, t: Zeit, z: Ladungszahl, F: Faradaykonstante, R: allgemeine Gaskonstante, T: Temperatur, D: Diffusionskoeffizient, ∇φ Potentialgradient, i: Komponente. 6.4 Berechnung der Elektrodissoziation Die im elektrischen Feld erhöhte Dissoziation lässt sich mathematisch nach einem Ansatz von Onsager berechnen (s. Gl. 46 und 47) [Moore & Hummel1986, Ramirez et al. 1991]: 1 1 KE 2 2 −3 = (8b ) 4 e (8b )2 KD π (46) 85 MODELLIERUNG UND SIMULATION b= e3 8πε 0 ε r kT 2 ∇ϕ (47) mit K E : Dissoziationskonstante im elektrischen Feld, K D : Dissoziationskonstante im feldfreien Zustand, ε 0 : elektrische Feldkonstante, ε r : relative Dielektrizitätskonstante, k: Boltzmannkonstante, e: Elementarladung, ∇ϕ Potentialgradient, T: Temperatur. 6.5 Berechnung des reaktiven Stoffübergangs im elektrischen Feld Mit diesem elektrostatisch erweiterten Kinetikmodell lässt sich die Stoffübergangskinetik im elektrischen Feld in guter Übereinstimmung mit den experimentellen Daten beschreiben (s. Abb. 66 bis 70). Zunächst wird dabei das anliegende Feld über Gleichung 42 berechnet und das Grenzflächenpotential bestimmt. Dann werden im nächsten Schritt die feldinduzierten Vorgänge, wie die Migration über Gleichung 45 und die Elektrodissoziation über die Gleichungen 46 und 47 ermittelt. Die feldinduzierten Konzentrationsänderungen und die Konzentrationspolarisation an der Phasengrenzfläche werden über Gleichung 37 in das Kinetikmodell integriert. Der nach diesem Modell berechnete Stoffübergang von p-Toluolsulfonsäure (PTS) im elektrischen Feld im Rührzellenreaktor ist in Abbildung 66 dargestellt. 0,1 0,09 0 kV, exp. 12,5 kV, exp. 0,08 c PTS, wässrig [mol/l] 25 KV, exp. 0,07 0 kV, Simulation 0,06 12,5 kV, Simulation 25 kV, Simulation 0,05 0,04 0,03 0,02 0,01 0 0 20 40 60 80 100 120 140 160 Zeit [min] Abb. 66 Berechnung des Stoffübergangs von p-Toluolsulfonsäure im elektrischen Feld unter Berücksichtigung der kalkulierten Grenzflächenpotentiale, PTS: 100 mM, TOA: 5 % 86 MODELLIERUNG UND SIMULATION 0,1 0 kV, exp. 12,5 kV, exp. 25 KV, exp. 0 kV, Simulation 12,5 kV, mit 12 500 V simuliert 25 kV, mit 25 000 V simuliert c PTS, wässrig [mol/l] 0,09 0,08 0,07 0,06 0,05 0,04 0,03 0,02 0,01 0 0 20 40 60 80 100 120 140 160 Zeit [min] Abb. 67 Berechnung des Stoffübergangs von p-Toluolsulfonsäure im elektrischen Feld ohne Berücksichtigung der kalkulierten Grenzflächenpotentiale Abbildung 67 verdeutlicht am Beispiel der Extraktion von PTS, warum nicht einfach die äußere Potentialdifferenz in die Nernst-Plank’sche Gleichung eingesetzt werden kann, sondern die explizite Berechnung des in der Messzelle vorliegenden Potentialverlaufs notwendig ist, da sonst der Feldeinfluss überbewertet ist und sich eine viel zu schnelle Extraktionskinetik ergibt. Dies resultiert daher, dass der Spannungsabfall an der Phasengrenzfläche, sowie Wechselwirkungen mit dem jeweiligen Dielektrikum (z. B. Elektrodenisolierung) unberücksichtigt blieben. Die Abbildungen 68 bis 70 zeigen die Ergebnisse der durchgeführten Simulationsrechnungen für die Extraktion von Salzsäure und Schwefelsäure, sowie für die Extraktion von Essigsäure im Mehrkomponentensystem, d. h. für die simultane Extraktion von Essigsäure und Salzsäure im Binärsystem. Bei diesen Berechnungen wurde jeweils der zuvor ermittelte Potentialgradient zwischen Bulk und Phasengrenzfläche berücksichtigt. Die berechneten Konzentrationszeitverläufe stimmen dabei gut mit den experimentell ermittelten Daten überein. 87 MODELLIERUNG UND SIMULATION 0,010 0,009 c HCl, wässrig [mol/l] 0,008 0,007 0,006 0,005 0,004 10 mM HCl, U: 0 kV, exp. 10 mM HCl, U: 0 kV, Simulation 10 mM HCl, U: 20 kV, exp. 10 mM HCl, U: 20 kV, Simulation, EMAS-Berechnung 10 mM HCl, U: 20 kV, Simulation, Plattenkondensatornäherung 0,003 0,002 0,001 0,000 0 20 40 60 80 100 120 140 Zeit [min] Abb. 68 Berechnung des Stoffübergangs von Salzsäure im elektrischen Hochspannungsfeld 0,01 Konz H2SO4, wässrig [mol/l] Simulation bei U: 20 kV 0,01 Schwefelsäure 10 mM, U: 0 KV, experimentell Schwefelsäure 10 mM, U: 20 kV, experimentell Simulation bei U: 0 kV 0,01 0,01 0,00 0,00 0,00 0 10 20 30 40 50 60 Zeit [min] Abb. 69 Berechnung des Stoffübergangs von Schwefelsäure im elektrischen Hochspannungsfeld 88 MODELLIERUNG UND SIMULATION Konz Essigsäure, wässrig [mol/l] 0,25 0,20 0,15 0,10 Essigsäure 200 mM, U: 20 kV, experimentell Essigsäure Mischsystem, U: 20 kV, experimentell 0,05 Simulation, Mischsystem, U: 20 kV Simulation, nur Essigsäure, U: 20 kV 0,00 0 20 40 60 80 100 120 Zeit [min] Abb. 70 Berechnung des Stoffübergangs von Essigsäure im Mehrkomponentensystem (Simultanextraktion von Essigsäure und Salzsäure) im elektrischen Hochspannungsfeld, TOA: 10 % Wie aus den gezeigten Abbildungen 66 bis 70 hervorgeht, bezieht sich die Migration der geladenen Stoffübergangskomponenten dabei auf die Ionenwanderung zwischen Bulk und dem Reaktionsort, der Phasengrenzfläche. Deshalb muss zur Berechnung des rein reaktiven Stoffübergangs im elektrischen Feld der Potentialgradient zwischen Bulk und Phasengrenze in der Nernst-Planck Gleichung berücksichtigt werden. Auch die Verwendung der Laplace Gleichung erweist sich als zulässig, wie in Abbildung 68 gezeigt. Der damit berechnete Stoffübergangsverlauf unterscheidet sich kaum von dem, welcher aus der Finiten Elemente Methode resultiert. Auch die Extraktion mehrwertiger Säuren, sowie die Extraktion im Mehrkomponentensystem unter Feldeinfluss lässt sich über dieses elektrostatisch erweiterte Stoffübergangsmodell gut beschreiben. Auch der Effekt der Elektrodissoziation wirkt sich beschleunigend auf den reaktiven Stoffaustausch schwacher Säuren aus, wie in Abb. 70 deutlich zu erkennen ist. Durch die erhöhte Ionenkonzentration wird das Reaktionsgleichgewicht im Vergleich zum feldfreien Zustand schneller erreicht, wodurch sich auch der abknickende Kurvenverlauf (GG-Wert ist erreicht) erklärt. 89 MODELLIERUNG UND SIMULATION 6.6 Berechnung des Stoffübergangs unter Berücksichtigung der Marangonikonvektion im elektrischen Feld Der rein diffusiv kontrollierte Stoffübergang lässt sich in Abwesenheit von Marangonikonvektionen im stationären Fall über das erste Fick’sche Gesetz und im instationären Fall über das zweite Fick’sche Gesetz beschreiben. Auch sind in der Literatur zahlreiche Korrelationen und je nach Trennproblem vereinfachte Lösungsfunktionen der Transportgleichung zur Berechnung des Stoffübergangs bzw. des Stoffübergangskoeffizienten k bekannt [Crank 1975, Sawistowski & Austin 1967, Mersmann 1986, Saeed & Jamil 1998, Wesselingh & Bollen 1999, Wesselingh & Krishna 2000]. Der molare Stoffstrom N ergibt sich dabei nach Gleichung 48, N = Ak D ∆c (48) wobei kD der Stoffübergangskoeffizient ist, A die Stoffaustauschfläche und ∆c die Konzentrationsdifferenz. Auch der reaktive Stoffübergang lässt sich nach Gleichung 49 über einen aus dem Kinetikgesetz N m (t ) (s. Gl. 37) resultierenden Stoffübergangskoeffizienten kr beschreiben. N = Ak r ∆c = AN m (t ) (49) Ab einer kritischen Konzentrationsdifferenz treten beim Stoffübergang jedoch Grenzflächenkonvektionen auf, welche den Stoffübergang erhöhen. Diese konzentrationsbedingte Stoffaustauscherhöhung lässt sich über ein semiempirisches Stoffübergangsmodell nach Maroudas und Sawistowski korrelieren (Gl. 50 bis 53) [Maroudas & Sawistowski 1964, Wolf 1999]. Der Stoffübergangskoeffizient unter Auftreten von Marangonikonvektionen kM definiert sich dabei nach Gleichung 51. Dieses Modell ist nur für Konzentrationen oberhalb der kritischen Marangonikonzentration anwendbar (cA > ckrit). N = ak M ∆c ( (50) ( k M = k 1 + α ∆σ − ∆σ krit ∆σ = σ c 0 − σ cA )) (51) (52) 90 MODELLIERUNG UND SIMULATION ∆σ krit = σ c 0 − σ krit (53) Die Grenzflächenspannungsdifferenz ∆σ berücksichtigt hierbei den Konzentrationseinfluss auf die Grenzflächenspannung für eine Konzentrationsdifferenz oberhalb der kritischen Marangonikonzentration mit: cA: Konzentration der Stoffübergangskomponente A, c0: A = 0, σ krit berücksichtigt die stoffsystemspezifische, kritische Marangonikonzentration, α ist ein stoffsystemspezifischer Parameter und σ c 0 stellt die Grenzflächenspannung zwischen wässriger und organischer Phase ohne Stoffübergangskomponente dar. Unterhalb der kritischen Marangonikonzentration ist kM = k gemäß Gleichungen 48 und 49, wobei der Stoffübergangskoeffizient k nach dem Ansatz von [Sawistowski & Austin 1967] berechnet wurde (s. Gl. 54). dc dt k= A c* − c V ( ) (54) Dabei sind V: Volumen, A: Grenzfläche, c: Konzentration, c * : Gleichgewichtskonzentration, t: Zeit. Mit diesem Modell lässt sich der stark von Marangonikonvektionen beeinflusste Stoffübergang von Aceton oberhalb der kritischen Marangonikonzentration nach Gleichung 51 in guter Übereinstimmung mit den experimentellen Daten korrelieren (s. Abb. 71). Zudem wird durch ein extern angelegtes elektrisches Feld die kritische Marangonikonzentration herabgesetzt, wie in Tabelle 3 gezeigt werden konnte, so dass dadurch die Grenzflächenturbulenz gesteigert wird und somit ebenfalls eine Stoffaustauscherhöhung stattfindet. Zur Berücksichtigung dieses Feldeinflusses auf die Marangonikonvektion muss das Modell nach Maroudas und Sawistowski um die kritische, durch das elektrische Feld E herabgesetzte Grenzflächenspannung σ krit , welche die Konvektionen verstärkt, nach Gleichung 55 erweitert werden. ( ( E k M = k 1 + α ∆σ − ∆σ krit E E ∆σ krit = σ c 0 − σ krit )) (55) (56) 91 MODELLIERUNG UND SIMULATION E ) ergibt sich somit Gleichung 51. Durch diese Für den feldfreien Raum ( ∆σ krit = ∆σ krit elektrostatische Erweiterung des Modells nach Maroudas und Sawistowski gelingt auch die Korrelation des Stoffübergangs von Aceton im elektrischen Feld in Gegenwart von Marangonikonvektionen (s. Abb. 71) in adäquater Übereinstimmung mit den experimentell Stoffübergangskoeffizient kM [µm/s] erhaltenen Daten. 750 mM Aceton, U: 0 kV, exp. 2000 Modell nach Maroudas und Sawistowski, U:0 kV, Simulation 1500 750 mM Aceton, U: 20 kV, exp. 1000 Elektrostatisch erweiteres Modell nach Maroudas und Sawistowski, U: 20 kV , Simulation 500 0 0 10 20 30 40 50 60 Zeit [min] Abb. 71: Berechnung des Stoffübergangs von Aceton, Stoffaustauschrichtung: wässrig nach organisch in Gegenwart von Marangonikonvektionen im elektrischen Hochspannungsfeld in der Elektrorührzelle, Aceton: 750 mM, α : 5760 [m/N] Somit konnte gezeigt werden, dass der Feldeinfluss auf die Grenzflächenspannung, bzw. auf die kritische Marangonikonzentration den Stoffaustausch signifikant beeinflussen kann. Dies gilt vor allem für den rein physikalischen Stoffaustausch, da im reaktiven Fall die verwendeten Ionenaustauscher starken Tensidcharakter besitzen und die Phasengrenzfläche gegenüber Marangonikonvektionen stabilisieren, weshalb in diesem Falle Marangonikonvektionen nur eine untergeordnete Rolle bezüglich des Stoffübergangsvorganges spielen und somit auch der Feldeinfluss auf eine Marangoni-bedingte Stoffaustauscherhöhung weitaus geringer Natur ist. 92 MODELLIERUNG UND SIMULATION 6.7 Berechnung des Stoffübergangs im Taylor-Couette Extraktor im elektrischen Feld Zur Beschreibung des Stoffübergangs im Taylor-Couette Extraktor existieren verschiedene Modelle für den feldfreien Betrieb. Nach dem Modell von Lo et al. definiert sich der Gesamtstoffübergangskoeffizient K 1 über die aktive Extraktorlänge, z, nach Gleichung 57 zu [Lo et al. 1983]: ν z ,1 dc1 ( z ) = (aV K 1 )[c1 * ( z ) − c1 ( z )]dz, (57) mit: vz,1 als Geschwindigkeit des inneren Fluids , c1 der Konzentration des inneren Fluids, c1* der Konzentration des inneren Fluids im Gleichgewicht mit dem äußeren Fluid (c2), aV der spezifischen volumenbezogenen Stoffaustauschfläche, K1 dem Gesamtstoffübergangskoeffizient. Die spezifische Stoffaustauschfläche a errechnet sich nach Gleichung 58: aV = A , V (58) mit A der Stoffaustauschfläche, V dem Volumen. Bei Annahme einer zylindrischen Grenzfläche ergibt sich a v nach Gleichung 59: aV = 2 Ri , ( R − R12 ) 2 2 (59) mit Ri dem Radius der Grenzfläche, R1 dem Radius des inneren Zylinders, R2 dem Radius des äußeren Zylinders. Zur Bestimmung des Gesamtstoffübergangskoeffizienten K1 leiteten Baier et al. [Baier et al. 2000] aus Gleichung 57 die folgende Beziehung (Gl. 60) ab, indem sie Gleichung 57 integrierten. aV K 1 = V2,1 m (1 − m) ln (1 − f ) , f (1 − ) m (60) mit m als Verteilungskoeffizient, welcher sich aus Gleichung 61 ergibt, und f der Extraktionsausbeute (Extraktion), c1*: Gleichgewichtskonzentration der Stoffübergangskomponente in der inneren Phase, c2*: Gleichgewichtskonzentration der Stoffübergangskomponente in der äußeren Phase. 93 MODELLIERUNG UND SIMULATION c2 * , c1 * m = (61) Die Extraktionsausbeute f (s. Gl. 11) wird experimentell bestimmt. Mit diesem semiempirischem Modell gelingt Baier et al. die Berechnung des Stoffübergangs im Taylor-Couette Extraktor. Ein weiterer Ansatz zur Beschreibung des Stoffaustausches im Taylor-Couette Extraktor ist ein modifiziertes Tank in Serie-Modell nach Zhu [Zhu et al. 2000]. Dieses Modell betrachtet die Extraktion im Taylor-Couette Extraktor als mehrstufigen Prozess und unterteilt den Extraktor in mehrere kontinuierlich betriebene Rührkessel. Die Aufteilung dieser Regionen erfolgt dabei nach den Turbulenzbereichen. So entspricht jeder Taylor-Wirbelbereich einem kontinuierlichen Rührkessel, welcher aufgrund der starken Turbulenzen als optimal durchmischt angenommen wird. Der Stoffaustausch wird dann über eine Massenbilanzrechnung nach den Gleichungen 62 – 64 ermittelt. dcc ,1 dt dcc , j dt dcc , N dt = α = = (cc , 2 − c c ,1 ) + F (cc , j +1 − 2cc , j + cc , j −1 ) + F (cc , N −1 − c c , N ) + Vc α F β (cbot − cc ,1 ) + (ce ,1 − cc ,1 ) Vc Vc F Vc α Vc β F (cc , j −1 − c c , j ) + (ce , j − cc , j ) Vc Vc F β (c c , N −1 − cc , N ) + (ce , N − cc , N ) Vc Vc (62) (63) (64) mit: F: axialer Fluss, cc: Konzentration in jedem Element, ce: Konzentration in der Extraktphase in jedem Element, cbot: Eingangskonzentration am Kolonnenanfang und N: Anzahl der auftretenden Taylor-Wirbel. Die drei system- und geometriebedingten Parameter α : Rückvermischungsparameter, β : volumenbezogene Stoffaustausch- konstante, Vc: Rührkesselvolumen. Mit diesem Modell gelingt Zhu et al. die Simulation des physikalischen Stoffübergangs eines Farbstoffes zwischen einer Kerosinphase und wässrigen Phase in guter Übereinstimmung mit den experimentellen Daten. Alle bisherigen Modelle beschreiben lediglich den Stoffübergang im Taylor-Couette Extraktor im feldfreien Zustand. Außerdem sind die verwendeten Korrelationen und Parameter nicht auf andere Geometrien und 94 MODELLIERUNG UND SIMULATION Funktionsweisen des Extraktors übertragbar. Zur Beschreibung des Stoffübergangs im Taylor-Couette Elektroextraktor ist aber auch die Berücksichtigung des Feldeinflusses notwendig. Ein solches Stoffübergangsmodell wird in Gleichung 65 vorgestellt. dc dt d 2c dc = D 2 + v + dz dz 1 2 o o o n + m + f 3 4 (65) 5 mit: c: Konzentration, t: Zeit, D: Dispersionskoeffizient, z: Ortskoordinate in axialer o o o Richtung, v: Strömungsgeschwindigkeit. n : Stoffübergang, m : Migration und f : Elektrodissoziation. Diese inhomogene, partielle Differenzialgleichung enthält 5 Terme (s. o.), die folgende Einflussgrößen berücksichtigen: Der erste Term berücksichtigt im Taylor-Couette Extraktor auftretenden Turbulenzen. Für den Dispersionskoeffizient D, lässt sich ein modifizierter, effektiver, axialer Dispersionskoeffizient nach einem Ansatz von Mecklenburgh und Hartland [Zhu et al. 2000] nach Gleichung 66 einsetzen, Deff 1 α + F 2 2 L = V N (66) mit: α : Rückvermischungsparameter, F: axialer Fluss, V: Reaktorvolumen, L: Extraktorlänge, N : Anzahl der Taylor-Wirbel. Dieser effektive, axiale Dispersionskoeffizient berücksichtigt den Einfluss der auftretenden Taylor-Wirbel, sowie hydrodynamische Faktoren und Geometriedaten. Im zweiten Term wird die Strömung im Extraktor in Abhängigkeit von der Strömungsgeschwindigkeit berücksichtigt. Der dritte Term beschreibt den eigentlichen Stoffübergang im Extraktor in radialer Richtung, z. B. von der wässrigen in die organische Phase. Dieser Stoffübergangsterm (dritter Term) lässt sich dabei für den rein physikalischen Stoffübergang nach Gleichung 48 und für den reaktiven Stoffübergang nach Gleichung 49 beschreiben. Der vierte Term beinhaltet den Feldeinfluss in Form der Migration, d. h. es wird die Ionenwanderung im angelegten elektrischen Feld nach der Nernst-Planck´schen Gleichung 95 MODELLIERUNG UND SIMULATION beschrieben (Gl. 44). Im 5. Term wird das durch das Feld geänderte Dissoziationsverhalten der jeweiligen Komponente in der wässrigen Phase berücksichtigt. Diese Elektrodissoziation lässt sich nach dem 2. Wien´schen Effekt über einen Ansatz nach Onsager (Gl. 46 und 47) berechnen. Das im Taylor-Couette Extraktor anliegende, elektrische Feld errechnet sich nach Gleichung 43. Für den reaktiven Stoffübergang von p-Toluolsulfonsäure im elektrischen Feld im TaylorCouette Elektroextraktor wurden Simulationsrechnungen unter Berücksichtigung der Strömung (Term 2), der reaktiven Stoffübergangskinetik (Term 3), der Migration (Term 4) und der Elektrodissoziation (Term 5) durchgeführt. Das erhaltene Ergebnis ist in Abbildung 72 dargestellt. 1 0,9 c PTS, wässrig aus normiert [-] 0,8 Wässrig: 0,1M p-Toluolsulfonsäure (PTS) Organisch: 5 % TOA in Toluol (i): 630 rpm, (a): 50 rpm 0,7 0,6 Experimentell, U: 10 kV Strömung, Reaktion, Migration und Elektrodissoziation berücksichtigt 0,5 Simulation, U: 10 kV 0,4 0,3 0,2 0,1 0 0 50 100 150 200 250 300 350 Zeit [min] Abb. 72: Berechnung des Stoffübergangs von PTS im Taylor-Couette Extraktor im elektrischen Feld, PTS: 100 mM, TOA: 5%, Flow: 0 ml/min, beide Zylinder rotierend Die Modellübereinstimmung mit den experimentellen Daten ist allerdings noch nicht ganz zufriedenstellend (s. Abb. 72), da die auftretenden Taylorverwirblungen und Strömungseffekte aufgrund fehlender hydrodynamischer Informationen nicht ausreichend berücksichtigt werden konnten. Jedoch lässt sich aus den durchgeführten Stoffübergangsberechnungen aber deutlich erkennen, dass gerade diese hydrodynamischen Instabilitäten den Stoffaustausch signifikant beeinflussen und den Stoffübergang durch die auftretenden Taylorverwirblungen zusätzlich zum elektrischen Feld stark erhöhen. 96 ZUSAMMENFASSUNG UND AUSBLICK 7 Zusammenfassung und Ausblick 7.1 Abschließende Stellungnahme und Anwendungspotential Es konnte gezeigt werden, dass der Stoffaustausch bei der Füssig-Füssig-Extraktion durch Applikation elektrischer Hochspannungsfelder (DC) gesteigert werden kann. Zur Verfahrensumsetzung der Extraktion im Hochspannungsfeld sind jedoch klassische Extraktionsapparate, welche mit Dispergierung und Tropfenbildung arbeiten ungeeignet, da in diesem Falle die Feldkraft nicht optimal ausgenutzt werden kann. Lediglich in speziellen Extraktionsapparaten, wie dem Taylor-Couette-Elektroextraktor gelingt die Verfahrensumsetzung in kontinuierlicher Betriebsweise (zumindest im Miniplantbereich) kostengünstig (kein Stromfluss) und sicherheitsoptimiert (einfacher Spannungsschutz über Elektrodenisolierung und als Faraday-Käfig fungierendes Metallgerüst). Durch das elektrische Feld kann in speziellen Fällen (z. B. schwache Elektrolyte) das natürliche Gleichgewicht auf die Produktseite hin verschoben werden, auch wird bei der Reaktivextraktion das Gleichgewicht durch das Feld schneller erreicht. Die Feldeffekte sind jedoch konzentrations-, zeit- und stoffsystemabhängig. Auch in Mehrkomponentensystemen kann zwar der Stoffaustausch bezüglich jeder Komponente gesteigert werden, die Selektivität der Trennung allerdings nur signifikant im Anfangszeitintervall. Da diese aber im Gleichgewicht maximal ist, ist somit auch der Feldeinfluss nicht von entscheidender Bedeutung. Auch lässt sich eine beschleunigte Gleichgewichtseinstellung durch höheren Energieeintrag (z. B. erhöhte Rührerdrehzahl) auch in klassischen Extraktionsapparaten erzielen, jedoch ist dies auch mit erhöhten Betriebskosten verbunden. Die Effizienz der Applikation elektrischer Felder im Bereich der Flüssig-FlüssigExtraktion ist also stark vom speziellen Einzelfallproblem abhängig und kann nicht verallgemeinert diskutiert werden. 7.2 Zusammenfassung Externe elektrische Gleichspannungsfelder können sowohl den physikalischen, als auch den reaktiven Stoffaustausch bei der Flüssig-Flüssig Extraktion signifikant beeinflussen, wodurch eine Steigerung des Stoffüberganges im elektrischen Feld erzielt werden kann. Die Gründe hierfür sind im elektrischen Feld gesteigerte Grenzflächenturbulenzen und 97 ZUSAMMENFASSUNG UND AUSBLICK feldinduzierte Konzentrationspolarisationen im Phasengrenzflächenbereich, welche durch Migrationswechselwirkungen verursacht werden. Das elektrische Feld hat bezüglich des reaktiven Stoffübergangs sowohl in Einzel- als auch im Mehrkomponentensystem keinen Einfluss auf das chemische Gleichgewicht. Jedoch wird durch das Feld die Kinetik beschleunigt und das Gleichgewicht schneller erreicht. Auch die maximale Trennselektivität im Mehrkomponentensystem, welche im Gleichgewicht erreicht wird, wird nicht durch das Feld verändert. Diese ist primär von der Konzentration und der Säurestärke abhängig. Lediglich im Falle sehr schwacher Säuren ist das Gleichgewicht über das natürliche hinaus verschiebbar. Diese Stoffaustauscherhöhung ist durch die im elektrischen Feld erhöhte Dissoziation der Übergangskomponente gemäß dem 2. Wien’schen Effekt erklärbar. Zudem ist die feldinduzierte Stoffaustauscherhöhung stark von der Feldwirkrichtung abhängig. Der Feldeinfluss ist dann maximal, wenn das Feld direkt in Stoffübergangsrichtung wirkt. Dies ist bei unbewegten (z. B. planaren) Grenzflächen erreichbar. So konnte in planaren Stoffübergangszellen und am hängenden Tropfen eine starke Stoffaustauschbeschleunigung in der Größenordnung von ca. 1000 % erzielt werden. Am bewegten Tropfen konnte zwar eine Stoffaustauscherhöhung durch die im Feld geänderten hydrodynamischen Betriebsgrößen (wie Tropfengröße und Verweilzeit) erzielt werden, jedoch konnte darüber hinaus keine weitere Stoffaustauschbeschleunigung erzielt werden. Dies kann damit erklärt werden, dass bei bewegter sphärischer Grenzflächengeometrie das Feld nicht nur in Stoffübergangsrichtung wirkt und feldinduzierte Polarisationserscheinungen sich weitgehend kompensieren. Daher gelingt in klassischen Extraktionsapparaten, welche mit Dispergierung und Tropfenbildung arbeiten, die Verfahrensumsetzung der kontinuierlich betriebenen Extraktion im Hochspannungsfeld nicht effizient. Diese gelingt in einem speziellen Zentrifugalextraktor, dem Taylor-Couette Elektroextraktor, in wessen Ringsspalt zwischen zwei als Elektroden fungierenden, konzentrischen Zylindern auf Grund der Rotationsbewegung sich eine planaranaloge, zylindrische Phasengrenzfläche ausbildet und das Feld somit direkt in Stoffübergangsrichtung wirken kann. Auch wird der stationäre Betriebszustand binnen weniger Minuten erreicht. Zudem entstehen im Phasengrenzbereich Taylorverwirblungen, welche ebenfalls den Stoffaustausch erhöhen. 98 ZUSAMMENFASSUNG UND AUSBLICK Zur theoretischen Beschreibung konnten Stoffübergangsmodelle entwickelt werden, welche die feldinduzierten Polarisationseffekte berücksichtigen. So gelingt die Berechnung des reaktiven Stoffaustauschs über ein elektrostatisch erweitertes Kinetikmodell, welches neben der chemischen Reaktion, der Grenzflächenadsorption des Ionenaustauschers und dem Reaktionsgleichgewicht, auch die Migration über die Nernst Planck Gleichung, sowie auch die Elektrodissoziation über einen Ansatz nach Onsager berücksichtigt. Die Berücksichtigung der im elektrischen gesteigerten Grenzflächenturbulenz gelingt über einen elektrostatisch erweiterten Ansatz nach Maroudas und Sawistowski. Auch wurde ein Modell zur Berechnung des Stoffübergangs im Taylor-Couette Extraktors vorgestellt. Die Berechnung der anliegenden elektrischen Felder gelingt über die Finite Elemente Methode basierend auf den Maxwell’schen Gleichungen oder vereinfacht über die Laplace Gleichung. Wesentlich ist, dass nicht die Elektrodenpotentialdifferenz, sondern das berechnete Potential an der Phasengrenzfläche den Stofftransfer im elektrischen Feld bestimmt, was durch die Simulationsrechnungen bestätigt wurde. 99 LITERATURVERZEICHNIS 8 Literaturverzeichnis Agaiev, A. A., Abdullaev, P. C., Kourbalaniev, T. G. (1969), ЭЛЕКТРИЧЕСКИЙ КОНТАКТОР ДЛЯ ЭКСТРАКЦИИ СИСТЕМ ЖИДКОСТЪ – ЖИДКОСТЪ, Izv. VUZ, Neft i Gas, 3, 53-57. Agble, D., Mendis-Tatsis, M. A. (2000a), The effect of surfactants on Marangoni convection in the isobutanol/water system, J. Non-Equilib. Thermodyn., 25, 239-249. Agble, D., Mendis-Tatsis, M. A. (2000b), The effect of surfactants on interfacial mass transfer in binary liquid-liquid systems, International Journal of Heat and Mass Transfer, 43, 1025-1034. Agble, D., Mendis-Tatsis, M. A. (2001), The prediction of Marangoni convection in binary liquid-liquid systems with added surfactants, International Journal of Heat and Mass Transfer, 44, 1439-1449. Andrade, C., Sanjuan, M. A., Recuero, A., Rio, O. (1994), Calculation of chloride diffusivity in concrete from migration experiments in non steady-state conditions, Cement and Concrete Research, 24, (6 & 7), 1214-1228. Anspach, S. (2003), Konstruktion und Inbetriebnahme eines kontinuierlich arbeitenden Taylor-Couette Extraktors zur Flüssig-Flüssig Extraktion im elektrischen Hochspannungsfeld, unveröffentlichte Ergebnisse der AG Bart: Studienarbeit am Lehrstuhl für Thermische Verfahrenstechnik im Fachbereich Maschinenbau und Verfahrenstechnik, Technische Universität Kaiserslautern. Arai, C., Hozumi, K., Sano, Y., Matsuda, H. (1992), Diffusion coefficients of aromatic compounds in water and alcohols, Kagaku Kogaku Ronbunshu, 18 (4), 538-541. Austin, L. J., Banczyk, L., Sawistowski, H. (1971), Effect of electric field on mass transfer across a plane interface, Chem. Eng. Sci. 26, 2120-2121. Baier, G. (1999), Liquid-liquid extraction based on a new flow pattern: two-fluid TaylorCouette flow, Dissertation, University of Wisconsin-Madison, USA. 100 LITERATURVERZEICHNIS Baier, G., Graham, M. D. (1998), Two-fluid Taylor-Couette flow: experiments and linear theory for immiscible liquids between corotating cylinders, Physics of Fluids, 10 (12), 3045-3055. Baier, G., Graham, M. D. (2000), Two-fluid Taylor-Couette flow with countercurrent axial flow: linear theory for immiscible liquids between corotating cylinders, Physics of Fluids, 12 (2), 294-302. Baier, G., Graham, M. D., Lightfoot, E. N. (2000), Mass transfer in a novel two-fluid Taylor vortex extractor, AIChE Journal, 46 (12), 2395-2407. Bailes, P. J. (1981), Solvent extraction in an electrostatic field, Ind. Eng. Chem. Process Des. Dev., 20 (3), 564-570. Bailes, P. J., Larkai, S. K. L. (1981), An experimental investigation into the use of high voltage DC fields for liquid phase separation, Trans. IchemE, 59 (4), 229-237. Bailes, P. J., Stitt, E. H. (1987), Column liquid contacting with vigorous agitation balanced by electrostatic coalescence. Part 1: intensified coalescence – redispersion, Chem. Eng. Res. Des., 65, 514-523. Baird, H. M. I. (1991), Solvent extraction - the challenge of a „mature“ technology, The Can. J. Chem. Eng., 69, 1287-1301. Baker, D. R., Verbrugge, M. W., Newman, J. (1992), A Transformation for the treatment of diffusion and migration. Application to the simulation of electrodeposition onto mircoelectrode geometries, Proccedings of the International Symposium on Electrochemical Microfabrication, October 14-16, Aizona, Electrochemical Society, 92 (3), 279-290. Bart, H.-J. (2001), Reactive extraction, in Springer Series Heat and Mass Transfer, Eds. D. Mewes, F. Mayinger, Springer-VCH, Heidelberg. Bart, H.-J. (2002), Electric fields in solvent extraction, Proc. Int. Solvent Conf., 11.-21. March 2002, Cape Town, South Africa, 45-52. 101 LITERATURVERZEICHNIS Basaran, O. A., Wohlhuter, F. K. (1996), Effect of nonlinear polarization on shapes and stability of pendant and sessile drops in an electric (magnetic) field, J. Fluid Mech., 244, 1-16. Baumann, K.-H., Mühlfriedel, K. (2001a), Mass transfer and concentration profiles near phase boundaries, Int. J. Therm. Sci., 40, 425-436. Baumann, K.-H., Mühlfriedel, K. (2001b), Untersuchung von Grenzflächenvorgängen an Flüssig/Flüssig Phasengrenzen mit laserinduzierter Fluoreszenz, Chemie Ingenieur Technik, 73, 1306-1310. Blankenship, K. D., DePaoli, D. W., Hylton, J. O., Tsouris, C. (1999), Effect of electrode configurations on phase equilibria with applied electric fields, Separation and Purification Technology, 15, 283-294. Blass, E. (1994), Centrifugal extractors, in: Liquid-Liquid Extraction Equipment, Chapter 14, Eds. J. C. Godfrey and M. J. Slater, John Wiley & Sons Ltd, New York, 531-568. Brouche, M., Gosse, J. P., Gosse, B. (1993), High electric field conduction in aromatic hydrocarbons, IEEE Int. Conf. Conduct. Breakdown Dielectr. Liq., 96-100. Brouche, M., Gosse, J. P. (1996), High electric field conduction in aromatic hydrocarbons: effects of the polymerization, Conference Record of the 1996 IEEE International Symposium on Electrical Insulation, Montreal, Quebec, Canada, June 16-19, 724-727. Byers, C. H., Amarnath, A. (1995), Understanding the potential of electro-separations, Chem. Eng. Prog., 2, 63-69. Byers, C. H., Perona, J. J. (1988), Drop formation from an orifice in an electric field, AIChE Journal, 34 (9), 1577-1580. Carleson, T. E., Berg, J. C. (1984), Marangoni and electric field effects upon mass transfer to translating drops, Chem. Eng. Commun., 25, 117-131. Chen, Y.-L., Chou, T.-C. (1993), Proton transport within a perfluorosulfonic acid membrane between aqueous anolyte and organic catholyte, Electrochimica Acta, 38 (15), 2172-2175. 102 LITERATURVERZEICHNIS Chen, L.-H., Lee, Y.-L. (1999), The effects of a surfactant on the mass transfer in spraytower extraction column, Chemical Engineering Journal, 73, 77-81. Christen, H. R. (1988), Grundlagen der Allgemeinen und Anorganischen Chemie, 9. Auflage, Otto Salle Verlag, Frankfurt am Main. Coulson, J. M., Richardson, J. F. (1996), Chemical engineering, Volume 1, 5th Edition, Butterwoth-Heinemann Ltd., Oxford. Cox, M., Flett, D. S. (1979), The significance of surface activity in solvent extraction reagents, Proc. Int. Solvent Extraction Conf., Toronto, Canada, 9.-11. September, 63-72. Crank, J. (1975), The mathematics of diffusion, Clarendon Press, Oxford. Czapla, C. (2000a), Zum Einfluss von Grenzflächenladungen auf den Reaktionsmechanismus organischer Säuren bei der Reaktivextraktion, Shaker Verlag, Aachen. Czapla, C., Bart, H.-J. (2001), Influence of surface potential on interfacial kinetics, Ind. Eng. Chem. Res., 40, 2525-2531. Czapla, C., Bart, H.-J., Jesberger, M. (2000b), Mass transfer and zeta potential in reactive extraction, Sep. Sci. and Technology, 35 (9), 1423-1438. Czarny, O., Serre, E., Bontoux, P. (2003), Interaction between Ekman pumping and the centrifugal instability in Taylor-Couette flow, Physics of Fluids, 15 (2), 467-477. Daikhin, L. I., Kornyshev, A. A., Urbakh, M. (1999), The effect of electric field on capillary waves at the interface of two immisicible electrolytes, Chemical Physics Letters, 309, 137-142. Das, D., Senapati, S., Chandra, A. (1999), Structure of dipolar liquids near charged solid surfaces: a nonlinear theory based on a density functional approach and Monte Carlo simulations, Journal of Chemical Physics, 110 (16), 8129-8138. Dong, J., Tsouris, C. (2001), Phase inversion of liquid-liquid dispersions under applied electric fields, J. Dispersion Science and Technology, 22 (1), 57-69. 103 LITERATURVERZEICHNIS Dörfler, H.-D. (1994), Grenzflächen- und Kolloidchemie, VCH Verlagsgesellschaft mbH, Weinheim. Dukhin , S. S. (1991), Electrokinetic phenomena of the second kind and their applications, Advances in Colloid and Interface Science, 35, 173-196. Dukhin, S. S., Kretzschmar, G., Miller, R. (1995), Dynamics of adsorption at liquid interfaces, in: Studies in Interface Science Series, Vol. 1, Eds. D. Möbius, R. Miller, Elsevier, Amsterdam. Efimov, N. A., Zvonov, V. A., Efimova, L. Y. (1974), The influence of the nature of the applied voltage on the rate of gasoline discharge through a jet, Electrochemistry in Industrial Processing and Biology, 2, 47-49. El Dib, Y. O. (1999), Nonlinear stability of an electrified interface supporting surface charge between two viscous fluids, Journal of Colloid and Interface Science, 210, 103-117. Franzreb, M., Höll, W. H., Sontheimer, H. (1993), Liquid-phase mass transfer in multicomponent ion exchange I. Systems without chemical reactions in the film, Reactive Polymers, 21, 117-133. Gneist, G. (2004), Untersuchung des Einflusses hochfrequenter elektrischer Felder auf die Hydrodynamik und den Stoffaustausch in der Extraktion, Shaker Verlag, Aachen. Gneist, G., Bart, H.-J. (2001), Zielgerichtetes Dispergieren mittels hochfrequenter elektrischer Felder in Flüssig/Flüssig-Systemen, Chemie Ingenieur Technik, 73 (7), 819823. Gneist, G., Bart, H.-J. (2002), Elektrostatische Tropfenbildung in Flüssig-Flüssig Systemen, Chemie Ingenieur Technik, 74 (3), 274-280. Grahn, A. (1997), Instabilities at fluid-fluid interfaces in the presence of chemical reactions, in: Berichte des Forschungszentrums Rossendorf, Dresden, 27-33. Ha, J.-W., Yang, S.-M. (1998), Effects of nonionic surfactant on the deformation and breakup of a drop in an electric field, Journal of Colloid and Interface Science, 206, 195204. 104 LITERATURVERZEICHNIS Hadamard, J. (1911), Mouvement permanente lent d'une sphère liquide et visqueuse dans un liquide visqueux, Comptes Rendus Hebd. Seances Acad. Sci., 152, 1735-1743. Hamann, C. H., Vielstich, W. (1998), Elektrochemie, 3. Auflage, Wiley-VCH, Weinheim. Hampe, M. (1980), Zur Thermodynamik der Transportprozesse in Grenzflächensystemen, Dissertation, Technische Universität München. Hampe, M. J. (1981), Entropieerzeugte Prozesse an Phasengrenzflächen, Ber. Bunsenges. Phys. Chem., 85, 834-842. He, W., Chang, J-S., Baird, M. H. I. (1996), Droplet charge-to-mass ratio measurement in an EHD liquid-liquid extraction system, IEEE Transactions on Industry Applications, 32 (1), 146-154. Hibiki, T., Yamaguchi, M., Katayama, T. (1993), Prediction of breakup length of laminar liquid jets in electric fields, Kagaku Kogaku Ronbun Shu, 19 (6), 963-970. Higgins, D. A., Corn, R. M. (1993), Second harmonic generation studies of adsorption at a liquid-liquid electrochemical interface, J. Phys. Chem., 97, 489-493. Hoogen, M. (2003), Untersuchungen zum reaktiven Stoffübergang organischer Säuren im elektrischen Gleichspannungsfeld, unveröffentlichte Ergebnisse der AG Bart: Studienarbeit am Lehrstuhl für Thermische Verfahrenstechnik im Fachbereich Maschinenbau und Verfahrenstechnik, Technische Universität Kaiserslautern. Howes, T., Rudman, M. (1998), Flow and axial dispersion simulation for travelling axisymmetric taylor vortices, AIChE Journal, 44 (2), 255-261. Hund, M., Lancelot, F. (1986), Interfacial transfer under electrostatic field in solvent extraction, Proc. Int. Solv. Extr. Conf., München, Vol. 1, 511-517. Iwata, M. (1995), Electroosmotic dewatering, in: Electric Field Applications, Ed. T. Tsuda, VCH, Weinheim, 133-151. Iyer, P. V. R., Sawistowski, H. (1974), Effect of electric field on mass transfer across a plane interface, Proc. Int. Solvent Conf. 1974, Lyon, 1029-1046. 105 LITERATURVERZEICHNIS Jesberger, M. (1998), Untersuchungen zur elektrophoretischen Mobilität chemischer Adsorptionschichten an der Phasengrenzfläche zweier flüssiger Phasen, Diplomarbeit, Universität Kaiserslautern. Kamenski, D., I., Dimitrov, S. D. (1993), Parameter estimation in differential equations by application of rational functions, Computers Chem. Eng., 17 (7), 643-651. Kirby, P. E., Steiner, R. F. (1969), The interaction of ground and excited states of indole derivates with electron scavengers, J. Phys. Chem., 73, 4130-4135. Koulova-Nenova, D., Atten, P., Malraison, B. (1995), On the interfacial EHD instability of two superposed liquids, Inst. Phys. Conf. Ser., 143, 279-282. Kowalski, W., Ziolkowski, Z. (1981), Increase in rate of mass transfer in extraction columns by means of an electric field, Int. Chem. Eng., 21 (2), 323-327. Kozolov, V. A., Popkova, I. A., Berezin, B. D. (1981), The solubility of sulphonic acid hydrates in aqueous acid systems, Russian Journal of Physical Chemistry, 55 (6), 827-830. Kuipa, P. K., Hughes, M. A. (1999), Influence of high voltage fields applied across a horizontal liquid-liquid interface on the rate of metal extraction using a rotating diffusion cell, Separation Science and Technology, 34 (13), 2643-2661. Kuipa, P. K., Hughes. M. A. (2002), Behaviour of interfacial tension at an oil-water interface in the presence of an applied electrical field, Proc. Int. Solvent Conf., 17.-21. March 2002, Cape Town, South Africa, 53-57. Kuzmin, M. G., Soboleva, I. V., Kotov, N. A. (1999), Kinetics of photoinduced charge at microsscopic and macroscopic interfaces, Analytical Sciences, 15 (1), 3-16. Lee, Y.-Y., Maa, J.-R., Yang, Y.-M. (1998), The effects of surfactant on the mass transfer in extraction column, Journal of Chemical Engineering of Japan, 31 (3), 340-346. Lo, T. C. (1997), Commercial Liquid-Liquid Extraction Equipment, in: Handbook of Separation Techniques for Chemical Engineers, 3rd Edition, Ed. P. A. Schweitzer, McGraw-Hill, New York, 449-518. 106 LITERATURVERZEICHNIS Lo, T. C., Baird, M. H. I., Hanson, C. (1983), Handbook of Solvent Extraction, J. Wiley & Sons, New York. Lu, Y. C., Luo, G. S., Jiang, W. B., Zhai, S. L. (2000), A study on treatment of butanol containing alphazurine a with electro-extraction, Shuichuli Jishu, 26 (2), 110-113. Luo, G. S., Jiang, W. B., Lu, Y. C., Zhu, S. L., Dai, Y. Y. (1999a), Two-phase electrophoresis separation of dyestuffs from dilute solution, Chemical Engineering Journal, 73, 137-141. Luo, G. S., Yu, M. J., Jiang, W. B., Zhu, S. L., Dai, Y. Y. (1999b), Electroextraction separation of dyestuffs, Separation Science and Technology, 34 (5), 781-791. Lyklema, J. (1999), Elektrische Doppelschichten: Elektrostatik und Elektrodynamik, Chem.-Ing-Tech., 71 (12), 1364-1369. Maekawa, T., Abe, K., Tanasawa, I. (1991), Onset of natural convection under electric fields, ASME/JMSME Thermal Engineering Proceedings, 1, 17-24. Maekawa, T., Abe, K., Tanasawa, I. (1992), Onset of natural convection under electric fields, Int. J. Heat Mass Transfer, 35 (3), 613-621. Maes, N., Moors, H., Canniere, De, P., Aertsens, M., Put, M. (1998), Determination of the diffusion coefficient of ionic species in boom clay by electromigration: feasibility study, Radicim. Acta, 82, 183-189. Mafe, S., Manzanares, J. A., Ramirez, P. (1990), Model for ion transport in bipolar membranes, Physical Review A, 42 (10), 6245-6248. Marangoni, C. (1871), Über die Ausbreitung der Tropfen einer Flüssigkeit auf der Oberfläche einer anderen, Ann. Phys., 143, Leipzig, 337-354. Maroudas, N. G., Sawistowski, H. (1964), Simultaneous transfer of two solutes across liquid-liquid interfaces, Chemical Engineering Science, 19, 919-931. Martin, L., Vignet, P., Fombarlet, C, Lancelot, F. (1983), Electric field contactor for solvent extraction, Sep. Sci. Techn., 18 (14 & 15), 1455-1471. 107 LITERATURVERZEICHNIS Melcher, J. R., Taylor, G. I. (1969), Electrodynamics: a review of the role of interfacial shear stresses, Annu. Rev. Fluid Mech., 1, 111-146. Melroy, O. R., Buck, R. P. (1983), Electrochemical irreversibility of ion transport at liquid/liquid interfaces, J. Electroanal. Chem., 151, 1-9. Mersmann, A. (1986), Stoffübertragung, in: Wärme- und Stoffübertragung, Ed. U. Grigull, Springer Verlag, Berlin. Miksis, M. J. (1981), Shape of a drop in an electric field, Phys. Fluids, 24, 1967-1972. Mohamed, A. E. M. A., El Shehawey, E. S. F., El Dib, Y. O. (1986), Electrohydrodynamic stability of a fluid layer. II. Effect of a normal electric field, J. Chem. Phys., 85 (1), 445455. Mohan, V., Jayasankar, P., Padmanabhan, K. (1986), Interfacial Phenomena of liquidliquid systems under electric, magnetic and gravitational fields, Proc. Int. Solv. Extr. Conf., München, Vol. 1, 507-510. Moore, A. D. (1973): Electrostatics and its applications, John Wiley & Sons, New York. Moore, W. J., Hummel, D. O. (1986), Physikalische Chemie, 4. Auflage, Walter de Gruyter, Berlin. Mörters, M. (2001), Zum Stoffübergang in Tropfen bei der Reaktivextraktion, Shaker Verlag, Aachen. Mörters, M., Bart, H.-J. (1999), Stoffaustausch und Sondentechnik in der Reaktivextraktion, Chem.-Ing.-Techn., 71, 1274-1278. Mörters, M., Bart, H.-J. (2000), Estimation of the multicomponent mass transfer in reactive heavy metal extraction, DECHEMA-Monographie, Vol. 136, Ed. E. Blass, Wiley-VCH, Weinheim, 373-386. Mühlfriedel, K., Baumann, K.-H. (2000a), Untersuchung von Stoffübergangsvorgängen an Flüssig/Flüssig Phasengrenzen mit laserinduzierter Fluoreszenz, Chem.-Ing.-Tech., 72 (9), 965-966. 108 LITERATURVERZEICHNIS Mühlfriedel, K., Baumann, K.-H. (2000b), Concentration measurements during mass transfer across liquid-phase boundaries using planar laser induced fluorescence (PLIF), Experiments in Fluids, 28, 279-281. Nitsch, W. (1989), Reaktionstechnik und Stoffaustauschtechnik in dispersen Zweiphasensystemen, DECHEMA Monographien, 114, 285-302. Nitsch, W., Roth, K. (1978), Adsorptionsschichten als chemische Barrieren für den Stoffübergang zwischen flüssigen Phasen, Colloid & Polymer Sci., 256, 1182-1190. Olander, D. R., Reddy, L. B. (1964), The effect of concentration driving force on liquidliquid mass transfer, Chemical Engineering Science, 19, 67-73. Otillinger, F., Blass, E. (1988), Mass transfer in centrifugal extractors, Chem. Eng. Technol., 11, 312-320. Pertler, M., Häberl, M., Rommel, W., Blass, E. (1995), Mass transfer across liquid-phase boundaries, Chemical Engineering and Processing, 34, 269-277. Polson, A. (1977), Isolation of viruses by electro-extraction of infected plants, Preparative Biochemistry, 7 (3 & 4), 207-215. Proplesch, R. (1994), Elektroextraktion - Stofftransport ionogener Substanzen über Flüssig/flüssig-Phasengrenzen unter dem Einfluss elektrischer Gleichspannungsfelder, VDI Forschungsberichte, Reihe 3: Verfahrenstechnik, Nr. 360, VDI-Verlag, Düsseldorf. Ptasinski, K.J., Kerkhof, P.J.A.M. (1992), Review: electric field driven separations, Sep. Sci. and Technology, 27 (8 & 9), 995-1021. Raharimalala, S., Nakache, E., Cote, G. (1995), Influence of Marangoni effect on liquidliquid extraction of copper(II) by sodium bis(2-ethylhexyl)phosphate, J. Chim. Phys., 92, 1286-1305. Ramirez, P., Manzanares, J. A., Mafe, S. (1991), Water dissociation effects in ion transport through anion exchange membranes with thin cation exchange surface films, Ber. Bunsenges. Phys. Chem., 95 (4), 499-503. 109 LITERATURVERZEICHNIS Reden, von C. (1998), Multicomponent mass transfer in liquid-liquid extraction, Shaker Verlag, Aachen. Riedel, E. (1994), Anorganische Chemie, 3. Auflage, Walter de Gruyter Verlag, Berlin. Roos, M. (2000), Zum Einfluss von Salzen auf die Reaktivextraktion organischer Säuren, Shaker Verlag, Aachen. Rose, P. M., Kintner, R. C. (1966), Mass transfer from large oscillating drops, AIChE J., 12 (3), 530-534. Rybczynski, W. (1911), Über die fortschreitende Bewegung einer flüssigen Kugel in einem zähen flüssigen Medium, Bull. Int. Acad. Sci. Cracovie, 403, 40-46. Saeed, M. T., Jamil, M. (1998), Mass transfer parameters for a reactive system in an extraction column, Part-II: Comparison with model predictions, Bangladesh J. Sci. Ind. Res., 33 (3), 397-403. Sattler, K. (1995), Thermische Trennverfahren, 2. Auflage, VCH, Weinheim. Sawistowski, H. (1973a), Surface-tension-induced interfacial convection and its effect on rates of mass transfer, Chem.-Ing.-Tech., 45 (18), 1093-1098. Sawistowski, H. (1973b), The effect of interfacial behaviour on mass transfer rates: liquidliquid systems, Indian Chemical Engineer, 15 (2), 35-43. Sawistowski, H. (1971), Interfacial phenomena, in: Liquid-Liquid Extraction, Ed. C. Hanson, Pergamon, Oxford, 293-366. Sawistowski, H., Austin, L. J. (1967), Stoffübergang zwischen flüssigen Phasen in einer Rührzelle, Chem.-Ing.-Techn., 39 (5 & 6), 224-231. Schenkel, J. (2000), Untersuchung des Gleichgewichtsverhaltens bei der reaktiven Extraktion von p-Toluolsulfonsäure unter Verwendung von Tri-n-octylamin, Diplomarbeit am Lehrstuhl für Thermische Verfahrenstechnik im Fachbereich Maschinenbau und Verfahrenstechnik, Fachhochschule Kaiserslautern und Universität Kaiserslautern. 110 LITERATURVERZEICHNIS Schmid, G. M., Hurd, R. M., Snavely (Jr.), E. S. (1962), Effects of electrostatic fields on the surface tension of salt solutions, J. Electrochem. Soc., 109, 852-858. Schmidt, J. (1990), Stofftrennung durch Elektroextraktion, Dissertation, Universität Essen. Schmidt, S. A. (2000), Untersuchung der Stoffübergangskinetik von p-Toluolsulfonsäure bei der reaktiven Elektroextraktion, Diplomarbeit am Lehrstuhl für Thermische Verfahrenstechnik im Fachbereich Maschinenbau und Verfahrenstechnik, Universität Kaiserslautern. Schwab, A. J. (1993), Begriffswelt der Feldtheorie, Springer Verlag, Berlin. Schwartz, E., Rock, K., Byeseda, J., Pehler R. (1992), An improved process for MTBE unit feed pretreatment, Proc. Sep. Division Topical Conf. on Sep. Technologies: New Developments and Opportunities, Vol. 1, Am. Ins. Chem. Eng., New York, 236 pp. Schweighofer, K. J., Benjamin, I. (1995), Electric field effects on the structure and dynamics at a liquid/liquid interface, Journal of Electroanalytical Chemistry, 391, 1-10. Schwuger, M. J. (1996), Lehrbuch der Grenzflächenchemie, Georg Thieme Verlag, Stuttgart. Scott, T.C. (1989), Use of electric fields in solvent extraction: a review and prospectus, Sep. Purif. Methods, 18 (1), 65-109. Scott, T. C. (1992), Effects of Low-Amplitude Forced Oszillation on the Rate of Mass Transfer to Circulating Liquid Drops, Ind. Eng. Chem. Res., 31 (12), 2731-2740. Scott, T. C., Basaran, O. A., Byers, C. H. (1990), Characteristics of electric-field-induced oscillations of translating liquid droplets, Ind. Eng. Chem. Res., 29, 901-909. Scott, T. C., Wham, R. M. (1989), An electrically driven multistage countercurrent solvent extraction device, Ind. Eng.-Chem. Res., 28, 94-97. Scriven, L. E., Sternling, L. E. (1960), Interfacial turbulence: hydrodynamic instability and the Marangoni effect, Nature, 187, London, 186-188. 111 LITERATURVERZEICHNIS Shchipunov, Y. A., Kolpakov, A. F. (1991), Phospholipids at the oil/water interface: adsorption and interfacial phenomena in an electric field, Advances in Colloid and Interface Science, 35, 31-138. Skoog, D. A., Leary, J. J. (1996), Instrumentelle Analytik, Springer Verlag, Berlin. Slater, M. J. (1994), Rate coefficients in liquid-liquid extraction systems, in: Liquid-Liquid Extraction Equipment, Chapter 4, Eds. J. C. Godfrey and M. J. Slater, John Wiley & Sons, New York, 45-94. Stern, O. (1924), Zur Theorie der elektrolytischen Doppelschicht, Z. Elektrochem., 30, 508 pp. Stichlmair, J., Proplesch, R. (1993), Stofftrennung durch Elektroextraktion, Chem.-Ing.Tech., 65 (9), 1114-1115. Stichlmair, J., Schmidt, J., Proplesch, R. (1992), Electroextraction: a novel separation technique, Chemical Engineering Science, 47 (12), 3015-3022. Stöcker, H. (1993), Taschenbuch der Physik, Verlag Harri Deutsch, Thun und Frankfurt am Main. Taky, M., Pourcelly, G., Lebon, F., Gavach, C. (1992a), Polarisation phenomena at the interfaces between an electrolyte solution and an ion exchange membrane – Part I – Ion transfer with a cation exchange membrane, J. Electroanal. Chem., 336, 171-194. Taky, M., Pourcelly, G., Lebon, F., Gavach, C. (1992b), Polarisation phenomena at the interfaces between an electrolyte solution and an ion exchange membrane – Part II – Ion transfer with a anion exchange membrane, J. Electroanal. Chem. 336, 195-212. Theos, C. W., Clark, W. M. (1995), Electroextraction – two-phase electrophoresis, Applied Biochemistry and Biotechnology, 54, 143-157. Thornton, J. D. (1968), The applications of electrical energy to chemical and physical rate processes, Rev. Pure Appl. Chem., 18, 197-218. Thornton, J. D., Porter, J. E. (1971), Electrically augmented heat and mass transfer, Symposium on Electrochemical Eng., 3, 3-38. 112 LITERATURVERZEICHNIS Todd, D. B., Hopper, C. A. (1971), Centrifugal extraction of waste dyes, Chemical Engineering Progress, 67 (9), 60-62. Tsuda, T. (1995a), Introduction and summary, in: Electric Field Applications, Ed. T. Tsuda, VCH, Weinheim, 1-9. Tsuda, T. (1995b), Electroosmosis and Electrochromatography, in: Electric Field Applications, Ed. T. Tsuda, VCH, Weinheim, 47-73. Tsuda, T. (1995c), Electrochromatography for focusing, counter-current, mass spectrometry, and two-dimensional separation, in: Electric Field Applications, Ed. T. Tsuda, VCH, Weinheim, 117-129. Tunison, M. E., Chapman, T. W. (1976), The effect of a diffusion potential on the rate of liquid-liquid ion exchange, Ind. Eng. Chem. Fundam., 15 (3), 196-201. Verbrügge, M. W., Hill, R. F. (1990), Ion and solvent transport in ion-exchange membranes, J. Electrochem. Soc., 137 (3), 886-893. Vu, N., Carleson, T. E. (1986), Electric field effects on drop size and terminal velocity in liquid-liquid systems, AIChE Journal, 32 (10), 1739-1742. Waubke, M., Nitsch, W. (1986), Zur Zweiphasenströmung in einer standardisierbaren Rührzelle, Cem.-Ing.-Tech., 58 (3), 216-218. Weatherley, L. R., Campbell, I., Slaughter, J. C., Sutherland, K. M. (1984), Electrically enhanced solvent extraction of biochemicals, in Liquid-Liquid-Extraction, Chapter 25, 341-350. Wesselingh, J. A., Bollen, A. M. (1999), Single particles, bubbles and drops: their velocities and mass transfer coefficients, Trans IchemE., 77, Part A, March, 89-96. Wesselingh, J. A., Krishna, R. (2000), Mass transfer in multicomponent mixtures, Delft University Press, Delft, Holland. Wham, R. M., Byers, C. H. (1987), Mass transport from single droplets in imposed electric fields, Sep. Sci. Technol., 22 (2 & 3), 447-466. 113 LITERATURVERZEICHNIS Wildberger, A., Schmidt, S., Bart, H.-J. (2001), Mass transfer enhancement in reactive extraction by an electric field, Proceedings of the 3rd European Conference of Chemical Engineering (ECCE), P 056, 26.–28. Juni, Nürnberg, 1-6. Wildberger, A., Bart, H.-J. (2002), Influencing the rate of mass transfer in reactive extraction using high voltage, Proc. Int. Solv. Extr. Conf., 17.-21. March 2002, Cape Town, South Africa, 251-256. Wohlhuter, F. K., Basaran, O. A. (1992), Shapes and stability of pendant and sessile dielectric drops in an electric field, J. Fluid Mech., 235, 481-510. Wolf, S. (1999), Phasengrenzkonvektionen beim Stoffübergang in Flüssig-Flüssig Systemen, Fortschritt-Berichte VDI, VDI Verlag, Düsseldorf. Wolf, S., Stichlmair, J. (1998), Interfacial instabilities in liquid-liquid systems, Proc. Int. Symp. Liquid-Liquid Two-Phase Flow and Transport Phenomena, Antalya, Turkey, 3.-7. November, 525-534. Wolff, I. (1997), Maxwellsche Theorie, Springer Verlag, Berlin. Yamaguchi, M., Yoshiyasu, S., Imai, T., Kunimasa, H., Katayama, T. (1992), Hydrodynamic and mass transfer characteristics of a spray column with vertical, parallel plate electrodes, in: Solvent Extraction 1990, Ed. B. T. Sekine, Elsevier Science Publishers, 1375-1380. Yamaguchi, M. (1994), Electrically aided extraction and phase-separation equipment, in: Liquid-Liquid Extraction Equipment, Eds. J. G. Godfrey, M. J. Slater, John Wiley & Sons, New York, 585-624. Yamaguchi, M. (1995a), Application of electric fields to solvent extraction, in: Electric Fields Applications, Ed. T. Tsuda, VCH, Weinheim, 185-203. Yamaguchi, M. (1995b), Application of the electric fields to the resolution of water-in-oil emulsions, in: Electric Fields Applications, Ed. T. Tsuda, VCH, Weinheim, 205-227. Yamaguchi, M., Kanno, M. (1996), Holdup and solvent extraction characteristics in electrostatic liquid-liquid contactor, AIChE Journal, 42 (9), 2683-2686. 114 LITERATURVERZEICHNIS Zhu, X., Campero, R. J., Vigil, D. (2000), Axial mass transport in liquid-liquid TaylorCouette-Poiseuille flow, Chemical Engineering Science, 55, 5079-5087. 115 ANHANG Anhang Anhang A Symbolverzeichnis A1 Verwendete lateinische Formelzeichen und Indizes Symbol Einheit Bezeichnung [A] a a A A1 , A2 , .. A4 , Ai ad, ad. aq, aq. aV A b b b B C c c, ci c* c0 c1 c1 * [mol l-1] [m] [mol m-3] [-] [-] [-] [-] [m-1] [m2] [-] [-] [m] [m] [C V-1] [s] [mol l-1] [mol l-1] [mol l-1] [mol l-1] [mol l-1] c2 * [mol l-1] cbot cc ce [mol l-1] [mol l-1] [mol l-1] co cw c wA c wGG d d d d da di D [mol l-1] [mol l-1] [mol l-1] [mol l-1] [m] [m] [m] [m] [m] [m] [m2 s-1] Konzentration von A spezifische Stoffaustauschfläche Parameter a nach Kamenski und Dimitrov Apparatekonstante Kalibrierungsparameter adsorbiert (an Phasengrenze) aqueous Stoffaustauschfläche per Volumeneinheit Grenzfläche Parameter b nach Kamenski und Dimitrov Parameter b nach Onsager Schichtdicke Breite Kapazität Parameter c nach Kamenski und Dimitrov Konzentration Gleichgewichtskonzentration Startkonzentration (t = 0) Konzentration des inneren Fluids Konzentration des inneren Fluids im Gleichgewicht mit dem äußeren Fluid Konzentration des äußeren Fluids im Gleichgewicht mit dem inneren Fluid Eingangskonzentration am Kolonnenanfang Konzentration in jedem Element Konzentration in der Extraktphase in jedem Element Konzentration in organischer Phase Konzentration in wässriger Phase Ausgangskonzentration in wässriger Phase Gleichgewichtskonzentration in wässriger Phase Plattenabstand Tropfendurchmesser Ringspaltweite Rührkreisdurchmesser des Rührwerkzeugs Kapillaraußendurchmesser Kapillarinnendurchmesser Dispersionskoeffizient I ANHANG i I0 [m2 s-1] [-] [m2 s] [C] [V m-1] [%] [-] [-] [%] [-] [-] [m] [C mol-1] [m3 s-1] [N] [m s-2] [m] [m] [m] [-] [-] [-] IF IL [-] [-] j k k k1 , k 2 , k 3 kD , K D kD kM [-] [J K-1] [m s-1] k1 : [l mol-1 s-1] k 2 : [l mol-1 s-1] k 3 : [l mol-1 s-1] k −1 , k − 2 : [s-1] k −3 : [l mol-1 s-1] [m s-1] K 1 , K 2 : [l mol-1] K 3 : [-] [mol l-1] [m s-1] [m s-1] kr KE K EX , K ex [m s-1] [mol l-1] [l2 mol-2] Deff Di Di e E, E E Ea Er E rel Es f f F F F g h h H i k −1 , k − 2 , k −3 K1 K1 , K 2 , K 3 effektiver, axialer Dispersionskoeffizient Verteilungskoeffizient Diffusionskoeffizient Elementarladung elektrische Feldstärke Extraktion absoluter Fehler statistischer Fehler relativer Fehler systematischer Fehler Extraktionsausbeute Brennweite Faradaykonstante axialer Fluss Kraft Erdbeschleunigung Fallstrecke Höhe des Messorts Höhe Komponente i Laufzahl Intensität des Laserlichtes am Eintritt in das Zellvolumen Fluoreszenzintensität Intensität des Laserlichtes am Eintritt des Messvolumens Laufzahl Boltzmann-Konstante Stoffübergangskoeffizient Kinetikparameter der Hinreaktion Kinetikparamter der Rückreaktion Gesamtstoffübergangskoeffizient Gleichgewichtskonstanten der Teilreaktionen Dissoziationskonstante Stoffübergangskoeffizient Stoffübergangskoeffizient unter Auftreten von Marangonikonvektionen reaktiver Stoffübergangskoeffizient Dissoziationskonstante im elektrischen Feld Gleichgewichtskonstante der Gesamtreaktion II ANHANG KS L m mi n n1 [mol2 l-2] [m] [-] [mol kg-1] [s-1] [-] n2 [-] N N N N (t ) , N m (t ) , N i Ni N0 p, P0 Q qi r r R R , R (t ) R2 R0 R1 , R2 R1 , R2 , R3 ra , R2 ri , R1 Ri Reo Rew t T T U v v z ,1 V V Vc w WA w-% x [-] [-] [mol s-1] [mol m-2 s-1] [mol m-3 s-1] [mol m-2 s-1] [N m-2] [C] [N V-1] [m] [m] [J mol-1 K-1] [mol m-3 s-1] [-] [mol m-3 s-1] [m] [mol m-3 s-1] [m] [m] [m] [-] [-] [s] [K] [m] [V] [m s-1] [m s-1] [m3] [m3] [m3] [-] [J] [-] [-] Aciditätskonstante Extraktorlänge Verteilungskoeffizient Molalität Rührerdrehzahl Brechnungsindex des optisch dichteren Mediums Brechnungsindex des optisch dünneren Mediums Anzahl der auftretenden Taylorwirbel Laufzahl molarer Stoffstrom molarer Fluss Stoffstrom anfänglicher molarer Fluss (t = 0) Druck Probenladung Ladungsdichte Abstand Ortsvariable molare Gaskonstante Stoffstrom Bestimmtheitsmaß Anfangsstoffstrom (t = 0) Hauptkrümmungsradien Teilstoffströme Radius des Außenzylinders Radius des Innenzylinders Radius der Grenzflächenposition Reynoldszahl in organischer Phase Reynoldszahl in wässriger Phase Zeit Temperatur Tiefe elektrische Spannung Geschwindigkeit Geschwindigkeit des inneres Fluids Phasenvolumen Reaktorvolumen Rührkesselvolumen wässrig elektrische Arbeit Gewichtsprozent Mittelwert III ANHANG [-] [nm] [-] [nm] [-] [m] [-] [m] [-] x x xt x0 y z z z zi A2 Ortskoordinate elektrische Doppelschicht definierter Wert Position der Phasengrenzfläche Ortskoordinate Tropfenhöhe Ortskoordinate Extraktorlänge Ladungszahl Verwendete griechische Formelzeichen und Indizes Symbol Einheit Bezeichnung α α α α α αm β γ γm ε ε ε0 εr Γ λ λF λL µ µi ν π ρ ρ σ ∆σ σ c0 [-] [-] [-] [m N-1] [-] [-] [m3 s-1] [N m-1] [mol l-1] [-] [As V-1 m-1] [A2 s2 N-1 m-2] [-] [mol m-2] [nm] [nm] [nm] [D] [J] [m2 s-1] [-] [kg m-3] [m] [N m-1] [N m-1] [N m-1] σ cA [N m-1] σE [N m-1] Reflexionswinkel Verstärkungsfaktor Dissoziationsgrad stoffsystemspezifischer Parameter Rückvermischungsparameter Adsorptionskonstante volumenbezogene Stoffaustauschkonstante Grenzflächenspannung Adsorptionskonstante molarer Absorptionskoeffizient Dielektrizitätskonstante elektrische Feldkonstante relative Dielektrizitätskonstante Grenzflächenbelegung Wellenlänge Wellenlänge des Fluoreszenzlichtes Wellenlänge des Laserlichtes Dipolmoment chemisches Potential kinematische Viskosität Kreiszahl Dichte radialer Abstand Grenzflächenspannung Grenzflächenspannungsdifferenz Grenzflächenspannung zwischen den reinen Lösungsmitteln gegenüber σ c 0 durch die Komponente A geänderte Grenzflächenspannung effektive Grenzflächenspannung IV ANHANG σ krit [N m-1] E σ krit [N m-1] φ ϕ ϕA [-] [V] [V] [rad s-1] [rad s-1] Ω1 Ω2 A3 kritische Grenzflächenspannung, ab welcher Marangonikonvektionen ausgelöst werden Durch das elektrische Feld gegenüber σ krit herabgesetze, kritische Grenzflächenspannung, ab welcher im elektrischen Feld Marangonikonvektionen ausgelöst werden Quantenausbeute elektrisches Potential elektrisches Potential des Punktes A Drehgeschwindigkeit des Innenzylinders Drehgeschwindigkeit des Außenzylinders Verwendete Abkürzungen und chemische Formelzeichen Symbol Bezeichnung A A A A AAII2− AAS Abb. Abt. ACAC AD Ag AG AgCl AgNO3 ARD BaCl2 BaSO4 C3v C CAD CCl4 CCD CFD CH3 CH3CH2 Cit3C/L Überstrich symbolisiert den Aufenthalt von A in organischer Phase Variable Komponente Stoffübergangskomponente Säureanion zweite Dissoziationsstufe einer zweiwertigen Säure Atomabsorptionsspektroskopie Abbildung Abteilung Acetation Wechselspannung/Wechselstrom Außendurchmesser Silber Arbeitsgemeinschaft Silberchlorid Silbernitrat asymmetric rotating disc contactor Bariumchlorid Bariumsulfat Punktgruppensymbol Kapazität/Kondensator im Schaltplan computer aided design Tetrachlorkohlenstoff charge coupled devices computational fluid dynamics Methylgruppe Ethylgruppe Citration Drehachse V ANHANG Cu2+ D2EHPA DC DFG DIN DTAB DTACl E. EFCE EMAS EMV ERZ exp. FID FIDAP FLUENT GC Gl Gl. GG, G. G. H2AII H2O H2OPPA H2SO4 H2CitH3Cit H H+ HA HAII− HAc HCit2HCl, HCL HETP HETS HPLC HPLC-UV I+ ID IDD IT K+ K. Konz, Konz. Kupfer(II)kation Di-ethylhexyl-phosphorsäurediester Gleichspannung/Gleichstrom Deutsche Forschungsgemeinschaft Deutsche Industrie Norm Dodecyltrimethylammoniumbromid Dodecyltrimethylammoniumchlorid Extraktor The European Federation of Chemical Engineers Computerprogramm (Feldberechnungen) elektromagnetische Verträglichkeit Elektrorührzelle experimentell Flammenionisationsdetektor Computerprogramm (Berechnungen zur Fluiddynamik) Computerprogramm (Berechnungen zur Fluiddynamik) Gaschromatographie Gleichrichter Gleichung Gleichgewicht zweiwertige Säure Wasser Octylpyrophosphorsäure Schwefelsäure Dihydrogencitrat Citronensäure Wasserstoff Wasserstoffion Säure erste Dissoziationsstufe einer zweiwertigen Säure Essigsäure Monohydrogencitrat Salzsäure height equivalent to one theoretical plate height equivalent to one theoretical state high performance liquid chromatography HPLC-Analytik mit UV-spektroskopischer Detektion Iodidion Innendurchmesser Isododecan Ionenaustauscher Kaliumion Kolonne Konzentration VI ANHANG krit. LDS LED LIF LM LSODI m M Me+ MPI n+ n N N Na+ NaDdS NaLS org. O p. A. PAT 1 PDS PG pH PTFE PTS R3N R3NHX (R1 )3 NHR2 SO3 R R2 , R4 R5 Ri RDC rpm S0 S1 , S 2 , S i SO3− SPP-1105 SRA SÜ Tab. TBP kritisch mit Bezug auf Schwellenwert Dodecyltrimethylammoniumbromid light emitting diode (Leuchtidiode im Schaltplan) Laser induzierte Fluoreszenz Lösungsmittel Computerprogramm (Lösung von Gleichungssystemen) Stöchiometriefaktor molar Metallkation Max Planck Institut Ladungszahl Stöchiometriefaktor normal Stickstoffatom Natriumion Natriumdodecylsulfat Natriumdodecansulfonat organisch Sauerstoffatom pro analysi, (Analysenqualität der verwendeten Chemikalien) Computerprogramm (Berechnung von Grenzflächenspannungen) Pyrazindicarbonsäure Phasengrenzfläche pH-Wert Polytetrafluorethylen p-Toluolsulfonsäure tertiäres Amin Ammoniumkomplex Ammoniumsulfonatkomplex Widerstand im Schaltplan Potentiometer im Schaltplan Shunt zur Messung der Stromstärke Restgruppe rotating disc contactor revolutions per minute Singulett des Fluorphors im Grundzustand Singulett des Fluorphors in einem angeregten Zustand Sulfonation DFG Schwerpunktprogramm: Nichtgleichgewichtsprozesse in Flüssig-flüssig-Systemen Sulforhodamin Stoffübergang Tabelle Tributylphosphat VII ANHANG TMV TOA TOAH+ TOAHA TOAHCl TOL TX 100 TYMV UV Xx X V Vol Zn2+ A4 Verwendete dimensionslose Kennzahlen Symbol Re A5 tobacco mosaic virus Trioctylamin protonierte Form des Trioctylamins Säure-Base-Komplex (aus Triocytlamin und Säure) Trioctylammoniumchlorid Toluol Triton X-100 turnip yellow mosaic virus Ultraviolett Säureanion Aggregationszahl Säurerest Voltmeter Volumen Zink(II)kation Berechnung d 2π n Re = ν Bezeichnung Berechnung der Reynoldszahl für den Rührzellenextraktor (s. Abb. 14) Verwendete Zahlensymbole Symbol Bezeichnung n Nano, Wert: 10-9 Mikro, Wert: 10-6 Milli, Wert: 10-3 Zenti, Wert: 10-2 Quadrat, Wert: 102 (z. B. qm) Kilo, Wert: 103 Giga, Wert: 109 Milliarde, Wert: 109 Peta, Wert: 1015 µ m c q k G Mrd. P VIII ANHANG Anhang B Stoffsysteme und Analytik B1 Verwendete Chemikalien Chemikalie Bezugsquelle/Hersteller Qualität Aceton Acetonitril Acetylen 2,6 Bariumchlorid Citronensäure Di-2-ethylhexylphosphorsäurediester Ethanol Essigsäure Isododecan Kaliumphosphat Phosphorsäure pH-Pufferlösungen p-Toluolsulfonsäure Pyrazindicarbonsäure Salpetersäure Salzsäure Silbernitrat Schwefelsäure Sulforhodamin Toluol Trioctylamin p-Xylol Trioctylammonuimchlorid Wasser Zinkchlorid Merck Sigma BASF Merck Merck Bayer p. A. HPLC-Qualität technische Qualität p. A. p. A. technische Qualität B2 Sigma für die Spektroskopie Merck p. A. Gefachem-ProChemie p. A. Merck HPLC-Qualität Aldrich HPLC-Qualität Titrisol®, Merck p. A. Fluka p. A. Merck p. A. Fluka für die Spektroskopie Fixanal® , Riedel-de Haën p. A. Merck p. A. ® Fixanal , Riedel-de Haën p. A. mobitec p. A. Merck p. A. Fluka p. A. Merck p. A. selbst hergestellt aus Trioctylamin und Salzsäure destilliert und zusätzlich über Ionenaustauscher gereinigt Merck p. A. Chemische Struktur von Sulforhodamin Abb. A1 Chemische Struktur des Fluorophors Sulforhodamin G (S-6957) IX ANHANG B3 Reinigung Sämtliche verwendeten Aufbewahrungs- und Reaktionsgefäße (Qualilabflaschen, Erlenmeyerkolben, ect.), sowie alle verwendeten Messinstrumente (Zylinder, Kolben, Pipetten, ect.) wurden mit einer Reaktionsmischung aus Isopropanol und Kaliumhydroxid gereinigt und mit destilliertem Wasser nachgespült und im Trockenschrank bei T = 60 °C getrocknet. Sämtliche Versuchsanlagen (Elektrorührzelle, Taylor-Couette Extraktor, ect.) wurden mit Ethanol, Aceton und Wasser gespült. Küvetten, welche für spektroskopische Untersuchungen verwendet wurden, wurden mit Wasser und Ethanol gereinigt. Die Konditionierung und Reinigung der HPLC-Trennsäulen erfolgte mit Wasser, Methanol, Acetonitril und Ethanol. B4 Verwendete Analytikmethoden und Analysengeräte Tabelle A1: Übersicht zur verwendeten Analytik analysierter Stoff Verfahren Analysengerät und Hersteller Spezifikationen Aceton (aq.) HLPC-UV Shimadzu Aceton (org.) GC-FID HP 6890 Citronensäure (aq.) HPLC-UV Shimadzu Essigsäure (aq.) HPLC-UV Shimadzu HPLC-Pumpe: LC-10A, Trennsäule: RP-18e: L: 10 cm (Merck), UVDetektor: SPD-M10 AVP, Eluent: Wasser / Acetonitril (70/30), Flow: 1,5 ml/min, p: 93 bar, Probeschleife: 20 µl, Detektion bei λ = 264 nm GC-Säule: HP 5 (Hewlett Packard), L: 30 m, Filmdicke: 0,25 µm, Probeninjektion über Autosampler, Operationsmodus: split: 1:15, Trägergas: Argon, Temperatur: zeitlich gesteuert, Detektion: FID (Flammenionisationsdetektor) HPLC-Pumpe: LC-10A, Trennsäule: Supelcogel H: L: 25 cm (Supelco), UV-Detektor: SPD-M10 AVP, Eluent: 0,1 %ige Phosphorsäure, Flow: 0,1 ml/min, p: 21 bar, Probeschleife: 25 µl, Detektion bei λ = 229 nm analog der Citronensäure, nur Detektion bei λ = 208 nm X ANHANG analysierter Stoff Verfahren Analysengerät und Hersteller Spezifikationen Pyrazindicarbonsäure (aq.) Salzsäure (aq.) HPLC-UV Shimadzu Fällungstitration Mettler DL 25 analog Aceton, nur Detektion bei λ = 346 nm Fällung mit AgNO3, als AgCl aus schwefelsaurer Lösung, Ag/AgClElektrode: Schott, potentiometrische Indikation des Endpunktes pH-Elektrode: Mettler Toledo, DG 111-SC Elektrode: DG 111-SC, potentiometrische Indikation des Endpunktes Säure, allgemein (aq.) Säure, allgemein, (aq. und org.) Schwefelsäure (aq.) pH-WertWTW 526 messung Neuralisations- Mettler DL 25 titration Leitfähigkeit Fällungstitration Sulforhodamin UV(aq.) Spektroskopie p-Toluolsulfon- UVsäure (aq.) Spektroskopie HPLC-UV Shimadzu, SPD-M10 AVP Shimadzu, SPD-M10 AVP Shimadzu Zink (aq.) Hitachi Z 8100 B5 AAS WTW Mettler DL 25 Typ: inoLab® Cond Level 2 Fällung mit BaCl2, als BaSO4 aus salzsaurer Lösung Bestimmung aus wässriger Lösung, bei λ = 550 nm Online-Bestimmung aus wässriger Lösung, bei λ = 276 nm (s. Abb. 14) analog Aceton, nur Detektion bei λ = 276 nm Flammenionisationsspektrometer, Bestimmung von Zn2+ über eine Zinkhohlkathodenlampe der Firma Schott aus salpetersaurer Lösung Kalibrierung und analytische Determination Die Kalibrierung der jeweiligen Analysegeräte erfolgt über die Vermessung von Standardlösungen mit definierter Konzentration. Die erhaltenen Messwerte werden dann über eine Regressionsfunktion korreliert. Aus der resultierenden Kalibrierungsfunktion kann dann die unbekannte Konzentration einer Probe innerhalb des Bestimmungs- und Kalibrationsbereiches ermittelt werden. Am Beispiel der p-Toluolsulfonsäure ist eine solche Kalibrierfunktion für die UV-Online Detektion dargestellt (s. Abb. A2), die aufgrund des zugrunde liegenden Analysenprinzips, dem Lambert Beer’schen Gesetz linearen Charakter aufweist [Skoog & Leary 1996]. Wie aus Abb. A2 hervorgeht, lässt sich der Sulfonsäuregehalt mittels dieses Analyseverfahrens über einen weiten Konzentrationsbereich hinweg sehr gut determinieren. XI ANHANG Abb. A2 Kalibrierkurve zur Bestimmung der p-Toluolsulfonsäurekonzentration bei λ = 276 nm, Bestimmung aus wässriger Lösung B6 Fehlerbetrachtung Systematische Fehler lassen sich in der Regel auf ein zu vernachlässigendes Minimum reduzieren. Statistische Fehler, wie zum Beispiel verschiedene Messwerte beim Vermessen von ein und derselben Probe (Präzision) lassen sich aber leider nicht vermeiden. Diese Fehler können errechnet werden, um dann im Rahmen dieser Messfehlergrenzen arbeiten und diskutieren zu können. Der absolute Fehler Ea ergibt sich nach Gleichung (A1) zu: Ea = Er + Es (A1), wobei Er den statistischen Fehler und Es den systematischen Fehler angibt. Der absolute Fehler beschreibt die Messgenauigkeit. In der Praxis hat es sich nun eingebürgert als Maß für die Messgenauigkeit nicht den absoluten Fehler, sondern den relativen Fehler Erel anzugeben, welcher über Gleichung (A2) mit dem absoluten Fehler verknüpft ist [Skoog & Leary 1996]: XII ANHANG E rel = ( ) Ea x − xt ⋅ 100 = ⋅ 100 xt xt (A2), mit dem Mittelwert x und xt einem akzeptierten Wert (analysiert oder Sollwert) der zu bestimmenden Größe. Setzt man nun für xt denjenigen Wert ein, welcher von seiner Differenz her am stärksten vom Mittelwert abweicht, erhält man den maximalen Fehler für die Messgenauigkeit. Tabelle A2 gibt eine Übersicht über alle sowohl bei der Probenpräparation, als auch bei der Messung auftretenden Fehler. Der Mittelwert x errechnet sich dabei aus Gleichung (A3) mit einem Wert für N = 50 wie folgt: N x= Σ xi i=1 (A3), N wobei x die experimentell bestimmte Größe darstellt. Tabelle A2 stellt die nach Gleichung A2 errechneten experimentellen Fehler dar. Tabelle A2: Fehlerübersichtstabelle Gerät / Verfahren Maximaler Fehler [%] a) Probenpräparation Waagen 0,004 Mikropipetten 0,2 Messkolben 0,4 Vollpipetten 0,5 Messzylinder 1,0 b) Analytik GC-FID 0,7 HPLC-UV 0,9 Potentiometrische Titration 1,9 Atomabsorptionsspektroskopie 2,1 Leitfähigkeit 3,8 pH-Wertbestimmung 4,5 XIII ANHANG B7 Versuchsdurchführung der Gleichgewichtsexperimente Die Gleichgewichtsversuche wurden in geschlossenen Qualilabflaschen (Merck, Größe: 100 ml) durchgeführt. Das Phasenverhältnis zwischen organischer und wässriger Phase betrug 1:1, das Phasenvolumen jeweils 40 ml. Die Reaktionsproben wurden in einem temperierbaren Schüttelwasserbad (Julabo SW21) bei 25 °C turbulent durchmischt (200 rpm), bis sich das Reaktionsgleichgewicht eingestellt hat (Mindestreaktionszeit: 24 h). Die Probenentnahme erfolgte aus der wässrigen Phase. Die Zusammensetzung der organischen Phase wurde über Massendifferenzrechnung ermittelt. Zuvor konnte gezeigt werden, dass die direkte Analyse aus organischer Phase und die Massendifferenzmethode innerhalb des experimentellen Fehlers übereinstimmten. Die Gleichgewichtsuntersuchungen im elektrischen Feld wurden in einer modifizierten Versuchsapparatur durchgeführt (s. Abb. A3). An die Glasapparatur wurden in jeweils gleichem Abstand zur Grenzfläche (1 cm) teflonisolierte Stabelektroden (Gesamtaußendurchmesser: 8 mm, Dicke der Isolierung: 1 mm, Länge: 7 cm) adaptiert. Das elektrische Hochspannungsfeld (DC) wurde dabei orthogonal zur Phasengrenzfläche angelegt. Die obere Elektrode (in organischer Phase) ist positiv geladen, während die untere (in wässriger Phase) geerdet ist. Von den jeweils gleichen, aus dem Schüttelwasserbad entnommenen Probepaaren, wurde ein Reaktionsgefäß für die Dauer von 30 Minuten dem Einfluss des elektrischen Gleichspannungsfeldes ausgesetzt, die andere Probe diente bei sonst gleichen Bedingungen als Referenz im feldfreien Raum. Abb. A3 Versuchsaufbau zur Messung im Hochspannungsfeld XIV ANHANG B8 Durchführung der Rührzellenversuche Die Funktionsweise und Bedingung der in Abb. 14 dargestellten Elektrorührzelle ist analog dem klassischen, für den feldfreien Zustand konzipierten Rührzellenextraktor, wie er in Abb. A4 dargestellt und im Folgenden beschrieben ist. 1 6 5 4 P 8 M 12 3 7 9 14 17 T 16 18 15 11 13 10 M 2 Abb. A4 Schematische Darstellung der Versuchsapparatur 1 2 Entlüftung Online-Detektion 10 11 3 4 Thermostat mit Temperaturregulierung Pumpe 12 13 5 6 7 8 9 Vorratsbehälter der organischen Phase Vorratsbehälter der wässrigen Phase Absperrarmatur wässriger Bereich Absperrarmatur organischer Bereich Absperrarmatur organische Phase - Zelle 14 15 16 17 18 Absperrarmatur wässrige Phase - Zelle Entleerungsarmatur bzw. Rücklauf aus Online-Analytik Probenentnahme organisch Probenentnahme wässrig bzw. Abfluss zum Online-Detektionssystem Befüllrohr organische Phase Verbindung Thermostat-Rührzelle Doppelmantel zur Temperierung Strömungsleitrohr Strömungsleitblech Über Kupplungen (Kardangelenke) sind die Rührer der Zelle mit den Antriebsmotoren M der Firma Heidolph (RZR 2051), die sich mittels Drehzahlregler stufenlos zwischen 401980 min-1 in zwei Übersetzungen und einer Genauigkeit von ± 1 min-1 regeln lassen, verbunden. Die Rührzelle besteht aus einem Doppelmantel (16), der an einen Thermostaten (3) der Firma Lauda angeschlossen ist. Die Strömungen beider Phasen XV ANHANG werden durch Strömungsleitrohre und Strömungsleitbleche (17, 18) geführt, wobei sie jeweils im Bereich der Mittelachse von der Phasengrenze wegen der Rotation der Rührer abgesogen werden. Sie fließen über die Deckelwölbung in den äußeren Ringspalt zwischen Zellenwand und Strömungsleitrohr, und strömen an der Phasengrenze angelangt von außen radial nach innen, bis sie wieder in den Absaugstrom gelangen. Die Rührzelle hat ein Gesamtvolumen von 796 ml (Phasenvolumen: 398 ml) und eine Querschnittsfläche von 44.18 cm². Die wässrige Phase wird aus dem Vorratsbehälter (6) über eine Leitung, die zwei Absperrarmaturen beinhaltet, in die Rührzelle gefüllt. Für die organische Phase (5) existiert der gleiche Zuleitungsaufbau, der von dem wässrigen getrennt ist. Nach Befüllung des Extraktors werden die Rührwerke gestartet, wobei darauf geachtet werden muss, dass in beiden Phasen gleiche Strömungsverhältnisse (Rew = Reo) vorliegen. Bei den Versuchen in der Elektrorührzelle (s. Abb. 14) wird umgehend nach Start der Rührwerke das elektrische Feld angelegt und mittels eines Drehpotentiometers auf die gewünschte Potentialdifferenz geregelt. Die Stoffübergangsrichtung war bei allen Versuchen von wässriger nach organischer Phase. Die Probenentnahme kann sowohl stationär sowohl aus wässriger, als auch aus organischer Phase über eine Probenentnahmestation (13) erfolgen, oder die Konzentration aus wässriger Phase direkt online (2) bestimmt werden. Nach Versuchsende werden beide Phasen getrennt voneinander über den Absperrhahn (11) in die dafür vorgesehenen Abfallbehälter entleert und fachgerecht entsorgt. B9 Ergänzung zu den Schlierenoptikversuchen Schlierenexperimente wurden für wässrige hängende Tropfen in den Systemen Wasser/Aceton//Toluol und Wasser/PTS//TOA/Toluol durchgeführt. Die sich zeitlich ändernde Grenzflächenkonvektion wurde für den feldfreien Fall, sowie bei angelegter Gleichspannung aufgenommen. Die wässrige Phase wurde dabei über einen Dosimaten durch eine als Elektrode fungierenden Kapillare geleitet, wobei nach Ausbildung des Tropfens die Zudosierung gestoppt wurde und die Untersuchung somit am hängenden Tropfen durchgeführt werden konnte. Für die Experimente im elektrischen Feld wird zwischen der Kapillarelektrode und der geerdeten Ringelektrode im Abstand von 4 cm eine XVI ANHANG Gleichspannung angelegt. Die im Zuge dieser Untersuchungen verwendete Kapillare ist in Tabelle A3 dargestellt. Tabelle A3: Verwendetes Kapillarsystem Skizze Abmessungen Bemerkungen Edelstahlkapillare: ID = 0,1 mm, 0,25 mm AD = 1,59 mm Edelstahlkapillare und Glaskapillare wurden klebend verbunden; für die schlierenoptischen Messungen wurde die Kapillare mit dem Innendurchmesser von 0,25 mm verwendet. Glaskapillare: ID = 1,6 mm AD = 7,0 mm Die verwendete Versuchsapparatur ist bereits in Abb. 36 dargestellt. Das zugrunde liegende optische Messprinzip wird im folgenden genauer erläutert. Das Licht einer Nanoblitzlampe (1) wird über eine Bi-Konvexlinse (2), mit einer Brennweite von f = 200 mm, auf den Schlierenspalt (3) abgebildet. Der Spalt besteht aus zwei beweglichen scharfen Kanten und ermöglicht die Einstellung der Spaltbreite. Das vom Spalt ausgehende Licht wird über eine Plan-Konvexlinse (4), mit einer Brennweite von f = 250 mm, in ein paralleles Lichtbündel aufgeweitet. Das parallele Lichtbündel durchläuft die Messzelle (5) und fällt auf einen Achromat (6), mit einer Brennweite von f = 310 mm. Der Achromat entwirft ein reelles Bild des Schlierenspalts in seinem Brennpunkt, das von der scharfen Kante der Schlierenblende (7) mehr oder weniger vollständig aufgefangen wird. Das Schlierenbild wird anschließend von der CCD-Kamera (8) aufgenommen und in digitalisierter Form erhalten. B10 Ergänzungen zu den Einzeltropfenexperimenten Für die Tropfensäulenexperimente wurde die in Abb. 41 dargestellte Apparatur eingesetzt. Sie besteht aus einem DN 50 Glasschuss (1) mit einer Gesamtlänge von 1 m mit integrierten parallelen Plattenelektroden mit einer Breite von 2 cm und einem Abstand von 3 cm. Die Elektroden sind mit einer dünnen Teflonschicht überzogen, um die Benetzung zu unterdrücken. Der fallende wässrige Tropfen kann so möglichst lange dem elektrischen Feld ausgesetzt werden. Eine der Plattenelektroden liegt auf Hochspannungspotential (2), XVII ANHANG die andere wird zusammen mit der Edelstahlkapillare geerdet (3). Die Hochspannung (Gleichspannung) wird wieder mittels eines Generators (4) erzeugt. Die disperse, wässrige Phase (5) wird wie zuvor mittels Dosimat (6) der Kapillarelektrode zugeführt. Nach Durchlaufen der Fallstrecke h werden die Tropfen in einem Trichter (7) aufgefangen und können von dort tropfenweise mittels einer Spritze abgezogen werden. Bei der kontinuierlichen Probenahme ist auf ein geringes Totvolumen von nur wenigen Tropfen zu achten, sodass der Einfluss des Totvolumens auf das Volumen der Probe vernachlässigt werden kann. Die aus wässriger Phase an verschiedenen Trichterpositionen entnommenen Proben werden mittels HPLC-UV analysiert. Auch wird die Verweilzeit des Tropfens an jeder Probeentnahmestation bestimmt, um Informationen über den Konzentrationszeitverlauf (s. Abb. 46) zu erhalten. Um die in Abb. 42 dargestellte, durch das elektrische Feld bedingte Tropfengrößenänderung egalisieren zu können, und somit beide Versuche bei gleicher Tropfengröße durchführen zu können, wurde zur Tropfenerzeugung für die Referenzmessungen im feldfreien Zustand, die in Tab. A3 dargestellte Kapillare mit einem Innendurchmesser von 0,1 mm, für die Messung im elektrischen Hochspannungsfeld die Kapillare mit dem Innendurchmesser von 0,25 mm bei gleichem Außendurchmesser von 1,59 mm verwendet. Somit konnten die Tropfen sowohl im elektrischen Feld, als auch im feldfreien Zustand mit gleicher Tropfengröße von d = 1,59 mm erzeugt werden. B11 Ergänzungen zur Grenzfächenspannungsbestimmung im elektrischen Feld Die der Grenzflächenspannungsbestimmung im elektrischen Feld zugrunde liegenden Messdaten wurden in der in Abb. 36 dargestellten Versuchsapparatur erhalten. Dabei wurde unter Verwendung der in Tab. A3 dargestellten Kapillargeometrie (ID: 0,25 mm) die Abnahme der Tropfengröße des wässrigen Tropfens, dispergiert in der organischen Kontiphase, unter Verwendung der reinen Lösungsmittel Wasser (dispergiert) und Toluol (kontinuierliche Phase) im elektrischen Hochspannungsfeld bestimmt. Die über die CCDKamera in digitalisierter Form erhaltenen Bildaufnahmen konnten direkt von der Software PAT 1 von SINTERFACE am Max Planck Institut für Kolloid- und Grenzflächenforschung in Golm (AG Dr. Miller) verarbeitet werden. Zunächst wurden dabei die Daten mit Hilfe des Computerprogramms PAT-1 Drop & Bubble Picture Processor einer Tropfenprofilanalyse (Datenspezifizierung über Dichtedifferenz und Graviations- XVIII ANHANG konstante) unterzogen (s. Abb. A5) und in ein für die eigentliche Grenzflächenspannungsberechnungssoftware, PAT 1 Fitting Version 3.05, verwertbares Dateiformat überführt. Abb. A5 Bildanalyse mittels der Software PAT-1 Drop & Bubble Processor Abb. A6 Berechnung der Grenzflächenspannung aus den aus der Bildanalyse spezifizierten Daten über die Gauss-Laplace Gleichung mittels der Software PAT 1 Fitting Version 3.05 von SINTERFACE XIX ANHANG Dieses Programm berechnet durch Anpassung der experimentellen Daten an die GaussLaplace Gleichung (Gl. 17) die Grenzflächenspannung im elektrischen Feld (als auch im feldfreien Zustand). Das Ausgabefile einer solchen Berechnung für das System Toluol // Wasser (bei U: 0 kV) ist in Abb. A6 dargestellt. Der erhaltene Grenzflächenspannungswert von 35,27 mN/m entspricht nahezu dem Literaturwert von 36,10 mN/m [Dukhin et al. 1995] und zeigt somit, das dieses Verfahren zuverlässige Werte liefert. Die Auflösung des Eingangsdatenmaterials (Bilder) sollte dabei in der Größenordnung 101 µm/Pixel betragen. Das im Rahmen dieser Studie verwendete Datenmaterial besaß eine Auflösung von ca. 80 µm/Pixel und konnte daher bearbeitet werden. Die Ermittlung der Grenzflächenspannung war im Stoffsystem Toluol // Wasser bis zu einer in der Versuchsapparatur angelegten Spannung bis maximal 1100 V möglich. B12 Ergänzungen zur Fluoreszenzmessung im Phasengrenzflächenbereich Die experimentellen Untersuchungen wurden in einer wie in Abb. A7 dargestellten 50 ml Groß-Küvette (Firma helma, Typ: 741) bei gleichem Phasenverhältnis zwischen wässriger und organischer Phase (jeweils 25 ml Phasenvolumen) im Stoffsystem Wasser / Sulforhodamin (fluoreszierende, reaktive Stoffübergangskomponente) // TOA / Toluol bei 25 °C durchgeführt. Die Stoffaustauschrichtung war von wässriger nach organischer Phase. Zur Messung der Konzentrationsprofile im elektrischen Feld musste die verwendete Küvette, wie in Abb. 48 gezeigt, modifiziert werden. Im Abstand von jeweils 1 cm von der Phasengrenzflächenposition wurden in jeder Phase mit Teflon ummantelte VA-Stabelektroden mittig an der schmalsten Quaderfläche adaptiert, die sich über die gesamte Quaderbreite erstreckten (Länge: 7 cm, ADVA: 3 mm, Stärke der Isolierung: 0,5 mm) und noch etwas aus dem Quader herausragten, um den Hochspannungsgenerator anschließen zu können. Die Hochspannung wurde an die obere Elektrode in organischer Phase angelegt, die Gegenelektrode geerdet. Auf Grund der starken Streueffekte im Lichtschnitt war die Adaption mechanischer Rührer nicht möglich, so dass die Untersuchungen im ungerührten System durchgeführt wurden. Der schematische Versuchsaufbau ist in Abb. A7 dargestellt. Der in einem Argon-Laser erzeugte monochromatischer Lichtstrahl der Wellenlänge 514,5 nm, wird über einen Spiegel auf einen anderen rotierenden Spiegel geleitet, wobei durch die Rotationsbewegung des oberen Spiegels quasi eine zweidimensionale Aufweitung des XX ANHANG Lichtstrahls, der sogenannte Lichtschnitt (grün dargestellte Fläche) erzeugt wird. Dieser Lichtschnitt passiert an einer definierten Position die Messküvette in vertikaler Richtung zur Grenzfläche über die komplette Küvettenlänge (und Küvettenbreite). Abb. A7 Schematische Darstellung der Versuchsapparatur [Baumann & Mühlfriedel 2001b] Das sich in der Küvette befindliche Fluorophor (hier: Sulforhodamin) absorbiert zunächst das Laserlicht und wird dadurch photochemisch angeregt, so dass ein energetisch höherer und somit instabilerer, angeregter Singulettzustand (S1, S2, .., Si) erreicht wird. Nach Abführung der überschüssigen Vibrationsenergie erfolgt schließlich ein Strahlungsübergang, der vom Schwingungsgrundzustand des oberen elektronischen Zustands ausgeht und somit das Fluorophor wieder in den Grundzustand S0 überführt wird [Kirby & Steiner 1969]. Die bei diesem Energieübergang freigesetzte Energie wird in Form von elektromagnetischer Strahlung abgeführt, die aufgrund der abgeführten Schwingungsenergie energieärmer ist als die des absorbierten Lichtes, wie auch in Abb. A7 anhand des Fluorophors Rhodamin B ersichtlich ist. Dieses Fluoreszenzlicht wird von einer CCDKamera aufgefangen und in digitale Signale umgewandelt. Daraus lassen sich über eine Bildbearbeitungssoftware letztlich Grauwertbilder unterschiedlicher Intensität erhalten. Anhand dieser Intensitätsunterschiede lässt sich aufgrund des direkten Zusammenhangs zwischen der Intensität des Fluoreszenzlichtes I F und der Konzentration des Fluorophors, die Konzentration der Stoffübergangskomponente c in Stoffübergangsrichtung über Gleichung A4 für den eindimensionalen Fall ermitteln. XXI ANHANG I F = AI 0φεbc (A4) Der in Gleichung A4 beschriebene Zusammenhang zwischen Konzentration und Intensität ist allerdings nur für eindimensionale Systeme in dieser Form gültig. Bei dem hier betrachteten zweidimensionalen Mess- und Fluoreszenzsystem nimmt das Laserlicht mit zunehmendem Weg durch das Messvolumen aufgrund von Absorptionseffekten nach dem Lambert Beer’schen Gesetz ab. Dieser Effekt ist nicht vernachlässigbar und muss deshalb nach Gleichung A5 berücksichtigt werden. I 0 = I L e −εbc (A5) Der für die Auswertung relevante Zusammenhang zwischen der Fluoreszenzintensität I F und der Konzentration der Stoffübergangskomponente ergibt sich letztlich in Abhängigkeit der Messortshöhe (Berücksichtigung der auftretenden Absorptionseffekte) für den zweidimensionalen Fall nach Gleichung A6 [Baumann & Mühlfriedel 2001b]. ( ) I F = A1c − A2 + A3 c + A4 c 2 h (A6) Zur Auswertung muss das Messsystem für jede Phase kalibriert werden, und die Kalibrierungsparamter Ai bestimmt werden. Die genaue Grenzflächenposition wird über einen Laserstrahl nach dem Verfahren der Totalreflexionsanalyse nach Gleichung A7 bestimmt. sin (α ) = n2 n1 (A7) Dieser Vorgang ist in Abbildung A8 dargestellt. Abb. A8 Bestimmung der Phasengrenzflächenposition über die Methode der Totalreflexion [Baumann & Mühlfriedel 2001a] XXII ANHANG Der Lichtstrahl wird dann vollständig reflektiert, wenn der Eintrittswinkel kleiner als α ist. Daraus lässt sich die genaue Grenzflächenposition ermitteln [Baumann & Mühlfriedel 2001b]. Die maximale Auflösung der verwendeten 2D-Messtechnik liegt im untersuchten Stoffsystem bei 15,9 µm. Im untersuchten Stoffübergangssystem SRA/TOA konnten die erhaltenen Fluoreszenzintensitätswerte nicht in Konzentrationswerte umgerechnet werden, da eine Kalibrierung für die Stoffaustauschrichtung wässrig nach organisch an der in Halle zur Verfügung stehenden Messapparatur nicht möglich war. Dazu wäre ein inverses optisches Detektionssystem notwendig gewesen. Dennoch lässt sich eine feldbedingte Konzentrationsänderung der Stoffübergangskomponente im Grenzflächenbereich anhand des in Abb. 49 dargestellten Grauwertprofils diskutieren, da sowohl der Feldversuch, als auch die Referenzmessung unter genau den gleichen Versuchsbedingungen durchgeführt wurden und auch eine gute Reproduzierbarkeit der erhaltenen Fluoreszenzwerte ersichtlich ist. B13 Ergänzungen zur Versuchsdurchführung im Taylor-Couette Extraktor Die Stoffübergangsversuche im Taylor-Couette Extraktor wurden unter kontinuierlicher Betriebsweise bei 25 °C im Gegenstromprinzip (s. Abb. A9) durchgeführt. a) Abbildung A9 : Prinzip der Phasenführung, b) a : Gegenstrom-Prinzip b : Gleichstrom-Prinzip : Phase A : Phase B Das Volumen der Messzelle beträgt 2735 ml. Zum Start des Versuches wird die Anlage zunächst bis zur Hälfte mit der wässrigen Phase befüllt, dann die organische Phase darüber geschichtet. Nach vollständiger Befüllung des Taylor-Couette Extraktors werden zunächst alle vier Pumpen aktiviert (jeweils Ab- und Zulauf für jede der Phasen). Im nächsten Schritt wird der Antrieb der Zylinderwellen gestartet und das elektrische Hochspannungsfeld an die Versuchsapparatur angelegt. Dies ist der Startzeitpunkt der Messung. Die Proben werden am Kolonnenaustritt über einen Dreiwegehahn entnommen und auf ihre Zusammensetzung hin analysiert. Im Rahmen dieser Arbeit wurde stets der Stoffaustausch von wässriger nach organischer Phase untersucht. XXIII ANHANG Anhang C Konstruktive Ergänzungen C1 Elektrorührzelle Abbildung A10 zeigt einen Schnitt durch die modifizierte Rührzelle nach Nitsch. Diese Modifizierung ermöglicht die Untersuchung der Stoffübergangskinetik im elektrischen Hochspannungsfeld. Rührzellendeckel Elektrodenbefesetigung Propellerrührer Glassc hüsse Temperierm antel Elektrode Drallblec he Abb. A10: Für den Feldbetrieb modifizierte Rührzelle nach Nitsch [Schenkel 2000] XXIV ANHANG C2 Taylor-Couette Elektroextraktor Die Konstruktions- und Zeichnungsarbeiten am Taylor-Couette Extraktor wurden mit dem CAD-Programm „Mechanical Desktop 6“ durchgeführt. Abbildung A11 zeigt in schematischer Darstellung die wichtigsten Bauteile des Zentrifugalextraktors und die zum Aufbau verwendeten Materialien, Tabelle A4 die wichtigsten Spezifikationsdaten. 3 1 2 4 3 5 2 8 7 1, Wellenende für Übertragung Drehmoment (VA Stahl mit PTFE-Mantel) 2, Kugellager (6002 2RSR) + Simmerring (Viton) 3, Kugellager (6009 2RSR) + Simmerring (Viton) 4, Welle (VA Stahl mit PTFE-Mantel) 5, Glaszylinder 6 2 2 10 9 6, Spannungsüberträger (PTFE) 7, Spannvorrichtung (VA Stahl) 8, Lagerisolierung (PTFE) 9, Glaszylinderhalterung (PTFE) 10, Bohrung mit Schlauchadapter Abb. A11: Aufbau des Taylor-Couette Elektroextraktors Tabelle A4: Spezifikationen des Taylor-Couette Elektroextraktors Bauteil Innenzylinder, VA Spezifizierung Metallwelle, Außendurchmesser Länge des reinen Metallkörpers Länge mit Teflonbeschichtung Gesamtlänge Teflonisolierung Zylindrische Teflonhülse, mit welcher die Metallwelle beschicht ist, Außendurchmesser Außenzylinder, Glas Innendurchmesser Außendurchmesser Länge des Außenzylinders Grenzflächenposition Gemessen in radialer Richtung vom Mittelpunkt der Innenzylinderwelle aus Sedimentationsbereich Bereich zwischen Feldapplikation und Ablauf Ringspalt Größe des Ringspaltes Zu- und Abflüsse Rohrdurchmesser Maße [mm] 30 490 500 970 40 80 90 708 30 109 20 3 XXV ANHANG Anhang D Elektrotechnische Ergänzungen D1 Hochspannungsgenerator In Zusammenarbeit mit den Lehrstuhl für Hochspannungstechnik und Elektromagnetische Verträglichkeit der Universität Kaiserslautern (o. Prof. Dr. Weiß) wurde der in Abbildung A12 dargestellte Hochspannungsgenerator, welcher die Versorgung der Versuchsanlagen mit Gleichspannung gewährleistete, konzipiert und gefertigt. Der Aufbau des Generators ist in Abbildung A13 gezeigt. externe Spannungsregulierung Spannungsanzeige Sicherheitsschalter Anzeige der Stromstärke Abb. A12: Abb. A13: Bildaufnahme des verwendeten Hochspannungsgenerators Aufbau des Hochspannungsgenerators Zur Spannungserzeugung wird das Hochspannungsmodul HV der Firma Applied Kilovolts (U. K.) verwendet. Die Ausgangsspannung dieses Moduls beträgt zwischen 0 und 50 kV bei einem Maximalstrom von 2 mA. Die zu erzeugende Spannung lässt sich mit Hilfe des Potentiometers R4 stufenlos einstellen. Als Versorgungsspannung werden 24 V bei einem XXVI ANHANG Strom von maximal 6 A benötigt. Zur Erzeugung dieser Eingangsspannung wurde die über das Stromnetz erhältliche, handelsübliche Wechselspannung (230 V) gleichgerichtet und geglättet (GI) und über den variablen Spannungsregler LT1038 auf 24 V gebracht, womit der Hochspannungsgenerator betrieben werden konnte. Die Leuchtdiode LED zeigt den Betriebszustand der Versorgungsschaltung an. Für die interne Regulierung der Ausgangsspannung des Generators dient das Potentiometer R2. Die Messung der ausgehenden Gleichspannung erfolgt über den am Hochspannungsmodul der Firma Applied Kilovolts integrierten Voltage Monitor im Niederspannungsbereich. Die bei durchgeführten Referenzmessungen an einem Kugelblitzkondensator im Hochspannungsbereich bei 50 000 V ermittelten Spannungswerte waren in guter Übereinstimmung mit den über den Voltage Monitor gemessenen Werten. Die maximale Abweichung betrug über einen weiten Spannungsbereich von 1000 bis 50000 V lediglich 5 %. Die Messung der Stromstärke erfolgte mit Hilfe des Shunts R5 und konnte wie auch die an der Messzelle anliegende Spannung über ein Display direkt am Hochspannungsgenerator, wie in Abb. A 12 gezeigt, abgelesen werden. D2 Betriebssicherheit Zur Gewährleistung der Betriebssicherheit wurde die VDE-Norm 0105 zugrunde gelegt. Auch standen bei der Entwicklung der Messapparatur die Sicherheitsaspekte im Vordergrund. Das elektrische Hochspannungsfeld wurde nur innerhalb einer nach außen hin abgeschlossenen Gesamtapparatur angelegt, wie in Abb. A14 am Beispiel des Rührzellenelektroextraktors gezeigt ist. Folgende Sicherheitsmaßnahmen wurden im einzelnen getroffen: • Die Rührzelle ist auf einer massiven Platte in einem verschließbaren Gerüst befestigt • Gestell und Rührzellenaußenmantel sind geerdet • Metallgerüst fungiert bei starker Spannungsentladung zusätzlich als abschirmender Farday-Käfig • Die Anlage verfügt über einen Hauptsicherheitsschalter XXVII ANHANG • Die Apparatur verfügt über einen Sicherheitsdruckschalter, welcher den Hochspannungsgenerator nur bei geschlossenem Schutzgehäuse einschaltet und bei Öffnung der isolierenden Plexiglasverkleidung sofort ausschaltet. • Ein extern angebrachter Regler ermöglicht eine definierte Einstellung der angelegten Spannung • Das Hochspannungsgerät verfügt über einen Stromflussregler. Bei Überschreiten eines kritischen Stromflusses (von ca. 200 µA) schaltet sich die Anlage sofort selbstständig aus • Kabel und Elektrodenkontaktstellen sind isoliert • Erdungsleiste zum Stromabfluss im Überspannungsfall vorhanden geerdetes Metallgerüst Sicherheitsschalter Hauptschalter Abb. A14: Betrieb des Rührzellenextraktors im elektrischen Hochspannungsfeld XXVIII ANHANG Anhang E Ergänzungen zur Modellierung und Simulation E1 Kinetikparameter und weitere Eingangsdaten zur Berechnung des reaktiven Stoffübergangs im elektrischen Hochspannungsfeld Die zur Simulation des reaktiven Stoffaustausches von wässriger nach organischer Phase bei 25 °C verwendeten Kinetikparameter sind in Tabelle A5 gegeben. Diese Parameter sind gültig für die (in Tab. A5) angegebene(n) Stoffübergangskomponente(n), gelöst in Wasser für den reaktiven Stoffübergang bei Verwendung des Ionenaustauschers Trioctylamin, gelöst in Toluol. Alle weiteren zur Stoffübergangsberechnung im elektrischen Gleichspannungsfeld verwendeten Eingangsgrößen sind in Tabelle A6 aufgeführt. Tabelle A5: Kinetikparameter zur Berechnung des reaktiven Stoffübergangs Reinsysteme Stoffübergangskomponente p-Toluolsulfonsäure Kinetikparameter k1 k-1 k2 k-2 k3 k-3 ln KEX ln K1 ln K2 ln K3 αm γm Werte 22,1027 0,0438 302,3974 0,0357 166,0696 64,0879 16,2165 6,2224 9,0420 0,9521 2,98⋅10-2 8,49⋅10-4 Einheiten [l mol-1 s-1] [s-1] [l mol-1 s-1] [s-1] [l mol-1 s-1] [l mol-1 s-1] [-] [-] [-] [-] [-] [mol l-1] Gültigkeitsbereich der Parameter: PTS: 10-4 bis 10-1 mol/l, TOA: 0 bis 25 %Vol Salzsäure k1 k-1 k2 k-2 k3 k-3 ln KEX ln K1 ln K2 ln K3 αm γm 22,1027 0,0438 20281,5272 66,4069 2451,1245 41903,3091 9,1053 6,2224 5,7216 -2,8388 2,98⋅10-2 8,49⋅10-4 [l mol-1 s-1] [s-1] [l mol-1 s-1] [s-1] [l mol-1 s-1] [l mol-1 s-1] [-] [-] [-] [-] [-] [mol l-1] Gültigkeitsbereich der Parameter: HCl: 10-2 mol/l, TOA: 5 %Vol XXIX ANHANG Stoffübergangskomponente Schwefelsäure Kinetikparameter k1 k-1 k2 k-2 k3 k-3 ln KEX ln K1 ln K2 ln K3 αm γm Werte 17,7836 0,0307 2533,3230 15,7393 10008,6028 32431,3102 10,2656 6,360 5,0811 -1,1756 2,98⋅10-2 8,49⋅10-4 Einheiten [l mol-1 s-1] [s-1] [l mol-1 s-1] [s-1] [l mol-1 s-1] [l mol-1 s-1] [-] [-] [-] [-] [-] [mol l-1] Gültigkeitsbereich der Parameter: H2SO4 : 10-2 mol/l, TOA: 5 %Vol Binärsysteme Essigsäure k1 k-1 k2 k-2 k3 k-3 ln KEX ln K1 ln K2 ln K3 αm γm 155,9287 0,0233 2496,6478 48,3323 9999,1314 32433,0196 11,5729 8,8050 3,9446 -1,1766 2,98⋅10-2 8,49⋅10-4 Gültigkeitsbereich der Parameter: HAc: 10-1 mol/l, TOA: 10 %Vol Salzsäure k1 k-1 k2 k-2 k3 k-3 ln KEX ln K1 ln K2 ln K3 αm γm 27,0428 9,9338 31327,4824 232791,6759 739253,0937 16,7936 9,6882 1,0014 -2,0056 10,6923 2,98⋅10-2 8,49⋅10-4 [l mol-1 s-1] [s-1] [l mol-1 s-1] [s-1] [l mol-1 s-1] [l mol-1 s-1] [-] [-] [-] [-] [-] [mol l-1] [l mol-1 s-1] [s-1] [l mol-1 s-1] [s-1] [l mol-1 s-1] [l mol-1 s-1] [-] [-] [-] [-] [-] [mol l-1] Gültigkeitsbereich der Parameter: HCl: 10-1 mol/l, TOA: 10 %Vol XXX ANHANG Tabelle A6: Weitere Eingangsgrößen zur Berechnung des reaktiven Stoffübergangs Eingangsgröße Symbol Wert Einheit Phasengrenzfläche Elementarladung elektrische Feldkonstante relative Dielektrizitätskonstante der wässrigen Lösung Diffusionskoeffizient, in Wasser A e [cm2] [C] [A2 s2 N-1 m-2] [-] ε0 εr 44,18 1,6021⋅10-19 8,8541⋅10-12 78,54 Di HAc: 0,88⋅10-9 (a) [m2 s-1] HCl: 2,64⋅10-9 (a) (a): [Coulson & Richardson 1996] H2SO4: 1,73⋅10-9 (a) Faraday-Konstante Boltzmann-Konstante F k Potentialgradient in der wässrigen Phase Grenzflächenpotential ∇ϕ Ψ PTS: 0,69⋅10-9 (b) 9,6485⋅104 1,3806⋅10-23 dψ ∇ϕ = dr ist abhängig von der äußeren [V] Potentialdifferenz U [kV] ψ (U ψ (U ψ (U ψ (U Elektrodenabstand zur Grenzfläche molare Gaskonstante Temperatur Phasenvolumen (b): [Arai et al. 1992] [C mol-1] [J K-1] = 0 ) = 0,1 ≈ 0 [Czapla 2000a] = 12,5) = 369 = 20 ) = 578 = 25) = 737 r 0,01 [m] R T V 8,3145 298,16 398 [J mol-1 K-1] [K] [ml3] Die pKs-Werte und Wertigkeiten der im Rahmen dieser Arbeit untersuchten, aciden Stoffübergangskomponenten sind bereits in Tabelle 1 aufgeführt. Die Ladungszahl der hier untersuchten einwertigen Säuren hat bezüglich jeder der dissoziierten Komponenten den Wert 1, genauso wie die erste Dissoziationsstufe der hier untersuchten mehrwertigen Säuren. Die zweite Dissoziationsstufe der mehrwertigen Schwefelsäure hat die Ladungszahl 2 bezüglich des Säureanions und 1 bezüglich der Protonen. XXXI ANHANG E2 Ergänzungen zur Feldberechnung Das zur numerischen Berechnung des im Elektrorührzellenextraktors (s. Abb. A10) anliegenden elektrischen Gleichspannungsfeldes über die Finite Elemente Methode, basierend auf den Maxwell’schen Gleichungen, mittels des Computerprogramms EMAS (Ansoft, U. K.) verwendete Gitternetz ist in Abb. A15 dargestellt. Aufgrund der rotationssymmetrischen Geometrie der Stoffübergangszelle (Hohlzylinder) und der verwendeten Elektroden (Ringelektroden) konnte das zu berechnende Volumenelement um die Hälfte reduziert werden, was ein engmaschigeres Gitternetz und somit eine genauere Determination des Grenzflächenpotentials ermöglichte (s. Abb. A15). Das Gitternetz setzte sich dabei aus 40 000 Knoten, welche vor allem im Grenzflächenbereich zentriert wurden (mittlerer, gelbfarbener Balken in Abb. A15), zusammen. Abb. A15: Numerische Potentialbestimmung im Rührzellenextraktor Das Grenzflächenpotential konnte für eine angelegte, äußere Potentialdifferenz von 20 kV zu 578 V bestimmt werden. Die für diese Berechnungen relevanten Eingangsdaten, wie XXXII ANHANG auch die Eingangsinformationen zur Feldberechnung über die Laplace Gleichung, sind in Tabelle A7 aufgeführt. Tabelle A7: Eingangsgrößen zur Feldberechnung Eingangsgröße Symbol Wert Einheit äußere Potentialdifferenz: variabel, hier verwendet: U a: 20 b: 25 [kV] e ε0 εr 1,6021⋅10-19 8,8541⋅10-12 78,54 [C] [A2 s2 N-1 m-2] [-] εr 2,379 [-] εr 2,05 [-] µH O µ Toluol 1,85 0,36 [D] [D] ηw ηo ρw ρo 34,3 0 0,997 0,867 [m S cm-1] [m S cm-1] [kg l-1] [kg l-1] F k r 9,6485⋅104 1,3806⋅10-23 a: 0,02 b: 0,025 [C mol-1] [J K-1] [m] ra 0,066 [m] ri 0,05 [m] rd 0,072 [m] R T 8,3145 298,16 [J mol-1 K-1] [K] a) Elektrorührzelle b) Taylor-Couette Extraktor Elementarladung elektrische Feldkonstante relative Dielektrizitätskonstante der wässrigen Lösung relative Dielektrizitätskonstante der organischen Phase relative Dielektrizitätskonstante der Elektrodenisolierung Dipolmonent des Wassermoleküls Dipolmonent des organischen Lösungsmittels (Toluol) Leitfähigkeit der wässrigen Phase Leitfähigkeit der wässrigen Phase Dichte der wässrigen Phase Dichte der organischen Phase (5 % TOA in Toluol) Faraday-Konstante Boltzmann-Konstante Elektrodenabstand a) Elektrorührzelle b) Taylor-Couette Extraktor äußerer Durchmesser der Ringelektrode (org. Phase) äußerer Durchmesser der Ringelektrode (org. Phase) Durchmesser der als Fläche behandelten Ringgitterelektrode in wässriger Phase molare Gaskonstante Temperatur 2 XXXIII ANHANG E3 Ergänzungen zur Berechnung der Stoffübergangskoeffizienten Die zur Berechnung der Stoffübergangskoeffizienten k M in der Elektrorührzelle über das elektrostatisch erweiterte Stoffübergangsmodell nach Maroudas und Sawistowski für das Stoffsystem Wasser, Aceton // Toluol (Stoffaustauschrichtung: wässrig nach organisch, T: 25 °C) relevanten Daten sind in Tabelle A8 aufgeführt. Tabelle A8: Eingangsgrößen zur Feldberechnung Eingangsgröße Symbol Wert Einheit Stoffaustauschfläche stoffsystemspezifischer Parameter wässrige Acetonausgangskonzentration organische Acetonausgangskonzentration Verteilungskoeffizient Diffusionskoeffizient für Aceton, in Wasser Diffusionskoeffizient für Aceton, in Toluol Grenzflächenspannung der reinen Lösungsmittel (Wasser und Toluol) Grenzflächenspannung zwischen Toluol und wässriger Phase bei einer Acetonkonzentration von 750 [mmol/l] Grenzflächenspannung zwischen Toluol und wässriger, Aceton-haltiger Phase bei der kritischen Marangonikonzentration im feldfreien Zustand von 500 [mmol/l] Grenzflächenspannung zwischen Toluol und wässriger, Aceton-haltiger Phase bei der durch das elektrische Feld reduzierten, kritischen Marangonikonzentration von 200 [mmol/l]. Temperatur Phasenvolumen A σ c0 44,18 5760 750 0 0,56 1,062⋅10-9 2,51⋅10-9 33,76 [cm2] [m N-1] [mmol l-1] [mmol l-1] [-] [m2 s-1] [m2 s-1] [mN m-1] σ cA 25,36 [mN m-1] σ krit 27,79 [mN m-1] E σ krit 30,00 [mN m-1] T V 298,16 398 [K] [ml3] α c c D Dw Dw XXXIV ANHANG E4 Ergänzungen zur Berechnung des Stoffübergangs im Taylor-Couette Extraktors Die Berechnung des reaktiven Stoffübergangs von p-Toluolsulfonsäure im elektrischen Feld im Taylor-Couette Extraktors erfolgte aufgrund fehlender hydrodynamischer Informationen ohne Berücksichtigung der Taylorverwirblungen über das elektrostatisch erweiterte Kinetikmodell in Analogie zu den Stoffübergangsberechnungen im Rührzellenextraktor. Die in Tabelle A9 dargestellten Daten waren neben den bereits im Teil E1 aufgeführten elektrokinetischen Berechnungsparametern relevant und mussten daher zur Stoffübergangsberechnung berücksichtigt werden. Tabelle A9: Eingangsgrößen zur Berechnung des Stoffübergangs im Taylor-Couette Extraktors Eingangsgröße Symbol Wert Einheit Stoffaustauschfläche wässrige PTS-Ausgangskonzentration organische PTS-Ausgangskonzentration Ionenaustauscherkonzentration in organischer Phase, LM: Toluol Flow, organische Phase Flow, wässrige Phase Grenzflächenpotential, bei äußerer Potentialdifferenz von 10 kV Abstand zwischen Innenelektrode und Phasengrenzfläche Dicke der Isolierung Temperatur Phasenvolumen A w c PTS o c PTS c ITo 0,0942 0,1 0 5 [m2] [mol l-1] [mol l-1] [%] Fo Fw Ψ 0 0 4457,50 [ml min-1] [ml min-1] [V] ρm 1,5 [cm] ρI 0,5 298,16 1367,5 [cm] [K] [ml3] T V XXXV ANHANG Anhang F Experimentelle Daten F1 Gleichgewichtsexperimente Stoffsystem: p-Toluolsulfonsäure, Wasser/Trioctylamin, Toluol PTS, Start [mol l-1] PTS, GG [mol l-1] TOA [%] Spannung [kV] 0,1 1,48⋅10-3 5 0 -3 0,1 1,46⋅10 5 10 -4 0,1 7,15⋅10 7,5 0 -4 0,1 7,08⋅10 7,5 5 -4 0,1 3,09⋅10 10 0 -4 0,1 3,12⋅10 10 5 Stoffsystem: Citronensäure, Wasser/Trioctylamin, Toluol HCit, Start [mol l-1] HCit, GG [mol l-1] TOA [%] Spannung [kV] 0,2 0,2 0 0 0,2 0,2 0 2,5 -1 0,2 1,71⋅10 5 0 -1 0,2 1,66⋅10 5 1,5 -1 0,2 1,29⋅10 7,5 0 -1 0,2 1,27⋅10 7,5 1 -1 0,2 1,05⋅10 10 0 -1 0,2 1,02⋅10 10 1 F2 Extraktion E [%] 98,52 98,54 99,28 99,29 99,69 99,69 Extraktion E [%] 0 0 14,10 16,72 35,12 36,41 47,46 48,89 Rührzellenexperimente Teil 1: Rührerdrehzahlverhältnisse zwischen wässriger und organischer Phase naq 0 %Vol. TOA 5 %Vol. TOA 10 %Vol. TOA 25 %Vol. TOA Umdrehungszahl norg [RPM] [RPM] [RPM] [RPM] [RPM] 100 70 75 80 102 120 84 90 96 122 140 98 104 112 143 160 112 119 128 163 180 norg/naq 126 134 144 184 0,70 0,75 0,80 1,02 Teil 2: Daten zur Bestimmung des Plateaugebietes im Stoffsystem: p-Toluolsulfonsäure, Wasser/Trioctylamin, Toluol im feldfreien Zustand, RZ-Versuche 1 bis 37 XXXVI ANHANG RZ-Versuch 1 Ausgangskonzentrationen PTSaq PTSorg pH [min] [mol/l] [mol/l] - PTS 0,10 TOA 5,00 Umdrehungszahlen 0 1,00E-01 0,00E+00 1,15 8 9,32E-02 7,00E-03 1,17 100 24 8,34E-02 1,68E-02 1,2 75 [RPM] Parameter der Fitfunktion 30 8,04E-02 1,97E-02 1,21 54 7,22E-02 2,79E-02 1,255 Fit aq-1 Fit org-1 Fit org-2 83 6,23E-02 3,78E-02 1,31 b 1,03E-01 7,04E-02 1,01E-01 110 5,48E-02 4,54E-02 1,37 c 2,40E+00 1,01E-02 1,03E+00 140 4,69E-02 5,32E-02 1,42 d 1,45E+02 -1,71E-06 1,90E+02 Zeit PTSaq PTSorg pH [min] [mol/l] [mol/l] - naq norg [mol/l] [%Vol.] Zeit [RPM] RZ-Versuch 2 Ausgangskonzentrationen PTS 0,10 TOA 5,00 Umdrehungszahlen 0 9,84E-02 0,00E+00 1,21 10 8,98E-02 8,61E-03 1,23 120 20 8,56E-02 1,28E-02 1,25 30 7,91E-02 1,93E-02 1,27 50 6,96E-02 2,88E-02 1,31 1. Funkaq 1. Funkaq 1. Funkaq 80 5,85E-02 3,99E-02 1,38 b 1,18E-01 1,19E-01 1,03E-01 110 4,89E-02 4,95E-02 1,45 c 6,07E-04 4,64E-03 7,26E-01 140 4,07E-02 5,77E-02 1,51 d 1,53E+02 -6,22E+00 8,83E+01 Zeit PTSaq PTSorg pH [min] [mol/l] [mol/l] - naq norg [mol/l] [%Vol.] [RPM] 90 [RPM] Parameter der Fitfunktion RZ-Versuch 3 Ausgangskonzentrationen PTS 0,10 TOA 5,00 Umdrehungszahlen 0 1,01E-01 0,00E+00 1,15 14 8,31E-02 1,81E-02 1,19 140 20 7,84E-02 2,28E-02 1,21 32 7,30E-02 2,82E-02 1,24 50 6,26E-02 3,86E-02 1,29 1. Funkaq 1. Funkaq 1. Funkaq 80,5 5,12E-02 5,00E-02 1,36 b 1,18E-01 7,86E-02 1,03E-01 110 4,25E-02 5,87E-02 1,44 c 4,09E+00 1,16E-02 8,51E-01 163 2,85E-02 7,26E-02 1,58 d 1,19E+02 -8,50E+00 8,83E+01 naq norg [mol/l] [%Vol.] [RPM] 105 [RPM] Parameter der Fitfunktion XXXVII ANHANG RZ-Versuch 4 Ausgangskonzentrationen PTSaq PTSorg pH [min] [mol/l] [mol/l] - PTS 0,10 TOA 5,00 Umdrehungszahlen 0 9,99E-02 0,00E+00 1,075 10 8,78E-02 1,20E-02 1,14 160 20 7,88E-02 2,11E-02 1,16 120 [RPM] Parameter der Fitfunktion 32 7,15E-02 2,83E-02 1,2 50 6,37E-02 3,62E-02 1,26 Fit aq-1 Fit org-1 Fit org-2 80 4,87E-02 5,12E-02 1,36 b 1,02E-01 8,05E-02 1,00E-01 110 3,99E-02 5,99E-02 1,46 c 7,37E-01 1,22E-02 1,20E+00 140 3,21E-02 6,78E-02 1,57 d 8,15E+01 -3,24E+00 1,20E+02 Zeit PTSaq PTSorg pH [min] [mol/l] [mol/l] - naq norg [mol/l] [%Vol.] Zeit [RPM] RZ-Versuch 5 Ausgangskonzentrationen PTS 0,10 TOA 5,00 Umdrehungszahlen 0 1,03E-01 0,00E+00 1,21 10 9,11E-02 1,21E-02 1,245 180 20 9,79E-02 5,33E-03 1,26 135 [RPM] Parameter der Fitfunktion 30 7,82E-02 2,51E-02 1,295 50 6,70E-02 3,63E-02 1,36 Fit aq-1 Fit org-1 Fit org-2 87 5,11E-02 5,22E-02 1,46 b 9,99E-02 7,69E-02 1,05E-01 110 4,22E-02 6,11E-02 1,52 c 1,11E+00 1,32E-02 1,10E+00 142 3,41E-02 6,92E-02 1,62 d 8,17E+01 -2,07E-02 1,20E+02 Zeit PTSaq PTSorg pH [min] [mol/l] [mol/l] - naq norg [mol/l] [%Vol.] [RPM] RZ-Versuch 6 Ausgangskonzentrationen PTS 0,01 TOA 5,00 Umdrehungszahlen 0 1,02E-02 0,00E+00 2,08 10 8,62E-03 1,57E-03 2,12 100 20 7,75E-03 2,44E-03 2,16 30 6,92E-03 3,26E-03 2,21 52 5,79E-03 4,39E-03 2,3 naq norg [mol/l] [%Vol.] [RPM] 75 [RPM] Parameter der Fitfunktion Fit aq-1 Fit org-1 Fit org-2 80 4,51E-03 5,67E-03 2,43 b 1,15E-02 7,75E-03 1,00E-02 110 3,39E-03 6,79E-03 2,55 c 2,55E+00 1,89E-02 1,74E+00 140 2,68E-03 7,50E-03 2,65 d 8,44E+01 -1,76E-03 1,80E+02 XXXVIII ANHANG RZ-Versuch 7 Ausgangskonzentrationen PTSaq PTSorg pH [min] [mol/l] [mol/l] - PTS 0,01 TOA 5,00 Umdrehungszahlen 0 1,01E-02 0,00E+00 2,075 10 8,42E-03 1,70E-03 2,12 120 20 7,56E-03 2,56E-03 2,17 90 [RPM] Parameter der Fitfunktion 30 6,71E-03 3,41E-03 2,22 50 5,42E-03 4,71E-03 2,325 Fit aq-1 Fit org-1 Fit org-2 80 3,99E-03 6,14E-03 2,465 b 1,21E-02 9,15E-03 1,01E-02 110 2,97E-03 7,16E-03 2,61 c 3,42E+00 1,29E-02 1,55E+00 140 2,37E-03 7,75E-03 2,74 d 8,57E+01 -6,20E+00 1,30E+02 RZ-Versuch 8 Zeit PTSaq PTSorg pH [min] [mol/l] [mol/l] - naq norg [mol/l] [%Vol.] Zeit [RPM] Ausgangskonzentrationen PTS 0,01 TOA 5,00 Umdrehungszahlen 0 1,02E-02 0,00E+00 2,075 10 8,48E-03 1,73E-03 2,125 140 20 7,43E-03 2,78E-03 2,185 33,5 6,28E-03 3,92E-03 2,26 50 5,11E-03 5,10E-03 2,35 naq norg [mol/l] [%Vol.] [RPM] 105 [RPM] Parameter der Fitfunktion Fit aq-1 Fit org-1 Fit org-2 84 3,49E-03 6,72E-03 2,53 b 1,16E-02 8,43E-03 9,96E-03 110 2,63E-03 7,58E-03 2,66 c 1,09E-06 1,99E-02 1,65E+00 147 1,86E-03 8,35E-03 2,845 d 6,38E+01 -2,23E-06 1,30E+02 RZ-Versuch 9 Zeit PTSaq PTSorg pH [min] [mol/l] [mol/l] - Ausgangskonzentrationen PTS 0,01 TOA 5,00 Umdrehungszahlen 0 1,01E-02 0,00E+00 2,06 16 7,69E-03 2,37E-03 2,17 160 [RPM] 20 7,44E-03 2,62E-03 2,185 120 [RPM] Parameter der Fitfunktion Fit aq-1 Fit org-1 Fit org-2 30 6,34E-03 3,72E-03 2,25 50 4,87E-03 5,19E-03 2,36 80 3,39E-03 6,67E-03 2,55 naq norg [mol/l] [%Vol.] b 1,18E-02 8,51E-03 8,28E-03 110 2,42E-03 7,64E-03 - c -2,46E-02 1,91E-02 1,53E+00 140 1,75E-03 8,31E-03 2,89 d 6,38E+01 -1,27E-05 1,14E+02 XXXIX ANHANG RZ-Versuch 10 Ausgangskonzentrationen PTSaq PTSorg pH [min] [mol/l] [mol/l] - PTS 0,01 TOA 5,00 Umdrehungszahlen 0 1,01E-02 0,00E+00 2,07 10 8,12E-03 1,95E-03 2,15 180 20 6,89E-03 3,18E-03 2,22 135 [RPM] Parameter der Fitfunktion 30 5,92E-03 4,16E-03 2,3 54 4,11E-03 5,96E-03 2,46 Fit aq-1 Fit org-1 Fit org-2 80 2,94E-03 7,14E-03 2,63 b 1,24E-02 8,37E-03 9,24E-03 113 1,95E-03 8,12E-03 2,84 c 8,46E-01 2,40E-02 1,76E+00 140 1,47E-03 8,60E-03 2,985 d 6,11E+01 -1,93E-03 1,30E+02 Zeit PTSaq PTSorg pH [min] [mol/l] [mol/l] - naq norg [mol/l] [%Vol.] Zeit [RPM] RZ-Versuch 11 Ausgangskonzentrationen PTS 0,00 TOA 5,00 Umdrehungszahlen 0 1,00E-03 0,00E+00 3,055 10 8,98E-04 1,03E-04 3,075 100 20 8,26E-04 1,75E-04 3,11 75 [RPM] Parameter der Fitfunktion 32 7,82E-04 2,19E-04 3,15 50 6,88E-04 3,13E-04 3,23 Fit aq-1 Fit org-1 Fit org-2 80 5,97E-04 4,04E-04 3,36 b 9,97E-04 6,85E-04 1,07E-03 110 4,95E-04 5,06E-04 3,49 c 3,90E+00 1,22E-02 1,61E+00 144 4,27E-04 5,74E-04 3,64 d 1,16E+02 -6,43E-05 1,60E+02 Zeit PTSaq PTSorg pH [min] [mol/l] [mol/l] - 0 1,02E-03 0,00E+00 3,06 10,5 9,08E-04 1,11E-04 3,1 20 8,34E-04 1,85E-04 3,13 90 [RPM] Parameter der Fitfunktion 30 7,75E-04 2,44E-04 3,175 75 5,66E-04 4,53E-04 3,4 Fit aq-1 Fit org-1 Fit org-2 100 5,39E-04 4,80E-04 3,51 b 9,65E-04 6,51E-04 1,02E-03 120 4,36E-04 5,83E-04 3,605 c 1,27E+00 1,59E-02 1,57E+00 140 4,30E-04 5,89E-04 3,69 d 9,21E+01 5,63E-03 1,40E+02 naq norg [mol/l] [%Vol.] [RPM] RZ-Versuch 12 Ausgangskonzentrationen PTS 0,00 TOA 5,00 Umdrehungszahlen naq norg 120 [mol/l] [%Vol.] [RPM] XL ANHANG RZ-Versuch 13 Ausgangskonzentrationen Zeit PTSaq PTSorg pH [min] [mol/l] [mol/l] - 0 1,00E-03 0,00E+00 3,05 10 8,94E-04 1,10E-04 3,08 [RPM] 20,5 8,10E-04 1,94E-04 3,125 105 [RPM] Parameter der Fitfunktion Fit aq-1 Fit org-1 Fit org-2 31 7,42E-04 2,62E-04 3,17 56 6,16E-04 3,88E-04 3,31 88 4,93E-04 5,11E-04 3,47 PTS 0,00 TOA 5,00 Umdrehungszahlen naq norg 140 [mol/l] [%Vol.] b 9,75E-04 7,00E-04 1,04E-03 110 4,35E-04 5,68E-04 3,59 c 8,43E-01 1,44E-02 1,78E+00 140 3,95E-04 6,09E-04 3,76 d 8,59E+01 -1,90E+00 1,60E+02 RZ-Versuch 14 Zeit PTSaq PTSorg pH [min] [mol/l] [mol/l] - Ausgangskonzentrationen PTS 0,00 TOA 5,00 Umdrehungszahlen 0 1,00E-03 0,00E+00 3,005 10 8,69E-04 1,34E-04 3,04 160 [RPM] 20 7,92E-04 2,12E-04 3,095 120 [RPM] Parameter der Fitfunktion Fit aq-1 Fit org-1 Fit org-2 32 7,18E-04 2,85E-04 3,15 50 6,07E-04 3,97E-04 3,26 80 4,88E-04 5,15E-04 3,44 naq norg [mol/l] [%Vol.] b 1,01E-03 6,48E-04 1,00E-03 114 4,13E-04 5,90E-04 3,62 c 2,76E+00 1,97E-02 1,82E+00 140 3,76E-04 6,27E-04 3,77 d 8,58E+01 -7,78E-02 1,60E+02 RZ-Versuch 15 Zeit PTSaq PTSorg pH [min] [mol/l] [mol/l] - Ausgangskonzentrationen PTS 0,00 TOA 5,00 Umdrehungszahlen 0 1,03E-03 0,00E+00 3,025 10 8,62E-04 1,65E-04 3,065 180 [RPM] 20 7,92E-04 2,35E-04 3,12 135 [RPM] Parameter der Fitfunktion Fit aq-1 Fit org-1 Fit org-2 32 7,03E-04 3,25E-04 3,18 53 5,60E-04 4,67E-04 3,32 80 4,44E-04 5,83E-04 3,49 naq norg [mol/l] [%Vol.] b 1,13E-03 7,64E-04 1,00E-03 110 3,65E-04 6,63E-04 3,67 c 3,94E+00 1,80E-02 1,82E+00 140 3,36E-04 6,92E-04 3,84 d 8,58E+01 2,47E-03 1,60E+02 XLI ANHANG RZ-Versuch 16 Ausgangskonzentrationen PTSaq PTSorg pH [min] [mol/l] [mol/l] - PTS 0,00 TOA 5,00 Umdrehungszahlen 0 1,00E-04 0,00E+00 4 10 9,44E-05 5,59E-06 4,025 100 20 8,61E-05 1,39E-05 4,065 75 [RPM] Parameter der Fitfunktion 54 6,10E-05 3,90E-05 4,215 67 4,95E-05 5,05E-05 4,305 Fit aq-1-pH Fit org-1-pH Fit org-2-pH 77 4,52E-05 5,48E-05 4,345 b 1,71E-04 1,47E-04 1,08E-04 117 2,32E-05 7,68E-05 4,635 c -4,99E+00 6,09E-03 1,73E+00 147 1,53E-05 8,47E-05 4,815 d 1,43E+02 3,44E+00 1,50E+02 180 2,99E-06 9,70E-05 5,525 Zeit PTSaq PTSorg pH [min] [mol/l] [mol/l] - naq norg [mol/l] [%Vol.] Zeit [RPM] RZ-Versuch 17 Ausgangskonzentrationen PTS 0,00 TOA 5,00 Umdrehungszahlen 0 1,00E-04 0,00E+00 4 10 8,91E-05 1,09E-05 4,05 120 20 7,76E-05 2,24E-05 4,11 90 [RPM] Parameter der Fitfunktion 30 6,76E-05 3,24E-05 4,17 50 5,25E-05 4,75E-05 4,28 Fit aq-1-pH Fit org-1-pH Fit org-2-pH 80 3,31E-05 6,69E-05 4,48 b 1,86E-04 1,21E-04 1,01E-04 110 2,14E-05 7,86E-05 4,67 c -1,06E+00 9,61E-03 1,92E+00 140 1,35E-05 8,65E-05 4,87 d 1,43E+02 1,50E+02 170 7,59E-06 9,24E-05 5,12 Zeit PTSaq PTSorg pH [min] [mol/l] [mol/l] - 0 1,00E-04 0,00E+00 4 11,5 8,91E-05 1,09E-05 4,05 21 7,76E-05 2,24E-05 4,11 105 [RPM] Parameter der Fitfunktion 30 6,76E-05 3,24E-05 4,17 50 4,79E-05 5,21E-05 4,32 Fit aq-1-pH Fit org-1-pH Fit org-2-pH 80 2,95E-05 7,05E-05 4,53 b 2,01E-04 1,32E-04 1,00E-04 109 1,86E-05 8,14E-05 4,73 c -2,80E+00 8,92E-03 1,95E+00 d 1,43E+02 1,50E+02 naq norg [mol/l] [%Vol.] [RPM] 2,05E-01 RZ-Versuch 18 Ausgangskonzentrationen PTS 0,00 TOA 5,00 Umdrehungszahlen naq norg 140 [mol/l] [%Vol.] [RPM] 2,05E-01 XLII ANHANG RZ-Versuch 19 Ausgangskonzentrationen PTSaq PTSorg pH [min] [mol/l] [mol/l] - PTS 0,00 TOA 5,00 Umdrehungszahlen 0 1,00E-04 0,00E+00 4 10 8,71E-05 1,29E-05 4,06 160 20 7,76E-05 2,24E-05 4,11 120 [RPM] Parameter der Fitfunktion 30 6,61E-05 3,39E-05 4,18 50 4,68E-05 5,32E-05 4,33 Fit aq-1-pH Fit org-1-pH Fit org-2-pH 80 2,88E-05 7,12E-05 4,54 b 1,90E-04 1,10E-04 9,91E-05 110 1,74E-05 8,26E-05 4,76 c 3,78E-01 1,27E-02 1,95E+00 140 9,77E-06 9,02E-05 5,01 d 1,42E+02 1,63E-01 1,50E+02 Zeit PTSaq PTSorg pH [min] [mol/l] [mol/l] - naq norg [mol/l] [%Vol.] Zeit [RPM] RZ-Versuch 20 Ausgangskonzentrationen PTS 0,00 TOA 5,00 Umdrehungszahlen 0 1,00E-04 0,00E+00 4 10 8,51E-05 1,49E-05 4,07 180 20 7,08E-05 2,92E-05 4,15 135 [RPM] Parameter der Fitfunktion 32 6,03E-05 3,97E-05 4,22 50 4,27E-05 5,73E-05 4,37 Fit aq-1-pH Fit org-1-pH Fit org-2-pH 80 2,69E-05 7,31E-05 4,57 b 1,63E-04 9,70E-05 9,60E-05 110 1,70E-05 8,30E-05 4,77 c 7,68E-02 1,77E-02 1,87E+00 140 9,12E-06 9,09E-05 5,04 d 9,98E+01 5,71E-01 1,40E+02 Zeit PTSaq PTSorg pH [min] [mol/l] [mol/l] - 0 1,01E-01 0,00E+00 1,2 10 9,14E-02 9,72E-03 1,23 20 8,38E-02 1,73E-02 1,25 80 [RPM] Parameter der Fitfunktion 30 7,78E-02 2,33E-02 1,28 50 6,67E-02 3,44E-02 1,335 Fit aq-1 Fit org-1 Fit org-2 78 5,28E-02 4,83E-02 1,43 b 1,50E-01 9,92E-02 1,04E-01 110 4,01E-02 6,10E-02 1,54 c 1,37E+00 8,67E-03 1,49E+00 137 3,21E-02 6,90E-02 1,6 d 1,65E+02 -8,18E-03 1,90E+02 naq norg [mol/l] [%Vol.] [RPM] RZ-Versuch 21 Ausgangskonzentrationen PTS 0,10 TOA 10,00 Umdrehungszahlen naq norg 100 [mol/l] [%Vol.] [RPM] XLIII ANHANG RZ-Versuch 22 Ausgangskonzentrationen Zeit PTSaq PTSorg pH [min] [mol/l] [mol/l] - 0 9,68E-02 0,00E+00 1,19 10 8,79E-02 8,88E-03 1,22 20 8,11E-02 1,57E-02 1,25 96 [RPM] Parameter der Fitfunktion 32 7,37E-02 2,31E-02 1,29 50 6,16E-02 3,52E-02 1,34 Fit aq-1 Fit org-1 Fit org-2 80 4,73E-02 4,94E-02 1,46 b 1,53E-01 1,02E-01 1,06E-01 110 3,55E-02 6,12E-02 1,57 c 1,64E-01 8,37E-03 1,21E+00 d 1,65E+02 -8,15E-03 1,15E+02 Zeit PTSaq PTSorg pH [min] [mol/l] [mol/l] - 0 1,01E-01 0,00E+00 1,2 10 8,84E-02 1,27E-02 1,24 20 8,08E-02 2,02E-02 1,28 112 [RPM] Parameter der Fitfunktion 30 7,24E-02 2,87E-02 1,32 50 5,88E-02 4,23E-02 1,41 Fit aq-1 Fit org-1 Fit org-2 80 4,22E-02 5,89E-02 1,55 b 1,27E-01 9,21E-02 1,07E-01 110 2,98E-02 7,13E-02 1,705 c -2,12E-01 1,24E-02 1,42E+00 138 2,13E-02 7,98E-02 1,86 d 9,14E+01 -7,64E-04 1,15E+02 Zeit PTSaq PTSorg pH [min] [mol/l] [mol/l] - 0 9,90E-02 0,00E+00 1,21 10 8,41E-02 1,48E-02 1,24 20 7,46E-02 2,44E-02 1,28 128 [RPM] Parameter der Fitfunktion 30 6,58E-02 3,31E-02 1,33 59 4,66E-02 5,24E-02 1,46 Fit aq-1 Fit org-1 Fit org-2 80 3,49E-02 6,40E-02 1,56 b 1,36E-01 8,84E-02 1,08E-01 110 2,35E-02 7,55E-02 1,73 c 1,13E+00 1,61E-02 1,53E+00 140 1,46E-02 8,43E-02 1,89 d 9,24E+01 -7,83E-04 1,25E+02 PTS 0,10 TOA 10,00 Umdrehungszahlen naq norg 120 [mol/l] [%Vol.] [RPM] RZ-Versuch 23 Ausgangskonzentrationen PTS 0,10 TOA 10,00 Umdrehungszahlen naq norg 140 [mol/l] [%Vol.] [RPM] RZ-Versuch 24 Ausgangskonzentrationen PTS 0,10 TOA 10,00 Umdrehungszahlen naq norg 160 [mol/l] [%Vol.] [RPM] XLIV ANHANG RZ-Versuch 25 Ausgangskonzentrationen Zeit PTSaq PTSorg pH [min] [mol/l] [mol/l] - 0 9,93E-02 0,00E+00 1,2 10 8,55E-02 1,38E-02 1,24 [RPM] 26 6,87E-02 3,05E-02 1,31 144 [RPM] Parameter der Fitfunktion Fit aq-1 Fit org-1 Fit org-2 42 5,60E-02 4,33E-02 1,39 63 4,12E-02 5,81E-02 1,505 80 3,26E-02 6,66E-02 1,6 PTS 0,10 TOA 10,00 Umdrehungszahlen naq norg 180 [mol/l] [%Vol.] b 1,44E-01 9,90E-02 1,06E-01 110 2,02E-02 7,91E-02 1,79 c -2,01E-01 1,40E-02 1,64E+00 140 1,22E-02 8,71E-02 2,01 d 9,23E+01 -1,56E-07 1,30E+02 RZ-Versuch 26 Zeit PTSaq PTSorg pH [min] [mol/l] [mol/l] - 0 9,85E-03 0,00E+00 1,995 10 8,59E-03 1,26E-03 2,04 [RPM] 20 7,64E-03 2,21E-03 2,075 96 [RPM] Parameter der Fitfunktion Fit aq-1 Fit org-1 Fit org-2 29 6,96E-03 2,89E-03 2,11 50 5,69E-03 4,16E-03 2,19 75 1,18E-02 -1,95E-03 2,295 115 3,05E-03 6,80E-03 2,47 Zeit PTSaq PTSorg pH [min] [mol/l] [mol/l] - 0 1,02E-02 0,00E+00 1,97 9 8,56E-03 1,63E-03 2,035 [RPM] 21 7,29E-03 2,89E-03 2,105 112 [RPM] Parameter der Fitfunktion Fit aq-1 Fit org-1 Fit org-2 32 6,43E-03 3,75E-03 2,15 50 5,33E-03 4,86E-03 2,22 77 3,98E-03 6,21E-03 2,37 100 3,80E-03 6,38E-03 2,49 Ausgangskonzentrationen PTS 0,01 TOA 10,00 Umdrehungszahlen naq norg 120 [mol/l] [%Vol.] b 1,17E-02 8,51E-03 1,07E-02 c 1,02E+00 1,34E-02 1,22E+00 d 9,23E+01 -1,93E+00 9,00E+01 RZ-Versuch 27 Ausgangskonzentrationen PTS 0,01 TOA 10,00 Umdrehungszahlen naq norg 140 [mol/l] [%Vol.] b 1,20E-02 8,94E-03 1,00E-02 c 2,04E-06 1,54E-02 1,31E+00 d 7,00E+01 1,75E-04 9,00E+01 XLV ANHANG RZ-Versuch 28 Ausgangskonzentrationen Zeit PTSaq PTSorg pH [min] [mol/l] [mol/l] - 0 9,38E-03 0,00E+00 2 9 6,94E-03 2,44E-03 2,04 20 6,22E-03 3,16E-03 2,1 128 [RPM] Parameter der Fitfunktion 30 6,10E-03 3,28E-03 2,15 50 5,88E-03 3,50E-03 2,27 Fit aq-1 Fit org-1 Fit org-2 80 3,36E-03 6,02E-03 2,42 b 1,30E-02 8,42E-03 1,04E-02 100 2,58E-03 6,80E-03 2,53 c 4,15E-08 1,65E-02 1,37E+00 d 9,23E+01 2,09E-04 9,15E+01 Zeit PTSaq PTSorg pH [min] [mol/l] [mol/l] - 0 9,80E-04 0,00E+00 2,96 10 8,85E-04 9,43E-05 3,02 23,5 1,26E-03 -2,82E-04 3,09 96 [RPM] Parameter der Fitfunktion 29 9,81E-04 -1,53E-06 3,12 57 6,32E-04 3,48E-04 3,28 Fit aq-1 Fit org-1 Fit org-2 80 5,10E-04 4,69E-04 3,42 b 9,52E-04 6,07E-04 1,01E-03 112 4,64E-04 5,15E-04 3,6 c 4,30E-07 1,68E-02 1,53E+00 d 9,21E+01 -2,99E-03 1,10E+02 Zeit PTSaq PTSorg pH [min] [mol/l] [mol/l] - 0 1,02E-03 0,00E+00 2,955 10 8,90E-04 1,27E-04 2,99 20 7,97E-04 2,20E-04 3,045 112 [RPM] Parameter der Fitfunktion 27 7,59E-04 2,58E-04 3,085 50 6,12E-04 4,05E-04 3,225 Fit aq-1 Fit org-1 Fit org-2 80 4,89E-04 5,28E-04 3,43 b 1,11E-03 6,52E-04 1,06E-03 110 4,04E-04 6,13E-04 3,65 c 1,64E+00 2,05E-02 1,76E+00 d 9,22E+01 -2,56E-02 1,30E+02 PTS 0,01 TOA 10,00 Umdrehungszahlen naq norg 160 [mol/l] [%Vol.] [RPM] RZ-Versuch 29 Ausgangskonzentrationen PTS 0,00 TOA 10,00 Umdrehungszahlen naq norg 120 [mol/l] [%Vol.] [RPM] RZ-Versuch 30 Ausgangskonzentrationen PTS 0,00 TOA 10,00 Umdrehungszahlen naq norg 140 [mol/l] [%Vol.] [RPM] XLVI ANHANG RZ-Versuch 31 Ausgangskonzentrationen Zeit PTSaq PTSorg pH [min] [mol/l] [mol/l] - 0 9,64E-04 0,00E+00 3 10 8,52E-04 1,12E-04 3,035 20 7,98E-04 1,66E-04 3,085 128 [RPM] Parameter der Fitfunktion 27 7,11E-04 2,53E-04 3,135 48 6,35E-04 3,29E-04 3,28 Fit aq-1 Fit org-1 Fit org-2 80 5,17E-04 4,47E-04 3,51 b 9,65E-04 5,37E-04 1,05E-03 110 4,32E-04 5,32E-04 3,71 c -1,58E-01 2,23E-02 1,77E+00 d 9,23E+01 -3,33E-07 1,30E+02 Zeit PTSaq PTSorg pH [min] [mol/l] [mol/l] - 0 1,01E-01 0,00E+00 1,2 10 8,40E-02 1,67E-02 1,24 20 7,44E-02 2,63E-02 1,29 143 [RPM] Parameter der Fitfunktion 28 6,76E-02 3,31E-02 1,33 49 4,95E-02 5,13E-02 1,44 Fit aq-1 Fit org-1 Fit org-2 79 3,33E-02 6,74E-02 1,58 b 1,40E-01 1,07E-01 1,09E-01 113 2,18E-02 7,90E-02 1,755 c 2,19E+00 1,13E-02 1,27E+00 140 1,50E-02 8,58E-02 1,91 d 9,22E+01 -4,97E+00 7,98E+01 Zeit PTSaq PTSorg pH [min] [mol/l] [mol/l] - 0 9,89E-02 0,00E+00 1,21 10 7,77E-02 2,12E-02 1,26 20 6,48E-02 3,41E-02 1,33 163 [RPM] Parameter der Fitfunktion 30 5,31E-02 4,59E-02 1,4 50 3,59E-02 6,31E-02 1,55 Fit aq-1 Fit org-1 Fit org-2 80 2,03E-02 7,87E-02 1,78 b 1,40E-01 1,04E-01 1,03E-01 110 1,15E-02 8,75E-02 2,03 c 1,29E+00 1,59E-02 1,45E+00 135 8,88E-03 9,01E-02 2,24 d 6,43E+01 -4,98E+00 7,98E+01 PTS 0,00 TOA 10,00 Umdrehungszahlen naq norg 160 [mol/l] [%Vol.] [RPM] RZ-Versuch 32 Ausgangskonzentrationen PTS 0,10 TOA 25,00 Umdrehungszahlen naq norg 140 [mol/l] [%Vol.] [RPM] RZ-Versuch 33 Ausgangskonzentrationen PTS 0,10 TOA 25,00 Umdrehungszahlen naq norg 160 [mol/l] [%Vol.] [RPM] XLVII ANHANG RZ-Versuch 34 Ausgangskonzentrationen Zeit PTSaq PTSorg pH [min] [mol/l] [mol/l] - 0 1,02E-02 0,00E+00 1,96 10 8,25E-03 1,91E-03 2,03 21 6,87E-03 3,29E-03 2,09 143 [RPM] Parameter der Fitfunktion 30 6,30E-03 3,86E-03 2,15 50 4,87E-03 5,29E-03 2,27 Fit aq-1 Fit org-1 Fit org-2 79 3,41E-03 6,75E-03 2,45 b 1,20E-02 9,36E-03 1,08E-02 110 2,44E-03 7,72E-03 2,63 c 1,84E+00 1,52E-02 1,28E+00 130 2,01E-03 8,15E-03 2,76 d 6,43E+01 -5,08E+00 6,51E+01 Zeit PTSaq PTSorg pH [min] [mol/l] [mol/l] - 0 1,00E-02 0,00E+00 1,98 10 9,16E-03 8,67E-04 2,04 18 8,19E-03 1,84E-03 2,1 163 [RPM] Parameter der Fitfunktion 29 5,99E-03 4,03E-03 2,18 50 4,53E-03 5,49E-03 2,3 Fit aq-1 Fit org-1 Fit org-2 78 3,23E-03 6,79E-03 2,48 b 1,22E-02 9,15E-03 1,06E-02 110 2,09E-03 7,93E-03 2,72 c 1,59E+00 1,83E-02 1,32E+00 131 1,66E-03 8,36E-03 2,89 d 6,38E+01 -1,44E-04 6,50E+01 Zeit PTSaq PTSorg pH [min] [mol/l] [mol/l] - 0 9,88E-04 0,00E+00 2,95 11 8,97E-04 9,12E-05 3 20 8,06E-04 1,83E-04 3,06 143 [RPM] Parameter der Fitfunktion 28 7,46E-04 2,43E-04 3,115 49 6,42E-04 3,47E-04 3,27 Fit aq-1 Fit org-1 Fit org-2 77 4,97E-04 4,92E-04 3,53 b 9,38E-04 7,15E-04 1,14E-03 110 4,18E-04 5,71E-04 3,83 c -3,62E+00 1,46E-02 1,45E+00 d 6,49E+01 7,00E+01 PTS 0,01 TOA 25,00 Umdrehungszahlen naq norg 140 [mol/l] [%Vol.] [RPM] RZ-Versuch 35 Ausgangskonzentrationen PTS 0,01 TOA 25,00 Umdrehungszahlen naq norg 160 [mol/l] [%Vol.] [RPM] RZ-Versuch 36 Ausgangskonzentrationen PTS 0,00 TOA 25,00 Umdrehungszahlen naq norg 140 [mol/l] [%Vol.] [RPM] 4,01E-02 XLVIII ANHANG RZ-Versuch 37 Ausgangskonzentrationen Zeit PTSaq PTSorg pH [min] [mol/l] [mol/l] - 0 1,01E-03 0,00E+00 2,96 10 8,75E-04 1,36E-04 3 [RPM] 20 7,69E-04 2,42E-04 3,055 163 [RPM] Parameter der Fitfunktion Fit aq-1 Fit org-1 Fit org-2 34 6,80E-04 3,31E-04 3,17 47 6,05E-04 4,06E-04 3,27 77 4,76E-04 5,35E-04 3,56 110 4,23E-04 5,88E-04 3,9 PTS 0,00 TOA 25,00 Umdrehungszahlen naq norg 160 [mol/l] [%Vol.] b 9,50E-04 6,33E-04 1,12E-03 c 7,08E-01 2,41E-02 1,47E+00 d 6,47E+01 -5,82E-06 7,00E+01 Teil 3: Feldeinfluss auf den reaktiven Stoffübergang im System: Salzsäure, Wasser/ Trioctylamin, Toluol, Molverhältnis zwischen HCl und TOA ca. 1 zu 1 Ausgangskonzentrationen HCl: 100 mM TOA: 5% Spannung U: 0 kV Rührerdrehzahlen ORG: 104 W: 140 Zeit [min] 0 5 30 45 60 90 120 HCl [mM] 100 92,12 73,57 67,54 59,27 49,62 46,18 Ausgangskonzentrationen HCl: 100 mM TOA: 5% Spannung U: 20 kV Rührerdrehzahlen ORG: 104 W: 140 Zeit [min] 0 15 30 41 60 90 120 HCl [mM] 100 85,31 72,34 65,23 53,44 45,56 41,01 Teil 4: Daten zur Bestimmung des Feldeinflusses, sowie der Elektrodengeometrie auf den reaktiven Stoffübergang im Stoffsystem p-Toluolsulfonsäure, Wasser/Trioctylamin, Toluol und Zink, Wasser/D2EHPA, Isododecan, EZ-Versuche 1 bis 14 XLIX ANHANG EZ-Versuch 1 PTS TOA naq Versuchsdaten 0,10 5,00 90 [mol/l] [%Vol.] [RPM] norg 120 [RPM] Elektrode Stabelektrode Hochspannung 0 [KV] Feldstärke 0,00 [KV/cm] Parameter der Fitfunktion aq-1 b 1,01E-01 c 1,17E+00 d 1,15E+02 EZ-Versuch 2 Versuchsdaten PTS 0,10 [mol/l] [%Vol.] TOA 5,00 naq 90 [RPM] Zeit [min] PTSaq [mol/l] PTSorg [mol/l] 0 1,00E-01 0,00E+00 10 9,33E-02 6,67E-03 18 28 59 98 116 132 164 186 8,71E-02 7,94E-02 6,10E-02 4,68E-02 4,12E-02 3,72E-02 3,09E-02 2,75E-02 1,29E-02 2,06E-02 3,90E-02 5,32E-02 5,88E-02 6,28E-02 6,91E-02 7,25E-02 Zeit [min] PTSaq [mol/l] PTSorg [mol/l] 0 0,00E+00 1,00E-01 0 0,00E+00 1,00E-01 0,00E+00 0,00E+00 0,00E+00 0,00E+00 0,00E+00 0,00E+00 0,00E+00 0,00E+00 1,00E-01 1,00E-01 1,00E-01 1,00E-01 1,00E-01 1,00E-01 1,00E-01 1,00E-01 PTSaq [mol/l] PTSorg [mol/l] 1,00E-01 0,00E+00 9,37E-02 6,32E-03 8,35E-02 7,61E-02 6,79E-02 5,91E-02 4,59E-02 3,48E-02 2,83E-02 2,25E-02 1,65E-02 2,39E-02 3,21E-02 4,09E-02 5,41E-02 6,52E-02 7,17E-02 7,75E-02 norg 120 [RPM] 0 Elektrode Stabelektrode 0 Hochspannung 20 [KV] 0 Feldstärke 16,66 [KV/cm] 0 Parameter der Fitfunktion aq-1 0 b 9,89E-02 0 c 1,09E+00 0 d 8,79E+01 0 EZ-Versuch 3 Versuchsdaten Zeit PTS 0,10 [mol/l] [min] [%Vol.] TOA 5,00 0 naq 90 [RPM] 7 norg 120 [RPM] 18 Elektrode Spiralelektrode 25 Hochspannung 0 [KV] 36 Feldstärke 0,00 [KV/cm] 49 Parameter der Fitfunktion aq-1 77 b 1,00E-01 111 c 1,17E+00 148 d 9,25E+01 183 L ANHANG EZ-Versuch 4 PTS TOA naq Versuchsdaten 0,10 5,00 90 [mol/l] [%Vol.] [RPM] norg 120 [RPM] Elektrode Spiralelektrode Hochspannung 12,5 [KV] Feldstärke 12,5 [KV/cm] Parameter der Fitfunktion aq-1 b 9,93E-02 c 1,09E+00 d 6,58E+01 EZ-Versuch 5 Versuchsdaten PTS 0,10 [mol/l] [%Vol.] TOA 5,00 naq 90 [RPM] norg 120 [RPM] Elektrode Spiralelektrode Hochspannung 25 [KV] Feldstärke 25 [KV/cm] Parameter der Fitfunktion aq-1 b 9,64E-02 c 1,04E+00 d 4,98E+01 EZ-Versuch 6 Versuchsdaten PTS 0,10 [mol/l] [%Vol.] TOA 5,00 naq 90 [RPM] norg 120 [RPM] Elektrode Ringelektrode Hochspannung 0 [KV] Feldstärke 0,00 [KV/cm] Parameter der Fitfunktion aq-1 b 0,00E+00 c 9,35E-01 d 1,87E+00 Zeit [min] PTSaq [mol/l] PTSorg [mol/l] 0 1,00E-01 0,00E+00 4 9,33E-02 6,67E-03 8 16 24 30 55 84 116 162 8,71E-02 7,76E-02 7,08E-02 6,61E-02 5,01E-02 3,89E-02 3,02E-02 2,19E-02 1,29E-02 2,24E-02 2,92E-02 3,39E-02 4,99E-02 6,11E-02 6,98E-02 7,81E-02 Zeit [min] PTSaq [mol/l] PTSorg [mol/l] 0 1,00E-01 0,00E+00 2 8,91E-02 1,09E-02 16 37 53 66 82 106 123 158 7,24E-02 5,62E-02 4,79E-02 4,27E-02 3,63E-02 3,02E-02 2,63E-02 2,04E-02 2,76E-02 4,38E-02 5,21E-02 5,73E-02 6,37E-02 6,98E-02 7,37E-02 7,96E-02 Zeit [min] PTSaq [mol/l] PTSorg [mol/l] 0 1,00E-01 0,00E+00 9 9,55E-02 4,50E-03 33 42 56 79 84 95 108 145 8,71E-02 8,32E-02 7,85E-02 7,24E-02 7,00E-02 6,76E-02 6,46E-02 5,62E-02 1,29E-02 1,68E-02 2,15E-02 2,76E-02 3,00E-02 3,24E-02 3,54E-02 4,38E-02 LI ANHANG EZ-Versuch 7 PTS TOA naq Versuchsdaten 0,10 5,00 90 [mol/l] [%Vol.] [RPM] Zeit [min] PTSaq [mol/l] PTSorg [mol/l] 0 1,00E-01 0,00E+00 9 9,12E-02 8,80E-03 8,91E-02 8,71E-02 8,51E-02 8,32E-02 7,94E-02 7,76E-02 7,41E-02 7,08E-02 1,09E-02 1,29E-02 1,49E-02 1,68E-02 2,06E-02 2,24E-02 2,59E-02 2,92E-02 PTSaq [mol/l] PTSorg [mol/l] 1,00E-01 0,00E+00 9,55E-02 4,50E-03 8,71E-02 8,51E-02 8,32E-02 6,76E-02 6,61E-02 6,46E-02 6,38E-02 6,17E-02 1,29E-02 1,49E-02 1,68E-02 3,24E-02 3,39E-02 3,54E-02 3,62E-02 3,83E-02 PTSaq [mol/l] PTSorg [mol/l] 1,00E-01 0,00E+00 1 9,66E-02 3,39E-03 4 6 11 12 15 29 49 71 9,33E-02 9,12E-02 9,02E-02 8,91E-02 8,71E-02 8,32E-02 7,59E-02 6,92E-02 6,67E-03 8,80E-03 9,84E-03 1,09E-02 1,29E-02 1,68E-02 2,41E-02 3,08E-02 norg 120 [RPM] 11 Elektrode Ringelektrode 13 Hochspannung 5 [KV] 16 Feldstärke 4,545 [KV/cm] 18 Parameter der Fitfunktion aq-1 25 b 9,75E-02 33 c 1,06E+00 42 d 1,39E+02 51 EZ-Versuch 8 Versuchsdaten Zeit PTS 0,10 [mol/l] [min] [%Vol.] TOA 5,00 0 naq 90 [RPM] 8 norg 120 [RPM] 41 Elektrode Ringgitterelektrode 47 Hochspannung 0 [KV] 61 Feldstärke 0,00 [KV/cm] 151 Parameter der Fitfunktion aq-1 162 b 9,91E-02 166 c 1,08E+00 171 d 3,50E+02 188 EZ-Versuch 9 Versuchsdaten Zeit PTS 0,10 [mol/l] [min] [%Vol.] TOA 5,00 0 naq 90 [RPM] norg 120 [RPM] Elektrode Ringgitterelektrode Hochspannung 2,9 [KV] Feldstärke 2,07 [KV/cm] Parameter der Fitfunktion aq-1 b 9,53E-02 c 1,07E+00 d 2,05E+02 LII ANHANG EZ-Versuch 10 PTS TOA naq Versuchsdaten 0,10 5,00 90 [mol/l] [%Vol.] [RPM] Zeit [min] PTSaq [mol/l] PTSorg [mol/l] 0 1,00E-01 0,00E+00 0 9,77E-02 2,28E-03 1,00E-01 1,00E-01 9,77E-02 9,55E-02 8,91E-02 8,51E-02 7,94E-02 7,59E-02 0,00E+00 0,00E+00 2,28E-03 4,50E-03 1,09E-02 1,49E-02 2,06E-02 2,41E-02 PTSaq [mol/l] PTSorg [mol/l] 1,00E-01 9,89E-02 0,00E+00 1,14E-03 9,02E-02 9,84E-03 8,04E-02 7,33E-02 6,53E-02 5,96E-02 5,43E-02 3,85E-02 3,05E-02 2,60E-02 1,96E-02 2,67E-02 3,47E-02 4,04E-02 4,57E-02 6,15E-02 6,95E-02 7,40E-02 PTSaq [mol/l] PTSorg [mol/l] 1,00E-01 9,77E-02 0,00E+00 2,28E-03 9,33E-02 6,67E-03 9,12E-02 8,91E-02 8,32E-02 7,08E-02 5,62E-02 5,01E-02 4,68E-02 4,27E-02 8,80E-03 1,09E-02 1,68E-02 2,92E-02 4,38E-02 4,99E-02 5,32E-02 5,73E-02 norg 120 [RPM] 1 Elektrode Ringgitterelektrode 2 Hochspannung 7 [KV] 3 Feldstärke 5 [KV/cm] 5 Parameter der Fitfunktion aq-1 9 b 9,78E-02 17 c 1,12E+00 30 d 1,34E+02 40 EZ-Versuch 11 Versuchsdaten Zeit PTS 0,10 [mol/l] [min] [%Vol.] TOA 5,00 0 TOAHCl 1,00E-04 [mol/l] 1 naq 90 [RPM] 9 norg 120 [RPM] 16 Elektrode Spiralelektrode 24 Hochspannung 0 [KV] 33 Feldstärke 0,00 [KV/cm] 40 Parameter der Fitfunktion aq-1 47 b 9,97E-02 84 c 1,21E+00 111 d 8,50E+01 133 EZ-Versuch 12 Versuchsdaten Zeit PTS 0,10 [mol/l] [min] [%Vol.] TOA 5,00 0 TOAHCl 1,00E-04 [mol/l] 2 naq 90 [RPM] 6 norg 120 [RPM] 8 Elektrode Spiralelektrode 12 Hochspannung 25 [KV] 14 Feldstärke 25 [KV/cm] 25 Parameter der Fitfunktion aq-1 41 b 1,01E-01 49 c 1,19E+00 54 d 6,71E+01 64 LIII ANHANG EZ-Versuch 13 Versuchsdaten ZnCl2 HCl D2EHPA naq 0,005 0,01 0,06 90 [min] 0 2 H+aq [mol/l] 1,00E-03 1,32E-03 3 1,55E-03 Zeit [mol/l] [mol/l] [mol/l] [RPM] norg 120 [RPM] 5 Elektrode Spiralelektrode 8 Hochspannung 0 [KV] 10 Feldstärke 0,00 [KV/cm] 14 Parameter der Fitfunktion aq-1 18 b 8,44E-03 55 c 8,70E+00 95 d 5,33E+01 126 EZ-Versuch 14 Versuchsdaten Zeit ZnCl2 0,005 [mol/l] [min] HCl 0,01 [mol/l] 0 D2EHPA 0,06 [mol/l] 2 naq 90 [RPM] 4 norg 120 [RPM] 11 Elektrode Spiralelektrode 15 Hochspannung 25 [KV] 28 Feldstärke 25 [KV/cm] 41 Parameter der Fitfunktion aq-1 61 b 8,18E-03 90 c 1,06E+01 119 d 6,75E+01 140 1,91E-03 2,34E-03 2,69E-03 2,95E-03 3,31E-03 4,90E-03 5,89E-03 6,46E-03 H+aq [mol/l] 1,00E-03 1,12E-03 1,70E-03 2,34E-03 2,72E-03 3,31E-03 3,80E-03 4,37E-03 5,13E-03 5,69E-03 6,03E-03 Teil 5: Feldeinfluss auf den reaktiven Stoffübergang im System: Schwefelsäure, Wasser/ Trioctylamin, Toluol Ausgangskonzentrationen H2SO4 : 100 mM TOA: 5 % Spannung U: 0 kV Rührerdrehzahlen ORG: 119 W: 160 Zeit [min] 0 16 32 48 60 90 120 H2SO4 [mM] 100 83,01 65,99 57,90 53,04 46,55 44,78 Molverhältnis S zu N ca. 1 zu 1 LIV ANHANG Ausgangskonzentrationen H2SO4 : 100 mM TOA: 5 % Spannung U: 20 kV Rührerdrehzahlen ORG: 119 W: 160 Zeit [min] 0 15 30 47 61 90 120 H2SO4 [mM] 100 80,93 66,69 58,67 53,01 47,66 44,92 Zeit [min] 0 15 30 60 90 120 H2SO4 [mM] 50 46,16 31,90 22,63 18,21 15,92 Zeit [min] 0 15 30 62 90 120 H2SO4 [mM] 50 40,20 29,65 19,49 16,28 13,34 Zeit [min] 0 18 31 48 62 90 120 H2SO4 [mM] 10 7,21 6,35 5,25 4,63 3,95 3,43 Molverhältnis S zu N ca. 1 zu 1 Ausgangskonzentrationen H2SO4 : 50 mM TOA: 5 % Spannung U: 0 kV Rührerdrehzahlen ORG: 119 W: 160 Molverhältnis S zu N ca. 1 zu 2 Ausgangskonzentrationen H2SO4 : 50 mM TOA: 5 % Spannung U: 20 kV Rührerdrehzahlen ORG: 119 W: 160 Molverhältnis S zu N ca. 1 zu 2 Ausgangskonzentrationen H2SO4 : 10 mM TOA: 5 % Spannung U: 0 kV Rührerdrehzahlen ORG: 119 W: 160 Molverhältnis S zu N ca. 1 zu 10 LV ANHANG Ausgangskonzentrationen H2SO4 : 10 mM TOA: 5 % Spannung U: 20 kV Rührerdrehzahlen ORG: 119 W: 160 Zeit [min] 0 15 30 46 64 93 120 H2SO4 [mM] 10 7,05 5,01 3,99 3,28 3,09 3,01 Molverhältnis S zu N ca. 1 zu 10 Stoffsystem: Schwefelsäure, Wasser/Trioctylamin, Toluol (Gleichgewichtsdaten) H2SO4, Start [mM] H2SO4, GG [mM] TOA [%] Molverhältnis N:S Extraktion E [%] 10 6,33 2 1 : 4,58 36,60 10 5,22 2,5 1 : 5,72 47,76 10 2,45 5 1 : 11,45 75,43 10 1,56 10 1 : 22,90 84,33 50 6,47 5 1 : 2,29 87,05 100 24,96 5 1 : 1,14 75,03 Teil 6: Feldeinfluss auf den reaktiven Stoffübergang im System: Essigsäure, Wasser/ Trioctylamin, Toluol Ausgangskonzentrationen HAc : 250 mM TOA: 10 % Spannung U: 0 kV Rührerdrehzahlen ORG: 112 W: 140 Zeit [min] 0 15 34 60 90 HAc [mM] 250 226,64 220,67 223,50 214,35 Molverhältnis Säure zu N ca. 1,25 zu 1 Ausgangskonzentrationen HAc : 250 mM TOA: 10 % Spannung U: 25 kV Rührerdrehzahlen ORG: 112 W: 140 Zeit [min] 0 15 30 62 92 120 HAc [mM] 250 200,15 185,95 174,76 167,79 163,92 Molverhältnis Säure zu N ca. 1,25 zu 1 LVI ANHANG Ausgangskonzentrationen HAc : 166 mM TOA: 10 % Spannung U: 0 kV Rührerdrehzahlen ORG: 112 W: 140 Zeit [min] 0 15 30 60 90 120 HAc [mM] 166 154,96 155,69 154,51 152,89 153,29 Zeit [min] 0 15 30 60 90 120 HAc [mM] 166 151,24 148,81 144,52 140,19 137,50 Molverhältnis Säure zu N ca. 1 zu 1 Ausgangskonzentrationen HAc : 166 mM TOA: 10 % Spannung U: 25 kV Rührerdrehzahlen ORG: 112 W: 140 Molverhältnis Säure zu N ca. 1 zu 1 Teil 7: Feldeinfluss auf den reaktiven Stoffübergang im System: PDS, Wasser/ Trioctylamin, Toluol im Molverhältnis zwischen PDS und TOA von ca. 1:1 Ausgangskonzentrationen PDS : 250 mM TOA: 10 % Spannung U: 0 kV Rührerdrehzahlen ORG: 96 W: 120 Zeit [min] 0 5 10 20 30 45 60 75 90 PDS [mM] 100 80,09 71,13 60,56 52,18 44,41 39,81 37,47 36,20 Ausgangskonzentrationen PDS : 100 mM TOA: 5 % Spannung U: 25 kV Rührerdrehzahlen ORG: 90 W: 120 Zeit [min] 0 5 20 30 45 60 75 90 PDS [mM] 100 81,01 62,10 53,64 45,63 39,87 36,40 35,34 LVII ANHANG Teil 8: Feldeinfluss auf den reaktiven Stoffübergang im System: Sulforhodamin, Wasser/ Trioctylamin, Toluol Ausgangskonzentrationen SRA : 10 µM TOA: 10 % HCl: 0,1 M Spannung U: 0 kV Rührerdrehzahlen ORG: 96 W: 120 Zeit [min] 0 0,5 1 2 3 4 5 10 15 20 30 45 60 90 120 150 180 210 240 SRA [µM] 10 9,82 9,77 9,65 9,53 9,4 9,28 8,69 8,24 7,81 7,03 6,04 5,2 3,88 2,87 2,28 1,72 1,46 1,21 Ausgangskonzentrationen SRA : 10 µM TOA: 10 % HCl: 0,1 M Spannung U: 25 kV Rührerdrehzahlen ORG: 96 W: 120 Zeit [min] 0 0,5 1 2 3 4 5 10 15 20 30 45 60 90 120 150 180 210 240 SRA [µM] 10 9,47 9,4 9,29 9,15 9,02 8,88 8,22 7,66 7,19 6,32 5,22 4,37 3,04 2,21 1,63 1,27 1,03 0,94 LVIII ANHANG Teil 9: Feldeinfluss auf den reaktiven Stoffübergang im System: Citronensäure, Wasser/ Trioctylamin, Toluol Ausgangskonzentrationen HCit : 250 mM TOA: 10 % Spannung U: 0 kV Rührerdrehzahlen ORG: 96 W: 120 Zeit [min] 0 15 30 60 90 HCit [mM] 250 0 167,14 95,36 48,48 Molverhältnis Säure zu N ca. 1,25 zu 1 Ausgangskonzentrationen HCit : 250 mM TOA: 10 % Spannung U: 25 kV Rührerdrehzahlen ORG: 96 W: 120 Zeit [min] 0 15 30 60 90 HCit [mM] 250,00 169,34 137,11 55,81 48,49 Molverhältnis Säure zu N ca. 1,25 zu 1 Ausgangskonzentrationen HCit : 100 mM TOA: 10 % Spannung U: 0 kV Rührerdrehzahlen ORG: 96 W: 120 Zeit [min] 0 10 20 45 60 105 HCit [mM] 100 87,05 81,00 74,95 76,73 75,45 Zeit [min] 0 4,75 10 20 30 45 75 120 HCit [mM] 100 97,08 88,33 82,85 77,09 76,31 78,23 68,49 Molverhältnis Säure zu N ca. 1 zu 2 Ausgangskonzentrationen HCit : 100 mM TOA: 10 % Spannung U: 25 kV Rührerdrehzahlen ORG: 96 W: 120 Molverhältnis Säure zu N ca. 1 zu 2 LIX ANHANG Teil 10: Minderung der Salzsäureextraktion im Binärsystem bei Zugabe einer zweiten Säure, HCl: 100 mM System I HCit : 200 mM TOA: 10 % U: 0 kV Rührerdrehzahlen ORG: 128 W: 160 PKS: 6,39 Minderung: 9,99 % System II PDS : 100 mM TOA: 5 % U: 0 kV Rührerdrehzahlen ORG: 119 W: 160 PKS: 1,52 Minderung: 33,72 % System III PTS : 100 mM TOA: 5 % U: 0 kV Rührerdrehzahlen ORG: 119 W: 160 PKS: -5,8 Minderung: 54,83 % Das Molverhältnis zwischen Säure und dem Ionenaustauscher ist in allen Fällen stets 1 zu 1 Teil 11: Messdaten zum Binärsystem Salzsäure, PTS, Wasser/TOA, Toluol Ausgangskonzentration Zeit RZ [min] c PTSaq [mM] c HClaq [mM] [mM] 0 100 100 PTS 100 3,5 94,02 HCl 100 [mM] 7,4 87,50 93,52 TOA 5 % Vol Umdrehungszahlen 15 75,43 87,45 30 62,71 84,29 n aq 160 [rpm] 45 49,50 82,41 n org 120 [rpm] elektrisches Feld 60,5 43,75 80,39 90,1 27,26 --Spannung U 20 [kV] 121 20,20 85,47 151,5 14,46 87,07 180 10,74 84,55 Ausgangskonzentration Zeit RZ [min] c PTSaq [mM] c HClaq [mM] PTS 100 [mM] 0 100 100 HCl 100 [mM] 3,5 96,65 79,94 TOA 7,5 % Vol 7,2 90,70 76,81 Umdrehungszahlen 15,5 78,25 --n aq 160 [rpm] 30 59,25 55,27 n org 120 [rpm] 45 45,60 50,40 elektrisches Feld 60 32,82 44,39 Spannung U 10 [kV] 90 19,89 43,27 119,7 9,75 38,86 149,8 4,43 34,73 180,5 2,02 46,66 LX ANHANG Ausgangskonzentration Zeit RZ [min] c PTSaq [mM] c HClaq [mM] 100 [mM] 0 100 100 PTS 100 [mM] 3 95,20 HCl 7,5 % Vol 7,5 88,89 85,83 TOA Umdrehungszahlen 15 78,43 82,90 30 61,79 69,89 160 [rpm] n aq 45,5 45,86 53,33 120 [rpm] n org elektrisches Feld 60 33,51 55,57 0 [kV] 90 19,57 50,60 Spannung U 120 --47,81 150 7,85 53,59 180 5,90 49,71 Ausgangskonzentration Zeit RZ [min] c PTSaq [mM] 100 [mM] 0 100 PTS 93,77 3,25 5 % Vol 7 78,95 TOA Umdrehungszahlen 15,1 73,80 160 [rpm] 30 41,25 n aq 120 [rpm] 45 25,87 n org elektrisches Feld 60 16,86 20 [kV] 89 9,36 Spannung U 120 5,63 150 4,69 180 4,34 Ausgangskonzentration Zeit RZ [min] c HClaq [mM] 100 [mM] 0 100 HCl 3 95,88 5 % Vol 7 92,77 TOA Umdrehungszahlen 15 79,65 160 [rpm] 30 60,92 n aq 120 [rpm] 45 47,59 n org elektrisches Feld 60 36,64 20 [kV] 90 26,80 Spannung U 122,25 23,96 150 18,94 180 19,33 LXI ANHANG Teil 12: Messdaten zum Binärsystem Salzsäure, HAc, Wasser/TOA, Toluol TOA: 10 % HCl: 0,2 M Binärsystem Zeit [min] 0 11 25,5 25,5 40 49 59 90 110 120 Binärsystem HAc: 0,2 M U: 0 kV c HCl, w [mmol/l] 200 152,30 106,04 107,39 83,37 73,30 62,74 38,56 27,78 22,94 ORG: W: 128 rpm 160 rpm Zeit [min] 0 11 25,5 39 50 69,5 90 110 120 c HAc,w [mmol/l] 200 187,02 181,93 179,59 176,67 172,89 171,84 167,49 166,72 TOA: 10 % HCl: 0,2 M Binärsystem Zeit RZ [min] 0 13 25 41 50,25 77 96,5 111 120 Binärsystem HAc: 0,2 M U: 20 kV c HCl, w [mmol/l] 200 125,23 84,66 59,48 50,33 34,05 30,57 25,23 24,24 ORG: W: 128 rpm 160 rpm Zeit RZ [min] 0 13 25 41 50,25 77 97,5 111 c HAc,w [mmol/l] 200 185,95 181,86 168,50 166,71 168,48 163,71 161,92 LXII ANHANG TOA: 10 % Referenzprobe Essigsäure Zeit [min] 0 10 20 35,25 51,5 70 95 110 120 Teil 13: Reinsystem Essigsäure U: 0 kV c HAc, w [mmol/l] 200 199,70 199,50 193,77 189,04 188,89 184,08 183,07 182,83 128 160 U: 20 kV c HAc,w [mmol/l] 200 199,2 197,53 197,01 186,23 180,25 179,34 171,45 161,37 Vorprotonierung des Ionenaustauschers, Stoffsystem: Schwefelsäure, Wasser/TOAHCl, Toluol Vorprotonierung des IT TOAHCl: 5 % H2SO4 U: 0 kV Zeit c HAcl, w [min] [mmol/l] 0 10 30 45 60 90 137 155 182 ORG: W: Essigsäure Zeit [min] 0 11,5 20 30 51 73,5 90 106,5 138,5 6,69 5,78 5,42 4,72 4,68 4,67 4,47 ORG: W: H2SO4 Zeit [min] 0 15 30,5 45 59,6 90 120 153 180,5 128 160 U: 20 kV c HAc,w [mmol/l] 10 6,44 4,26 4,41 4,80 4,60 4,61 5,15 4,89 LXIII ANHANG Teil 14: Aceton Wasser/Toluol in Elektrorührzelle Stoffübergangsrichtung: W → ORG W: 38 rpm ORG: 27 rpm U: 0 kV Zeit [min] Aceton, w [mM] 0 100 5 89,73 10 88,54 20 85,40 30 82,75 45 79,95 60 76,90 Stoffübergangsrichtung: W → ORG W: 38 rpm ORG: 27 rpm U: 0 kV Zeit [min] Aceton, w [mM] 0 500 5 428,12 10 412,35 20 392,65 30 373,98 45 351,47 60 345,38 F3 Startkonzentration Aceton: 100 mM Zeit [min] 0 5 10 20 30 45 60 U: 20 kV Aceton, w [mM] 100 88,91 86,37 84,40 81,46 77,70 74,73 Startkonzentration Aceton: 500 mM Zeit [min] 0 5 10 20 30 45 60 U: 20 kV Aceton, w [mM] 500,47 419,19 398,02 357,81 337,40 319,12 304,33 Einzeltropfenexperimente Teil 1: Tropfengröße im elektrischen Feld, Kapillardurchmesser: AD: 1,5; ID: 0 ,25 [mm] Spannung [kV] 0 0,5 1 1,1 1,2 1,3 1,4 1,5 1,6 1,7 1,8 1,9 2 Tropfendurchmesser [LE] 1,125 1,1 0,975 0,95 0,9 0,8 0,75 0,675 0,625 0,575 0,4 0,3 0,25 Tropfenvolumen normiert [-] 1 0,93 0,65 0,60 0,51 0,35 0,29 0,21 0,17 0,13 0,04 0,02 0,01 LXIV ANHANG Teil 2: Stoffübergangsversuche in der Tropfensäule, PTSaq. → organisch Tropfensäule: PTS, Wasser/Toluol Ausgangskonzentration Fallhöhe [cm] caq PTS [mM] Verweilzeit [s] PTS 100 [mM] 0 45,73 0,00 TOA 5 [%] 5 42,45 0,98 Elektrisches Feld 20 33,51 3,92 Spannung U 6,18 [kV] 40 28,11 7,84 Stoffübergangsrichtung: 60 18,34 11,76 wässrig (Dispersphase) nach organisch (Kontiphase) Flow: 0,18 [ml/min] Elektrodenabstand: 4 cm, Plattenelektroden Kapillare und Platte geerdet, Kapillare: AD: 1,5 mm, ID: 0,25 mm Tropfensäule: PTS, Wasser/Toluol Ausgangskonzentration Fallhöhe [cm] caq PTS [mM] Verweilzeit [s] PTS 100 [mM] 0 60,73 0,00 TOA 5 [%] 5 46,24 0,70 Elektrisches Feld 20 40,24 2,82 Spannung U 0 [kV] 40 34,43 5,63 Stoffübergangsrichtung: 60 26,77 8,45 wässrig (Dispersphase) nach organisch (Kontiphase) Flow: 0,18 [ml/min] Elektrodenabstand: 4 cm, Plattenelektroden Kapillare und Platte geerdet, Kapillare: AD: 1,5 mm, ID: 0,25 mm F4 Stoffübergangsversuche im Taylor-Couette Elektroextraktor Teil 1: Physikalischer Stoffübergang (Aceton, Wasser/Toluol) Gegenstrombetrieb Ausgangskonzentration Aceton: 1000 mM Aceton, w. → organisch Konzentrationen: Wässrige Phase Ringspalt: 2 cm Phasenverhältnis o/w 1:1 Außenzylinder: 50 rpm Innenzylinder: 650 rpm Flow, org: 5 ml/min Flow, w: 5 ml/min Zeit [min] 0 2,15 3,15 4,5 7,15 9,5 11,5 14,5 17 24 30,5 40 U: 0 kV Aceton [mM] 1000 910,08 827,80 813,37 801,49 793,86 792,40 785,83 788,06 784,15 785,28 787,89 Zeit [min] 0 0,5 1,5 2,833 5 6,5 10,5 15,5 23 30,65 40,5 60 U: 5 kV Aceton [mM] 1000 978,45 716,80 711,81 708,51 712,38 723,67 729,43 744,67 735,88 737,30 721,15 LXV ANHANG Teil 2: Reaktiver Stoffübergang von p-Toluolsulfonsäure (PTS, Wasser/TOA, Toluol) Gegenstrombetrieb Ausgangskonzentration PTS: 100 mM, TOA: 5% PTS, w. → organisch Ringspalt: 2 cm Phasenverhältnis o/w 1:1 Außenzylinder: 50 rpm Innenzylinder: 630 rpm Flow, org: 0 ml/min Flow, w: 0 ml/min Zeit [min] 0 0,83 2 3,5 9 16 21,5 35,16 U: 0 kV PTS [mM] 100 97,99 53,61 5,36 2,97 2,58 2,67 2,74 Zeit [min] 0 1,5 3,33 5,33 8,5 15 25 30 U: 10 kV PTS [mM] 100 71,88 11,63 2,37 1,41 0,86 0,66 0,72 Teil 3: Reaktiver Stoffübergang von Essigsäure (Essigsäure, Wasser/TOA, Toluol) Gegenstrombetrieb Ausgangskonzentration Aceton: 1000 mM Aceton, w. → organisch Konzentrationen: Wässrige Phase Ringspalt: 2 cm Phasenverhältnis o/w 1:1 Außenzylinder: 0 rpm Innenzylinder: 630 rpm Flow, org: 5 ml/min Flow, w: 5 ml/min Zeit [min] 0 2,15 3,15 4,5 7,15 9,5 11,5 14,5 17 24 30,5 40 60 U: 0 kV Aceton [mM] 1000 910,08 827,80 813,37 801,49 793,86 792,40 785,83 788,06 784,15 785,28 787,89 783,41 Zeit [min] 0 0,5 1,5 2,833 5 6,5 10,5 15,5 23 30,65 40,5 60 U: 10 kV Aceton [mM] 1000 978,46 716,81 711,82 708,51 712,39 723,67 729,43 744,68 735,88 737,31 721,16 LXVI ANHANG Anhang G Sonstiges G1 Veröffentlichungen A. Wildberger, H.-J. Bart (2005), Kontinuierlich betriebene Flüssig-Flüssig Extraktion im elektrischen Hochspannungsfeld (DC) in einem Taylor-Couette Elektroextraktor, Chem. Ing. Techn., eingereicht. A. Wildberger, H.-J. Bart (2002), Influencing the rate of mass transfer in reactive extraction using high voltage, Proc. Int. Solv. Extr. Conf., 18.-21. March 2002, Cape Town, South Africa, 251-256. A. Wildberger, S. Schmidt, H.-J. Bart (2001), Mass transfer enhancement in reactive extraction by an electric field, Proc. ECCE, P 056, 26.-28. July 2001, Nuremberg, Germany, 1-6. A. Wildberger, A. Schöneberger, H.-J. Bart (2000), Schwermetallextraktion mittels multifunktioneller Extraktionsmittel-Imprägnierter Polymere, vom Wasser, 95, 237-244. A. Schöneberger, H.-J. Bart, A. Nanoti, A. Wildberger, (2000), Extraction chromatography: equilibria and kinetics, Proc. Int. Solv. Extr. Conf., 11.-16. July 1999, Barcelona, Spain, 927-932. A. Wildberger, A. Schöneberger, H.-J. Bart (2000), Removal of heavy metals from waste waters with solvent impregnated resins, Biologische Abwasserreinigung, 14, 67-78. H.-J. Bart, M. Mörters, A. Neu, A. Wildberger (2000), Entfernung von Schadstoffen aus Abwasser mittels reaktiver Verfahren, Proc. FUE Symposium Abwasser-AltlastenRecycling, 09.-10. Februar 2000, Kaiserslautern, 10-16. A. Wildberger (1999), Untersuchung zu dem Reaktionsgleichgewicht bei der Schwermetallsorption mittels Extraktionsmittel-Imprägnierter Polymere, Diplomarbeit, Universität Kaiserslautern. LXVII ANHANG G2 Tagungsbeiträge Poster und Vortrag: A. Wildberger, H.-J. Bart (2003), Kontinuierlich betriebene FlüssigFlüssig Extraktion im elektrischen Hochspannungsfeld (DC) in einem Taylor-Couette Elektroextraktor, DECHEMA/GVC Jahrestagung, 16.-18. September 2003, Mannheim. Poster: A. Wildberger, H.-J. Bart (2003), Kontinuierlich betriebene Flüssig-Flüssig Extraktion im elektrischen Hochspannungsfeld, Workshop SPP 1105 und SFB 540, 11.-12. Juni 2003, Aachen. Poster: A. Wildberger, H.-J. Bart (2002), Einfluss von Grenzflächenladungen und äußeren elektrischen Feldern auf den reaktiven Stoffaustausch, Workshop SPP 1105 und SFB 540, 04.-05. November 2002, Aachen. Vortrag: A. Wildberger, H.-J. Bart (2002), Stoffübergang im elektrischen Feld, Workshop SPP 1105, 26.-28. Juni 2002, Golm. Vortrag: A. Wildberger, H.-J. Bart (2002), Reaktiver Stoffübergang im elektrischen Feld, DECHEMA/GVC Fachausschuss „Extraktion“, 11.-12. April 2002, Bingen. Vortrag: A. Wildberger, H.-J. Bart (2002), Influencing the rate of mass transfer in reactive extraction using high voltage, Proc. Int. Solv. Extr. Conf., 18.-21. March 2002, Cape Town, South Africa, 251-256. Poster: A. Wildberger, H.-J. Bart (2001), Einfluss von Grenzflächenladungen und äußeren elektrischen Feldern auf den reaktiven Stoffaustausch, Kolloquium SPP 1105, 29.-30. November 2001, Darmstadt. Poster: A. Wildberger, S. Schmidt, H.-J. Bart (2001), Mass transfer enhancement in reactive extraction by an electric field, Proc. ECCE, P 056, 26.-28. July 2001, Nuremberg, Germany, 1-6. Vortrag: A. Wildberger, H.-J. Bart (2001), Einfluss von Grenzflächenladungen und äußeren elektrischen Feldern auf den reaktiven Stoffaustausch, Workshop SPP 1105, 19.-21. Juni 2001, München. LXVIII ANHANG Vortrag: A. Wildberger (2001), Electro extraction: mass transfer, Extraktionssymposium, 13. Februar 2001, Kaiserslautern. Poster: A. Wildberger, H.-J. Bart (2000), Einfluss von Grenzflächenladungen und äußeren elektrischen Feldern auf den reaktiven Stoffaustausch, Kolloquium SPP 1105, November 2000, Darmstadt. Poster: A. Wildberger, A. Schöneberger, H.-J. Bart (2000), Schwermetallextraktion mittels multifunktioneller Extraktionsmittel-Imprägnierter Polymere, Proc. GDCh Jahrestagung der wasserchemischen Gesellschaft, 29.-31. Mai 2000, Weimar, 403-406. Poster: A. Schöneberger, H.-J. Bart, A. Nanoti, A. Wildberger, (2000), Extraction chromatography: equilibria and kinetics, Proc. Int. Solv. Extr. Conf., 11.-16. July 1999, Barcelona, Spain, 927-932. Vortrag: A. Wildberger, A. Schöneberger, H.-J. Bart (2000), Removal of heavy metals from waste waters with solvent impregnated resins, Kolloquium des SFB 193, 20.-21. November 2000, Berlin. Vortrag: H.-J. Bart, M. Mörters, A. Neu, A. Wildberger (2000), Entfernung von Schadstoffen aus Abwasser mittels reaktiver Verfahren, Proc. FUE Symposium AbwasserAltlasten-Recycling, 09.-10. Februar 2000, Kaiserslautern, 10-16. Poster: A. Wildberger, H.-J. Bart (1999), Einfluss von Grenzflächenladungen und äußeren elektrischen Feldern auf den reaktiven Stoffaustausch, Kolloquium SPP 1105, 05. November 1999, Darmstadt. LXIX ANHANG G3 Betreute Studien- und Diplomarbeiten Anspach, S. (2003), Konstruktion und Inbetriebnahme eines kontinuierlich arbeitenden Taylor-Couette Extraktors zur Flüssig-Flüssig Extraktion im elektrischen Hochspannungsfeld, Studienarbeit am Lehrstuhl für Thermische Verfahrenstechnik im Fachbereich Maschinenbau und Verfahrenstechnik, Technische Universität Kaiserslautern. Hoogen, M. (2003), Untersuchungen zum reaktiven Stoffübergang organischer Säuren im elektrischen Gleichspannungsfeld, Studienarbeit am Lehrstuhl für Thermische Verfahrenstechnik im Fachbereich Maschinenbau und Verfahrenstechnik, Technische Universität Kaiserslautern. Schenkel, J. (2000), Untersuchung des Gleichgewichtsverhaltens bei der reaktiven Extraktion von p-Toluolsulfonsäure unter Verwendung von Tri-n-octylamin, Diplomarbeit am Lehrstuhl für Thermische Verfahrenstechnik im Fachbereich Maschinenbau und Verfahrenstechnik, Fachhochschule Kaiserslautern und Universität Kaiserslautern. Schmidt, S. A. (2000), Untersuchung der Stoffübergangskinetik von p-Toluolsulfonsäure bei der reaktiven Elektroextraktion, Diplomarbeit am Lehrstuhl für Thermische Verfahrenstechnik im Fachbereich Maschinenbau und Verfahrenstechnik, Universität Kaiserslautern. LXX ANHANG G4 Lebenslauf Name: Andreas Wildberger Geburtsdatum: 30.05.1973 Geburtsort: Ludwigshafen am Rhein Staatsangehörigkeit: deutsch Familienstand: ledig Schulausbildung 1979 - 1981 Grundschule Roxheim 1981 - 1983 Grundschule Zellertal 1983 - 1992 Gymnasium Weierhof am Donnersberg (Abitur: 23.06.1992) Hochschulausbildung 10/92 – 09/96 Universität Kaiserslautern, Studium der Chemie Vordiplom: 20.02.1995 10/96 – 03/97 University of Edinburgh, Studium der Chemie 04/97 – 03/99 Universität Kaiserslautern, Studium der Chemie Hauptvertiefungsrichtung: Analytische Chemie Diplomarbeit in Technischer Chemie Diplom: 31.03.1999 Berufstätigkeit 04/99 – 09/04 wissenschaftlicher Mitarbeiter und Promotionsstudent an der Technischen Universität Kaiserslautern seit 10/04 stellvertretender Abteilungsleiter am Deutschen Institut für Kautschuktechnologie e. V. im Bereich Werkstoffentwicklung in Hannover LXXI