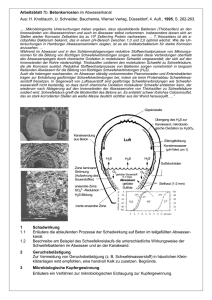
Elementares Schmp.[°C] Farbe Vorkommen Sauerstoff O O2
Werbung
![Elementares Schmp.[°C] Farbe Vorkommen Sauerstoff O O2](http://s1.studylibde.com/store/data/009044601_1-980725b348afa2fec9b2e0a4c148c872-768x994.png)
202
21 Die Chalkogene (Erzbildner, 6.HG, 16. Gruppe des PSE)
-
weil sie namentlich mit den beiden ersten Gliedern (in Form der Oxide und Sulfide)
maßgeblich am Aufbau der natürlichen Erze beteiligt sind.
Erze:
Metallhalige Gesteine und Mineralgemenge, aus denen mit technischen Methoden und mit
wirtschaftlichem Nutzen Metalle oder Metallverbindungen gewonnen werden.
Minerale: Homogene, durch natürliche Vorgänge entstandene Festkörper
Elementares
Vorkommen
Schmp.[°C]
Farbe
Sauerstoff
O
O2
-219
hellblau
Schwefel
S
S8
120
gelb
Selen
Se
Sex
220
grau
Tellur
Te
Tex
450
braun
Polonium
Po
254
Nichtmetalle
Halbmetalle
Metall
(radioaktiv)
203
Valenzelektronenkonfiguration ns2p4 (n = 2 bis 6)
.A.
+ 2e
A 2-
+ 2H.
H
A H
A = Atom
Dimerisierung;
Ring-und Kettenbildung
A A
; A8, Ax (A A A)
Edelgaselektonenkonfiguration
Chalkogenide
Oxide
Sulfide
Selenide
Telluride
Chalkogenwasserstoffe
Wasser
Schwefelwasserstoff
Selenwasserstoff
Tellurwasserstoff
O2 Disauerstoff
S8 Cyclooctaschwefel
Sex (grau)
Ketten
Tex
Kovalente Verbindungen
(Sonderstellung des Sauerstoffs)
Elektronegativität
O
3,5
S
2,44
Valenzorbitale
2s, 3 x 2p
maximale
Bindigkeit
Oxidationszahlen
+
H
drei H O H
-II, -I, 0 ,
C O
Se
2,48
Te
2,01
neben
s- und p-Orbitalen
auch
sechs (SF6)
unbesetzte
d-Orbitale
(+II in Fluorverb.)
-II (S2-, H2S)
0 (S8)
+IV (SO32-)
+VI (SO42-)
204
21.1 Schwefel
Vorkommen:
in freiem (elementar als Cyclooctaschwefel und gebundenem Zustand (vorwiegend sulfidisch und
sulfatisch)
Die Sulfide bezeichnet man je nach ihrem Aussehen als Kiese, Glanze und Blenden.
Eisenkies (Schwefelkies, Pyrit) FeS2
auf Calcit, CaCO3
205
Bleiglanz, PbS auf Dolomit, CaMg(CO3)2
Zinkblende, ZnS mit niedrigem Fe-Gehalt,
gelb (Honigblende od. karamellisierte Blende),
rot (Rubinblende) auf Calcit, CaCO3
206
Wichtige Sulfate in der Natur sind Calciumsulfat (Gips, CaSO4 2H2O und Anhydrit, CaSO4),
Magnesiumsulfat (Bittersalz, MgSO4 7H2O und Kieserit, MgSO4 H2O) und Bariumsulfat
(Schwerspat, BaSO4).
Als Bestandteil der Eiweißstoffe (Aminosäuren Methionin und Cystein) findet sich Schwefel in der
Biosphäre auch organisch gebunden. Der Mensch enthält ca. 2,5 g des essentiellen Elements Schwefel
pro kg Gewebe; schwefelreich sind insbesondere die Haare und Nägel. Der bei der Verwesung von
Tierleichen oder beim Faulen von Eiern auftretende üble Geruch rührt hauptsächlich von
Schwefelverbindungen (Schwefelwasserstoff, H2S und Mercaptanen, RSH her), die sich bei der
Eiweißfäulnis bilden. Steinkohlen - die pflanzlichen Ursprungs sind - weisen bis zu 8 % Schwefel,
teils in organischer, teils in Form von Schwefelkies auf. Erdöl enthält ebenfalls organisch gebundenen
Schwefel, Erdgas Schwefelwasserstoff.
Modifikationen:
Es gibt Stoffe (neben Schwefel z. B. auch Phosphor, Kohlenstoff, Zinn, Eisen, Quecksilbersulfid), die
je nach Zustandsbedingungen (Temperatur, Druck) in verschiedenen festen Zustandsformen
(Modifikationen) existieren (bei Schwefel - und -Schwefel). Diese Erscheinung nennt man
Polymorphie (Vielgestaltigkeit) und spricht von polymorphen Modifikationen. Die bereits beim
Sauerstoff beobachtete Erscheinung, dass Elemente zudem in verschiedenen Molekülgrößen auftreten
(bei Sauerstoff O2 und O3) bezeichnet man als Allotropie (Umwandlung in etwas anderes) und spricht
von allotropen Modifikationen. Die ausgeprägte Tendenz des Schwefels Ringe oder Ketten
auszubilden, ist die Ursache für die Bildung einer Vielzahl allotroper Modifikationen (Ringe z. B.: S10,
S8, S7, S6, Kettenschwefel (µ-Schwefel) Sx, x = 103-106).
Die bei Raumtemperatur stabile Molekülgröße wird durch kronenförmig gebaute (gewellte) S 8-Ringe
(Cyclooctaschwefel, Kronenschwefel) repräsentiert, in dem die S-Atome durch Einfachbindungen
verbunden sind.
S8 (Cyclooctaschwefel, Kronenschwefel)
S
S
S
S
S
S
S
S
207
Vom festen S8-Schwefel gibt es zwei polymorphe Modifikationen. Bei Raumtemperatur ist der
rhombische Schwefel (-Schwefel, -S8) thermodynamisch am stabilsten. Er bildet schwefelgelbe
rhombische Kristalle. Bei 95,6 °C wandelt sich der -Schwefel unter geringem Wärmeverbrauch
langsam in eine zweite, fast farblose, Modifikation den monoklinen Schwefel oder -Schwefel ( -S8)
um. Monokliner Schwefel kristallisiert in Nädelchen.
Blockartiger, zitronengelber, rhombischer (a)
und nadelförmiger, hellgelber, monokliner (b)
Schwefel
a
b
Die Umwandlung von - in -Schwefel ist reversibel. - und -Schwefel sind unlöslich in Wasser,
aber sehr gut löslich in Schwefelkohlenstoff, CS2. Oberhalb der Umwandlungstemperatur (96,5 °C) ist
nur
der
monokline,
unterhalb
nur
der
rhombische
Schwefel
beständig;
die
Umwandlungsgeschwindigkeit ist allerdings unter normalen Bedingen so klein, dass beispielsweise
Nadeln des bei höherer Temperatur gewonnenen monoklinen Schwefels bei Zimmertemperatur erst im
Laufe einiger Tage unter Bildung kleiner rhombischer Kriställchen zerfallen.
Beim Erwärmen über den Schmelzpunkt hinaus bilden sich Modifikationen, die sich in der
Molekülgröße unterscheiden (Versuch):
- Raumtemperatur:
-S8
- T > 95,6 °C:
-S8
- T > 119 °C:
hellgelbe, leicht bewegliche Flüssigkeit, die mit zunehmender Temperatur
undDauer des Erwärmungsvorganges abnehmende Mengen an S8-Ringen
(-Schwefel) und zunehmende Mengen an -Schwefel (niedermolekulare
Schwefelringe Sn, n hauptsächlich 6,7,9,12) sowie µ-Schwefel
(hochmolekularer, aus großen Ringen und langen Ketten bestehend) enthält.
- T = 159 °C :
plötzliche Zunahme der Viskosität, Schmelze wird dunkelrot, überwiegende
Bildung von µ-Schwefel
208
- T > 243 °C:
Abnahme der Viskosität, durch die Abnahme der mittleren Kettenlänge des
µ-Schwefels. Die Lösung ist jetzt tief braun-rot gefärbt. Durch Eingießen in kaltes Wasser
(Abschrecken) wird plastischer Schwefel (unterkühlte Schmelze, hauptsächlich - und µ-Schwefel)
erhalten.
- T > 445 °C:
Schwefel geht in die Dampfphase über, in der neben S8 mit zunehmender
Temperatur auch S7- , S6-, S5-, S4-, S3- und S2-Moleküle vorliegen. S2 und S3 entsprechen den
Sauerstoffmodifikationen O2 und Ozon, O3. S-Atome überwiegen erst ab Temperaturen oberhalb von
2200 °C. Bei langsamem Abkühlen treten alle genannten Zustande des Schwefels in umgekehrter
Reihenfolge auf.
Gewinnung:
a) Aus natürlichen Vorkommen:
Durch Tagebau oder in tieferen, Schwefel führenden Gesteinsschichten nach dem Frash-Verfahren
durch Ausschmelzen mit überhitztem Wasserdampf (155 - 157 °C) unter einem Druck von 25 bar. Der
heiße Wasserdampf wird durch ein äußeres Rohr eingepresst, so dass der Schwefel schmilzt
(Smp. 119 °C). Durch ein inneres Rohr tritt heiße Pressluft unter einem Druck von 40 bar ein,
wodurch der geschmolzene Schwefel als Schaum durch ein mittleres Rohr nach oben gepresst wird.
Gewinnung von elementarem Schwefel durch
das Frash-Verfahren
b) Aus Schwefelwasserstoff:
Technisch fällt H2S in riesigen Mengen bei der Erdölentschwefelung sowie bei der Förderung „saurer“
Erdgase an. Die Umwandlung des Schwefelwasserstoffs in Schwefel erfolgt ganz allgemein durch
Verbrennen mit Sauerstoff in Gegenwart von Katalysatoren in zwei Stufen,
209
H2S + 3 O2
2
H2O
= -518 kJ/mol (1)
3S
8 8
+ 2H2O
= -146 kJ/mol (2)
3S
8 8
+ 3H2O
= -664 kJ/mol (3)
SO2 +
SO2 + 2H2S
3H2S + 3 O2
2
da bei direkter Oxidation zu Schwefel gemäß (3) die gesamte Verbrennungsenthalpie im Kontakt frei
wird, wo sie nur schwierig zu beherrschen ist (bei zu hoher Temperatur entsteht SO2 statt S).
Die Zerlegung des Vorgangs in die beiden Stufen (1) und (2), von denen nur die zweite – schwächer
exotherme – eines Katalysators bedarf, beseitigt diese Schwierigkeit. Bei diesem als Claus-Verfahren
bezeichneten Prozess wird das H2S-haltige Gas im Gemisch mit der gemäß (3) benötigten Menge
Sauerstoff zunächst in einer Brennkammer zur Reaktion gebracht (60 – 70 % Umsatz zu Schwefel,
Rest H2S und SO2) und anschließend in einem ersten Reaktor bei 300 °C an einem Co/Mo-Katalysator
(fein verteilt auf Al2O3) sowie in einem zweiten Reaktor bei 170 °C an einem oberflächenreichen
Al2O3-Katalysator praktisch vollständig in Schwefel verwandelt.
Die Komproportionierungsreaktion (2) verläuft nur in Gegenwart geeigneter Katalysatoren (Co/Mo,
Al2O3). Auch Wasser katalysiert diese Reaktion: Während ein Gemisch aus völlig trockenem SO2 und
H2S metastabil ist, wird mit etwas Wasser schlagartig Schwefel gebildet.
Verwendung:
90°% gehen in die Schwefelsäureproduktion. Weitere Verwendungsgebiete sind die
Zündholzindustrie, die Vulkanisation von Kautschuk, die Herstellung von Feuerwerkskörpern,
Schwarzpulver, Malerfarben und Schwefelkohlenstoff, CS2.
Chemische Eigenschaften:
S8-Schwefel verbindet sich schon bei mäßig erhöhter Temperatur mit fast allen Metallen und
Nichtmetallen (ausgenommen Gold, Platin, Iridium, Stickstoff, Tellur, Iod und Edelgase). Vielfach
verlaufen diese Redox-Reaktionen des Schwefels, bei denen er meist reduziert, seltener oxidiert wird,
unter großer Wärmeabgabe.
Versuche:
) Erhitzen mit Eisenspäne
Fe + 1 S8
8
FeS
95 kJ/mol
Erhitzen an der Luft, Verbrennung mit blauer Flamme zu Schwefeldioxid
1S + O
2
8 8
SO2
H = 297 kJ/mol
210
21.1.1 Verbindungen des Schwefels
a) Schwefelwasserstoff, H2S
Struktur:
gewinkelt
+I
-II
S
H
+I
H
S
H
92,3° Elektronegativität 2,4 2,2
Vergleich mit anderen Chalkogenwasserstoffen:
H2O
H2S
H2Se
H2Te
Siedepunkt [°C]
+100
- 60,8
- 41,5
- 1,8
Bildungsenthalpie [kJ/mol]
- 285
- 20,1
+77,4
+143
MAK-Wert [mg/m3]
-
15
0,2
0,1
Während die Siedetemperatur von H2S, H2Se und H2Te insofern „normal“ verlaufen, als sie
entsprechend der Zunahme der Molmassen in diese Richtung ansteigen, zeigt sich beim Wasser eine
„Anomalie“. Der „zu hohe“ Siedepunkt ist eine Folge der Assoziierung der H2O-Moleküle über
Wasserstoffbrücken (s. S. 103); s.a. das vergleichbare Phänomen beim Fluorwasserstoff, S.193). Die
Bildungsenthalpien von H2Se und H2Te sind positiv, d.h. dass diese Verbindungen thermodynamisch
instabil sind. H2S, H2Se und H2Te sind hochgiftige, übel riechende (faule Eier: H2S, fauler Rettich:
H2Se) Gase. Als Anhaltspunkte für ihre Giftigkeit mögen die MAK-Werte (MAK = maximale
Arbeitsplatzkonzentration) in obiger Tabelle gelten. Zum Vergleich HCN (Blausäure) : 11, CO : 55
mg/m3 Luft. Die Toxizität von H2S beruht auf der Blockierung des Eisens im Hämoglobin. Man
erkennt außerordentlich geringe Mengen an H2S am Geruch. Der charakteristische Geruch nach faulen
Eiern ist noch in einer Verdünnung von 1 : 100000 wahrzunehmen. Die Geruchempfindlichkeit sinkt
allerdings deutlich bei längerer Einwirkung und höherer Konzentration.
211
Geruchsschwellen
Stoff
Trimethylamin
Buttersäure
Schwefelwasserstoff
Blausäure
Stickstoffdioxid
Chlor
Konzentration in mg · m-3
0,0005
0,004
0,007
0,65
0,75
0,88
Essigsäure
2,5
Phosgen
3,7
Benzol
16,0
Ammoniak
33,0
Methanol
Aceton
133,0
278,0
Vorkommen:
H2S kommt in größeren Mengen im Erdöl und insbesondere im Erdgas vor. Auch entströmt er in
vulkanischen Gegenden vielfach der Erde. Eine geringe H2S - Konzentration ist ein wichtiger
Bestandteil der Schwefelheilquellen. Er bildet sich bei der Fäulnis schwefelhaltiger organischer Stoffe
(Eiweiße); so rührt der üble Geruch fauler Eier größtenteils von Schwefelwasserstoff her.
Darstellung:
) In der Technik
- aus den Elementen (sehr reiner H2S)
H 2 + 1 S8
8
600°C
Kat.
H2S
21 kJ/mol
und bei der Entschwefelung fossiler Brennstoffe (Erdölentschwefelung – Hydrodesulfurierung,
Absorbieren von H2S durch schwache Basen aus sauren Erdgasen)
) im Labor { im Kippschen Gasentwickler aus säurezersetzbarem Sulfid, meist FeS (in Stangen oder
Stücken) und Salzsäure (c = 5 mol/l)}
FeS + 2H+ (halbkonz. HCl)
H2S
+ Fe2+
212
Chemische Eigenschaften:
) Mittelstarkes Reduktionsmittel
An der Luft entzündet brennt er je nach der Luftzufuhr mit blauer flamme zu H 2O und SO2 oder zu
H2O und S8 (vergl. S. 209)
Versuche:
vollständige Verbrennung:
-II
0
2H2S + 3O2
-II
unvollständige Verbrennung: 2H2S +
0
O2
-II
+IV-II
2H2O + 2SO2
-II
0
2H2O + 2
8 S8
Schwefelwasserstoff ist sowohl im gasförmigen wie im gelösten Zustand ein mittelstarkes
Reduktionsmittel:
H2S
1 S + 2H+ + 2e8 8
E° = 0,144 V (pH = 0)
S2-
1 S + 2e8 8
E° = 0,476 V (pH = 14)
Die Reduktionskraft nimmt im basischen Milieu zu, da hier die c(H+) viel kleiner ist, was eine
Verschiebung des Redoxgleichgewichtes nach rechts entspricht.
Regel:
Die Redoxpotentiale von Redoxpaaren, an deren Redoxgleichgewichten in saurer Lösung
Wasserstoffionen beteiligt sind, nehmen in basischen Lösungen negativere bzw. weniger positive
Werte an (die Reduktionskraft der reduzierten Form des korrespondierenden Redoxpaares steigt, die
Oxidationskraft der oxidierten Form nimmt dagegen ab, vergl. pH-Abhängigkeit der Oxidationskraft
von MnO4- S. 175)
Versuch:
Oxidation des H2S mit Iod
H2S + I2
2I- + 2H+ + 1
8 S8
Es tritt Entfärbung ein, und Schwefel wird frei, der in sehr feiner Verteilung als milchige Trübung zu
erkennen ist.
) Sehr schwache zweibasige Säure
Der Schwefelwasserstoff hat in wässeriger Lösung den Charakter einer sehr schwachen zweibasigen
Säure:
213
H2S + H2O
H3O+ + HS-
KS(1) = 10-7 mol/l
(1)
HS- + H2O
H3O+ + S2-
KS(2) = 10-13 mol/l
(2)
pH-Wert einer gesättigten H2S-Lösung {c0(H2S) = 0,1 mol/l}:
1
pH [pK S (1) lg c0 (H 2S)]
2
1
(7 1) 4
2
sehr schwach sauer
Als zweibasige Säure bildet der Schwefelwasserstoff zwei Reihen von Salzen. Hydrogensulfide
M I HS und Sulfide M I2S . Lösliche Sulfide (z.B. Na2S) reagieren in Wasser basisch, da das Sulfidion
als korrespondierende Base der sehr, sehr schwachen Anionensäure HS- eine starke Anionenbase ist
(vergl. S. 148 und 149):
S2- + H2O
HS- + OH-
pH-Wert einer Na2S-Lösung c0(Na2S) = 0,1 mol/l:
pKS(HS-) + pKB(S2-) = 14
pKB(S2-) = 14 - 1
=1
pOH
1
pK B (S2 ) lgc0 ( Na 2S)
2
1
1 1
2
=1
pOH + pH = 14
1 + pH = 14
pH = 13
stark basisch
pH-Wert einer NaHS-Lösung c0(NaHS) = 0,1 mol/l:
Das Hydrogensulfidion ist ein Ampholyt (s. S. 149)
214
pH
pK S (HS ) pK S (H 2S) 13 7
10
2
2
schwach basisch
Die Hydrogensulfide sind in Wasser alle leicht löslich. Bei den Sulfiden sind nur die Alkali- und
Erdalkalisulfide leicht löslich. Die meisten anderen Sulfide sind in Wasser schwer löslich. Die
Schwerlöslichkeit von Metallsulfiden benutzt man in der analytischen Chemie im
Kationentrennungsgang dazu, um Metalle aus wässeriger Lösung gruppenweise zu fällen.
) S2- als Fällungmittel
Die Sulfidionen-Konzentration in einer wässerigen Lösung ist pH-abhängig. Die Addition der
Gleichungen (1) und (2) auf der Seite 213 ergibt:
H2S + 2H2O
2H3O+ + S2-
KS(1+2) = KS(1) . KS(2) = 10-20 mol2/l2
(3)
Durch Erhöhung der Hydroniumionenkonzentration (pH-Wert sinkt) wird das Gleichgewicht nach
links verschoben und die Sulfidionenkonzentration nimmt ab, bei pH-Wert Erhöhung nimmt die
Konzentration der Sulfidionen zu.
Berechnung der c(S2-) eines Schwefelwasserstoffwasser, c0(H2S) = 0,1 mol/l, bei pH = 0:
Das MWG für Gleichung (3) lautet:
K S (1 2)
c 2 (H3O ) c(S2 )
c(H 2S)
c(H2S) c0 (H2S)
K S (1 2) c0 (H 2S) 1020 mol 2 /l 2 101 mol/l
c(S )
c 2 (H3O )
12 mol 2 /l 2
2
= 10-21 mol/l
Die S2--Konzentration in einer gesättigten H2S-Lösung in Gegenwart einer starken Säure {c(H3O+) =
1} beträgt rund 10-21 mol/l (entsprechend 1S2—Ion je ml). Mit dieser minimalen S2--Konzentration
können noch schwerlösliche Metallsulfide quantitativ (d.h. mit einer Restkonzentration von in Lösung
verbleibendem Metallion von maximal 10-5 mol/l) gefällt werden, deren Löslichkeitsprodukte
hinreichend klein sind.
Beispiele (Versuche):
Restkonzentration
an M2+
KL(HgS) = 10-54 mol2/l2 = c(Hg2+) c(S2-) = 10-33 mol/l 10-21 mol/l
KL(PbS) = 10-28 mol2/l2 = c(Pb2+) c(S2-) = 10-7 mol/l 10-21 mol/l
fallen im
stark sauren
pH = 0
215
KL(ZnS) = 10-23 mol2/l2 = c(Zn2+) c(S2-) = 10-2 mol/l 10-21 mol/l
fällt im stark sauren nicht
quantitativ (sehr schwach
saures Milieu notwendig)
KL(MnS) = 10-15 mol2/l2 = c(Mn2+) c(S2-)
fällt nur im alkalischen
Medium
Quantitative Fällung
pH < 7
pH > 7
HgS,
Bi2S3, CdS,
PbS,
CuS,
schwarz
braun- gelb
schwarz
10-54
KL =
bis
As2S3, Sb2S3, SnS
gelb
orange braun
10-25
NiS,
CoS,
schwarz
10-24
Schwefelwasserstoffgruppe:
Fällung aus HCl-saurer Lösung mit H2S im pH-Bereich von 0 bis 3,5
MnS,
ZnS
fleisch- weiß
farben
bis
10-15
Ammoniumsulfidgruppe:
Fällung mit Ammoniumsulfid,
NH4HS bei pH 8 bis 10
Mit Ammoniumpolysulfid, (NH4)HSn, können aus der H2S-Gruppe solche Sulfide abgetrennt werden,
die lösliche Thiometallate bilden.
+III +III
+II
+V
So bilden sich aus As2S3, Sb2S3, und SnS (Arsen-Zinn-Gruppe) Thioarsenat AsS43-, Thioantimonat
+V
+IV
SbS43- und Thiostannat SnS32-, die nach dem Abfiltrieren von den in (NH4)HSn nicht löslichen Sulfiden
der Kupfergruppe (HgS, PbS, CuS, Bi2S3 und CdS) durch ansäuern in die Sulfide As2S5 (gelb), Sb2S5
(orange) und SnS2 (gelbbraun) umgewandelt werden.
Bei der Bildung der Thiometallate kommt es durch die Polysulfide zu einer Oxidation von As(III)
As(V), Sb(III) Sb(V) und von Sn(II) Sn(IV).
Beispiel:
Bildung von Thioarsenat
+III
-I
-II
As2S3 + 2HS2 + HS- + 3OH-
+V-II
2AsS43- + 3H2O
Hydrogendisulfid
+I -I -I
H S S-
Die Reaktion ist hier für das Hydrogensulfidion, HS2-, mit dem Schwefel in der Oxidationsstufe –I
formuliert. Auch andere Polysulfide wirken als Oxidationsmittel. Sulfid und Polysulfid liegen - vergl.
die KS-Werte auf S. 213 - hauptsächlich in Form von Hydrogensulfid bzw. –polysulfid vor.
216
Nachweis von H2S als PbS:
Durch Hydrolyse wasserlöslicher Sulfide sowie beim Behandeln von schwerlöslichen Sulfiden mit
HCl oder H2SO4 entsteht H2S, das am Geruch oder durch ein in dem Gasraum gehaltenes, mit
Bleiacetat, Pb(CH3COO)2, getränktes Filterpapier infolge Bildung von schwarzem PbS identifiziert
wird.
H2S + Pb2+
PbS
+ 2H+
Schwefel-Anionen:
Das Monosulfid- oder kurz Sulfidion, S2-, ist farblos. Darüber hinaus existieren eine Reihe hell- bis
dunkelgelber Dianionen Sn2- {Polysulfide (2-)} mit n = 2, 3, 4, 5, 6 usw..
Polysulfide entstehen z.B. beim Vereinigen von Schwefel mit heißen wässerigen S2-haltigen
Lösungen. Vereinigt man Alkalimetallpolysulfide mit polaren Medien wie Aceton oder
Dimethylformamid, so entstehen farbige Lösungen. Die Farbe geht auf die Anwesenheit von
Polysulfiden (1-) Sn1- zurück, nämlich auf das gelbgrüne Disulfid (1-) S2-, das blaue Trisulfid (1-) S3sowie das rote Tetrasulfid (1-) S4-. Die Monoanionen entstehen u.a. in Gleichgewichtsreaktionen durch
Spaltung von Dianionen:
S42-
2S2-
S62-
2S3-
blau
S82-
2S42-
rot
gelbgrün
Die Schwefel-Monoanionen sind für die Farbe einiger schwefelhaltiger Mineralien verantwortlich. So
verdankt etwa Lapsilazuli seine blaue Farbe den in Hohlräumen eines Natrium-Alumosilicates
eingelagerten S3--Ionen.
217
Lapislazuli mit goldglänzenden Pyritadern
Lapislazuli auf Kalkstein
218
b) Schwefelsauerstoffverbindungen
Oxidationszahl
Schwefel
Oxide
+II
" SO
Säure
"
" H2S2O3
Schwefelmonoxid
+IV
Anionen
(Salze)
"
Thioschwefelsäure
SO2
Schwefeldioxid
" H2SO3
"
Schweflige Säure
S2O32Thiosulfat
HSO3Hydrogensulfit
SO32Sulfit
+VI
SO3
Schwefeltrioxid
H2SO4
Schwefelsäure
HSO4Hydrogensulfat
SO42Sulfat
) SO2 ( " H2SO3 " , HSO3-, SO32-, S2O52--Disulfit)
farbloses, stechend riechendes, giftiges, nicht brennbares Gas
Sdp. = -10°C (lässt sich leicht zu einer farblosen Flüssigkeit verdichten, ausgezeichnetes
Lösungsmittel für viele anorganische und organische Stoffe)
Struktur:
gewinkelt
O
S
O
119,5°
polares Molekül
Herstellung (Technik):
- Verbrennen von Schwefel
- Abrösten sulfidischer Erze
S
+
O2
4FeS2 + 11O2
SO2
H = -297 kJ/mol
2Fe2O3 + 8SO2
H = -297 kJ/mol
219
Löslichkeit in Wasser:
sehr gut, 40l SO2 lösen sich in einem Liter H2O bei 20°C
Chemische Eigenschaften:
- SO2 wirkt reduzierend, Bestreben sich zur Oxidationsstufe der Schwefelsäure zu oxidieren
- die zu SO3 führende Reaktion mit Sauerstoff ist gehemmt und erfolgt nur in Anwesenheit von
Katalysatoren (s. unten, Herstellung SO3)
- wässerige Lösungen von SO2 reagieren ausgesprochen sauer, leiten den elektrischen Strom und
wirken ebenfalls reduzierend
Die sauren Eigenschaften beruhen auf der Reaktion von SO2 mit H2O:
SO2
+ 2H2O
HSO3- +
H 2O
H3O+ + HSO3-
pKS = 1,8 (1)
H3O+ + SO32-
pKS = 7,0 (2)
Der größte Teil des gelösten Schwefeldioxids liegt als unverändertes bzw. hydratisiertes SO2 in
Wasser vor. Die hypothetische Schweflige Säure H2SO3 kann nicht isoliert werden. Auch in wässeriger
Lösung existiert keine nichtprotolysierte H2SO3.
SO2
+ 2H2O
H2SO3
K << 10-9
Bei höheren Konzentrationen von SO2 in Wasser entstehen Disulfit-Ionen, S2O52-.
2HSO3-
S2O52- + H2O
(3)
- von der hypothetischen Säure H2SO3 leiten sich zwei Reihen von Salzen ab:
Hydrogensulfite, HSO3Sulfite, SO32-
l.l. in H2O
außer Alkalimetallsulfite mehr oder weniger s.l. in H2O
Herstellung durch Einleiten von SO2 in Laugen {Gleichgewichte (1) bzw. (2) werden nach rechts
verschoben}:
NaOH
+ SO2
NaHSO3 + NaOH
NaHSO3
Na2SO3 + H2O
220
Disulfite, S2O52- entstehen bei der Aufkonzentrierung von HSO3--Lösungen:
2NaHSO3
Na2S2O5 + H2O
Strukturen von SO32-, HSO3- und S2O52-:
SO32-
2-
S
O
HSO3-
O
Die -Bindungen sind delokalisiert (auch in HSO3und S2O52-), d.h. zwei weitere Lewis-Formeln sind
zur Beschreibung der Struktur (trigonal pyramidal)
notwendig.
O
in wässerigen Lösungen liegen zwei Tautomere im Gleichgewicht vor (Tautomere:
Konstitutionsisomere, die sich durch die Position eines Atoms oder einer Atomgruppe
unterscheiden), wobei die Form b in wässeriger Lösung nur in geringen Mengen
vorliegt.
H
-
S
O
O
O
-
S
H
O
a
O
O
b
2-
O
S2O52-
S
O
O
S O
O
anomal lange S-S-Bindung = 2,205 Å (normal ~2,08 Å)
Hydrogensulfite (alte Bezeichnung Bisulfite) als Lewis-Basen:
- mit Aldehyden und Ketonen Additionsverbindungen (Bisulfit-Addukte), die infolge ihrer
Schwerlöslichkeit in H2O zur Abtrennung und Reinigung von Aldehyden bzw. Ketonen verwendet
werden können:
C
O
+
S
OH
O
O- Na+
OH
C
O
S O
O- Na+
221
„Schweflige Säure“ und ihre Salze wirken stark reduzierend, die Reduktionswirkung ist im alkalischen
stärker als im sauren Milieu:
E [V]
+
2H2O
SO42-
+
4H+ + 2e-
SO32- +
2OH-
SO42-
+
H2O + 2e-
SO2
0,158 (pH = 1)
-0,936 (pH = 14)
- Nachweis von SO32- bzw. HSO3- durch Reduktion von I2 -Entfärbung – (Versuche)
+IV
0
HSO3- + I2 + H2O
+VI
-I
SO42- + 2I- + 3H+
+IV
SO32-
+VI
-I
2SO4 + 2I- + H2O
0
+ I2 + 2OH-
- Permanganat-Reste können mit einer Sulfit-Lösung reduzierend vernichtet werden (Versuch)
+VII
+IV
+
2MnO4 + H + 5HSO3-
+II
+VI
2+
2Mn
+ 3H2O + 5SO42-
- durch stärkere Reduktionsmittel wird HSO3- reduziert (Versuch)
+II
+IV
6SnCl3 + 2HSO3- + 10H+ + 12Cl-
+IV-II
SnS2
+IV
+ 5SnCl62- + 6H2O
Trichlorostannat(II)
gelbbraun
Hexachlorostannat(IV)
Nachweis von SO32- durch Geruch:
Na2SO3 + 2KHSO4
Na2SO4 + H2O + SO2
+ K2SO4
Das durch starke Säuren (hier Hydrogensulfat) in Freiheit gesetzte SO2 riecht stechend (zu prüfende
Substanz wird mit KHSO4 verrieben).
SO2-Darstellung im Labor (Versuch):
NaHSO3 + H2SO4
NaHSO4 + H2O + SO2
50%-ige H2SO4 zu konz. NaHSO3 tropfen lassen.
222
Schwefeldioxid als Konservierungsmittel:
SO2 tötet Bakterien, wirkt oxidationshemmend und verhindert das braune Anlaufen mancher
Nahrungsmittel, in großem Maßstab wird daher das Gas selbst oder seine Salze z. B. Natriumsulfit
(E221), die in wässeriger Lösung Schwefeldioxid freisetzen (s. Rückreaktionen in (1) und (2) auf S.
219), als Konservierungsmittel verwendet. SO2 bewahrt die natürliche Färbung von Obst und Gemüse:
geschälte Kartoffeln bleiben weiß. (Versuch: frisch geriebene Kartoffeln laufen braun an, gekaufte
Kloßmasse bleibt weiß – enthält Natriumdisulfit)
Seit den Tagen des Römischen Reiches ist das sogenannte Schwefel eine gebräuchliche Methode der
Weinkonservierung. Man gewann das Schwefeldioxid damals durch einfaches Abbrennen natürlich
vorkommenden Schwefels in der Nähe von Weinfässern, so dass der darin enthaltene Traubensaft die
Dämpfe aufnehmen konnte. Bereits geringste Konzentrationen SO2 100 ppm (Millionstel), reichen
aus, um die Vermehrung unerwünschter Hefen zu unterbinden und gleichzeitig das Wachstum
erwünschter Hefearten zu fördern. Wilde Hefen auf den Schalen der Trauben sorgen dafür, dass der
Saft nach dem Zerquetschen der Früchte von selbst zu gären beginnt; SO2 unterdrückt diese
Wildstämme und ermöglicht dem Winzer, sogenannte Reinzuchthefen nach seinen Wünschen
zuzusetzen. Wer in kleinem Maßstab Bier braut oder Wein bereitet, verwendet zum Schwefeln
Natriumdisulfit-Tabletten (Freisetzung von SO2 in H2O, s. Rückreaktionen in (3), (2) und (1) auf S.
219). Unmittelbar vor dem Abfüllen kann man dem Getränk zusätzliches Sulfit zufügen, um es am
Weitergären zu hindern. Dazu sind Dosen von bis zu 350 mg pro Flasche erforderlich. Der größte Teil
der Verbindung reagiert im Laufe der Zeit mit anderen Weinbestandteilen und verschwindet; junger
Weißwein kann jedoch beträchtliche Mengen SO2 enthalten.
Schwefeldioxid als Umweltgift:
Im Dezember 1952 tötete Schwefeldioxid 4000 Einwohner Londons, als sich die dichteste je da
gewesene Nebelsuppe fünf Tage lang über die Stadt legte und schließlich eine Fläche von
zweieinhalbtausend Quadratkilometer förmlich unter sich begrub (Inversionswetterlage). Zu dieser
Zeit heizten noch alle Haushalte mit Kohle, wobei SO2 freigesetzt wird.
SO2 entsteht immer, wenn Kohle verbrennt, ob in der Industrie, in Kraftwerken oder Haushalten.
Unser Planet muss mit SO2 fertig werden, das bei der Verbrennung entsteht und mit SO2, das Vulkane
in die Luft speien. Das Gas wird in der Atmosphäre zum größten Teil oxidiert, löst sich in den
Wassertröpfchen der Wolken und fällt als saurer Regen auf die Erde zurück.
„Sauberer“ Regen, der als pH-Wert-veränderndes Gas im wesentlichen nur CO2 enthält, müsste ein
pH-Wert zwischen 5 und 5,6 haben. Tatsächlich liegt der pH-Wert aber niedriger. In weiten Gegenden
der USA und Nordeuropas hat der Regen pH-Werte von 4 bis 4,5: Man spricht von saurem Regen.
In der Atmosphäre befindliche starke Säuren leisten dazu einen Beitrag, an der Spitze die SVerbindungen mit einem Anteil von mehr als 80 %:
Anorganische Stoffe
Anteil an der Acidität des Niederschlags
[in %]
SO2 ( H2SO4)
83
NO, NO2 ( HNO3)
12
HCl
5
Über 300 Millionen Tonnen SO2 gelangen jährlich in die Erdatmosphäre. Etwa die Hälfte davon ist
vulkanischen Ursprungs, die andere Hälfte stammt aus fossilen Brennstoffen. Die Lage könnte
nochschlimmer sein, denn SO2 wird beim Verbrennen jedes schwefelhaltigen Stoffes freigesetzt,
dochglücklicherweise wird Erdgas und zum größten Teil auch Erdöl vor dem Verheizen
entschwefelt.Den in Kohle enthaltenen Schwefel ebenfalls zu entfernen, ist wesentlich komplizierter,
der üblichere Weg besteht darin, die Kohle unbehandelt zu verfeuern und anschließend die Rauchgase
zu entschwefeln.
223
- Rauchgasentschwefelung
Bei der Rauchgasreinigung wird das Rauchgas nacheinander entstaubt (durch Elektrofiltration)
entschwefelt (s.u.) und entstickt (s. u. bei Stickstoffmonoxid).
Abluftreinigung: Rauchgasentschwefelung und Entstickung
Die Rauchgasentschwefelungsanlagen in Deutschland arbeiten nach mit dem Calciumverfahren.
Abluftreinigung: Rauchgasentschwefelung und Gipsaufbereitung
224
Beim Kalksteinverfahren wird CaCO3 (Kalkstein) mit dem SO2 der Rauchgase zunächst zu CaSO3 und
dann durch Oxidation zu CaSO4 2 H2O (Gips) umgesetzt. Dazu wird eine Waschflüssigkeit, die aus
einer CaCO3-Suspension besteht, in den Abgasstrom eingesprüht (Absorbertank).
CaSO3 . 0,5H2O + CO2
CaCO3 + SO2 + 0,5H2O
In der Oxidationszone (Oxidationsbehälter) bildet sich mit eingeblasener Luft Gips.
CaSO4 . 2H2O
CaSO3 . 0,5H2O + 1,5H2O + 0,5O2
Der anfallende Gips wird teilweise weiterverwendet.
) Schwefeltrioxid, SO3
SO3 ist unter Normalbedingungen eine Festsubstanz.
Es kommt in mehreren Modifikationen vor: Das Monomere existiert nur in Gaszustand im
Gleichgewicht mit S3O9-Molekülen (Trimeres des SO3):
3SO3(g)
H = -126 kJ/mol
S3O9(g)
O
Struktur SO3
Trigonal planar (drei gleichstarke S-ODoppelbindungen)
S
O
O
Kühlt man gasförmiges SO3 auf –80 °C ab, entsteht kristallines, eisartiges - SO3, dass aus S3O9Molekülen aufgebaut ist.
Struktur -SO3
O
O
S
O
O
S
S
O
O
O
O
O
gewellte Ringe, in denen die S-Atome
verzerrt tetraedrisch von Sauerstoff
umgeben sind
225
Trimeres „eisartiges“ -SO3
Unterhalb der Raumtemperatur wandelt sich - SO3 in stabilere, asbestartige Modifikationen (-SO3,
-SO3) um, die weiße, seidig glänzende Nadeln bilden. -SO3 besteht aus kettenförmigen Molekülen
und ist eigentlich eine Polyschwefelsäure.
Struktur von -SO3
n 105
O
H
O
S
O
H
n
O
Die Struktur von -SO3 ist nicht bekannt.
Chemische Eigenschaften:
SO3 ist eine sehr reaktive Verbindung, ein starkes Oxidationsmittel und reagiert im Gegensatz zu SO 2
vollständig mit H2O unter starker Wärmeentwicklung, wobei die wichtigste Chemikalie der
chemischen Industrie, die Schwefelsäure gebildet wird.
SO3 + H2O
H2SO4
H = -73,7 kJ/mol
(1)
226
) Schwefelsäure und ihre Salze
Technische Herstellung der Schwefelsäure:
Das für die H2SO4-Herstellung erforderliche Schwefeltrioxid erhält man durch katalytische Oxidation
von SO2 mit Luftsauerstoff nach dem Kontaktverfahren. Schwefeldioxid wird durch Verbrennen von
Schwefel bzw. beim Abrösten von sulfidischen Erzen gewonnen (s. S. 218).
Kontaktverfahren:
SO3 kann nicht durch direktes Verbrennen von Schwefel an der Luft oder in einer
Sauerstoffatmosphäre gewonnen werden, da die bei der Verbrennung des Schwefels zu SO2
freiwerdende bedeutende Wärmemenge (1) die Bildung des bei höherer Temperaturen endotherm in
Schwefeldioxid und Sauerstoff zerfallenden Schwefeltrioxids verhindert (2).
1S +
8 8
O2
SO2
H = -297 kJ/mol
(1)
SO2 + 1 O2
2
SO3
H = - 99 kJ/mol
(2)
Deshalb wird zunächst Schwefel zu SO2 verbrannt und dann das gewonnene SO2 mit Luftsauerstoff zu
SO3 oxidiert. Diese Reaktion (2) ist exotherm, d.h. für eine möglichst quantitative Oxidation von SO 2
zu SO3, sollte man bei möglichst tiefen Temperaturen arbeiten. Bei tiefen Temperaturen ist die
Reaktionsgeschwindigkeit aber zu gering. Selbst bei 400 bis 600 °C verläuft die Reaktion noch viel zu
langsam. Glücklicherweise gibt es aber feste Katalysatoren („Kontakte“), die in diesem
Temperaturbereich die Reaktion (2) beschleunigen. Man benutzt als Katalysator Vanadiumpentoxid,
V2O5 vermischt mit einem Aktivator auf einem Träger. Die ab ca. 420 °C wirksame Katalysatormasse
wirkt als Sauerstoff-Überträger, wobei für diese Fähigkeit die Wertigkeitsänderung
Vanadium (V)
Vanadium (IV) entscheidend ist. Die Wirkungsweise des Katalysators kann
formal durch die Gleichungen (4) und (5) zum Ausdruck gebracht werden:
+V
+IV
V2O5 + SO2
+IV
+VI
V2O4 + SO3
(3)
+IV
0
1
V2O4 + 2 O2
+V-II
V2O5
(4)
SO2
+ 1
2 O2
SO3
Die Geschwindigkeiten der Teilreaktionen (4) und (5) sind dabei in Summe größer als die
Geschwindigkeit der direkt verlaufenden Oxidation von SO2 zu SO3.
Zur Verschiebung des Gleichgewichts (2) arbeitet man mit einem zwei- bis dreifachen Überschuss an
Luftsauerstoff (1 bis 1,5 statt 0,5 mol O2 je mol SO2, s. S. 132) und – da die Umsetzung unter
Volumenminderung abläuft - gegebenenfalls bei erhöhtem Druck (z. B. 5 bar). Besonders wichtig ist
aber die Aufrechterhaltung einer sowohl hinsichtlich der SO3-Ausbeute als auch hinsichtlich der
Reaktionsgeschwindigkeit günstigen Temperatur. Es muss die bei der Umsetzung freiwerdende
Wärme abgeführt werden, da sonst die Temperatur des Kontaktes steigt und die SO3-Ausbeute sinkt.
Die Temperaturabhängigkeit der SO3-Ausbeute (Startgemisch: 10 Vol. -% SO2, 10 Vol. -% O2, 80
Vol.- % N2) zeigt folgende Abbildung:
227
Temperaturabhängigkeit der SO3-Ausbeute
Als Reaktoren benutzt man „Hordenkontaktöfen“ in denen die Katalysatormasse auf Rosten
(„Horden“) schichtweise übereinander angeordnet ist:
Kontaktkessel (h = 13 m, 10 m, 80 t Katalysator)
zur Gewinnung von SO3 aus SO2
228
Bei neueren Anlagen haben die Öfen meist vier Kontaktschichten und drei dazwischen geschaltete
Kühlzonen, in denen die Reaktionsgase teils durch Wärmeaustauscher, teils durch Zumischung kalter
Luft gekühlt werden. Mit derartigen Anlagen sind Ausbeuten um 98 % erzielbar. Vorteilhafterweise
werden die Reaktionsgase nach dem Durchgang durch die ersten drei Horden erst nach dem
Auswaschen des gebildeten SO3 mit konz. H2SO4 (s. unten) durch die vierte Katalysatorschicht
gegeben (“Doppelkontaktverfahren“). Diese Variante gewährleistet einen SO2-Umsatz von mehr als
99,5 %.
Die Vereinigung des katalytisch gebildeten SO3 mit Wasser zu H2SO4 (vergl. Gl. 1 S. 225) kann nicht
einfach so erfolgen, dass man das den Kontaktkessel verlassende Gasgemisch durch Wasser leitet,
weil hierbei ein großer Teil des SO3 entweicht (stark exotherme Reaktion), ohne sich mit Wasser
umzusetzen. Dagegen nimmt konz. (98 %-ige) Schwefelsäure das SO3 vollständig und momentan
unter Bildung von Dischwefelsäure, H2S2O7 auf {Gl. (7)}. Durch Zufließenlassen von Wasser
{Hydrolyse der gebildeten Dischwefelsäure Gl. (8)} ergibt sich die gewünschte Schwefelsäurebildung:
SO3
+ H2SO4
H2S2O7
(7)
H2S2O7 + H2O
2H2SO4
(8)
SO3
H2SO4
+ H2O
Technische Herstellung der Schwefelsäure
229
Kontaktsäure (konz. H2SO4) 98%-ig
+ berechnete Menge
SO3
Sdp. 338°C
+ 20 - 25% SO3 - Überschuß
100%-ige wasserfreie H2SO4
rauchende Schwefelsäure Oleum"
"
Versuch zur SO3-Herstellung:
Ein SO2/Luftgemisch (SO2 aus der Gasflasche) wird mit einer Wasserstrahlpumpe durch ein
Reaktionsrohr, das erhitztes Vanadiumpentoxid enthält, gesaugt. In einem nachgeschaltetem Kolben
bilden sich H2SO4-Nebel (SO3 reagiert sofort mit dem H2O-Dampf der Luft).
In der dann folgenden Waschflasche, die eine wässerige BaCl2-Lösung enthält, bilden die Sulfationen
der Schwefelsäure mit Ba2+-Ionen einen schwerlöslichen Niederschlag von BaSO4 (s. S. 231 SulfatNachweis).
Strukturen:
O
H2SO4
HO
S
OH
O
O
H2S2O7
HO
S
O
O
O
S
OH
O
Chemische Eigenschaften:
- Starke zweibasige Säure
Die Schwefelsäure ist in Wasser eine starke, zweibasige Säure und ist praktisch vollständig in H3O+
und HSO4- protolysiert:
H2SO4 + H2O
H3O+ + HSO4-
pKS (1) = - 3,0
HSO4- + H2O
H3O+ + SO42-
pKS (2) = +1,96
Das erste Wasserstoff-Ion ist in wässeriger Lösung zu praktisch 100 % abgespalten, die Dissoziation
in zweiter Stufe beträgt dem gegenüber nur 1,3 %. Die Protonenaktivität a(H+) der Schwefelsäure
steigt mit der Säurekonzentration an, so dass reine Schwefelsäure ein hochacides Medium ist, in
welchem die meisten darin aufgelösten Stoffe als Basen wirken.
230
Die hohe Protonenabgabetendenz der Schwefelsäure bedingt auch ihre außerordentlich große Affinität
zum Wasser. Mischt man Schwefelsäure mit Wasser, kommt es zu einer starken Wärmeentwicklung:
H2SO4 + H2O
H = -95,33 kJ/mol H2SO4
Hydrate der Schwefelsäure
Das Vermischen muss wegen der beträchtlichen Wärmeentwicklung stets mit Vorsicht in der Weise
geschehen, dass man die Säure in dünnem Strahl und unter Umrühren in das Wasser einträgt; gießt
man umgekehrt das Wasser in die Schwefelsäure, so kann die intensive Wärmeentwicklung zum
Herausspritzen der aggressiven Flüssigkeit und zum Springen des Glasgefäßes führen.
Schwefelsäure und rauchende Schwefelsäure zerstören organisches Gewebe und verursachen auf der
Haut schmerzende, schwer heilende Wunden.
- Wasserentziehende Wirkung
Die starke wasserentziehende Wirkung der konz. Schwefelsäure wird zum Trocknen von chemischen
Substanzen in Exsikkatoren oder Waschflaschen sowie zur Entfernung von Wasser aus chemischen
Gleichgewichten genutzt. Beispielsweise geht Salpetersäure HNO3 beim Eintragen in konz.
Schwefelsäure unter H2O-Abspaltung qualitativ in das Nitryl-Kation über:
NO2+ + H3O+ + 2HSO4-
HNO3 + 2H2SO4
Die konz. Schwefelsäure protoniert die Salpetersäure und bewirkt durch seine wasserentziehende
Wirkung die Bildung des Nitryl-Kations.
+
HO
+ H+
N
O
O
O
H
O
O
H
N
H2O +
O
+
N
O
Solche Salpetersäure-Schwefelsäure-Gemische „Nitriersäure“ werden in der organischen Chemie zur
Nitrierung von Aromaten verwendet.
Versuch:
Permangant wird durch konz. H2SO4 protoniert, aus der gebildeten instabilen Permangansäure bildet
sich durch H2O-Entzug das Dimanganheptoxid, das sehr leicht Sauerstoff abgibt und z. B. Ethanol
augenblicklich entzündet (Gleichungen im Kapitel 32.1. Mangan).
Auf viele organische Stoffe (Zucker, Papier, Kleiderstoffe) wirkt konz. H2SO4 verkohlend und
zerfressend ein, indem sie die Elemente des Wassers daraus abspaltet:
CmH2nOn
mC + nH2O
und zugleich oxidativ (s. unten) zerstörend wirkt.
Eine konzentrierte Zuckerlösung bläht sich bei Zugabe konz. H2SO4 unter Bildung voluminöser Kohle
auf (Versuch).
231
- Oxidierende Eigenschaften
Verdünnte Schwefelsäure entwickelt als Säure bei der Einwirkung auf alle in der Spannungsreihe
oberhalb des Wasserstoffs stehenden Metalle (s. S. 72) Wasserstoff:
0
+I
z.B. Zn + 2H+ (verd. H2SO4)
+II
0
Zn2+ + H2
Metalle, die in der Spannungsreihe oberhalb des Wasserstoffs stehen (z. B. Cu, Hg und Ag) lösen sich
nicht in verdünnter, wohl aber beim Erhitzen in konz. Schwefelsäure. Die Auflösung des Metalls
erfolgt nicht unter Wasserstoff-, sondern unter SO2-Entwicklung, dem Reduktionsprodukt der
Schwefelsäure:
0
+VI
z.B. Ag + 2H2SO4
+I
+IV
Ag2SO4 + SO2 + 2H2O
Konz. Schwefelsäure ist ein mildes Oxidationsmittel. Mit zunehmender Verdünnung der
Schwefelsäure nimmt die Oxidationswirkung ab.
Salze der Schwefelsäure:
Als zweibasige Säure bildet die Schwefelsäure zwei Reihen von Salzen: Hydrogensulfate, HSO4- und
Sulfate, SO42-. Sulfate sind meist in Wasser leicht löslich. Praktisch unlöslich sind Barium-, Strotiumund Bleisulfat, Calziumsulfat ist etwas löslich.
Nachweis von SO42--Ionen mit einer BaCl2-Lösung als schwerlösliches BaSO4:
SO42- + Ba2+
verd. HCl
BaSO4
Man muss die SO42- -Lösung stets vorher mit HCl ansäuern, da viele andere Bariumsalze, wie BaCO3,
Ba3(PO4)2, BaSO3, in Wasser schwer löslich sind, aber bei Gegenwart von Wasserstoffionen wieder in
Lösung gehen.
Hydrogensulfate sind in Wasser sehr leicht löslich. Sie gehen beim Erhitzen auf 150-200 °C unter
H2O-Abspatung in die Disulfate und bei höherem Erhitzen unter SO3-Abspaltung dann in normale
Sulfate über:
2NaHSO4
-H2O
Na2S2O7
-SO3
Na2SO4
Die Abgabe der starken Lewis-Säure SO3 bei höheren Temperaturen aus Disulfaten wird beim
sogenannten sauren Aufschluss von geglühten Oxiden (Fe2O3, Cr2O3, TiO2 - nicht löslich in konz.
Säuren und Königswasser) in der Schmelze genutzt. Aus den Oxid-Ionen und SO3 bildet sich SO42-:
z.B. Fe2O3 + 6KHSO4
Fe2(SO4)3 + 3K2SO4 + 3H2O
Al2O3 wird durch KHSO4 nur unvollständig in eine leicht lösliche Form gebracht.
232
Verwendung:
Die Hauptmenge der Schwefelsäure wird zur Herstellung von Kunstdünger verwendet. Andere
Verwendungen, die zum Teil schon genannt oder später besprochen werden, fasst die folgende Abb.
zusammen.
Verwendung der Schwefelsäure
)
Thiosulfat, S2O32- (Thioschwefelsäure, „H2S2O3”)
Thiosulfate erhält man durch Kochen von SO32--Lösungen mit feingepulvertem Schwefel:
S8
+IV
+ 8Na2SO3
50 - 100°C
+II
8Na2S2O3
mittlere
Oxidationszahl
Strukturen
2-
O
O
S
O
O
Sulfat
2-
O
O
S
S
O
Thiosulfat
(S-S-Bindungen: 201 pm)
233
Beim Aufkonzentrieren einer wässerigen Natriumthiosulfat-Lösung kristallisiert das Pentahydrat aus
(Na2S2O3 5 H2O). Na2S2O3 5 H2O schmilzt bei 48,5 °C in seinem Kristallwasser (Versuch).
Nachweise für Thiosulfat:
- Einwirkung von Säuren (Versuch mit HCl)
S2O32-
+
+ 2H
+II
H2S2O3"
"
0
S
+IV
+ SO2
+ H2O
Beim Ansäuern einer S2O32--Lösung entsteht zunächst die unbeständige freie Thioschwefelsäure. Sie
zerfällt (disproportioniert) in Schwefel und Schwefeldioxid.
- Als Ag2S2O3/Ag2S (Versuch)
S2O32- + 2Ag+
Ag2S2O3
+H2O
Ag2S + H2SO4
Thiosulfat gibt mit Silberionen schwerlösliches Silberthiosulfat, das unbeständig ist. Es zersetzt sich
unter Bildung von schwarzem Silbersulfid, wobei die Schwarzfärbung von Weiß über Gelb, Orange
und Braun verläuft (Anorganischer Sonnenuntergang).
Silberthiosulfat löst sich im Überschuss von Thiosulfat (Versuch):
Ag2S2O3 + S2O32-
[Ag(S2O3)2]3-
Di(thiosulfato)argentat(I)-Komplex
Hierauf beruht die Verwendung von Thiosulfat als Fixiersalz in der Schwarz-Weiß-Photographie (s.
Kapitel 29.2 Silber).
Thiosulfate sind schwache Reduktionsmittel und werden durch starke Oxidationsmittel {(z. B. Cl2, Gl.
(1)} zu Sulfat oxidiert. Mit Iod verläuft dagegen die Umsetzung quantitativ zu Tetrathionat Gl. (2).
Die Reaktion (2) besitzt große Bedeutung für die Maßanalyse (Iodometrie).
Auf dieser Reaktion beruht die Verwendnung von Thiosulfat als „Antichlor“ in der Bleicherei.
Blaufärbung durch
Zugabe von Stärke
(blauer Einschlusskomplex)
farblos
234
Strukturen
Tetrathionat
O
O
Peroxodisulfat
O
S
S
S
S
O
O
O
O
S
O
2-
O
O
O
S
O
2-
O
O
) Peroxodisulfate
Peroxodisulfate werden in der Analyse als starke Oxidationsmittel eingesetzt. Sie oxidieren in
Gegenwart von Ag+ als Katalysator z. B. Mn2+ zu MnO4- und Cr3+ zu Cr2O72- (s. Kapitel 33.1. Chrom).
Peroxodisulfate werden technisch durch anodische Oxidation konzentrierter Sulfatlösungen
hergestellt:
2SO42-
S2O82- + 2e-