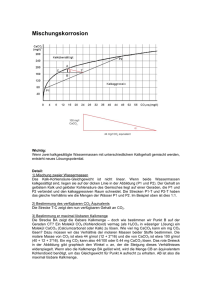
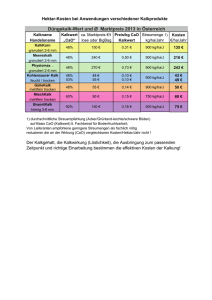
Reaktion Bezeichnung Beispiel L −→ S Kondensation H2O(l) −→ H
Werbung
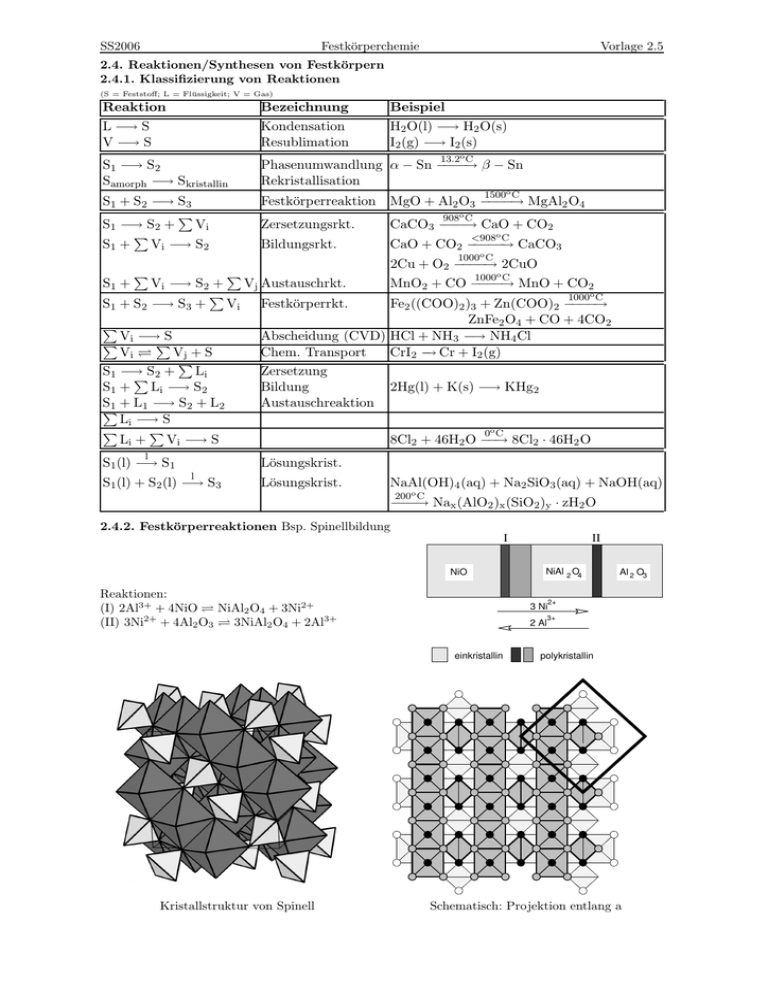
SS2006 Festkörperchemie Vorlage 2.5 2.4. Reaktionen/Synthesen von Festkörpern 2.4.1. Klassifizierung von Reaktionen (S = Feststoff; L = Flüssigkeit; V = Gas) Reaktion L −→ S V −→ S Bezeichnung Kondensation Resublimation Beispiel H2 O(l) −→ H2 O(s) I2 (g) −→ I2 (s) S1 −→ S2 Samorph −→ Skristallin Phasenumwandlung α − Sn −−−−→ β − Sn Rekristallisation S1 + S2 −→ S3 P S1 −→ S2 + Vi P S1 + Vi −→ S2 Festkörperreaktion MgO + Al2 O3 −−−−→ MgAl2 O4 Zersetzungsrkt. CaCO3 −−−→ CaO + CO2 Bildungsrkt. CaO + CO2 −−−−−→ CaCO3 13.2o C 1500o C 908o C <908o C 1000o C 2Cu + O2 −−−−→ 2CuO P Vi −→ S2 + Vj Austauschrkt. P S1 + S2 −→ S3 + Vi Festkörperrkt. S1 + P P V −→ S P i P Vi Vj + S P S1 −→ PS2 + Li S1 + Li −→ S2 S1 + L1 −→ S2 + L2 P Li −→ S P P Li + Vi −→ S l S1 (l) −→ S1 1000o C MnO2 + CO −−−−→ MnO + CO2 1000o C Fe2 ((COO)2 )3 + Zn(COO)2 −−−−→ ZnFe2 O4 + CO + 4CO2 Abscheidung (CVD) HCl + NH3 −→ NH4 Cl Chem. Transport CrI2 − → Cr + I2 (g) Zersetzung Bildung 2Hg(l) + K(s) −→ KHg2 Austauschreaktion 0o C 8Cl2 + 46H2 O −−→ 8Cl2 · 46H2 O Lösungskrist. l S1 (l) + S2 (l) −→ S3 Lösungskrist. NaAl(OH)4 (aq) + Na2 SiO3 (aq) + NaOH(aq) 200o C −−−→ Nax (AlO2 )x (SiO2 )y · zH2 O 2.4.2. Festkörperreaktionen Bsp. Spinellbildung I NiO Reaktionen: (I) 2Al3+ + 4NiO NiAl2 O4 + 3Ni2+ (II) 3Ni2+ + 4Al2 O3 3NiAl2 O4 + 2Al3+ NiAl 2 O4 3 Ni 2 Al einkristallin Kristallstruktur von Spinell II Al 2 O3 2+ 3+ polykristallin Schematisch: Projektion entlang a