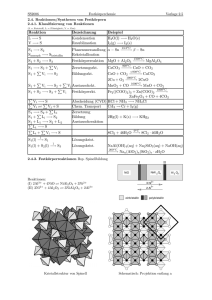
Mischungskorrosion
Werbung
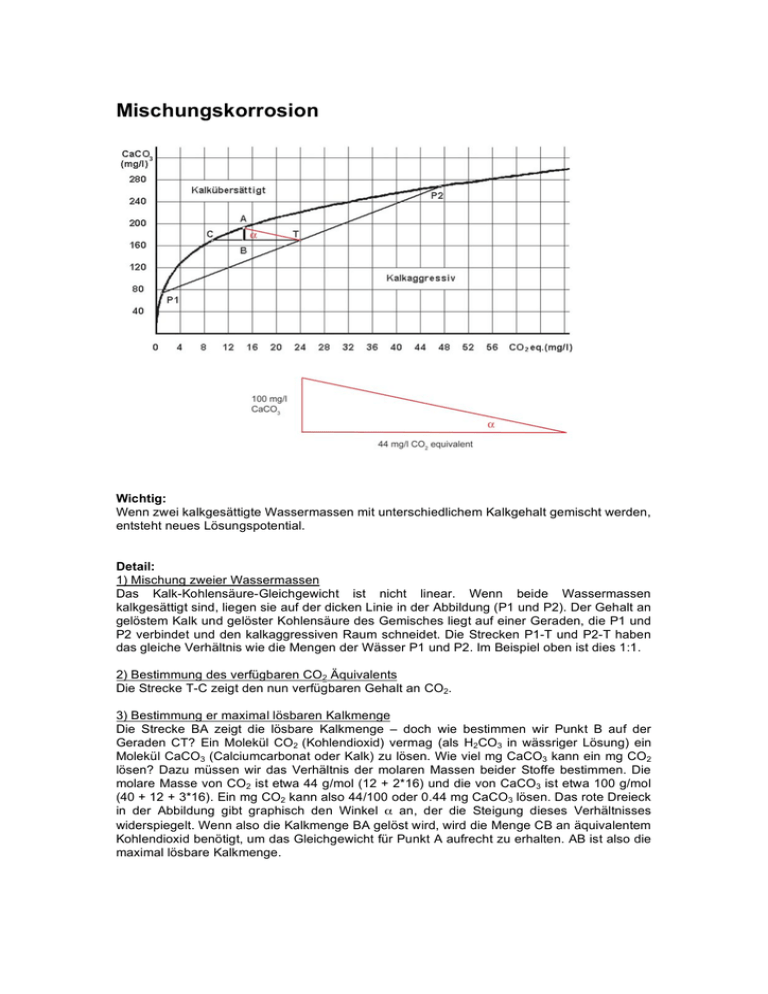
Mischungskorrosion Wichtig: Wenn zwei kalkgesättigte Wassermassen mit unterschiedlichem Kalkgehalt gemischt werden, entsteht neues Lösungspotential. Detail: 1) Mischung zweier Wassermassen Das Kalk-Kohlensäure-Gleichgewicht ist nicht linear. Wenn beide Wassermassen kalkgesättigt sind, liegen sie auf der dicken Linie in der Abbildung (P1 und P2). Der Gehalt an gelöstem Kalk und gelöster Kohlensäure des Gemisches liegt auf einer Geraden, die P1 und P2 verbindet und den kalkaggressiven Raum schneidet. Die Strecken P1-T und P2-T haben das gleiche Verhältnis wie die Mengen der Wässer P1 und P2. Im Beispiel oben ist dies 1:1. 2) Bestimmung des verfügbaren CO2 Äquivalents Die Strecke T-C zeigt den nun verfügbaren Gehalt an CO2. 3) Bestimmung er maximal lösbaren Kalkmenge Die Strecke BA zeigt die lösbare Kalkmenge – doch wie bestimmen wir Punkt B auf der Geraden CT? Ein Molekül CO2 (Kohlendioxid) vermag (als H2CO3 in wässriger Lösung) ein Molekül CaCO3 (Calciumcarbonat oder Kalk) zu lösen. Wie viel mg CaCO3 kann ein mg CO2 lösen? Dazu müssen wir das Verhältnis der molaren Massen beider Stoffe bestimmen. Die molare Masse von CO2 ist etwa 44 g/mol (12 + 2*16) und die von CaCO3 ist etwa 100 g/mol (40 + 12 + 3*16). Ein mg CO2 kann also 44/100 oder 0.44 mg CaCO3 lösen. Das rote Dreieck in der Abbildung gibt graphisch den Winkel α an, der die Steigung dieses Verhältnisses widerspiegelt. Wenn also die Kalkmenge BA gelöst wird, wird die Menge CB an äquivalentem Kohlendioxid benötigt, um das Gleichgewicht für Punkt A aufrecht zu erhalten. AB ist also die maximal lösbare Kalkmenge.