12 Elektrolyse
Werbung
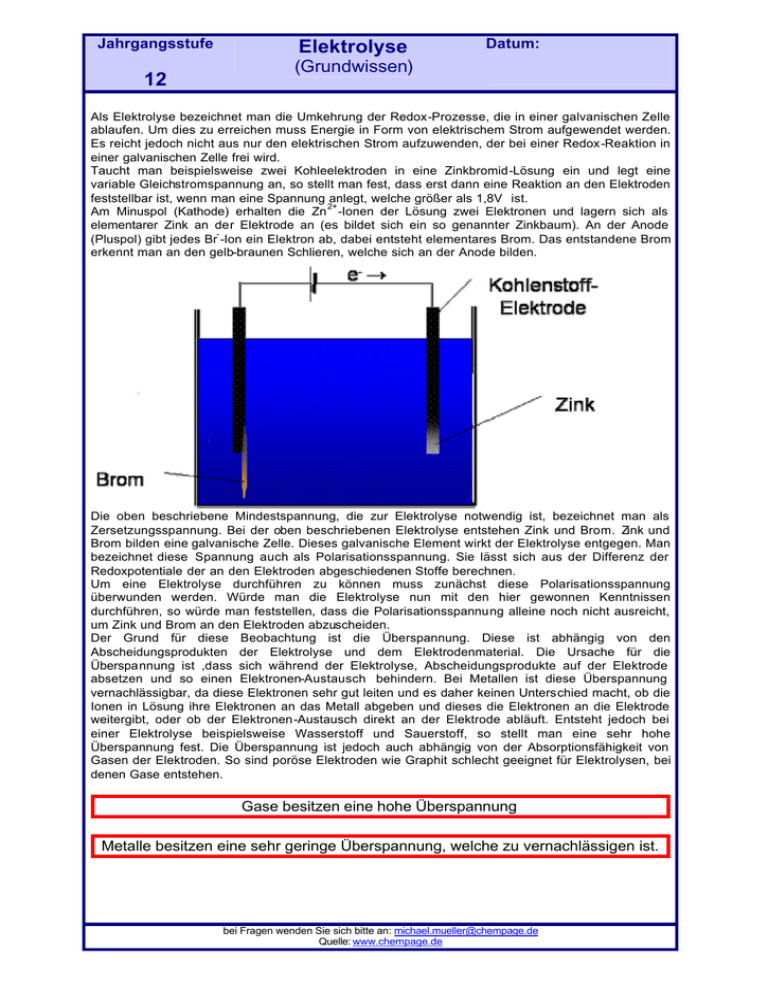
Jahrgangsstufe 12 Elektrolyse Datum: (Grundwissen) Als Elektrolyse bezeichnet man die Umkehrung der Redox-Prozesse, die in einer galvanischen Zelle ablaufen. Um dies zu erreichen muss Energie in Form von elektrischem Strom aufgewendet werden. Es reicht jedoch nicht aus nur den elektrischen Strom aufzuwenden, der bei einer Redox-Reaktion in einer galvanischen Zelle frei wird. Taucht man beispielsweise zwei Kohleelektroden in eine Zinkbromid-Lösung ein und legt eine variable Gleichstromspannung an, so stellt man fest, dass erst dann eine Reaktion an den Elektroden feststellbar ist, wenn man eine Spannung anlegt, welche größer als 1,8V ist. 2+ Am Minuspol (Kathode) erhalten die Zn -Ionen der Lösung zwei Elektronen und lagern sich als elementarer Zink an der Elektrode an (es bildet sich ein so genannter Zinkbaum). An der Anode (Pluspol) gibt jedes Br -Ion ein Elektron ab, dabei entsteht elementares Brom. Das entstandene Brom erkennt man an den gelb-braunen Schlieren, welche sich an der Anode bilden. Die oben beschriebene Mindestspannung, die zur Elektrolyse notwendig ist, bezeichnet man als Zersetzungsspannung. Bei der oben beschriebenen Elektrolyse entstehen Zink und Brom. Zink und Brom bilden eine galvanische Zelle. Dieses galvanische Element wirkt der Elektrolyse entgegen. Man bezeichnet diese Spannung auch als Polarisationsspannung. Sie lässt sich aus der Differenz der Redoxpotentiale der an den Elektroden abgeschiedenen Stoffe berechnen. Um eine Elektrolyse durchführen zu können muss zunächst diese Polarisationsspannung überwunden werden. Würde man die Elektrolyse nun mit den hier gewonnen Kenntnissen durchführen, so würde man feststellen, dass die Polarisationsspannung alleine noch nicht ausreicht, um Zink und Brom an den Elektroden abzuscheiden. Der Grund für diese Beobachtung ist die Überspannung. Diese ist abhängig von den Abscheidungsprodukten der Elektrolyse und dem Elektrodenmaterial. Die Ursache für die Überspannung ist ,dass sich während der Elektrolyse, Abscheidungsprodukte auf der Elektrode absetzen und so einen Elektronen-Austausch behindern. Bei Metallen ist diese Überspannung vernachlässigbar, da diese Elektronen sehr gut leiten und es daher keinen Unterschied macht, ob die Ionen in Lösung ihre Elektronen an das Metall abgeben und dieses die Elektronen an die Elektrode weitergibt, oder ob der Elektronen-Austausch direkt an der Elektrode abläuft. Entsteht jedoch bei einer Elektrolyse beispielsweise Wasserstoff und Sauerstoff, so stellt man eine sehr hohe Überspannung fest. Die Überspannung ist jedoch auch abhängig von der Absorptionsfähigkeit von Gasen der Elektroden. So sind poröse Elektroden wie Graphit schlecht geeignet für Elektrolysen, bei denen Gase entstehen. Gase besitzen eine hohe Überspannung Metalle besitzen eine sehr geringe Überspannung, welche zu vernachlässigen ist. bei Fragen wenden Sie sich bitte an: [email protected] Quelle: www.chempage.de











