Physik 9 Name - Mathe Physik Chemie
Werbung

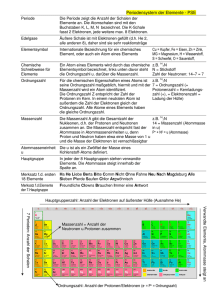
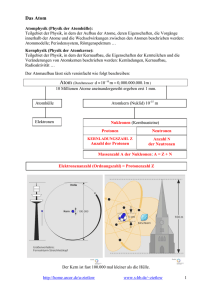
Physik 9 Name: Radioaktivität 30. April 2014 1. Aufgabenblatt Atomphysik Aufgabe 1 Erkläre folgende Begriffe: • Ordnungszahl • Massenzahl • Isotop Aufgabe 2 Vervollständige die folgende Tabelle. Verwende dafür das Periodensystem der Elemente, wenn nötig. Element Natrium Blei Uran Chlor Symbol Na Pb U Cl Ordnungzahl Z 11 82 Neutronenzahl N 12 Massenzahl A 207 146 Aufgabe 3 Warum wirken die Atome nach außen hin elektrisch neutral? Aufgabe 4 Erkläre den Begriff Isotop anhand eines Beispiels. Lösungen Aufgabe 1 Erkläre folgende Begriffe: • Ordnungszahl Anzahl der Protonen im Kern. • Massenzahl Summe der Anzahl der Protonen und der Anzahl der Neutronen. • Isotop Elemente, die die gleiche Ordnungszahl, aber unterschiedliche Massenzahl haben. Aufgabe 2 Vervollständige die folgende Tabelle. Verwende dafür das Periodensystem der Elemente, wenn nötig. Element Natrium Blei Uran Chlor Symbol Na Pb U Cl Ordnungzahl Z 11 82 92 17 Neutronenzahl N 12 125 146 18 Massenzahl A 23 207 238 35 Aufgabe 3 Warum wirken die Atome nach außen hin elektrisch neutral? Ein elektrisch neutrales Atom besitzt dieselbe Anzahl an Elektronen wie an Protonen. Aufgabe 4 Erkläre den Begriff Isotop anhand eines Beispiels. Elemente, die die gleiche Anzahl von Protonen (gleiche Ordnungszahl), aber unterschiedliche Anzahl an Neutronen (also unterschiedliche Massenzahl) haben, nennt man Isotope. Beispiel: Wasserstoff. In der Natur exisiteren drei Isotope vom Wasserstoff: • Wasserstoff 11 H (Auch Protium genannt) besitzt nur ein Proton im Kern. Seine Häufigkeit beträgt 99,985% • Deuterium 21 H (schwerer Wasserstoff) besitzt ein Proton und ein Neutron im Kern. Seine Häufigkeit beträgt 0,015%. Einsatz in Kernreaktoren. • Tritium 31 H (Superschwerer Wasserstoff) besitzt ein Proton und zwei Neutronen im Kern. Seine Häufigkeit beträgt 0,0001%