Chemie Tabelle (Sprachlicher Zweig)
Werbung
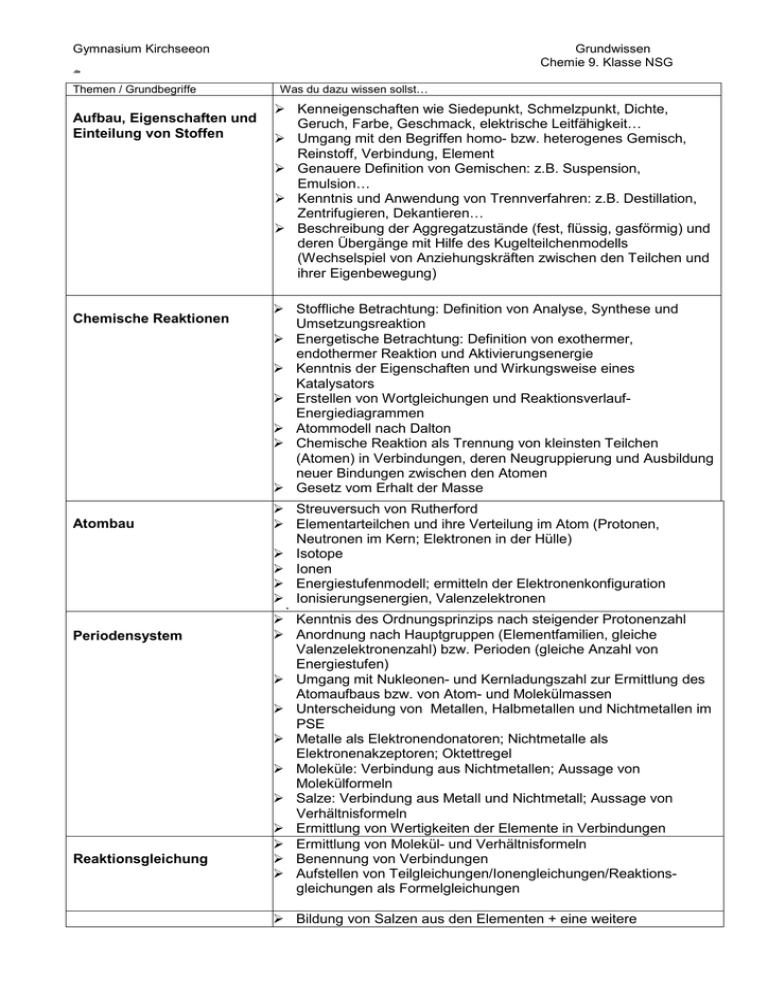
Gymnasium Kirchseeon Grundwissen Chemie 9. Klasse NSG .de Themen / Grundbegriffe Aufbau, Eigenschaften und Einteilung von Stoffen Chemische Reaktionen Atombau Was du dazu wissen sollst… Kenneigenschaften wie Siedepunkt, Schmelzpunkt, Dichte, Geruch, Farbe, Geschmack, elektrische Leitfähigkeit… Umgang mit den Begriffen homo- bzw. heterogenes Gemisch, Reinstoff, Verbindung, Element Genauere Definition von Gemischen: z.B. Suspension, Emulsion… Kenntnis und Anwendung von Trennverfahren: z.B. Destillation, Zentrifugieren, Dekantieren… Beschreibung der Aggregatzustände (fest, flüssig, gasförmig) und deren Übergänge mit Hilfe des Kugelteilchenmodells (Wechselspiel von Anziehungskräften zwischen den Teilchen und ihrer Eigenbewegung) Stoffliche Betrachtung: Definition von Analyse, Synthese und Umsetzungsreaktion Energetische Betrachtung: Definition von exothermer, endothermer Reaktion und Aktivierungsenergie Kenntnis der Eigenschaften und Wirkungsweise eines Katalysators Erstellen von Wortgleichungen und ReaktionsverlaufEnergiediagrammen Atommodell nach Dalton Chemische Reaktion als Trennung von kleinsten Teilchen (Atomen) in Verbindungen, deren Neugruppierung und Ausbildung neuer Bindungen zwischen den Atomen Gesetz vom Erhalt der Masse Streuversuch von Rutherford Elementarteilchen und ihre Verteilung im Atom (Protonen, Neutronen im Kern; Elektronen in der Hülle) Isotope Ionen Energiestufenmodell; ermitteln der Elektronenkonfiguration Ionisierungsenergien, Valenzelektronen Periodensystem Reaktionsgleichung Kenntnis des Ordnungsprinzips nach steigender Protonenzahl Anordnung nach Hauptgruppen (Elementfamilien, gleiche Valenzelektronenzahl) bzw. Perioden (gleiche Anzahl von Energiestufen) Umgang mit Nukleonen- und Kernladungszahl zur Ermittlung des Atomaufbaus bzw. von Atom- und Molekülmassen Unterscheidung von Metallen, Halbmetallen und Nichtmetallen im PSE Metalle als Elektronendonatoren; Nichtmetalle als Elektronenakzeptoren; Oktettregel Moleküle: Verbindung aus Nichtmetallen; Aussage von Molekülformeln Salze: Verbindung aus Metall und Nichtmetall; Aussage von Verhältnisformeln Ermittlung von Wertigkeiten der Elemente in Verbindungen Ermittlung von Molekül- und Verhältnisformeln Benennung von Verbindungen Aufstellen von Teilgleichungen/Ionengleichungen/Reaktionsgleichungen als Formelgleichungen Bildung von Salzen aus den Elementen + eine weitere Gymnasium Kirchseeon Salze Metalle Moleküle Grundwissen Chemie 9. Klasse NSG Darstellungsmethode Gewinnung von Kochsalz (Salinebecken…) Teilvorgänge bei der Bildung eines Salzes aus den Elementen Vorstellung von der Ausbildung eines Salzkristalls, Anordnung der Ionen und Ursache des Zusammenhalts (elektrostatische Anziehung, Ionengitter, Koordinationszahl, dichteste Kugelpackung, Ionenbindung) Kenntnis und Erklärung der Salzeigenschaften ((Un-)Löslichkeit, Sprödigkeit, elektrische Leitfähigkeit…) Formulierung einer Darstellungsmöglichkeit: Elektrolyse, Umsetzungsreaktion Vorstellung vom Aufbau eines Metalls und der Ursache des Zusammenhalts der Atome (Metallgitter, delokalisierte Elektronen, Elektronengas, positiv geladene Atomerümpfe) Erklärung der Metalleigenschaften (Verformbarkeit, Wärmeleitfähigkeit, elektrische Leitfähigkeit, Verformbarkeit… Unterscheidung von unedlen und edlen Metallen aufgrund ihres Bestrebens zur Elektronenabgabe Vorstellung vom Aufbau von Molekülen und Ursache des Zusammenhalts der Atome durch gemeinsame Elektronenpaare ( = Atombindung, Elektronenpaarbindung, kovalente Bindung) Ermitteln von Valenzstrichformeln ( = Lewisformeln); Einfach- und Mehrfachbindungen, Formalladungen Quantitative Aspekte Atommasse und atomare Masseneinheit Teilchenzahl und der Begriff des Mol (Avogadro-Konstante NA) Molare Masse und molares Volumen Durchführung einfacher quantitativer Berechnungen Wasser Wasserstoffsulfid (Kenneigenschaft: Geruch) Wasserstoffchlorid (in Wasser gelöst: Salzsäure) Wasserstoffperoxid Ammoniak (Kenneigenschaft: Geruch) Kohlenstoffdioxid Zweiatomige Elemente nach der „HOFBrINCl-Regel“ Molekülanionen („Gruppen“) und Ableitung der entsprechenden Säure bzw. Base bzw. eines Salzes Chlorid, Salzsäure, z.B. Natriumchlorid Nitrat, Salpetersäure, z.B. Kaliumnitrat ( = Kaliumsalpeter) Sulfid, Wasserstoffsulfid, z.B. Zinksulfid Sulfat, Schwefelsäure, z.B. Calciumsulfat ( = Gips) Carbonat, Kohlensäure, z.B. Calciumcarbonat ( = Kalk) Phosphat, Phosphorsäure, z.B. Calciumphosphat Hydroxid, Natriumhydroxid ( = in Wasser gelöst: Natronlauge) Nachweisreaktionen Knallgasprobe Glimmspanprobe Kohlenstoffdioxidnachweis mit Calcium- oder Bariumhydroxidlösung Verbindungen/Elemente