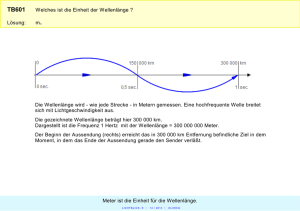
ε ε ε - stern-im
Werbung

MAO mögliche Klausurfragen stern-im-web.de 1. Nennen Sie jeweils ein Beispiel für eine thermische-, mechanische- und eine weitere Trennmethode. Thermisch: Spektroskopie Mechanisch: Beugungsmethode Andere: Bildgebendes Verfahren 2. Was bedeutet energiedispersiv bzw. nicht energiedispersiv? Energiedispersiv: Λ → Λ’ (anderes Spektrum) Nicht energiedispersiv: Energie und Wellenlänge bleiben erhalten. 3. Nennen Sie die Aussage des Lambert-Beer`schen Gesetzes im Bezug auf die Konzentration und die Schichtdicke bei der UV-VIS Spektroskopie. Erhöht man die Konzentration arithmetisch, nimmt die Lichtenergie exponentiell ab. Nimmt die Schichtdicke arithmetisch zu, nimmt die Lichtenergie exponentiell ab. 4. Bei 270 nm beträgt der molare Absorptionskoeffizient einer in Hexan gelösten Substanz 855 l · mol-1 ·cm-1. Um wie viel Prozent wird Licht dieser Wellenlänge abgeschwächt, wenn es einen Weg von 2,5 mm in einer Lösung der Konzentration 3,25 · 10-3 · mol-1 zurücklegt? log I = −ε ⋅ c ⋅ d I0 = ( −855l ⋅ mol −1 ⋅ cm −1 ) ⋅ (3,25 ⋅ 10 −3 ⋅ mol ⋅ l −1 ) ⋅ (0,25cm ) = −0,695 I = 0,2 I0 Die Abnahme beträgt 80% 5. Eine Lösung eines unbekannten Bestandteils einer biologischen Probe lässt 20,1% der auftreffenden Strahlung einer Wellenlänge von 340 nm durch eine Probenkammer der Länge 1 cm passieren. Wie groß ist der molare Absorptionskoeffizient der Substanz, wenn ihre Konzentration 1,11 · 10-4 · mol-1 beträgt? log I = −ε ⋅ c ⋅ d I0 ε =− 1 I log 0,201 ⋅ log = = 6,28 ⋅ 10 4 l ⋅ mol −1 ⋅ cm −1 −4 −1 c⋅d I 0 (1,11 ⋅ 10 ⋅ mol ⋅ l ) ⋅ 1cm 6. Wenn Licht einer Wellenlänge von 400 nm einen Weg von 3,5 mm in einer Lösung der Konzentration 6,67 · 10-4 · mol · l-1 einer absorbierenden Substanz zurücklegt, beträgt die Transmission 65,5 % Wie groß ist der Absorptionskoeffizient bei dieser Wellenlänge? ε = 7,9 ⋅ 10 5 cm 2 ⋅ mol −1 7. Bei 540 nm beträgt der molare Absorptionskoeffizient eines gelösten Stoffes 268 mol-1 · cm-1. Wenn Licht dieser Wellenlänge einen Weg von 6,5 mm in einer Lösung zurücklegt, so wird 45 % absorbiert. Welche Konzentration hat die Lösung? c= 1 I 1 ⋅ log = ⋅ log(1 − 0,45) = 1,5mmol ⋅ l −1 −1 I 0 286l ⋅ mol ⋅ cm −1 ⋅ 0,65mm ε ⋅d 8. Nennen Sie mindestens drei Halbleiterelemente. GaAs, InP, InAs 9. Wann ist ein Molekül IR-aktiv? Ein Molekül ist IR-aktiv, wenn ein dynamisches Dipolmoment bei der Schwingung entsteht. 10. Welches Einbettungsmaterial wird bei der IR-Spektroskopie für feste, flüssige oder gasförmige Proben verwendet und welche Eigenschaften sollte es besitzen? KBr (fest, flüssig) Gasküvette (gasförmig) Hohe Masse Geeigneter Messbereich Handhabbar Durchleuchtbar 11. Welchen Effekt hat der Austausch von KBr durch CsBr als Einbettungsmaterial bei der IR-Spektroskopie? Der Austausch erhöht die Durchlässigkeit für kleinere Wellenzahlen. 12. Welche Schwingungen im Spektrum zeigen Salze? Keine. 13. Welche Streckschwingung von CO2 ist IR-aktiv? O→C→O IR-aktiv O←C→O O→C←O Nicht IR-aktiv 14. Welche Schwingungen sind Raman aktiv und was bezeichnet man als RamanEffekt? Nur Schwingungen, die symmetrisch zum Symmetriezentrum erfolgen, können Raman aktiv sein. Raman-Effekt: Aktivität liegt vor, wenn sich die Polarisierbarkeit der Elektronenhülle des Moleküls während der Anregung ändert. 15. Welche der folgenden Moleküle sind IR bzw. Raman aktiv? 1. CO in Formaldehyd 2. Wasser 3. [PdCl4]24. NH3 5. Chloroform 6. Ether 7. Kohlenstoffdisulfid 1. 2. 3. 4. 5. 6. 7. IR + Raman IR + Raman Raman IR + Raman IR + Raman IR Raman 16. In Cs3Cr2Cl9 wurde für T = 300 K ein effektives magnetisches Moment µeff = 3,81 µB gemessen. Der Abstand zwischen den Cr-Atomen beträgt 332 pm. Für Cs3W2Cl9 wird bei T = 300 K eine magnetische Suszeptibilität Χ = -2,73 · 10-3 cm3 · mol-1 gemessen. Der Abstand zwischen den W-Atomen beträgt 250 pm. Die Verbindung kristallisiert isotyp. Welche Bindung liegt zwischen den Cr- bzw. W-Atomen vor? Cr ist paramagnetisch. W ist diamagnetisch Æ Dreifachbindung. 3 ungepaarte Elektronen in Cr-Verbindung Æ keine Cr Einfachbindung. 17. Für die Verbindung Cs2Re2Br8 wird bei 298 K eine magnetische Suszeptibilität von Χ = 3,1 · 10-2 cm3 · mol-1 gemessen. Die Anionen haben eine ekliptische Konformation. Der Abstand zwischen den Re-Atomen ist mit 223 pm sehr kurz. Welche Bindung zwischen den Re-Zentren liegt vor? Ekliptische Konformation nur bei KEINER freien Drehbarkeit Æ Mehrfachbindung. 18. Warum wird bei Verbindungen wie NiSO4 · 7H2O, CoSO4 · 7 H2O keine antiferromagnetische Ordnung beobachtet? Bei größer werdendem Anion, wird der Superaustausch schlechter. 19. Was ist der kürzeste Abstand in der Kristallstruktur bei einer kubisch dichtesten Packung? dm = a ⋅ 2 2 20. Formulieren Sie die Mooser-Pearson-Regel. ne + ba − bc =8 na ne = Zahl der Valenzelektronen ba = Zahl der Anion-Anion-Bindungen bc = Zahl der Kation-Kation-Bindungen na = Zahl der Anionen 21. Welche Symmetrie und welches Symmetriesymbol haben folgende Sätze? „O, Genie der Herr ehre dein Ego“ „Eine güldne gute Tugend lüge nie“ Es handelt sich um Palindrome. Sie sind spiegelsymmetrisch, Symmetriesymbol m. 22. Formulieren Sie die Bragg-Gleichung und benennen Sie die Variablen bzw. Konstanten. n ⋅ λ = 2d hkl ⋅ sin Θ hkl n = Ordnungszahl (meist 1) λ = Wellenlänge d = Netzebenenabstand Θ = Beugungswinkel 23. Formulieren Sie die Gleichung zur Bestimmung des Zellparameters a. sin 2 Θ = λ2 4a 2 (h 2 + k 2 + l 2 ) 24. Bestimmen Sie die fehlenden Parameter in folgender Tabelle. CsCl sin2Θ sin2Θk / sin2Θ1 hkl sin2Θ sin2Θk / sin2Θ1 hkl 2Θ sin2Θ sin2Θk / sin2Θ1 hkl 27,57 39,38 48,75 56,92 64,38 71,41 0,057 0,114 0,170 0,227 0,284 0,341 1 2 3 4 5 6 100 110 111 200 210 211 2Θ sin2Θ sin2Θk / sin2Θ1 hkl 39,38 56,92 71,41 84,74 97,78 111,25 0,114 0,227 0,341 0,454 0,568 0,681 1 2 3 4 5 6 110 200 112 220 310 222 2Θ 27,57 39,38 48,75 56,92 64,38 71,41 W 2Θ 39,38 56,92 71,41 84,74 97,78 111,25 CsCl W 25. Welches Licht (Bereich) absorbieren farblose, bzw. weiße Stoffe? λ < 300nm farblos: Licht geht durch weiß: Komplette diffuse Reflexion 26. Werden bei der Absorption von UV-Licht a) elektronische Übergänge b) Schwingungen c) Rotationen angeregt? Elektronische Übergänge 27. Über das Lambert-Beer’sche Gesetz können elektronische Übergänge im UV-VIS Bereich zur Quantifizierung bestimmter Ionen oder Verbindungen eingesetzt werden. Welche der folgenden Ionen kann man mit UV-VIS nicht bzw. sehr schlecht bestimmen? NO3-, NO2-, Benzol, Ho3+, Li+, F- Li+ und F- sind aufgrund ihrer Elektronenkonfiguration schlecht anregbar. 28. Welche Metallkationen haben eine Farbe? Lanthaniden-Ionen 29. Nennen Sie Beispiele für Moleküle mit a) Spiegelebene b) Zweizähliger Drehachse c) Dreizähliger Drehachse d) Vierzähliger Drehachse e) Inversionszentrum a) H2O b) H2O c) NH3 d) [PtCl4]2e) trans [Pt(NH3)Cl2] 30. Wie kann man cis- und trans-Platin mit Raman und IR unterscheiden? trans-Pt: Inversionszentrum cis-Pt: kein Inversionszentrum 31. Zeigt ein ideal aufgebauter Ionenkristall Ionenleitfähigkeit? Nein, da keine freien Plätze für das Wandern von Ionen vorhanden sind (keine Defekte). 32. Welcher Ionenleiter wird im KFZ für die Messung des Sauerstoffpartialdruckes eingesetzt? λ-Sonde, mit Y2O3 (CaO) dotiertes ZrO2 33. Wie wird die Leitfähigkeit eines Ionenleiters bzw. elektronischen Halbleiters chemisch vergrößert? Durch Dotierung 34. Welchen elektrischen Widerstand sollte ein Metall am absoluten Nullpunkt haben? Null-Widerstand (Bei realen Metallen: Restwiderstand) 35. Welchen elektrischen Widerstand sollte ein Halbleiter am absoluten Nullpunkt haben? ∞-Widerstand 36. Welche der folgenden Elemente und Verbindungen sind Halbleiter? a) Si b) Ga c) GaAs d) NiAs e) ZnSe f) As a) Halbleiter b) Metall c) Halbleiter d) Metall e) Halbleiter f) Metallisch 37. Welcher der beiden Halbleiter liefert Licht mit kürzerer Wellenlänge GaAs, GaN? GaN (Je kleiner die Ordnungszahl, desto kürzerwelliger ist das Licht) 38. Welche Drehsymmetrien sind bei Kristallen erlaubt? 1,2,3,4,6 39. Was unterscheidet den kristallinen vom amorphen Festkörper? Amorph: nur Nahordnung Kristall: Nahordnung + Fernordnung 40. Wie groß ist der Abstand zwischen Na und Cl im NaCl mit a = 600 pm? d= a 2 41. Wie groß ist der Abstand zwischen Cs und Cl im CsCl mit a = 400 pm? d= a ⋅ 3 2 42. Wie groß ist der Abstand zwischen den Cu-Atomen in der Cu-Struktur mit a = 360 pm? d= a ⋅ 2 2 43. Cl liegt in der kubisch flächenzentrierten Kochsalzstruktur auf der vierzähligen Punktlage ½ , ½ , ½ . Berechnen Sie die Koordinaten der anderen Punkte. ½ , 0, 0 ; 0 , ½ , 0 ; 0 , 0 , ½ 44. Erhält man bei der Röntgenbeugung ein Diagramm oder ein Spektrum? Diagramm E = const. λ = const. 45. Nennen Sie Symmetrieelemente, die bei kristallinen Festkörpern auftreten. Spiegelebene, Drehachse, Inversionszentrum, Gleitspiegelebene, Schraubenachse 46. Welche Art von Magnetismus wird in den folgenden Verbindungen bei Raumtemperatur beobachtet? a) K2PtCl6 b) Mn2(CO)10 c) O2 d) CrO2 e) NiO f) Fe a) diamagnetisch b) diamagnetisch c) paramagnetisch d) ferromagnetisch e) antiferromagnetisch f) ferromagnetisch 47. Welche der aufgelisteten Verbindungen hat die höchste antiferromagnetische Ordnungstemperatur NiTe, NiF2, NiS, NiO? NiO 48. Wie sind die Wellenzahlen der Schwingungen von D2O im Vergleich zu H2O? Die Wellenzahl von D2O ist kleiner als die des H2O.