Teil A Kostbare Wärme!
Werbung

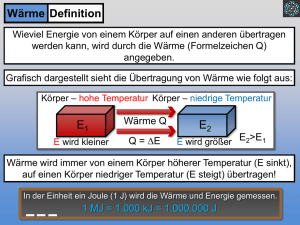
DECHEMAX-Schülerwettbewerb 2011/2012 MUSTERLÖSUNGEN Teil A Kostbare Wärme! In unserer ersten Runde habt ihr bestimmt schon gemerkt: Auch in der Chemie dreht sich bei einem Blick in die Zukunft sehr vieles um die Themen Energie und Energieversorgung. Wichtige Fragen sind: Aus welchen Quellen können wir unsere so dringend benötigte Energie in Zukunft schöpfen, wie können wir gewonnene Energie speichern und andernorts verfügbar machen und – last but not least – wie können wir Energie sparen und so unseren übermäßigen Verbrauch drosseln? Wer die Antworten auf diese Fragen hat, hat mit Sicherheit wenigstens einen Nobelpreis verdient. Wir wollen uns mit unseren Versuchen diese Thematik noch einmal genauer anschauen. 1. Wie viel Wärme kann eine Substanz speichern? Die Wärmekapazität beschreibt die Wärmemenge, die eine Substanz enthält: Bezogen auf die Masse einer Substanz: C=ΔQ/(m x ΔT) Q= Wärme c= Wärmekapazität (spezifische) m = Masse ΔT= Temperaturdifferenz Messung der Wärmekapazität von Wasser Was ihr braucht: 2 gleich große Herdplatten 2 gleich große Töpfe mit Deckeln, passend zu den Herdplatten 1 Thermometer (0-120 °C) 1 Küchenwaage oder 1 Messbecher Topf A mit 1 Liter (1 kg) kaltem Wasser aus dem Hahn füllen und Deckel aufsetzen. Topf B mit 0,5 Liter (0,5 kg) kaltem Wasser aus dem Hahn füllen und Deckel aufsetzen. Dreht beide Herdplatten auf volle Leistung und setzt die Töpfe auf. Messt jede Minute die Temperatur in jedem Topf und schreibt diese auf, bis das Wasser kocht. DECHEMAX-Schülerwettbewerb 2010/2011 Beispieldaten t [min] Topf A: 1 kg H2O Topf B: 0,5kg H2O T [°C] T [°C] 0 10 1 17 2 26 3 35 4 44 5 53 10 26 45 65 84 99 6 63 7 72 8 80 9 87 10 96 Schaltet im Anschluss die Herdplatten aus, gießt das Wasser ab und wartet, bis die Töpfe wieder Raumtemperatur haben. Führt das Experiment erneut durch, vertauscht dabei die Töpfe auf den Herdplatten. Wozu dient dieses Vorgehen? Wir gehen in unserem Experiment davon aus, dass beide Herdplatten genau die gleiche Leistung haben. Ob das wirklich der Fall ist, erkennt man, wenn man das Experiment mit vertauschten Herdplatten wiederholt. Einige fleißige unter euch haben auch die Töpfe vertauscht um auch hier die Vergleichbarkeit zu untersuchen. Sollte es eine Gebrauchsanweisung für den Herd geben, so könnt ihr die dortigen Angaben der Leistung P (Energie pro Zeit) für die Herdplatten verwenden. Sonst nehmt einfach 1000 W (J/s). Berechne c für den Temperaturbereich von 20 - 80°C. Für diese Berechnung musstet ihr entweder genau die Sekunden messen, bis das Wasser im Topf 20 bzw. 80°C erreicht hat, oder etwas vom Protokoll abweichen und etwa 26 und 84°C als Messpunkte verwenden. Eine Beispielrechnung hatten wir euch vorgegeben. Natürlich konntet ihr auch hier mit 1000 oder 500g Wasser rechnen und die Werte der beiden Herdplatten vergleichen… Bsp: t= 5 min = 300 s, 1 kg Wasser ΔT= 60°C bzw. 60K (Kelvin) C=ΔQ/(m x ΔT) ΔQ = P x t C= P x t/(m x ΔT) C= 1000 J/s x 300 s / (1 kg x 60K)= 5000 J/(kg K) Die tatsächliche Wärmekapazität von Wasser beträgt: Cm= 4,18 kJ/(kg x K). Euer errechneter Wert dürfte etwas höher ausgefallen sein. Warum ist das wohl so? DECHEMAX-Schülerwettbewerb 2010/2011 Die Wärme, die die Herdplatte erzeugt, geht natürlich nicht komplett in das Wasser über. Auch der Topf wird heiß und einige Wärme wird an die Umgebung abgegeben. In unserer Rechnung haben wir aber so getan, wie wenn das Wasser die komplette Wärme aufgenommen hätte, damit hätte es dann eine höhere Wärmekapazität. 2. Phasenübergang Wärme kann nicht nur in fühlbarer (sensibler) Wärme gespeichert werden, sondern auch in dem Aggregatszustand einer Substanz (latente Wärme). Experiment: Was ihr braucht: 1 Herdplatte 1 Topf mit Deckel, passend zur Herdplatte 1 Thermometer (0-120 °C) 1 Küchenwaage oder 1 Messbecher Friert 0,5 Liter (kg) Wasser im Gefrierschrank ein. Holt das entstandene Eis aus dem Gefrierschrank und zerkleinert es. Stellt die Herdplatte wie oben auf volle Leistung und stellt den Topf mit dem Eis darin mit einem Deckel abgedeckt auf die Platte. Messt jede Minute die Temperatur in dem Topf unter Rühren und notiert sie, ebenso wie andere Beobachtungen, bis das Wasser 5 min gekocht hat. Macht ein Diagramm, in dem ihr das das Temperaturprofil über der Zeit auftragt (also x-Achse: Zeit, y-Achse: Temperatur). Was fällt auf? Warum? Eure Kurve sollte in etwa so eine Form haben. Warum sieht sie so aus? Wenn das Eis schmilzt, ändert sich die Temperatur zunächst nicht obwohl ständig Energie zugeführt wird. In dieser Zeit wird die Energie „in den Phasenübergang gesteckt“. Erst wenn das Eis vollständig geschmolzen ist, erhöht sich die Temperatur. Am Siedepunkt wiederholt sich dann das Phänomen. Die Energie wird benötigt, um flüssiges Wasser zu verdampfen. Die Temperatur in der kochenden Flüssigkeit übersteigt aber trotz stetiger Wärmezufuhr 100 °C nicht. DECHEMAX-Schülerwettbewerb 2010/2011 3. Wärmeübergang: Wärme fließt immer von einem warmen zu einem kalten Körper. Dabei kommen verschiedene Mechanismen zum Einsatz: a) Konvektion: Dieses Wort kennt ihr vielleicht aus dem Wetterbericht. Unter Konvektion versteht man das Aufsteigen von weniger dichter (wärmerer) Luft, Gas, oder Flüssigkeiten gegenüber ihrer dichteren (kälteren) Umgebung. Insgesamt wird dabei Wärme von unten nach oben transportiert. b) Wärmeleitung: Unter Wärmeleitung versteht man den Transport von Wärme durch einen Stoff hindurch. Die Geschwindigkeit der Wärmeleitung ist stark stoffabhängig. Metalle sind generell recht gute Wärmeleiter, poröse Materialien hingegen isolieren in der Regel recht gut. Experiment: Was ihr braucht: 1 Herdplatte 1 Topf, passend zur Herdplatte 1 Metallbecher 1 Keramikbecher beide Becher solltet ihr nebeneinander in den Topf stellen können. Wenn ihr keinen Metallbecher habt, könnt ihr auch andere Becher verwenden, es sollten nur unterschiedliche Materialien sein. Metall eignet sich aber für den Versuch besonders gut. 1 Thermometer (0-120 °C) 1 Küchenwaage oder 1 Messbecher Stellt 0,5 Liter Wasser (kg) in einen Topf auf die Herdplatte und erhitzt dieses bis 80°C. Versucht, das Wasser möglichst bei der Temperatur zu halten. Füllt die Becher mit 100 ml (g) kaltem Wasser und stellt sie in den Topf. Messt jede Minute die Temperatur im Wasser der Becher und schreibt sie auf. (Wenn ihr es schafft, die Wassertemperatur einigermaßen konstant zu halten, könnt ihr die Versuche mit den Bechern auch nacheinander durchführen). Zeichnet die Temperaturverläufe in ein (T,t)-Diagramm auf (x-Achse: Zeit in Minuten, y-Achse: Temperatur). Beschreibt die Unterschiede. DECHEMAX-Schülerwettbewerb 2010/2011 Als Beispiel seht ihr ein gelungenes Diagramm aus dem Protokoll einer Gruppe. Rot ist hier das Wasser im Metallbecher, blau das im Keramikbecher. Man sieht deutlich, dass die Temperatur im Metallbecher die 80 °C-Grenze schneller erreicht als die im Keramikbecher. Metall leitet also die Wärme besser als Keramik. c) Strahlung: Jeder Körper gibt in Abhängigkeit von der Temperatur elektromagnetische Strahlung an die Umgebung ab. In den meisten Fällen können wir diese Strahlung nicht wahrnehmen. Allerdings wissen wir, dass beim Schmieden rotglühendes Eisen kälter ist als weißglühendes. Die Sonne transportiert den größten Teil ihrer Wärmeenergie als Strahlung auf die Erde. Umgekehrt nimmt ein Körper auch Strahlung auf und zwar abhängig von seiner Farbe. Experiment: Was ihr braucht: 1 weißes T-Shirt 1 schwarzes T-Shirt Fenster zur Südseite Sonnenschein Lege beide T-Shirts für 15 min in die Sonne. Welches der beiden T-Shirts wird wärmer? Warum? Das schwarze T-Shirt wird deutlich wärmer als das weiße. Die schwarze Farbe absorbiert die Energie der Sonnenstrahlung stärker als das weiße. Bunte T-Shirts liegen irgendwo dazwischen. Hier wird ein Teil des Sonnenlichtes reflektiert, weshalb die T-Shirts eben auch bunt erscheinen. Weiß reflektiert am meisten. Es gibt zum Beispiel Vorschläge von Wissenschaftlern, Dächer von Häusern oder Autos oder andere große Flächen weiß zu gestalten, um so der Klimaerwärmung entgegenzuwirken. DECHEMAX-Schülerwettbewerb 2010/2011 4. Optimierungsversuch Ihr habt nun die folgenden Wärmetransportarten kennengelernt: Konvektion Wärmeleitung Strahlung Immer, wenn wir Energie/Wärme nutzen, geht ein Teil davon (als Wärme) über eben diese Wege verloren. Daher gibt es eine Menge Anstrengungen, zum Beispiel das Beheizen einer Wohnung oder das Kochen so zu optimieren, dass möglichst wenig Wärme verlorengeht. Wer bei euch zu Hause einen Induktionsherd verwendet und die Kartoffeln im Dampfdrucktopf kocht, hat mit Sicherheit schon seinen Energieverbrauch minimiert. Ganz anders sieht es oft noch in Entwicklungsländern aus, wo in der Regel ein großer Topf auf dem offenen Feuer steht und nur ein viel zu kleiner Teil des knappen Brennholzes zur Zubereitung der Speisen genutzt wird. Könnt ihr aus einfachen Mitteln (ausgehend von einer Konservendose als Topf und einem Stövchen mit Teelicht als Energiequelle) eine ‚Kochstelle‘ so optimieren, dass möglichst wenig Energie verbraucht wird? Erklärt uns eure Ideen und schickt uns ein Foto eurer Kochstelle. Vielen Dank! Wir sind begeistert von euren Ideen. Hier wurde(n) doppelwandige Gefäße mit zwei unterschiedlich großen Konservendosen geschaffen, die Wärme durch Trichter eingefangen, mit Alufolie isoliert, Deckel gebastelt, der Abstand zur Kerze optimiert und vieles mehr! Wir sollten einige eurer Vorschläge direkt bei der UNO einreichen. DECHEMAX-Schülerwettbewerb 2010/2011 Teil B Selfmade-Wärmekissen Hat man erst einmal Energie gewonnen, zum Beispiel aus regenerativen Energien wie Sonne oder Windkraft, muss man sie speichern können, um sie im Bedarfsfall auch wieder abzurufen. Denn manchmal scheint die Sonne, manchmal weht der Wind... aber eben nur manchmal - ihr kennt das ja. Chemiker machen sich Gedanken über die chemische Speicherung von Energie, zum Beispiel in Form von Latentwärmespeichern. Eine Art von Latentwärmespeicher ist in den letzten Jahren recht beliebt geworden: die sogenannten Taschenwärmer. In diesen ist das Salz Natriumacetat-Trihydrat ,das Natriumsalz der Essigsäure, an das drei Wassermoleküle gebunden oder angelagert sind – man spricht von einer Hydrathülle. Kurz gesagt, funktioniert das Wärmekissen etwa so: Erwärmt man das Salz (mit wenig Wasser), löst es sich in dem wenigen zugegebenen Wasser und dem Wasser der eigenen Hydrathülle (also den 3 H2O), die sich bei höherer Temperatur aus dem Verbund löst. Dazu muss man Energie zuführen. Beim Abkühlen bleibt die (übersättigte) Lösung zunächst flüssig (hier wird also die Wärme in Form einer metastabilen Lösung gespeichert). Erst durch einen kleinen Anreiz von außen (bei den Taschenwärmern das Knicken des Metallplättchens) beginnt die Kritallisation und damit die Freisetzung der Wärme. Bei den folgenden Versuchsanweisungen solltet ihr ziemlich genau so arbeiten, wie es hier steht. Das Ganze kann gut funktionieren, ist aber ähnlich schwierig herzustellen wie einer von Severus Snapes anspruchsvolleren Zaubertränken. Nehmt euch Zeit für diesen Versuch. Da ihr lange Trocknungs-/ Reaktionszeiten habt, ist es schwierig, alles an einem Tag durchzuziehen. 1 Herstellung von Natriumacetat Achtet darauf, dass ihr in gut gelüfteten Räumen arbeitet. Der Geruch der Essigsäure ist stechend. Benutzt Schutzbrillen und Schutzkleidung und beachtet die Sicherheitshinweise der Chemikalien! Da Natriumacetat-Trihydrat nicht einfach so gekauft werden kann, wollen wir es selbst machen: was ihr braucht: Soda (60 g) (zum Beispiel aus der Drogerie) Essigessenz (200 ml) Wasser einen kleinen Topf evtl. eine kleine Pfanne (auf keinen Fall Mamas Beste mit der guten Beschichtung) Thermometer (0-120 °C) DECHEMAX-Schülerwettbewerb 2010/2011 Gebt 60 g Soda in einen Topf oder Becherglas und gebt dann langsam die Essigessenz hinzu (Vorsicht – schäumt stark). Am besten lasst ihr die Mischung über Nacht stehen, damit die beiden Substanzen gut miteinander reagieren können. Erwärmt die wässrige Mischung in einer Pfanne oder einem Topf oder einer Pfanne auf dem Herd auf niedriger Stufe. Vorsicht: Wenn zu stark erwärmt wird und noch viel Essigsäure vorhanden ist, kann das unangenehme Dämpfe produzieren – also auf ausreichend Lüftung achten! Erwärmt nie zu stark! Prüft die Temperatur mit einem Thermometer und achtet darauf, dass ihr unter 58 °C bleibt, sonst habt ihr nachher Natriumacetat ohne Hydrathülle. Wenn alle Flüssigkeit verdampft ist, tropft ihr noch einmal ein wenig Essigsäure zu. Erst, wenn die Mischung nicht mehr schäumt, könnt ihr davon ausgehen, dass die Umsetzung vollständig stattgefunden hat. Natriumacetat Trihydrat kristallisiert in langen Nadeln aus, die ungefähr so aussehen: Trocknet das Salz vollständig, damit ihr nachher mit den richtigen Mengen Wasser hantieren könnt. Das kann etwas dauern! Fragen: 1. Formuliert die Reaktionsgleichung für die Herstellung von Natriumactetat. 2 CH3COOH + Na2CO3 2 Na+(CH3COO)- + CO2 + H2O (eigentlich entsteht zunächst H2CO3, das in CO2 und H2O zerfällt.) Wikipedia: Aus wässrigen Lösungen kristallisiert Natriumacetat mit 3 Mol Kristallwasser: Na(CH3COO) · 3 H2O, Natriumacetat-Trihydrat. Dieses löst sich ab 58 °C im eigenen Kristallwasser. Bei höherer Temperatur (~120 °C) verdampft das Kristallwasser und es entsteht kristallwasserfreies Natriumacetat Na(CH3COO), manchmal auch NaAc (Schreibweise der Anorganik), "organisch korrekt" NaOAc geschrieben. 2. Weshalb schäumt es, wenn ihr die beiden Substanzen zusammengebt? Was entsteht? Es entsteht, wie man in der obigen Gleichung sieht, das Gas CO2, daher das Schäumen. DECHEMAX-Schülerwettbewerb 2010/2011 2 Das Wärmekissen Jetzt gilt es, eine übersättigte Lösung von Natriumacetat herzustellen: was ihr braucht: euer selbsthergestelltes Natriumacetat einen Filter (Kaffeefilter) einen Trichter ein weiteres Gefäß Wahrscheinlich habt ihr in Topf/Pfanne ein ziemlich festgebackenes Salz. Behaltet einen Krümel eures Salzes zurück. Löst euer Salz in 10 ml (maximal 20 ml – ein wenig verdampft auch wieder) Wasser und erwärmt es. Das Wasser befeuchtet zunächst das Salz nur und es sieht aus, als ob es viel zu wenig wäre. Beim Erwärmen (zunächst auf niedriger Stufe auf der Herdplatte) ändert sich dies aber. Fragen: 1. Was könnt ihr beobachten? Beim Erwärmen auf dem Herd steht zunächst nur ein wenig Wasser am Boden des Gefäßes. Nach und nach „entsteht“ aber immer mehr Wasser, es sieht aus, als würde das Salz in der Wärme schmelzen. 2. Was passiert in diesem Moment? Tatsächlich schmilzt das Salz aber nicht, sondern es ‚verliert‘ sein Kristallwasser in der Wärme. Das gut wasserlösliche Salz löst sich im Wasser des Kristallgitters. Obwohl man nur sehr wenig Wasser zugegeben hat, ist also zum Schluss ausreichend Wasser vorhanden, um eine übersättigte Lösung von Natriumacetat zu erhalten. Wenn ihr das Gemisch noch in einer Pfanne habt, wäre es jetzt die beste Zeit, umzuziehen - am besten in einen Topf oder ein Becherglas, aus dem man gut ausgießen kann. Wenn ein wenig Flüssigkeit im Topf/Becherglas steht, könnt ihr die Temperatur höher stellen, so lange, bis die Flüssigkeit kocht. Stellt einen Löffel/einen Spatel in das Wasser, damit es keinen Siedeverzug gibt und euch alles entgegenspritzt! Wenn der ganze Feststoff gelöst ist, filtriert ihr die noch heiße Flüssigkeit (Vorsicht, verbrennt euch nicht!) in ein sauberes (!) Gefäß, stellt das Thermometer hinein und lasst dieses so lange stehen, bis die Flüssigkeit auf ca. 20 °C abgekühlt ist. Lasst diese Flüssigkeit ganz in Ruhe stehen – Kleinigkeiten können genügen, um die Kristallisation anzuregen. Nach dem Abkühlen kratzt ihr einfach ein wenig mit dem Thermometer an der Topf/Glaswand. Wenn das nicht reicht, werft den Krümel Natriumacetat, den ihr zurückbehalten habt, in die Lösung. DECHEMAX-Schülerwettbewerb 2010/2011 Fragen/Aufgaben: 1. Beschreibt, was passiert Spätestens nach dem Hinzufügen mit dem Krümels NaOAc geht alles ganz schnell. Ausgehend von diesem Kristallisationskeim bilden sich wieder die typischen Nadeln des Natriumacetats. Innerhalb von wenigen Sekunden ist eine Feststoff (Natriumactetat Trihydrat) entstanden. 2. Wie ändert sich die Temperatur? Die Temperatur steigt von 20 auf nicht ganz 60°C an. Die Wärme in dem Feststoff hält sich recht lange. 3. Erklärt die Temperaturänderung. Natriumacetat-Trihydrat liegt im "geladenen Zustand" (die Chemiker nennen das metastabil) in einer übersättigten Lösung vor. Bei vorsichtiger Handhabung bleibt die Kristallisation des Salzes tagelang aus. Erst durch Reiben mit einem Glasstab oder Animpfen der Lösung mit einem Kristall wird der Zustand gestört; das Natriumacetat-Trihydrat kristallisiert schlagartig aus und gibt die im System gespeicherte Wärme ("latente Wärme") frei. CH3COO¯ (aq) + Na+ (aq) CH3COONa · 3 H2O (fest) /exotherm Die Ionen bauen zunächst das Ionengitter auf. Wassermoleküle nehmen in den Zwischenräumen des Ionengitters festgelegte Plätze ein, wobei sie ihre Dipole exakt ausrichten. Die Wassermoleküle bilden sozusagen ein Gitter im Kristallgitter. Ein Teil der bei diesem Vorgang freigesetzten latenten Wärme ist die Lösungswärme bzw. Kristallisationswärme des Salzes. Wichtig für die kräftige Erwärmung des Kissens ist auch die parallel ablaufende, stark exotherme Bildung des Wassermolekül-Gitters. Bei dieser Bildungswärme des Salzhydrats handelt es sich ebenfalls um eine latente Wärme. Deshalb nennt man Natriumacetat-Trihydrat auch einen chemischen Latentwärmespeicher. Wir hoffen, euch haben die Versuche Spaß gemacht. Und vor allem freuen wir uns, dass wir doch einige ganz tolle Bilder von nadelförmigen Kristallen sehen konnten. Der Versuch scheint überwiegend geklappt zu haben. Herzlichen Glückwunsch! Euer DECHEMAX-Team