Allg. u. Anorg. Chemie
Werbung
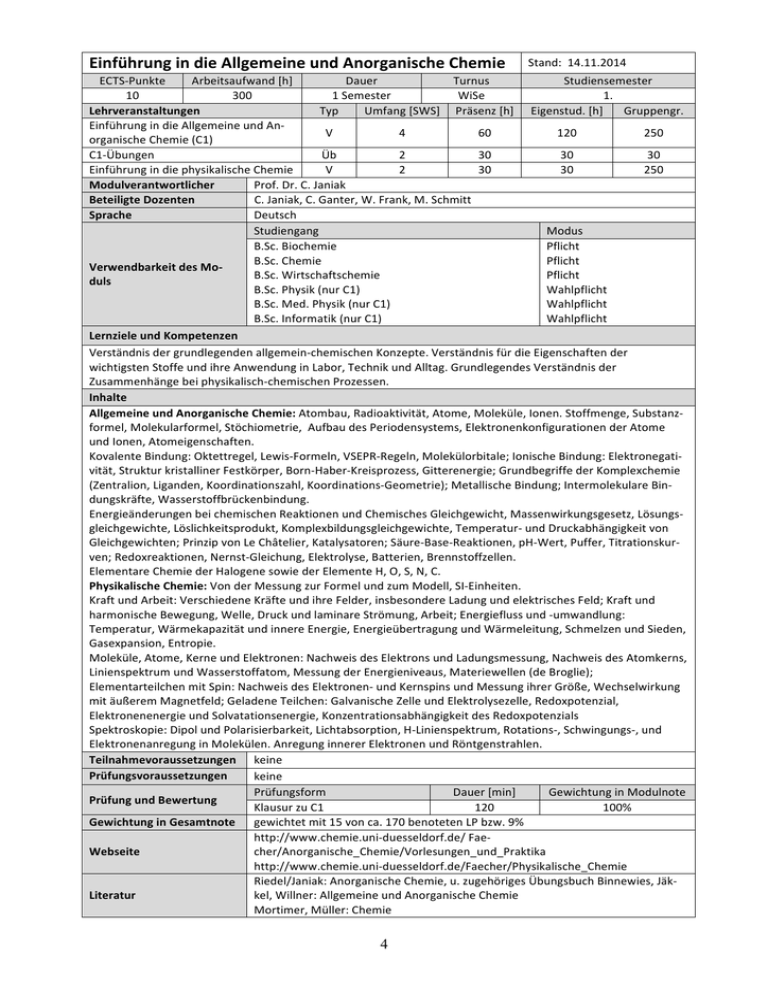
Einführung in die Allgemeine und Anorganische Chemie Stand: 14.11.2014 ECTS-­‐Punkte Arbeitsaufwand [h] Dauer Turnus Studiensemester 10 300 1 Semester WiSe 1. Lehrveranstaltungen Typ Umfang [SWS] Präsenz [h] Eigenstud. [h] Gruppengr. Einführung in die Allgemeine und An-­‐ V 4 60 120 250 organische Chemie (C1) C1-­‐Übungen Üb 2 30 30 30 Einführung in die physikalische Chemie V 2 30 30 250 Modulverantwortlicher Prof. Dr. C. Janiak Beteiligte Dozenten C. Janiak, C. Ganter, W. Frank, M. Schmitt Sprache Deutsch Studiengang Modus B.Sc. Biochemie Pflicht B.Sc. Chemie Pflicht Verwendbarkeit des Mo-­‐ B.Sc. Wirtschaftschemie Pflicht duls B.Sc. Physik (nur C1) Wahlpflicht B.Sc. Med. Physik (nur C1) Wahlpflicht B.Sc. Informatik (nur C1) Wahlpflicht Lernziele und Kompetenzen Verständnis der grundlegenden allgemein-­‐chemischen Konzepte. Verständnis für die Eigenschaften der wichtigsten Stoffe und ihre Anwendung in Labor, Technik und Alltag. Grundlegendes Verständnis der Zusammenhänge bei physikalisch-­‐chemischen Prozessen. Inhalte Allgemeine und Anorganische Chemie: Atombau, Radioaktivität, Atome, Moleküle, Ionen. Stoffmenge, Substanz-­‐ formel, Molekularformel, Stöchiometrie, Aufbau des Periodensystems, Elektronenkonfigurationen der Atome und Ionen, Atomeigenschaften. Kovalente Bindung: Oktettregel, Lewis-­‐Formeln, VSEPR-­‐Regeln, Molekülorbitale; Ionische Bindung: Elektronegati-­‐ vität, Struktur kristalliner Festkörper, Born-­‐Haber-­‐Kreisprozess, Gitterenergie; Grundbegriffe der Komplexchemie (Zentralion, Liganden, Koordinationszahl, Koordinations-­‐Geometrie); Metallische Bindung; Intermolekulare Bin-­‐ dungskräfte, Wasserstoffbrückenbindung. Energieänderungen bei chemischen Reaktionen und Chemisches Gleichgewicht, Massenwirkungsgesetz, Lösungs-­‐ gleichgewichte, Löslichkeitsprodukt, Komplexbildungsgleichgewichte, Temperatur-­‐ und Druckabhängigkeit von Gleichgewichten; Prinzip von Le Châtelier, Katalysatoren; Säure-­‐Base-­‐Reaktionen, pH-­‐Wert, Puffer, Titrationskur-­‐ ven; Redoxreaktionen, Nernst-­‐Gleichung, Elektrolyse, Batterien, Brennstoffzellen. Elementare Chemie der Halogene sowie der Elemente H, O, S, N, C. Physikalische Chemie: Von der Messung zur Formel und zum Modell, SI-­‐Einheiten. Kraft und Arbeit: Verschiedene Kräfte und ihre Felder, insbesondere Ladung und elektrisches Feld; Kraft und harmonische Bewegung, Welle, Druck und laminare Strömung, Arbeit; Energiefluss und -­‐umwandlung: Temperatur, Wärmekapazität und innere Energie, Energieübertragung und Wärmeleitung, Schmelzen und Sieden, Gasexpansion, Entropie. Moleküle, Atome, Kerne und Elektronen: Nachweis des Elektrons und Ladungsmessung, Nachweis des Atomkerns, Linienspektrum und Wasserstoffatom, Messung der Energieniveaus, Materiewellen (de Broglie); Elementarteilchen mit Spin: Nachweis des Elektronen-­‐ und Kernspins und Messung ihrer Größe, Wechselwirkung mit äußerem Magnetfeld; Geladene Teilchen: Galvanische Zelle und Elektrolysezelle, Redoxpotenzial, Elektronenenergie und Solvatationsenergie, Konzentrationsabhängigkeit des Redoxpotenzials Spektroskopie: Dipol und Polarisierbarkeit, Lichtabsorption, H-­‐Linienspektrum, Rotations-­‐, Schwingungs-­‐, und Elektronenanregung in Molekülen. Anregung innerer Elektronen und Röntgenstrahlen. Teilnahmevoraussetzungen keine Prüfungsvoraussetzungen keine Prüfungsform Dauer [min] Gewichtung in Modulnote Prüfung und Bewertung Klausur zu C1 120 100% Gewichtung in Gesamtnote gewichtet mit 15 von ca. 170 benoteten LP bzw. 9% http://www.chemie.uni-­‐duesseldorf.de/ Fae-­‐ Webseite cher/Anorganische_Chemie/Vorlesungen_und_Praktika http://www.chemie.uni-­‐duesseldorf.de/Faecher/Physikalische_Chemie Riedel/Janiak: Anorganische Chemie, u. zugehöriges Übungsbuch Binnewies, Jäk-­‐ Literatur kel, Willner: Allgemeine und Anorganische Chemie Mortimer, Müller: Chemie 4