ρA + ρA
Werbung

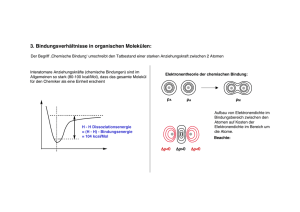
3. Bindungsverhältnisse in organischen Molekülen: Der Begriff ‚Chemische Bindung‘ umschreibt den Tatbestand einer starken Anziehungskraft zwischen 2 Atomen Interatomare Anziehungskräfte (chemische Bindungen) sind im Allgemeinen so stark (80-100 kcal/Mol), dass das gesamte Molekül für den Chemiker als eine Einheit erscheint E H - H H • + H • Energie der separierten H-Atome H - H Dissoziationsenergie = (H - H) - Bindungsenergie = 104 kcal/Mol r (H - H) r0 (H - H) - Bindungsabstand = 0.746 Å Elektronentheorie der chemischen Bindung: ρA ρA ρM atomare Elektronendichte molekulare Elektronendichte Δρ = ρM - (ρA + ρA) Aufbau von Elektronendichte im Bindungsbereich zwischen den Atomen auf Kosten der Elektronendichte im Bereich um die Atome. Beachte: Δρ<0 Δρ>0 Δρ<0 ρM ≠ ρA + ρA Interferenzeffekte elektronische Differenzdichte Δρ ist mittels Röngtenbeugung und Neutronenstreuung experimentell zugängig 3.1. Der vierbindige Kohlenstoff: 3.1.1. Atomorbitale: = Beschreibung der elektronischen Zustände im Rahmen der Quantenmechanik; elektronische Wellenfunktionen = Orbitale physikalische Bedeutung = Aufenthaltswahrscheinlichkeit der Elektronen bei den in organischen Verbindungen am häufigsten vorkommenden Elementen sind nur die die Energieniveaus mit den Hauptquantenzahlen n=1 und n=2 mit Elektronen besetzt. Die beiden Elektronen des Niveaus n=1 befinden sich im kugelsymmetrischen 1s-Orbital. Alle vier Orbitale, welche die 8 Elektronen des Niveaus n=2 aufnehmen sind durch eine Kotenfläche (bzw. bei 2s einen Kugelknoten) zweigeteilt. Jedes dieser Orbitale kann 2 Elektronen mit antiparallelen Spin aufnehmen. Atomorbitale für n = 2: Knotenfläche z z y y x x s px 3.1.2. Elektronenpaarbindungen, Molekülorbitale: py pz einfachster Fall: Wasserstoffmolekül H2 (vgl. vorhergehende Seite) Stärke der Bindung ist abhängig hängt von: - Grad der Überlappung - Form der beteiligten Orbitale (im Falle von 1s-Orbitalen ist diese nicht allzu gross; stärkere Bindungen entstehen unter Beteiligung von p-Orbitalen: F2-Molekül) Elektronenkonfiguration (Fluoratom): 1s2 2s2 2px2 2py2 2pz + Fluoratom F Fluoratom F Fluormolekül F2 die Bindung entsteht durch Überlappung der beiden nur einfach besetzten 2pz-Orbitale (die kugelförmigen s-Orbitale sind weggelassen) Unterschiede zwischen s-Orbitale und p-Orbitale : s-Orbitale:nahe am Kern; starke Anziehung zu Kern p-Orbitale:weiter vom Kern entfernt; folglich: grössere Deformierbarkeit;Richtungsabhängigkeit bei der Bindungsbildung 3.1.3. Das Methanmolekül, sp3-Hybridisierung: Kohlenstoff im Grundzustand: zwei 2s- und zwei 2p-Elektronen (a) (es wären nur 2 Bindungen möglich) durch Energiezufuhr (Kohlenstoff im angeregten Zustand): eines der beiden 2s-Elektronen wird in das leere 2pz-Orbital versetzt (b) (damit stehen vier ungepaarte Elektronen zur Bindungsbildung zur Verfügung)) Energie Erwartung nach Figur (b): das Methanmolekül besitzt 2 Klassen 2p von Bindungen (drei richtungsabhängige, eine richtungsunabhängige) ! 2s Experiment zeigt: (a) (b) alle Bindungen im Methanmolekül sind absolut gleichwertig Erklärung: die vier Orbitale mit der Hauptquantenzahl n=2 sind hybridisiert (= gemischt oder gekreuzt) aus einem s- und drei p-Orbitalen entstehen vier neue, energiegleiche Orbitale: vier sp3-Orbitale (c) Energie 2p sp3 2s (b) Form eines sp3-Orbitals: (c) Überlappungsgrad zwischen einem s-Orbital und einem p- oder sp3-Orbitals: sp3 + s d.h. es entsteht eine starke Bindung, höhere Überlappung d.h. viel Bindungsenergie wird frei, d.h. Energieaufwand für den Übergang vom Grundzustand zum angeregten, hybridisierten Zustand (c) wird mehr als wettgemacht p + s geringere Überlappung Geometrische Anordnung der Atome im CH4 Molekül: H Tetraeder mit C im Zentrum H-C-H Bindungs-Winkel : 109,5 ° C H H aufgrund der elektrostatischen Abstossung ordnen sich die sp3-Orbitale so weit wie möglich voneinander entfernt an: H symbolisiert durch chemisches Formelbild: fette Keile = Bindung ragt aus der Zeichenebene heraus; gestrichelte Keile = Bindung vom Betrachter aus gesehen nach hinten gerichtet Bindungen, die unter Beteiligung von p- oder Hybridorbitalen zustande kommen, sind also gerichtet. Die Art der Orbitale und deren Anordnung im Raum bestimmen die Molekülgeometrie. Einzig bei den kugelsymmetrischen s-Orbitalen ist die Richtung, in der Bindungen gebildet werden, unbestimmt. 3.1.4. Ketten und Ringe: Butan, C4H10: H H H H HH H C C C C H H H H H HH veraltete Schreibweise; die tatsächliche gewinkelte Struktur von Butan ist nicht ersichtlich H H H H H HH HH HH HH H H H die tetraedische Koordination des Kohlenstoffs ist in der perspektivischen Darstellung ersichtlich das Molekül ist um alle Bindungen drehbar; dies bewirkt die Ausbildung unterschiedlicher Konformationen (siehe oben) die Vielzahl von Konformeren des Butans sind nicht voneinander zu trennen; im gasförmigen Zustand (oder in Lösung) sind alle möglichen Konformationen vertreten; im festen Zustand wird ein Molekülgitter aufgebaut durch regelmässiges Übereinanderschichten von Molekülen in einer bestimmten Konformation. Cyclohexan, C6H12: H H H H H H H 109,5 ° H H H H H H H H-Atome werden nicht angeschrieben (übersichtlicher) veraltert H H H H H H H H H Cyclopentan H H H H H H realistischer H Cyclopropan H H H H H gespannter, instabiler H H Cyclobutan H H H H H H H H H H H 3.1.4. Polarisierte Bindungen: Bindungsbildung aus zwei gleichen, sp3-hybridisierten Atomen: symmetrisches Molekülorbital Bindungsbildung aus zwei sp3-hybridisierten Atome unterschiedlicher Elektronegativität: asymmetrisches Molekülorbital + sp3-Orbital von C sp3-Orbital von C symmetrische C-C-Bindung + sp3-Orbital von C p-Orbital von F asymmetrische C-F-Bindung Elektronegativität = Affinität gebundener Atome für Bindungselektronen - beim elektronegativeren Atom ist die Elektronendichte grösser: partielle negative Ladung δ + beim elektropositiveren Atom ist die Elektronendichte geringer: partielle positive Ladung δ + δ H3 C δ - F 3.2. sp2-hybridisierter Kohlenstoff, Doppelbindungen: Bei vielen organischen Verbindungen hat C nur drei Bindungspartner, mit einem davon wird aber eine Doppelbindung ausgebildet H H H3 C H N O H Ethen H H Formaldehyd - C-Atome mit einer Doppelbindung sind sp2-hybridisiert H3 C CH3 N-Methyl-2-propanimin - die Bindungspartner und das sp2-hybridisierte C-Atom selbst liegen in einer gemeinsamen Ebene Form eines sp2-Orbitals: Geometrie eines sp2-hybridisierten C-Atoms: sp2 pz - drei sp2-Orbitale bilden sich aus 2s + 2 px+ 2py - (ein) 2pz bleibt erhalten - Winkel zwischen den sp2 Hybridorbitalen = 120 ° sp2 sp2 (sehr ähnlich dem sp3-Orbital) Orbitale im Ethenmolekül: H H π H C σ H σ -Bindungen: π -Bindungen: H H C H σ C H Überlappung findet auf der Verbindungslinie zwischen den Kernen statt entstehen aus der Überlappung der senkrecht zueinanderstehenden p-Orbitale; bilden ein neues, doppelt besetztes Molekülorbital π-Bindungen sind schwächer als σ-Bindungen π H σ π H H H H C C H H C H Drehung um C-C Doppelbindung ist durch hohe Energiebarriere (ΔE ~ 60 kcal/Mol) gehindert H σ π C O σ H σ 120 ° Formaldehyd auch Doppelbindungen können polarisiert sein (wichtig für die Reaktivität) : H3 C H3 C δ + O δ - Aceton 3.2.2. Mesomerie (Resonanz): Die Eigenschaften vieler Verbindungen können anhand der bis jetzt behandelten Bindungsarten nicht erklärt werden; z.B. das Acetat-Anion: (entsteht durch Dissoziation von Essigsäure) Essigsäure Acetatanion O H3 C O C O C H3C O Proton H H3C + C O H + O zwei gleichwertige, geladene Strukturformeln Realzustand: O H3C Zentren hoher negativer Ladungsdichte C O negative Ladung ist delokalisiert der tatsächliche Zustand des Moleküls (hier Ions) liegt also zwischen den mesomeren Grenzstrukturformen Mit der Mesomerie ist ein Energiegewinn verbunden, der durch die Delokalisation von Bindungen und Ladungen zustande kommt. Dies ist nur bei geeigneter paralleler Orbitalanordnung möglich (hier: p-Orbitale blau) pz n sp 2 Acetatanion n sp 2 pz O H3 C C O n s p2 pz n sp 2 Mesomeriepfeil Unterscheide: im Gegensatz zum Gleichgewichtspfeil Beim Aufstellen von mesomeren Grenzstrukturformen ist darauf zu achten, dass in allen Fällen die Verknüpfung der Atome dieselbe ist. Bei folgender Reaktion handelt es sich demnach nicht um mesomere Grenzformen, sondern um die Beschreibung einer Gleichgewichtsreaktion: O OH H3 C CH3 H2 C Proton wechselt seinen Platz und wandert vom C-Atom zum O-Atom = TAUTOMERIE CH3 3.2.3. Kohlenstoff-Ionen und Radikale: positiv geladene Kohlenstoff-Ionen: negativ geladene Kohlenstoff-Ionen: Carbokationen Carbanionen C-Radikale z.B. Trimethylmethyl-Kation H3 C + CH3 H3 C H3 C C + R sp2-hybridisiert planar - R R sp3-hybridisiert tetraedrisch ! neutral leeres p-Orbital H CH3 R R H3 C C besitzt nur ein Elektronensextett und ist daher sehr reaktionsfähig: C C- + H2O + OH + H C besitzt ein einsames Elektronenpaar und ist sehr reaktionsfähig: ungeladen R3 C - + H2O H H R C besitzt ein ungepaartes Elektron (durch Punkt symbolisiert) und ist sehr reaktionsfähig z.B. + sp2-hybridisiert planar H3 C R3 C - H + HO durch Mesomerieeffekte können Carbokationen, Carbanionen, bzw Radikale stabilisiert sein: z.B. Carbanion des deprotonierten Malonsäuredimethylesters O - H C O C C dieses Carbanion ist eben aufgebaut; das einsame Elektronenpaar tritt mit den p-Orbitalen der direkt benachbarten Doppelbindungen (Carbonylgruppen C=O) in Wechselwirkung OCH3 OCH3 3.3. sp-hybridisierter Kohlenstoff, Dreifachbindungen: Bei einigen organischen Verbindungen hat C nur zwei Bindungspartner, mit einem davon wird eine Dreifachbindung ausgebildet H C C H Ethin (Acetylen) - C-Atome mit einer Dreifachbindung sind sp-hybridisiert - die Bindungspartner und das sp-hybridisierte C-Atom selbst liegen auf einer Geraden Form eines sp-Orbitals: Geometrie eines sp-hybridisierten C-Atoms: 2pz sp 2py sp - zwei sp-Orbitale bilden sich aus 2s + 2 px - (ein) 2py + (ein) 2pz bleiben erhalten (ähnlich dem sp3-und sp2-Orbital; aber etwas bauchiger) Orbitale im Ethinmolekül: H π H H π C σ C H 3.4. s- und p- Charakteranteile von Hybridorbitalen: Regel: Hybridorbital s-Charakter p-Charakter sp3 25 % 75 % sp2 33,3 % 66,7 % 50 % 50 % sp mit zunehmendem s-Charakter wird die Bindung kürzer und stärker (s-Elektronen sind näher am Kern; werden stärker angezogen) länger als d.h.: länger als Elektronegativität hybridisierter C-Atome nimmt in der Reihenfolge sp3 < sp2 < sp zu Bindungen in der Reihe Ethan (CH3-CH3), Ethen, Ethin werden immer stärker, da das Elektronenpaar immer stärker vom C-Atom angezogen wird, C-H Bindung im Ethin ist am stärksten, lässt sich daher am schlechtesten homolytisch spalten. Andererseits: aufgrund der starken Anziehung ist es bei Ethin am leichtesten den Wasserstoff ohne sein Elektron als H+-Ion abzuspalten; Ethin ist daher eine, allerdings sehr schwache, Säure; mit starken Basen kann man das entsprechende Salz herstellen: H C C H + NaNH2 H C C - + + Na + NH3 3.5. Bindungsverhältnisse bei Stickstoff und Sauerstoff 3.5.1. Ammoniak, NH3 tetrahedral (pyramidal) Inversion der pyramidalen Konfiguration erfordert Energie: trigonal planar Inversionsbarriere bei aliphatischen Aminen: lone-pair H N H N H H H H 4 x sp3 (N), 3 x 1s (H) ΔE ~ 6 - 10 kcal / Mol (entspricht 108 -106 Inversionen pro Sekunde) E m ol N N N 3 x sp2 (N), 1 x p (N), 3 x 1s (H) - p-Orbital ungünstiger als sp3-Hybridorbital (25% s Charakter) ΔE - σNH aus sp2(N) (33% s-Char.) und 1s(H) energetisch etwas günstiger als σNH aus sp3-(N) (25% s Char.) und 1s(H) Inversionkoordinate Experimentell: das N-Atom in einem gesättigten Amin besitzt wichtig: pyramidale Konfiguration unterscheide Amide: planar O N H analog Essigsäure 3.5.2. Wasser, H2O das O-Atom in Wasser ist sp3-hybridisiert zwei einsame Elektronenpaare in zwei sp3-Hybridorbitalen Experimentell: das O-Atom in Wasser, in Alkoholen (R-OH), in Ethern (R-O-R) besitzt eine gewinkelte Konfiguration R-O-R‘ Winkel γ ~ 104 - 112 ° (je nach Art von R und R‘) O H γ H Elektronenpaarbindung zwischen einem Elektronenpaar-Donor und -Akzeptor H+ N NH3 + + H Elektronenpaardonor: R - R Carbanion R +N H + NH4 Energiegewinn durch Ausbildung einer vierten Elektronenpaarbindung unter Beteiligung eines besetzten und eines leeren nicht-bindenden Orbitals Atom oder Molekül mit Elektronenpaar in einem nicht bindenden bzw. energetisch hochliegenden Orbital nucleophiler Partner bei der Bindungsbildung; N nucleophiles Zentrum: Zentrum mit nicht-bindendem Elektronenpaar Lewis-Base O - OH O O O Elektronenpaarakzeptors: Atom oder Molekül mit einem leeren nicht-bindenden Bzw. energetisch besonders tiefliegenden Orbital + Carbokation elektrophiler Partner bei der Bindungsbildung; elektrophiles Zentrum: Zentrum mit leerem Orbital Lewis-Säure H + BH3 2+ Zn O 3.6. Moleküle mit mehreren Doppelbindungen isolierte Doppelbindung: durch zwei oder mehrere C-C-Einfachbindungen getrennte Doppelbindungen 2.6.1. Konjugierte Doppelbindung: H C H C 1,3-Butadien H π H tatsächlich: Unterschiede in der Länge H zw. C-C und C=C Bindungen C sind nicht so stark H ausgeprägt C H C H H π σ H C σ C C H H die π-Elektronen breiten sich über das ganze Molekül aus = Konjugative Stabilisierung energetisch günstig ! 3.6.2. Kumulierte Doppelbindung: einfachste Verbindung mit kumullierter Doppelbindung: π π H H2 C C CH2 Allen C C H H C mittleres C-Atom: sp-hybridisiert H 3.6.3. Aromatische Verbindungen: Pericyclische konjugierte, planare π-Systeme mit 4n+2 π-Elektronen erhalten eine besonders hohe konjugative Stabilisierung = Hückel-Regel Beispiel: Benzol Realstruktur: experimentell: rCC(Benzol) = 1.396 Å zwei gleichwertige Grenzstrukturen vergleiche: rC-C = 1.54 Å alle C-Atome: sp2-hybridisiert rC=C = 1.34 Å Derartige Ringsysteme werden auch aromatische Verbindungen bezeichnet: weitere Beispiele: H N H N O S N Anzahl der π-Elektronen: Pyrrol Furan Thiophen Pyridin Naphtalin Indol Anthracen 6 6 6 6 10 10 14 N N H das freie Elektronenpaar von N nimmt am Ringstrom teil ! Pyrrol ist schwer zu protonieren das freie Elektronenpaar von N nimmt nicht am Ringstrom teil ! Allgemeine Definition der Säuredissoziationskonstante + - HA (aq) H (aq) +A (aq) + [H ] [A-] K = [HA ] pKa = - log Ka Pyridin ist leicht zu protonieren; Pyridin ist eine Base + hier: Pyrrol.H Pyrrol pKa ~ 0 pKa = 5.2 (Pyridin analog) Substituierte aromatische Verbindungen: sterische Hinderung durch die Methylgruppen CH3 O NO2 N N O CH3 O O NO2 CH3 Nitrobenzol entspricht HA - entspricht A 2,6-Dimethylnitrobenzol N O O O CH3 N O CH3 3.6.4. Weitere Beispiele für mesomeriestabilisierte Verbindungen: - Atom- und Bindungssymbole - Symbole für nichtbindende Elektronenpaare bzw. ungepaarte Elektronen - Ladungssymbole klassische Strukturformel die Bindungsverhältnisse in einem konjugierten System sind beschreibbar durch die Überlagerung verschiedener, für ein und dieselbe Kernanordnung schreibbarer Strukturformeln (= Grenzstrukturen, = mesomere Grenzstrukturen) Vorgehen bei konjugiertem Bindungssystem: 1) Erstellen einer Liste aller schreibbaren Grenzstrukturen 2) Energetische Beurteilung der Grenzstrukturen 3) Schlussfolgerungen für das konjugierte Bindungssystem: A) konjugiertes Bindungssystem gleicht strukturell einer GEWICHTETEN ÜBERLAGERUNG aller schreibbaren Grenzstrukturen: - bei gleichwertigen Grenzstrukturen tragen alle zu gleichen Teilen zur Realstruktur bei - bei ungleichwertigen Grenzstrukturen gleicht die Realstruktur der energetisch günstigsten Grenzstruktur B) konjugiertes Bindungssystem ist energetisch stabiler als jede schreibbare Grenzstruktur (= konjugative Stabilisierung, = Resonanzstabilisierung, = Mesomeriestabilisierung) Qualitative Beurteilung von Grenzstrukturen: - Optimale Grenzstrukturen haben: - maximale Zahl von kovalenten Bindungen - keine Ladungstrennung - falls Ladungstrennung, Ladung auf geeigneter Elektronegativität Beispiele bisher: Acetatanion, Benzol (= gleichwertige Grenzstrukturformeln) Amide: O- O R R A N B + N -beide Grenzstrukturen haben maximale Zahl kovalenter Bindungen Realstruktur ist näher dem Zustand A; Beitrag von B manifestiert sich in: - r(CNAmid) = 1.352 Å r(C-N) = 1.47 Å r(C=N) = 1.27 Å - Rotationsbarriere ΔE ~ 20 kcal/Mol - planare Konfiguration am N-Atom (sp2-hybridisiert) -Grenzstruktur A ohne Ladungstrennung, = energetisch besser als Grenzstruktur B (B = dipolare Grenzstruktur) Allylkation: folgende Reaktion (heterolytische Bindungsspaltung) findet NICHT statt (primäres Carbokation ist extrem instabil): H3 C Cl + CH2 + H3 C 1-Chlorbutan Cl primäres Carbokation hingegen kann folgende Reaktion beobachtet werden: H H3 C Cl + CH2 H3 C A 1-Chlor-2-buten Stabilität: H + + CH2 H3 C Cl B H H primäres < sekundäres < tertiäres Carbokation sekundäres Carbokation Beweis für die Mesomerie: OH H H3 C + CH 2 OH H3 C OH + H3 C ca. 25% H CH2 ca. 75% Nitrobenzol: O + ON - O + O N - O + ON - O + ON + - O + ON + + (vgl. Nitrocyclohexan: nur 2 Grenzstrukturformeln; weniger stabil; vgl. Kaufmann, Hädener, 10 Aufl., S.34)