3. Bindungsverhältnisse in organischen Molekülen:
Werbung

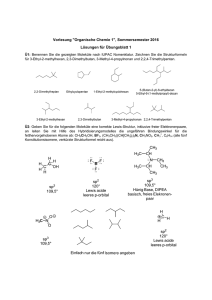
3. Bindungsverhältnisse in organischen Molekülen: Der Begriff ‚Chemische Bindung‘ umschreibt den Tatbestand einer starken Anziehungskraft zwischen 2 Atomen Interatomare Anziehungskräfte (chemische Bindungen) sind im Allgemeinen so stark (80-100 kcal/Mol), dass das gesamte Molekül für den Chemiker als eine Einheit erscheint Elektronentheorie der chemischen Bindung: ρA ρA ρM Aufbau von Elektronendichte im Bindungsbereich zwischen den Atomen auf Kosten der Elektronendichte im Bereich um die Atome. H - H Dissoziationsenergie = (H - H) - Bindungsenergie = 104 kcal/Mol Beachte: ∆ρ<0 ∆ρ>0 ∆ρ<0 3.1. Der vierbindige Kohlenstoff: 3.1.1. Atomorbitale: bei den in organischen Verbindungen am häufigsten vorkommenden Elementen sind nur die die Energieniveaus mit den Hauptquantenzahlen n=1 und n=2 mit Elektronen besetzt. Die beiden Elektronen des Niveaus n=1 befinden sich im kugelsymmetrischen 1s-Orbital. Alle vier Orbitale, welche die 8 Elektronen des Niveaus n=2 aufnehmen sind durch eine Kotenfläche (bzw. bei 2s einen Kugelknoten) zweigeteilt. Jedes dieser Orbitale kann 2 Elektronen mit antiparallelen Spin aufnehmen. Atomorbitale für n = 2: 3.1.2. Elektronenpaarbindungen, Molekülorbitale: Stärke der Bindung ist abhängig hängt von: einfachster Fall: Wasserstoffmolekül H2 (vgl. vorhergehende Seite) (im Falle von 1s-Orbitalen ist diese nicht allzu gross; stärkere Bindungen entstehen unter Beteiligung von p-Orbitalen: F2-Molekül) Elektronenkonfiguration (Fluoratom): 1s2 2s2 2px2 2py2 2pz + Fluoratom F Fluormolekül F2 Fluoratom F die Bindung entsteht durch Überlappung der beiden nur einfach besetzten 2pz-Orbitale (die kugelförmigen s-Orbitale sind weggelassen) Unterschiede zwischen s-Orbitale und p-Orbitale : s-Orbitale: p-Orbitale: 3.1.3. Das Methanmolekül, sp3-Hybridisierung: Kohlenstoff im Grundzustand: (es wären nur 2 Bindungen möglich) durch Energiezufuhr (Kohlenstoff im angeregten Zustand): (damit stehen vier ungepaarte Elektronen zur Bindungsbildung zur Verfügung)) Erwartung nach Figur (b): Experiment zeigt: Erklärung: aus einem s- und drei p-Orbitalen entstehen vier neue, energiegleiche Orbitale: Energie 2p 2s Form eines sp3-Orbitals: Überlappungsgrad zwischen einem s-Orbital und einem p- oder sp3-Orbitals: Geometrische Anordnung der Atome im CH4 Molekül: H C H H H symbolisiert durch chemisches Formelbild: fette Keile = Bindung ragt aus der Zeichenebene heraus; gestrichelte Keile = Bindung vom Betrachter aus gesehen nach hinten gerichtet Bindungen, die unter Beteiligung von p- oder Hybridorbitalen zustande kommen, sind also gerichtet. Die Art der Orbitale und deren Anordnung im Raum bestimmen die Molekülgeometrie. Einzig bei den kugelsymmetrischen s-Orbitalen ist die Richtung, in der Bindungen gebildet werden, unbestimmt. 3.1.4. Ketten und Ringe: Butan, C4H10: veraltete Schreibweise; die tatsächliche gewinkelte Struktur von Butan ist nicht ersichtlich die tetraedische Koordinationdes Kohlenstoffs ist in der perspektivischen Darstellung ersichtlich die Vielzahl von Konformeren des Butans sind nicht voneinander zu trennen; im gasförmigen Zustand (oder in Lösung) sind alle möglichen Konformationen vertreten; im festen Zustand wird ein Molekülgitter aufgebaut durch regelmässiges Übereinanderschichten von Molekülen in einer bestimmten Konformation. Cyclohexan, C6H12: H-Atome werden nicht angeschrieben (übersichtlicher) veraltert H H H H H H H H H Cyclopentan Cyclobutan H H H realistischer H H H H H H Cyclopropan H H H H H H 3.1.4. Polarisierte Bindungen: Bindungsbildung aus zwei gleichen, sp3-hybridisierten Atomen: Bindungsbildung aus zwei sp3-hybridisierten Atome unterschiedlicher Elektronegativität: + sp3-Orbital von C sp3-Orbital von C symmetrische C-C-Bindung + sp3-Orbital von C p-Orbital von F asymmetrische C-F-Bindung + δ H3 C - δ F 3.2. sp2-hybridisierter Kohlenstoff, Doppelbindungen: Bei vielen organischen Verbindungen hat C nur drei Bindungspartner, mit einem davon wird aber eine Doppelbindung ausgebildet H H H3 C H N O H Ethen H H Formaldehyd H3 C CH3 N-Methyl-2-propanimin Form eines sp2-Orbitals: Geometrie eines sp2-hybridisierten C-Atoms: sp2 pz sp2 sp2 (sehr ähnlich dem sp3-Orbital) Orbitale im Ethenmolekül: H H C H C H σ -Bindungen: π -Bindungen: H C H σ H H H C C H H Hσ auch Doppelbindungen können polarisiert sein (wichtig für die Reaktivität) : π O σ H σ 120 ° C C H Formaldehyd Aceton 3.2.2. Mesomerie (Resonanz): Die Eigenschaften vieler Verbindungen können anhand der bis jetzt behandelten Bindungsarten nicht erklärt werden; z.B. das Acetat-Anion: (entsteht durch Dissoziation von Essigsäure) Essigsäure Acetatanion O H3 C O C H3C O Proton H O C H3C + C O H + O zwei gleichwertige, geladene Strukturformeln Realzustand: O H3C Zentren hoher negativer Ladungsdichte C O negative Ladung ist delokalisiert der tatsächliche Zustand des Moleküls (hier Ions) liegt also zwischen den mesomeren Grenzstrukturformen Mit der Mesomerie ist ein Energiegewinn verbunden, der durch die Delokalisation von Bindungen und Ladungen zustande kommt. Dies ist nur bei geeigneter paralleler Orbitalanordnung möglich (hier: p-Orbitale blau) pz n sp 2 Acetatanion n sp 2 pz O H3 C C O n s p2 pz n 2 sp Unterscheide: Mesomeriepfeil im Gegensatz zum Gleichgewichtspfeil Beim Aufstellen von mesomeren Grenzstrukturformen ist darauf zu achten, dass in allen Fällen die Verknüpfung der Atome dieselbe ist. Bei folgender Reaktion handelt es sich demnach nicht um mesomere Grenzformen, sondern um die Beschreibung einer Gleichgewichtsreaktion: O OH H3 C CH3 H2 C CH3 3.2.3. Kohlenstoff-Ionen und Radikale: positiv geladene Kohlenstoff-Ionen: negativ geladene Kohlenstoff-Ionen: Carbokationen Carboanionen C-Radikale z.B. Trimethylmethyl-Kation H3 C R + - CH3 H3 C R R H3 C H3C C + H CH3 R R H3 C C besitzt nur ein Elektronensextett und ist daher sehr reaktionsfähig: C C- H R C besitzt ein einsames Elektronenpaar und ist sehr reaktionsfähig: z.B. + + ungeladen + H + C besitzt ein ungepaartes Elektron (durch Punkt symbolisiert) und ist sehr reaktionsfähig durch Mesomerieeffekte können Carbokationen, Carbanionen, bzw Radikale stabilisiert sein: z.B. Carbanion des deprotonierten Malonsäuredimethylesters O C - H C O C OCH3 OCH 3 3.3. sp-hybridisierter Kohlenstoff, Dreifachbindungen: Bei einigen organischen Verbindungen hat C nur zwei Bindungspartner, mit einem davon wird eine Dreifachbindung ausgebildet H C C H Ethin (Acetylen) Form eines sp-Orbitals: Geometrie eines sp-hybridisierten C-Atoms: (ähnlich dem sp3-und sp2-Orbital; aber etwas bauchiger) Orbitale im Ethinmolekül: H C σ C H 3.4. s- und p- Charakteranteile von Hybridorbitalen: Regel: Hybridorbital s-Charakter p-Charakter sp3 25 % 75 % sp2 33,3 % 66,7 % sp 50 % 50 % (s-Elektronen sind näher am Kern; werden stärker angezogen) d.h.: Bindungen in der Reihe Ethan (CH3-CH3), Ethen, Ethin werden immer stärker, da das Elektronenpaar immer stärker vom C-Atom angezogen wird, C-H Bindung im Ethin ist am stärksten, lässt sich daher am schlechtesten homolytisch spalten. Andererseits: aufgrund der starken Anziehung ist es bei Ethin am leichtesten den Wasserstoff ohne sein Elektron als H+-Ion abzuspalten; Ethin ist daher eine, allerdings sehr schwache, Säure; mit starken Basen kann man das entsprechende Salz herstellen: + + + 3.5. Bindungsverhältnisse bei Stickstoff und Sauerstoff 3.5.1. Ammoniak, NH3 tetrahedral (pyramidal) Inversion der pyramidalen Konfiguration erfordert Energie: trigonal planar Inversionsbarriere bei aliphatischen Aminen: H N H N H H H H Em ol N N N - p-Orbital ungünstiger als sp3-Hybridorbital (25% s Charakter) - σ NH aus sp2(N) (33% s-Char.) und 1s(H) energetisch etwas günstiger als σNH aus sp3-(N) (25% s Char.) und 1s(H) Inversionkoordinate Experimentell: O wichtig: unterscheide Amide: planar N H analog Essigsäure 3.5.2. Wasser, H2O das O-Atom in Wasser ist sp3-hybridisiert Experimentell: das O-Atom in Wasser, in Alkoholen (R-OH), in Ethern (R-O-R) besitzt eine gewinkelte Konfiguration O H H Elektronenpaarbindung zwischen einem Elektronenpaar-Donor und -Akzeptor H+ N NH3 + + H Elektronenpaardonor: R - R Carbanion R +N H Energiegewinn durch Ausbildung einer vierten Elektronenpaarbindung unter Beteiligung eines besetzten und eines leeren nicht-bindenden Orbitals + NH4 Atom oder Molekül mit Elektronenpaar in einem nicht bindenden bzw.energetisch hochliegenden Orbital nucleophiler Partner bei der Bindungsbildung; nucleophiles Zentrum: Zentrum mit nicht-bindendem Elektronenpaar O - OH O O O Lewis-Base Elektronenpaarakzeptors: Atom oder Molekül mit einem leeren nicht-bindenden bzw. bzw.energetisch besonders tiefliegenden Orbital + N Carbokation elektrophiler Partner bei der Bindungsbildung; elektrophiles Zentrum: Zentrum mit leerem, nicht-bindenden Elektronenpaar Lewis-Säure + H BH3 2+ Zn O 3.6. Moleküle mit mehreren Doppelbindungen isolierte Doppelbindung: 2.6.1. Konjugierte Doppelbindung: 1,3-Butadien tatsächlich: Unterschiede in der Länge zw. C-C und C=C Bindungen sind nicht so stark ausgeprägt H H C H σ C C σ H C H H = Konjugative Stabilisierung energetisch günstig ! 3.6.2. Kumulierte Doppelbindung: einfachste Verbindung mit kumullierter Doppelbindung: H H C Allen C H C mittleres C-Atom: H 3.6.3. Aromatische Verbindungen: Pericyclische konjugierte, planare π-Systeme mit 4n+2 π-Elektronen erhalten eine besonders hohe konjugative Stabilisierung Beispiel: Benzol Realstruktur: experimentell: rCC(Benzol) = 1.396 Å vergleiche: rC-C = 1.54 Å alle C-Atome: rC=C = 1.34 Å Derartige Ringsysteme werden auch aromatische Verbindungen bezeichnet: H N weitere Beispiele: H N O S N Anzahl der π-Elektronen: Pyrrol Furan Thiophen Pyridin Naphtalin Indol Anthtracen 6 6 6 6 10 10 14 N Allgemeine Definition der Säuredissoziationskonstante + HA (aq) H (aq) + A (aq) + [H ] [A - ] K = [HA ] N H pKa = - log Ka + hier: Pyrrol.H Pyrrol pKa ~ 0 pKa = 5.2 entspricht HA entspricht A (Pyridin analog) Substituierte aromatische Verbindungen: CH 3 NO2 N O O NO2 O N O CH3 CH 3 Nitrobenzol 2,6-Dimethylnitrobenzol 3.6.4. Weitere Beispiele für mesomeriestabilisierte Verbindungen: - Atom- und Bindungssymbolen - Symbole für nichtbindende Elektronenpaare bzw. ungepaarte Elektronen - Ladungssymbole klassische Strukturformel die Bindungsverhältnisse in einem konjugierten System sind beschreibbar durch die Überlagerung verschiedener, für ein und dieselbe Kernanordnung schreibbarer Strukturformeln (= Grenzstrukturen, = mesomere Grenzstrukturen) 1) Erstellen einer Liste aller schreibbaren Grenzstrukturen 2) Energetische Beurteilung der Grenzstrukturen 3) Schlussfolgerungen für das konjugierte Bindungssystem: A) konjugiertes Bindungssystem gleicht strukturell einer GEWICHTETEN ÜBERLAGERUNG aller schreibbbaren Grenzstrukturen: - bei gleichwertigen Grenzstrukturen tragen alle zu gleichen Teilen zur Realstruktur bei - bei ungleichwertigen Grenzstrukturen gleicht die Realstruktur der energetisch günstigsten Grenzstruktur B) konjugiertes Bindungssystem ist energetisch stabiler als jede schreibbare Grenzstruktur (= konjugative Stabilisierung, = Resonanzstabilisierung, = Mesomeriestabilisierung) - maximale Zahl von kovalenten Bindungen - keine Ladungstrennug - falls Ladungstrennug, Ladung auf geeigneter Elektronegativität Beispiele bisher: Acetatanion, Benzol (= gleichwertige Grenzstrukturformeln) Amide: O R R A N Realstruktur ist näher dem Zustand A; Beitrag von B manifestiert sich in: O- B - r(CNAmid) = 1.352 Å r(C-N) = 1.47 Å r(C=N) = 1.27 Å + N - Rotationsbarriere -beide Grenzstrukturen haben maximale Zahl kovalenter Bindungen -Grenzstruktur A ohne Ladungstrennung, = energetisch besser als Grenzstruktur B ∆E ~ 20 kcal/Mol - planare Konfiguration am N-Atom (sp2-hybridisiert) (B = dipolare Grenzstruktur) Allylkation: folgende Reaktion (heterolytische Bindungsspaltung) findet NICHT statt (primäres Carbokation ist extrem instabil): 1-Chlorbutan primäres Carbokation hingegen kann folgende Reaktion beobachtet werden: H + CH 2 H3 C CH 2 H3 C H 1-Chlor-2-buten Stabilität: H + H sekundäres Carbokation Beweis für die Mesomerie: OH + ca. 25% ca. 75% Nitrobenzol: O + O N - O + O N - O + ON + (vgl. Nitrocyclohexan: nur 2 Grenzstrukturformeln; weniger stabil; vgl. Kaufmann, Hädener, 10 Aufl., S.34 ) primäres < sekundäres < tertiäres Carbokation







![6.3.1 1-Oxa-spiro[2.5]octan - Institut für Organische Chemie](http://s1.studylibde.com/store/data/001356875_1-96e669e5c88ad586db9f9f199d424d05-300x300.png)

