Lösung
Werbung

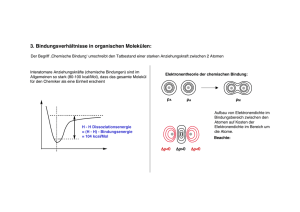
Vorlesung "Organische Chemie 1", Sommersemester 2016 Lösungen für Übungsblatt 1 Ü1: Benennen Sie die gezeigten Moleküle nach IUPAC Nomenklatur. Zeichnen Sie die Strukturformeln für 3-Ethyl-2-methylhexan, 2,3-Dimethylbutan, 3-Methyl-4-propylnonan und 2,2,4-Trimethylpentan. Ü2: Geben Sie für die folgenden Moleküle eine korrekte Lewis-Struktur, inklusive freier Elektronenpaare, an leiten Sie mit Hilfe des Hybridisierungsmodelles die ungefähren Bindungswinkel für die fetthervorgehobenen Atome ab: CH3CH2OH, BF3, (CH3CH2)(CH[CH3]2)2N, CH3NO2, CH3+, C6H14 (alle fünf Konstitutionsisomere, verkürzte Strukturformel reicht aus). Ü3: Zeichnen Sie das 2s und die drei 2p-Orbitale. Zeichnen Sie die daraus resultierenden sp3, sp2 und sp-Hybridorbitale. Nennen Sie die resultierenden Bindungswinkel wenn die Hybridorbitale -Bindungen eingehen und die geometrische Ausrichtung der Bindungen im Raum. Bindungswinkel = 109.5°, tetraedrisch zwei weitere sp2-Orbitale orthogonal dazu Bindungswinkel = 120°, trigonal-planar ein weiteres sp-Orbital orthogonal dazu Bindungswinkel = 180°, linear Ü4: Geben Sie für folgende Moleküle Partialladungen so an, dass die Polarität der enthaltenen Bindungen korrekt wiedergegeben wird. Zeichnen Sie Lewis-Strukturen mit freien Elektronenpaaren: CH3F, CH3OH, (COCl)2, CH3(CH2)3Li, CH2NH. Zeichnen Sie die Resonanzformeln des Essigsäureanions. Take-Home-Message: Was bedeuten Partialladungen, wie werden sie erstellt und was ist der Unterschied zu einer Formalladung? Wo ist die Bildung einer polaren Bindung wichtig? Partialladungen entstehen zwischen Atomen mit Elektronegativitätsdifferenz. Partialladungen helfen bei der Einschätzung der Reaktivität von chemischen Verbindungen und werden anhand der Elektronegativitäten (EN nimmt in der Regel innerhalb einer Elementperiode von links nach rechts zu und innerhalb einer Elementgruppe von oben nach unten ab) ermittelt. Partialladungen sind nützlich um Abgangsgruppen und acide Protonen zu definieren, und den lokalen Angriff eines Reagenzes zu bestimmen (nukleophiles Zentrum (-) reagiert mit elektrophilem Zentrum (+). Zur Ermittlung der Formalladung werden die Bindungen gedanklich homolytisch gespalten und die Elektronen an den Atomen gezählt. Diese Zahl wird mit der Gesamtzahl seiner Valenzelektronen im freien Zustand verglichen. Der Resonanzpfeil darf nicht mit dem Gleichgewichtspfeil verwechselt werden! Ü5: Zeichnen sie für Ethan, Ethen und Ethin die an den Bindungen beteiligten Atomorbitale. Zeichnen Sie σ- und π- Bindungen ein. Welche Hybridisierung liegt hier jeweils vor? Ethan = sp3‐hybridisierte Kohlenstoffatome Ethen = sp2 -hybridisierte Kohlenstoffatome Ethin = sp‐hybridisierte Kohlenstoffatome