gentechnik vorteile und risiken agrobacterium tumefaciens
Werbung
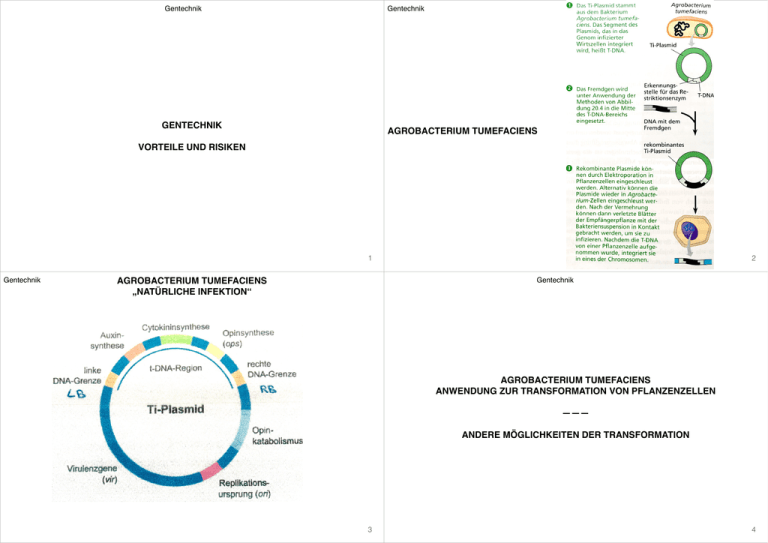
Gentechnik Gentechnik GENTECHNIK AGROBACTERIUM TUMEFACIENS VORTEILE UND RISIKEN 1 Gentechnik 2 Gentechnik AGROBACTERIUM TUMEFACIENS „NATÜRLICHE INFEKTION“ AGROBACTERIUM TUMEFACIENS ANWENDUNG ZUR TRANSFORMATION VON PFLANZENZELLEN ——— ANDERE MÖGLICHKEITEN DER TRANSFORMATION 3 4 ➡ Möglichkeit zum gezielten Eingriff in das Genom ➡ rekombinante DNA gentechnisch veränderte Organismen • Modellorganismus, der die Fähigkeit besitzt, DNA in pflanzliche Zellen zu übertragen • gramnegativ, sporenlos, aerob, bewegliches Stäbchen • Pflanzenpathogen: Ti-Plasmid (Tumor induzierende Gene enthalten) zur Transformation Pflanzenzellenzu autonom wuchernden Tumorzellen (Bildung von Wurzeltumoren) ➡ Pflanzenzellen werden veranlasst, Opine (Octopin, Nopalin) zu produzieren, die den Bakterien als Nahrung dienen, für die Pflanze jedoch wertlos sind (➝ Nutzen für Bakterien) ➝ C- und N-Quelle • Wirtsbereich von A. tumefaciens sehr weit, hauptsächlich dikotyle und gymnosperme Pflanzen Ti-Plasmid: • besteht aus 2o.ooo Basenpaare, ca. 1oo Genen ➡ nur ein kleiner Teil des Ti-Plasmids (T-DNA, Tumor-DNA) wird in Pflanzenzelle eingeschleust Anwendung zur Transformation von Pflanzenzellen siehe auch ➝ Transformation durch Agrobakterien • für Freisetzung der T-DNA werden nur Randsequenzen (LB, RB) benötigt ➡ dazwischen liegende Gene (onc-Gene) können durch Restriktionsenzyme entfernt werden ➡ kein unkontrolliertes Wachstum ➡ Ersetzen durch andere Gene (rekombiniertes Plasmid) • Einbringen von Markergeben für die Selektion (GFP: grün fluoreszierendes Protein) Vorteile — Zuchtziele • Herbizidtoleranz ➝ Einsparung von Herbiziden, Pestiziden • Resistenz gegenüber Schadorganismen (siehe Bt-Sorten) • Pilzresistenzen (gegen Phytophlora infestans bei Kartoffeln, Minderung der Mykotoxinbildung durch Fusarium bei Weizen) • Verbesserung der Ernährung, Optimierung vorhandener Qualitäten, höhere Ertragsfähigkeit (golden rice; Verbesserung der Transport-, Lager-, Verarbeitungseigenschaften • nachwachsende Rohstoffe zur industriellen Verwertung (amylosefreie Kartoffel (Amflora) für die Papierherstellung ➝ geringerer Energieverbrauch) Produktion von Insulin, Interferonen, Antikörpern für die Pharmaindustrie Risiken • allergenes Potenzial neu eingeführter Proteine nicht abschätzbar (➝ Nahrungsmittelunverträglichkeiten) • Nachweis,dass gentechnisch verändertes Soja die Leberstruktur von Mäusen verändert • horizontaler Gentransfer (Boden- oder Darmbakterien) • vertikaler Gentransfer (gleiche Art oder verwandte Wildpflanzen) • Beeinträchtigung der Biodiversität durch Verdrängung traditioneller Nutzpflanzen ➝ Monokulturanbau, bedingt durch Selektionsvorteil der gentechnisch veränderten Pflanze erfolgt durch kleinste Verletzungen am Wurzelhals der Pflanze ➡ Austreten von sekundären Pflanzenstoffen aus verwundeten Pflanzenteilen (phenolische Verbindungen) ➡ Anlockung von Bakterien durch chemisches Signal (positive Chemotaxis) ➡ Induktion der Genaktivität von vir-Genen (wichtig für Transferprozess) durch vir-Gene exprimierte Proteine erfüllen verschiedene Funktionen: • Kopierung der T-DNA des Ti-Plasmids in einzelsträngige DNA • Verpackung in Proteine • Transport unter ATP-Beteiligung an Tubulinsträngen in der Zellkern der Wirtszelle (mithilfe bakteriellen Sekretinssystems) ➡ Transfer erfolgt über Proteinkanäle von der Bakterien- in die Pflanzenzelle Im Zellkern: Abbau der die T-DNA umgebenden Proteine • andere Möglichkeiten der Transformation: • Synthese des Komplementärstrangs zur T-DNA • Partikel-Bombardemont (Bioliostik): DNA auf Gold- oder Wolframpartikel fixiert • Integration der doppelsträngigen DNA in das Wirtsgenom (Ort der Insertion zufällig) ➡ Mikroprojektile werden mit Druck in Zelle geschossen • bakterielle Promotoren werden in der Pflanzenzelle erkannt • Elektroporation: kurze Hochspannungsimpulse bewirken kurzzeitiges Öffnen von Poren in ➡ Gene in der Pflanze sind aktiv! der Plasmamembran (sich schnell entladender Kondensator) Onc-Gene auf T-DNA codieren für Biosynthese-Enzyme • • Mikroinjektion: Einbringen von Genen in Protoplasen mittels feiner Kanülen • Phytohormone Auxine + Cytokine sorgen für ungehemmte Teilung ➡ Tumorbildung • GenO (ops) codiert für opinsynthesierendes Enzym (Opinsynthase) Gentechnik Gentechnik TRANSFORMATION DURCH AGROBAKTERIEN ——— SCHRITTE BEI DER HERSTELLUNG TRANIGEREN PFLANZEN RESTRIKTIONSENZYME 5 6 Gentechnik Gentechnik BT-MAIS (TRANSGENE PFLANZEN-BEISPIELE) ZUR SELEKTIONIERUNG: LACZ ALS REPORTERGEN 7 8 1) Isolierung und genaue Charakterisierung des zu übertragenden DNA-Moleküls (Genabschnitt, Gen, cDNA) 2) Konstruktion eines Klonierungsvektors, mit dem sich das zu übertragende Gen in einen geeigneten Rezipienten übertragen und in hoher Kopienzahl replizieren lässt (Klonierungsvektoren: meist Abkömmlinge bakterieller Resistenzplasmide) 3) Konstruktion eines Trensformationsvektors (meist Plasmid) und Einbringen des Vektors in zur Transformation von Pflanzenzellen befähigten Bakterien (heute fast ausnahmslos Agrobacterium tumefaciens) 4) Transformation der Wirtszelle / -pflanze ➡ Integration der DNA in das Erbgut der Zielzelle 5) Selektionierung erfolgreich transformierter (bzw. transfizierter) Zellen da Effizienz der Transformation normalerweise gering, werden Zielgene zusammen mit Selektionsmarkern in Pflanzenzelle eingeführt • visuelle Marker: GFP — grün fluoreszierendes Protein • positive Marker: ermöglichen Wachstum auf Medien, die für untransformierte Zellen keine ausreichende Nährstoffversorgung bieten oder toxische Substanzen enthalten (Antibiotika, Herbizide) 6) Regeneration differenzierter Pflanzen 7) genetische, biochemische und physiologische Charakterisierung der transgenen Pflanze ➡ Einsatz von Agrobacterium tumorfaciens-Plasmiden als Vektoren beim DNA- oder Gentransfer 1) Ein Hybridplasmid, das nur die T—DNA eines Ti-Plasmids trägt, wird mit einem Restriktionsenzym aufgeschnitten 2) Einfügen eines fremden Gens ➝ rekombinantes Plasmid 3) Transfer in eine A. tumorfaciens-Zelle, die bereits ein modifiziertes Ti-Plasmid ohne TDNA enthält 4) A. tumorfaciens-Zellen, die das modifizierte Ti-Plasmid enthalten, werden zu Infektion der Pflanze genutzt • Bt-Mais ist eine Variante des genveränderten Mais, in die ein oder mehrere Gene des Bakteriums Bacillus thuringiensis eingeschleust wurden • Pflanzenzellen produzieren eine Vorstufe (Protoxin) des für Fraßinsekten giftigen Wirkstoffs ➡ spezifische Wirkung auf verschiedene Insektenlarven, harmlos für andere Organismen • Wirkung des Toxins entfaltet sich erst im basischen Milieu iim Verdauungstrakt verschiedener Insektenlarven (Bt-Toxin) ➡ Toxin bildet Poren im Verdauungstrakt ➡ Zerstörung des osmotischen Potenzials ➝ Abtöten der Zelle • Toxine biologisch abbaubar, werden aber über Wurzel in den Boden abgegeben • Verwendung von E. coli-Zellen, die Plasmide mit den Genen ampR (Resistenz ggü Ampicillin) und lacZ (➝ 𝛃-Galactosidase, das Lactose hydrolysiert) enthalten ➡ Behandeln der Zellen, dass Plasmide freigesetzt werden + Freisetzung der DNA aus Pflanzenzellen, die gewünschtes Gen enthalten ➡ Plasmide und Pflanzen-DNA werden mit gleichem Restriktionsenzym geschnitten ➡ einzige Erkennungssequenz im Plasmid innerhalb de lacZ-Gens ➡ Gen unterbrochen ➡ Vermischung der geschnittenen Plasmide mit den DNA-Fragmenten ➡ rekombinante Plasmide + intakte Plasmide (ohne Insertion von Fremd-DNA) ➡ Mischen der Plasmide mit Bakterienzellen, denen ampR- und lacZ-Gene fehlen ➡ einige Bakterien nehmen Plasmide auf ➡ Übertragen der Bakterien auf Kulturmedium, das Ampicillin und X-Gal enthält ➡ Bakterien, die Plasmide aufgenommen haben, sind resistent ggü. Ampicillin und können auf so einem Medium wachsen ➡ X-Gal: modizifierter Zucker, der sich blau färbt, wenn er von 𝛃-Galaktosidase gespalten wird (blue-white-screening) ➡ Kolonien mit intakten lacZ-Gen erscheinen blau (können 𝛃-Galactosidase bilden) ➡ Kolonien mit rekombinanten Plasmid erscheinen weiß (lacZ-Gen defekt) transiente Genexpression: vorübergehende, nicht dauerhafte Expression eines Gens (Gen wird nur vorübergehend abgelesen) ➝ transiente Transformation stabile Transformation: dauerhafte Integration von Fremdgenen in das Wirtsgenom Vorteile: • Resistenz gegen Schädlinge (Maiswurzelbohrer / Maiszünsler) • höhere Erträge (wirtschaftlicher Vorteil) • weniger Insektizide benötigt, gezielterer Einsatz (da Mais eigenes Insektizid bildet) Risiken: • Parasiten unterliegen durch Einsatz von Bt-Mais hohem Selektionsdruck ➡ resistente Parasiten wahrscheinlich • Befürchtung, dass auch andere Insekten indirekt getötet werden (Fressen von kontaminierten Insekten) • Bt-Toxin-Konzentration in Böden mit monokultureller Aufzucht sehr hoch Restriktionsenzyme: • bakterieller Herkunft ➝ Schutzmechanismus der Bakterien gegen Viren, Bakteriophagen • Plasmid wird mit Restriktionsenzym geschnitten ➝ sticky ends (überstehende Enden) (EcoRI: (5’)—G↓AATTC—(3’); Hind III: (5’)—A↓AGCTT—(3’)) • sticky ends können mit anderem DNA-Fragment zusammengefügt werden, das mit dem gleichen Restriktionsenzym geschnitten wurde (da gleiche Enden) • rekombinante Plasmide werden in Bakterienkultur gegeben • werden von einigen Bkterienzellen aufgenommen • Vermehrung der Zellen Replikation der rekombinanten Plasmide Gentechnik Gentechnik VERGLEICH TRANSGENER PFLANZEN — TRADITIONELLE ZÜCHTUNG BIOLISTISCHE TRANSFORMATION 9 10 Gentechnik Gentechnik 11 12 transgen ———— • Veränderung der genetisch bedingten Merkmale • ein gewünschtes Merkmal kann exakt übertragen werden • DNA an winzige Partikel Gold oder Wolfram gebunden und mit hohem Druck in Pflanzenzellen geschossen • beschleunigte Partikel durchdringen Zellwände und -membrane und werden im Zellinneren abgebremst • Ablösen der DNA und Integration in das Genom Nachteil: Verletzung von Zellgewebe • Merkmalsübertragung zwischen unterschiedlichen Gattungen • weniger Zeitaufwans traditionell ———— • Kreuzung der besten, schönsten und größten Exemplare • viele andere Merkmale werden mitvererbt (Genkopplung) ➡ unerwünschte weitere Merkmalsveränderungen • Austausch nur bei naher Verwandtschaft • Veränderungen über einen langen Zeitraum