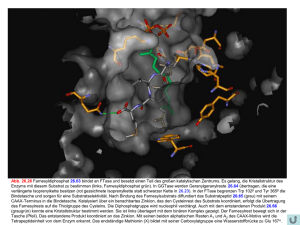
V12
Werbung

Kapitel 12: Kristallchemie 12.1 Gegenstand der Kristallchemie 12.2 Kristallstruktur - Strukturtyp 12.3 Polymorphie - Isomorphie Diadochie 12.4 Bindungstypen 12.5 Koordination 12.6 Kugelpackungen 12.7 Radien 12.8 Metallstrukturen - Lücken Kristallchemie Gegenstand Aufgabe der Kristallchemie ist es, „festzustellen, welche gesetzmäßigen Beziehungen zwischen der chemischen Zusammensetzung und den physikalischen Eigenschaften kristalliner Stoffe existieren und in welcher Weise die Kristallstruktur die Anordnung der Atome im Kristall - von der chemischen Zusammensetzung abhängt.“ Victor Moritz Goldschmidt 1926 Kristallstruktur Definition Unter Kristallstruktur eines Stoffes wird die Gesamtheit der zeitlich gemittelten Koordinaten aller Atomkerne in Bezug auf die Elementarzelle verstanden. Kristallbaufehler werden entweder nicht oder gemittelt berücksichtigt. Besetzungswahrscheinlichkeiten werden berücksichtigt. Kristallstruktur = Gitter + Basis Kristallstrukturen Daten Beispiel Zinkblende-Strukturtyp: RGr. F -43m Position x y z w S 0 0 0 1 Zn 1/4 1/4 1/4 1 Vertreter: u.a. Sphalerit Hawleyit Coloradoit ZnS CdS HgTe a0=543 pm a0=582 pm a0=645 pm Gitterkonstanten sind substanzspezifisch ! auch: GaAs, GaP, GaSb, InP, CdTe, ZnSe, AgI Kristallstrukturen Daten Beispiel Wurtzit-Strukturtyp: RGr. P 63mc Position x y z S1 0 0 0 S2 2/3 1/3 1/2 Zn 1 0 0 1/2+z Zn 2 2/3 1/3 z w 1 1 1 1 (z~1/8) Vertreter: Wurtzit ZnS a0=385 pm, c0=629 pm Freie Parameter (wie z) Zinkit ZnO a0=325 pm, c0=519 pm sind substanzspezifisch ! c/a-Verhältnis: 1,634 bzw. 1,597 auch: ZnSe, AgI (Polymorphie !), GaN, InN... Strukturtyp Definition Zwei Kristallstrukturen gehören zum gleichen Strukturtyp, wenn sie die gleiche Raumgruppe und eine gleiche Besetzung von Punktlagen haben. Es besteht Isotypie, bzw. sie sind isotyp. Chemische Konstitution und Bindungstyp spielen bei dieser Klassifizierung keine Rolle. Kristallstruktur Begriffshygiene Richtig: NaCl-Struktur, NaCl-Strukturtyp, Steinsalz-Struktur, Halit-Strukturtyp Falsch: Gitterstruktur NaCl-Gitter, NaCl-Gittertyp Na- bzw. Cl-Teilgitter Cl-Gitterplatz Polymorphie Viele Kristalle können bei gleicher chemischer Zusammensetzung (unter verschiedenen thermodynamischen Bedingungen) in verschiedenen Kristallstrukturen auftreten. Diese Erscheinung nennt man Polymorphie. Beispiele: C SiO2 ZnS CaCO3 Diamant Tief-Quarz Cristobalit nicht aber: Sphalerit Calcit - Graphit Hochquarz Coesit Opal Wurtzit Aragonit => Es genügt nicht zu sagen: „ZnS-Kristallstruktur“! - Tridymit Stishovit Lechatellierit - Vaterit Kristallchemische Begriffe Homöotypie liegt vor, wenn zwei Strukturen sich in wesentlichen Zügen entsprechen. Der Begriff ist nicht streng definiert, gestattet die Beschreibung struktureller Verwandtschaften. Isomorphie bezeichnet eine so weitgehende kristallchemische Verwandtschaft zweier Kristallphasen, daß zwischen beiden lückenlose Mischbarkeit besteht (Mischkristallbildung). z.B. Olivin: Forsterit Mg2SiO4 - Fayalit Fe2SiO4 Granate, Feldspäte, u.v.a.m. Diadochie bezeichnet die gegenseitige Austauschbarkeit einzelner Atome oder Ionen in einer Kristallphase. z.B. silberhaltiger Galenit (Pb, Ag)S oder (Mg, Fe)2SiO4 Diadochie Möglichkeiten Fe 2+ Co 2+ Ni 2+ S 2- Ge 2+ Se 2- As 3- Te 2- Sb 3- Kristallchemie Grundprinzipien 1. Prinzip der dichten Packungen Die Bausteine streben eine Kristallstruktur mit möglichst dichtester Raumerfüllung an. 2. Symmetrieprinzip Die Bausteine streben eine Struktur mit möglichst hoher Symmetrie an. 3. Wechselwirkungsprinzip Die Bausteine streben die höchstmögliche Koordination an. Bindungstypen 4 Grundtypen metallisch + - + + - + + - + + van-der-Waals ionar (heteropolar) + - + - + + - + kovalent (homöopolar) Koordination Die Koordinationszahl bezeichnet die Zahl der nächsten, untereinander gleichartigen Nachbarn um ein Zentralatom. Das durch die Verbindungslinien der gleichartigen Bausteine um den Zentralbaustein gebildete Polyeder nennt man Koordinationspolyeder. Koordination Nach Borchardt-Ott Koordination Nach Borchardt-Ott Dichteste Kugelpackungen 2 Grundtypen kubisch dichtest hexagonal dichtest Radien 4 Grundtypen metallisch van-der-Waals ionar (heteropolar) kovalent (homöopolar) Beispiele (in pm) Br Sn 158 (12) 195 - 196(-1), 39(+7) 294(-4), 74(+4) 114 141 Radien Grundregeln Innerhalb einer Vertikalreihe des PSE nimmt der Radius wegen steigender Elektronenzahl zu. (Li+=70 pm -> Na+=98 pm -> K+=133 pm -> Rb+=152 pm -> Cs+=170 pm) Ein Ansteigen der Kernladung reduziert den Ionenradius Metallstrukturen Alpha-Po-Typ W-Typ Cu-Typ Mg-Typ Lücken Cu-Typ Nach Paufler/Leuschner Lücken Mg-Typ Lücken W-Typ