Synthese neuartiger Fettstoffe mit heterocyclischen
Werbung

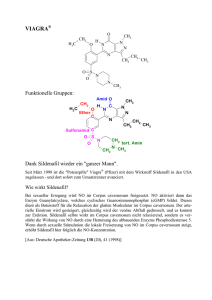
Synthese neuartiger Fettstoffe mit heterocyclischen Funktionen Sandra Fürmeier und Jürgen O. Metzger Universität Oldenburg, Fachbereich Chemie, Postfach 2503, 26111 Oldenburg e-mail: [email protected] Die ersten enantiomerenreinen Aziridine 4 und 7 auf Fettbasis sowie neue N-substituierte Aziridin-Derivate 9-16 auf der Basis von cis-9,10Epiminooctadecansäuremethylester (8) werden präsentiert. (+)-Vernolsäuremethylester (1) und Epoxyricinolsäuremethylester (5) wurden durch eine neuentwickelte, ressourcenschonende Umesterung des jeweiligen epoxidiertenTriglycerids mit Methanol in Gegenwart eines basischen Hydrotalcit-Katalysators erhalten. Einleitung Fettstoffe mit heterocyclischen Funktionen sind von zunehmendem Interesse, da sie die guten Wirkeigenschaften des heterocyclischen Grundkörpers mit der hohen Lipophilie der Fettsäurekette vereinen und somit ein großes biologisches Potential versprechen. Aziridine sind aufgrund ihrer Tendenz, nucleophile Ringöffnungsreaktionen einzugehen, gute Alkylierungsmittel und daher häufig stark mutagen und toxisch. Einige Aziridine zeigen interessante pharmakologische Wirkungen und kommen beispielsweise als Antitumor-Agenzien oder Chemosterilantien zum Einsatz. Ergebnisse und Diskussion LIE KEN JIE berichtete über die Reaktion von racemischem cis-9,10Epoxyoctadecansäuremethylester durch nucleophile Ringöffnung mit Natriumazid zu den entsprechenden regioisomeren Azidoalkoholen. Letztere konnten in einer STAUDINGER-Reaktion durch reduktive Cyclisierung mit Triphenylphosphin zu racemischem cis-9,10-Epiminooctadecansäuremethylester 8 umgesetzt werden.[1] Durch Verwendung von polymergebundenem Triphenylphosphin konnten wir diese Methode hinsichtlich der Ausbeuten deutlich verbessern. Auf diese Weise gelang die Synthese der ersten enantiomerenreinen Aziridin-Derivate auf Fettbasis. Im ersten Schritt der Umsetzung von (+)-Vernolsäuremethylester (1) mit Natriumazid erhielten wir zwei Produkte in annähernd der gleichen Menge. Dabei handelte es sich zum einen um den enantiomerenreinen Azidoalkohol 2 und zum anderen um das Pyrrol 3. Die Reduktion mit polymergebundenem Triphenylphosphin lieferte das enantiomerenreine ungesättigte Aziridin 4 (Schema 1). N3 CH3(CH2)4 O CH3(CH2)4 (CH2)7COOCH3 1 + NaN3, NH4Cl EtOH, H2O OH 68% (CH2)7COOCH3 2 Abb.1 Röntgenstruktur des Überschussdiastereomers (9R,10S,12R)9,10-Epimino-12-hydroxyoctadecansäuremethylester (7a). Aziridine können als sekundäre Amine durch Alkylhalogenide oder analoge Reagenzien alkyliert und beispielsweise durch Säurechloride acyliert werden.[2] Des Weiteren sind sie in der Lage, an ,-ungesättigte Nitrile zu addieren. Das Reaktionsverhalten des Monoaziridins 8 wurde untersucht und zur Synthese N-substituierter Aziridin-Derivate genutzt (Abb. 2). Reaktion von 8 mit Phenylisocyanat und –isothiocyanat in Diethylether lieferte Harnstoff- 9 bzw. Thioharnstoff-Derivate 10. Die Acylierung mit Acetylchlorid in Benzol in Gegenwart von Triethylamin als Säurefänger ergab das Amid 11. Die Urethane 12 resultierten aus der analogen Umsetzung mit Chlorameisensäureethylester bzw. –isopropylester. Die Reaktion des Aziridins 8 mit Chlorameisensäurebenzylester ergab in Diethylether unter CO2-Abspaltung das N-benzylierte Produkt 14. Das erwartete Urethans 13 konnte durch analoge Umsetzung in Benzol zugänglich gemacht werden. Das Monoaziridin 8 wurde weiterhin an Acrylnitril in Methanol zum Propionitril-Derivat 16 addiert. + CH3(CH2)4 polym.-geb. PPh3 34% Das Überschussdiastereomer 7a konnte kristallisiert und mittels Röntgenstrukturanalyse identifiziert werden (Abb. 1). N H H N CH3(CH2)4 (CH2)8COOCH3 3 37% R N CH3(CH2)7 (CH2)7COOCH3 4 Schema 1 (CH2)7COOCH3 Racemat 8: R = H 9: R = CONHPh, 10: R = CSNHPh 11: R = COMe 12: R = COOEt, 13: R = COOi-Pr, 14: R = COOCH2Ph 15: R = CH2Ph 16: R = (CH2)2CN Abb. 2 Die Reaktion von Epoxyricinolsäuremethylester (5) ergab unter den bekannten Reaktionsbedingungen zunächst das Azidodiol 6 als Gemisch zweier Regioisomere und deren zwei Diastereomeren (Schema 2). OH OH OH O 5 (CH2)7COOCH3 + anti-Diastereomer CH3(CH2)5 (CH2)7COOCH3 CH3(CH2)5 + NaN3, NH4Cl EtOH, H2O N3 6 OH N3 89% (CH2)7COOCH3 CH3(CH2)5 OH + polym.-geb. PPh3, THF OH H N CH3(CH2)5 58% CH3(CH2)5 Schema 2 OH H N Diastereomerengemisch (CH2)7COOCH3 7a 2.5 : (CH2)7COOCH3 7b 1 Die weitere Umsetzung ergab die chiralen Hydroxyaziridine 7a und 7b, die säulenchromatographisch getrennt werden konnten. Eine Kombination der neuen Aziridine 4 und 7 sowie des von uns synthetisierten Bis- und Trisaziridins[2] mit den verschiedenen Derivatisierungsmöglchkeiten am Aziridin-N-Atom eröffnet eine Palette neuer Verbingungen und erlaubt möglicherweise ein Tuning der biologischen Eigenschaften. Das Bis- und Trisaziridin zeigten neben einer cytotoxischen und antimikrobiellen Aktivität einen äußerst bemerkenswerten anti-tumorpromovierenden Effekt sowie eine gute neuroprotektive Wirkung. Wir danken dem Bundesministerium für Verbraucherschutz, Ernährung, und Landwirtschaft (Förderkennzeichen 97 NR 174) und der Heinz Neumüller Stiftung Oldenburg für die finanzielle Unterstützung zur Förderung unserer Arbeiten. [1] M.S.F. Lie Ken Jie, M.S.K. Syed-Rahmatullah, J. Am. Oil Chem. Soc. 1992, 69, 359-362. [2] J.O. Metzger, S. Fürmeier, Eur. J. Org. Chem. 1999, 661-664.