Phosphoproteine aus einer Mischung herausholen
Werbung

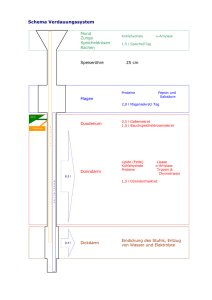
30.07.2009 Die Nadel im Heuhaufen immer gezielter suchen: Selektive Oberflächen „fischen“ Phosphoproteine Die Proteomik ist eine noch junge Technologie, die sich mit der systematischen Erforschung der Eiweißstoffe in biologischen Systemen beschäftigt. Sie analysiert Art und Menge der vorhandenen Proteine und in welchen „Teams“ sie zusammenwirken. Österreichische Proteomik Plattform startet erfolgreich in Phase III Die in Österreich tätigen Experten auf diesem Fachgebiet arbeiten seit 2003 in der Österreichischen Proteomik Plattform (APP) zusammen. Die zweite Phase dieses Programms war so erfolgreich, dass nun eine dritte Periode anläuft. Insbesondere auf dem Gebiet der Phosphoproteomik konnten die APP-Forscher wichtige Ergebnisse erzielen. Die Phosphoproteomik untersucht Eiweißstoffe, die mit einer oder mehreren Phosphatgruppen versehen sind. Das Anhängen und Abhängen von Phophatgruppen an Eiweißstoffe ist einer der wichtigsten Mechanismen zur Feinregulierung zellulärer Abläufe. Auf diese Weise wird die Aktivität von Proteinen gesteuert. Auch werden Signalwege, die zu Wachstum, Reifung oder Tod einer Zelle führen, durch Phosphorilierung an- oder ausgeschaltet. Zu verstehen, welche Proteine, wann, wo und wie phosphoriliert werden, ist daher einer der Schlüssel zur Erforschung natürlicher Systeme. Auch bei der Entstehung vieler Krankheiten, vor allem von Krebs, spielen fehlgesteuerte Phosphoproteine eine entscheidende Rolle. Die Phosphorilierung ist eine sehr effiziente und gezielte Maßnahme. Sie setzt an jenen Proteinen an, die wichtige Schaltstellen einnehmen. Für Analytiker ist dies ein Problem, denn die interessanten Phosophoproteine sind nur in sehr geringen Mengen vorhanden. Sie unter den immensen Mengen anderer Proteine aufzuspüren ist so schwierig, wie die sprichwörtliche Nadel im Heuhaufen zu finden. Gesuchte Eiweißstoffe bleiben in Pipettenspitzen hängen Im Rahmen des APP-Programms haben Wissenschaftler um Prof. Dr. Günther Bonn vom Institut für Analytische Chemie und Radiochemie der Leopold Franzens Universität Innsbruck ein raffiniertes Verfahren entwickelt, mit dessen Hilfe die Suche leichter geht. Bonn und seine Mitarbeiter sind Spezialisten für das Design von analytischen Oberflächen mit spezifischen Bindungseigenschaften. Diese Oberflächen sind chemisch so gestaltet, dass nur ganz bestimmte Moleküle an ihnen anhaften. Leitet man ein komplexes Stoffgemisch an so einem Trägermaterial vorbei, werden die gewünschten Stoffe herausgefischt. Pipettenspitzen zum Anreichern von Phosphoproteinen Ein solches Trägermaterial haben Bonns Mitarbeiter für Phosphoproteine gestaltet. Sie haben Pipettenspitzen innen mit einem Kunststoffpolymer ausgekleidet, das nicht nur einen Kanal zum Aufziehen der Flüssigkeit freilässt – das Polymer selbst ist auch von winzigen Kanälen und Poren durchzogen. In diesem Polymer sitzen Nanopartikel von Titan- und Zirkoniumdioxid. Diese sind in der Lage, Phosphoproteine zu binden, und zwar spezifischer als das mit bisherigen Materialien möglich gewesen ist. Mit derartigen Pipettenspitzen kann man also, vereinfacht gesagt, einen Tropfen Flüssigkeit aufsaugen – die Phosphoproteine bleiben in der Spitze kleben – und die Flüssigkeit wird ohne Phosphoproteine wieder entlassen. Die Phosphoproteine können anschließend mit einer anderen Lösung aus der Pipettenspitze ausgespült und in weiteren Verfahren quantitativ und qualitativ analysiert werden. „Diese Arbeit ist ein methodischer Durchbruch“, urteilt Prof. Lukas Huber, der die Proteomik-Plattform leitet, und der bereits in seiner eigenen Forschung gute Erfahrungen mit den von Bonns Gruppe kreierten Pipettenspitzen gemacht hat. Die Arbeit wurde als Titelstory in der Fachzeitschrift „proteomics“ veröffentlicht. (1) Im Rahmen der APP Plattform wurden noch weitere Trennverfahren für Phosphopeptide entwickelt, beispielsweise von Karl Mechtlers Arbeitsgruppe am Institute of Molecular Pathology (IMP) in Wien (2), die in der Fachzeitschrift „nature protocols“ veröffentlicht wurde, und von Prof. Dr. Wolfgang Lindners Arbeitsgruppe am Institut für Analytische Chemie der Universität Wien (3). Prof. Dr. Guilio Superti-Furga, Direktor des Research Center for Molecular Medicine CeMM in Wien, klärt im Rahmen der Proteomik Plattform spezifische Protein-Netzwerke auf, indem er ein Protein als „Köder“ nutzt. Wissenschaftler seiner Arbeitsgruppe binden dieses an eine Oberfläche und angeln damit sämtliche andere Proteine aus einer Probe heraus, die an den Köder binden. Auf diese Weise hat SupertiFurgas Team gemeinsam mit Karl Mechtler das Netzwerk des Proteins Bcr-Abl analysiert und im Journal PNAS veröffentlicht (4). Bcr-Abl ist eine Kinase, also ein Protein, das Phosphatgruppen an andere Proteine anhängt. Sie entsteht durch eine Genveränderung und stellt eines der eindrucksvollsten Beispiele für die Folgen fehlgeleiteter Phosphorilierung dar: Sie löst Chronischen Myeloide Leukämie aus. Das Aufklären von Protein-Netzwerken ist wichtig, um die Wirkweise von Medikamenten wie beispielsweise Kinase-Hemmern besser zu verstehen. Deren Zielmoleküle, beispielsweise Bcr-Abl, liegen ja im Körper nicht separat vor, sondern in großen Protein-Komplexen. Diese zu kennen hilft, den Einfluss der Medikamente besser zu steuern. Hintergrund APP Die österreichische Proteomik Plattform APP ist ein Forschungsnetzwerk, das im Rahmen des österreichischen Genomforschungsprogramms GEN-AU von der Bundesregierung gefördert wird. APP wurde im Jahr 2003 gestartet. Sie wird von Prof. Dr. Lukas Huber, Medizinische Universität Innsbruck, geleitet und von CEMIT Center of Excellence in Medicine and IT in Innsbruck gemanagt. CEMIT initiiert und managt Großforschungsprojekte an der Schnittstelle zwischen Wissenschaft und Wirtschaft, z.B. Kompetenzzentren oder EU-Projekte oder –Programme. www.bmwf.gv.at www.gen-au.at/projekt.jsp?projektId=111&lang=de www.cemit.at Hintergrund GEN-AU Das Genomforschungsprogramm GEN-AU (GENome Research in AUstria) wurde 2001 gestartet und ist das höchst dotierte Forschungsprogramm des Bundesministeriums für Wissenschaft und Forschung. Das Programmmanagement führt die FFG durch. www.gen-au.at www.ffg.at Hintergrund Proteomik/Genomik Das Proteom ist die Gesamtheit aller Proteine, die in einem biologischen System zu einem bestimmten Zeitpunkt anzutreffen sind. In einer einzigen Zelle können mehr als 100 000 verschiedene Proteine in höchst unterschiedlichen Mengen vorhanden sein. Die Erforschung des Proteoms – die Proteomik – gehört daher zu den größten wissenschaftlichen Herausforderungen unserer Zeit. Dabei gelingt immer nur eine momentane Bestandaufnahme, denn das Proteom verändert sich fortwährend – im Gegensatz zum Genom. Das Genom, also die in der DNA festgelegte Erbinformation eines Organismus’, bleibt zeitlebens gleich, selbst wenn sich dieser von der Raupe zum Schmetterling wandelt. Das Proteom hingegen gibt jeweils den aktuellen Zustand eines biologischen Systems wieder, und das macht es so interessant. Links zu diesem Thema: Leopold-Franzens Universität Innsbruck < zurück zur Übersicht