Konfokale Mikroskopie - Universität Osnabrück
Werbung

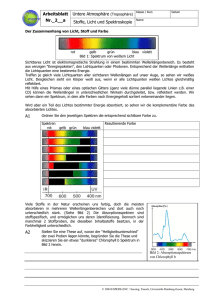
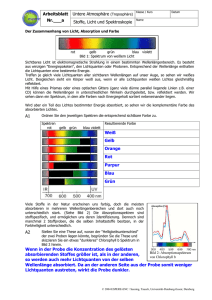
Skript zum Vortrag über Konfokale Mikroskopie Seminar „Laserphysik“ SoSe 2007 03.Juli.2007 Christine Derks Universität Osnabrück Inhaltsverzeichnis 1 Einleitung 1.1 Lichtmikroskop 2 Konfokales Laser-Scanning-Mikroskop 2.1 Laser-Scanning-Mikroskop 2.2.1 Lichtquelle 2.2.2 Die konfokale Blende 2.2.3 Optik 2.2.4 Signalverarbeitung 2.3 Optische Schnitte 2.4 Reflexionsmodus 2.4.1 Reflexionsmodus Beispiele 2.5 Fluoreszenzmodus 2.5.1 Fluoreszenzmodus Beispiele 3 Auflösungsvermögen 3.1 Point-Scattering-Funktion 3.2 Geometrisch optische Konfokalität 3.3 Wellenoptische Konfokalität 4 Konfokale Mikropskope 4.1 Konfokales Weißlichtmikroskop 4.2 Nipkow-Mikroskop 5 Zusammenfassung 6 Quellen 7 Abbildungsverzeichnis 1 Einleitung Das konfokale Prinzip wurde 1955 von Marvin Minsky entwickelt. Marvin Minsky wurde am 9.August.1927 in New York geboren, er machte 1950 seinen Bachelor in Mathematik an der Universität in Harvard und vier Jahre später seinen Doktor in Mathematik in Princeton. Seit 1958 ist er Mitglied im MIT (Massachusetts Institute of Technology). Dort forscht und lehrt er heute noch auf dem Gebiet der künstlichen Intelligenz. 1.1 Lichtmikroskop Um die Besonderheiten der konfokalen Mikroskopie herauszuarbeiten, werden vorher die Funktionsweise und Schwäche eines handelsüblichen Lichtmikroskops beschrieben. Abbildung 01: Strahlengang eines Lichtmikroskops Das Objekt wird durch das Objektiv und das Okular optisch abgebildet, indem das Objektiv zuerst ein echtes Zwischenbild vom Objekt erzeugt, das dann durch das Okular betrachtet werden kann. Die Fokusebene wird dabei scharf abgebildet, leider wird diese Ebene von anderen Ebenen überlagert. Diese werden zwar unscharf abgebildet, verschlechtern aber die Tiefenschärfe der fokussierten Ebene. Aus diesem Grund darf die Dicke der Probe die Tiefenschärfe des Mikroskops nicht übersteigen. Eine Lösung für dieses Problem liefert das konfokale Prinzip, durch das Einführen einer konfokalen Blende. Die Funktionsweise dieses Prinzips wird im Folgenden am Beispiel des konfokalen Laser-ScanningMikroskops (CLSM) erklärt werden. 3 2 Konfokales Laser-Scanning-Mikroskop Es gibt drei Mikroskoparten in denen das konfokale Prinzip hauptsächlich verwendet wird, dazu gehören, das konfokale Laser-Scanning-Mikroskop, das konfokale Weißlichtmikroskop und das Nipkow-Mikroskop. Sie unterscheiden sich nur in Details. Aus diesem Grund wird das CLSM im Weiteren ausführlich beschrieben. Im Anschluss daran wird auf die Unterschiede zu den anderen Mikroskopen eingegangen. 2.1 Laser-Scanning-Mikroskop Abbildung 02: Schematischer Aufbau eines Laser-Scanning-Mikroskops Aufbau Ein Laser-Scanning-Mikroskop besteht aus einem Laser, einer konfokalen Anregungslochblende, einem Farbteiler, Scan-Spiegeln, einem Objektiv, einer konfokalen Detektionslochblende, einem Detektor und einem Kontrollsystem. Diese Bestandteile werden so wie in Abbildung 02 angeordnet. 4 Funktionsweise/Überblick Der entscheidende Unterschied zwischen einem Lichtmikroskop und einem konfokalen Laser-Scanning-Mikroskop besteht darin, dass zusätzlich zwei konfokale Blenden in den Strahlengang gebracht werden. Sie verhindert, dass Licht, das außerhalb der Brennebene des Laserstrahls liegt den Detektor erreicht. In Abbildung 03 liegt die Brennebene in der roten Schicht, das Licht das aus der blauen oder grünen Schicht kommt, kann die Blende nicht passieren, da der Fokus nicht exakt auf Höhe der Blende liegt. Abbildung 03: Strahlengang eines Konfokalen-Laser-Scanning-Mikroskops Ein Laser wird als Anregungslichtquelle verwendet und auf die Anregungslochblende fokussiert. Ein geeigneter Farbteiler (in Abbildung 02 Dichroischer Spiegel) reflektiert einen großen Teil der Intensität dieses Strahls. Er trifft auf zwei bewegliche Spiegel, die ihn durch das Objektiv auf das Objekt abbilden. Die Lochblende ist so klein gewählt, dass ihr Bild in der Objektebene beugungsbegrenzt ist. Das vom Objekt emittierte Fluoreszenz- oder Reflexionslicht wird wieder durch das Objektiv gesammelt und über den Scannspiegel zurück auf den Farbteiler abgebildet und auf eine Detektionslochblende abgebildet. Dahinter befindet sich ein Lichtdetektor, 5 der das vom Objekt emittierte Licht farbselektiv misst. Dieser Lichtdetektor wird durch einen Photomultiplier realisiert. In dieser Anordnung wird das Bild Punktweise abgebildet. Um ein Bild des gesamten Objektes zu erzeugen müssen die übereinander liegenden Bilder der Anregungs- und Detektionslochblende über das Objekt geführt werden. Das wird durch eine entsprechende Ansteuerung der Scannspiegel erreicht. Dafür wird ein Laserstrahl in Zeilen und Spalten über das Objekt geführt. Nur die Signale, die sich genau in der Bildebene des Lasers befinden werden detektiert, denn sie haben ihren Brennpunkt an der Lochblende. Alle anderen Strahlen, die in tieferen oder höheren Schichten liegen, werden ausgeblendet. So können verschiedene Schichten aufgenommen werden. Aus der dabei entstehenden sequentiellen Folge von Signalen am Detektor kann dann das Bild des Objekts digital rekonstruiert werden. Das Laser-Scanning-Mikroskop kann mit zwei verschiedenen Moden betrieben werden - von dem gewählten Modus hängt die geeignete Wahl des Farbteilers ab. 2.2.1 Lichtquelle Als Lichtquelle werden Laser verwendet, sie haben eine hohe Intensität und lassen sich stark fokussieren. Deswegen sind sie für das CLSM besonders gut geeignet. Verwendet werden Argon-Ionen-Laser mit Wellenlängen von λ = 488nm und von λ = 514,5nm , ND YAG-Laser mit λ = 532nm , HeNe Gaslaser mit λ = 543nm oder Diodenlaser mit einer Wellenlänge von λ = 635nm . 2.2.2 Die konfokale Blende Der Laser wird auf die Probe fokussiert, trotzdem finden Reflexion und Anregung auch in anderen Teilen der Probe statt. Das Objektiv bildet auch diese unerwünschten Bildanteile ab, durch das Einfügen einer konfokalen Blende in einer zum Objekt konjugierten Ebene, erreichen nur die Informationen den Detektor, die ihren Fokus direkt in der Lochblende haben. Alle anderen Bildanteile werden so ausgeblendet. Das ermöglicht 6 auch das betrachten dicker Präparate. Im Gegensatz zum Lichtmikroskop, wo andere Ebenen das Bild überlagern. Vgl. Abbildung 4. Abbildung 4: Vergleich des Strahlengangs eines Lichtmikroskops mit einem CLSM. Die Größe des Pinholes wird in Airy-Einheiten angegeben. 1AE = λ ⋅λ 1, 22 ⋅ λ mit λ = 2 em exc 2 2 NA λem + λexc λem : Emissionswellenlänge λexc : Anregungswellenlänge Die Größe des Pinholes hat einen entscheidenden Einfluss auf das Auflösungsvermögen. Er wird in Abschnitt 3 ausführlich erläutert. 2.2.3 Optik Der Farbteiler oder Strahlteiler sorgt durch seine Transmissions- und Reflexionseigenschaften dafür, dass das vom Objektiv abgebildete Signal aus dem Verlauf des Laserstrahls ausgekoppelt wird. Für unterschiedliche Betriebsmoden müssen dabei unterschiedliche Kriterien erfüllt werden. Beispiele dafür werden bei der Erklärung dieser unterschiedlichen Moden gegeben. 7 Die Scannspiegel werden benötigt um den fokussierten Laserstrahl in der x-y-Ebene über die Probe zu führen, damit nacheinander die Informationen einer ganzen Ebene der Probe detektiert werden. Sie können dann mit einer geeigneten Software zu einem Bild der Probenebene zusammengesetzt werden. Ein Linsensystem fokussiert den Laserstrahl auf der Probe und den reflektierten bzw. emittierten Strahl auf der konfokalen Blende. 2.2.4 Signalverarbeitung Das Signal, dass vom Fokus kommt und das Pinhole passieren kann, wird Wellenlängen abhängig detektiert, indem Wellenlängenfilter verwendet werden. Dafür gibt es verschiedene Verfahren. Eine Möglichkeit besteht darin, das Licht mit Hilfe eines Prismas zu spalten so trifft jede Wellenlänge an einer anderen Stelle des Photomultipliers auf. Meist ist es möglich den Bereich, der gemessen werden soll, vorher einzugrenzen um die Empfindlichkeit zu erhöhen oder es werden verschiedene Kanäle für unterschiedliche Wellenlängenbereiche angelegt. 2.3 Optische Schnitte Das CLSM ermöglicht das Erstellen optischer Schnitte. Darunter versteht man, dass zusätzlich zur x-y-Ebene noch die z-Richtung beobachtet wird. Das ist beim Laser-Scanning-Mikroskop möglich indem der Objekttisch computergesteuert in z-Richtung bewegt wird, dabei wird der Fokus des Lasers in tiefere Ebene der Probe projiziert. Im Gegensatz zum Lichtmikroskop werden dabei die Bildteile der darüber liegenden Ebenen durch die konfokale Blende ausgeblendet. Bei einer transparenten Probe ermöglicht das einen sogenannten optischen Schnitt durch die Probe. Eine geeignete Software kann die erhaltenen Daten, dann entweder in einen zweidimensionalen Schnitt oder eine dreidimensionale Darstellung bringen. 8 Abbildung 5: Serie optischer Schnitte 2.4 Reflexionsmodus Im Reflexionsmodus wird der Laserstrahl von der Probe reflektiert, es erfolgt also keine Änderung der Wellenlänge. In diesem Fall wird ein Farbteiler gewählt, der beispielsweise 30% reflektiert und 70% transmittiert. Die Verluste beim Einfallendenstrahl werden durch eine Erhöhung der Laserleistung kompensiert. Das zurückkommende Signal wird lediglich auf 70% reduziert, bevor es auf den Detektor trifft. 2.4.1 Reflexionsmodus Beispiele Der Reflektionsmodus wird an einer 2 Cent Münze demonstriert, die Bilder dazu wurden zusammen mit Frau Baensch während des F-Praktikums im WS 2006/07 aufgenommen. Abbildung 6: 2 Cent Münze 9 Ein Stern der 2 Cent Münze wurde mit dem Reflexionsmodus mikroskopiert, die Farbe entspricht dabei einer Skala des Computerprogramms und erlaubt keine Rückschlüsse auf die Wellenlänge des verwendeten Lasers. In Abbildung 07 ist deutlich zu erkennen, dass die fokussierte Ebene hell dargestellt ist alles darüber und darunter sehr viel dunkler. Es ist an dieser Abbildung nicht erkennbar ob es sich bei dem Stern um eine Erhebung oder eine Senke handelt. Abbildung 07: Bild im Reflexionsmodus Im Gegensatz dazu ermöglicht ein zusammensetzen optischer Schnitte mit einer Software das Drehen des Objekts, so ist es möglich die Struktur eindeutig zu bestimmen. Abbildung 08 zeigt solche zusammengesetzte zScans. 10 Abbildung 08: 3D Abbildung aus optischen Schnitten 2.5 Fluoreszenzmodus Im Fluoreszenzmodus regt der einstrahlende Laserstrahl Elektronen der Probenatome an. Beim Übergang zurück in den Grundzustand senden diese Licht mit einer vom Laser verschiedenen Wellenlänge aus. In wie weit das möglich ist, hängt natürlich von der Probe ab. Fluoresziert die Probe, so hat das vom Objekt kommende Signal eine längere Wellenlänge als der anregende Laserstrahl. Der Farbteiler kann dann so gewählt werde, dass er das anregende Laserlicht möglichst optimal reflektiert und das zu erwartende Fluoreszenzlicht optimal transmittiert. 2.5.1 Fluoreszenzmodus Beispiele Abbildung 09 zeigt eine untersuchte Alge, die Aufnahme wurde mit dem Lichtmikroskopteil eines CLSM und einer USB-Kamera aufgenommen. 11 Abbildung 09: Alge unter einem Lichtmikroskop Abbildung 10 zeigt eine x-y-Ebene einer Zelle. Dabei werden die Chloroplasten der Alge angeregt, welche deutlich zu erkennendes Fluoreszenzlicht aussenden. Wieder hat die Farbe des Bildes keine Aussagekraft über die Wellenlänge des emittierten oder eingestrahlten Lichtes, da die Farbskalen beliebig gewählt werden können. Abbildung 10: Bild im Fluoreszenzmodus Abbildung 11 zeigt ein dreidimensionales Bild, dass aus optischen Schnitten durch die Probe zusammengesetzt wurde. Hieran sind deutlich die Chloroplasten in der Zelle erkennbar. 12 Abbildung 11: 3D Abbildung aus optischen Schnitten 3. Auflösungsvermögen Um eine Aussage über das Auflösungsvermögen zu machen, muss man sich zuerst darüber bewusst werden, dass ein Punkt selbst unter optimalen Bedingungen nicht wieder auf einen Punkt abgebildet werden kann. Es kommt immer zu Verwaschungen. Man erhält einen Rotationselipsoiden im Kern mit schwächeren Strukturen darum herum. Diese Struktur wird durch die Point Scattering Funktion beschrieben und ist in Abbildung 12 dargestellt. Abbildung 12: Darstellung der Point-Scatterin-Funktion 13 3.1 Point-Scattering-Funktion Das Auflösungsvermögen wird durch die Halbwertsfläche (FWHM) der Point Scattering Funktion berechnet. Die Ungenauigkeit bei der Abbildung spielt sowohl beim Abbilden des Lasers auf die Probe ( PSFBel ) als auch bei der Abbildung des Objektpunktes ( PSFNachw ) eine Rolle. Sie werden zu einer Ungenauigkeit PSFGes zusammengefasst. PSFGes ist das Produkt aus PSFBel und PSFNachw . Sie hängt besonders von der Numerischen Apparatur (NA) des Objektivs und der Laserwellenlänge ab, wird jedoch auch von Beugungserscheinungen an der Objektpupille und der Aberration der verwendeten optischen Bauteile ab. PSFGes ist immer größer als PSFBel . Wie nah man die beiden Werte annähern kann, hängt von der Größe des Pinholes ab. Je nach Größe des Pinholes muss zwischen geometrisch optischer Konfokalität und wellenoptischer Konfokalität unterschieden werden. 3.2 Geometrisch optische Konfokalität Man spricht von geometrisch optischer Konfokalität, wenn das Pinhole einen Durchmesser hat, der größer als 1AE ist. Dabei ist die Bedingung dafür, dass zwei Punkte noch als getrennt wahrgenommen werden, dass sie eine Abstand haben, der größer als PSFBel ist. Aufgrund der Ellipsenform gelten dabei unterschiedliche Werte für die axiale und laterale Auflösbarkeit. Für axiale Auflösbarkeit gilt: FWHM Bel ,axial = 0,88 ⋅ λexc n − n 2 − NA2 Für die laterale Auflösbarkeit gilt: FWHM Bel ,lateral = Wie man 0,51⋅ λem NA den Formeln entnehmen kann ist dabei nur die Anregungswellenlänge relevant. Für die Schichtdicke gilt: 14 2 FWHM Nachw,axial 0,88 ⋅ λem 2 ⋅ n ⋅ PH = + 2 2 NA n − n − NA 2 mit PH: Größe des Pinholes in µm und n: Brechungsindex des Immersionsmediums Der erste Summand unter der Wurzel ist ein wellenoptischer Term, der bei gegebenem Objektiv und Wellenlänge konstant ist. Der zweite Summand ist geometrisch optisch und bei gegebenem Objektiv nur von der Größe der Lochblende abhängig. Das heißt die Auflösbarkeit ist proportional zum Durchmesser des Pinholes. 3.3 Wellenoptische Konfokalität Man spricht von wellenoptischer Konfokalität, wenn das Pinhole einen Durchmesser hat, der kleiner als 1AE ist. Dabei verändert sich der Abbildungscharakter. Die PSFNachw nähert sich der Größe von PSFBel an und es müssen Beugungserscheinungen berücksichtigt werden. (Vgl. Abbildung 13) Für den nicht realisierbaren Grenzfall PH=0, lassen sich die folgenden Gleichungen herleiten, die jedoch auch für den Bereich bis PH=1 gelten, wenn man die numerischen Vorfaktoren anpasst. FWHM ges ,axial = 0, 64 ⋅ λ n − n 2 − NA2 FWHM Ges ,lateral = 0,37 ⋅ λ NA Im Falle der wellenoptischen Konfokalität ist die axiale Auflösbarkeit von Punkten, auf Grund der Beugungserscheinungen nicht mehr von den aufgenommenen Schichtdicken zu unterschieden. Deswegen gilt für sie dieselbe Gleichung. 15 Abbildung 13: Der Durchmesser der Blende nimmt von a) nach c) ab Geometrisch optische Wellenoptische Konfokalität Konfokalität Laterales Auflösungsvermögen 0,51 ⋅ λem NA 0,37 ⋅ λ NA Axiales Auflösungsvermögen 0,88 ⋅ λexc 0, 64 ⋅ λ n − n 2 − NA2 n − n 2 − NA2 Optische Schnittdicke 2 0,88 ⋅ λem 2 ⋅ n ⋅ PH + 2 2 NA n − n − NA 2 0, 64 ⋅ λ n − n 2 − NA2 Tabelle 01: Auflösungsvermögen eines CLSM Als Werte zur Orientierung kann mit einer Auflösung von 170 nm in x-yEbene und von 500 nm in z-Richtung. 4 Konfokale Mikroskope Wie bereits erwähnt gibt es noch weitere Anwendungen des konfokalen Prinzips in anderen Mikroskopen. An dieser Stelle sollen jetzt noch kurz das konfokale Weißlichtmikroskop und das Nipkow-Mikroskop vorgestellt werden. 16 4.1 Konfokales Weißlichtmikroskop In einem konfokalen Wisslichtmikroskop verwendet man weißes Licht, anstelle eines Lasers, so werden auch Farbabbildungen mit einem konfokalen Mikroskop möglich. Ein Nachteil ist dabei, dass weißes Licht sich nicht mit einer so hohen Intensität auf die Probe fokussieren lässt, das führt zu einer Verlängerung der Beobachtungszeit. Darum verfügen konfokale Weißlichtmikroskope meist über mehrere parallele Strahlengänge, die eine gleichzeitige Beobachtung mehrerer Stellen auf dem Objekt ermöglichen. 4.2 Nipkow-Mikroskop „Das Nipkow-Mikroskop enthält statt der konfokalen Blenden eine sogenannte Nipkow-Scheibe, sie ermöglicht das gleichzeitige Beobachten mehrer Punkte auf der Probe, sodass ein Bild in Echtzeit betrachtet werden kann. Nipkow-Scheiben haben bis zu 20.000 Löcher mit je ca 20µm Durchmesser. Diese Löcher sind bogenförmig angeordnet. In der Abbildung 14 ist die untere Scheibe die eigentliche Nipkow-Scheibe, die darüber liegende Scheibe hat ein identisches Lochmuster. Mikrolinsen in jedem Loch der oberen Scheibe fokussieren Laserlicht auf das darunter liegende Loch in der Nipkow-Scheibe. In der Abbildung sind nur einige wenige Löcher dargestellt, um die bogenförmige, radiale Anordnung zu erklären. Die beiden Scheiben rotieren mit einigen hundert Umdrehungen pro Minute. Licht, das durch ein Loch der Nipkow-Scheibe auf das Objekt fällt, beschreibt deshalb eine kreisbogenförmige Bahn über das Objekt (schwarzer Pfeil auf dem Objekt). Diese Bahn ergibt sozusagen eine Zeile des Bildes. Das benachbarte Loch auf der Scheibe erzeugt die nächste Zeile, und jedes weitere Loch des Bogens fügt eine Zeile hinzu. Die Löcher eines Bogens erzeugen also bei ihrer Passage über das Objekt ein vollständiges Bild, allerdings nur für den Bruchteil einer Sekunde. Der nächste Satz Löcher erzeugt ein neues Bild, und wegen der schnellen Rotation der Scheibe entstehen Bilder in so schneller Folge (über 300 pro Sekunde), dass die Einzelbilder im Auge zu einem stehenden Bild des Objekts verschmelzen. 17 In der Abbildung ist der Strahlengang nur für ein Loch dargestellt tatsächlich aber werden mehrere Löcher eines Bogens gleichzeitig beleuchtet. Anregungslicht (grün) und Fluoreszenzlicht (rot) werden durch dieselbe Lochblende geführt. Da die Lochblende konfokal mit der Brennebene der Objektivlinse ist, gelangt nur Licht aus der Brennebene auf den Strahlenteiler zwischen den beiden Scheiben und damit ins Okular.“1 Abbildung 14: CLSM mit Nipkow-Scheibe 5 Zusammenfassung Konfokale Mikroskopie ist die Verbesserung der Lichtmikroskopie durch den Einsatz einer konfokalen Blende. Abbildung 15: Vergleich Wide-Field und konfokal 1 http://www.sinnesphysiologie.de/methoden/fluo/nipkowl.htm, 23.06.2007 18 6 Quellen http://www.lme.ei.tum.de/paper/VorlesungMikroskop.pdf http://www.thch.unibonn.de/wandelt/pcf_praktikum/versuchsanleitungen/LSM.pdf http://web.media.mit.edu/~minsky/papers/ConfocalMemoir.htmlhttp://www. uni-stuttgart.de/ito/Forschung/3d1/KonfokaleMikroskopie/ http://www.sinnesphysiologie.de/methoden/fluo/nipkowl.htm http://www.palaeontologischegesellschaft.de/palges/schule/posterimgs_seiten/CLMS/CLSM_A0.pdf www.wikipedia.de Gerthsen Physik (Springer Lehrbuch) von Dieter Meschede und Christian Gerthsen http://www.sinnesphysiologie.de/methoden/fluo/confocl.htm http://www.pc.tu-clausthal.de/dienstleistungen/clsm/ 7 Abbildungsverzeichnis Abbildung 01: Gerthsen Physik (Springer Lehrbuch) von Dieter Meschede und Christian Gerthsen Abbildung 02: http://www.lme.ei.tum.de/paper/VorlesungMikroskop.pdf Abbildung 03: http://www.lme.ei.tum.de/paper/VorlesungMikroskop.pdf Abbildung 04: http://www.sinnesphysiologie.de/methoden/fluo/confocl.htm Abbildung 05: http://www.palaeontologische-gesellschaft.de/ palges/schule/posterimgs_seiten/CLMS/CLSM_A0.pdf Abbildung 06: Bilder entstanden beim F-Praktikum WS2006/07 von Frau Baensch und Frau Derks Abbildung 07: Bilder entstanden beim F-Praktikum WS2006/07 von Frau Baensch und Frau Derks Abbildung 08: Bilder entstanden beim F-Praktikum WS2006/07 von Frau Baensch und Frau Derks Abbildung 09: Bilder entstanden beim F-Praktikum WS2006/07 von Frau Baensch und Frau Derks Abbildung 10: Bilder entstanden beim F-Praktikum WS2006/07 von Frau Baensch und Frau Derks 19 Abbildung 11: Bilder entstanden beim F-Praktikum WS2006/07 von Frau Baensch und Frau Derks Abbildung 12: Die konfokale Laser-Scanning-Mikroskopie von Stefan Abbildung 13: Die konfokale Laser-Scanning-Mikroskopie von Stefan Abbildung 14: http://www.sinnesphysiologie.de/methoden/fluo/nipkowl.htm Abbildung 15: http://www.lme.ei.tum.de/paper/VorlesungMikroskop.pdf 20