Organische Chemie für MST 7
Werbung
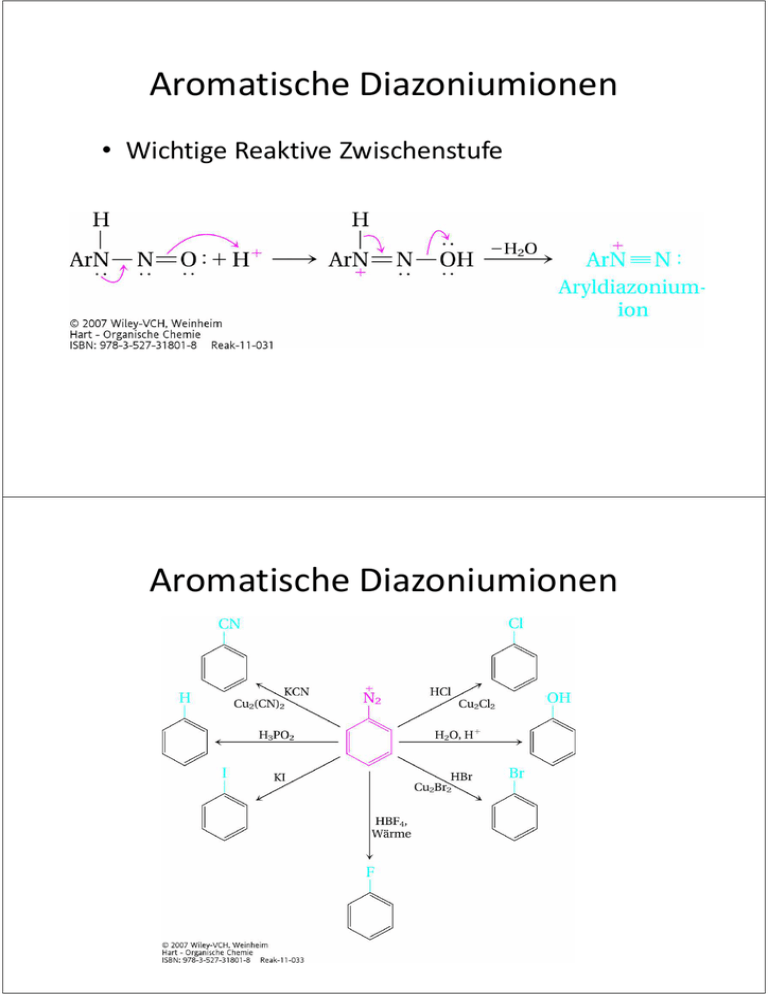
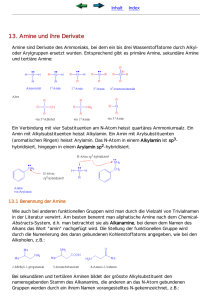
Aromatische Diazoniumionen • Wichtige Reaktive Zwischenstufe Aromatische Diazoniumionen Aromatische Diazoniumionen • Azofarbstoffe Organische Chemie für MST 7 Lienkamp / Prucker / Rühe Inhalt 7 Amine – Nomenklatur, Struktur, Herstellung, Basizität, Reaktionen Amide Aminosäuren Amine • „Ammoniak“ mit Alkylresten, je nach Anzahl der Reste primäre, sekundäre oder tertiäre Amine • stinken nach Fisch • Primäre Amine = Stickstoffanaloga von Alkohol • tetraedrisch wegen freiem Elektronenpaar am N • Wasserstoffbrückenbindungen: Donor (1°, 2°) bzw. Akzeptor (1°, 2°,3°) für H-Brücken, daher meist wasserlöslich • Chiralität: Inversion durch „Durchschwingen“ des freien Elektronenpaares am N http://en.wikipedia.org/wiki/Amine Nomenklatur der Amine • einfache Amine: z.B. Triethylamin • komplexere Amine: NH2-Gruppe = Substituent, z.B. 2-Chlor-1-aminopentan Herstellung von Aminen • Alkylierung von Ammoniak durch Alkohole (kat.) oder Halogenalkane Herstellung von Aminen • Reduktion von Nitrilen (R-CN) oder Amiden mit LiAlH4 • Aromatische Amine aus Nitro-Verbindungen Reaktionen der Amine • Imin-Bildung und Reduktion • Acidität: Biogene Amine • primäre Amine, die als Stoffwechselprodukt durch Abbau von Aminosäuren entstehen • Histamin (Hormon, Botenstoff für Entzündungsreaktionen ⇒ Allergien) • Serotonin (Neurotransmitter) Amide • entstehen durch Reaktionen von Carbonsäuren, Carbonsäurechloriden oder – anhydriden mit Aminen (Substitution an C=O) http://en.wikipedia.org/wiki/Amine Amide • primäre Amide: Carbonsäurederivat + Ammoniak • sekundäre Amide: Carbonsäurederivat + primäres Amin: • tertiäre Amine: Carbonsäurederivat + sekundäres Amin: Acidität von Amiden Amine stinken... Aminosäuren • Mindestens eine Aminogruppe und eine Carboxylgruppe • Bausteine von Proteinen: α-Aminosäuren = Aminogruppe ist am ersten C-Atom neben der Säuregruppe • Das α-C-Atom ist ein asymmetrisches Zentrum optische Aktivität • Natürliche Aminosäuren haben L-Konfiguration • Charakteristischer Rest bestimmt die Eigenschaften Aminosäuren http://de.wikipedia.org/wiki/Aminos%C3%A4uren aus: Paula Bruice, Organische Chemie – Studieren kompakt, 5. Aufl, Pearson Verlag, 2010 aus: Paula Bruice, Organische Chemie – Studieren kompakt, 5. Aufl, Pearson Verlag, 2010 Aminosäuren • Weitere Eigenschaften: – Zwitterionisch: tragen aleichzeitig eine positive und eine negative Ladung – Isoelektrischer Punkt: pH-Wert, bei dem eine Aminosäure neutral (=zwitterionisch) ist – Ampholyte: können Protonen aufnehmen und abgeben Pufferwirkung, halten den pH-Wert von Blut konstant – Ampholyt-Verhalten hängt vom charakteristischen Rest ab Analyse von Aminosäuren • Trennung nach Ladung • Trennung nach Polarität Proteine • Peptidbindung (=Amidbindung zwischen zwei Aminosäuren) • Klassifizierung nach Anzahl der Aminosäuren: Dipeptid, Tripeptid, …., Protein • Verknüpfung von Aminosäuren über eine Peptidbindung: C-N-Bindung http://de.wikipedia.org/wiki/Peptidbindung Proteinstruktur • Primärstruktur = Aminosäuresequenz • Sekundärstruktur = räumliche Konformation des Proteins oder eines Proteinteils, z.B. Helix, stabilisiert z.B. durch H-Brücken aus: Paula Bruice, Organische Chemie – Studieren kompakt, 5. Aufl, Pearson Verlag, 2010 Proteinstruktur • Sekundärstruktur: z.B. β-Faltblattstruktur • Weitere Stabilisierung Disulfidbrücken aus: Paula Bruice, Organische Chemie – Studieren kompakt, 5. Aufl, Pearson Verlag, 2010 Proteinstruktur • Tertiärstruktur = Übergeordneter Räumlicher Aufbau einer Proteinkette durch zusätzliche WW wie Disulfidbindungen, aus: Paula Bruice, Organische Chemie – Studieren kompakt, 5. Aufl, Pearson Verlag, 2010 Proteinstruktur • Quartärstruktur = Zusammen-lagerung von zwei oder mehr Proteinen zu einem Proteinkomplex http://de.wikipedia.org/wiki/Quart%C3%A4rstruktur aus: Paula Bruice, Organische Chemie – Studieren kompakt, 5. Aufl, Pearson Verlag, 2010 Übung • Formulieren Sie die Herstellung von primären Aminen aus Alkohol und Ammoniak. • Propylnitril (CH3CH2CH2-CN) wird mit Lithiumaluminiumhydrid zum entsprechenden Amin reduziert. Schreiben Sie die Reaktionsgleichung inkl. der Oxidationszahlen.