CHE 172.1: Organische Chemie fŁr die Biologie
Werbung
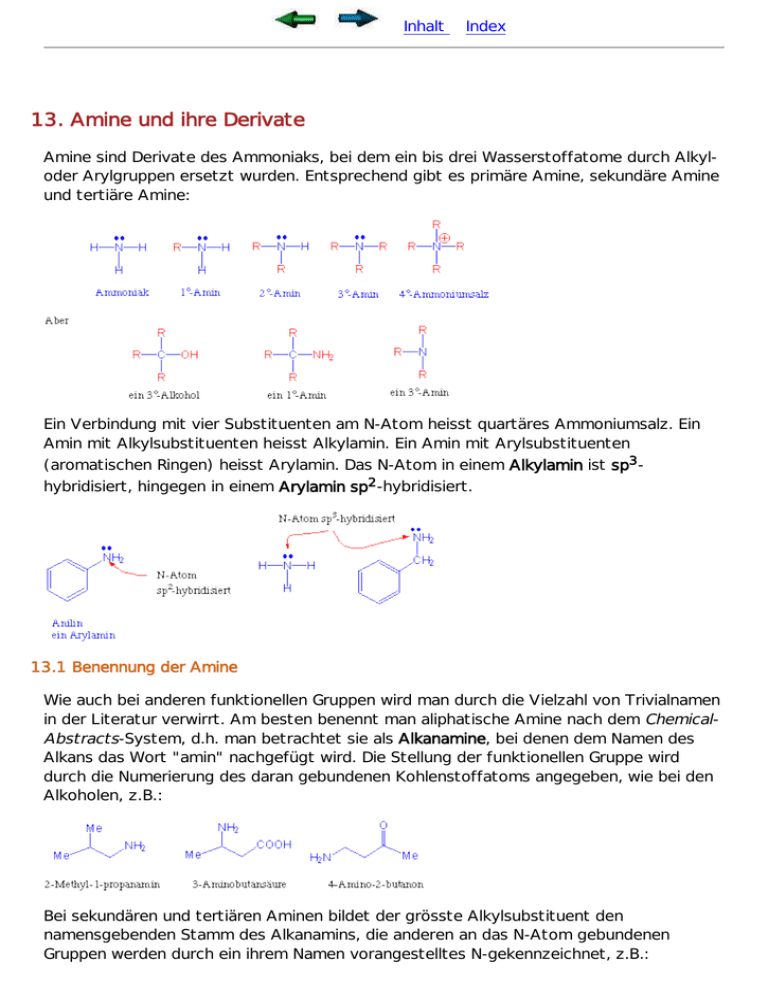
Inhalt Index 13. Amine und ihre Derivate Amine sind Derivate des Ammoniaks, bei dem ein bis drei Wasserstoffatome durch Alkyloder Arylgruppen ersetzt wurden. Entsprechend gibt es primäre Amine, sekundäre Amine und tertiäre Amine: Ein Verbindung mit vier Substituenten am N-Atom heisst quartäres Ammoniumsalz. Ein Amin mit Alkylsubstituenten heisst Alkylamin. Ein Amin mit Arylsubstituenten (aromatischen Ringen) heisst Arylamin. Das N-Atom in einem Alkylamin ist sp3hybridisiert, hingegen in einem Arylamin sp2-hybridisiert. 13.1 Benennung der Amine Wie auch bei anderen funktionellen Gruppen wird man durch die Vielzahl von Trivialnamen in der Literatur verwirrt. Am besten benennt man aliphatische Amine nach dem ChemicalAbstracts-System, d.h. man betrachtet sie als Alkanamine, bei denen dem Namen des Alkans das Wort "amin" nachgefügt wird. Die Stellung der funktionellen Gruppe wird durch die Numerierung des daran gebundenen Kohlenstoffatoms angegeben, wie bei den Alkoholen, z.B.: Bei sekundären und tertiären Aminen bildet der grösste Alkylsubstituent den namensgebenden Stamm des Alkanamins, die anderen an das N-Atom gebundenen Gruppen werden durch ein ihrem Namen vorangestelltes N-gekennzeichnet, z.B.: 13.2 Struktur und physikalische Eigenschaften der Amine Das Stickstoffatom in Alkylaminen ist sp3-hybridisiert und bildet deshalb ein nahezu reguläres Tetraeder. Die Substituenten nehmen drei der Tetraederecken ein - in die vierte weist das freie Elektronenpaar des N-Atoms. Das Stickstoffatom in Arylaminen ist hingegen sp2-hybridisiert und deshalb planar. Das freie Elektronenpaar befindet sich jetzt in ein p-Orbital: Die tetraedrischer Geometrie am N-Atom im Alkylamine ist jedoch nicht starr, da eine rasche Inversion stattfinden kann. Für diese Bewegung muss in einfachen Aminen eine Energiebarriere von ungefähr 21-29 KJ/mol überwunden werden : Es ist deshalb nicht möglich ein isomerenreines, einfaches di- oder trialkyliertes Amin bei RT zu erhalten. Die Inversion findet bei RT sehr rasch statt. Die besondere Fähigkeit der Alkohole, Wasserstoffbrücken auszubilden, ist für ihre hohen Siedepunkte verantwortlich. Die gleichen Eigenschaften finden wir auch bei den Aminen : Amine bilden jedoch schwächere Wasserstoffbrücken als Alkohole. Die Siedepunkte der Amine liegen im allgemeinen zwischen denen der entsprechenden Alkane und Alkohole. Einfache Amine sind in Wasser und Alkoholen löslich. 13.3 Basizität von Amine Die Chemie der Amine wird durch ihr freies Elektronenpaar am N-Atom dominiert. Wegen dieses freien Elektronenpaars besitzen Amine basische und nucleophile Eigenschaften. Amine sind, wie erwartet, viel stärker basisch als Alkohole. Amine deprotonieren Wasser in geringem Ausmass, so dass Ammonium- und Hydroxid-Ionen entstehen: Eine Möglichkeit die relative Basizität von Aminen zu vergleichen ist durch die pKa Werte der entsprechenden Ammonium-Ionen : Name Struktur pKa des Ammoniumions Ammoniak NH3 Methylamin MeNH2 10.64 Ph-NH2 4.63 Ethylamin Anilin Dimethylamin Diethylamin Trimethylamin Triethylamin Primäre Amine CH3CH2NH2 Sekundäre Amine Me2NH Et2NH Tertiäre Amine Me3N Et3N 9.26 10.75 10.73 10.94 9.79 10.79 Wir sehen auch, dass Arylamine, wie Anilin, wesentlich schwächere Basen sind, als Alkylamine. Warum? Offentsichlich ist jetzt die protonierte Form nicht so bevorzugt wie beim Alkylamin. Den Grund dafür findet man, wenn man die Struktur beider Formen vergleicht : Arylamine sind stabiler als Alkylamine weil es für Arylamine mehrere Resonanz-Strukturen gibt, worin das freie Elektronenpaar über den aromatischen Ring delokalisiert wird (sie sind also "weniger zugänglich" für Protonierung). Dieser Resonanz-Effekt geht bei der Protonierung verloren. Wir verlieren also die Resonanzstabilisierung, und deswegen ist die protonierte Form weniger bevorzugt. Zur Erinnerung : Beim Amid ist das N-Atom überhaupt nicht mehr basisch. Amide sind also in Hinsicht auf Säure-Base-Eigenschaften neutral : Die basischen Eigenschaften von Aminen können ausgenutzt werden, um Amine zu reinigen : 13.4 Synthese von Aminen Alkylierung von Aminen Amine sind nucleophil : sie reagieren mit Halogenalkanen zu Alkalaminen. Die Reaktion ist jedoch schwer zu kontrolieren. Es entstehen mehrfach substituierte Produkte, meist sogar Tetraalkylammonium-Salze. Zum Beispiel : Betrachten wir die Alkylierung von Ammoniak mit 1-Brombutan. Wenn wir äquimolare Mengen der Ausgangssubstanzen vorlegen, entsteht als Produkt Butylammoniumbromid, das mit dem vorliegenden Ammoniak sofort ein Proton austauscht. Die geringen Mengen von Butylamin, die so entstehen, konkurrieren mit Ammoniak um das Alkylierungsreagenz. Durch weitere Alkylierung entsteht ein Dibutylammoniumsalz, das sein Proton an jede der beiden anwesenden N-Basen geben kann, so dass Di-n-butylamin entsteht. u.s.w. So kommt es schliesslich zu einer Mischung von Alkylammoniumsalzen und Alkanaminen: Reduktion von Nitrilen Wir haben schon gesehen, dass durch Reduktion mit LiAlH4 oder durch Hydrierung mit Pd/C Katalysator und H2 Nitrile in Amine umgewandelt werden können: Reduktion von Nitroarenen Für die Synthese von Arylaminen ist die einfachste Methode die Reduktion von dem entsprechenden Nitro-Aromaten. Die Nitrogruppen-Reduktion kann unter verschiedenen Bedingungen durchgeführt werden, z.B.: 13.5 Reaktionen von Aminen Das chemische Verhalten der Amine wird von der Nucleophilie des Stickstoffatoms wesentlich bestimmt. In früheren Abschnitten wurde diese Eigenschaft bereits erwähnt, z.B.: Amin + Halogenalkan Amin + Säurechlorid Amin + Aldehyd/Keton In den zwei letzten Prozessen sind tertiäre Amine nicht reaktionsfähig, weil sie kein Wasserstoffatom am N-Atom tragen, das abgespalten werdem könnte: Durch nucleophilen Angriff eines Amins auf ein Halogenalkan entsteht ein Ammonium-Ion. Bei einem quartären Ion ist keine weitere Alkylierung möglich, da keine substituierbaren Protonen mehr vorhanden sind, und das freie Elektronenpaar am N-Atom steht auch nicht zur Verfügung. Hofmann Eliminierung Quartäre Ammoniumsalze sind in Gegenwart von starken Basen instabil, da sie eine bimolekulare Eliminierung eingehen können (E2 Reaktion), die zur Ausbildung eines Alkens führt. Dabei greift die Base das zum Stickstoff ß-ständige Wasserstoffatom an, und das neutrale Trialkylamin tritt zusammen mit seinem Elektronenpaar aus : Diese Reaktion heist Hofmann-Eliminierung. Sie gleicht der säurekatalysierten Dehydratisierung von Alkoholen, in der Wasser als Abgangsgruppe fungiert. Die Hofmann-Eliminierung wurde zur Strukturaufklärung von stickstoffhaltigen Naturstoffen eingesetzt. Vor allem dann, wenn der Stickstoff Teil eines Ringsystems ist, kann durch wiederholte Hofmann-Eliminierung die Lage des Heteroatoms genau zurückverfolgt werden. Aber: 13.6 Amine in der Natur - Alkaloide Stickstoff ist in einer grossen Anzahl physiologisch aktiver Verbindungen enthalten. Viele bekannte Naturstoffe enthalten Amingruppen, und viele andere synthetische medizinisch wirksame Substanzen enthalten auch N-Atome in Form von Amingruppen, z.B.: Alkaloide sind natürliche stickstoffhaltige Verbindungen, die vor allem in Pflanzen vorkommen. Der Name leitet sich davon ab, dass alle Alkaloide charakteristische basische (alkali-ähnlich) Eigenschaften zeigen, die durch das freie Elektronenpaar am N-Atom zustandekommen. Viele Alkaloide sind von ausserordentlich starker pharmakologischer Wirkung und wichtige Arzneimittel: Inhalt Index