1 6. Stoffwechsel der Kohlenhydrate: 6.1. Glycolyse: Glucose ⇒ 2
Werbung

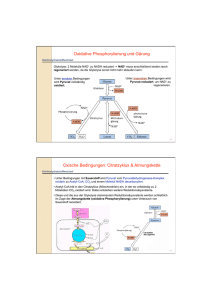
6. Stoffwechsel der Kohlenhydrate: 6.1. Glycolyse: Glucose ⇒ 2 * Pyruvat • • • • Glucose+ 2 NAD+ + 2 Pi + 2 ADP ⇒ 2* (Pyruvat + NADH + H+ +ATP +H2O ) Glycos: süß, lysis: Spaltung Ubiquitärer Stoffwechselweg: 10 enzymatische Schritte, Alle Schritte im Cytoplasma. Alle Enzyme sind löslich. Nur in einigen eukaryontischen Parasiten (z.B. Trypanosoma) sind die Glycolyseenzyme in spezialisierten Multienzymkomplexen kompartmentiert. 6.1.1. Aufnahme von Glucose in die Zelle A) Cotransport von Glucose und Na+: Indirekt aktiver Transport • Wichtig für die Resorption von Glucose. Wird im Abschnitt Verdauung/ Resorption besprochen. B) Glucosetransporter: Carrier • • • Transmembranproteine, enthalten 12 Transmembranhelices, transportieren Glucose entlang des GlucoseKonzentrationsgradienten, Sättigungskinetik, keine Diffusion!. Bilden eine Familie homologer Gene (GLUT x) mit gewebsspezifischer Expression. Isoformen (1...,12) unterscheiden sich in Affinität, Selektivität, Regulation! GLUT 4 wird u.a. in der Muskulatur und in Adipocyten exprimiert. Der Einbau in die Membran wird durch Insulin stimuliert. In gluconeogenetischen Organen werden GLUTs auch für den Export von Glucose genutzt! 6.1.2. Phasen der Glycolyse A) Stufe I (Investition: Energieaufwand) • • • Glucose wird phosphoryliert und in zwei Triosephosphate (Glycerinaldehyd-3-phosphat, GAP) gespalten. Zwei energiereiche Bindungen (ATP) werden investiert! 2 mol ATP/ mol Glucose werden hier verbraucht! Glucose + 2 ATP ⇒ 2 GAP + 2 ADP B) Stufe II (Ertrag: ATP-Bildung) • • • Umwandlung der Triosephosphate in Pyruvat 2 GAP + 4 ADP + 2 Pi => 2 Pyruvat + 4 ATP ATP-Synthese: 4 mol ATP/ mol Glucose werden in der Stufe II gebildet! 6.1.3. Glucose ⇒ 2* Pyruvat: 10 enzymkatalysierte Reaktionen 1.Glucose wird zu Glucose-6-phosphat (Glc-6-P) phosphoryliert Glucose + ATP ⇒ Glc-6-P + ADP; ∆G0r= - 16.7 kJ/mol; irreversibel! Enzym: Hexokinase. Gruppenübertragungsreaktion • • • • • ATP-Verbrauch (MgATP2-) Glucose induziert eine Konformationsänderung des Proteins! Das Enzym katalysiert auch die Phosphorylierung von D-Fructose und D-Mannose Leberzellen enthalten ein als Glucokinase bezeichnetes Isoenzym! Die Glucokinase unterscheidet von anderen Hexokinasen in der Organverteilung und regulatorischen Eigenschaften. Glc-6-P ist negativ geladen und kann (wie auch andere Zuckerphosphate) die Zelle nicht verlassen! 1 2. Glucose-6-phosphat wird zu Fructose-6-phosphat (Fru-6-P) isomerisiert. Glc-6-P == Fru-6-P ; ∆G0r= +1.7 kJ/mol, reversibel! Enzym: Phosphoglucose-Isomerase (PGI): eine Isomerase • Glc-6-P (Aldose, Pyranosering) wird zu einer Ketose (Furanosering) isomerisiert. 3. Fructose-6-phosphat wird zu Fructose-1,6-bisphosphat (Fru-1,6-P2) Fru-6-P + ATP ⇒ Fru-1,6-P2 + ADP; ∆G0r= -14.2 kJ/mol: irreversibel! Enzym: Phosphofructokinase (PFK, auch PFK-1), eine Kinase! • • ATP-Verbrauch (MgATP2-) Ansatzpunkt der Regulation der Glycolyse; ein allosterisches Enzym! 4. Fructose-1,6-bisphosphat wird zu Glycerinaldehyd-3-phosphat (GAP) und Dihydroxyacetonphosphat (DHAP) gespalten! Fru-1,6-P2 == GAP + DHAP; ∆G0r= +23.8 kJ/mol • • GAP: Aldose. DHAP: Ketose Durch Aldolspaltung von Fru-1,6-P2 (C6) entstehen zwei C3-Fragmente. Enzym: Aldolase • Stereospezifische Reaktion. Reversible basenkatalysierte Aldolspaltung! • Die Carbonylgruppe des Fru-1,6-P2 reagiert mit der ε-Aminogruppe eines Lysylrestes des Aldolaseenzyms unter Bildung • • einer Schiff-Base. Isoenzyme: o Aldolase A ist für Fructose-1,6-bisphosphat spezifisch. o Aldolase B (Leber, Nieren) katalysiert auch die Spaltung von Fru-1-P (s. Fruktosestoffwechsel). 5. Dihydroxyacetonphosphat (DHAP) wird zu Glycerinaldehyd-3-phosphat (GAP) isomerisiert DHAP == GAP ; ∆G0r= +7.5 kJ/mol; Enzym: Triosephosphat Isomerase (TIM) • reversibel! Nur Glycerinaldehyd-3-P (GAP) kann in der Glycolyse abgebaut werden! Ende der Investitionsphase, Beginn der Ertragsphase der Glycolyse! 6. Oxidation von Glycerinaldehyd-3-phosphat (GAP) zu 1,3-Bisphosphoglycerat (1,3-BPG) GAP + Pi + NAD+ == 1,3-BPG + NADH + H+ ; reversibel, ∆G0r= +6.3 kJ/mol Enzym: Glyceraldehyd-3-phosphat-Dehydrogenase (GAPDH) • • • Oxidation der Aldehydgruppe des GAP und Kondensation der Carboxylgruppe mit Phosphat Energiekonservierung: 1,3-BPG- ein Acylphosphat- ist eine energiereiche Verbindung! Bildung von NADH! Dabei reagiert die Aldehydgruppe des GAP mit einem Cysteinylrest des Enzyms unter Ausbildung eines Thiohalbacetals. Die bei der Oxidation der Aldehydgruppe freiwerdende Energie wird in einem kovalent am Enzym gebundenen energiereichen Thioester konserviert, der dann unter Bildung von 1,3-BPG phosphorylytisch gespalten wird. Die endergone Entstehung des Acylphosphates wird mit der exergonen Aldehydoxidation durch den energiereichen Thioester am Enzym gekoppelt! Irrversible Hemmung Jodacetat! Arsenat entkoppelt GAPDH und PGK! 2 7. 1,3-Bisphosphoglycerat wird zu 3-Phosphoglycerat (3-PG) und ATP 1,3-BPG + ADP == 3-PG + ATP ; reversibel, ∆G0r= -18.5 kJ/mol • • Enzym: Phosphoglyceratkinase, Mg2+ Substratkettenphosphorylierung: ATP wird gebildet! Kopplung von GAPDH (endergonisch) und Phosphoglyceratkinase (exergonisch): GAP + ADP + Pi + NAD+ == 3-PG + ATP + NADH + H+ ; ∆G0r= -12 kJ/mol • • 1,3-BPG ist das gemeinsame Zwischenprodukt beider Reaktionen, dessen energiereiche Acylphosphatgruppe in der exergonischen PGK-Reaktion auf ADP übertragen wird! Entkopplung: Arsenat reagiert in der GAPDH-Reaktion unter Bildung von 1-Arseno-3-Phosphoglycerat, das spontan (ohne ATP-Bildung) zu Arsenat und 3-PG umgesetzt wird! 8. Mutase-Reaktion: 3-Phosphoglycerat wird zu 2-Phosphoglycerat (2-PG) isomerisiert 3-Phosphoglycerat == 2-Phosphoglycerat ; ∆G0r= + 4.4 kJ/mol • • • Enzym: Phosphoglycerat-Mutase Reversible intermolekulare Verschiebung der Phosphatgruppe! 2,3-Bisphosphat (2,3-BPG) wird als Cosubstrat benötigt! Bei der Reaktion entsteht intermediär ein phosphorylierter Histidinyl-Rest im aktiven Zentrum: Erster Schritt in der Umwandlung von 3-PG in eine C3-Verbindung mit hohem Phosphoryl-gruppenübertragungspotential. Die Phosphatgruppe wird von C3-OH auf C2-OH verschoben. Intermolekularer Phosphattransfer! 9. Dehydratisierung von 2-Phosphoglycerat zu Phosphoenolpyruvat (PEP) 2-PG == PEP + H2O ; reversibel, ∆G0r= + 7.5 kJ/mol Enzym: Enolase, Mg2+ -abhängig; Ein energiereiches Enolphosphat (PEP) entsteht! 10. Übertragung der Phosphatgruppe von Phosphoenolpyruvat (PEP) auf ATP. PEP + ADP ⇒ Pyruvat + ATP ; ∆G0r= - 31 kJ/mol; irreversibel! Enzym: Pyruvatkinase • • • • Substratkettenphosphorylierung: ATP wird gebildet! Allosterisches Enzym (Aktivator: Fru-1,6-P2; Inhibitoren: ATP, Alanin) Isoenzyme der Pyruvatkinase (L-Leber, M-Muskel und Gehirn) unterscheiden sich in der Regulation! Pyruvat tritt zunächst in der Enolform auf, die nichtenzymatisch in die Ketoform tautomerisiert! 6.1.4. Glycolyse: Bilanz Glucose+ 2 NAD+ + 2 Pi + 2ADP ⇒ 2 (Pyruvat + NADH + H+ + ATP + H2O ); ∆G0r= - 85 kJ/mol, irreversibel! A) Exergonischer Teilprozeß: Glucose+ 2 NAD+ => 2 (Pyruvat + NADH + H+ ); ∆G0r= - 140 kJ/mol B) Endergonischer Teilprozeß: 2 Pi + 2 ADP ⇒ 2 (ATP + H2O ); ∆G0r= +61 kJ/mol 3 Ca. 95% der Energie (bezogen auf den physiologischen Brennwert der Glucose) verbleiben im Pyruvat ! Die Glycolyse ist ein irreversibler Prozeß: Drei irreversible enzymatische Reaktionen treten auf, katalysiert durch Hexokinase, Phosphofructokinase und Pyruvatkinase. 6.1.5. Metabolismus des Pyruvats: Regeneration von NAD+ Die Glycolyse benötigt: • NAD+ (GAPDH) und ADP (Phosphoglyceratkinase und Pyruvatkinase), ATP (Hexokinase und Phosphofructokinase) NAD+ muß reoxidiert werden! Je nach Situation werden verschiedene Metabolite als Oxidationsmittel verwendet! A) anaerob: Lactatbildung (Erythrocyten, Retina, Muskel); Ethanolbildung (Hefen) B) aerob : Bildung von Acetyl-CoA 6.1.5.1 Lactatbildung: Lactatdehydrogenase (LDH) Pyruvat + NADH + H+ == Lactat + NAD+ ; reversibel, Oxidation von NADH, Bildung von Lactat! Lactat: • • Endprodukt des Glucoseabbaus in Erythrocyten; Retina,.. wird im Glucosestoffwechsel des Muskels bei O2 -Mangel gebildet! Anaerober Abbau der Glucose zu Lactat: Bilanz Glucose + 2 Pi + 2 ADP ⇒ 2 (Lactat +ATP + H2O ) 6.1.5.2 Alkoholische Gärung: Bildung von Ethanol, CO2 (in Hefen) Kooperation von Pyruvatdecarboxylase (Thiaminpyrophosphat) und Alkoholdehydrogenase (NADHOxidation). In Hefen wird dadurch NADH reoxidiert und Ethanol gebildet, In der Leber wird Alkohol durch cytosolische Alkoholdehydrogenasen (ADH) und das MEOS (microsomal ethanol oxidizing system) abgebaut. Die Alkoholdehydrogenase ist ein dimeres Metalloenzym (mehrere Isoenzyme. (Km = 0.2...2 mmol/l)). Das MEOS ist ein mikrosomales Cytochrom P450-Enzym (eine Monooxygenase, Km =8...12 mmol/l). 6.1.5.3 Bildung von Acetyl-CoA durch den Pyruvatdehydrogenase-Komplex (PDH) Bildung von Acetyl-CoA aus Pyruvat durch den mitochondrialen Pyruvatdehydrogenase-Komplex (PDH)! Die Glycolyse findet im Cytoplasma, die Bildung von Acetyl-CoA und der Citratcyclus in den Mitochondrien statt. Ein Pyruvat-Carrier transportiert Pyruvat gegen OH- (elektroneutral) in die Mitochondrien. Pyruvatdehydrogenase-Reaktion: Oxidative Decarboxylierung von Pyruvat: Pyruvat + CoA + NAD+ ⇒ Acetyl-CoA + CO2 + NADH + H+ ; Irreversibel! • • PDH: Ein mitochondrialer Enzymkomplex: 3 Enzyme und 5 Coenzyme sind beteiligt! Coenzyme und prosthetische Gruppen: NADH, CoA, FAD, Thiamin-Pyrophosphat, Liponamid. Die Reaktion wurde durch Fritz Albert Lipmann (1899-1986) aufgeklärt, der dafür den Nobelpreis 1953 erhielt. 4 Enzyme des PDK-Komplexes Enzym Abk. Coenzyme Pyruvat-Dehydrogenase (Decarboxylase) E1 Thiaminpyrophosphat (TPP), FAD Dihydrolipoyl-Transacetylase E2 Lipoamid Dihydrolipoyl-Dehydrogenase E3 FAD, NADH Reaktionen am PDH-Komplex Alle Zwischenprodukte bleiben am Komplex gebunden! E1: Decarboxylierung von Pyruvat und Bindung an Thiaminpyrophosphat (TPP) • Pyr + TPP ⇒ Hydroxyethyl-TPP + CO2 E2: Oxidation der Hydroxyethylgruppe, Transfer auf Liponamid • Hydroxyethyl-TPP + Liponamid ⇒ Acetyl-Liponamid + TPP E2: Transfer der Acetylgruppe auf CoA • Acetyl-Liponamid + CoA ⇒ Acetyl-CoA + Dihydroliponamid E3: Regeneration des Liponamids (FAD abhängige Teilreaktion an E3!!) • Dihydroliponamid + NAD+ ⇒ Liponamid + NADH +H+ Regulation der PDH-Aktivität • • • • Das Enzym wird durch Phosphorylierung von Serylresten des E1-Proteins (A) inaktiviert.! Kinase und Phosphatase sind mit dem PDH-Komplex assoziiert. Die PDH wird durch die Produkte Acetyl-CoA und NADH gehemmt (Produkthemmung). ATP und GTP hemmen, AMP aktiviert! Ligandenbindung führt zu Konformationsänderungen, die die Aktivitäten von Proteinkinase und Proteinphosphatase beeinflussen: Die Proteinkinase wird durch ATP, Acetyl-CoA und NADH aktiviert und durch Pyruvat gehemmt. PDH: Pathobiochemie • Genetische Defekte der PDH bewirken Lactacidose und neurologische Störungen wie dem LEIGH-SYNDROM. 6.2. Gluconeogenese: Neubildung von Glucose/Glycogen aus NichtKohlenhydraten 2.1 Einordnung Erythrocyten, Nervengewebe und Nierenmark sind auf eine kontinuierliche Glucosezufuhr angewiesen. Der Glucosebedarf des Nervensystems liegt bei ca. 140 g/d: "Glucosehomeostase"! Substrate der Gluconeogenese: • Alanin, Lactat, Oxalacetat, Glutamat, Glycerin; Acetyl-CoA ist kein Substrat der Gluconeogenese! 5 Organe der Gluconeogenese: • • Leber, Niere (bei Acidose), Teilsequenzen findet man auch in anderen Organen. An der Gluconeogenese sind Reaktionen im Cytosol, dem Mitochondrium und dem ER beteiligt. Die Gluconeogenese ist keine Umkehrung der Glycolyse Die irreversiblen Reaktionen werden bei der Gluconeogenese durch andere, gleichfalls irreversible Reaktionen umgangen! Die Gluconeogenese nutzt die reversiblen Reaktionen der Glycolyse! Glycolyse Gluconeogenese Lokalisation Hexokinase Glucose-6-phosphatase ER Phosphofructokinase Fructose-1,6-bisphosphatase Cytosol Pyruvatkinase Pyruvatcarboxylase und PEP-Carboxykinase Mitochonrien/Cytosol 2.2 Gluconeogenese aus Pyruvat 2.2.1 Umwandlung von Pyruvat in Phosphoenolpyruvat: Umgehung der PyruvatkinaseReaktion der Glycolyse • • Pyruvatcarboxylase (Mitochondrien) PEP-Carboxykinase (Mitochondrien und Cytosol) Pyruvatcarboxylase Pyruvat + ATP + HCO3- ⇒ Oxalacetat + ADP • • Irreversibel! Ein mitochondriales Enzym, enthält Biotin-Enzym! Wird durch Acetyl-CoA allosterisch aktiviert! Die Transkription des Gens wird durch Glucocorticoide induziert! PEP-Carboxykinase Oxalacetat + GTP == Phosphoenolpyruvat + CO2 + GDP • • Reversibel! In der Leber des Menschen findet man das Enzym in Mitochondrien und im Cytosol In Zellen, in denen das Enzym nur im Cytosol auftritt, sind Substratshuttle für den Transport von Oxalacetat nötig. Netto-Reaktion (Pyruvatcarboxylase plus PEP-Carboxykinase): Pyruvat + ATP + GTP + H2O ⇒ Phosphoenolpyruvat + ADP + GDP + Pi • • • Keine netto-Fixierung von CO2 2 energiereiche ~P werden eingesetzt! ∆G0r= + 0.8 kJ/mol, aber ∆G = -26 kJ/mol ! irreversibel! 2.2.2 Umgehung der Phosphofructokinase-Reaktion: Fructose-1,6-bisphosphatase • ∆G0r= -17 kJ/mol; irreversibel!; Ein cytosolisches allosterisches Enzym. 6 2.2.3 Umgehung der Hexokinase-Reaktion: Glucose-6-phosphatase • • Die Glucose-6-phosphatase ist ein Enzym der Membran des ER (innen)! Die von Gierkesche Krankeit (Glycogenose Ia) wird durch einen Defekt im Gen der Glucose-6phosphatase verursacht. 2.3 Bilanz: Gluconeogenese versus Glycolyse Gluconeogenese: 6 energiereiche Bindungen werden eingesetzt! 2 Pyruvat + 4 ATP + 2 GTP+ 2 NADH + 2 H+ + 6H2O ⇒ Glucose + 4 ADP + 2 GDP + +6 Pi +2 NAD+ ∆G0r= -48 kJ/mol; irreversibel! Glycolyse: 2 mol ATP/mol Glucose verden gebildet! Glucose + 2 ADP + 2 Pi + 2 NAD+ ⇒ 2 Pyruvat + 2 ATP + 2 NADH + 2 H+ + 2H2O ∆G0r= -73 kJ/mol; irreversibel! 2.4 Gluconeogenese aus Lactat und Alanin Umwandlung von Lactat und Alanin in Pyruvat (im Cytoplasma) • • Lactat: Die LDH-Reaktion ist reversibel! Lactat + NAD+ == Pyruvat + NADH + H+ Alanin: Alaninaminotransferase (ALAT), reversibel! Alanin + α-Ketoglutarat == Pyruvat + Glutamat Pyruvat wird im Austausch gegen OH- in die Mitochondrien transportiert. 2.5 Der Cori-Zyklus (Glucose-Lactat-Zyklus) Substrat für die Gluconeogenese in der Leber sind das in Erythroycten und der Muskulatur gebildete Lactat (Cori-Zkylus) und Alanin, sowie Glycerin (aus dem Fettgewebe)! Der Glucose-Alanin-Zyklus ist eine Variante des Cori-Zyklus. Das in der Muskulatur gebildete Pyruvat wird durch eine Alanin-Aminotransferase (ALAT) in Alanin überführt und zur Leber transportiert. In der Leber wird wieder Pyruvat gebildet: ALAT: Alanin + α-Ketoglutarat == Pyruvat + Glutamat besprochen!) (wird im Aminosäurestoffwechsel Pyruvat wird in der Leber zur Gluconeogense verwendet. Das in der ALAT-Reaktion gebildete Glutamat wird durch die Glutamatdehydrogenase oxidativ desaminiert. Durch den Glucose-AlaninZyklus wird auch Ammoniak zur Leber transportiert! 3. Regulation von Glycolyse und Gluconeogenese 3.1 Regulation der Glycolyse Ein ziemlich komplexer Prozess! Dabei wird die Geschwindigkeit des Glucoseabbaus an den ATP-Bedarf der Zelle angepasst! Weil aber Zwischenprodukte der Glycolyse auch Vorläufer für Biosynthesen (z.B. Aminosäuren und Nukleotiden) sind, und beim Abbau von Aminosäuren und Nukleotiden auch Metabolite der Glycolyse gebildet werden, müssen Glycolyse und Biosynthese regulatorisch aufeinander abgestimmt sein. Dabei wird die intrazelluläre Konzentration von Metaboliten in engen Bereichen konstant gehalten. Beispiel zur Regulation: Pasteur-Effekt • Hemmung der Glycolyse durch die Atmung. Beim Übergang von aeroben zu anaeroben Bedingungen steigt die Geschwindigkeit der Glucoseverwertung durch die Glycolyse! Entdeckt von Louis Pasteur (1822-1895) bei Untersuchungen zur Hefegärung. 7 Energetische Grundlage: ATP • • anaerobe Glycolyse + 2 mol ATP/mol Glucose aerober Stoffwechsel + 32 mol ATP/mol Glucose Enzymologische Grundlage: Regulation der PFK • Hemmung durch Citrat und ATP, Stimulation durch Fru-2,6-P2 und Pi Umgekehrt zeigen viele Tumorzellen eine hohe aerobe Glycolyse (Warburg-Effekt). Auch dafür ist vermutlich Fru-2,6-P2 (PFKFB3) wichtig! Alle Enzyme eines Stoffwechselweges leisten einen Beitrag zur Kontrolle des Metabolitenflusses, jedoch in unterschiedlichem Ausmaß. Die Enzyme mit der höchsten Kontrollstärke sind: Hexokinase, Phosphofruktokinase und Pyruvatkinase! Das sind zugleich die irrversible Schritte in der Glycolyse! Phosphofructokinasen (PFK1) sind allosterische Enzyme! • • Inhibitoren: ATP, Citrat, Acidose (Lactat!) Aktivatoren: AMP, ADP, Fru-1,6-P2, Fru-2,6-P2,... Fructose-2,6-bisphosphat (Fru-2,6-P2) • • • • Der wirksamste allosterischer Aktivator der PFK-1. Hemmt auch die Fructose-1,6-bisphosphatase (s.unten). Entsteht aus Fru-6-P durch eine Phosphofructokinase-2 (PFK-2). Wird durch eine spezifische Fructose-2,6-bisphosphatase (FBPase-2) zu Fru-6-P abgebaut! PFK-2/FBPase-2 der Leber ist ein bifunktionelles Enzym! Beide Enzymaktivitäten werden durch ein Enzymprotein katalysiert. Im Menschen gibt es wenigstens 4 Isoenzyme der PFK-2/FBPase-2, die sich in Organverteilung und Regulation unterscheiden! • • Die Transkription des PFK-2/FBPase-2-Gens durch Insulin + Glucose induziert! Durch Phosphorylierung eines Serylrestes des PFK-2/FBPase-2-Proteins wird die PFK-2-Aktivität unterdrückt und die Aktivität der FBPase-2 stimuliert. Organspezifische Regulation des Glucosestoffwechsels durch Fru-2,6-P2 A) Leber: Phosphorylierung aktiviert die Fructose-2,6-bisphosphatase und hemmt die Phosphofructokinase-2. • Senkt die Konzentration an Fru-2,6-P2! Hemmung der Glycolyse/Aktivierung der Gluconeogenese B) Herzmuskel: Phosphorylierung • • Aktiviert die PFK-2. Die FBPase-Aktivität wird nicht beeinflußt. erhöht die Konzentration an Fru-2,6-P2 ! Aktivierung der Glycolyse und Hemmung der Gluconeogenese. Pyruvatkinase: Ein allosterisches Enzym Isoenzyme der Pyruvatkinase (L(Leber) - und M (Muskel)-Typ) unterscheiden sich in regulatorischen Eigenschaften. • • Das L-Typ Enzym wird durch Fru-1,6-P2 allosterisch aktiviert und durch Alanin gehemmt. Die Leber-Pyruvatkinase wird durch Phosphorylierung inaktiviert! Insulin induziert die Transkription des Gens der Leber-Pyruvatkinase. 8 Hexokinase: Isoenzyme In der Leber wirken verschiedene Isoenzyme der Hexokinase. Die Hexokinase IV (=Glucokinase) unterscheidet sich in regulatorischen Eigenschaften von anderen Isoenzymen. Während die Hexokinasen I-III im Vergleich zum Glucosespiegel im Blut (ca. 4-5 mmol/l) sehr hohe Affinitäten für Glucose besitzen (Km < 0.1 mmol/l), liegt der Km-Wert der Glucokinase für Glucose bei ca. 10 mmol/l. Die Glucokinase wird durch Glc-6-P nicht gehemmt. Diese Eigenschaften der Glucokinase ermöglichen es der Leber, die Geschwindigkeit des Glucoseverbrauches an den Blutglucosespiegel anzupassen. Die Transkription des Glucokinase-Gens wird durch Insulin stimuliert. Im Typ-I-Diabetes kommt es zu verminderten Aktivitäten der Glucokinase in der Leber! 3.2 Regulation der Gluconeogenese 3.2.1 Verfügbarkeit der Substrate • Lactat, Pyruvat, Glycerol, NADH • Alkohol "hemmt" die Gluconeogenese in der Leber • Alkohol wird in der Leber schnell metabolisiert (Alkoholdehydrogenase)! Dabei wird NADH gebildet, das durch die LDH reoxidiert wird! Folge ist ein Abfall der Pyruvatkonzentration (und eine Lactatacidose). 3.2.2 Regulation gluconeogenetischer Enzyme Pyruvatcarboxylase: • • Allosterische Aktivierung durch Acetyl-CoA; Kontrolle durch die intramitochondriale PyruvatKonzentration. Induktion der Transkription durch Glucocorticoide, Repression der Transkription durch Insulin. PEP-Carboxykinase • Induktion der Transkription durch Glucocorticoide, Repression der Transkription durch Insulin. Fructose-1,6-bisphosphatase • Allosterische Hemmung durch Fru-2,6-P2, AMP 3.3 Koordination von Glycolyse und Gluconeogenese: Reziproke Regulation Glycolytischer und gluconeogenetischer Enzyme In der Kooperation glycolytischer und gluconeogenetischer Enzyme entstehen ATP-abhängige Reaktionszyklen. Die gleichzeitige Aktivität glycolytischer und gluconeogenetischer Enzyme führt zur ATP-Hydrolyse ohne Netto-Umsatz. Durch eine reziproke Regulation funktionell antagonistischer Enzyme wird die Substratzyklierung vermindert und die regulatorische Effizienz drastisch erhöht (Schlagworte: Schalter, Hypersensitivität, Hysterese). Der PFK-FbPase-Zyklus: Ein futile cycle Phosphofructokinase und Fructose-1,6-bisphosphatase werden allosterisch reguliert! Fru-2,6-P2, AMP und Fru-1,6-P2 sind zugleich Aktivatoren der Phosphofructokinase und Inhibitoren der Fructose-1,6bisphosphatase. Der Phosphoenolpyruvat/Pyruvat-Zyklus • • Pyruvatkinase (Cytosol). Pyruvatcarboxylase (Mitoch.) und PEP-Carboxykinase (Mitoch. und Cytosol). 9 Allosterische Regulation Enzym Aktivatoren Inhibitoren Pyruvatkinase Fru-1,6-P2 Alanin PDH-Komplex Pyruvat Acetyl-CoA, NADH Pyruvatcarboxylase Acetyl-CoA Regulation durch Phosphorylierung/Dephosphorylierung • Pyruvatkinase und PDH werden durch Phosphorylierung inaktiviert! Transkriptionsregulation kontrolliert Enzymkonzentrationen! Die Transkription der Gene von PEP-Carboxykinase und Pyruvatcarboxylase werden durch Glucocorticoide induziert und durch Insulin reprimiert! Bei der Feinregulation der Enzyme gibt es Unterschiede zwischen den Organen. Obige Zusammenstellung bezieht sich auf Enzyme in der Leber. 4. Pentosephosphatzyklus Wird auch als Hexosemonophosphatweg (hexose monophosphate shunt), Phosphogluconatzyclus oder „direkte Oxidation der Glucose“ bezeichnet. Der Pentosephosphatweg liefert • • • NADPH für reduktive Biosynthesen Ribose-5-phosphat: ATP, GTP; DNA, RNA,... Zuckerphosphate: C3, C4, C5, C6, C7 Alle Reaktionen des Pentosephosphatweges laufen im Cytosol ab! 4.1 NADPH: Die „2. Währung“ der Zelle. NAD+ /NADH und NADP+/NADPH werden von verschiedenen Enzymen verwendet! • • NAD+ ⇒ NADH: NADPH ⇒ NADP+: Oxidation von Metaboliten Reduktion von Metaboliten (⇒ oxidative Phosphorylierung) (⇒ reduktive Biosynthesen) 4.2 Abschnitte des Pentosephosphatweges (PPC) 4.2.1 Oxidativer Teil des PPC • • • Glucose-6-phosphat ⇒ Ribulose-5-phosphat + CO2; irreversibel! Bildung von 2 mol NADPH/mol Glc-6-P Bildung von 1 mol CO2/mol Glc-6-P Der Pentosephosphatweg ist in Zellen mit hohem NADPH-Bedarf (Fettgewebe) besonders aktiv! Glucose-6-phosphat-Dehydrogenase: Glc-6-P + NADP+ ⇒ 6-Phosphogluconolacton + NADPH + H+ Oxidation der Aldehyddruppe (Hemicaetyl) am C1 von Glc-6-P, Bildung einer Carboxylgruppe (Lacton). Lactonase: 6-Phosphogluconolacton + H2O == 6-Phosphogluconat + H+ Hydrolyse des Lactons, Ringöffnung! 6-Phosphogluconat-Dehydrogenase: Oxidative Decarboxylierung 6-Phosphogluconat + NADP+ ⇒ Ribulose-5-phosphat + NADPH + H+ + CO2 10 Bilanz des oxidativen Abschnitts: Glc-6-P + 2 NADP+ + H2O ⇒ Ribulose-5-phosphat + 2 NADPH + 2 H+ +CO2 4.2.2 Nichtoxidativer (reversibler) Teil des PPC • Reversible Umwandlungen von Zuckerphosphaten. Bildung von Ribose-5-phosphat. Ribulose-5-phosphat kann reversibel umgewandelt werden durch eine: • • Isomerase in Ribose-5-phosphat Epimerase in Xylulose-5-phosphat (R5P, eine C5-Aldose). (Xu5P, eine C5-Ketose). Diesen Reaktionen schließen sich durch Transaldolase und Transketolase katalysierten reversiblen Reaktionen an, in denen verschiedene Zuckerphosphate (C3 - C7) entstehen. Transketolase: • • • Benötigt Thiaminpyrophosphat als prosthetische Gruppe ! Katalysiert die Übertragung von C2-Fragmenten C5 + C5 == C7 + C3; C5 + C4 == C6 + C3 Die Transaldolase katalysiert die Übertragung von C3-Einheiten von Sedoheptulose -7-P auf GAP. Im reversiblen Abschnitt des PPC werden Fructose-6-phosphat und Glycerinaldehyd-3-phosphat gebildet, die einen reversiblen Anschluß an die Glycolyse vermitteln: Bilanz des reversiblen (anaeroben) Teiles des Pentosephosphatzyklus: C5 + C5 == C7 + C3 C3 + C7 == C6 + C4 C5 + C4 == C6 + C3 (Transketolase) (Transaldolase) (Transketolase) 3 Ribose-5-phosphat == 2 Fructose-6-phosphat + Glycerinaldehyd-3-phosphat Bilanz beider Abschnitte des Pentosephosphatzyklus: 3 Glc-6-P+ 6 NADP+ + 3 H2O ⇒ 2 Fru-6-P + GAP + 6 NADPH + 6 H+ + 3 CO2 4.3 Regulation des PPC Die beiden Abschnitte des PPC können unabhängig voneinander kontrolliert werden! • • • Im oxidativen Teil des PPC entsteht NADPH. Die Geschwindigkeit der Reaktionen im oxidativen Teil des PPC wird durch den NADP+-Spiegel (den Bedarf an NADPH) kontrolliert. Wenn in einer Stoffwechselsituation mehr Rib-5-P als NADPH benötigt wird, kann Rib-5-P aus Fru-6-P und Glycerinaldehyd-3-phosphat gebildet werden. Wenn mehr NADPH als Rib-5-P benötigt wird, kann aus Fru-6-P und GAP durch Reaktionen der Gluconeogenese Glc-6-P gebildet werden. Dabei muß man berücksichtigen, daß bei jedem Durchlauf ein CO2 gebildet wird! Beim vollständigen + Abbau des Glc-6-P erhält man: Glc-6-P + 7 H2O + 12 NADP+ => 6 CO2 + 12 NADPH + 12 H + Pi 11 4.4 Klinische Bedeutung A) Genetische Defekte am Glucose-6-phosphat-Dehydrogenase-Gen • Bewirken eine eingeschränkte Belastbarkeit von Erythrozyten durch oxidativen Stress (verminderte NADPH-Bildung). Erythrozyten benötigen NADPH aus dem PPC für die Glutathionreduktase-Reaktion! Begünstigen arzeneimittelinduzierte hämolytische Anämien. B) Die Transketolase benötigt Thiaminpyrophosphat • TPP-Mangel und/oder eine gestörte TPP-Bindung an die Transketolase verursachen eine schwere neurophysische Erkrankung (Wernicke-Korsakoff-Syndrom, auch WernickeEnzephalopathie). Interaktion von genetischer Veranlagungen (bei Heterozygoten Merkmalsträgern) und Umwelteinflüssen! 5. Stoffwechsel einiger Monosaccharide 5.1 D-Fructose • • • • Bestandteil der Saccharose (α-Glucosyl-(1-2) –ß-Fructosid). Disaccharide aus der Nahrung werden zu Monosacchariden hydrolysiert. Direkter Abbau der Fructose in der Leber! Biosynthese aus Glucose in vielen Geweben (Polyolweg)! 5.1.1 Der Fructose-1-phosphat-Weg (Leber) 1. Fructokinase: Fructose + ATP ⇒ Fru-1-P + ADP : irreversibel! Fructose wird in der Leber schneller metabolisiert als Glucose (hohe Aktivität der Fruktokinase)! 2. Aldolase B: Fru-1-P == Glycerinaldehyd + DHAP ; reversibel! Aldolase B: Die Aldolase ist ein tetameres Protein. Die Untereinheiten werden beim Menschen durch drei Gene codiert: Aldolase A (ALDOA, Muscle type aldolase), Aldolase B (ALDOB, Liver type aldolase) und Aldolase C (ALDOC, Brain type aldolase). In der Leber dominiert die B4-Isoform. Während die Aldolase A spezifisch Fru-1,6-P2 umsetzt, spaltet die Aldolase B Fru-1,6-P2 und Fru-1-P. 3. Glycerinaldehyd wird im Leberstoffwechsel phosphoryliert, kann aber auch oxidiert oder reduziert werden. Phosphorylierung von Glycerinaldehyd: Glycerinaldehyd-Kinase: • • Glycerinaldehyd + ATP ⇒ Glycerinaldehyd-3-phosphat + ADP Glycerinaldehyd-3-phosphat und DHAP sind Metabolite der Glycolyse! Hereditäre Fruktoseintoleranz (HFI), Defekt im Fruktose-Aldolase B Gen Indikation: Gastrointestinale Beschwerden und Hypoglykämie mit Übelkeit, Erbrechen, Schwitzen, Hyperuricämie und z. T. Krampfanfällen nach fruktosehaltigen Mahlzeiten;. • • • Autosomal-rezessiv vererbbarer Defekt im Gen der Aldolase B! Akkumulation von Fru-1-P in Leber, Niere und Darm nach Fruktoseaufnahme. Hemmung von Phosphorylase, Fructose-1,6-bisphosphatase und Fructokinase. o Hypoglycämie (Hemmung der Phosphorylase in der Leber, Hemmung der hepatischen Gluconeogenese). o Starke Veränderungen im ATP/AMP-Quotienten (↓ATP,↑AMP), erhöhter Abbau von 12 • • Adeninukleotiden. Hyperuricämie. Schädigung von Leber, Niere und Gehirn. Wichtig ist eine fructosearme Ernährung! Die HFI sollte nicht mit der essentiellen Fructosurie (primär verminderte Aktivität der Fructokinase) oder der Fructosemalabsorption (gestörte Resorption der Fruktose) verwechselt werden! 5.1.2. Der Sorbitolweg: Extrahepatische Biosynthese von Fructose 1. Glucose kann durch eine ubiquitäre Aldose-Reduktase (NADPH) zu Sorbitol reduziert werden. Aldosereductase (EC 1.1.1.21): Monomeres NADPH-abhängiges Enzym! 2. Eine NADH-abhängige Sorbitol-Dehydrogenase wandelt Sorbitol in Fructose um. 2+ + Sorbitol-Dehydrogenase (SORD; EC 1.1.1.14 ) Homotetramer, Zn -Enzym, NAD ! SORD-Polymorphismen sind vermutlich an der Entstehung der microvasculären Probleme bei Diabetikern (OMIM 182500) beteiligt! Sorbitolweg: Klinische Bedeutung Bei Erhöhung des Blutzuckerspiegels (Diabetes mellitus, Hyperglykämien) kommt es in der Linse und in Nervenzellen zu einer toxischen Erhöhung der Sorbitolkonzentration und des osmotischen Drucks (Katarakte) und zu verstärkter Oxidation von Glutathion (↓NADPH)! 5.2 Galactose (Gal): C4-Epimer der Glucose • • • Ist in der Lactose enthalten. Wird für die Synthese von Lactose, Sphingolipiden und Glycoproteinen benötigt! Umwandlung in Glc-1-P in der Leber! 5.2.1 Galactosestoffwechsel der Leber 1. Galactokinase: Galactose + ATP ⇒ Galactose-1-phosphat + ADP; Irreversibel, Galactose-1phosphat (Gal-1-P) wird gebildet 2. Galactose-1-phosphat-Uridyltransferase : Gal-1-P + UDP-Glucose == UDP-Galactose + Glc-1-P 3. UDP-Galactose-Epimerase UDP-Galactose == UDP-Glucose ; Reversibel, Epimerisierung am C4 der UDP-Galactose, NAD+ wird als Cosubstrat benötigt Klinische Relevanz • Die klassische Galactosämie beruht auf einem Defekt der Galactose-1-phosphatUridyltransferase. o Eine angeborene, autosomal-rezessive vererbte Stoffwechselerkrankung (Häufigkeit 1:55 000). Durch Fehlen der Galactose-1-P-Uridyltransferase häufen sich Galactose und Galactose-1-P in Blut und Gewebe an. Galactosefreie Ernährung ist wichtig! 5.3 Biosynthese von Mannose, Fucose und Aminozuckern • • • Mannose und Fucose sind in Glycoproteinen und Glycolipiden enthalten. GDP-Derivate sind Intermediate bei der Synthese von Mannose und Fucose und beim Einbau in Glycoproteine und – Lipide. Die Biosynthese beginnt mit Fructose-6-phosphat. 5.3.1 Biosynthese aus Fructose-6-phosphat 1. Isomerase: Fru-6-P == Mannose-6-phosphat 2. Mutase Man-6-phosphat == Man-1-phosphat 3. Aktivierung mit GTP Man-1-phosphat + GTP ⇒ GDP-Mannose + 2 Pi 4. Reduktion GDP-Mannose + NADPH + H == GDP-Fucose + NADP +H2O + + 13 5.3 2 Synthese von Aminozuckern. • • • • Fru-6-P ist Ausgangsstoff für die Synthese von Aminozuckern und N-Acetylneuraminsäure. Der Donor für die NH2-Gruppe ist Glutamin. Der Donor für die Acetyl-Gruppe ist Acetyl-CoA. Aminozucker werden für Glycolipide, Glycoproteine und Heteroglykane benötigt! Bildung von Glucosamin 1-P und N-Acetyl-Glucosamin-1-P. Aktivierung von Glucosamin 1-phosphat und N-Acetyl-Glucosamin-1-phosphat mit UTP • • • Glucosamin 1-phosphat + UTP ⇒ UDP-Glucosamin. N-Acetyl-Glucosamin-1-phosphat + UTP ⇒ UDP-N-Acetyl-Glucosamin. UDP-N-Acetyl-Glucosamin ist Ausgangspunkt für die Biosynthese von N-Acetylneuraminsäure (NANA, Sialinsäure). Dabei wird zunächst N-Acetylmannosamin-6-P gebildet, das in einer zweiten Reaktion mit PEP zu N-Acetylneuraminatphosphat (Enoylphosphattransferase) umgesetzt wird! 5. 4 UDP-Glucuronsäure wird durch Oxidation von UDP-Glucose gebildet • • UDP-Glucuronsäure wird u.a für die Kopplung von Metaboliten bei der Biotransformation in der Leber benötigt. UDP-Glucose + H2O +2 NAD+ == UDP-Glucuronsäure + 2 (NADH + H+ ). 14