Tetracycline
Werbung

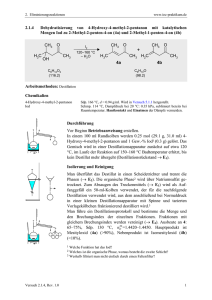
Tetracycline Tetracyclin Geschichte Die Tetracycline sind Antibiotika, die aus StreptomycesArten gewonnen werden. Sie kommen in der Erde, im Staub, im Getreide vor. Isolierung Chlorotetracycline 1948 aus (Streptomyces aureofaciens), Oxytetracyclin 1950 (Streptomyces rimosus). Tetracyclin synthetische Verbindung (später es wurde auch aus Streptomyces aureofaciens gewonnen.) Struktur, chemische Eigenschaften I H3C H3C OH OH H O H OH OH CH3 H3C CH3 OH N H3C HOH H N OH C O D NH2 O OH TETRACYCLIN O B OH A OH C O NH2 O OXITETRACYCLIN H3C CH3 N CH3 OH H H OH C OH O OH OH OH C O DOXICYCLIN O NH2 Struktur, chemische Eigenschaften II CH3 H3C H3C N H H CH3 OH Cl N OH O OH H H CH3 N OH OH C D OH H3C C O MINOCYCLIN O B NH2 OH O OH A OH C O O DEMECLOCYCLIN NH2 Struktur, chemische Eigenschaften III Sie besitzen ein gemeinsames Grundgerüst bestehend aus vier annelierten Sechsringen (Octahydrotetracen früher Naphthacen). Der Ring D ist aromatisch, die anderen Ringe sind teilweise gesättigt. Die Chiralitätzentren (6): 4, 4a, 5, 5a, 6, 12. Die verschiedene Vertreter unterscheiden Substituenten in Stellungen 5,6,7. sich in den Physikalische und chemische Eigenschaften I Sie sind gelbe Feststoffe ohne Geruch mit bitterem Geschmack. Sie zersetzen sich im Licht und bräunen sich. Sie lösen sich im Wasser schlecht, in polaren Lösungsmitteln besser. Sie besitzen sowohl sauere, als auch basische hydrolysieren. Gruppen (amphoter). Ihre Salze Physikalische und chemische Eigenschaften II H3C 8 9 CH3 H N CH3 OH 7 6 5 D C B 10 11 12 1 OH O OH O Phenoldiketon 4 A OH Ammoniumion OH 3 2 CONH2 Tricarbonylmethan Die pK Werte für Tetracyclin, Oxytetracyclin Chlorotetracyclin. (pK1 für Tricarbonylmethan 3,3, pK2 für Phenoldiketon 7,3-7,7, für Ammoniumion 9,1-9,7) Stabilität I Es hat die höhste Stabilität bei pH=3. Es gibt unterschiedliche Zersetzung abhängig von pH. In sauerem Milieu (pH<2) kommt es unter Abspaltung der 6-OH-Gruppe zu Anhydrotetracyclinen (B-Ring ist aromatisch.) Doxycyclin ist der stabilste Vertreter (Es ist keine 6OH-Gruppe für die Lactonbildung.) Stabilität II Die Struktur des Anhydrotetracyclins CH3 N(CH3)2 OH OH OH OH O O CONH2 5,6-Anhydrotetracyclin Stabilität III Bei Chlortetracyclin mit einer Base (pH>8) wird Ring wird C zu einem Lacton gespalten (Isochlortetracyclin). CH3 H3C Cl N CH3 OH Chlortetracyclin NaOH t = 20oC O C OH O O OH CONH2 O Stabilität II Bei Erwärmung mit Säure tritt eine ähnliche Reaktion auf, aber Ring B wird geöffnet (Apooxytetracyclin). H3C CH3 CH3 N OH HCl Oxytetracyclin t ~ 60oC O C OH OH O OH CONH2 O Stabilität III CH3 CH3 H N OH A B OH OH H3C CH3 H+ (pH = 2-6) H OH A B CONH2 O N OH OH CONH2 Im Bereich von pH 2-6 tritt eine Epimerisierung vor (4-EpiTetracycline). Diese Derivate verlieren einen Teil oder die gesamte antibakterielle Wirkung. Komplexbildung I Tetracycline bilden nicht resorbierbare Chelate mit divalenten Kationen, pH 3-7,5: Komplexbildung mit Phenol-Diketon-System; pH > 7,5: zusätzlich Komplexbildung mit Aminstickstoff und 12a-OH. OH O O O O OH Me O O Komplexbildung II Vorsicht bei Ca2+, Mg2+ Antacida oder Eisenpräparaten, Infusionen. Einnahme Darum von verbietet von Mg und sich die gleichzeitige Al-haltigen Antacida, Eisenpräparaten oder Milch mit Tetracyclinen. Diese Reaktion Wirkungsmechanismus. spielt eine Rolle im Wirkungsmechanismus I Die Tetracycline binden ebenfalls ans intakte 30 S Ribosom und hemmen die Elongation der Peptidketten. Sie verhindern die Anlagerung von Aminoacyl - tRNA an die mRNA in der 30-S-Untereinheit eines BakterienRibosoms. Die geringe Toxizität basiert auf der höheren Affinität der Tetracycline zu Bakterien- als SäugetierRibosomen. Wirkungsmechanismus II Noch dazu spielen in der Wirkung eine Rolle: die Bildung von Chelat-Komplexen, die Hemmung der bakteriellen Oxidation und die Hemmung der Biosynthese der Nucleinsäuren. Wirkungstyp: bakteriostatisch Wirkungsspektrum Wirkungsspektrum Sie sind wirksam gegen zahlreiche grampositive (Streptokokken, Pneumokokken, Listerien) und gramnegative Bakterien (Neisserien, Yersinien, Haemophilus), sowie Spirochäten. Es ist klinisch wichtig, dass sie gegen intrazelluläre Keime aktiv sind (Mycoplasmen, Chlamydien). Doxycyclin bewirkt gegen Plasmodium falciparum (Minocyclin ist aktiv gegen einige Mykobakterien). (Malaria), Kinetik und Metabolismus I Sie sind lipophile Substanzen, sie werden in Zähne und Knochen eingelagert. Orale Bioverfügbarkeit 75 bzw. 100 % (Doxycyclin und Minocyclin). Verteilung im gesamten Organismus, auch in intrazelluläre Räume, (intrazellulär parasitierende Fettgewebe. Keime) mit der Ausnahmen von Kinetik und Metabolismus II Metabolismus: Glukuronidierung und teilweise Metabolisierung, Plasma-HWZ 12-24 h (Mino- und Doxycyclin) Exkretion: renal (Tetracyclin) und biliär (Minocyclin und Doxycyclin). Plasmabindung: Tetracyclin 40 %, Oxytetracyclin 40 %, Doxycyclin 96 %, Minocyclin 75 %. Nebenwirkungen Zahnschmelzschäden, Knochenentwicklungsschäden Chelatbildung mit Ca2+, Kontraindikation in Gravidität und Kindesalter (nur über 8 Jahre) Gastrointestinale Oesophagusmukosa. Symptome, Bei der Reizung der Behandlung von Tetracyclinen kann durch das Toxin von Clostridium difficile pseudomembranöse Enterocolitis werden. (Lebertoxizität, Photosensibilisierung.) verursacht Resistenz Resistente Bakterien: Staphylococci, Streptococci, Pneumococci, Neisseria gonorrhoae, Aktiver Austransport der Tetracycline (Efflux) Hemmung des Eintritts durch Porinveränderung Affinitätsverlust der Bindungsstellen Enzymatische Oxidation Neuere Tetracycline (Tigecyclin 2006)I N(CH3)2 N(CH3)2 OH O R NH2 N H OH O TBG-minocyclin DMG-minocyclin OH OH O O R = t-BuNH =Tigecyclin R = (CH3)2N Neuere Tetracycline (Tigecyclin 2006)II Tigecyclin (TYGACIL) ist das erste therapeutisch verfügbare Antibiotikum aus der Gruppe der Glycylcycline. Tigecyclin wirkt gegen grampositive und gramnegative Erreger, einschließlich solcher Stämme die gegen Tetracycline oder andere Antibiotika resistent sind (u.a. MRSA und VRE produzierende Bakterien). Kinetik Die Gewebegängigkeit ist gut und das Verteilungsvolumen hoch. Die Halbwertzeit liegt bei etwa 40 Stunden.
![6.3.1 1-Oxa-spiro[2.5]octan - Institut für Organische Chemie](http://s1.studylibde.com/store/data/001356875_1-96e669e5c88ad586db9f9f199d424d05-300x300.png)