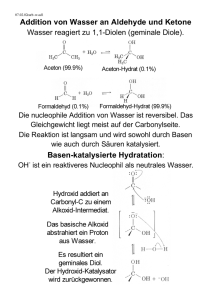
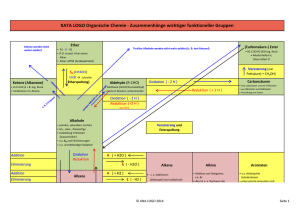
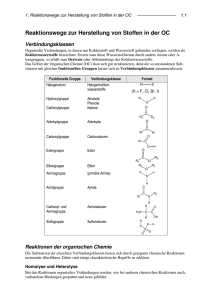
11.4 Allgemeine Übersicht über Reaktionsmechanismen 11.4.1
Werbung

11__SAUERSTOFFHALTIGE ORGANISCHE VERBINDUNGEN
11.4 Allgemeine Übersicht über Reaktionsmechanismen
11.4 Allgemeine Übersicht über Reaktionsmechanismen
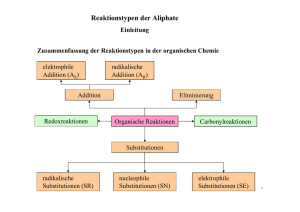
Substitution: Bei Substitutionen werden Atome oder Atomgruppen in einem organischen Molekül durch andere Atome
oder Atomgruppen ersetzt.
11.4.1 Einteilung nach der Art des angreifenden Teilchens
Einteilung nach Art des angreifenden Teilchens
nucleophile Substitution
Angriffsort
am positivierten Kohlenstoff- am delokalisierten -ElekAtom polarer Verbindungen tronensystem aromatischer
Moleküle
wie z. B. Halogenalkane,
Alkanole
an C2H-Bindungen
Reaktionsweise
Das angreifende Nucleophil
bildet mit dem positivierten
C-Atom eine Bindung aus.
Gleichzeitig wird die Bindung
zwischen dem C-Atom und
seinem elektronegativeren
Bindungspartner heterolytisch gespalten
Das Elektrophil tritt mit dem
-Elektronensystem des
Rings in Wechselwirkung.
Intermediär wird dabei der
aromatische Zustand durch
Bildung eines σ-Komplexes
aufgelöst. Die Rearomatisierung erfolgt durch Abspaltung eines Protons
Durch Licht und Wärme
werden Halogene homolytisch in Radikale gespalten.
Die Wasserstoff-Atome von
C2H-Bindungen werden
nun durch Halogen-Atome
ersetzt.
Beispiel:
Reaktion von CH3F mit OH—
Methylierung von Benzol
Chlorierung von Methan
Radikale sind so reaktiv, dass sie am C-Atom jeder
organischen Verbindung angreifen können.
Nucleophil
Teilchen mit negativer
Ladung oder negativer
Partialladung
Cl—-Ion,
O-Atom im Wasser
Nucleophile Teilchen greifen den Reaktionspartner an Zentren positiver Ladung an,
z. B. am C-Atom eines Carbenium-Ions.
Elektrophil
Teilchen mit positiver
Ladung oder positiver
Partialladung
Br+-Ion, CH3Br
Elektrophile Teilchen greifen den Reaktionspartner an
Zentren negativer Ladung an, z. B. an den -Elektronen
von Doppelbindungen oder von Benzol.
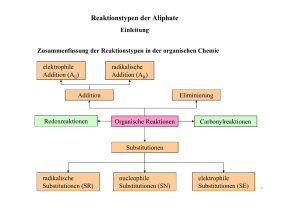
11.4.2 Überblick über Reaktionstypen
CH3
2
H2CI + ?CH3
2
2 2
?CH3 + CI2CI
2 2
2
H2CI + ?CH3
2
2
2
2
2
2 2
2
2
2—
+ CI
2
2
2
2
C5C
2
2 CI?
2
2
CI? + CH4
2
2
H
CH3
2
2
+
2
2
→ H3O+ +
2
2
2
2—
H2O2C2
+2
F
2
Licht
2
{2
2C2CI
2
2
Beispiel
Aus einem protonierten Alkohol-Molekül
H
bildet sich unter Wasserabspaltung ein CarbeC2C {
H
nium-Ion, das unter Abspaltung eines Protons
+ O2H →
O {H { +
eine Doppelbindung ausbildet.
H
C2C
H
2 2
CI2CI
2 2
δ—
2
2
Reaktionsverlauf
2
2C2F
2
δ+
δ—
2
2—
H2O
2
Eliminierung: Aus gesättigten Molekülen werden Atome abgespalten, sodass ungesättigte Verbindungen entstehen.
δ+
2
Halogen-Atome
2
Teilchen mit einem
ungepaarten Elektron
radikalische Substitution
2
Radikal
2 2
Angriffsort
elektrophile Substitution
2
Beispiele
2 2 2 2
angreifendes Kennzeichen
Teilchen
Oxonium-Ion
Carbenium-Ion
H+
Alken
Addition: Atome oder Atomgruppen werden an organische Moleküle mit Mehrfachbindung (ungesättigte Verbindungen) angelagert. Dabei werden Einfachbindungen gebildet, aus -Bindungen werden σ-Bindungen.
Einteilung nach Art
des angreifenden
Teilchens
Elektrophile Addition
Angriffsort
an C5C-Doppelbindungen in Alkenen und
an C;C-Dreifachbindungen in Alkinen
an die C5O-Doppelbindung der Carbonyl-Gruppe.
Reaktionsweise
Durch Anlagerung des Elektrophils an die
-Bindung entsteht ein Carbenium-Ion.
Dieses stabilisiert sich durch die Anlagerung
eines nucleophilen Teilchens
Der nucleophile Angriff erfolgt an das positivierte
C-Atom der Carbonyl-Gruppe, welches in Gegenwart von H+-Ionen ein Carbenium-Ion bildet. Die
Stabilisierung erfolgt oft in einem zweiten Schritt
durch intramolekulare Protonenwanderung
Addition von HCl an Ethen
Addition von NH3 an Ethanal
2
2
δ—
2
+ O2H
δ+ O
+
H
→
H3C2C
H3C2C
H
H
2
OH
2
O2H
+
+
→
H3C2C
+ NH3
H3C2C2NH3
H
H
OH
OH
2 2
+
H3C2C2NH3
H
2 2
2
2 2
2 2
22 2
2
2 2
2
2
2
2
+ CI
2
H CI
2
Radikalische
Substitutuion
Elektrophile
Addition
reagieren z.B.
mit Halogenen
reagieren z.B.
mit Halogenen
Alkane
Alkene u. Alkine
reagieren
unter
reagieren
unter
reagieren unter
Einfluss eines
Energiezufuhr
Homolyse
Heterolyse
Katalysators
Heterolyse
Elektrophile
Substitution
Nucleophile
Substitution
reagieren z.B.
mit Halogenen
reagiert mit
anorganischer
Säure
Aromaten (Benzol) Alkohol
2
δ—
+
2
CI
2
H
2
2
H2
δ+
5
→ 2C2C2 → 2C2C2
2
2
2
2
C5C
2
2
Beispiel
typische Reaktonsmechanismen
in der organischen Chemie
Nucleophile Addition
sind
2
120
H3C2C2NH2
H+
H
Abb. 11.15: Übersicht: typische Reaktionsmechanismen
Nucleophile
Addition
Eliminierung
reagiert mit polaren spaltet Wasser ab
Molekülen
Carbonylgruppe
Ethanol
Veresterung
reagiert mit Alkohol
Carbonsäure
121