Diagnostik bei Kindern mit primärer Mikrozephalie
Werbung
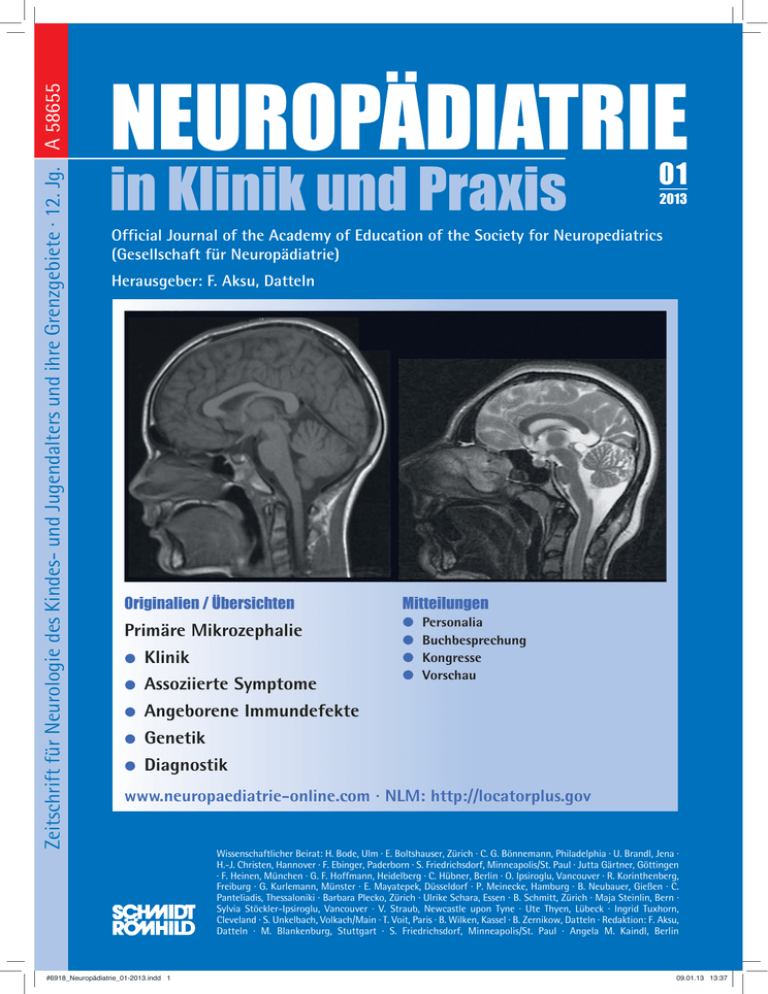
Zeitschrift für Neurologie des Kindes- und Jugendalters und ihre Grenzgebiete · 12. Jg. A 58655 01 2013 Official Journal of the Academy of Education of the Society for Neuropediatrics (Gesellschaft für Neuropädiatrie) Herausgeber: F. Aksu, Datteln Originalien / Übersichten Primäre Mikrozephalie Klinik Assoziierte Symptome Angeborene Immundefekte Genetik Diagnostik Mitteilungen Personalia Buchbesprechung Kongresse Vorschau www.neuropaediatrie-online.com · NLM: http://locatorplus.gov Wissenschaftlicher Beirat: H. Bode, Ulm · E. Boltshauser, Zürich · C. G. Bönnemann, Philadelphia · U. Brandl, Jena · H.-J. Christen, Hannover · F. Ebinger, Paderborn · S. Friedrichsdorf, Minneapolis/St. Paul · Jutta Gärtner, Göttingen · F. Heinen, München · G. F. Hoffmann, Heidelberg · C. Hübner, Berlin · O. Ipsiroglu, Vancouver · R. Korinthenberg, Freiburg · G. Kurlemann, Münster · E. Mayatepek, Düsseldorf · P. Meinecke, Hamburg · B. Neubauer, Gießen · C. Panteliadis, Thessaloniki · Barbara Plecko, Zürich · Ulrike Schara, Essen · B. Schmitt, Zürich · Maja Steinlin, Bern · Sylvia Stöckler-Ipsiroglu, Vancouver · V. Straub, Newcastle upon Tyne · Ute Thyen, Lübeck · Ingrid Tuxhorn, Cleveland · S. Unkelbach, Volkach/Main · T. Voit, Paris · B. Wilken, Kassel · B. Zernikow, Datteln · Redaktion: F. Aksu, Datteln · M. Blankenburg, Stuttgart · S. Friedrichsdorf, Minneapolis/St. Paul · Angela M. Kaindl, Berlin #6918_Neuropädiatrie_01-2013.indd 1 09.01.13 13:37 %JFFSTUFVOEFJO[JHF[JFMHFSJDIUFUF5IFSBQJF 7056#*"−#FJ5VCFSÚTFS4LMFSPTF BTTP[JJFSUNJUTVCFQFOEZNBMFN 3JFTFO[FMMBTUSP[ZUPN54$4&(" FOGàSFSXBDITFOF +FU[UOFV[VHFMBTT .- 1BUJFOUFONJU54$" t%FVUMJDIFTDIOFMMFVOEBOIBMUFOEF 3FEVLUJPOEFT5VNPSWPMVNFOT1 t6STBDIFOPSJFOUJFSUF5IFSBQJFEVSDI TQF[JGJTDIF)FNNVOHWPON5031 tÃCFS[FVHFOEFT4JDIFSIFJUTQSPGJM1 * SEGA: Patienten ab 3 Jahren, die eine therapeutische Maßnahme benötigen, für die aber ein chirurgischer Eingriff nicht angemessen ist. ** AML: Erwachsene Patienten, bei denen ein Komplikationsrisiko vorliegt (aufgrund von Faktoren wie Tumorgröße, vorhandenes Aneurysma oder multiplen bzw. beidseitigen Tumoren), die jedoch nicht gleich operiert werden müssen. 1 Fachinformation Votubia, Oktober 2012. 7PUVCJB®NHNHNH5BCMFUUFO8JSLTUPGG Everolimus. ;VT Jede Tablette enth.: Arzneilich wirksamer Bestandt.: 2,5 mg/5 mg/10 mg Everolimus. Sonst. Bestandt.: Butylhydroxytoluol, Magnesiumstearat, Lactose-Monohydrat, Hypromellose, Crospovidon Typ A, Lactose. "OX Erwachsene Patienten mit renalem Angiomyolipom assoziiert mit einer tuberösen Sklerose (TSC), bei denen ein Risiko für Komplikationen vorliegt (aufgrund von Faktoren wie Tumorgröße oder vorhandenem Aneurysma oder multiplen bzw. beidseitigen Tumoren), die jedoch nicht unmittelbar operiert werden müssen. Patienten ab 3 Jahren mit subependymalem Riesenzellastrozytom (SEGA) aufgrund einer tuberösen Sklerose (TSC), die eine therapeutische Maßnahme benötigen, für die aber ein chirurgischer Eingriff nicht angemessen ist. (FHFOBO[ Überempfindlichkeit gegen den Wirkstoff, andere Rapamycin-Derivate oder einen der sonstigen Bestandt. /FCFOX Sehr häufig: Infektionen (inkl. Infektionen der oberen Atemwege, Sinusitis, Otitis media, Nasopharyngitis sowie ein Fall von Herpes zoster), Hypercholesterinämie, Stomatitis (inkl. Mundulzera, aphthöse Stomatitis, Zahnfleischschmerzen, Glossitis und Lippenulzera). Häufig: Thrombozytopenie, Anämie, Leukopenie, Neutropenie, Krampfanfälle, Hypertriglyzeridämie, Hyperlipidämie, Hypophosphatämie, verminderter Appetit, Kopfschmerzen, Dysgeusie, Konjunktivitis, Hypertonie, Blutungen, Husten, Gastritis, Durchfall, Erbrechen, Übelkeit, Gingivitis, abdominale Schmerzen, Blähungen, Obstipation, Hautausschlag (inkl. Erythem, erythematöser Hautaus schlag, makulärer Hautausschlag, makulopapulöser Hautausschlag und generalisierter Hautausschlag), Akne, akneförmige Dermatitis, Hauttrockenheit, Pruritus, Alopezie, Proteinurie, Amenorrhoe, Anstieg des luteinisierenden Hormons, unregelmäßige Menstruation, verzögerte Menstruation, Menorrhagie, Vaginalblutungen, Ovarialzysten, Müdigkeit, Pyrexie, Reizbarkeit, Laktatdehydrogenase im Blut erhöht, Gewichtsverlust. Gelegentl.: Hypersensibilität, Schlaflosigkeit, Unruhe, Aggression, Pneumonitis (inkl. interstitielle Lungenerkrankung, Lungeninfiltration, pulmonal-alveoläre Blutung, Lungentoxizität und Alveolitis), Angioödem, Rhabdomyolyse, Gangstörung. Weitere Nebenwirkungen unter Everolimus: Hepatitis-B-Reaktivierung (auch mit tödl. Ausgang), Nierenversagen (einschl. letalem Ausgang), Erhöhung des Serumkreatinins, Herzinsuffizienz, Lungenembolie, tiefe Venenthrombose, Wundheilungsstörungen, Hyperglykämie. 8BSOIJOXFJT Enthält Lactose. 8FJUFSF"OHBCFOSiehe Fachinfo. 7FSTDISFJCVOHTQþJDIUJH4UBOEOktober 2012 (MS 10/12.4) /PWBSUJT1IBSNB(NC)3PPOTUS/àSOCFSH Tel.: (09 11) 273-0, Fax: (09 11) 273-12 653. www.novartis.de #6918_Neuropädiatrie_01-2013.indd 2 09.01.13 13:37 Zeitschrift für Neurologie des Kindes- und Jugendalters und ihre Grenzgebiete Offizielles Organ der Fortbildungsakademie der Gesellschaft für Neuropädiatrie e. V. Heft 1/2013 Impressum Herausgeber: F. Aksu, Datteln Redaktion: F. Aksu (verantwortlich) · M. Blankenburg, Datteln · S. Friedrichsdorf, Minneapolis/St. Paul · Angela M. Kaindl, Berlin Inhalt · Contents Editorial · Editorial Primäre Mikrozephalie Primary microcephaly A. M. Kaindl ........................................................................................... 4 Originalien/Übersichten · Original/Review articles Primäre autosomal-rezessive Mikrozephalie (MCPH) Autosomal recessive primary microcephaly (MCPH) N. Krämer, D. J. Morris-Rosendahl, A. M. Kaindl ....................... 5 Wissenschaftlicher Beirat: H. Bode, Ulm · E. Boltshauser, Zürich · C. G. Bönnemann, Philadelphia · U. Brandl, Jena · H.-J. Christen, Hannover · F. Ebinger, Paderborn · S. Friedrichsdorf, Minneapolis/ St. Paul · Jutta Gärtner, Göttingen · F. Heinen, München · G. F. Hoffmann, Heidelberg · C. Hübner, Berlin · O. Ipsiroglu, Vancouver · R. Korinthenberg, Freiburg · G. Kurlemann, Münster · E. Mayatepek, Düsseldorf · P. Meinecke, Hamburg · B. Neubauer, Gießen · C. Panteliadis, Thessaloniki · Barbara Plecko, Graz · Ulrike Schara, Essen · B. Schmitt, Zürich · Maja Steinlin, Bern · Sylvia Stöckler-Ipsiroglu, Vancouver · V. Straub, Newcastle upon Tyne · Ute Thyen, Lübeck · Ingrid Tuxhorn, Cleveland · S. Unkelbach, Volkach/ Main · T. Voit, Paris · B. Wilken, Kassel · B. Zernikow, Datteln Layout: Atelier Schmidt-Römhild Primäre Mikrozephalie und assoziierte Syndrome Primary microcephaly and associated syndromes D. Wieczorek ....................................................................................... 13 Mikrozephalie und angeborene Immundefekte Diagnostik bei Kindern mit primärer Mikrozephalie Anschrift von Verlag und Anzeigenverwaltung: Max Schmidt-Römhild KG, Hausadresse: Mengstraße 16, 23552 Lübeck, Großkundenadresse: 23547 Lübeck, Telefon: 0451/7031-01 Fax 0451/7031-253, E-mail: [email protected] Diagnosis in children with primary microcephaly Erscheinungsweise: 4x jährlich Januar, April, Juli, Oktober D. Wieczorek, H. von Bernuth, J. B. Hennermann, R. John, C. Bührer, A. M. Kaindl...................................................... 38 Bezugsmöglichkeiten: Einzelheft € 12,– zzgl. Versandkosten; Jahresabonnement € 46,– zzgl. Versandkosten (€ 3,– Inland, € 6,50 Ausland) Microcephaly and primary immunodeficiency S. Kenzel, K. Eirich, D. Schindler, H. v. Bernuth ........................ 20 Moderne genetische Methoden zur Untersuchung von Patienten mit Mikrozephalie Anzeigenpreisliste: Nr. 1 vom 1. Dezember 2001 R. Abou Jamra .................................................................................... 51 Namentlich gekennzeichnete Beiträge brauchen sich nicht unbedingt mit der Meinung des Herausgebers und der Redaktion zu decken. Mitteilungen · Communications Für unverlangt eingesandte Beiträge und Fotos lehnt der Verlag die Verantwortung ab. Current genetic investigation methods in microcephaly patients Titelbild: Faziale Dysmorphien und MRT-Befunde von Patienten mit Seckel-Syndrom und CEP152-Mutationen, (D. Wieczorek, 2013) Anschrift der Redaktion: Redaktion Neuropädiatrie, Vestische Kinderund Jugendklinik Datteln, Postfach 1351, D-45704 Datteln, Telefon 02363/975 230, Fax 02363/975 393, E-mail: [email protected] Personalia · Personalia .................................................................. 58 Buchbesprechung · Book review ............................................... 58 Kongresse · Congress announcements ................................... 58 Vorschau · Preview .......................................................................... 59 www.neuropaediatrie-online.com © 2013 Die Zeitschrift und alle in ihr enthaltenen Beiträge und Abbildungen sind urheberrechtlich geschützt. Jede Verwertung außerhalb der engen Grenzen des Urheberrechtsgesetzes ist ohne Zustimmung des Verlages unzulässig und strafbar. Das gilt insbesondere für Vervielfältigungen, Übersetzungen, Mikroverfilmung und die Einspeicherung und Bearbeitung in elektronischen Systemen. ISSN 1619-3873 Neuropädiatrie in Klinik und Praxis 12. Jg. (2013) Nr. 1 3 #6918_Neuropädiatrie_01-2013.indd 3 09.01.13 13:37 Editorial Primäre Mikrozephalien Die vorliegende Ausgabe von „Neuropädiatrie in Klinik und Praxis“ befasst sich mit dem Schwerpunktthema „Primäre Mikrozephalie“ und greift damit ein Symposium-Thema der letzten Tagung der Gesellschaft für Neuropädiatrie in Münster auf. Mikrozephalie bezeichnet das klinische Zeichen eines signifikant reduzierten Kopfumfangs. Liegt eine Mikrozephalie bereits bei Geburt vor, so bezeichnet man diese als kongenital oder primär. Eine solche primäre Mikrozephalie tritt bei über 400 verschiedenen Krankheitsentitäten und weltweit mit einer Inzidenz von 1 bis 150 pro 100.000 Lebendgeburten auf. Verbesserungen der Diagnostik und des Verständnisses der Pathogenese haben in den vergangenen Jahren zu einer deutlichen Zunahme bekannter Mikrozephalie-Erkrankungen geführt. Auch werden zunehmend klinische und genetische Heterogenität sowie Phänotyp-Überschneidungen bei verschiedenen genetisch-bedingten Mikrozephalien offensichtlich. In den nachfolgenden Übersichtsarbeiten präsentieren wir einen kleinen Ausschnitt dieses umfassenden, klinisch und wissenschaftlich relevanten The- mengebiets der Neuropädiatrie. Wir stellen als Prototyp einer ‚isoliert’ auftretenden kongenitalen Mikrozephalie die Primäre autosomal-rezessive Mikrozephalie im Beitrag von Frau Dr. Krämer (Kinderneurologie und Institut für Zell- und Neurobiologie, Charité – Universitätsmedizin Berlin) und Koautoren vor. Diese Form der Mikrozephalie weißt sowohl im Bezug auf ihre Klinik als auch ihre genetischen Ursachen Überschneidungen mit Krankheitsentitäten auf, die durch Kombination von Mikrozephalie und Kleinwuchs geprägt sind. Insbesondere auf das Seckel-Syndrom und den mikrozephalen osteodysplastischen primordialen Kleinwuchs geht Frau Prof. Wieczorek (Humangenetik, Universität Essen) in ihrem Beitrag „Primäre Mikrozephalie und assoziierte Syndrome“ ein. Ursachen einer primären Mikrozephalie, zu denen auch DNA-Reparaturdefekte und Stammzell-Proliferationsdefekte gehören, können sich mit denen von Immundefekten überschneiden. Somit ist bei Patienten mit Mikrozephalie die aufmerksame Suche nach einem Immundefekt indiziert. Die gezielte Überprüfung des Immunsystems und dabei insbesondere der Chromosomeninstabilität kann entscheidende Hinweise auf die genetische Ursache der Mikrozephalie liefern. Frau Dr. Kenzel (Pädiatrische Pneumologie und Immunologie, Charité – Universitätsmedizin Berlin) und Koautoren stellen in ihrem Beitrag entsprechende Erkrankungen vor. Für die Diagnostik der primären Mikrozephalie stehen mehrere, zum Teil kostenintensive und für das betroffene Kind sowie seine Familie belastende Untersuchungsmethoden zur Verfügung. Wir stellen in unserem Beitrag „Diagnostik bei Kindern mit primärer Mikrozephalie“ aus Sicht verschiedener Spezialgebiete der Pädiatrie und der Humangenetik einen Vorschlag zur diagnostischen Herangehensweise an ein Kind mit primärer Mikrozephalie vor. Die Thematik wird abgerundet durch eine Übersicht von Herrn PD Dr. Abou Jamra (Humangenetik, Universität Erlangen-Nürnberg) über moderne genetische Methoden zur Untersuchung von Patienten mit Mikrozephalie. PD Dr. Angela M. Kaindl Klinik für Pädiatrie mit Schwerpunkt Neurologie und Institut für Zellund Neurobiologie Charité – Universitätsmedizin Berlin 4 Neuropädiatrie in Klinik und Praxis 12. Jg. (2013) Nr. 1 #6918_Neuropädiatrie_01-2013.indd 4 09.01.13 13:37 Originalien/Übersichten Primäre autosomal-rezessive Mikrozephalie (MCPH) N. KRÄMER1, 2, D. J. MORRIS-ROSENDAHL3, A. M. KAINDL1-2, 4* 1 Klinik für Pädiatrie mit Schwerpunkt Neurologie, Charité – Universitätsmedizin Berlin, Campus Virchow-Klinikum, Augustenburger Platz 1, 13353 Berlin 2 Institut für Zell- und Neurobiologie, Charité – Universitätsmedizin Berlin, Campus Mitte, Charitéplatz 1, 10115 Berlin 3 Institut für Humangenetik der Universitätsklinik Freiburg, Breisacherstr. 33, 79106 Freiburg 4 SPZ Neuropädiatrie, Charité – Universitätsmedizin Berlin, Campus Virchow-Klinikum, Augustenburger Platz 1, 13353 Berlin Zusammenfassung Abstract Einleitung Mikrozephalie ist ein häufiges, bei circa 2-3% der Bevölkerung auftretendes klinisches Symptom, welches oftmals mit einer geistigen Behinderung einhergeht. Der Prototyp einer isolierten Mikrozephalie, die primäre autosomal-rezessive Mikrozephalie (MCPH), ist eine genetisch heterogene Erkrankung und wird klassischerweise definiert durch das Vorliegen einer schweren, nicht progredienten Mikrozephalie bei Geburt, einer weitgehend normalen Hirnarchitektur, einer mentalen Retardierung und dem Fehlen weiterer neurologischer Befunde oder schwerer Fehlbildungen. Bei der MCPH ist die Mikrozephalie auf eine Volumenreduktion des Gehirns zurückzuführen, welche insbesondere den zerebralen Kortex und damit die graue Substanz betrifft. Als genetische Ursachen der MCPH wurden bislang Mutationen in den neun Genen MCPH1 (MCPH1), WDR62 (MCPH2), CDK5RAP2 (MCPH3), CEP152 (MCPH4), ASPM (MCPH5), CENPJ (MCPH6), STIL (MCPH7), CEP135 (MCPH8) und CASC5 sowie die Kopplung zu dem Genlokus 10q11.23-21.3 identifiziert. In dem vorliegenden Artikel werden eine Übersicht über den aktuellen Kenntnisstand der MCPH gegeben und mögliche Differentialdiagnosen aufgeführt. Microcephaly is a frequent clinical sign affecting about 2-3% of the population and is often associated with intellectual disability. Autosomal recessive primary microcephaly (MCPH), the prototype of isolated microcephaly, is a genetically heterogeneous disorder in which patients typically exhibit severe, non-progressive microcephaly at birth, a grossly normal brain architecture, variable degrees of intellectual disability, but usually no further neurological findings, gross malformations or dysmorphy. Their microcephaly is a consequence of reduced brain volume, which is evident particularly within the cerebral cortex and thus results to a large part from a reduction in grey matter. Genetic causes of MCPH subtypes include mutations in the nine genes: MCPH1 (MCPH1), WDR62 (MCPH2), CDK5RAP2 (MCPH3), CEP152 (MCPH4), ASPM (MCPH5), CENPJ (MCPH6), STIL (MCPH7), CEP135 (MCPH8) and CASC5 as well as linkage to the locus 10q11.23-21.3. Here, we provide a timely overview of current knowledge on MCPH and differential diagnosis. Mikrozephalie bezeichnet das klinische Symptom eines verkleinerten fronto-occipitalen Kopfumfangs von mindestens 2-3 Standardabweichungen unter dem altersund geschlechtsbezogenen Mittelwert (oder < 3. Perzentile) und geht mit einer Verringerung des Hirnvolumens sowie meist mit einer mentalen Retardierung einher. Eine Mikrozephalie kann genetisch bedingt sein oder durch Umwelteinflüsse wie Alkohol, Drogen oder Infektionen entstehen und wird je nach Zeitpunkt des Auftretens in eine primäre (kongenitale) oder sekundäre (postnatale) Form unterteilt (1, 2). Die Inzidenz einer primären Mikrozephalie liegt nach weltweiten Geburtsregistern zwischen 1,3 und 150 pro 100,000 Lebendgeburten, abhängig von der jeweiligen Population und der Mikrozephalie-Definition (Quelle: International Clearinghouse for Birth Defects Surveillance and Research, 2006 report; http:// www.icbdsr.org/). Die Inzidenz der primären, nicht-syndromalen Mikrozephalien beträgt circa 1:30,000 bis 1:250,000 Lebendgeburten (3). Als Sonderform einer kongenitalen Mikrozephalie prägte der italienische Arzt Carlo Giacomini im 19. Jahrhundert den Begriff microcephalia vera, um eine Gruppe von Betroffenen abzugrenzen, bei denen, abgesehen von einer Mikrozephalie, keine weiteren pathologischen Veränderungen beobachtet wurden (4). Dieser historische Begriff, der die Ätiologie primärer Mikrozephalien unberücksichtigt lässt, wird heute nur noch selten für Patienten mit nicht-syndromalen, autosomal-rezessiven Mikrozephalien ohne Keywords primary microcephaly – MCPH – intellectual disability – centrosome Schlüsselwörter Primäre Mikrozephalie – MCPH – geistige Behinderung – Zentrosom Autosomal recessive primary microcephaly (MCPH) Bibliography Neuropaediatrie 2013; 12: 5-12, © Schmidt-Roemhild-Verlag, Luebeck, Germany: ISSN 1619-3873; NLM ID 101166293; OCoLc 53801270 Neuropädiatrie in Klinik und Praxis 12. Jg. (2013) Nr. 1 5 #6918_Neuropädiatrie_01-2013.indd 5 09.01.13 13:37 Originalien/Übersichten Pachygyrie oder Lissenzephalie verwendet. Eingang gefunden hat die Erkrankungsentität der primär autosomal-rezessiven Mikrozephalie (MCPH; MicroCephaly Primary Hereditary). Die MCPH ist eine seltene Sonderform einer genetischen, kongenitalen Mikrozephalie, die auf Grund der isoliert auftretenden Mikrozephalie auch als Prototyp einer solchen angesehen wird und deshalb im letzten Jahrzehnt in das Zentrum des Forschungsinteresses vieler Kliniker und Grundlagenforscher gerückt ist. In dem vorliegenden Artikel wird eine Übersicht über den aktuellen Kenntnisstand der MCPH gegeben. Klinik der MCPH Die MCPH wird klassischerweise durch das Vorliegen einer schweren, nicht progredienten Mikrozephalie bei Geburt, einer weitgehend normalen Hirnarchitektur, einer mentalen Retardierung und dem Fehlen weiterer neurologischer Befunde oder schwerer Fehlbildungen definiert (Tab. 1; Abb. 1). Bisher wurden annähernd 300 Familien und einzelne Patienten mit MCPH weltweit publiziert, wobei es wenige detaillierte klinische Beschreibungen gibt. Allerdings weisen diese wenigen darauf hin, dass der Phänotyp breiter ist als in der klassischen Definition berücksichtigt wurde. Die unterschiedlichen MCPH-Subtypen können allein aufgrund der Klinik kaum voneinander unterschieden werden. Ausnahmen bilden MCPH1 und MCPH5, bei denen im Gegensatz zu den anderen Unterformen ein Kleinwuchs beschrieben wurde, und MCPH2, bei der auch unterschiedliche kortikale Fehlbildungen vorkommen können (5-7). Das Vorliegen einer Mikrozephalie ist bei Patienten mit MCPH bereits in utero um die 24. Schwangerschaftswoche (SSW) mittels Ultraschall erkennbar (8, 9), und die Gyrierung des fetalen Gehirns kann auch mittels Magnetresonanztomographie (MRT) im dritten Schwangerschaftstrimester beurteilt werden. Betroffene zeigen meist bereits bei Geburt eine schwere Mikrozephalie mit einem Kopfumfang deutlich unterhalb der dritten Perzentile bzw. unterhalb der -3. Standardabweichung (SD). Einzelne Autoren beschrieben allerdings einen Kopfumfang oberhalb der -3. SD bei Geburt, der innerhalb des ersten Lebensjahrs auf Werte unterhalb der -3. SD abfiel (10), entsprechend der Entwicklung einer „sekundären Mikrozephalie“ im ersten Lebensjahr (11). Somit stellt eine postnatale weitere Perzentilenflucht des Kopfumfangs kein Ausschlusskriterium für das Vorliegen einer MCPH dar. Die Entwicklung der Kinder ist im ersten Lebenshalbjahr meist unauffällig (12), Abb. 1: Klinischer Phänotyp der MCPH. (A) Fotos eines 17-monatigen Mädchens mit Mutationen im WDR62-Gen (MCPH2). Auffallend ist neben einer Mikrozephalie eine abgeflachte Stirn. Typischer Entwicklung des Kopfumfanges (B) bei einem Jungen und (C) bei einem Mädchen, jeweils mit Mutationen im ASPM-Gen (MCPH5) Hauptkriterien • Mikrozephalie bei Geburt weitere Reduktion des relativen Kopfumfangs im 1. Lebensjahr möglich • Volumenreduktion insbesondere des zerebralen Kortex • vereinfachte kortikale Gyrierung • milde bis schwere mentale Retardierung (aber: normaler IQ möglich) inkonsistente klinische Befunde • neurologische/neuropsychologische Befunde: – verzögertes Erreichen der Meilensteine – Sprachentwicklungsverzögerung – Aufmerksamkeits- und Hyperaktivitätsstörung – Aggressivität – Schlafstörung – Epilepsie – Pyramidenbahnzeichen • weitere intrakranielle Malformationen: – Agenesie/Hypoplasie des Corpus callosum – fokale Dysplasien – fokale Mikrogyrien – perisylvanische Polymicrogyrie – dysmorphe oder vergößerte Seitenventrikel – große Hypophyse – Reduktion der weißen Substanz – infratentorielle Anomalien (Hirnstamm/zerebelläre Hypoplasie) • endokrinologische Befunde: – Kleinwuchs – prämature Pubertät • extrakranielle Malformationen: – Syndaktylie – Nierenagenesie – multizystische Nieren • Weiteres: – prämature Chromosomenkondensation (MCPH1) – bislang kein erhöhtes Tumorrisiko beschrieben Tab. 1: Übersicht über MCPH-Phänotyp; in Anlehnung an (12) 6 Neuropädiatrie in Klinik und Praxis 12. Jg. (2013) Nr. 1 #6918_Neuropädiatrie_01-2013.indd 6 09.01.13 13:37 Originalien/Übersichten Bezug auf das Ausmaß der Mikrozephalie und der mentalen Retardierung. Untypisch für Patienten mit MCPH sind schwere neurologische Auffälligkeiten wie eine schwere motorische Entwicklungsstörung, aber Patienten haben typischerweise eine Sprachentwicklungsstörung und können eine Aufmerksamkeits- und Hyperaktivitätsstörung und/oder Verhaltensauffälligkeiten aufweisen (11). Darüber hinaus wurde bei einigen Patienten eine gut behandelbare Epilepsie beschrieben (10, 12, 13). Es fehlen Dysmorphien oder Malformation außer einer fazialen Dysmorphie durch eine schmale fliehende Stirn. In seltenen Fällen besteht ein geringer Kleinwuchs (Größe zwischen -2 und -3 SD, vorwiegend bei MCPH1 und MCPH5) (10, 13, 14). Bislang wurde bei Patienten kein eindeutig erhöhtes Tumorrisiko beschrieben. Abb. 2: Radiologischer Phänotyp der MCPH. Darstellung von cMRT-Befunden (A-D) eines gesunden 9-jährigen Jungen und (E-L) zweier Patienten mit Mutationen im ASPM-Gen (MCPH5). Zu beachten ist die deutliche Reduktion des Gehirnvolumens (z. B. Vergleich H zu D), ein schmaleres Corpus callosum (G) und eine leichte Kleinhirnwurmhypoplasie (G und L) bei sonst unauffälligen Hirnstrukturen kann aber von einem leicht verzögerten Erreichen der motorischen Meilensteine gefolgt werden. Später fällt eine mentale Retardierung unterschiedlichen Schweregrads auf (IQ meist zwischen 30 und 80) (12). Es besteht keine lineare Korrelation zwischen der Ausprägung der Mikrozephalie und dem Ausmaß der mentalen Retardierung, allerdings weisen Patienten mit einer sehr schweren Mikrozephalie mit einem Kopfumfang unter der -10. SD auch eher eine schwere mentale Retardierung auf. Es gibt eine gewisse intrafamilliäre Variabilität in Radiologische Befunde bei MCPH Ausführliche Beschreibungen der Befunde bildgebender Verfahren bei Patienten mit MCPH gibt es nur wenige. Sie halfen allerdings darzustellen, dass die Mikrozephalie bei Patienten mit MCPH auf eine Volumenreduktion des Gehirns zurückzuführen ist, welche insbesondere den zerebralen Kortex und damit die graue Substanz betrifft (Abb. 2) (15). Zudem wird häufig eine verplumpte Gyrierung (‚simplified gyration’) des Neokortex beschrieben. Entgegen der klassischen radiologischen Befundkonstellation weisen einzelne Patienten mit MCPH neueren Berichten zufolge auch periventrikuläre Heterotopien, kortikale Dysplasien, Polymikrogyrien, Agenesien oder Hypogene des Corpus callosum, erweiterte Seitenventrikel und/oder infratentorielle Anomalien wie Hirnstamm- oder Kleinhirnhypoplasien auf (5, 7, 10, 16, 17). Auch die radiologischen Befunde erlauben kaum ein Differenzierung zwischen den MCPHUnterformen. Laborbefunde bei Patienten mit MCPH Abb. 3: Auffälligkeiten bei Chromosomenpräperationen von MCPH-Patienten. Prophase-ähnliche Zellen (Pfeile) in Chromosomenpräparaten aus Lymphozyten eines Patienten mit Mutationen im MCPH1-Gen (geschlossene Pfeile). Sogar die Metaphase-Chromosomen (offener Pfeil) sind viel kürzer als normal (Bild von Herrn Dr. M. Trimborn, Institut für Medizinische Genetik, Charité - Universitätsmedizin Berlin) Es gibt keine für die MCPH typischen Laborbefunde. Allerdings tritt oft bei Patienten mit MCPH1 ein erhöhter Anteil prophase-ähnlicher Zellen in Chromosomenpräparaten aus Lymphozyten und Fibroblasten auf (circa 4-10% statt ca. 1% bei Gesunden). Diese entstehen auf der Grundlage von Zellzyklusstörungen, die sich auch in einer vorzeitigen Chromosomenkondensation (‚premature chromosome condensation’) äußern (14, 17) (Abb. 3). Letzteres ist bei der Karyotypisierung Neuropädiatrie in Klinik und Praxis 12. Jg. (2013) Nr. 1 7 #6918_Neuropädiatrie_01-2013.indd 7 09.01.13 13:37 Originalien/Übersichten daran zu erkennen, dass keine ausreichende Darstellung des Bandenstatus eines Patienten gelingt. Genetische Ursachen der MCPH Als genetische Ursachen der MCPH wurden bislang Mutationen in den neun Genen identifiziert, die für folgende Proteine kodieren (Tab. 2; Abb. 4): Microcephalin [MCPH1; (14, 17)], WD-repeatcontaining-protein-62 [WDR62; MCPH2; (7, 18)], Cyclin-dependent-kinase-5-regulatory subunit-associated-protein-2 [CDK5RAP2; MCPH3; (19, 20)], Centrosomal-protein-150 kD [CEP152; MCPH4; (21, 22)], Abnormal-spindle-like-microcephaly-associated-protein [ASPM; MCPH5; (23-25)], Centromeric-protein-J [CENPJ; MCPH6; (20, 26)], SCL/TAL1-interruptinglocus [STIL; MCPH7; (27)], Centrosomalprotein-135-kDa [CEP135; MCPH8; (28)] und Cancer-susceptibility-candidate-5 [CASC5; (29)]. Mittels Kopplungsanalysen wurde zudem kürzlich der weitere MCPHGenlokus 10q11.23-21.3 (30) beschrieben. Am häufigsten wurden Mutationen im ASPM-Gen beschrieben (ca. 205 der bisher 299 beschrieben Familien, entsprechend ca. 68,6% aller MCPH-Fälle), gefolgt von Mutationen im WDR62-Gen (ca. 14,1%; 42 von 299 Familien) und MCPH1-Gen (ca. 8%; 24 von 299 Familien). Sehr viel seltener sind Mutationen in den Genen CDK5RAP2 (4 Familien), CEP152 (6 Familien), CENPJ (10 Familien), STIL (4 Familien), CEP135 (1 Familie) und CASC5 (3 Familien) beschrieben, dies kann bei einzelnen Genen aber auch an der erst vor wenigen Monaten bis Jahren zurückliegenden Erstbeschreibung liegen. Sehr wahrscheinlich besteht eine weitere genetische Heterogenität, da nach unserer Erfahrung bei circa 20-40% der Familien mit dem Phänotyp Abb. 4: Häufigkeitsverteilung bisher beschriebener MCPH-Gen-Mutationen. Insgesamt wurden bisher ca. 299 Familien mit MCPH-Gen-Mutationen beschrieben: Hierzu zählen insbesondere Mutationen in den Genen ASPM (205/299; 68,6%), WDR62 (42/299; 14,1%) und MCPH1 (24/299; 8%). Sehr viel seltener (oder gerade erst neu) beschrieben wurden Mutationen in den Genen CDK5RAP2 (4/299; 1,3%), CEP152 (6/299; 2%), CENPJ (10/299; 3%), STIL (4/299; 1,3%), CEP153 (1/299; 0,3%) und CASC5 (3/299; 1%) beschrieben. einer MCPH keine Kopplung zu den bekannten Loci hergestellt bzw. keine Mutation in den MCPH Genen identifiziert werden kann (12, 15, 31). Es konnte bislang keine Phänotyp-Genotyp-Korrelation hergestellt werden. Die Diagnosestellung kann bei entsprechendem Verdacht, zum Beispiel bei positiver Familienanamnese und einer bekannten Mutation in der Familie, bereits pränatal ab der 10. SSW nach Chorionzottenbiopsie oder in der 15.-24. SSW nach Amniozentese durch eine genetische Untersuchung (Mutationsanalyse mittels Gensequenzierung, Kopplungsanalyse) erfolgen. Postnatal erfolgt bei Vorliegen einer entsprechenden Klinik die genetische Untersuchung meist aus EDTA-Blut gewonnener DNA mittels klassischer Sanger-Sequenzierung oder per Next-generation Sequenzierung (Panel-Diagnostik). Pathogenese der MCPH, ein kurzer Überblick Es gibt bisher keine Berichte über die zellulären und molekularen Konsequenzen von MCPH-Genmutationen im Menschen, sodass über einen gemeinsamen zur Mikrozephalie führenden Mechanismus auf Modellorganismen und Zellkulturen zurückgegriffen werden muss. Die MCPH-Genprodukte sind vorwiegend am Zentrosom bzw. im Bereich des Spindelapparats lokalisert [siehe Info-Box 1, Abb. 5; (12)]. Sie spielen eine wichtige MCPH Protein Gen Chromosom OMIM Ref. MCPH1 Microcephalin MCPH1 8p23 251200 (14, 17) MCPH2 WD repeat containing-protein 62 WDR62 19q13.12 604317 (7, 18) MCPH3 Cyclin dependent kinase 5 regulatory subunit-associated protein 2 CDK5RAP2 9q33.3 604804 (19, 20) MCPH4 Centrosomal protein 150 kD CEP152 15q15-q21 604321 (21, 22) MCPH5 Abnormal spindle-like, microcephaly associated ASPM 1q31 608716 (23-25) MCPH6 Centromeric protein J CENPJ 13q12.2 608393 (20, 26) MCPH7 SCL/TAL1 interrupting locus STIL 1p32 612703 (27) MCPH8 Centrosomal protein 153 kDa CEP135 4q12 614673 (28) MCPH9? ? ? 10q11.23-21.3 MCPH10? Cancer susceptibility candidate 5 CASC5 15q14 (30) 609173 (29) Tab. 2: Genetische Formen der primär autosomal-rezessiven Mikrozephalie (MCPH) 8 Neuropädiatrie in Klinik und Praxis 12. Jg. (2013) Nr. 1 #6918_Neuropädiatrie_01-2013.indd 8 09.01.13 13:37 Originalien/Übersichten Rolle in der Organisation und gestörte DNA-Reparatur, verder Orientierung der mitotimehrte Apoptose und möglischen Spindeln in neuralen cherweise auch eine starker Vorläuferzellen und in der Proliferationsdefekt sich difAnordnung der Mikrotubuferenzierender Stammzellen li an Zentrosomen und an [Abb. 6 (12)]. Es bedarf weiKinetochoren während der terer experimenteller und kliMitose. Für einige MCPHnischer Studien, um die Rolle Proteine (CDK5RAP2, CENPJ, von MCPH-Proteinen in der STIL, CEP152) konnte geEntstehung einer Mirozephazeigt werden, dass sie eine lie besser zu verstehen. entscheidende Rolle bei der Duplikation und dem ZusamMCPH und Evolution menhalt von Zentriolen sowie der Reifung von ZentrosoEine der Hauptmerkmale men spielen (32-36). Viele der der Säugetierevolution ist die MCPH-Proteine spielen eine dramatische Expansion der entscheidende Rolle in der Gehirngröße, die insbesonAusrichtung des Spindelapdere mit einer Vergrößerung parates während der Zelltei- Abb. 5: Schematische Darstellung der Lokalisation von MCPH-Proteinen in des Neokortex einhergeht. In lung, und es wird angenom- einer sich teilenden Zelle. Viele MCPH-Proteine sind am Zentrosom (bzw. in diesem Zusammenhang wermen, dass dieser Prozess kri- der PCM) und im Bereich des Spindelapparats lokalisiert den die MCPH-Formen von tisch für die Entstehung der einigen Autoren als ModellMCPH-Erkrankung ist. So ist die Ausrich- trische Zellteilung oder eine vorzeitige erkrankungen angesehen bei der es durch tung der mitotischen Spindel entschei- Umschaltung auf eine asymmetrische Genmutationen zu einem Rückschritt der dend für die Festlegung, ob eine mitoti- Zellteilung während der Expansionsphase Evolution mit einer deutlichen Reduktion sche Zellteilung früh in der Neurogenese des Stammzell-Pools zu der Generierung des Gehirnvolumens auf die Größe des Gesymmetrisch oder asymmetrisch erfolgt einer geringeren Anzahl an neuralen Vor- hirns früherer Hominiden kommt (12, 15, (Abb. 6). Während eine symmetrische läuferzellen und folglich eines kleineren 38, 39). Sie gehen davor aus, dass durch Zellteilung neuraler Stammzellen eher zur Gehirns führen würde. Es sei hier erwähnt, ein Verständnis der MCPH-Pathogenese Bildung weiterer Stammzellen und damit dass die Ausrichtung des Spindelapparats auch grundlegende Erkenntnisse in Bezug zu einer Erweiterung des Stammzell-Pools nicht der einzige MCPH-Mechanismus auf die Evoltion des menschlichen Geführt, entstehen bei einer asymmetri- sein kann, da auch bei Ausbleiben dieser hirns gewonnen werden können. Es bleibt schen Zellteilung eher postmitoische Zel- zellulären Auffälligkeit in einem ASPM- allerdings nachzuweisen, ob die MCPHlen. Obgleich der genaue Mechanismus Mausmodell eine Mikrozephalie auftrat Genprodukte tatsächlich eine Rolle in der noch unklar ist, kann man sich gut vor- (37). Weitere Mechanismen, die zur Pa- andauernden Evolution des menschlichen stellen, dass eine insuffiziente symme- thogenese der MCPH beitragen sind eine Gehirns innehaben. Abb. 6: Schematische Darstellung des möglichen MCPH-Pathomechanismus Neuropädiatrie in Klinik und Praxis 12. Jg. (2013) Nr. 1 9 #6918_Neuropädiatrie_01-2013.indd 9 09.01.13 13:37 Originalien/Übersichten Abb. 7: Ein Kontinuum: MCPH, Seckel-Syndrom, MOPD2? Es besteht eine Überschneidung des Phänotyps, des Genotyps und molekularer Mechanismen von MCPH, Seckel-Syndrom und mikrozephalem osteodysplastischen primordialen Kleinwuchs (engl. ‚Microcephalic osteodysplastic primordial dwarfism’, MOPD2); Abbildung in Anlehnung an (41) Abkürzungen: siehe Tabelle 2 und: PCNT, Pericentrin; ATR, Ataxiateleangiectasia-andRAD3-related Protein; RBBP8, Retinoblastomabinding-protein-8. Therapie von Patienten mit MCPH Es gibt keine kurative Behandlung für Patienten mit MCPH. Im Vordergrund steht eine Förderung und Unterstützung des Patienten und seiner Familie sowie einer Beratung der Familienangehörigen. Sprach- und Verhaltenstherapien sollten früh initiiert werden, Aufmerksamkeitsund Hyperaktivitätsstörungen können u. a. mit Methylphenidat (Ritalin®) behandelt werden, und Epilepsien sind meist gut mit einem einzigen Antiepileptikum behandelbar. Kürzlich wurde bei Patienten mit CDK5RAP2-Mutationen eine Hörstörung beschrieben (diese konnten wir bei unseren Patienten allerdings nicht nachweisen)(40), sodass bei allen Patienten mit MCPH und Sprachstörungen auch eine pädaudiologische Untersuchung erfolgen sollte. Differentialdiagnose der MCPH Die Differentialdiagnose der MCPH umfasst andere Erkrankungen, die mit einer kongenitalen Mikrozephalie einhergehen, aber bei denen keine weiteren schweren Fehlbildungen auftreten (siehe Abschnitt über Phänotyp). In den letzten Jahren wurde insbesondere eine Überschneidung des Phänotyps von MCPH mit dem von Patienten mit einem Seckel-Syndrom oder einem mikrozephalen osteodysplastischen primordialen Kleinwuchs (engl. ‚Microcephalic osteodysplastic primordial dwarfism’, MOPD2) deutlich (Abb. 7). Dies liegt nicht zuletzt an der genetischen Aufklärung dieser Erkrankungen, bei der Mutationen in den Genen CENPJ oder CEP152 sowohl bei Patienten mit einem MCPH- als auch mit einem Seckel-Phänotyp beschrieben wurden. Zudem weisen experimentelle Arbeiten auf eine Interaktion zwischen Pericentrin (Genmutationen führen zu MOPD2) und MCPH-Genprodukten, wie MCPH1 und CDK5RAP2. Darüber hinaus spielt ATR (Genmutationen führen zum Seckel-Syndrom) auch in den Stoffwechselwegen von MCPH-Genprodukten eine Rolle. Wir verweisen hinsichtlich der Klinik und der Pathgenese der Seckel- und MOPD2Erkrankung auf den Beitrag von Frau Prof. Wieczorek in dem aktuellen Sonderheft zum Thema „Primäre Mikrozephalie“. Danksagung Unsere Forschungsarbeiten wurden finanziell gefördert durch die Deutsche Forschungsgemeinschaft (DFG; SFB665), Info-Box. 1: Definitionen und Grundlagen Zentrosomen: Diese ca. 1 µm großen subzelluläre Organellen dienen als primäre Zentren der Mikrotubuli-Organisation (engl. ‚microtubule organizing center’, MTOC). Sie sind dadurch an der Kontrolle einer Vielzahl von zellulären Prozessen beteiligt, wie beispielsweise an der Organisation eines bipolaren Spindelapparates während der Zellteilung, der Regulierung von Zellmotilität, Zelladhäsion, Zellpolarität und des intrazellulären Vesikeltransports sowie an der Rekrutierung von regulatorischen Proteinen. Zentrosomen der Vertebraten bestehen aus zwei senkrecht zueinander ausgerichteten Zentriolen. Im Laufe der Zellteilung kommt es zur Duplikation der Zentrosomen. Zentriolen: Diese ca. 0,5 µm langen Bausteine der Zentrosomen sind von einem elektronendichten amorphen Material, der perizentriolären Matrix (engl. ‚pericentriolar matrix’, PCM) umgeben. Eine Zentriole besteht aus neun zylindrisch angeordneten Mikrotubuli-Tripletts, die zusätzlich zu Tubulin-Isoformen weitere Strukturproteine wie beispielsweise Centrin, Sas4, CEP135 und CP110 enthalten. Sie sind zudem Bestandteile des Basalkörperchens einer Zilie. Perizentrioläre Matrix: Die perizentrioläre Matrix (PCM) besteht zum größten Teil aus sogenannten Coiled-Coil-Proteinen wie Pericentrin und umgibt Zentriolen. Sie stellt damit eine zentrale Matrix für die Nukleation und Organisation der Mikrotubuli dar (Pericentrin interagieren bsw. mit dem für die Mikrotubulus-Nukleation essentiellen Gamma-Tubulin-Ringkomplex (gTuRC)). Spindelapparat: Dieser bildet sich während der Zellteilung aus und besteht aus vielen Spindelfasern (Mikrotubuli). Spindelfasern: Diese werden auch als Mikrotubuli bezeichnet und bestehen vorwiegend aus Isoformen des Proteins Tubulin. Zentromer: Dies stellt die Einschnürungsstelle zwischen beiden Armen (p und q) eines Metaphasen-Chromosoms dar an dem auch das Kinetochor lokalisiert ist und indirekt die Spindelfasern während der Zellteilung ansetzen. Kinetochor: Spezifische Struktur (Proteinkomplex), der an das Zentromer angelagert ist und als Ansatzstelle für die Fasern des Spindelapparates dient. Neurale Stammzellen: Eine pluripotente Stammzelle, die in weitere Stammzellen und/oder Zellen des Zentralen Nervensystems (Neurone, Glia-Zellen) differenzieren kann. Zellzyklus-Checkpoint: Der auch als mitotischer Checkpoint oder Spindel-Checkpoint bezeichnete Mechanismus umfasst Kontrollprozesse, die eine (auch zeitlich) korrekte Abfolge bestimmter Zellzyklusprozesse beinhalten. 10 Neuropädiatrie in Klinik und Praxis 12. Jg. (2013) Nr. 1 #6918_Neuropädiatrie_01-2013.indd 10 09.01.13 13:37 Trotz ADHS durchstarten bis in den Nachmittag In de r Sc hu le kr ie ge n w ir vi el e Ha us au fg ab en au f Equasym® Retard bei ADHS: r'KP\KICTVKIGU(TGKUGV\WPIUXGTJÀNVPKUXQP r&KTGMVHTGKIGUGV\VGU/2*HØTGKPGPIWVGP5VCTVKPFGP5EJWNVCI1 r<GKIVUGKPG\YGKVG5VÀTMGCOHTØJGP0CEJOKVVCI2 Equasym® Retard 10 mg / 20 mg / 30 mg Hartkapseln mit veränderter Wirkstofffreisetzung. Wirkstoff: Methylphenidathydrochlorid. Zusammensetzung: 10/20/30 mg Methylphenidathydrochlorid. Sonstige Bestandteile: Saccharose, Maisstärke, Povidon K29 bis K32, Opadry Clear YS-1-7006 (Hypromellose, Macrogol 400, Macrogol 8000), Ethylcellulose (wässr. Dispersion), Dibutyldecandioat, Gelatine, Titandioxid, Indigocarmin-Aluminiumsalz, Eisen(II, III)-oxid, Schellack, SchellackGlasur 45 % (20 % verestert) in Ethanol, Propylenglycol, Natriumhydroxid, Povidon K16, Ammoniumhydroxid 28 %. Zusätzl. gelbes Eisenoxid (Equasym® Retard 10 mg), rotes Eisenoxid (Equasym® Retard 30 mg). Anwendungsgebiet: Im Rahmen einer therapeut. Gesamtstrategie zur Behandl. von ADHS (Aufmerksamkeitsdefizit-/Hyperaktivitätsstörung) bei Kindern über 6 Jahren, falls andere Maßnahmen allein unzureichend. Behandlung durch Spezialisten. Diagnose nach DSM-IV o. ICD-10. Gegenanzeigen: Überempfindlichkeit geg. Methylphenidathydrochlorid o. sonst. Bestandteile, Glaukom, Phäochromozytom, kürzliche o. laufende Einnahme v. MAO-Inhibitoren, Hyperthyreose, Thyreotoxikose, schwere Depression, anorektische Störungen, Suizidneigung, psychotische Symptome, schwere affektive Störungen, Manie, Schizophrenie, psychopathische/Borderline-Persönlichkeitsstörungen, schwere u. episodische (Typ I) bipolare affektive Störungen (nicht gut kontrolliert), vorbest. Herz-Kreislauferkrankungen einschl. schwerer Hypertonie, Herzinsuffizienz, arterieller Verschlusskrankheit, Angina pectoris, hämodynamisch signifikanter, angeborener Herzfehler, Kardiomyopathien, Myokardinfarkt, potenziell lebensbedrohender Arrhythmien und Kanalopathien, vorbestehender zerebrovaskulärer Erkrankungen wie z. B. zerebrale Aneurysmen, Gefäßabnormalitäten einschl. Vaskulitis o. Schlaganfall. Die folgenden Sicherheitshinweise beruhen auf der Harmonisierung der Fach- u. Gebrauchsinformationen sämtlicher methylphenidathaltiger Medikamente. Vor der Verordnung von Methylphenidat sollte die aktuelle Fach- und Gebrauchsinformation zurate gezogen werden. Untersuchungen vor Behandlungsbeginn: Vor einer Verschreibung ist es notwendig, den Patienten hinsichtl. seines kardiovaskulären u. psychischen Status sowie Körpergröße u. -gewicht zu beurteilen. Laufende Überwachung: Das Wachstum, der psychische u. der kardiovaskuläre Status sollten kontinuierlich, mind. alle 6 Monate, überwacht werden. Weitere Einzelheiten bzgl. der Überwachung s. Fach- u. Gebrauchsinformation. Auch sollten Patienten hinsichtlich des Risikos von Zweckentfremdung, Fehlgebrauch u. Missbrauch überwacht werden. Dauertherapie (mehr als 12 Monate) bei Kindern und Heranwachsenden: Die Unbedenklichkeit u. Wirksamkeit der Langzeitanwendung v. Methylphenidat wurden nicht systematisch in kontrollierten Studien untersucht. Es wird empfohlen, Methylphenidat mind. einmal im Jahr abzusetzen, um das Befinden des Kindes zu beurteilen (vorzugsweise während d. Schulferien). Dosisreduktion und Unterbrechung der Medikation: Die Behandlung muss beendet werden, wenn die Symptome nach geeigneter Dosisanpassung über einen Zeitraum von einem Monat nicht besser werden. Bei Auftreten einer paradoxen Verschlimmerung d. Symptome o. anderer schwerwiegender Nebenwirkungen muss die Dosis reduziert o. das Präparat abgesetzt werden. Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung: Eine Behandlung mit Methylphenidat ist nicht bei allen Kindern mit ADHS indiziert u. der Entscheidung zur Anwendung dieses Arzneimittels muss eine sehr sorgfältige Einschätzung der Schwere u. Dauer der Symptome des Kindes in Bezug auf sein Alter vorausgehen. Bitte beachten Sie vor Verordnung die Fach- u. Gebrauchsinformation insbes. hinsichtl. Herz-Kreislaufstatus, plötzlichem Tod u. vorbestehender kardialer Erkrankungen o. anderer schwerer Herzerkrankungen, zerebrovaskulärer Störungen, psychiatrischer Erkrankungen, Suizidalität, Tics, Angst- u. Spannungszuständen o. Agitiertheit, bipolarer Störungen, Wachstum, Krampfanfällen, Fehlgebrauch, Missbrauch u. Zweckentfremdung. Schwangerschaft und Stillzeit: Nicht zur Anw. während der Schwangersch. empfohlen, es sei denn, es ist klin. entschieden, dass eine Verschiebung der Behandl. ein größeres Risiko für die Schwangersch. bedeutet. Methylphenidat wurde in der Muttermilch von Frauen nachgewiesen, die mit Methylphenidat behandelt wurden. Strenge Nutzen-Risiko-Abwägung für Stillzeit. Nebenwirkungen: Sehr häufig (≥ 1/10): Schlaflosigkeit, Nervosität, Kopfschmerzen. Häufig (≥ 1/100 bis < 1/10): Nasopharyngitis, Anorexie, Appetitverlust, mäßige Verminderung der Gewichtszunahme und des Längenwachstums b. längerer Anwendung b. Kindern, Affektlabilität, Aggression, Erregung, Ängstlichkeit, Depression, Reizbarkeit, anormales Verhalten, Zähneknirschen, Schwindelgefühl, Dyskinesie, psychomotorische Hyperaktivität, Somnolenz, Arrhythmie, Tachykardie, Palpitationen, Hypertonie, Husten, Rachen- und Kehlkopfschmerzen, Bauchschmerzen, Diarrhö, Übelkeit, Magenbeschwerden u. Erbrechen, Mundtrockenheit, Alopezie, Pruritus, Rash, Urtikaria, Arthralgie, Fieber, Änderung d. Blutdrucks u. der Herzfrequenz (üblicherweise eine Erhöhung) , Gewichtsverlust. Gelegentlich: Überempfindlichkeitsreaktionen wie angioneurotisches Ödem, anaphylaktische Reaktionen, Ohrenschwellung, bullöse Erkrankungen, exfoliative Erkrankungen, Hautausschläge, psychotische Erkrankungen, auditive, visuelle u. taktile Halluzinationen, Ärger, Suizidgedanken, Verstimmung, Stimmungsschwankungen, Ruhelosigkeit, Weinerlichkeit, Tics o. Verschlechterung bestehender Tics d. Tourette-Syndroms, Hypervigilanz, Schlafstörungen, Sedierung, Tremor, Diplopie, verschwommenes Sehen, Brustschmerzen, Dyspnoe, Obstipation, erhöhte Leberenzymwerte, angioneurotisches Ödem, Erkrankungen m. Blasenbildung, schuppende Erkrankungen, Myalgie, Muskelzuckungen, Hämaturie, Müdigkeit, Herzgeräusche. Selten: Manie, Desorientiertheit, Libidostörungen, Schwierigkeiten b. d. visuellen Akkommodation, Mydriasis, Sehstörungen, Angina pectoris, Hyperhidrose, fleckiger Ausschlag, Erythem, Gynäkomastie. Sehr selten: Anämie, Leukopenie, Thrombozytopenie, thrombozytopenische Purpura, Suizidversuch (einschließlich vollendetem Suizid) , transiente depressive Stimmung, abnormes Denken, Apathie, repetitive Verhaltensweisen, übermäßiges Fokussieren, Konvulsionen, choreatisch-athetotische Bewegungen, reversible ischämisch neurologische Ausfälle, malignes neuroleptisches Syndrom (MNS; die Berichte wurden nicht ausreichend dokumentiert u. in den meisten Fällen erhielten die Patienten zusätzlich andere Wirkstoffe, sodass die Rolle von Methylphenidat in diesen Fällen unklar ist), Herzstillstand, Myokardinfarkt, zerebrale Arteriitis u./o. Verschluss, periphere Kälte, Raynaud-Syndrom, anormale Leberfunktion einschließlich Leberkoma, Erythema multiforme, exfoliative Dermatitis, fixes Arzneimittelexanthem, Muskelkrämpfe, plötzlicher Herztod, erhöhte alkalische Phosphatase im Blut, erhöhtes Bilirubin im Blut, reduzierte Thrombozytenzahl, Leukozytenzahl pathologisch. Nicht bekannt: Panzytopenie, Wahnvorstellungen, Denkstörungen, Verwirrtheitszustand, Abhängigkeit, zerebrovaskuläre Erkrankungen (einschließlich Vaskulitis, Hirnblutungen, zerebrovaskuläre Ereignisse, zerebrale Arteriitis, zerebraler Verschluss), Grand-Mal-Anfälle, Migräne, supraventrikuläre Tachykardie, Bradykardie, ventrikuläre Extrasystolen, Extrasystolen, Brustbeschwerden, Hyperpyrexie. Es wurden Fälle von Missbrauch u. Abhängigkeit beschrieben, häufiger mit schnellfreisetzenden Formulierungen. Warnhinweis: Arzneimittel für Kinder unzugänglich aufbewahren. Enthält Sucrose (Zucker). Wechselwirkung, Dosierung: s. Fach- u. Gebrauchsinformation. Verschreibungspflichtig, BtM. Stand der Fachinformation: November 2011, Shire Pharmaceuticals Ireland Ltd., 5 Riverwalk Citywest Business Campus, Dublin 24, Irland. [1] Greenhill LL et al. A double-blind, placebo-controlled study of modified-release methylphenidate in children with attention-deficit/hyperactivity disorder. Pediatrics 2002;109(3):e39. [2] Wigal SB et al. Selection of the optimal dose ratio for a controlled-delivery formulation of methylphenidate. J Appl Research 2003;3(1):46-63. #6918_Neuropädiatrie_01-2013.indd 11 09.01.13 13:37 Originalien/Übersichten die Sonnenfeld-Stiftung, die Berliner Krebsgesellschaft e. V. und die Charité – Universitätsmedizin Berlin. Wir bedanken uns sehr bei den Eltern der Patientin in Abb. 1 für die Überlassung der Bilder ihrer Tochter. Zudem danken wir Herrn Dr. M. Trimborn, Humangenetik der Charité, sehr für die Bereitstellung der Abbildung einer Chromosomenpräperation eines MCPH1Patienten. Literatur 1. Opitz JM, Holt MC. Microcephaly: general considerations and aids to nosology. J Craniofac Genet Dev Biol. 1990; 10(2): 175-204. 2. Woods CG. Human microcephaly. Curr Opin Neurobiol. 2004 Feb; 14(1): 112-7. 3. Van Den Bosch J. Microcephaly in the Netherlands: a clinical and genetical study. Ann Hum Genet. 1959 Apr; 23(2): 91-116. 4. Mochida GH, Walsh CA. Molecular genetics of human microcephaly. Curr Opin Neurol. 2001 Apr; 14(2): 151-6. 5. Bilguvar K, Ozturk AK, Louvi A, Kwan KY, Choi M, Tatli B et al. Whole-exome sequencing identifies recessive WDR62 mutations in severe brain malformations. Nature. 2010 Sep 9; 467(7312): 207-10. 6. Nicholas AK, Khurshid M, Desir J, Carvalho OP, Cox JJ, Thornton G et al. WDR62 is associated with the spindle pole and is mutated in human microcephaly. Nat Genet. 2010 Nov; 42(11): 1010-4. 7. Yu TW, Mochida GH, Tischfield DJ, Sgaier SK, Flores-Sarnat L, Sergi CM et al. Mutations in WDR62, encoding a centrosome-associated protein, cause microcephaly with simplified gyri and abnormal cortical architecture. Nat Genet. 2010 Nov; 42(11): 1015-20. 8. Jackson AP, McHale DP, Campbell DA, Jafri H, Rashid Y, Mannan J et al. Primary autosomal recessive microcephaly (MCPH1) maps to chromosome 8p22-pter. Am J Hum Genet. 1998 Aug; 63(2): 541-6. 9. Tunca Y, Vurucu S, Parma J, Akin R, Desir J, Baser I et al. Prenatal diagnosis of primary microcephaly in two consanguineous families by confrontation of morphometry with DNA data. Prenat Diagn. 2006 May; 26(5): 449-53. 10. Passemard S, Titomanlio L, Elmaleh M, Afenjar A, Alessandri JL, Andria G et al. Expanding the clinical and neuroradiologic phenotype of primary microcephaly due to ASPM mutations. Neurology. 2009 Sep 22; 73(12): 962-9. 11. Passemard S TL, Elmaleh M, Afenjar A, Alessandri JL, Andria G, Billette de Villemeur T, BoespflugTanguy O, Burglen L, Del Gundice E, Guimiot F, Hyon C, Isidor B, Megarbane A, Moog U, Odent S, Hernandez K, Pouvreau N, Scala I, Schaer M, Gressens P, Gerard B, Verloes A. Expanding the clinical and neuroradiological phenotype of primary microcephaly (MCPH) due to ASPM mutations. Neurology. 2009. 14. Neitzel H, Neumann LM, Schindler D, Wirges A, Tonnies H, Trimborn M et al. Premature chromosome condensation in humans associated with microcephaly and mental retardation: a novel autosomal recessive condition. Am J Hum Genet. 2002 Apr; 70(4): 1015-22. 15. Woods CG, Bond J, Enard W. Autosomal recessive primary microcephaly (MCPH): a review of clinical, molecular, and evolutionary findings. Am J Hum Genet. 2005 May; 76(5): 717-28. 16. Desir J, Cassart M, David P, Van Bogaert P, Abramowicz M. Primary microcephaly with ASPM mutation shows simplified cortical gyration with anteroposterior gradient pre- and post-natally. Am J Med Genet A. 2008 Jun 1; 146A(11): 1439-43. 17. Trimborn M, Bell SM, Felix C, Rashid Y, Jafri H, Griffiths PD et al. Mutations in microcephalin cause aberrant regulation of chromosome condensation. Am J Hum Genet. 2004 Aug; 75(2): 261-6. 18. Roberts E, Jackson AP, Carradice AC, Deeble VJ, Mannan J, Rashid Y et al. The second locus for autosomal recessive primary microcephaly (MCPH2) maps to chromosome 19q13.1-13.2. Eur J Hum Genet. 1999 Oct-Nov; 7(7): 815-20. 19. Moynihan L, Jackson AP, Roberts E, Karbani G, Lewis I, Corry P, et al. A third novel locus for primary autosomal recessive microcephaly maps to chromosome 9q34. Am J Hum Genet. 2000 Feb; 66(2): 724-7. 20. Bond J, Roberts E, Springell K, Lizarraga SB, Scott S, Higgins J et al. A centrosomal mechanism involving CDK5RAP2 and CENPJ controls brain size. Nat Genet. 2005 Apr; 37(4): 353-5. 21. Jamieson CR, Govaerts C, Abramowicz MJ. Primary autosomal recessive microcephaly: homozygosity mapping of MCPH4 to chromosome 15. Am J Hum Genet. 1999 Nov; 65(5): 1465-9. 22. Guernsey DL, Jiang H, Hussin J, Arnold M, Bouyakdan K, Perry S et al. Mutations in centrosomal protein CEP152 in primary microcephaly families linked to MCPH4. Am J Hum Genet. 2010 Jul 9; 87(1): 40-51. 23. Jamieson CR, Fryns JP, Jacobs J, Matthijs G, Abramowicz MJ. Primary autosomal recessive microcephaly: MCPH5 maps to 1q25-q32. Am J Hum Genet. 2000 Dec; 67(6): 1575-7. 24. Pattison L, Crow YJ, Deeble VJ, Jackson AP, Jafri H, Rashid Y et al. A fifth locus for primary autosomal recessive microcephaly maps to chromosome 1q31. Am J Hum Genet. 2000 Dec; 67(6): 1578-80. 25. Bond J, Roberts E, Mochida GH, Hampshire DJ, Scott S, Askham JM et al. ASPM is a major determinant of cerebral cortical size. Nat Genet. 2002 Oct; 32(2): 316-20. 26. Leal GF, Roberts E, Silva EO, Costa SM, Hampshire DJ, Woods CG. A novel locus for autosomal recessive primary microcephaly (MCPH6) maps to 13q12.2. J Med Genet. 2003 Jul; 40(7): 540-2. 27. Kumar A, Girimaji SC, Duvvari MR, Blanton SH. Mutations in STIL, encoding a pericentriolar and centrosomal protein, cause primary microcephaly. Am J Hum Genet. 2009 Feb; 84(2): 286-90. 12. Kaindl AM, Passemard S, Kumar P, Kraemer N, Issa L, Zwirner A et al. Many roads lead to primary autosomal recessive microcephaly. Prog Neurobiol. 2010 Mar; 90(3): 363-83. 28. Hussain MS, Baig SM, Neumann S, Nurnberg G, Farooq M, Ahmad I et al. A truncating mutation of CEP135 causes primary microcephaly and disturbed centrosomal function. Am J Hum Genet. 2012 May 4; 90(5): 871-8. 13. Shen J, Eyaid W, Mochida GH, Al-Moayyad F, Bodell A, Woods CG et al. ASPM mutations identified in patients with primary microcephaly and seizures. J Med Genet. 2005 Sep; 42(9): 725-9. 29. Genin A, Desir J, Lambert N, Biervliet M, Van Der Aa N, Pierquin G et al. Kinetochore KMN network gene CASC5 mutated in Primary Microcephaly. Hum Mol Genet. 2012 Sep 13. 30. Marchal JA, Ghani M, Schindler D, Gavvovidis I, Winkler T, Esquitino V et al. Misregulation of mitotic chromosome segregation in a new type of autosomal recessive primary microcephaly. Cell Cycle. 2011 Sep 1; 10(17): 2967-77. 31. Sajid Hussain M, Marriam Bakhtiar S, Farooq M, Anjum I, Janzen E, Reza Toliat M et al. Genetic heterogeneity in Pakistani microcephaly families. Clin Genet. 2012 Jul 6. 32. Dzhindzhev NS, Yu QD, Weiskopf K, Tzolovsky G, Cunha-Ferreira I, Riparbelli M et al. Asterless is a scaffold for the onset of centriole assembly. Nature. 2010 Oct 7; 467(7316): 714-8. 33. Hatch EM, Kulukian A, Holland AJ, Cleveland DW, Stearns T. Cep152 interacts with Plk4 and is required for centriole duplication. J Cell Biol. 2010 Nov 15; 191(4): 721-9. 34. Cizmecioglu O, Arnold M, Bahtz R, Settele F, Ehret L, Haselmann-Weiss U et al. Cep152 acts as a scaffold for recruitment of Plk4 and CPAP to the centrosome. J Cell Biol. 2010 Nov 15; 191(4): 731-9. 35. Barrera JA, Kao LR, Hammer RE, Seemann J, Fuchs JL, Megraw TL. CDK5RAP2 regulates centriole engagement and cohesion in mice. Dev Cell. 2010 Jun 15; 18(6): 913-26. 36. Barr AR, Kilmartin JV, Gergely F. CDK5RAP2 functions in centrosome to spindle pole attachment and DNA damage response. J Cell Biol. 2010 Apr 5; 189(1): 23-39. 37. Pulvers JN, Bryk J, Fish JL, Wilsch-Brauninger M, Arai Y, Schreier D et al. Mutations in mouse Aspm (abnormal spindle-like microcephaly associated) cause not only microcephaly but also major defects in the germline. Proc Natl Acad Sci U S A. 2010 Sep 21; 107(38): 16595-600. 38. Ponting C, Jackson AP. Evolution of primary microcephaly genes and the enlargement of primate brains. Curr Opin Genet Dev. 2005 Jun; 15(3): 241-8. 39. Evans PD, Vallender EJ, Lahn BT. Molecular evolution of the brain size regulator genes CDK5RAP2 and CENPJ. Gene. 2006; 375: 75-9. 40. Pagnamenta AT, Murray JE, Yoon G, Sadighi Akha E, Harrison V, Bicknell LS et al. A novel nonsense CDK5RAP2 mutation in a Somali child with primary microcephaly and sensorineural hearing loss. Am J Med Genet A. 2012 Oct; 158A(10): 2577-82. 41. Megraw TL, Sharkey JT, Nowakowski RS. Cdk5rap2 exposes the centrosomal root of microcephaly syndromes. Trends Cell Biol. 2011 Aug; 21(8): 470-80. Korrespondenzadresse Priv.-Doz. Dr. med. Angela M. Kaindl Klinik für Pädiatrie mit Schwerpunkt Neurologie Charité – Universitätsmedizin Berlin Campus Virchow-Klinikum Augustenburger Platz 1 D-13353 Berlin, Germany Tel./Fax: +49 30 450 566112/920 E-Mail: [email protected] Interessenkonflikt Die Autoren geben an, dass kein Interessenkonflikt besteht. 12 Neuropädiatrie in Klinik und Praxis 12. Jg. (2013) Nr. 1 #6918_Neuropädiatrie_01-2013.indd 12 09.01.13 13:37 Originalien/Übersichten Primäre Mikrozephalie und assoziierte Syndrome D. WIECZOREK Institut für Humangenetik, Universitätsklinikum Essen, Universität Duisburg-Essen, Hufelandstrasse 55, 45122 Essen Zusammenfassung Schlüsselwörter Bibliography Als Mikrozephalie (griechisch: mikros „klein“; kephale „Kopf“) bezeichnet man einen Kopfumfang unterhalb der 3. Perzentile bzw. einen Kopfumfang, der mehr als zwei Standardabweichungen (SD) unterhalb des Mittelwerts für den Kopfumfang unter Berücksichtigung von Alter und Geschlecht liegt. Die Winter-Baraitser-Dysmorphology Database führt in der aktuellen Version 825 Krankheitsbilder mit dem klinischen Zeichen Mikrozephalie. Dies macht klar, dass die nachfolgende Übersicht zu syndromalen Krankheitsbildern mit primärer Mikrozephalie nur einen kleinen Ausschnitt dieses umfassenden Gebiets der klinischen Genetik/Dysmorphologie wiedergeben kann. Der primordiale mikrozephale Kleinwuchs ist eine extreme Form des Kleinwuchses assoziiert mit einer ausgeprägten primären Mikrozephalie. Hierzu gehören das Seckel-Syndrom (MIM 210600), der mikrozephale osteodysplastische primordiale Kleinwuchs (MOPD) Typ I (MIM 210710) und Typ II (MIM 210720) und die verschiedenen Formen des Meier-Gorlin-Syndroms (MIM 224690). Bisher wurden 13 Gene beschrieben, die für einzelne Entitäten dieser Krankheitsgruppe ursächlich sind. Die kodierten Proteine sind in fundamentale zelluläre Prozesse involviert, wie die Genom-Replikation, DNA-Reparaturmechanismen und die Zentrosomenfunktion. Zu den primordialen mikrozephalen Kleinwuchsformen wird dieser Artikel eine Übersicht geben. Eine andere Form der syndromalen Mikrozephalie, die durch Mutationen im EFTUD2-Gen verursacht wird, wurde erst kürzlich beschrieben: die mandibulofaziale Dysostose mit Mikrozephalie (MIM 610536). Das kodierte Protein, U5-116kD, eine hoch konservierte spleißosomale GTPase, spielt eine wichtige Rolle beim Spleißen. Auch hier resultiert ein wiedererkennbarer Phänotyp mit dem Leitsymptom progressive Mikrozephalie. Auch zu diesem Krankheitsbild gibt dieser Artikel exemplarisch einen Überblick. Mikrozephalie – osteodysplastischer primordialer Kleinwuchs – Seckel-Syndrom – EFTUD2 – MFD mit Mikrozephalie Neuropaediatrie 2013; 12: 13-18, © Schmidt-Roemhild-Verlag, Luebeck, Germany: ISSN 1619-3873; NLM ID 101166293; OCoLc 53801270 Primary microcephaly and associated syndromes Abstract Microcephaly is defined as a head circumference below the 3rd percentile or more than two standard deviations below mean matched for age and gender. The Winter-Baraitser-Dysmorphology Database lists 825 conditions with one of the clinical signs being microcephaly. This makes clear, that this paper only allows describing a selection of syndromic conditions with microcephaly. Primordial microcephalic dwarfism is an extreme form of short stature associated with severe microcephaly, including Seckel syndrome (MIM 210600), MOPD type I (MIM 210710) and II (MIM 210720) and Meier-Gorlin syndrome (MIM 224690). Thirteen genes causative for these conditions have been described. The encoded proteins are involved in fundamental cellular processes like genome replication, DNA damage repair and centrosomal function. This article gives a short review on conditions being part of primordial microcephalic dwarfism. Another, very distinct syndromic microcephaly, caused by mutations within the EFTUD2 gene, encoding for U5116kDa involved in splicing, named mandibulofacial dysostosis with microcephaly (MIM 610536), will also be described in more detail. Keywords Microcephaly – osteodysplastic primordial dwarfism – Seckel syndrome – EFTUD2 – mandibulofacial dysostosis with microcephaly Einleitung Einen Kopfumfang unterhalb der 3. Perzentile bzw. einen Kopfumfang, der mehr als zwei Standardabweichungen (SD) unterhalb des Mittelwerts für den Kopfumfang unter Berücksichtigung von Alter und Geschlecht liegt, bezeichnet man als Mikrozephalie. Eine konservativere Definition der Mikrozephalie schließt nur Kopfumfänge von mehr als 3 SD unterhalb des Mittelwerts ein. Zur korrekten Bewertung der Kopfumfangsmessungen müssen die Werte in Perzentilenkurven eingetragen werden. Für Neugeborene können die Perzentilenkurven aus dem Neugeborenenkollektiv der Bundesrepublik Deutschland (23) verwendet werden. Nach der Neugeborenenperiode finden z. B. die älteren Kopfumfangs-Kurven nach Nellhaus (16) oder die Aktuelleren nach Schienkiewitza et al. (19) Anwendung. Für einige syndromale Krankheitsbilder, z. B. für das Noonan-Syndrom, gibt es syndromspezifische Perzentilen. Abhängig von der Definition der Mikrozephalie und dem ethnischen Hintergrund wird die Inzidenz mit 1.3 bis 150/100.000 angegeben (12). Manchmal gelingt nach ausführlicher Anamnese und körperlicher Untersuchung eine spezifische Syndromdiagnose entweder durch den erfahrenen Pädiater selbst oder durch den hinzugezogenen Syndromologen. Dann kann häufig eine molekulargenetische Analyse zur Bestätigung der klinischen Diagnose durchgeführt werden. Dies ist jedoch nicht immer der Fall. Oft gibt es trotz einiger klinischer Zeichen, die assoziiert mit der Mikrozephalie vorliegen, keine eindeutige klinische Verdachtsdiagnose. In diesen Fällen muss sorgfältig abgewogen werden, welche diagnostischen Neuropädiatrie in Klinik und Praxis 12. Jg. (2013) Nr. 1 13 #6918_Neuropädiatrie_01-2013.indd 13 09.01.13 13:37 Originalien/Übersichten Schritte eingeleitet werden. Hierzu sei auf den Artikel zum diagnostischen Vorgehen bei primärer Mikrozephalie von Wieczorek et al. (25) in diesem Heft verwiesen. Die primären autosomal rezessiven Mikrozephalien werden in dem Beitrag dieses Hefts von Krämer et al. (10) beschrieben und sollen hier nicht Thema sein. In diesem Beitrag geht es vielmehr um syndromale Mikrozephalien. In der Winter-BaraitserDysmorphology-Datenbank (27) gibt es in der aktuellen Version hierzu 825 Einträge, sodass für diesen Artikel eine Auswahl getroffen werden muss. Ein Schwerpunkt dieses Beitrags liegt auf dem mikrozephalen primordialen Kleinwuchs (9). Das Seckel-Syndrom (MIM 210600) (20), die MOPD (microcephalic osteodysplastic primordal dwarfism) Typ I (MIM 210710) (14) und MOPD Typ II (MIM 210720) sollen hier detaillierter dargestellt werden. Aber auch die mandibulofaziale Dysostose mit Mikrozephalie (MIM 610536) (11) soll als Beispiel für eine wiedererkennbare progressive Mikrozephalie vorgestellt werden. I. Mikrozephaler primordialer Kleinwuchs Unter dem mikrozephalen primordialen Kleinwuchs werden das Seckel-Syndrom, die MOPDI (microcephalic osteodysplastic primordial dwarfism type I) und MOPDII (microcephalic osteodysplastic primordial dwarfism type II) und das Meier-GorlinSyndrom zusammengefasst. Die klinischen Hauptmerkmale dieser seltenen Syndrome sind eine ausgeprägte Mikrozephalie, ein extremer Kleinwuchs, faziale Dysmorphien und verschiedene, variabel ausgeprägte Skelettanomalien. Die schwere Mikrozephalie, die häufig stärker ausgeprägt ist als der Kleinwuchs, unterscheidet diese Form des Kleinwuchses von anderen Kleinwuchsformen. Das Hirnvolumen kann bis auf ein Drittel reduziert sein. Alle bisher beschriebenen Formen des mikrozephalen primordialen Kleinwuches werden autosomal rezessiv vererbt. Bis heute wurden dreizehn ursächliche Gene für den mikrozephalen primordialen Kleinwuchs identifiziert, aber es wird erwartet, dass die Anzahl in den nächsten Jahren noch deutlich ansteigen wird. Eine aktuelle Übersicht hierzu gibt Tabelle 1. Die dort aufgeführten Gene kodieren für Proteine, die in fundamentale zelluläre Prozesse involviert sind: die Genomreplikation (die Gene ORC1, ORC4, ORC6, CDT1 und CDC6), in DNA-Reparaturmechanismen (das ATRGen), das mRNA-Spleißing (das U4atacGen) und die Zentrosomenfunktion (die Gene CEP152, PCNT, CPAP) (11). Die Seckel-Syndrome (Typ I bis VII) Die Definition Seckel-Syndrom geht auf die Erstbeschreibung von Helmut Seckel (20) zurück. Allerdings wird der Begriff Seckel-Syndrom sehr unterschiedlich angewendet. Majewski und Goeke (13) haben die diagnostischen Zeichen definiert: eine intrauterine Wachstumsverzögerung (mittleres Geburtsgewicht zum Termin von 1543 g), eine schwere Mikrozephalie (durchschnittlich -8.7 SD), ein Kleinwuchs (durchschnittlich -7.1 SD), ein verzögertes Knochenalter und eine moderate bis schwere geistige Behinderung (50% der Patienten haben einen IQ unter 50). Man fasst also unter dem Seckel-Syndrom Patienten zusammen, die eine ausgeprägte Lernschwäche/geistige Behinderung aufweisen sowie einen Kopfumfang, der im Verhältnis zur Körpergröße dysproportioniert klein ist (5). Faziale Dysmorphien bestehend aus einer fliehenden Stirn, einer prominenten Nase und einem kleinen Kinn werden als charakteristisch beschrieben. Es gibt in der Literatur zahlreiche Patienten mit Seckel-Syndrom, die die oben definierten Kriterien nicht erfüllen. Im Einzelfall kann es auch schwierig sein, das Seckel-Syndrom von der MOPD II zu trennen. Hierzu sei auf die Arbeit von Willems et al. (26) verwiesen. Hier wurden PCNTMutationen bei Patienten mit der Erstdiagnose Seckel-Syndrom nachgewiesen. Eine Re-Evaluation der klinischen Daten zeigte jedoch, dass diese Patienten auch klinisch eine MOPD II hatten. Bisher wurden sieben verschiedene Genloci/Gene für das Seckel-Syndrom beschrieben (siehe Tab. 1). Um einen Eindruck Seckel-Syndrom Gen Chromosom Proteinfunktion Typ 1 ATR 3q23 Essentieller Regulator der genomischen Integrität, kontrol#210600 liert und koordiniert die DNA-Replikation und die ZellzyklusKontrollpunkte, DNA-Reparatur Typ II (17) RBBP8 18q11 DNA-Reparatur, Zellzyklus-Kontrollpunkt-Kontrolle #606744 Typ III / 14q21-q22 / #608664 Typ IV CENPJ 13q12.12 Zentromer-Protein-Familie, Aufrechterhaltung der Zentroso- #609279 men-Integrität und normalen Spindel-Morphologie MCPH6 Typ V CEP152 15q21 Zentrosomales Protein, involviert in genomische Integrität und DNA-Reparatur #613823 MCPH4 Typ VI (21) CEP63 3q22.2 Zentrosomales Protein #614728 Typ VII (3) NIN 14q22 Zentrosomales Protein Ninein #608684 MOPD1 U4atac 2q14.2 Komponente des Minor-Spleißosoms #210710 MOPD2 PCNT 21q22.3 Organisation der mitotischen Spindeln, Segregation der Chromosomen #210720 Meier-GorlinSyndrom ORC1, ORC4, ORC6, CDT1, CDC6 1p32.3 Komponenten des präreplikativen Komplexes 2q22.2-q23.1 16q11.2 16q24.3 17q21.2 OMIM MCPH #224690 #613800 #613803 #613904 #613805 Tab. 1: Übersicht zum primordialen mikrozephalen Kleinwuchs. Für einen Review sei hier auf die Arbeit von Klingeisen & Jackson (9) verwiesen 14 Neuropädiatrie in Klinik und Praxis 12. Jg. (2013) Nr. 1 #6918_Neuropädiatrie_01-2013.indd 14 09.01.13 13:37 Originalien/Übersichten Abb. 1: Faziale Dysmorphien und MRT’s von Patienten mit Seckel-Syndrom und CEP152-Mutationen. A,B,D: Die Patienten haben eine Mikrozephalie, eine fliehende Stirn, einen hohen Nasenrücken, eine gebogene Nase und eine Retrognathie. Die MRT’s (C,E,F) zeigen ein vereinfachtes gyrales Muster. Reproduktion der Abbildungen aus Kalay et al., 2011 (8) mit Zustimmung von Herrn Professor Bernd Wollnik und dem Verlag über den fazialen Phänotyp zu geben, sind in Abb. 1 Patienten mit Seckel-Syndrom Typ V und Mutationen im CEP152-Gen und in Abb. 2 Patienten mit Seckel-Syndrom und Mutationen im CENPJ-Gen Typ IV dargestellt. Die Tatsache, dass Mutationen in diesen beiden Genen sowohl zur primären Mikrozephalie als auch zum SeckelSyndrom führen, macht deutlich, dass es eine klinische Überlappung zwischen den Seckel-Syndromen und der primären autosomal rezessiven Mikrozephalie gibt. MOPD Typ II Im Gegensatz zum Seckel-Syndrom ist die MOPD Typ II gut definiert und eine wiedererkennbare Form des mikrozephalen Kleinwuchses. Die Mikrozephalie ist im Vergleich zum Seckel-Syndrom milder ausgeprägt und proportioniert zum Kleinwuchs und die intellektuellen Fähigkeiten sind weniger deutlich eingeschränkt. Das Geburtsgewicht zum Termin beträgt hier auch ca. 1500 g, die erwachsenen Patienten sind ungefähr 100 cm groß und haben einen Kopfumfang wie ein drei Monate altes Kind. Die Intelligenz ist fast normal. Allerdings gehören Skelettanomalien zum klinischen Bild: eine Brachydaktylie an Händen und Füßen, kurze erste Metakarpalia, kurze Mittelphalangen, eine mesomele Verkürzung der Extremitäten bedingt durch verkürzte und gebogene Unterarmknochen, veränderte distale Femurmetaphysen, eine Coxa vara, ein hohes und schmales Becken und Pseudoepiphysen an den Händen. Ferner haben die Patienten häufig hypoplastische oder fehlende Zähne. Auch Anomalien des Zahnschmelzes wurden beschrieben. Die Patienten mit MOPD II haben eine verringerte Lebenserwartung durch ein deutlich erhöhtes Risiko für neurovaskuläre Komplikationen wie Hirnaneurysmen und Moyamoya disease. Die meisten Patienten entwickeln eine Insulinresistenz mit Akanthosis nigricans und Diabetes mellitus Typ II schon während der Kindheit (18). Die kraniofazialen Dysmorphien sind in Abb. 3 dargestellt. Typisch sind neben der Mikrozephalie eine lange Nase mit prominenter Nasenspitze und hypoplastischen Nasenflügeln und ein kleines Kinn (18). Rauch et al. konnten biallelische „lossof-function“ Mutationen im PCNT-Gen bei 25 Patienten nachweisen, d. h. auch hierbei handelt es sich um ein autosomal rezessives Krankheitsbild. Sie konnten zeigen, dass das Fehlen von PCNT zu disorganisierten mitotischen Spindeln und zu einer Missegregation von Chromosomen führt. Mutationen in verwandten Genen verursachen primäre Mikrozephalien oder Seckel-Syndrom (MCPH1, CDK5RAP2, ASPM, und CENPJ). MOPD Typ I Die klinisch schwerste Form dieser Krankheitsgruppe ist die MOPD Typ I, auch Taybi-Linder-Syndrom genannt (Abb. 4). Es wurden bisher nicht mehr als 30 Familien weltweit beschrieben. Die meisten Patienten sterben in den ersten drei Lebensjahren, allerdings sind auch Patienten bekannt, die deutlich länger leben. Neuropädiatrie in Klinik und Praxis 12. Jg. (2013) Nr. 1 15 #6918_Neuropädiatrie_01-2013.indd 15 09.01.13 13:37 Originalien/Übersichten Typisch bei dieser Form sind die kurzen, auch gebogenen langen Röhrenknochen und die schweren Hirnfehlbildungen mit Pachygyrie/Agyrie. Zusätzlich findet man eine trockene Haut und spärliches Haar. In der Publikation von Nagy et al. (15) wurden die klinischen Daten der 14 Ohio Amish-Patienten beschrieben. Die Patienten haben ein durchschnittliches Geburtsgewicht von -5.8 SD und eine Mikrozephalie mit einem Kopfumfang durchschnittlich von -7.0 SD. Die Patienten haben fehlendes oder sehr spärliches Haar, trockene und vorgealterte Haut, multiple Gelenkkontrakturen und Dislokationen, eine auffällige Haltung von Händen und Füßen, eine Brachydaktylie, Hirnanomalien und eine durchschnittliche Lebenserwartung von 8.5 Monaten. Die fazialen Dysmorphien schließen einen prominenten Hinterkopf, eine fliehende Stirn, prominente Augen, eine prominente Nase mit nach unten reichender Nasenspitze und kleine, nach hinten rotierte Ohren ein. Eine Bildgebung vom Gehirn war nur von drei Patienten vorhanden. Alle drei Patienten zeigten ein fehlendes Corpus callosum, eine Lissenzephalie oder andere Gyrierungsstörungen. Skelettaufnahmen gab es von zwei Patienten. Sie wiesen eine Platyspondylie, dysplastische Acetabuli, gebogene Humeri, eine radioulnäre Synostose, eine Aufweitung der distalen Metaphysen, gebogene oder hypoplastische Phalangen auf. Die Nicht-Ohio-Amish-Patienten, davon zwei aus Deutschland, lebten deutlich länger. Der eine Patient starb im Alter von 12 Jahren, die andere Patientin lebt im Alter von 10 Jahren noch. Sie zeigten im Vergleich zu den anderen Patienten einen deutlich milderen Phänotyp. Der Patient in Abbildung 4 ist ein Patient mit MOPDI und ist compound heterozygot für Mutationen im RNU4ATAC-Gen (4, 7). Dieses Gen kodiert für das Protein U4atac, eine kleine nukleäre RNA, die eine essentielle Komponente des Minor-Spleißosoms darstellt. II. Mandibulofaziale Dysostose mit Mikrozephalie Patienten mit dieser Form der syndromalen Mikrozephalie haben eine Entwicklungsverzögerung, die sehr variabel ausgeprägt ist, Choanalstenosen/-atresien, eine sensorineurale und/oder Schallleitungsschwerhörigkeit und eine mediane Gaumenspalte. Die kraniofazialen Dysmorphien sind charakteristisch und wiedererkennbar: eine meistens primäre Mikrozephalie, die ausgeprägt und progressiv ist, nach außen ansteigende Lidachsen, eine malare Hypoplasie, bilaterale Mikrotien mit präaurikulä- Abb. 2: Stammbaum (siehe oben) und klinische Fotografien (siehe unten) von Patienten mit CENPJ-Mutation und Seckel-Syndrom. (A) Oben rechts findet sich der Vater (Körpergröße 168 cm). Die Indexpatientin ist 4 Jahre alt und zeigt einen prominenten und hohen Nasenrücken, eine gebogene Nase, hypoplastische Nasenflügel und ein zurückweichendes Kinn. Drei betroffene Cousins (B, C, D) mit vergleichbaren fazialen Dysmorphien (die weißen Nummern korrespondieren mit der Beschriftung im Stammbaum. Die Abbildungen sind Al-Dosari et al. (1) entnommen und werden mit freundlicher Genehmigung des Verlags reproduziert ren Anhängseln und eine Mikrognathie. Die Patienten in Abb. 3 A-E zeigen die charakteristischen kraniofazialen Dysmorphien. Nachdem zunächst Patienten klinisch als distinkte Entität beschrieben wurden (6, 24), gelang es der Arbeitsgruppe um Kym Boycott (11) mittels Exomsequenzierung von vier Patienten die molekulargenetische Ursache aufzuklären: Mutationen im EFTUD2-Gen führen zum Phänotyp der mandibulofazialen Dysostose mit Mikrozephalie (Abb. 5). Das Protein U5-116kD, das von EF- TUD2 kodiert wird, ist eine hoch konservierte spleißosomale GTPase, die eine wichtige Rolle beim Spleißen spielt. Aus welchem Grund eine Störung in einem ubiquitären Prozess zu einem so umschriebenen Phänotyp führt, ist bisher nicht geklärt. Bisher wurden nur 13 Patienten mit Mutationen im EFTUD2-Gen publiziert (2, 11), die Inzidenz scheint aber nicht gering zu sein. Zusätzlich zu den oben dargestellten kraniofazialen Dysmorphien findet man bei den Patienten diskrete Anomalien des 16 Neuropädiatrie in Klinik und Praxis 12. Jg. (2013) Nr. 1 #6918_Neuropädiatrie_01-2013.indd 16 09.01.13 13:37 Originalien/Übersichten Abb. 3: Patienten mit MOPDII. A. P18 im Alter von 8 3/12 Jahren mit einer Höhe von 84 cm (enstsprechend der normalen Größe einer Patientin im Alter von 1 3/12 Jahren). B, E. P1 im Alter von 8 8/12 Jahren mit einer Größe von 85 cm. C, F. P2 im Alter von 12 6/12 Jahren mit einer Größe von 95 cm und im Alter von 14 Jahren mit einer Größe von 96 cm entsprechend der Größe einer 3-Jährigen. Bemerkenswert sind die kurzen Unterarme besonders bei P18 und die prämature Pubertät bei P1, die faziale Asymmetrie bei P2 und das Fehlen der fliehenden Stirn. Alle drei Patienten haben eine lange Nase mit prominenter Nasenspitze und hypoplastischen Nasenflügeln und einem kleinen Unterkiefer. G, H. Röntgenaufnahme und Fotografie der linken Hand von Patientin P2 mit generalisierter Brachydaktylie mit diaphysealer Konstriktion der Metakarpalia und Phalangen als auch einer flachen Ausformung der distalen Epiphysen von Radius und Ulna. I, J. Hypoplasie und partielle Agenesie der Zähne von Patientin P2, Schmelzhypoplasie der Zähne von Patientin P18. Die Abbildung ist dem Paper von Rauch et al. (18) entnommen und wurde reproduziert mit freundlicher Zustimmung von Professor Anita Rauch und dem Verlag Abb. 4: Patient mit MOPD Typ I im Alter von 11 Jahren. A, B. Deutlich sichtbar sind die ausgeprägte Mikrozephalie, die fliehende Stirn, die diskret ansteigenden Lidachsen und die kleinen Ohren. C, E. Schaukelfüße mit Brachydaktylie und Fußrückenödemen. D. Hypoplastische Zähne im Unterkiefer. Die Eltern haben ihr Einverständnis zur Veröffentlichung der Fotos gegeben Daumens (Abb. 3 F,G), die im Einzelfall eine Abgrenzung zum Nager-Syndrom (2), einer akrofazialen Dysostose mit präaxialen Extremitätenfehlbildungen, schwierig machen können. So findet sich in der Arbeit von Bernier et al., die das Gen für das NagerSyndrom, das SF3B4-Gen, identifiziert haben, ein Patient, bei dem sich eine EFTUD2Mutation nachweisen ließ. Die MFD mit Mikrozephalie stellt eine wichtige Differenzialdiagnose zum Franceschetti-Syndrom (Treacher Collins- Syndrom) (22) dar. Allerdings sind sowohl eine Entwicklungsverzögerung als auch eine Mikrozephalie beim FranceschettiSyndrom selten und helfen, diese beiden Diagnosen zu differenzieren. Schlussfolgerung/Ausblick In diesem Beitrag werden einige syndromale Mikrozephalie-Syndrome vorgestellt. Exemplarisch wird hier deutlich gemacht, dass die Syndromdiagnose zum jetzigen Zeitpunkt immer noch den Blick des erfahrenen Syndromologen erfordert. Ob sich in einigen Jahren das Vorgehen in „exome/genome sequencing first“ ändert und der Syndromologe erst hinterher zur Bewertung der nachgewiesenen Varianten gefordert ist, bleibt abzuwarten. Literatur 1. Al-Dosari MS, Shaheen R, Colak D, Alkuraya FS (2010) Novel CENPJ mutation causes Seckel syndrome. J Med Genet 47: 411-414. Neuropädiatrie in Klinik und Praxis 12. Jg. (2013) Nr. 1 17 #6918_Neuropädiatrie_01-2013.indd 17 09.01.13 13:37 Originalien/Übersichten Abb. 5: Faziale Dysmorphien und Handanomalien bei Patienten mit nachgewiesener de novo EFTUD2-Mutation. A. Patient 2 aus Lines et al. (11) mit nach außen ansteigenden Lidachsen, Mikrotie beidseits und milder Mandibulahypoplasie. B/C. Patientin 3 aus Lines et al. (11) mit nach unten abfallenden Lidachsen, milder Mikrotie, die besonders den oberen Teil des Ohrs betrifft und milder Mandibulahypoplasie. D/E. Patientin 7 aus Lines et al. (11) mit deutlicher Mikrozephalie, nach außen ansteigenden Lidachsen, bilateraler Mikrotie und ausgeprägter Mikrognathie. F. Rechte Hand von Patient 2 aus Lines et al. (11). Der Daumen ist proximal angesetzt. G. Die Hände von Patientin 3 aus Lines et al. (11) zeigen diskret tief angesetzte und hypoplastische Daumen. Die Fotos von Patientin 3 wurden freundlicherweise von Dr. Blanca Gener zur Verfügung gestellt. Alle Eltern haben ihr Einverständnis zur Veröffentlichung der Fotos gegeben. 2. Bernier FP, Caluseriu O, Ng S et al. (2012) Haploinsufficiency of SF3B4, a component of the pre-mRNA spliceosomal complex, causes Nager syndrome. Am J Hum Genet 90(5): 925-33. 3. Dauber A, LaFranchi SH, Maliga Z et al. (2012) Novel microcephalic primordial dwarfism disorder associated with variants in the centrosomal protein ninein. J Clin Endocr Metab 6Aug, 2012. 4. Edery P, Marcaillou C, Sahbatou M et al. (2011) Association of TALS developmental disorder with defect in minor splicing component U4atac snRNA. Science. 332(6026): 240-243. 5. Goodship J, Gill H, Carter J et al. (2000) Autozygosity mapping of a seckel syndrome locus to chromosome 3q22.1-q24. Am J Hum Genet 67: 498–503. 6. Guion-Almeida ML, Zechi-Ceide RM, Vendramini S, Junior AT (2006). A new syndrome with growth and mental retardation, mandibulofacial dysostosis, microcephaly, and cleft palate. Clin Dysmorphol 15: 171-174. 7. He H, Liyanarachchi S, Akagi K et al. (2011) Mutations in U4atac snRNA, a component of the minor spliceosome, in the developmental disorder MOPD I. Science 332: 238-240 8. Kalay E, Yigit G, Aslan Y et al. (2011) CEP152 is a genome maintenance protein disrupted in Seckel syndrome. Nature Genet 43: 23-26. 9. Klingeisen A, Jackson AP (2011) Mechanisms and pathways of growth failure in primordial dwarfism. Genes Dev 25(19): 2011-24 mutation continuum. Orphanet Journal of Rare Diseases 2011, 6: 39-54 13. Majewski F, Goecke T (1982) Studies of microcephalic primordial dwarfism I: approach to a delineation of the Seckel syndrome. Am J Med Genet 12: 7-21. 14. Majewski F, Spranger J (1976) Über einen neuen Typ des primordialen Minderwuchses: der brachymele primordiale Minderwuchs. Monats Kinderheilkd 124: 499-503. 15. Nagy R, Wang H, Albrecht B et al. (2012) Microcephalic osteodysplastic primordial dwarfism type I with biallelic mutations in the RNU4ATAC gene. Clin Genet 82(2): 140-6. 16. Nellhaus G (1968) Head circumference from birth to eighteen years. Pediatrics 41: 106-114 17. Qvist, P., Huertas, P., Jimeno et al. (2011) CtIP mutations cause Seckel and Jawad syndromes. PLoS Genet. 7: e1002310 18. Rauch A, Thiel CT, Schindler D et al. (2008) Mutations in the Pericentrin (PCNT) Gene Cause Primordial Dwarfism. Science 319: 816-819 19. Schienkiewitz A, Schaffrath Rosario A, Dortschy R et al. (2011) German head circumference references for infants, children and adolescents in comparison with currently used national and international references. Acta Paediatr. 100(7): e28-33. 20. Seckel HPG. Bird-headed Dwarfs. Springfield, Illinois, Charles C Thomas, 1960. 10. Krämer N, Morris-Rosendahl DJ, Kaindl AM (2012) Primäre autosomal-rezessive Mikrozephalie (MCPH) Neuropädiatrie in Klinik und Praxis (Faziale Dysmorphien und MRT-Befunde von Patienten mit Seckel-Syndrom und CEP152-Mutationen) 21. Sir J-H, Barr AR, Nicholas AK et al. (2011) A primary microcephaly protein complex forms a ring around parental centrioles. Nature Genet 43: 1147-1153 11. Lines MA, Huang L, Schwartzentruber J et al. (2012). Haploinsufficiency of a spliceosomal GTPase encoded by EFTUD2 causes mandibulofacial dysostosis with microcephaly. Am J Hum Genet 90(2): 369-77. 22. Teber OA, Gillessen Kaesbach G, Fischer S et al (2004). Genotyping in 46 patientswith tentative diagnosis of Treacher Collins syndrome revealed unexpected phenotypic variation. Eur J Hum Genet 12: 879-890. 12. Mahmood S, Ahmad W, Hassan MJ. Autosomal recessive primary microcephaly (MCPH): clinical manifestations, genetic heterogeneity and 23. Voigt M, Fusch C, Olbertz D et al. (2006) Analyse des Neugeborenenkollektivs der Bundesrepublik Deutschland. Geburtsh Frauenheilk 66: 956-970. 24. Wieczorek D, Gener B, González MJ et al. (2009) Microcephaly, microtia, preauricular tags, choanal atresia and developmental delay in three unrelated patients: a mandibulofacial dysostosis distinct from Treacher Collins syndrome. Am J Med Genet A. 149A(5): 837-43. 25. Wieczorek D, von Bernuth H, Hennermann J, Bührer C, Kaindl AM. Diagnostik bei Kindern mit primärer Mikrozephalie. Neuropädiatrie in Klinik und Praxis (Faziale Dysmorphien und MRTBefunde von Patienten mit Seckel-Syndrom und CEP152-Mutationen) 26. Willems M, Genevieve D, Borck G et al. (2010). Molecular analysis of pericentrin gene (PCNT) in a series of 24 Seckel/microcephalic osteodysplastic primordial dwarfism type II (MOPD II). J Med Genet 47: 797-802. 27. Winter-Baraitser Dysmorphology Database, Version 1.0.25, 2012 Danksagung Vielen Dank an die Patienten und deren Familien, die sich mit der Veröffentlichung der klinischen Daten und Fotos einverstanden erklärt haben. Forschungsarbeiten zu diesem Thema wurden finanziell gefördert durch das BMBF (CRANIRARE, 01GM1211B). Korrespondenzadresse Prof. Dr. med. Dagmar Wieczorek Institut für Humangenetik Universitätsklinikum Essen Hufelandstr. 55 D-45122 Essen, Germany Tel./Fax: +49 0201 723 4567/-5900 E-Mail: [email protected] Interessenkonflikt Die Autorin gibt an, dass kein Interessenkonflikt besteht. 18 Neuropädiatrie in Klinik und Praxis 12. Jg. (2013) Nr. 1 #6918_Neuropädiatrie_01-2013.indd 18 09.01.13 13:38 DIACOMIT ® Stiripentol Zur Anwendung beim Dravet-Syndrom (SMEI) Orphan drug-Zulassung Hartkapseln und Pulver mit je 250 mg und 500 mg Diacomit® 250 mg / 500 mg Hartkapseln - Wirkstoff: Stiripentol. Verschreibungspflichtig. Zusammensetzung: arzneil. wirksamer Bestandteil: 1 Hartkapsel Diacomit® 250 mg enth. 250 mg (E)-Stiripentol (Stiripentol); 1 Hartkapsel Diacomit® 500 mg enth. 500 mg (E)-Stiripentol (Stiripentol) Sonstige Bestandteile Hartkaps. Diacomit® 250 mg: Povidon K29/32; Carboxymethylstärke-Natrium (Typ A) entspricht 0,16 mg Natrium pro Hartkaps.; Magnesiumstearat, Gelatine, Titandioxid (E 171); Erythrosin (E 127); Indicogarmin (E 132). Sonstige Bestandteile Hartkaps. Diacomit® 500 mg: Povidon K29/32; Carboxymethylstärke-Natrium (Typ A) entspricht 0,32 mg Natrium pro Hartkaps.; Magnesiumstearat, Gelatine, Titandioxid (E 171) Anwendungsgebiete: Diacomit® ist indiziert für die Anwendung in Verbindung mit Clobazam u. Valproat bei refraktären generalisierten tonisch-klonischen Anfällen bei Patienten mit schwerer myoklonischer Epilepsie im Kindesalter (SMEI, Dravet-Syndrom), deren Anfälle mit Clobazam u. Valproat nicht angemessen kontrolliert werden können. Gegenanzeigen: Überempfindlichkeit gegenüber Stiripentol od. einen der sonst. Bestandteile; Vorgeschichte mit Psychosen in Form deliranter Anfälle. Nebenwirkungen: Sehr häufig: Anorexie; Appetitverlust; Gewichtsverlust (v. a. in Komb. mit Natriumvalproat); Schlaflosigkeit; Benommenheit; Ataxie; Hypotonie; Dystonie. Häufig: Neutropenie (persistierende schwere Neutropenie bildet sich nach Absetzen i. allg. spontan zurück); Aggressivität; Reizbarkeit; Verhaltensstörungen, ablehnendes Verhalten; Übererregbarkeit, Schlafstörungen; Hyperkinesie; Übelkeit; Erbrechen; erhöhte γ-GT (v.a. in Komb. mit Carbamazepin u. Valproat). Gelegentlich: Diplopie (bei Anwendung mit Carbamazepin); Lichtempfindlichkeit; Hautausschlag; Hautallergie; Urtikaria; Müdigkeit. Vorsichtsmaßnahmen b. d. Anwendung: Hemmung v. Cytochrom P450-Isoenzymen: Cave Wechselwirkungen mit anderen Arzneimitteln! Vor Behandlungsbeginn u. alle 6 Monate Blutbild u. Leberfunktion kontrollieren. Bei eingeschränkter Leber- u./od. Nierenfunktion Anwendung nicht empfohlen. Anwendung b. Kindern zwischen 6 Monaten u. 3 Jahren sowie d. Wachstumsrate v. Kindern in Komb. m. Natriumvalproat sorgfältig überwachen. Hinweis: weitere Informationen zu Wechselwirkungen, Dosierungsangaben; Anwendungsempfehlungen sowie Hinweise für Verkehrsteilnehmer enthält die Fach- und Gebrauchsinformation. DESITIN ARZNEIMITTEL GMBH, Weg beim Jäger 214, 22335 Hamburg, www.desitin.de . Stand: Januar 2012 Diacomit® 250 mg / 500 mg Pulver - Wirkstoff: Stiripentol. Verschreibungspflichtig. Zusammensetzung: arzneilich wirksamer Bestandteil: 1 Beutel Diacomit® 250 mg Pulver enth. 250 mg (E)-Stiripentol (Stiripentol); 1 Beutel Diacomit® 500 mg Pulver enth. 500 mg (E)-Stiripentol (Stiripentol) Sonstige Bestandteile Diacomit® 250 mg Pulver: Povidon K29/32; Carboxymethylstärke-Natrium (Typ A) und Carmellose-Natrium, entspricht 0,11 mg Natrium pro Beutel; sprühgetrockn. Glucosesirup (500 mg pro Beutel); Aspartam (E 951) 2,5 mg pro Beutel; Tutti-Frutti-Aroma (enth. 2,4 mg Sorbitol pro Beutel); Hyetellose; Erythrosin (E 127); Titandioxid (E 171). Sonstige Bestandteile Diacomit® 500 mg Pulver: Povidon K29/32; Carboxymethylstärke-Natrium (Typ A) und Carmellose-Natrium, entspricht 0,22 mg Natrium pro Beutel; sprühgetrockn. Glucosesirup (1000 mg pro Beutel); Aspartam (E 951) 5 mg pro Beutel; Tutti-Frutti-Aroma (enthält 4,8 mg Sorbitol pro Beutel); Hyetellose; Erythrosin (E 127); Titandioxid (E 171). Warnhinweise: Diacomit® 250 mg / 500 mg Pulver enthält Aspartam u. kann daher für Menschen mit Phenylketonurie schädlich sein; Pat. mit Glucose-Galactose-Malabsorption sollten Diacomit® 250 mg / 500 mg Pulver aufgrund seines Gehaltes an Glucose nicht einnehmen; aufgrund des Gehaltes an Sorbitol sollten Pat. mit hereditärer Fructoseintoleranz Diacomit® 250 mg / 500 mg n i c h t e i n n e h m e n . H i n w e i s : I n f o r m a t i o n e n z u N e b e n w i r k u n g e n , Gegen a n z e i g e n s i e h e o b e n ; I n f o r m a t i o n e n z u W e c h s e l w i r k u n g e n , Dosierungsangaben; Anwendungsempfehlungen sowie Hinweise für Ve r ke h r s t e i l n e h m e r e nt h ä l t d i e Fa c h - u n d Gebrauchsinformation. DESITIN ARZNEIMITTEL GMBH, Weg beim Jäger 214 , 22335 Hamburg , www.desitin.de Stand: Januar 2012 #6918_Neuropädiatrie_01-2013.indd 19 09.01.13 13:38 Originalien/Übersichten Mikrozephalie und angeborene Immundefekte S. KENZEL1, 2, 3, K. EIRICH4, D. SCHINDLER4, H. V. BERNUTH1, 5 1 Klinik für Pädiatrie mit Schwerpunkt Pneumologie und Immunologie Charité – Universitätsmedizin Berlin, Campus Virchow-Klinikum, Augustenburger Platz 1, 13353 Berlin 2 Berlin-Brandenburg Centrum für Regenerative Therapien, Charité – Universitätsmedizin Berlin, Campus Virchow-Klinikum, Augustenburger Platz 1, 13353 Berlin 3 Berlin-Brandenburg School for Regenerative Therapies, Charité – Universitätsmedizin Berlin, Campus Virchow-Klinikum, Augustenburger Platz 1, 13353 Berlin 4 Institut für Humangenetik, Biozentrum, Universität Würzburg, Theodor-Boveri-Weg, 97074 Würzburg 5 Labor Berlin – Fachbereich Immunologie Zusammenfassung Neben den im vorangegangenen Artikel vorgestellten Ursachen für primäre Mikrozephalie sind Ursachen einer Mikrozephalie bekannt, die mit einem angeborenen Immundefekt einhergehen. Gemeinsame pathophysiologische Grundlage der Kombination aus „Mikrozephalie und Immundefekt“ ist dabei meist eine Störung im Erhalt der DNA-Integrität. Eine verminderte genomische Stabilität kann durch verschiedene vererbte Defekte verursacht werden: Mit Mikrozephalie in Verbindung gebracht werden vor allem Störungen der Doppelstrang- oder Replikations-abhängigen DNA-Reparatur wie des Non-Homologous-End-Joinings (NHEJ) und der Homologen Rekombination (HR), das Bloom Syndrom, Defekte der Telomerintegrität (Dyskeratosis congenita), Defekte der DNA-Replikation (M. Schimke), Defekte der DNA-Entwindung (MCM4-Defekt) und die Immundefekt Centromerinstabilität Faciale Anomalien (ICF) Syndrome 1 und 2. Das menschliche adaptive Immunsystem erkennt vermutlich 1012 – 1018 verschiedene Antigene. Diese Fähigkeit geht auf die klonale Bildung von Zellen zurück, die jedes dieser Antigene mit ihrem (TZell-) Rezeptor oder dem von Ihnen sezernierten Antikörper spezifisch erkennen können. Diese Vielfalt der spezifischen Antigenerkennung wird durch die sogenannte V(D)J-Rekombination erreicht. Hierbei werden an prädisponierten Stellen der für T-Zell-Rezeptoren und Antikörper kodierenden DNA Doppelstrangbrüche eingefügt (durch die Enzyme RAG1 und RAG2) und die entstehenden V, D und J Bruchstücke per Zufall mittels NonHomologous-End-Joining (NHEJ) wieder zusammengefügt (u. a. beteiligte Moleküle: DNA-PKcs, Artemis, DNA-Ligase IV, Cernunnos/XLF). Neben einer Mikrozephalie mit Immundefekt durch verminderte DNA-Integrität/erhöhte genomische Instabilität sind einzelne Entitäten bekannt, die sich nicht auf eine gemeinsame pathophysiologische Störung zurückführen lassen [22q11.2 Deletionssyndrome, M. Cohen, Glykolisierungsdefekte/Congenital Disorders of Glycosylation (verschiedene CDG-Syndrome und Leukozytenadhäsionsdefekt Typ II) und MECP2 Duplikationssyndrom]. Dieser Artikel soll einen Überblick über über Krankheitsbilder und assoziierte Syndrome, die mir Mikrozephalie und Immundefekt einhergehen geben und das klinische Bewusstsein dahingehend schärfen. Schlüsselwörter Mikrozephalie – angeborene Immundefekte – DNA-Integrität – genomische Instabilität – Radiosensitivität – Non-homologous-End-Joining (NHEJ) – Homologe Rekombination (HR) – Telomerasedefekte – Fanconi-Anämie Microcephaly and primary immunodeficiency Abstract In addition to the causes of primary microcephaly presented in the preceding, microcephaly can occur in association with congenital immunodeficiency. The common pathophysiological basis of “mi- crocephaly and immunodeficiency” is frequently due to disturbed preservation of DNA integrity. Decreased genomic stability may be caused by several inherited defects: disorders of the double-stranded or replication-dependent DNA repair, repair such as the Non-Homologous End Joining (NHEJ) and Homologous Recombination (HR), Bloom syndrome, defects of telomere integrity (dyskeratosis congenita), defects of DNA replication (M. Schimke), defects of DNA untangling (MCM4-defect) and the immunodeficiency-centromeric instability-facial anomalies (ICF) syndromes type 1 and 2. The human adaptive immune system recognizes approximately 1012 – 1018 different antigens. This ability is ensured by the generation of cellular clones, that can recognize specific antigens by their surface (T-cell) receptor or secreted antibody. Clonal diversity of antigen-specific recognition is achieved by the so-called V(D)J recombination. Within this process DNA double strand breaks are inserted at predisposed locations of the gene coding for the T-cell receptor or antibody (by the enzymes RAG1 and RAG2) and the resulting V, D and J fragments are randomly realigned by NHEJ (participating molecules: DNA-PKcs, Artemis, DNA ligase IV, Cernunnos/XLF). In addition to microcephaly with immunodeficiency due to diminished DNA integrity/increased genomic instability individual entities with microcephaly and immunodeficiency are known, which can not be traced back to a common pathophysiological disorder [22q11.2 deletion syndrome, M. Cohen, Congenital Disorders of Glycosylation (CDG) (e. g. leukocyte adhesion deficiency Type II), 20 Neuropädiatrie in Klinik und Praxis 12. Jg. (2013) Nr. 1 #6918_Neuropädiatrie_01-2013.indd 20 09.01.13 13:38 Originalien/Übersichten Entität Klinisches Bild Humorale Immunität Zelluläre Immunität Zelluläre Funktionsdiagnostik Defekte der homologen Rekombination Ataxia teleangiectatika OMIM #208900: AR-ATM • • • • • Mikrozephalie Ataxie Teleangiektasien Pneumonie, Sinusitis Lymphome und Karzinome IgM ↑ IgG ↓ IgA ↓ Impfantwort ↓ TlowBlow(S)CID CD3↓ CD19↓ CD4/CD45RA↓ CD4/CD45R0↑ ↑g/d T-Zellen • Material: Lymphozyten Erhöhte Rate an spontanen und strahleninduzierten Doppelstrangbrüchen (Mitose) Strahleninduziert vermehrter G2-Arrest Telomerlängenverkürzung (sekundär) Translokation 7/14 Oligoklonales TCRVβ Profil Nijmegen-breakage-Syndrom OMIM #252269: AR-NBS • • • • • • • Mikrozephalie Entwicklungsverzögerung Intrauteriner Minderwuchs Kleinwuchs Vogelähnliche Gesichtsdysmorphie Erhöhte Infektionsneigung B Zell-Lymphome IgM ↑ IgG ↓ (in 30%) IgA↓ IgG2↓ IgG4↓ Impfantwort ↓ Normal in 10% CD3/CD4↓ CD8 nicht erniedrigt • Material: Lymphozyten Erhöhte Rate an spontanen und strahleninduzierten Doppelstrangbrüchen (Mitose) Strahleninduziert vermehrter G2-Arrest Telomerlängenverkürzung (sekundär) Translokation 7/14 Oligoklonales TCRVβ-Profil Defekte des Non-homologous-end-joining DNA-Ligase-IV-Defekt OMIM #606593: AR-LIG4 • • • • • • • Mikrozephalie Entwicklungsverzögerung Vogelähnliche Gesichtsdysmorphie Kleinwuchs Path. Infektneigung T-ALL EBV-ass. Hodgkin Lymphome IgM ↑ IgG ↓ IgA ↓ Impfantwort ↓ T-B-(S)CID oder TlowBlow(S)CID CD3↓ CD4/CD45RA↓ CD4/CD45R0↑ CD19↓ • Material: Fibroblasten (Hautbiopsie) Erhöhte Rate an strahleninduzierten Doppelstrangbrüchen (Mitose) Strahleninduziert vermehrter G2-Arrest Fehlende TRECs • Material: Lymphozyten Erhöhte Rate an strahleninduzierten Doppelstrangbrüchen (Mitose) Strahleninduziert vermehrter G2-Arrest Oligoklonales TCRVβ-Profil Cernunnos Defekt OMIM #611291: AR-NHEJ1 • • • • • • • Mikrozephalie Vogelähnliche Gesichtsdysmorphie Entwicklungsverzögerung Kleinwuchs Erhöhte Infektionsneigung Skelettfehlbildungen Ggf. B-Zell-Lymphome IgM ↑ IgG ↓ IgA ↓ Impfantwort ↓ TlowBlow(S)CID CD3↓ CD4/CD45RA↓ CD4/CD45R0↑ CD19↓ • Material: Fibroblasten (Hautbiopsie) Erhöhte Rate an strahleninduzierten Doppelstrangbrüchen (Mitose) Strahleninduziert vermehrter G2-Arrest • Material: Lymphozyten Erhöhte Rate an strahleninduzierten Doppelstrangbrüchen (Mitose) Strahleninduziert vermehrter G2-Arrest Oligoklonales TCRVβ-Profil Fehlende TRECs Fanconi Anämie und Bloom Syndrom Fanconi Anämie OMIM #227650 OMIM #607139: AR-FANCA OMIM #300515: XR-FANCB OMIM #613899: AR-FANCC OMIM #600185: AR-FANCD1 OMIM #613984: AR-FANCD2 OMIM #613976: AR-FANCE OMIM #613897: AR-FANCF OMIM #602956: AR-FANCG OMIM #611360: AR-FANCI OMIM #609054: AR-FANCJ OMIM #608111: AR-FANCL OMIM #609644: AR-FANCM OMIM #610832: AR-FANCN OMIM #602774: AR-FANCO OMIM #613951: AR-FANCP • • • • • • • • • • • • • • • Daumen- und Radiusfehlbildungen Mikrozephalie Mikrophthalmie Mikrosomie niedriges Geburtsgewicht Fehlbildungen der Augen Café-au-lait-Flecken Herzfehlbildungen Hypogonadismus Hypothyreose Entwicklungsverzögerung Innenohrschwerhörigkeit Diabetes mellitus Knochenmarksversagen Myelodysplasie variabel Immundefekt im Rahmen des Myelodysplastischen Syndroms (MDS) • Material: Lymphozyten Spontan erhöhte Chromosomenbrüchigkeit Induktion eines G2-Arrestes durch Mitomycin C, Diepoxybutan und Cisplatin Erhöhte Apoptoserate Sauerstoffinduzierte Zellzyklusstörung und Wachstumsversagen • Material: Fibroblasten (Hautbiopsie) Induktion eines G2-Arrestes durch Mitomycin C, Diepoxybutan und Cisplatin Sauerstoffinduzierte Zellzyklusstörung und Wachstumsversagen Bloom-Syndrom OMIM #210900: AR-RECQL3 • • • • • • • Dolichocephaly Kleinwuchs intrauterin und postnatal Teleangiektasien Café-au-lait-Flecken Minderwuchs Vogelähnliche Gesichtsdysmorphie Leukämie, Lymphome, Karzinome IgG ↓ IgM ↓ IgA ↓ CD3↓ Normales TCRVß • Material: Lymphozyten Induktion eines G2-Arrestes durch Mitomycin C, Diepoxybutan, Cisplatin Strahleninduziert vermehrter G2-Arrest Telomerlängenverkürzung Erhöhte Schwesterchromatiden-Austauschrate z.T. reduzierte Lymphozytenproliferation z.T. verminderte CD4+ und CD8+ T Zell-Antwort auf CD3-abhängige Zellaktivierung Telomer-Integritäts-Defekte Dyskeratosis congenita OMIM #305000: XL-DKC1 OMIM #127550: AD-TERC OMIM #613989: AR-TERT OMIM #613990: AD-TINF2 OMIM #224230: AR-NOLA3 OMIM #613987: AR-NOLA2 OMIM #613988: AR-WRAP53 OMIM #224230: AR • • • • • • • • • • • IgG ↓ IgA ↓ IgM ↓ CD19↓ CD56/CD16↓ CD4↓ CD4/CD45RA↑ CD4/CD45R0↓ Neutropenie • Material: Lymphozyten Erhöhte Chromosomenbrüchigkeit durch Mitomycin C und Diepoxybutan Verzögerter Eintritt in M-Phase (G2/M checkpoint) Komplementationsanalysen Hoyeraal-HreidarssonSyndrom OMIM #300240: XR-DKC1 • Wie Dyskeratosis congenita, jedoch IgG ↓ zusätzlich„schwere Verlaufsform der IgA ↓ IgM ↓ Dyskeratosis congenita“ • Neonataler Beginn • Intrauterine Wachstumsverzögerung CD19↓ CD56/CD16↓ CD4↓ CD4/CD45RA↑ CD4/CD45R0↓ Neutropenie • Material: Lymphozyten Erhöhte Chromosomenbrüchigkeit durch MMC und DEB Verzögerter Eintritt in M-Phase (G2/M checkpoint) Mikrozephalie Mentale Retardierung Kleinwuchs Zerebelläre Hypoplasie Ataxie Hypopigementierung Nageldystrophie Alopezie Gingivahyperplasie Xanthome Nicht-infektiöse chronische Durchfälle („GvHD like disease“ mit vermehrter Apoptose mucosaler Enterozyten) • Lungenfibrose • Leberfibrose • Tumorerkrankungen Neuropädiatrie in Klinik und Praxis 12. Jg. (2013) Nr. 1 21 #6918_Neuropädiatrie_01-2013.indd 21 09.01.13 13:38 Originalien/Übersichten Revesz-Syndrom OMIM #268130: AD-TIN2 • • • • • • • • Bilaterale exsudative Retinopatie Knochenmarkshypoplasie Nageldystrophie Wachstumsretardierung Zerebelläre Hypoplasie Nageldystrophie Pigmentierungsstörungen der Haut orale Leukoplakie IgG ↓ IgA ↓ IgM ↓ CD19↓ CD56/CD16↓ CD4↓ CD4/CD45RA↑ CD4/CD45R0↓ Neutropenie • Material: Lymphozyten Erhöhte Chromosomenbrüchigkeit durch MMC und DEB Verzögerter Eintritt in M-Phase (G2/M checkpoint) Komplementationsanalysen Zentromer-Instabilitätsdefekte ICF Typ 1 und Typ 2 OMIM #602900: AR-DNMT3B OMIM #614069: AR-ZBTB24 IgM ↓ • Gesichtsdysmorphie (flache Nasenwurzel, Epikanthus, Hypertelorismus, IgG ↓ IgA ↓ Mikrognathie) • mentale Retardierung • erhöhte Anfälligkeit für Infektionen der Atemwege, des Gastrointestinaltraktes sowie der Haut • Kardiale Fehlbildungen • Café-au-lait-Flecken • Muskuläre Hypotonie • Gedeihstörung CD19↓ oder ↑ • Material: Lymphozyten CD3↓ Hypomethylierung der Chromosomen 1, 9, 16 Typ 2: Variante der PelgerZentromerinstabilität nach Stimulation mit PHA Huëtschen-Kernanomalie Typ 2: Pelger-Huëtsche-Kernanomalie Sonstige IgG teilweise↓ Immunoossäre Dysplasie Typ • Mikrozephalie • Kleinwuchs bei Skelettanomalien: Schimke u.a. Lendenlordose↑, breite NasenOMIM #242900: AD/AR-SMARwurzel, prominente Nasenspitze, CAL1 abgeflachte Wirbelkörper, kleines Becken, Mikrodontie, kurzer Hals, kurzer Stamm, Femur-/Pfannendachhypoplasie • Steroidrefraktäre, fokal-segmentale Glomerulosklerose mit konsekutiv chronischem Niereninsuffizienz • Rez. Schlaganfälle • Erhöhte Infektanfälligkeit MCM4-Defekt OMIM #609981 IgG2 teilweise↓ • Mikrozephalie • NK-Zell-Defekt mit erhöhter Anfälligkeit für virale Infektionen • Nebenniereninsuffizienz • Kleinwüchsigkeit 22q11-Deletionssyndrome OMIM #188400: AR-TBX1 OMIM #192430: AR-TBX1 • Mikrozephalie • Herzfehler • Milde Dysmorphie mit Retrognatie, pominenter Nase, kleinen Ohren, kleiner Mund • Thymushypoplasie mit konsekutivem T-Zelldefekt • Gaumenspalte • Hypokalzämie • Lernbehinderung variabel CD3↓ • Material: Lymphozyten CD4↓ Verminderte Lymphozytenproliferation auf Mitogene CD4+CD45RA+↓ CD8 selten ↓ γ/δ-CD4↑ CD4+CD45RA+↓ CD4/CD8 normal bis erniedrigt Neutropenie CD16+CD56+ ↓ CD16hi/CD16dim↑ • Material: Fibroblasten (Hautbiopsie) spontaner und durch Aphidicolin verstärkter G2-Arrest • Material: Lymphozyten Erhöhte Rate an spontanen und strahleninduzierten Doppelstrangbrüchen (Mitose) Strahleninduziert vermehrter G2-Arrest Telomerlängenverkürzung (sekundär) Translokation 7/14 oligoklonales TCRVβ-Profil CD3↓ CD4↓ CD4+CD45RA+↓ • Material: Lymphozyten Reduzierte Lymphozytenproliferation auf Antigene reduzierte TRECs Tab. 1: Syndrome, die mit Mikrozephalie, Immundefekt und auch erhöhter Sensitivität gegenüber ionisierender Strahlung einhergehen und auf Defekte im NHEJ-Signalweg zurückgeführt werden können and MECP2 duplication syndrome]. The following article gives an overview over syndromes presenting with immunodeficiency associated with microcephaly and aims to raise clinical awareness for these diseases. Keywords Microcephaly – primary imunodeficiency – DNA integrity – genomic instability – radiosensitivity – non-homologous end joining – homologous recombination – telomerase dysfunction – Fanconi anemia. Bibliography Neuropaediatrie 2013; 12: 20-37, © Schmidt-Roemhild-Verlag, Luebeck, Germany: ISSN 1619-3873; NLM ID 101166293; OCoLc 53801270 DNA-Reparatur-Defekte DNA-Doppelstrangbrüche (DNA-DSB) treten im normalen Zellzyklus eher selten auf. Physiologischerweise entstehen sie während der Meiose und der V(D)JRekombination im Rahmen der B- und T-Zell-Reifung (151). Aber auch exogene Noxen wie ionisierende Strahlung können DNA-DSB induzieren. Zur Korrektur dieser Defekte sind Reparaturmechanismen essentiell: (i) das Non-Homologous-End-Joining (NHEJ) und die Homologe Rekombination (HR) (117). In beiden Fällen wird in Folge des Defektes eine komplexe Kaskade in Gang gesetzt, die zum Zellzyklusarrest führt und entsprechende Reparaturmechanismen bzw. den Zelltod initiiert. Defekte innerhalb dieser Signalkaskaden führen in aller Regel zu einem klinischen Phänotyp, der durch neurologische und immunologische oder hämotologische Auffälligkeiten, aber auch weitere assoziierte Symptome charakterisiert ist (59). Während vermutet wird, dass neurologische Auffälligkeiten und somatische Fehlbildungen primär auf DNA-Schäden während der Embryonalentwicklung zurückzuführen sind, resultieren immunologische oder hämatologische Auffälligkeiten aus der hohen Proliferationskapazität des hämatopoietischen Systems und und werden daher oft erst zu einem späteren Zeitpunkt symptomatisch. Da neben den exogenen Noxen auch die für T- und BZellen essentielle V(D)J-Rekombination zu DNA-DSB führt, sind bei Reparaturdefekten diese Zellen in zweifacher Hinsicht prädisponiert für Funktionsdefizite, genomische Instabilität und neoplastische Entartung. Tabelle 1 fasst 22 Neuropädiatrie in Klinik und Praxis 12. Jg. (2013) Nr. 1 #6918_Neuropädiatrie_01-2013.indd 22 09.01.13 13:38 Originalien/Übersichten diejenigen Syndrome zusammen, die mit Mikrozephalie, Immundefekt und auch erhöhter Sensitivität gegenüber ionisierender Strahlung einhergehen und auf Defekte im NHEJ-Signalweg zurückgeführt werden können. Auf Grund der klinischen Gemeinsamkeiten werden diese Erkrankungen auch unter dem Begriff „kombinierter Immundefekt (CID) mit Mikrozephalie, Kleinwuchs und erhöhter Strahlensensitivität“ zusammengefasst. 1. Erkrankungen des NonHomologous-End-Joining (NHEJ) und der Homologen Rekombination (HR) 1.1 Ataxia teleangiectatica Die Ataxia teleangiectatica (=AT, LuisBar-Syndrom, OMIM #208900)), die mit dem markanten klinischen Bild, der im Kleinkindesalter einsetzenden zerebellären Ataxie einhergeht, wurde als erste Erkrankung aus dieser Gruppe der DNAReparaturdefekt-Syndrome 1975 durch Taylor et al. funktionell definiert (163). Sie wird autosomal-rezessiv mit einer Inzidenz von etwa 1:40.000 vererbt. Zugrunde liegen dabei biallelische Mutationen in dem für das ATM (Ataxia teleangiectasia, mutated) -Protein kodierenden Gen, das auf Chromosom 11q23 lokalisiert ist (142). Die Mutationen einer großen Anzahl in Deutschland lebender AT-Patienten wurden von Sandova et al. (133) und Demuth et al. (34) analysiert. Das ATM-Protein ist wesentlich an der Zellzykluskontrolle und Koordinierung des Zellzyklusarrestes DNADoppelstrangbrüchen (DNA-DBS) beteiligt (90). Bei Betroffenen ist das Auftreten von zerebellärer Ataxie und Teleangiektasien vor dem fünften Lebensjahr quasi pathognomonisch (164). Charakteristisch ist insbesondere vermehrtes Stolpern bei Kleinkindern, die das freie Laufen bereits beherrschten, und eine Dysmetrie. Die Ataxie, zunächst rumpfbetont, später auch die Extremitäten betreffend, geht meist der Entwicklung von Teleangiektasien voraus. Auf Grund einer progressiven neurologischen Degeneration treten bei >90% aller AT-Patienten Chorea oder Dystonie auf und Sehnenreflexe verschwinden vor dem achten Lebensjahr fast vollständig. Eine okkuläre Apraxie ist häufig (184). Bereits im Teenageralter benötigen betroffene Patienten meist intensive Hilfe bei der Bewältigung von Alltagstätigkeiten wie dem An- und Auskleiden, der Körperpflege und dem Essen. Die kognitive Entwicklung dieser Patienten ist in aller Regel normal, der Schulbesuch aus intellektueller Perspektive problemlos möglich. Für eine orientierende Diagnostik wird gerne die erhöhte zelluläre Radiosensitivität herangezogen. Neben den neurologischen Auffälligkeiten kann die AT mit einer deutlich erhöhten Anfälligkeit für sinopulmonale Infekte einhergehen (113, 132). Auf zellulärer immunologischer Ebene sind dabei verschieden schwer ausgeprägte Defekte der Lymphozytenreifung im Sinne kombinierter Immundefekte entsprechend eines TlowBlow(S)CID mit absolut erniedrigten CD3+-T-und CD19+-B-Zellen bei relativ erhöhten Werten von γ/δ und CD45RO+ T-Zellen nachweisbar. Die Antwort auf bakterielle Stimuli und die Impfantwort auf Polysaccharid-Vakzine ist meist reduziert (132). Auf Grund des eingeschränkten NHEJ sind die Prozesse des T-Zell-Rezeptor-Rekombinationsprozesses gestört, sodass ein oligoklonales Vß-T-Zell-Rezeptor-Profil entsteht (62). Die zellulären Defekte führen darüber hinaus zu einem eingeschränkten Antikörperklassenwechsel, sodass bei niedrigen Spiegeln für IgG und IgA der IgM-Spiegel häufig erhöht ist. Bemerkenswerterweise sind trotz der teilweise laboranalytisch schweren Immundefekte und der signifikant erhöhten Rate an sinopulmonalen Infektionen systemische oder opportunistische Infektionen bei AT-Patienten eher die Ausnahme. Im Rahmen ihres DNA-Reparaturdefekts und ihrer genomischen Instabilität innerhalb der lymphozytären Reihe haben ATPatienten zusätzlich ein deutlich erhöhtes Risiko für die Entwicklung eines malignen Lymphoms, dessen Erkrankungsgipfel am Beginn der zweiten Lebensdekade liegt. Heterozygote Mutationen können zu einem variablen klinischen Bild (Brustkrebsdisposition, verstärkte Reaktionen bei Strahlentherapie) führen oder völlig asymptomatisch bleiben (104). 1.2 Nijmegen-Breakage-Syndrom Die zweite große Krankheitsentität in dieser Gruppe ist das 1981 erstmalig publizierte Nijmegen-Breakage-Syndrom (NBS, NBN-Defekt, OMIM #252269) (178). Auf Grund einer gewissen klinischen Ähnlichkeit mit der AT wurde es zunächst als eine Variante der AT verstanden (130, 179). Ursächlich für diese Erkrankung sind Mutationen im NBN-Gen, das auf Chromosom 8q21 lokalisiert ist und für Nibrin, ein im DNA-Reparatur- und Zell-Zyklus multifunktionales Protein, kodiert (130). In einer tschechischen Studie, in der 67 Patienten mit Mikrozephalie unklarer Genese systematisch auf NBS untersucht wurden, wurde in 13% aller Patienten ein NBS diagnostiziert (145). Die betroffenen Patienten zeigen bereits pränatal eine starke intrauterine Wachstumsverzögerung, die in etwa 75% der Fälle mit einer kongenitalen Mikrozephalie einhergeht (28, 36). Postnatal imponiert eine ausgeprägte Gesichtsdysmorphie mit prominentem Mittelgesicht, zurückgetretener Stirn, Agnathie, Mikrognathie oder Retrognathie, großen, tief sitzenden Ohren und nach lateral ansteigenden Lidspalten („vogelähnliches Gesicht“) als Ausdruck eines stark verminderten Wachstums des Gehirns und des Hirnschädels. Dieser morphologische Phänotyp ist innerhalb der ersten Lebensmonate deutlich progredient und wird begleitet von proportioniertem Kleinwuchs entlang der 10. Perzentile (29). Etwa die Hälfte der Kinder zeigt bis zur Einschulung eine normale Intelligenz, weitere 40% eine leichte und nur 10% eine mittelschwere mentale Retardierung. Bis zum zehnten Lebensjahr ist ein langsam fortschreitender Verlust kognitiver Fähigkeiten bis hin zu einer mittelgradigen Intelligenzminderung bei der Mehrzahl der Patienten zu beobachten. Des Weiteren leiden NBS-Pateinten unter dermatologischen Auffälligkeiten im Sinne einer deutlich erhöhten Sonnenempfindlichkeit und stammbetonten Café-au-lait- oder Vitiligo-Flecken und Teleangiektasien, die jedoch nicht so prominent und pathognomonisch erscheinen wie bei AT. Auch zeigen NBS-Patienten in der Regel keine Ataxie oder andere neurologische Symptome. Organische Fehlbildungen können insbesondere die Milz, den Thymus und den Urogenitaltrakt betreffen. Immunologische Auffälligkeiten umfassen eine zelluläre und humorale Immundefizienz mit einer deutlich erhöhten Anfälligkeit für sinopulmonale Infekte. Dabei spielen Defekte im Antikörperklassenwechsel, die häufig mit erhöhten IgM und niedrigen IgG (insbesondere IgG2 und Ig4), IgE und IgA Spiegeln einhergehen, eine entscheidende Rolle. Bemerkenswerterweise sind agammaglobulinämische Verläufe ebenso möglich wie völlig normwertige IgSerumspiegel. Auf zellulärer Ebene findet sich eine moderate T- und B- Lymphopenie. Die Lymphopenie ist klassischerweise durch eine Reduktion der CD4+ T-Zellen bei normalen oder ebenfalls erniedrigten Frequenzen für CD3+CD8+ T-Zellen charakterisiert. Zusätzlich fehlen innerhalb des CD4+ T-Zellkompartiments naive, CD45RA exprimierende T-Zellen fast vollständig, während das CD8 Kompartiment von dieser Veränderung nicht betroffen ist (36, 106). Michalkiewicz et al. publizierten 2003, dass CD8+ T-Zellen von NBS-Patienten im Vergleich zu Gesunden eine deutlich niedrigere Expression von CD8 (CD8low) und zusätzlich (wie bei AT) eine signifikant Neuropädiatrie in Klinik und Praxis 12. Jg. (2013) Nr. 1 23 #6918_Neuropädiatrie_01-2013.indd 23 09.01.13 13:38 Originalien/Übersichten erhöhte Frequenz von natürlichen Killer (NK)-Zellen und γ/δ T-Zell-Rezeptor (TCR) exprimierenden T-Zellen aufweisen (106). Möglicherweise sind letztere Phänomene Ausdruck einer mangelhaften Differenzierung des Immunsystems. Letztendlich ist die erhöhte Inzidenz von Malignomen (ca. 50%) eine meist prognoselimitierende Komplikation. Lymphome, insbesondere B-Zell-Lymphome, stellen die häufigste Tumorentität bei NBS-Patienten dar (37, 105, 179). 1.3 Ataxia-teleangiectaticaähnliche und NijmegenBreakage–ähnliche Syndrome Neben der klassischen AT und dem klassischen NBS ist von wenigen Patienten mit AT (MRE11A-Defekt)- und NBS (RAD50Defekt)-ähnlichen Syndromen (OMIM #604391) berichtet worden (162, 177). Dem AT-ähnlichen Syndrom (AT-like disease) liegen hypomorphe Mutationen im MRE11A-Gen zugrunde, dessen Produkt Bestandteil des MRN-Komplexes ist (93). Klinisch zeigen diese Patienten ein der klassischen AT sehr ähnliches Krankheitsbild, wobei die neurologischen Zeichen später einsetzen und eine deutlich langsamere Progredienz aufweisen. Dennoch zeigen einige dieser Kinder eine Mikrozephalie bei normaler Intelligenz (100). Teleangiektasien treten nicht auf und auch der immunologische Phänotyp ist vergleichsweise mild ausgeprägt. Lediglich bei einigen Patienten ist eine reduzierte Antwort auf Pneumokokkenpolysaccharide beschrieben (162). Das Nijmegen Breakage – ähnliche Syndrom (NBS-like disease) ist dem klassischen NBS klinisch sehr nah verwandt. Ihm zugrunde liegen hypomorphe Mutationen im RAD50-Gen. Während die neurologischen und dermatologischen Charakteristika in klinisch abgeschwächter Form zu finden sind, ist die Immunität kaum beeinträchtigt und Malignome sind bei der einzigen bisher berichteten Patientin bislang nicht aufgetreten (177). 1.4 RIDDLE-Syndrom Ein weiteres, der AT verwandtes Syndrom ist das 2007 beschriebene RIDDLE Syndrom (OMIM #611943) (153). Der Name setzt sich als Akronym aus den klinisch führenden Charakteristika dieses bislang einzigen Patienten zusammen: Radiosensitivität, Immundefekt (erniedriges IgG und IgM), Dysmorphie und Lerndefizit bezüglich kognitiver und motorischer Fähigkeiten. Als molekulargenetische Ursache wurde ein Defekt in der Rekrutierung des Proteins TP53BP1, ein Protein, das wesentlich in die DNA-Reparatur involviert ist, zu Stellen mit DNA-DSB beschrieben. Eine Mutation konnte nicht nachgewiesen werden, sodass die Vermutung eines TP53BP1 übergeordneten Defektes nahe liegt (153, 154). 1.5 DNA-Ligase-IV-Defizienz Der erste Patient mit einer DNA-Ligase-IV-Defizienz wurde 1990 beschrieben (126). Klinisch auffällig wurde dieser 14-jährige Junge zunächst durch eine akute lymphatische Leukämie. Im Rahmen einer unkontrollierbaren Reaktion auf die nach MRC-UKALL-S-Protokolls durchgeführte Strahlentherapie verstarb der Junge 8 Monate nach Therapiebeginn infolge einer schweren Zytopenie und desquamativen Reaktion, die in eine strahleninduzierte Enzephalopathie mündete. Obwohl bereits zu diesem Zeitpunkt die Ursache für den Krankheitsverlauf, eine erhöhte Strahlensensitivität erkannt wurde, dauerte es 9 Jahre, bis die genetische Diagnose, eine Mutation im DNA-Ligase IV-(LIGIV)-Gen auf Chromosom 13q33, gestellt werden konnte (116). In der nachfolgenden Charakterisierung weiterer Patienten mit DNA-Ligase-IV-Defizienz konnten Mikrozephalie, Kleinwuchs und eine globale Entwicklungsverzögerung sowie weitere an das NBS erinnernde Symptome als klinische Charakteristika beschrieben werden, die im allgemeinpädiatrischen Untersuchungsbefund Anlass zur weiteren Diagnostik geben sollten (14, 20). Eine beeinträchtigte Fähigkeit zur Schaffung von Immundiversität, die sich in einer SCID-Variante mit charakteristischem immunologischen Phänotyp äußern kann, führt zum Bild eines rudimentären Immunsystems (46). Immunologisch geht die DNA-Ligase-IV-Defizienz häufig mit einer schweren Lymphopenie und Hypogammaglobulinämie (mit erhöhtem IgM bei erniedrigtem IgG, IgA und IgE) einher, die ursächlich für rezidivierende, insbesondere bronchopulmonale Infekte ist. Auf zellulärer Ebene zeigt sich dabei ein radiosensitiver T-B-(S)CID oder TlowBlow(S)CID mit charakteristischerweise vermehrt reifen Memory-CD4+CD45ROT-Zellen bei verminderten Frequenzen naiver CD4+CD45RA+-Lymphozyten (47). Alle Patienten haben ein deutlich erhöhtes Risiko für akute lymphatische Leukämien (ALL) und EBV-assoziierte NonHodgkin-Lymphome. Allerdings ist der klinische Phänotyp sehr variabel. Manche Patienten mit DNA-Ligase-IV-Defekt weisen ein progredientes Knochenmarkversagen auf, das zur Transfusionsabhängigkeit oder zur Notwendigkeit einer häma- topoetischen Stammzelltransplantation führen kann (66). 1.6. Cernunnos-XLF-NHEJ1Defizienz-Syndrom Ebenso wie die DNA-Ligase-IV-Defizienz geht auch das Cernunnos-XLFNHEJ1-Defizienz-Syndrom mit einem Defekt im NHEJ und der V(D)J-Rekombination einher. Das Cernunnos-Protein (= XLF, XRCC4-like-Faktor) interagiert mit dem XRCC4-Ligase-IV-Komplex und wird durch NEHJ1 auf 2q35 kodiert. Im Jahre 2006 wurden die ersten 6 Patienten mit diesem Syndrom beschrieben (34, 35). Diese Patienten zeigten einen klinischen und immunologischen Phänotyp wie er von DNA-Ligase-IV-Defizienz-Patienten bekannt war, wobei zusätzlich skelettale Fehlbildungen, insbesondere Handdeformitäten, auffällig waren (19). Assoziierte Lymphome wurden bislang ausschließlich in retrospektiven Analysen von B-ZellLymphomen beschrieben (36). Dutrannoy et al. berichteten über 5 weitere Patienten mit Cernunnos-Syndrom und ihre Mutationen im NHEJ1-Gen (41). Danach ergibt sich für Cernunnos-Patienten ein NBSähnliches klinisches Bild mit Mikrozephalie, Entwicklungsverzögerung und schwerer Immundefizienz infolge einer T- und B-Zell-Lymphopenie sowie ausgeprägter zellulärer Radiosensitivität. 1.7 Artemis Defizienz Das Artemis-Protein wird kodiert durch das Gen DCLRE1C (DNA cross-link repair 1C)-Gen. Artemis besitzt Einzelstrang5‘>3‘Exonuklease-Funktion, ist zuständig für die Trimmung von DNA-EinzelstrangÜberhängen im Rahmen des NHEJ-Prozesses und somit beteiligt an der DNAReparatur und V(D)J-Rekombination. Bei Artemis-defizienten Individuen ist die V(D)J-Rekombination blockiert. Reife T- und B-Zellen können nicht produziert werden. DLCRE1C-Mutationen wurden zuerst bei SCID-Patienten mit ungewöhnlich hoher zellulärer Strahlensensitivität identifiziert. Nach der Herkunft dieser Patienten wurde deren Erkrankung SCID vom Athabascan-Typ (SCIDA) benannt. Die Erkrankung wird autosomal-rezessiv vererbt. Bis 2010 waren 49 Patienten mit DCLRE1C- Mutationen berichtet. Sie zeigten entweder einen SCIDA oder einen Omenn-Phänotyp (118). 1.8 DNA-PKc-Defizienz Bei einem Patienten mit radiosensitiver T–B–-schwerer kombinierter Immundefizienz (RS-SCID) fand sich eine homozygote 24 Neuropädiatrie in Klinik und Praxis 12. Jg. (2013) Nr. 1 #6918_Neuropädiatrie_01-2013.indd 24 09.01.13 13:38 Originalien/Übersichten DNA-PKcs-missense-Mutation, L3062R (41). Diese Mutation führte zu insuffizienter Artemis-Aktivierung; die KinaseFunktion des DNA-PKcs-Proteins und seine Bindungs-Kapazität an DNA-Enden waren nicht beeinträchtigt. Hypomorphe DNA-PKcs-Mutationen mit residualer Proteinfunktion und überwiegend Artemis-abhängiger Dysfunktion können daher zu einem Artemis-ähnlichen Krankheitsbild führen. Pathophysiologie NHEJ (NHEJ, Abb.1) agiert häufiger während der G1-Phase als während der G2-Phase. Dieser Mechanismus spielt sowohl bei der Reparatur von DNA-DSB durch exogene Noxen als auch der Zusammenfügung von physiologischen DSB im Rahmen der V(D)J-Rekombination im Rahmen der Generierung von Immunglobulinen, T/B-Zell-Rezeptoren und des Immunglobulin-Klassenwechsels eine Rolle. Bislang sind acht Moleküle bekannt, die diesen Prozess kontrollieren. DNADSB werden von dem MRN-Komplex, bestehend aus den Molekülen MRE11A, RAD50 und Nibrin, erkannt und initiieren die Aktivierung der Serin-Protein-Kinase ATM, aus der Familie der Phosphatidylinositol-3-Kinasen (PIKK). Zunächst werden 3‘-Einzelstrang-Überhänge gebildet, die vermutlich, jedoch nicht ausschließlich durch die Exo- und Endonukleaseaktivität von MRE11A entstehen. Während RAD50 aufgrund seiner ATPase-Aktivität vermutlich zusätzlich zur Entwindung der DNA beiträgt, stellt Nibrin ein regulatorisches Protein dar, das die Bindung der einzelnen Moleküle und die Reparaturprozesse koordiniert. KU70/KU80 sowie die katalytische Untereinheit der DNA-abhängigen Proteinkinase (DNA-PKcs) binden an die Bruchstelle und bilden gemeinsam das DNA-PK-Holoenzym, das die Enden des DNA-DSB schützt, sie in räumlicher Nähe hält und zudem die Bindung weiterer Proteine des Ligationskomplexes (Artemis, XRCC4, DNA-Ligase IV, SLF (Cernunnos)/ NHEJ1 und DNA-Polymerase µ) initiiert. Insbesondere bei DNA-DSB durch ionisierende Strahlung entstehen häufig komplexe Strukturen an den überhängenden DNA-Enden. Artemis, die neben ihrer Exonuklease-Funktion auch eine Endonuklease-Funktion besitzt, kann komplexe Haarnadelstrukturen lösen, sodass die Ligation durch das Zusammenspiel von XRCC4, DNA-Ligase-IV und SLF (Cernunnos)/NHEJ1 vollzogen werden kann. Als Nebenprodukt entstehen während des Ligationsprozesses sog. T cell receptor excision cycles (TRECs). Bei der HR werden überhängende DNA-Einzelstrang-Enden von dem Replikationsenzym A (RPA) erkannt, das daran bindet und zur Rekrutierung weiterer Proteine (u. a. RAD51, BRCA 1 und 2) führt, die gemeinsam das Nukleoproteinfilament bilden. Im Folgenden wird nach homologen Sequenzen gesucht und der Reparaturprozess initiiert. Nach dessen Abschluss wird der neu synthetisierte DNA-Strang an das 5‘-Ende des geschädigten Fragmentes verbracht, eventuelle Lücken durch Polymerasen geschlossen und beiden Enden durch Ligasen miteinander verbunden (Abb. 1). Diagnostik Für die Diagnose der DNA-DSB-Reparaturdefekte sind die aufmerksame klinische Evaluation und das Bewusstsein für diese Erkrankungen entscheidend. Den ersten Schritt in der diagnostischen Aufarbeitung stellen die zelluläre Analyse von Lymphozyten-Subpopulationen sowie die Bestimmung zirkulierender Antikörper einschließlich IgG-Subklassen dar. Etwa 35% aller Patienten mit AT und NBS zeigen agammaglobulinämische Verläufe oder schwere Defekte in IgG2 und IgG4 bei z. T. normwertigen IgG-Gesamtspiegeln. Auf chromosomaler Ebene finden sich bei Patienten mit AT, NBS und anderen Defekten im NHEJ-Signalweg in 10-50% PHA-stimulierter Lymphozyten Chromosom 7 und 14 betreffende Inversionen oder Translokationen. Diesen liegen massiv gesteigerte Fehl-Rearrangements, sogenannte TransRearrangements, zugrunde (69). Sie treten infolge eines defektem NHEJ in Genen auf, in denen Rekombination und DSB physiologischerweise häufig abläuft wie im genannten Beispiel die verschiedenen T-ZellRezeptor-Gene. Bei ca. 95% der Patienten mit AT ist das Alphafetoprotein auf über 10 ng/ml erhöht. Dabei ist zu beachten, dass das Alphafetoprotein im ersten und zweiten Lebensjahr physiologischerweise höhere Werte aufweist, sodass altersadaptierte Normalwerte zu beachten sind (56). Auch das CEA ist bei AT erhöht. Bei weiterbestehendem Verdacht stellt die Radiosensitivitätstestung den Goldstandard dar. Protein-Immunoblot-Verfahren können zum direkten Nachweis von ATM, RAD50 oder NBS herangezogen werden. Bei den hier vorgestellten Defekten des NHEJ kann zusätzlich die PCR auf TRECs aus Fersenblut der Guthrie-Karte als Suchtest dienen. Bei hinreichenden klinischen und zellbiologischen Hinweisen sollte frühzeitig die genetische Diagnostik in die Wege geleitet werden. Therapie Abb. 1: Schematische Darstellung der DNA-DSB-Reparatur durch Non-Homologous-End-Joining Bei allen genannten Erkrankungen stellt ein prophylaktisches Konzept, das die Risiken von infektiologischen und onkologischen Komplikationen minimiert, die Behandlungsgrundlage dar. Hierzu ist die Behandlung der Patienten an einem Zentrum mit entsprechender interdisziplinärer Expertise von großer Bedeutung. Während die diagnostischen und prophylaktischen Maßnahmen in vielerlei Hinsicht bei allen Syndromen mit erhöhter Strahlensensitivität ähnlich sind, unterscheiden sich die interventionellen Therapieempfehlungen in Abhängigkeit von der Gesamtprognose des genetischen Defektes und der Neuropädiatrie in Klinik und Praxis 12. Jg. (2013) Nr. 1 25 #6918_Neuropädiatrie_01-2013.indd 25 09.01.13 13:38 Originalien/Übersichten Ausprägung der Strahlensensibilität. Bei signifikant erhöhtem Risiko für rezidivierende oder schwere Infektionen sollte eine prophylaktische Immunglobulintherapie und/oder antibiotische Prophylaxe erwogen werden (113). Auch muss bei Infektionsverdacht frühzeitig eine adäquate antibiotische Therapie eingeleitet werden. Eine mikrobiologische Untersuchung mit Testung auf Resistenzen vor Initiierung einer antibiotischen Therapie sollte veranlasst werden. Die Auswahl des verordneten Antibiotikums richtet sich nach Erfahrungswerten des individuellen Erregerspektrums und der klinischen Symptomatik. Hinsichtlich der neurologischen Progredienz sollten Kinder mit Entwicklungsverzögerung frühzeitig eine entsprechende Förderung erhalten. Ein Tumorscreening mit besonderem Fokus auf hämatologische Erkrankungen sollte engmaschig durchgeführt werden. Sollte eine Lymphomtherapie notwendig werden, muss der erhöhten Sensibilität gegenüber radioaktiver Strahlung und interkalierenden Substanzen unbedingt Rechnung getragen werden. Eine retrospektive Studie von Bienemann et al. berichtet allerdings über gute Erfolge in der Lymphomtherapie bei Patienten mit AT und NBS, die eine Chemotherapie mit reduzierter Intensität erhalten haben (15). Dabei ist jedoch zu beachten, dass auf Grund einer insgesamt erhöhten genomischen Instabilität das Risiko für einen Zweittumor durch die Behandlung des Ersttumors erhöht und von einer Dosisreduktion unbeeinflusst bleibt (15). Besonderheiten AT: Die Behandlung neurogenerativer Prozesse bei AT stellt weiterhin die größte Herausforderung in der Betreuung betroffener Patienten dar. Monozentrische Studien berichten über eine deutliche Verbesserung der motorischen und sprachlichen Fähigkeiten unter Behandlung mit Betamethason (0,01-0,1 mg/kg/d), die in funktionellen und radiologischen Untersuchungen, allerdings erneut nur monozentrisch, bestätigt wurden (17, 18, 121). Auch wenn die therapeutische Wirkung direkt von einer kontinuierliche Gabe abhängig zu sein scheint und Langzeitergebnisse sowie Bestätigungen aus anderen Zentren ausstehen, ist ein Therapieversuch erwägenswert. Bei neurologisch bedingten Schluckstörungen ist das perioperative Risiko durch Aspirationsereignisse, beeinträchtigte Infektionskontrolle und präexisitente Lungenschäden signifikant erhöht, sodass notwendige Operationen nur unter besonderen Vorsichtsmaßnahmen durchgeführt werden sollten. Auf Grund des progressiven und von einer SZT nicht beeinflussten neurologischen Verlaufs bei einem insgesamt weiterhin hohen transplantationsassoziierten Mortalitätsrisiko bleibt die Indikationsstellung zur SZT kontrovers. Besonderheiten NBS: Bei prämaturer Ovarialinsuffizienz sollten Mädchen und Frauen frühzeitig auf eine Hormonersatztherapie eingestellt werden, um sekundäre Folgeerscheinungen des Östrogenmangels zu minimieren. Bei schweren hämatologischen/immunologischen Defiziten kann bei Patienten mit NBS eine Stammzelltransplantation in Erwägung gezogen werden. Sie stellt im Gegensatz zur AT beim NBS eine mit den Eltern frühzeitig zu diskutierende alternative Option zur konservativen Therapie dar (3, 15). 1.9 Fanconi-Anämie 1927 berichtete der Kinderarzt Guido Fanconi erstmals über einen bei drei Geschwisterkindern beobachteten Symptomkomplex, der mit somatischen Fehlbildungen und progressiver, aplastischer Anämie einherging (51). Obwohl die Anämie nicht immer das klinisch führende Bild darstellen muss, erhielt das Krankheitsbild seine Bezeichnung entsprechend der Erstbeschreibung: Fanconi-Anämie (FA). Auf dem Boden einer genetisch bedingten, chromosomalen Instabilität, spiegelt die FA sowohl klinisch als auch pathophysiologisch manche Muster des bereits beschriebenen NBS und der AT wider, weist jedoch auch viele andere Manifestationen auf und ist in ihrem genetischen Hintergrund deutlich komplexer. Mutationen in einem von 15 verschiedenen Genen, die mit einer einzigen Ausnahme einem autosomal-rezessiven Vererbungsmuster folgen, wurden zwischenzeitlich als krankheitsverursachend identifiziert (5, 33, 159). Die FA tritt weltweit auf und wird auf eine Prävalenz von 1:350.000 Geburten geschätzt. Lediglich in bestimmten ethischen Gruppen wie den Ashkenazi-Juden, den spanischen Gitanos und der schwarzen Bevölkerung Südafrikas wird die Prävalenz asymptomatischer Merkmalsträger mit mindestens 1:100 mehr als doppelt so hoch wie generell vermutet (9, 21, 166). Klinisches Bild Das klinische Bild der FA ist sehr variabel und das Spektrum reicht von schwersten kongenitalen Fehlbildungen bis hin zu initial asymptomatischen Patienten mit einer bis ins Erwachsenenalter normal verlaufenden Entwicklung (73). Zusätzlich kann das klinische Bild auch innerhalb einer Familie stark variieren (84, 110). Die FA geht in aller Regel jedoch mit einer erhöhten Strahlensensibilität einher, die den Verlauf der Erkrankung mitbestimmen kann. Obwohl etwa 75% aller Kinder bereits bei Geburt mindestens eine kongenitale Fehlbildung aufweisen, liegt das Durchschnittalter bei Diagnosestellung mit 7 Jahren erst im Grundschulalter (88). Phänotypische Merkmale, die bereits perinatal zu ersten Verdachtsmomenten führen könnten, sind neben Daumen- und Radiusfehlbildungen (42%) Mikrozephalie (20%), Mikrosomie (40%), niedriges Geburtsgewicht (5%), Fehlbildungen der Augen (20%, Mikrophthalmie, Katarakt, Astigmatismus, Epikanthus, Ptosis) und der Ohren (10%), Hypo- oder Hyperpigmentierungen der Haut (40%) und renale (20%), kardiopulmonale (6%) oder urogenitale Fehlbildungen (Infertilität 25% d. Jungen, 2% d. Mädchen) (147). Zusätzlich fallen bei etwa 80% der Patienten endokrinologische Störungen auf, in erster Linie Hypothyreose und Glukoseverwertungsstörungen. Im frühen Kindesalter kann eine unspezifische Entwicklungsverzögerung auftreten, die bis hin zu einer manifesten mentalen Retardierung reichen kann. Da jedoch keine dieser Auffälligkeiten regelhaft auftritt oder gar pathognomonisch für die Erkrankung ist, wird die spezifische Diagnostik der FA meist erst bei Auftreten eines klinisch relevanten Stammzellverlustes – der zunächst nur einzelne Zelllinien betreffen kann – oder einer Myelodysplasie eingeleitet. Eine Anämie muss dabei nicht führend sein. Vielmehr können eine Thrombozytopenie oder eine Leukopenie, die sich als Gerinnungsstörung oder Immundefekt manifestiert, klinisch dominieren. Besondere Vorsicht ist bei neutropenen Verläufen, die mit einem besonders hohen Infektionsrisiko assoziiert sind, geboten. Insgesamt liegt das Risiko einer lebensbedrohlichen (meist infektiologischen) Komplikation mit 5% pro Jahr um das 10. Lebensjahr am höchsten (89, 147). Zusätzlich ist das Risiko, an einem myelodyplastischen Syndrom mit Chromosomenveränderung (Translokation, Inversion, Deletion) zu erkranken, gegenüber Gesunden etwa 500-fach erhöht. Weitere 10-15% der Patienten erkranken an Leukämie. Dabei handelt es sich in 90% der Fälle um die akute myeloische Leukämie (AML), eine im Kindesalter sonst seltene und prognostisch insgesamt eher ungünstige Form der Leukämie (8, 127, 128). Unabhängig von einer hämatologischen Beteiligung entwickeln etwa ¾ aller Patienten vor dem 50. Lebensjahr mindestens einen soliden Tumor, der die Manifestation der Erkrankung darstellen kann; in einigen Fällen treten mehrere Tumore in unterschiedlichen Organen auf. An häufigsten sind Plattenepithelzellkarzinome im Bereich des Kopfes und Halses, des Ösophagus und des Urogenitaltraktes (4, 129, 158). Auf Grund der genetischen Identität 26 Neuropädiatrie in Klinik und Praxis 12. Jg. (2013) Nr. 1 #6918_Neuropädiatrie_01-2013.indd 26 09.01.13 13:38 Originalien/Übersichten von FANCD1 mit BCRA2 besteht bei Patientinnen mit monoallelischen Mutationen in diesem Gen ein signifikant erhöhtes Risiko für die Entstehung von familiären Mamma- und Ovarial-Karzinomen (70). Heterozygotenmanifestation von Brustund Eierstockkrebs wurde auch für die FA-Gene BRIP1/FANCJ, PALB2/FANCN und RAD51C/FANCO beschrieben (103). Pathophysiologie Die molekulare Aufarbeitung von Patienten mit dem klinischen Bild einer FA hat zwischenzeitlich zu der Definition von 15 Genen (FANCA, FANCB, FANCC, FANCD1/ BRCA2, FANCD2, FANCE, FANCF, FANCG, FANCI, FANCJ/BRIP1, FANCL, FANCM, FANCN/PALB2, FANCO/RAD51C, FANCP/ SLX4) auf 12 Chromosomen geführt (42, 155, 181). Entsprechend des Zeitpunktes ihrer Erstbeschreibung wurde die Nomenklatur der zur FA führenden Gene FANC in alphabetischer Ordnung erweitert. Komplementationsanalysen führten zu einer funktionellen Einteilung in 15 sogenannte FA-Komplementationsgruppen: FA-A, FAB, FA-C, FA-D1, FA-D2, FA-E, FA-F, FA-G, FA-I, FA-J, FA-L, FA-M, FA-N, FA-O und FA-P, wobei jeder Komplementationsgruppe biallelische Mutationen in genau einem der genannten Gene zugrunde liegen (http://www.genenames.org/genefamilies/FANC). Patienten der verschiedenen Komplementationsgruppen können einen unterschiedlich schweren Verlauf zeigen (43, 50) (http://www.genenames. org/genefamilies/FANC). Acht der 15 FAProteine (FANCA, FANCB, FANCC, FANCE, FANCF, FANCG, FANCL, FANCM) bilden gemeinsam einen Komplex (Abb. 2), den sogenannten „FA nuclear core complex“ (55, 101, 149). Während der S-Phase des Zellzyklus und bei DNA-Schäden bindet die DNA-Translokase FANCM an das Chromatin und die nukleäre Matrix, rekrutiert den FA core complex durch Interaktion mit FANCF und katalysiert die Aktivierung von ATR und CHEK1. Letztere vermitteln die Phosphorylierung verschiedener Proteine zur Stabilisierung des FA core complex, der über FANCL Ubiquitin-Ligase-Aktivität gewinnt und die Monoubiquitinierung von FANCD2 und FANCI vermittelt. Monoubiquitinyliertes FANCD2 und FANCI bilden gemeinsam den ID2-Komplex, der den Reparaturprozess durch HR vermittelt (2, 23). Die HR beruht auf einen Korrekturmechanismus, der sich das zweite Allel oder eine Schwesterchromatide, die während der Replikation in der späten S und der G2Phase vorliegt, zunutze macht, um die Bruchstelle exakt zu rekonstruieren. Während die ATM-abhängige Phosphorylierung von FANCD2 entscheidend Abb. 2: Schematische Darstellung der FA-Proteine im DNA-Reparaturmechanismus für die Korrektur von DNA-DSB zu sein scheint, wird der Monoubiquitinierung und ATR-abhängigen Phosphorylierung dieses Proteins eine entscheidende Rolle bei der Reparatur von DNA-DoppelstrangQuervernetzungen zugeschrieben (101). Die abschließende Deubiquitinylierung terminiert den Reparaturprozess (60, 114) (Abb. 2). Auf molekularer Ebene führen Mutationen im FA-Signalweg zu einer signifikant erhöhten genomischen Instabilität mit Zellzyklusarrest in der G2-Phase und dem Risiko der Tumorentstehung (77, 160, 161). Charakteristisch ist eine bei Sauerstoffkonzentrationen >10% erhöhte Empfindlichkeit von FA-Zellen gegenüber DNA-quervernetzenden Substanzen (cross-linking agents) wie Diepoxybutan (DEB) oder Mitomycin C (MMC), die zu diagnostischen Zwecken genutzt werden kann (10, 76, 136). Zusätzlich ist bei Patienten mit Mutationen in FANCD2 die erhöhte Empfindlichkeit gegenüber ionisierender Strahlung (IR) auffällig. Letztere beruht auf der Tatsache, dass IR-bedingte Schäden zu einer ATM (MRE11-Komplex)abhängigen Aktivierung führen. In diesem Zusammenhang wird nochmals die klinische Überlappung der FA mit dem NBS und der AT deutlich: auf Grund der Interaktion von Nibrin mit FANCD2, wird FANCD2 zu einem Relais zwischen beiden Signalwegen (109). Diagnostik Obwohl die frühzeitige Diagnostik prognoseentscheidend sein kann, wird die systematische Diagnostik der FA auf Grund des klinisch heterogenen Bildes häufig erst bei Auftreten von hämatologi- schen oder onkologischen Komplikationen in die Wege geleitet. Diese Tatsache mahnt zu besonderer Aufmerksamkeit für assoziierte phänotypische Merkmale, die bereits bei Geburt vorliegen können. Im Verlauf sollte das Auftreten eines oder mehrerer der folgenden Symptome Anlass zur spezifischen FA-Diagnostik sein: Außerhalb von Infekten anhaltende Zytopenie einer Zellreihe, makrozytäre Anämie, die nicht durch Vitamin-B12- oder Folsäuremangel erklärt werden kann, Mikrozephalie, Lebertumoren oder -adenome, Ovarialinsuffizienz vor dem 30. Lebensjahr, Hirntumoren vor dem 5. Lebensjahr, Wilmstumor vor dem 4. Lebensjahr, AML im Kindesalter, persistierend erhöhtes HbF, Infertilität, Plattenepithelkarzinome des Mund-, Rachen-, Kehlkopf-, Speiseröhren- oder Genitalbereiches im frühem Lebensalter (44). Bei klinischem Verdacht auf FA steht die funktionelle zelluläre Diagnostik durch hämatologische oder genetische Speziallabore an oberster Stelle. In der zytogenetischen Screeninguntersuchung zeigen sich eine erhöhte Chromosomenbrüchigkeit oder andere chromosomale Alterationen unter dem Einfluss von Diepoxybutan (DEB) oder Mitomycin C (MMC). Gesteigerte Chromosomenbruchraten sind jedoch nur Ausdruck und Endpunkt einer vermehrten spontanen und induzierten genomischen Instabilität, wie auch die Zellzyklusblockierung von FA-Zellen in der G2-Phase und verminderte zelluläre Überlebensraten in Kultur. Wegen der Schnelligkeit und höheren statistischen Sicherheit (Untersuchung von 100.000 Interphase-, nicht nur Mitosezellen und wenigen Minuten) haben sich durchflusszytometrische Verfahren der Labordiag- Neuropädiatrie in Klinik und Praxis 12. Jg. (2013) Nr. 1 27 #6918_Neuropädiatrie_01-2013.indd 27 09.01.13 13:38 Originalien/Übersichten nostik von FA in jüngerer Vergangenheit zunehmend durchgesetzt. Ist trotz eines negativen Testergebnisses der klinische Verdacht weiterhin begründet, werden Untersuchungen an Fibroblasten angeschlossen, da ggf. auch ein somatisches Mosaik im hämatopoetischen System vorliegen kann (Reversion einer Mutation in einer hämatopoetischen Stammzelle). Solche Screeninguntersuchungen können auch bei Patienten mit anderen Chromosomeninstabilitätssyndromen (beispielsweise NBS oder AT) positive Ergebnisse liefern, die jedoch durch unterschiedliche Provokationsmethoden (MMC oder DEB bei FA, ionisierender Bestrahlung bei AT oder NBS) voneinander zu differenzieren sind. Gewählt werden diese Provokationsverfahren abhängig von der Verdachtsdiagnose, die dem Labor mit möglichst genauen Symptomen mitgeteilt werden sollte. Bestätigungstests für FA umfassen Komplementationsanalysen und die molekulargenetische Untersuchung auf spezifische Mutationen, die eine definitive genetische Klassifikation herbeiführen. Therapie Die verfügbaren Therapieoptionen bei FA-bedingten Knochenmarksversagen sind begrenzt. Im Gegensatz zur idiopathischen aplastischen Anämie, die initial häufig zufriedenstellend auf eine immunsuppressive Therapie anspricht, bleiben diese Therapieversuche bei FA-bedingtem Knochenmarksversagen wirkungslos, so dass die allogene Stammzelltransplantation (SZT) die einzige kurative Therapieoption darstellt. Der krankheitsbedingt notwendige Verzicht auf Alkylanzien und Bestrahlung macht eine angepasste, reduzierte Konditionierung vor SZT essentiell für den Erfolg der Transplantation. Zusätzlich sollte dem erhöhten Risiko der sekundären Karzinomentwicklung durch Minimierung des GvHD-Risikos unbedingt Rechnung getragen werden (67, 150). Daher ist die frühzeitige Behandlung an einem spezialisierten Zentrum mit Erfahrung in der Transplantation von FA-Patienten von großer Bedeutung. Bisherige Erfahrungen zeigen, dass FA-Patienten, die von einem HLA-idenen Geschwisterspender transplantiert wurden mit einer Überlebensrate von 66 bis >90% zwei Jahre nach Transplantation die besten Überlebenschancen hatten, sodass bei gesicherter Diagnose und Vorhandensein eines entsprechenden Spenders bereits bei einem Hb < 8g/dl, Thrombozyten <50 000/ µl oder Granulozytopenie <1000/µl die Indikation zur Transplantation gestellt werden kann (40, 64, 146). Bei Fehlen eines entsprechenden Spenders sollte die Suche eines passenden Fremdspenders frühzei- tig in die Wege geleitet und die SZT vor Auftreten eines MDS oder einer Leukämie durchgeführt werden (63, 97). Zur Überbrückung der Zeit bis zur Identifizierung eines passenden Fremdspenders können Transfusionen, G-CSF/GM-CSF oder Androgene zum Einsatz kommen (68, 122). Androgene, die in den 50er-Jahren zur Therapie der FA-Anämie etabliert wurden, verbessern innerhalb von ein bis zwei Monaten bei immerhin etwa 50-70% der Patienten eine bestehende Anämie. Die initiale Dosis sollte im Verlauf auf eine minimal notwendige Dosis zur Stabilisierung des Blutbildes titriert werden (2-5 mg/kg/d) (169). Eine Androgentherapie ist jedoch mit beträchtlichen Nebenwirkungen (insbesondere Maskulinisierung; Stimmungsschwankungen, vorzeitiger Epiphysenschluss, Cholestase, Peliosis hepatis, Leberadenome und Bluthochdruck) verbunden. In jüngster Zeit hat Danazol deutliche Vorteile in Bezug auf geringe Nebenwirkungen bezüglich Oxymetholon gezeigt (143). Multiple Erythrozyten- und Thrombozytentransfusionen von unterschiedlichen Spendern sind mit einem schlechteren Outcome bei späterer SZT assoziiert. Gentherapeutische Ansätze sind Gegenstand aktueller Forschung und könnten in Zukunft eine weitere Therapieoption darstellen (167). 2 Bloom-Syndrom (Kongenitales teleangiektatisches Syndrom) Das Bloom-Syndrom (BS, OMIM #210900) ist ein autosomal-rezessiv vererbtes Syndrom, das auf dem Boden einer funktionellen Chromosomeninstabilität klinische und pathophysiologische Gemeinsamkeiten mit der AT und der FA hat. Auf Grund der insgesamt niedrigen Inzidenz, ist eine Schätzung der Häufigkeit schwierig. Im größten online verfügbaren Register, das speziell für Patienten mit genetisch gesicherter Diagnose des BS angelegt wurde, waren bis 2009 265 Fälle registriert, 140 Männer und 125 Frauen (Bloom’s Syndrome Registry www.weill.cornell.edu/bsr). Das BS tritt in Deutschland mit einer Inzidenz von etwa 1:100.000 bei ca. 6 Neugeborenen pro Jahr auf. Klinisches Bild Klinisch leiden homozygot Betroffene an einer schweren Wachstumsretardierung, die bereits intrauterin beginnt und sich bis ins Erwachsenenalter fortsetzt. Obwohl der Kleinwuchs zwar proportioniert imponieren kann, gehören die Mikrozephalie und die Dolichokephalie zu den charakteristischen Zeichen. Weitere anatomische Fehlbildungen sind selten. Viele Erkrankte leiden an einem bis ins Erwachsenenalter persistierenden gastroösophagealen Reflux und reduziertem Appetit. Dermatologisch fallen betroffene Patienten bereits im Kleinkindesalter durch eine starke Sonnenempfindlichkeit, Erythemen, Café-au-lait-Flecken und Teleangiektasien auf. Infektionsimmunologisch zeigen Patienten mit BS ab dem Kleinkindesalter häufig rekurrierende Infektionen des Mittelohrs, des Mastoids sowie des oberen und unterem Atemwege. In der zellulären Diagnostik zeigt sich ein normales TCRVß-Profil bei jedoch insgesamt erniedrigen T–ZellFrequenzen und einer variabel verminderten Antwort von CD4+ und CD8+ T-Zellen auf TCR-spezifische Stimuli (11). Gleichzeitig findet sich in diesen Patienten häufig eine Hypogammaglubulinämie für IgG, IgM und/oder IgA (49, 75, 86). Da die Untersuchung des humoralen Immunstatus bei betroffenen Patienten insgesamt jedoch moderate Erniedrigungen der Immunglobulin-Serumspiegel zeigt, liegt die Vermutung nahe, dass zusätzlich zur reduzierten T-Zell-Immunität der gastroösophageale Reflux und wiederholte Aspirationsereignisse sinobronchopulmonale Infektionen begünstigt. Während männliche Betroffene in aller Regel zeugungsunfähig sind, sind Frauen grundsätzlich fertil, der Eintritt der Menopause ist jedoch deutlich früher als bei Gesunden. Auf dem Boden eines myelodysplatischen Syndroms ist die Entstehung von Leukämien und Lymphomen begünstigt. Insgesamt besteht in der dritten Lebensdekade eine signifikant erhöhte Malignominzidenz für Adenokarzinome der Mundhöhle, der Speiseröhren und des Colons, der oberen Atemwege, der Leber und des Urogenitaltraktes. Frauen mit Bloom-Syndrom erkranken zudem deutlich häufiger an einem Mammakarzinom. Laut BS-Register ist die mittlere Lebenserwartung bei Frauen (25; <1-49 Jahre) und Männern (27; 1-49 Jahre) durch das Auftreten maligner Komplikationen limitiert. Charakteristisch, pathophysiologisch bislang jedoch ungeklärt, ist zudem der frühzeitige Beginn einer gestörten Glukosetoleranz und eines Diabetes mellitus Typ II (17,7%, mittleres Alter 26,6 Jahre, Bloom’s Syndrome Registry: www.weill. cornell.edu/bsr). Pathophysiologie Ursächlich für die Erkrankung ist eine Mutation im BLM (RECQL3)-Gen auf Chromosom 15q26. Dieses Gen codiert für eine RecQ3‘-5‘ Helikase. Sie interagiert mit CHEK1, Replication protein A1 (RPA) 28 Neuropädiatrie in Klinik und Praxis 12. Jg. (2013) Nr. 1 #6918_Neuropädiatrie_01-2013.indd 28 09.01.13 13:38 Originalien/Übersichten der Werner-Syndrom-ATP-abhängigen Helikase WRN, ATM, RAD51, RAD51D, XRCC2, Flap structure-specific endonuclease 1, H2AX, TP53BP1, FANCM, P53, TOP3A, MLH1 und CHAF1A. WRN ist selbst Teil des BRCA1-associated genome surveillance complex (BASC) und des RAD50MRE11-Nibrin-Komplexes. Defekte im WRN-Protein führen zu Fehlern in der chromosomalen Replikation, der Rekombination sowie im Ablauf der Reparatur von DNA-Schäden. Dadurch kommt es zu einer erhöhten Austauschrate zwischen Schwesternchromatiden (sister chromatod exchanges, SCE) während der Meiose und einer signifikant erhöhten Chromosomenfragilität. Diagnostik Liegt klinisch ein Verdacht auf BS vor, ist das wichtigste und sicherste diagnostische Kriterium zur Diagnosesicherung der Nachweis einer erhöhten Chromosomenbrüchigkeit sowie einer erhöhten Austauschrate zwischen Schwesterchromatiden, die im Falle eines BS auf mindestens das Zehnfache erhöht ist. Alternativ kann der genetische Nachweis einer Mutation im BML-Gen geführt werden. Therapie Da eine kausale oder kurative Therapie nicht existiert, stehen prophylaktische und symptomatische Maßnahmen im Vordergrund. Hierbei sind ein engmaschiges Tumorscreening sowie eine adäquate antibiotische Therapie von entscheidender Bedeutung für den Verlauf und die Prognose des einzelnen Patienten. len des Immunsystems. In diesen Organen wird ein Alterungsprozess verhindert oder zumindest stark verzögert, indem ein Enzym-Protein-RNA-Komplex, bestehend aus Telomerase, Shelterin-Komplex und RNA, die DNA-Synthese katalysiert und die Telomerlänge stabilisiert. Primär verkürzte Telomere oder Defekte im Telomerase/Shelterin Verbund führen entsprechend zu einem komplexen Krankheitsbild, das potentiell alle Organsysteme betreffen kann. Zwischenzeitlich sind für jedes der acht an diesem Komplex beteiligten Proteine krankheitsverursachende Mutationen beschrieben, sodass die frühere Krankheitsentität der Dyskeratosis congenita heute pathophysiologisch unter dem Begriff „Telomeropathien“ subsumiert wird. Die Telomeropathien mit Mikrozephalie lassen sich in 3.1 die klassische Dyskeratosis congenita (kDC, OMIM #305000, OMIM #127550, OMIM #613989, OMIM #613990, OMIM #224230, OMIM #613987, OMIM #613988, OMIM #224230) 3.2 das Hoyeraal-Hreidarsson-Syndrom (HHS, OMIM #300240) und 3.3 das Revesz-Syndrom (RS, OMIM #268130) unterscheiden. Allen gemeinsam sind das im Verlauf progrediente Knochenmarksversagen mit Immundefekt sowie ein deutlich erhöhtes Risiko für Malignome. Isolierte idiopathische pulmonale Fibrose, aplastische Anämie und myelodysplastisches Syndrom können weitere Manifestationsformen einer Telomeropathie sein, da sie jedoch nicht mit Mikrozephalie auftreten, werden sie in dieser Übersicht nicht weiter diskutiert. Klinisches Bild und Diagnostik Die klassische Form der Dyskeratosis congenita (kDC), nach ihren Erstbeschreibern auch Zinsser-Engman-Cole-Syndrom genannt, ist eine seltene Form der ektodermalen Dysplasie, die X-chromosomal vererbt (Mutationen in den Proteinen DKC1 und Dyskerin) autosomal-dominant (Mutationen in TERC) und autosomalrezessiv (Gen unbekannt) auftreten kann. Tabelle 2 fasst die assoziierten Symptome, eingeteilt in diagnostisch relevante Haupt- und Nebenkriterien zusammen: Klinisch charakteristisch ist die Trias (i) Hauptkriterien % Retikuläre Pigmentierung der Oberkörpers und/oder Halsbereiches 89 Nageldysplasie 88 Knochenmarksversagen 85.5 Orale Leukoplakie 78 Nebenkriterien % Epiphora 30,5 3 Telomerintegritätsdefekte Entwicklungsverzögerung/mentale Retardierung 25,4 Telomere sind lineare Endstücke der Chromosomen, die den zellteilungsbedingten Alterungsprozess durch Verlust von genetischem Material verhindern. Sie bestehen aus repetitiven DNAAbschnitten aus jeweils 6 Nukleotiden (TTAGGG) und einem assoziierten Proteinkomplex, der die Telomerstruktur stabilisiert. Mit jedem Zellteilungsschritt gehen auf Grund der inkompletten terminalen Replikation des Tochterstranges bis zu 200 Basen verloren. Unterschreiten die Telomere eine Größe von etwa 4 Kilobasenpaaren, so wird eine apoptoseinduzierende Seneszenzkaskade aktiviert. Durch diesen Prozess können alternde, nicht mehr voll funktionsfähige Zellen aussortiert und Tumorwachstum verhindert werden. Bei einigen stark proliferierenden Zellpopulationen ist dieser Alterungsprozess jedoch ungünstig; hierzu zählen beispielsweise Keimbahnzellen, epitheliale Zellen, Stammzellen und Zel- Lungenerkrankung 20,3 Kleinwüchsigkeit 19,5 Taurodontismus/Zahnverlust 16,9 Ösophagusstenose 16,9 Vorzeitige Haarergrauung/dünne Augenbrauen und Wimpern 16,1 Hyperhidrosis 15,3 Tumorerkrankung 9,8 Intrauterine Wachstumsverzögerung 7,6 Lebererkrankung/gastrointestinale Ulcerationen/Enteropathie 7,3 Ataxie 6,8 Hypogonadismus, Maldescensus testis 5,9 Mikrocephalie 5,9 Urethralstenose 5,1 Osteoporose, aseptische Knochennekrose, Skoliose 5,1 Schwerhörigkeit 0,8 Tab. 2: Klinische Diagnosekriterien der Dyskeratosis congenita Neuropädiatrie in Klinik und Praxis 12. Jg. (2013) Nr. 1 29 #6918_Neuropädiatrie_01-2013.indd 29 09.01.13 13:38 Originalien/Übersichten retikuläre Pigmentstörungen, (ii) Nageldystrophie und (iii) Leukoplakie (insbesondere Mundschleimhaut, Ösophagus, Vagina und Anus betreffend). Dabei können neben der klassischen Symptomtriade eine intrauterine Wachstumsverzögerung (7,6%), Mikrozephalie (5,9%) Entwicklungsverzögerung (25,4%) oder Kleinwüchsigkeit früh zu allgemeinpädiatrischen Verdachtsmomenten führen. Gleichzeitig kann das Knochenmarksversagen zeitlich und klinisch führend sein und ist in 60-70% der Fälle ursächlich für die hohe Frühmortalität. Das HHS stellt klinisch sowie pathophysiologisch eine schwer verlaufende Form der DC dar Ursächlich ist eine Mutation im DKC1-Gen, das auch für die X-chromosomal vererbte Form der DC verantwortlich ist (71, 72, 82, 183). Aufgrund seiner bereits bei Geburt charakteristischen klinischen Zeichen wird das HHS auch als neonatale Ausprägung der DC bezeichnet. Für das HHS pathognomonisch, nahezu obligat, ist eine kongenitale cerebelläre Hypoplasie (71, 72, 82, 183). Das RS wurde 1992 zum ersten Mal von Revesz et al. in einem 6 Monate alten sudanesischen Jungen beschrieben. Klinisch führend waren in diesem Patienten neben einer Mikrozephalie eine bilaterale exsudative Retinopathie sowie eine schwere aplastische Anämie, die im Alter von 19 Monaten zum Tod führte. Zwischenzeitlich sind 3 weitere Patienten beschrieben, zu den klinischen Charakteristika gehörten multilineäres Knochenmarksversagen, zerebelläre Hypoplasie, Nageldystrophie, Pigmentierungsstörungen der Haut und orale Leukoplakie (79, 125, 135, 140). Die Diagnose des HHS kann klinisch gestellt werden wenn vier der folgenden sechs Symptome vorliegen: Intrauterine Wachstumsverzögerung, Entwicklungsverzögerung, Mikrozephalie, zerebelläre Hypoplasie, Immundefizienz oder Anämie. Die genetische Bestätigung der Diagnose kann über einen Mutationsnachweis im DKC1-Gen erfolgen. Die Diagnose des RS ist weniger gut definiert, bei Vorliegen einer bilateralen exsudativen Retinopatie, Knochenmarkshypoplasie, Nageldystrophie, Wachstumsretardierung und feinem Haar ist die Diagnose jedoch sehr wahrscheinlich. Molekularbiologisch kann die Diagnose durch den Nachweis einer Mutation im TIN2-Gen bestätigt werden. Pathophysiologie Die Telomerase besteht aus 6 Proteinen (DKC1, TERC, TERT, NOP10, NHP2 und TCAB1, Abbildung 3) sowie dem assoziierten Faktor C16orf57 (6, 32, 80, 107, 170, 172). Die „Telomerase reverse-Transkriptase“ (TERT), das integrierte RNA- Abb. 3: Schematische Darstellung der Telomerstruktur und des Telomerasekompleses. AA: Aplastische Anämie, DC: Dyskeratosis cogenita, HHS: Hoyeraal-Hreidarsson-Syndrom Fragmente 3‘-AAUCCC-5‘ („Telomerase RNA component“, TERC) und Dyskerin (DKC1) bilden dabei eine enzymatische Einheit. Während TERT das Ablesen der RNA-Matrize und TERC die Synthese des komplementären DNA-Telomerfragments TTAGGG ermöglicht, dient Dyskerin der Reifung des Ribonukleoproteins. TERC, TERT und Dyskerin (DKC1) bilden dabei eine enzymatische Einheit. Heterozygote Mutationen in TERT oder TERC können für eine AA, ein MDS, eine AML oder eine variable Ausprägung der DC verantwortlich sein. Heterozygote Mutationen in TERC können zusätzlich zum klinischen Bild einer pulmonalen oder hepatischen Fibrose führen. Diese variable klinische Ausprägung ist auf eine Haploinsuffizienz, der Insuffizienz des homologen Chromosoms für den haploiden Zustand zu kompensieren zurückzuführen (7). Häufig findet sich zudem eine Antizipation, sodass Nachkommen von Merkmalsträgern eine deutlich frühere oder schwerer verlaufende Manifestation zeigen können. Homozygote Mutationen in TERT hingegen gehen im Vergleich zu heterozygoten Mutationen mit deutlich kürzeren Telomerlängen einher und führen zum klassischen Bild der DC oder dem HHS (99). Auf Grund der X-chromosomalen Vererbung des Dyskerin (DKC1-Gen) sind Jungen von einer DKC1-Mutation klinisch deutlicher häufiger betroffen. Keimbahnmosaike mit milder klinischer Ausprägung sind beschrieben. Insbesondere bei chromosomal betroffenen Jungen sind die Telomerlängen im zytogenetischen Bild sehr kurz, entsprechend schwer ist die klinische Ausprägung, und alle Formen der DC und des HHS sind möglich (6, 53, 82, 156, 171). Dyskerin bildet gemeinsam mit NOP10 und NHP2 sowie GAR1 und TERC den H/ACA-Ribonukleinkomplex (H/ACARNP), der neben der Telomerhomeostase auch an der Ribosomenbiogenese und dem pre-mRNA-Splicing beteiligt ist (102, 175). Auf Grund der fast ubiquitären Rolle des H/ACA RNP in ribonukleären Abläufe führt eine biallelische, homozygote Mutation zur DC und es konnte gezeigt werden, dass eine NOP10-Mutation zusätzlich mit einer verminderten Expression von TERC einhergeht (176). Dem TelomeraseHoloenzym TCAB1 kommt eine entscheidende Bedeutung bei dem Transport der Telomerase zu den sog. Cajal-Bodies, den nukleären Orten der RNA-Prozessierung, zu. Biallelische Mutationen verhindern eine korrekte Synthese der Telomere und führen infolge dessen zu einem deutlich verkürzten und somit sekundär beschleunigten Zellalterungsprozess (186). Der Shelterin-Komplex besteht aus dem Telomeric-repeat binding protein 1 interacting nuclear factor 2 (TIN2) und 5 weiteren Proteinen (TRF1, TRF2, TPP1, POT1 und RAP1), die die telomerische DNA-Sequenz umschließen, in ihrer Konformation fixieren und so verhindern, dass dieses Fragment als DNA-DSB fehlinterpretiert wird (141). TRF1 und TRF2 bilden dabei eine strukturelle Plattform, an die die übrigen zum Shelterin-Komplex gehörenden Proteine und DNA-Reparaturproteine binden können. Zusätzlich zu den bereits beschriebenen Proteinen können die Nuklase Apollo und die Helikase BLM, die für die Entwindung der DNA im Reparaturprozess entscheidend sind, an diese Plattform binden (91, 131, 182). Mutationen im TIN2-Gen sind sowohl für 30 Neuropädiatrie in Klinik und Praxis 12. Jg. (2013) Nr. 1 #6918_Neuropädiatrie_01-2013.indd 30 09.01.13 13:38 Originalien/Übersichten die kDC als auch für das HHS, die aplastische Anämie und das Revesz-Syndrom beschrieben. Patienten mit heterozygoter Mutation, welche häufig auf Spontanmutationen zurückzuführen sind, zeigen im zytogenetischen Muster besonders kurze Telomere und erleiden einen sehr schweren Krankheitsverlauf (141, 174). In einem Patienten mit HHS wurde eine Transkriptionsvariante des Proteins Apollo/SNM1B nachgewiesen, die zu einer dominant-negative Spleisvariante des Proteins führt (168). Dies resultierte in einer schweren Temolerdysfunktion, die letztlich zu einer vorzeitigen Zellseneszenz mit entsprechender Klinik führt (Abb. 3). Diagnostik Zur klinischen Diagnosefindung wurden auf der Basis des Londoner DC-Registers 4 Haupt- und 17 Nebenkriterien definiert [Tab. 2 (138, 171)]. Bei Vorliegen von mindestens 2 der 4 Hauptkriterien und 2 oder mehr Nebenkriterien gilt die Diagnose als klinisch sehr wahrscheinlich. Zur Diagnosesicherung erfolgt die Bestimmung der Telomerlängen, die bei Evaluation von mindestens vier Lymphozyten-Gruppen eine Sensitivität und Spezifität von über 90% besitzt (6). Fällt dieser Test positiv aus, können zur Identifizierung des Gendefektes, die für die genetische Beratung der Familie entscheidend ist, Sequenzierungsanalysen angeschlossen werden. Therapie Eine kausale Therapie gibt es nicht. In erster Linie ist eine individuell angepasste, prophylaktische und symptomatische Versorgung der Patienten zur Vermeidung sekundärer Komplikationen essentiell (137, 139). Da hämatologische Komplikationen, Knochenmarksversagen und Immundefekt die führende Todesursache sind, finden sich hier die wichtigsten therapeutischen Ansatzpunkte. Ähnlich wie bei der FA konnte auch hier für Oxymetholon eine indirekte, über Zytokine vermittelte Induktion der Hämatopoiese gezeigt werden. Etwa 60% aller DC Patienten sprechen darauf an und der Effekt kann über Jahre anhalten. Während bei manchen Patienten bereits eine Dosis von 0,25 mg/ kgKG/d bereits ausreicht, können bei initialen Therapieversagern durch eine Dosissteigerung auf 2-5 mg/kg/d gute Effekte erzielt werden (169). Ein weiterer Therapieansatz beruht auf der Beobachtung, dass sowohl männliche als auch weibliche Geschlechtshormone über eine Induktion des TERT-Gens zu einer verbesserten Telomeraseaktivität und somit zu einer Stabilisierung des Krankheitsbildes führen (Androgene verbessern das BB in 60% der Patienten). Die einzige kurative Therapieoption ist die SZT. Allerdings ist diese in DC-Patienten mit einer deutlich erhöhten Mortalität assoziiert, die insbesondere auf pulmonale und vaskuläre Komplikationen zurückzuführen ist. Nicht myeloablative Konditionierungsregimes zeigen bessere Ergebnisse (111, 115, 173). 4 Immunoossäre Dysplasie Typ Schimke 1974 beschrieb Robert Schimke eine Erkrankung, die mit spondyloepiphysärer Dysplasie, eine langsam fortschreitenden Immundefekt und einem Immunkomplexnephritis sowie einer Mukopolysacharidose einherging als „Chondroitin6-Sulfat-Mukopolysaccharidose“ (144). Das Phänomen der Mukopolysaccharidose konnte im Kontext dieser Erkrankung später ausgeschlossen werden, der Name „Immunoossäre Dysplasie Typ Schimke“ blieb jedoch erhalten (OMIM #242900) (152). Ursächlich für die Erkrankung sind autosomal-rezessiv vererbte Mutationen im swi/snf-related matrix-associated actin-dependent regulator of chromatin, subfamily a-like 1 (SMARCAL1) Gen (16). Auf dem Boden einer Loss-of-functionMutation leiden betroffene Patienten immunologisch meist an kombinierten T/B-Zell-Reifungsdefekten mit verminderten CD4+ T-Zellen die zu einer T-ZellLymphopenie mit verminderter CD4/CD8Ratio führt. Gleichzeitig ist die Anzahl γ/δ positiver T-Zellen erhöht, die Frequenz naiver CD4+CD45RA+ Zellen sowie die proliferative Antwort auf die meisten Mitogene vermindert, sodass ein klinisch relevanter Immundefekt entsteht. Pathogonomonisch sind zudem skelettale Fehlbildungen auf dem Boden einer pathologischen Chondrogenese, Wachstumsverzögerung, eine steroidresistente fokal-segmentale Glomerulosklerose, frühzeitige atherosklerotische Gefäßveränderungen mit konsekutiven transitorischen ischiämischen Attacken (TIA), Zahnfehlbildungen sowie eine testikuläre Hypoplasie mit Azoospermie (30, 45, 108, 134). Darüber hinaus begünstigt diese Erkrankung die Entstehung eines Non-Hodgkin-Lymphoms (12). Therapeutische Optionen sind primär symptomorientierte Maßnahmen. Bei schwerer Immundefizienz kann die Indikation zur Stammzelltransplantation gestellt werden, die jedoch nur die hämatologischen/ immunologischen Komplikationen der Erkrankung therapiert (119). Darüber hinaus kann eine Nierentransplantation erwogen werden (95), und auch eine kombinierte Nierentransplantation/SZT stellt eine zu diskutierende Option dar. Das Problem der häufigen TIA bleibt jedoch trotz SZT und Nierentransplantation erhalten. 5 MCM4-Defekt 2012 wurde fast zeitgleich der MCM4Defekt (OMIM #609981) von 3 Gruppen in insgesamt 24 Patienten beschrieben (22, 61, 74). Ursächlich für diese Erkrankung ist ein DNA-Entwindungsdefekt durch eine autosomal-rezessiv vererbte Mutation im MCM4/PRKDC-Gen auf Chromosom 8. Klinisch imponieren die Patienten durch die Trias (i) NK-Zell-Verminderung mit erhöhter Anfälligkeit für virale Infektionen (insbesondere CMV), (ii) Nebenniereninsuffizienz und (iii) Kleinwüchsigkeit. Da MCM4/PRKDC im ATM/ATR-Signalweg eine wesentliche Rolle spielt, geht diese Erkrankung mit einer erhöhten Chromosomenbrüchigkeit einher (22, 61, 74). Immunologisch charakteristisch ist der deutlich vermehrte Anteil an CD56brightNK-Zellen bei insgesamt deutlicher NKZell-Verminderung (61). 6 Zentromer-Instabilitätsdefekte Die bisher molekular aufgeklärten ICFSyndrome (Immunodeficiency, Centromeric instability, Facial anomalies syndrome) sind autosomal-rezessiv vererbte Erkrankungen, die mit primärer Gesichtsdysmorphie, Antikörpermangel und einem T/B-Zell-Defekt einhergehen. Gleichzeitig sind eine Instabilität chromosomaler Zentromere und partielle Hypomethylierungsmuster auf den Chromosomen 1, 9, und 16 charakteristisch. Zwei verschiedene, molekulare Entitäten, ICF Typ1 (OMIM #602900) und ICF Typ 2 (OMIM #614069), verursacht durch Mutationen in DNMT3B und ZBTB24, sind bisher bekannt (24, 27, 65, 78, 120). Klinisch fallen betroffene Patienten durch Dysmorphien (flache Nasenwurzel, Epikanthus, Hypertelorismus, Mikrognathie), eine mentale Retardierung und eine erhöhte Anfälligkeit für Infektionen der Atemwege, des Gastrointestinaltraktes sowie der Haut auf. Assoziiert kann eine variabel ausgeprägte Immundefizienz auftreten. Beobachtet wurden erniedrigte Werte für IgA, IgG, IgG2 und IgG4, reduzierte Impfantikörper sowie eine vermindere Lymphozytenproliferation und verminderte CD4+CD45RA+ T-Zellen (von Bernuth und Kaindl, unpublizierte Beobachtung). Ein frühzeitiger Beginn der Immunglobulinsubstitution kann den Krankheitsverlauf positiv beeinflussen und sekundäre, infektionsbedingte Organschäden reduzieren. Im Falle eines schweren Immundefektes kann eine Stammzelltransplantation erwogen werden. Neuropädiatrie in Klinik und Praxis 12. Jg. (2013) Nr. 1 31 #6918_Neuropädiatrie_01-2013.indd 31 09.01.13 13:38 Originalien/Übersichten Neben den beschriebenen Syndromen können folgende weitere Syndrome mit Mikrozephalie und Immundefekt einhergehen und sollten ggf. differenzialdiagnostisch in Betracht gezogen werden. 7 22q11.2-Deletionssyndrome Die klinische Erstbeschreibung der Thymushypoplasie, später als eine im Rahmen des 22q11-Mikrodeletionssyndroms auftretende Erscheinung erfolgte bereits 1929 durch den Kindearzt L. Harrington (35). Angelo DiGeorge erkannte 1968 den Zusammenhang der Thymushypoplasie mit immunologischen Auffälligkeiten und vermutete als Ursache für das gleichzeitige Auftreten von Thymus- und Nebenschilddrüsenhypoplasie eine embryonale Fehlbildung der dritten und vierten Schlundtasche (35). 1981 konnte durch del la Chapelle et al. schließlich die genetische Ursache durch eine Deletion auf Chromosom 22 identifiziert werden. Heute werden in der Gruppe der 22q11.2-Deletionssyndrome das DiGeorge Syndrom, das Takao-Syndrom (157) sowie das Shprintzen-Syndrom (auch Velocardiofaziales Syndrom genannt) zusammengefasst (148). Wesentliche Gemeinsamkeit ist eine Fehlbildung bestehend aus Herzfehler (cardiac anomalies, häufig Fallot-Tetralogie), Gesichtsfehlbildungen (abnormal facies, u. a. Mikrognathie, tiefsitzende Ohren, abfallende Lidpalten, kurzes Philtrum), Thymushypoplasie (thymic hypoplasia), Gaumenspalte (cleft palate) und Hypokalzämie (hypocalcemia), die mit der Gemeinsamkeit des genetischen Defektes auf Chromosom 22q11.2 zu dem Akronym CATCH22/CATCH-Phänotyp (148, 180) führte. Im Rahmen einer begleitend auftretenden Nebenschilddrüsenhypoplasie kann die endokrine Freisetzung von Parathormon insuffizient sein, sodass hypokalzämiebdingt tetanische Krampfanfälle entstehen können. Der klinische Verdacht wird häufig pränatal spätestens jedoch bei der Geburt, im Rahmen des Fehlbildungskomplexes erhoben. Weitere klinische Auffälligkeiten sind ein abnormer Säuglingsschrei, Schalleitungsstörungen, mukuläre Hypotonie sowie eine im weiteren Verlauf imponierende Entwicklungsverzögerung. Die Diagnosesicherung erfolgt durch den molekulargenetischen Nachweis einer 22q11-Deletion. Im Rahmen einer Thymushypoplasie kann eine T-Zell-Lymphopenie auftreten, die zu einer pathologischen Infektanfälligkeit führt. In Abhängigkeit von der Größe funktionellen Thymusgewebes besteht eine Erniedrigung der CD4+ T-Zellen (partielles DiGeorge-Syndrom) und ggf. auch naiver (CD45RA+) CD4+ T-Zellen (kom- plettes DiGeorge-Syndrom). Im letzteren Fall finden sich bei deutlich reduzierte TRECs, die mit der funktionalen Kapazität des Thymus zu korrelieren scheinen. Entscheidend für die Einschätzung der immunologischen Kompetenz ist die Fähigkeit von T-Lymphozyten auf Antigene zu reagieren. Während bei Thymushypoplasie das Restgewebe kompensatorisch im Verlauf für eine ausreichende Zahl CD4+ T-Zellen sorgen kann, handelt es sich bei kompletter Thymusaplasie um einen immunologischen Notfall, sodass zelltherapeutische Ansätze sowie die Option einer Thymustransplantation in Erwägung gezogen werden sollten (26, 58, 83). Zur Evaluation des immunologischen Status und des daraus resultierenden Infektionsrisikos sollte eine entsprechende Diagnostik in einem spezialisierten Zentrum erfolgen. Unabhängig davon erfordert die Betreuung dieser Patienten ein interdiziplinäres Vorgehen, das kardiologischen, endokrinologischen und chirurgischen Anforderungen gerecht wird (13). 8 Cohen-Syndrom Das Cohen Syndrom ist eine autosomal-rezessiv vererbte Erkrankung, die typsicherweise mit muskulärer Hypotonie, Adipositas und prominenten Schneidezähnen einhergeht (31). Das klinische Bild ist sehr variabel, sodass eine klinische Diagnosestellung schwierig ist. Die folgenden Symptome sollten jedoch Anlass geben, das Cohen-Syndrom differentialdiagnostisch in Erwägung zu ziehen (38, 81): skelettale Auffälligkeiten (Gelenküberbeweglichkeit, Klinodaktylie, Fußdeformitäten, Lendenhyperlordose, Trichterbrust), Mikrozephalie bei prominentem Mittelgesicht, hoher Gaumen, Zungenhypertrophie, Innenohrschwerhörigkeit, ophthalmologische Komplikationen (Iriskolobom, Mypoie, Optikusatrophie, Retinitis pigmentosa, Retinoschisis). Hämatologische Auffälligkeiten schließen insbesondere Thrombozytopenien und Neutropenien ein. Ursächlich sind Mutationen im CHO1Gen auf Chromosom 8q22, welche in der finnischen Bevölkerung deutlich häufiger vorkommen als in anderen europäischen Ländern (85, 112). 9 Angeborene Glycosylierungsdefekte Der angeborene Glycosylierungsdefekt Typ IIc (OMIM #266265), auch bekannt als Leukozytenadhäsiondefekt Typ II oder Rambam-Hasgaron Syndrom, wird durch Mutationen im SLC23C1-Gen auf Chromosom 11p11.2 verursacht (48, 54, 94, 96, 98). Diese führen bei autoso- mal-rezessivem Vererbungsmuster zur defekten oder fehlenden Synthese des Guanosin-5’Diphosphat-Fukose-Transporter-Moleküls im Golgi-Apparat. Da Fukose ein wesentlicher Bestandteil von Leukozytenadhäsionsmolekülen und den H-Blutgruppenantigenen ist, ist eine erhöhte Zahl zirkulierender Leukozyten (keine Migration ins Gewebe) bei gleichzeitigem Fehlen von AB0-Blutgruppenantigenen (Bombay-Phänomen) pathognomonisch für diese Erkrankung. Infolge der verminderten Leukozytenmigration treten gehäuft rezidivierende, oft lebensbedrohliche bakterielle Infektionen auf. Weitere klinische Charakteristika können bereits im Säuglings- und Kleinkindesalter diagnoseweisend sein (Gesichtsdysmorphie mit flachem Nasenrücken, Kleinwuchs, Mikrozephalie) oder erst mit fortscheitendem Alter erkennbar werden (Entwicklungsverzögerung, Lerndefizit, Kleinwuchs, Peridontitis mit Zahnverlust, Adipositas). 10 Patienten wurden bislang beschrieben (48, 54). Durch eine Fukose-Supplementierung konnte bei einigen die Neutrophilenfunktion deutlich verbessert und Infektionsrate reduziert werden (96, 98). Der angeborene Glykosylierungsdefekt Typ Ig (OMIM #607143) wurde erstmalig 2002 in einem Mädchen mit muskulärer Hypotonie und Trinkschwäche, psychomotorischer Entwicklungsverzögerung, Mikrozephalie, Gesichtsdysmorphie und rezidivierenden Infektionen der oberen und unteren Atemwege bei deutlich verminderten IgG-Spiegeln beschrieben (25, 185). Weitere Fallberichte folgten und der klinische Phänotyp wurde um skelettale Dysplasien, Seh-, Hörstörungen und kardiale Auffälligkeiten (Kardiomyopathie) erweitert (87, 165). Ursächlich für diese Erkrankung ist ein Defekt im ALG12-Gen, das für die Man7GlcNAc2-PP-DolichylMannosyltransferase codiert (25). 10 MECP2-Duplikationssyndrom Beim MEPC2 (methyl-CpG-binding protein-2)-Duplikations-Syndrom handelt es sich um eine X-chromosomal vererbte Erkrankung, die typischerweise mit infantiler Hypotonie („floppy infant“), milder Dysmorphie, Mikrozephalie, rezidivierenden Infektionen und neurologischen Symptomen einhergeht (92). Letztere können dabei von einer verzögerten Entwicklung der Sprache und motorischen Fähigkeiten bis zu Krampfanfällen, progressiver Spastik und psychiatrischen Auffälligkeiten (Depression, autistische Züge, Angststörungen) reichen (123). Des Weiteren wurden Pateinten mit endokrinologischen Störungen (u. a. Hypothyroidismus, vorzeitige Menopause, Diabetes) beschrieben 32 Neuropädiatrie in Klinik und Praxis 12. Jg. (2013) Nr. 1 #6918_Neuropädiatrie_01-2013.indd 32 09.01.13 13:38 Originalien/Übersichten (124). Immunologisch fallen die meisten Patienten bereits im frühen Kindesalter durch rezidivierende Pneumonien auf. Bei einigen Patienten konnten zudem verminderte IgA-, IgG2- und IgG4-Spiegel gemessen werden (57), (Bauer, Krüger, von Bernuth, unpublizierte Beobachtungen). Aufgrund des X-chromosomalen Vererbungsmusters (Xq28) sind Jungen häufiger betroffen (92). Schlussfolgerungen Bei Patienten mit Mikrozephalie ist die aufmerksame Suche nach einem Immundefekt indiziert. Klinische Informationen mit hohem positiv-prädiktiven Wert für angeborene Immundefekte sind a) außergewöhnliche Infektionen (besonders schwerer Verlauf, atpyische (=„opportunistische“) Erreger), b) eine positive Familienanamnese (Konsanguinität und/ oder Immundefekte bekannt) und c) abweichende Perzentilenkurven für Gewicht oder Länge oder Kopfumfang (52). Im Falle einer Mikrozephalie kann jedoch auch ohne eine für einen Immundefekt verdächtige Anamnese die gezielte Überprüfung des Immunsystems durchgeführt werden und insbesondere die Untersuchung der Chromosomenstabilität eventuell Hinweise auf die genetische Ursache der Mikrozephalie liefern. Die Basisdiagnostik sollte ein großes Blutbild (unter besonderer Berücksichtigung der Lymphozytenzahl), die basalen Spiegel für IgG, IgA, IgM und IgE sowie Impfantikörper gegen Tetanus und Masern bei positiver Impfanamnese umfassen. Bei der Sonderkonstellation „Mikrozephalie mit Immundefekt“ oder „Mikrozephalieunklarere Genese“ sind nach unserer Auffassung auch die Analyse der Lymphozytensubpopoulationen (unter besonderer Berücksichtigung des CD4+CD45RA+/ CD4+CD45R0+-Verhältnisses und des α/β zu γ/δ T-Zell-Verhältnisses, der Klonalität des Vβ-T-Zell-Rezeptor-Repertoires und die gezielte Suche nach Störungen im Erhalt der DNA-Integrität hilfreich. Insbesondere Defekte der homologen Rekombination und des Non-Homologous End-Joinings (NHEJ) können in vitro typische immunologische Konstellationen aufweisen (Hyper-IgM-Phänotyp, niedrige Impfantikörper, kaum CD4+CD45RA+ T-Zellen, erhöhter Anteil an γ/δ-T-Zellen, oligoklonales (= eingeschränktes) Vβ-TZell-Rezeptor-Repertoire, erhöhte Strahlensensibilität). Aber auch andere hier dargestellte Ursachen einer Mikrozephalie können über eine gezielte Untersuchung der DNA-Integrität diagnostiziert werden. Dabei ist es wichtig, dem untersuchenden Labor klinische Verdachtsdiagnosen mit- zuteilen, da die verschiedenen Entitäten nicht mit einer globalen Überprüfung der „Chromosomenstabilität“ diagnostiziert werden können. Eine Zusammenfassung über die wichtigsten hier vorgestellten Immundefekte und die indizierte Diagnostik gibt die Tabelle 1. Abkürzungen HR NHEJ Homologe Rekombination Non-Homologous-EndJoining DNA-DSB DNA-Doppelstrangbruch AT Ataxia teleangiektasia NBS Nijmegen-BreakageSyndrom FA Fanconi-Anämie DC Dyskeratosis congenita ICF-Syndrom Immunodeficiency, centromeric instability and facial dysmorphism syndrome SZT Stammzelltransplantation Literatur 1. Ahnesorg P, Smith P, and Jackson SP. 2006. XLF interacts with the XRCC4-DNA ligase IV complex to promote DNA nonhomologous endjoining. Cell 124(2): 301–13. 2. Akkari YM, Bateman RL, Reifsteck CA et al. 2000. DNA replication is required To elicit cellular responses to psoralen-induced DNA interstrand cross-links. Molecular and cellular biology 20(21): 8283–9. 3. Albert M, Gennery A, Greil J et al. Successful SCT for Nijmegen breakage syndrome. http:// www.nature.com/bmt/journal/v45/n4/pdf/bmt2009207a.pdf. 4. Alter BP, Giri N, Savage SA et al. 2010. Malignancies and survival patterns in the National Cancer Institute inherited bone marrow failure syndromes cohort study. British journal of haematology 150(2):179–88. 5. Alter BP and Kupfer G. 2012. Fanconi Anemia. 1–29. 6. Alter BP, Rosenberg PS, Giri N et al. 2012. Telomere length is associated with disease severity and declines with age in dyskeratosis congenita. Haematologica 97(3): 353–9. 7. Armanios M, Chen J, Chang YC et al. 2005. Haploinsufficiency of telomerase reverse transcriptase leads to anticipation in autosomal dominant dyskeratosis congenita. 102(44): 1–5. 8. Auerbach AD. 1992. Fanconi anemia and leukemia: tracking the genes. Leukemia: official journal of the Leukemia Society of America, Leukemia Research Fund, U.K 6 Suppl 1: 1–4. 9. Auerbach AD. 1997. Fanconi anemia: genetic testing in Ashkenazi Jews. Genetic testing 1(1): 27–33. 10. Auerbach AD. 2003. Diagnosis of Fanconi Anemia by Diepoxybutane Analysis - Current Protocols. 8.7.1–8.7.15 http://www.currentprotocols.com/WileyCDA/CPUnit/refId-hg0807.html. 11. Babbe H, Chester N, Leder P et al. 2007. The Bloom’s syndrome helicase is critical for devel- opment and function of the alphabeta T-cell lineage. Molecular and cellular biology 27(5): 1947–59. 12. Baradaran-Heravi A, Raams A, Lubieniecka J et al. 2012. SMARCAL1 deficiency predisposes to non-Hodgkin lymphoma and hypersensitivity to genotoxic agents in vivo. American journal of medical genetics. Part A 158A(9): 2204–13. 13. Bassett AS, McDonald-McGinn DM, Devriendt K et al. 2011. Practical guidelines for managing patients with 22q11.2 deletion syndrome. The Journal of pediatrics 159(2): 332–9.e1. 14. Ben-Omran TI, Cerosaletti K, Concannon P et al. 2005. A patient with mutations in DNA Ligase IV: clinical features and overlap with Nijmegen breakage syndrome. American journal of medical genetics. Part A 137A(3): 283–7. 15. Bienemann K, Burkhardt B, Modlich S et al. 2011. Promising therapy results for lymphoid malignancies in children with chromosomal breakage syndromes (Ataxia teleangiectasia or Nijmegenbreakage syndrome): a retrospective survey. British journal of haematology 155(4): 468–76. 16. Boerkoel CF, Takashima H, John J et al. 2002. Mutant chromatin remodeling protein SMARCAL1 causes Schimke immuno-osseous dysplasia. Nature genetics 30(2): 215–20. 17. Broccoletti T, Del Giudice E, Amorosi S et al. 2008. Steroid-induced improvement of neurological signs in ataxia-telangiectasia patients. European journal of neurology: the official journal of the European Federation of Neurological Societies 15(3): 223–8. 18. Broccoletti T, Del Giudice E, Cirillo E et al. 2011. Efficacy of very-low-dose betamethasone on neurological symptoms in ataxia-telangiectasia. European journal of neurology: the official journal of the European Federation of Neurological Societies 18(4): 564–70. 19. Buck D, Malivert L, de Chasseval R et al. 2006. Cernunnos, a novel nonhomologous end-joining factor, is mutated in human immunodeficiency with microcephaly. Cell 124(2): 287–99. 20. Buck D, Moshous D, de Chasseval R et al. 2006. Severe combined immunodeficiency and microcephaly in siblings with hypomorphic mutations in DNA ligase IV. European journal of immunology 36(1): 224–35. 21. Callén E, Casado J a, Tischkowitz MD et al. 2005. A common founder mutation in FANCA underlies the world’s highest prevalence of Fanconi anemia in Gypsy families from Spain. Blood 105(5): 1946–9. 22. Casey JP, Nobbs M, McGettigan P et al. 2012. Recessive mutations in MCM4/PRKDC cause a novel syndrome involving a primary immunodeficiency and a disorder of DNA repair. Journal of medical genetics 49(4): 242–5. 23. Castella M and Taniguchi T. 2010. The role of FAN1 nuclease in the Fanconi anemia pathway. Cell cycle (Georgetown, Tex.) 9(21): 4259–60. 24. Cerbone M, Wang J, Van der Maarel SM et al. 2012. Immunodeficiency, centromeric instability, facial anomalies (ICF) syndrome, due to ZBTB24 mutations, presenting with large cerebral cyst. American journal of medical genetics. Part A 158A(8): 2043–6. 25. Chantret I, Dupré T, Delenda C et al. 2002. Congenital disorders of glycosylation type Ig is defined by a deficiency in dolichyl-Pmannose:Man7GlcNAc2-PP-dolichyl mannosyltransferase. The Journal of biological chemistry 277(28): 25815–22. Neuropädiatrie in Klinik und Praxis 12. Jg. (2013) Nr. 1 33 #6918_Neuropädiatrie_01-2013.indd 33 09.01.13 13:38 Originalien/Übersichten 26. Chinn IK and Markert ML. 2011. Induction of tolerance to parental parathyroid grafts using allogeneic thymus tissue in patients with DiGeorge anomaly. The Journal of allergy and clinical immunology 127(6): 1351–5. 27. Chouery E, Abou-Ghoch J, Corbani S et al. 2011. A novel deletion in ZBTB24 in a Lebanese family with immunodeficiency, centromeric instability, and facial anomalies syndrome type 2. Clinical genetics: 28. Chrzanowska KH, Kleijer WJ, KrajewskaWalasek M et al. 1995. Eleven Polish patients with microcephaly, immunodeficiency, and chromosomal instability: the Nijmegen breakage syndrome. American journal of medical genetics 57(3): 462–71. 29. Chrzanowska KH, Kleijer WJ, KrajewskaWalasek M, et al. 1995. Eleven Polish patients with microcephaly, immunodeficiency, and chromosomal instability: the Nijmegen breakage syndrome. American journal of medical genetics 57(3): 462–71. 30. Clewing JM, Antalfy BC, Lücke T et al. 2007. Schimke immuno-osseous dysplasia: a clinicopathological correlation. Journal of medical genetics 44(2): 122–30. 31. Cohen MM, Hall BD, Smith DW et al. 1973. A new syndrome with hypotonia, obesity, mental deficiency, and facial, oral, ocular, and limb anomalies. The Journal of pediatrics 83(2): 280–4. 32. Cohen SB, Graham ME, Lovrecz GO et al. 2007. Protein composition of catalytically active human telomerase from immortal cells. Science (New York, N.Y.) 315(5820): 1850–3. 33. Constantinou A. 2012. Rescue of replication failure by Fanconi anaemia proteins. Chromosoma 121(1): 21–36. 34. Demuth I, Dutrannoy V, Marques W et al. 2011. New mutations in the ATM gene and clinical data of 25 AT patients. Neurogenetics 12(4): 273–82. 35. DiGeorge A. 1968. Congenital absence of the thymus and its immunologic consequences: concurrence with congenital hypoparathyroidism. White Plains, NY: March of Dimes-Birth Defects Foundation;: 116–21. 42. D’Andrea AD. 2010. Susceptibility pathways in Fanconi’s anemia and breast cancer. The New England journal of medicine 362(20): 1909–19. 43. D’Andrea AD and Grompe M. 2003. The Fanconi anaemia/BRCA pathway. Nature reviews. Cancer 3(1): 23–34. 44. Eiler M, Frohnmeyer D, Frohnmeyer L et al. 2008. Fanconi Anemia – Guidelines for Diagnosis and Management. 45. Elizondo LI, Cho KS, Zhang W et al. 2009. Schimke immuno-osseous dysplasia: SMARCAL1 loss-of-function and phenotypic correlation. Journal of medical genetics 46(1): 49–59. 46. Enders A, Fisch P, Schwarz K et al. 2006. A severe form of human combined immunodeficiency due to mutations in DNA ligase IV. Journal of immunology (Baltimore, Md.: 1950) 176(8)5060–8. 47. Enders A, Fisch P, Schwarz K et al. 2006. A Severe Form of Human Combined Immunodeficiency Due to Mutations in DNA Ligase IV. The Journal of Immunology(176):060–5068. 48. Etzioni A, Frydman M, Pollack S et al. 1992. Brief report: recurrent severe infections caused by a novel leukocyte adhesion deficiency. The New England journal of medicine 327(25)1789–92. 49. Etzioni A, Lahat N, Benderly A et al. 1989. Humoral and cellular immune dysfunction in a patient with Bloom’s syndrome and recurrent infections. Journal of clinical & laboratory immunology 28(3)151–4. 50. Faivre L, Guardiola P, Lewis C et al. 2000. Association of complementation group and mutation type with clinical outcome in fanconi anemia. European Fanconi Anemia Research Group. Blood 96(13)4064–70. 51. Fanconi G. 1927. Familiäre infantile perniziosartige Anämie (perniziöses Blutbild und Konstitution). Jahrbuch Kinderheilkunde(117): 257–280. 52. Farmand S, Baumann U, von Bernuth H et al. 2011. [Interdisciplinary AWMF guideline for the diagnostics of primary immunodeficiency]. Klinische Pädiatrie 223(6): 378–85. 36. Digweed M and Sperling K. 2004. Nijmegen breakage syndrome: clinical manifestation of defective response to DNA double-strand breaks. DNA repair 3(8-9): 1207–17. 53. Fausto Cossu,Tom J Vulliamy,Anna Marrone, Manuela Badiali,Antonio Cao,Inderjeet Dokal. 2002. A novel DKC1 mutation, severe combined immunodeficiency (T+B-NK- SCID) and bone marrow transplantation in an infant with Hoyeraal-Hreidarsson syndrome. British journal of haematology 119(3): 765–8. 37. Distel L, Neubauer S, Varon R et al. 2003. Fatal toxicity following radio- and chemotherapy of medulloblastoma in a child with unrecognized Nijmegen breakage syndrome. Medical and pediatric oncology 41(1): 44–8. 54. Frydman M, Etzioni A, Eidlitz-Markus T et al. 1992. Rambam-Hasharon syndrome of psychomotor retardation, short stature, defective neutrophil motility, and Bombay phenotype. American journal of medical genetics 44(3): 297–302. 38. Douzgou S and Petersen MB. 2011. Clinical variability of genetic isolates of Cohen syndrome. Clinical genetics 79(6): 501–6. 55. Garcia-Higuera I, Taniguchi T, Ganesan S et al. 2001. Interaction of the Fanconi anemia proteins and BRCA1 in a common pathway. Molecular cell 7(2): 249–62. 39. Du L, Peng R, Björkman A et al. 2012. Cernunnos influences human immunoglobulin class switch recombination and may be associated with B cell lymphomagenesis. The Journal of experimental medicine 209(2): 291–305. 40. Dufour C, Rondelli R, Locatelli F et al. 2001. Stem cell transplantation from HLA-matched related donor for Fanconi’s anaemia: a retrospective review of the multicentric Italian experience on behalf of AIEOP-GITMO. British journal of haematology 112(3): 796–805. 41. Dutrannoy V, Demuth I, Baumann U et al. 2010. Clinical variability and novel mutations in the NHEJ1 gene in patients with a Nijmegen breakage syndrome-like phenotype. Human mutation 31(9): 1059–68. 56. Gatti R. Ataxia-Telangiectasia. In GeneReviewsTM [Internet], p. Bookshelf ID: NBK26468. University of Washington, Seattle. 57. del Gaudio D, Fang P, Scaglia F et al. 2006. Increased MECP2 gene copy number as the result of genomic duplication in neurodevelopmentally delayed males. Genetics in Medicine 8(12): 784– 792. The American College of Medical Genetics. 58. Gennery AR. 2012. Immunological aspects of 22q11.2 deletion syndrome. Cellular and molecular life sciences: CMLS 69(1): 17–27. 59. Gennery a R. 2006. Primary immunodeficiency syndromes associated with defective DNA double-strand break repair. British medical bulletin 77-78: 71–85. 60. Ghosh S and Saha T. 2012. Central Role of Ubiquitination in Genome Maintenance: DNA Replication and Damage Repair. ISRN Molecular Biology 2012: 1–9. 61. Gineau L, Cognet C, Kara N et al. 2012. Partial MCM4 deficiency in patients with growth retardation, adrenal insufficiency, and natural killer cell deficiency. The Journal of clinical investigation 122(3): 821–32. 62. Giovannetti A, Mazzetta F, Caprini E et al. 2002. Skewed T-cell receptor repertoire, decreased thymic output, and predominance of terminally differentiated T cells in ataxia telangiectasia. Blood 100(12): 4082–9. 63. Gluckman E. 1996. Allogeneic bone marrow transplantation in Fanconi anemia. Bone marrow transplantation 18 Suppl 3: S33–5. 64. Gluckman E, Auerbach AD, Horowitz MM et al. 1995. Bone marrow transplantation for Fanconi anemia. Blood 86(7): 2856–62. 65. de Greef JC, Wang J, Balog J et al. 2011. Mutations in ZBTB24 are associated with immunodeficiency, centromeric instability, and facial anomalies syndrome type 2. American journal of human genetics 88(6): 796–804. 66. Gruhn B, Seidel J, Zintl F et al. 2007. Successful bone marrow transplantation in a patient with DNA ligase IV deficiency and bone marrow failure. Orphanet journal of rare diseases 2:5. 67. Guardiola P, Socié G, Li X et al. 2004. Acute graft-versus-host disease in patients with Fanconi anemia or acquired aplastic anemia undergoing bone marrow transplantation from HLA-identical sibling donors: risk factors and influence on outcome. Blood 103(1): 73–7. 68. Guinan EC, Lopez KD, Huhn RD et al. 1994. Evaluation of granulocyte-macrophage colony-stimulating factor for treatment of pancytopenia in children with fanconi anemia. The Journal of pediatrics 124(1): 144–50. 69. Hinz T, Allam A, Wesch D et al. 2000. Cell-surface expression of transrearranged Vgammacbeta T-cell receptor chains in healthy donors and in ataxia telangiectasia patients. British journal of haematology 109(1): 201–10. 70. Howlett NG, Taniguchi T, Olson S et al. 2002. Biallelic inactivation of BRCA2 in Fanconi anemia. Science (New York, N.Y.) 297(5581): 606–9. 71. Hoyeraal H, Lamvik J, and Moe P. 1970. Congenital hypoplastic thrombocytopenia and cerebral malformations in two brothers. Acta Paediatr Scand. 59(2): 185–191. 72. Hreidarsson S, Kristjansson K, Johannesson G et al. 1988. A syndrome of progressive pancytopenia with microcephaly, cerebellar hypoplasia and growth failure. Acta paediatrica Scandinavica 77(5): 773–5. 73. Huck K, Hanenberg H, Gudowius S et al. 2006. Delayed diagnosis and complications of Fanconi anaemia at advanced age--a paradigm. British journal of haematology 133(2): 188–97. 74. Hughes CR, Guasti L, Meimaridou E et al. 2012. MCM4 mutation causes adrenal failure, short stature, and natural killer cell deficiency in humans. The Journal of clinical investigation 122(3): 814–20. 75. Hütteroth TH, Litwin SD, and German J. 1975. Abnormal immune responses of Bloom’s syndrome lymphocytes in vitro. The Journal of clinical investigation 56(1): 1–7. 76. Ishida R and Buchwald M. 1982. Susceptibility of Fanconi’s Anemia Lymphoblasts to DNA- 34 Neuropädiatrie in Klinik und Praxis 12. Jg. (2013) Nr. 1 #6918_Neuropädiatrie_01-2013.indd 34 09.01.13 13:38 Originalien/Übersichten cross-linking and Alkylating Agents. Cancer Res. 42(10): 4000–4006. 77. Jacquemont C and Taniguchi T. 2006. Disruption of the Fanconi anemia pathway in human cancer in the general population. Cancer biology & therapy 5(12): 1637–9. 78. Jin B, Tao Q, Peng J et al. 2008. DNA methyltransferase 3B (DNMT3B) mutations in ICF syndrome lead to altered epigenetic modifications and aberrant expression of genes regulating development, neurogenesis and immune function. Human molecular genetics 17(5): 690–709. 79. Kajtár P and Méhes K. 1994. Bilateral coats retinopathy associated with aplastic anaemia and mild dyskeratotic signs. American journal of medical genetics 49(4): 374–7. 80. Kirwan M, Vulliamy T, Marrone A et al. 2009. Defining the pathogenic role of telomerase mutations in myelodysplastic syndrome and acute myeloid leukemia. Human mutation 30(11): 1567–73. 81. Kivitie-Kallio S and Norio R. 2001. Cohen syndrome: essential features, natural history, and heterogeneity. American journal of medical genetics 102(2): 125–35. 82. Knight SW, Heiss NS, Vulliamy TJ et al. 1999. Unexplained aplastic anaemia, immunodeficiency, and cerebellar hypoplasia (HoyeraalHreidarsson syndrome) due to mutations in the dyskeratosis congenita gene, DKC1. British journal of haematology 107(2): 335–9. 83. Kobayashi D, Sallaam S, and Humes RA. 2012. Tetralogy of Fallot with Complete DiGeorge Syndrome: Report of a Case and a Review of the Literature. Congenital heart disease: 84. Koc A, Pronk JC, Alikasifoglu M et al. 1999. Variable pathogenicity of exon 43del (FAA) in four Fanconi anaemia patients within a consanguineous family. British journal of haematology 104(1): 127–30. 92. Lubs H, Abidi F, Bier JA et al. 1999. XLMR syndrome characterized by multiple respiratory infections, hypertelorism, severe CNS deterioration and early death localizes to distal Xq28. American journal of medical genetics 85(3): 243–8. 93. Lähdesmäki A, Taylor a MR, Chrzanowska KH et al. 2004. Delineation of the role of the Mre11 complex in class switch recombination. The Journal of biological chemistry 279(16): 16479–87. 94. Lübke T, Marquardt T, Etzioni A et al. 2001. Complementation cloning identifies CDG-IIc, a new type of congenital disorders of glycosylation, as a GDP-fucose transporter deficiency. Nature genetics 28(1): 73–6. 95. Lücke T, Kanzelmeyer N, Baradaran-Heravi A et al. 2009. Improved outcome with immunosuppressive monotherapy after renal transplantation in Schimke-immuno-osseous dysplasia. Pediatric transplantation 13(4): 482–9. 96. Lühn K, Wild MK, Eckhardt M et al. 2001. The gene defective in leukocyte adhesion deficiency II encodes a putative GDP-fucose transporter. Nature genetics 28(1): 69–72. 97. MacMillan ML and Wagner JE. 2010. Haematopoeitic cell transplantation for Fanconi anaemia – when and how? British journal of haematology 149(1): 14–21. 98. Marquardt T, Lühn K, Srikrishna G et al. 1999. Correction of leukocyte adhesion deficiency type II with oral fucose. Blood 94(12): 3976–85. 99. Marrone A, Walne A, Tamary H et al. 2007. Telomerase reverse-transcriptase homozygous mutations in autosomal recessive dyskeratosis congenita and Hoyeraal-Hreidarsson syndrome. Blood 110(13): 4198–205. the DNA damage response. Nature cell biology 4(12): 913–20. 110. Neveling K, Endt D, Hoehn H et al. 2009. Genotype-phenotype correlations in Fanconi anemia. Mutation research 668(1-2): 73–91. 111. Nishio N, Takahashi Y, Ohashi H et al. 2011. Reduced-intensity conditioning for alternative donor hematopoietic stem cell transplantation in patients with dyskeratosis congenita. Pediatric transplantation 15(2): 161–6. 112. Norio R. 2003. Finnish Disease Heritage I: characteristics, causes, background. Human genetics 112(5-6): 441–56. 113. Nowak-Wegrzyn A, Crawford TO, Winkelstein JA et al. 2004. Immunodeficiency and infections in ataxia-telangiectasia. The Journal of pediatrics 144(4): 505–11. 114. Oestergaard VH, Langevin F, Kuiken HJ et al. 2007. Deubiquitination of FANCD2 is required for DNA crosslink repair. Molecular cell 28(5): 798–809. 115. Ostronoff F, Ostronoff M, Calixto R et al. 2007. Fludarabine, cyclophosphamide, and antithymocyte globulin for a patient with dyskeratosis congenita and severe bone marrow failure. Biology of blood and marrow transplantation : journal of the American Society for Blood and Marrow Transplantation 13(3): 366–8. 116. O’Driscoll M, Cerosaletti KM, Girard PM et al. 2001. DNA ligase IV mutations identified in patients exhibiting developmental delay and immunodeficiency. Molecular cell 8(6): 1175–85. 117. O’Driscoll M and Jeggo PA. 2006. The role of double-strand break repair – insights from human genetics. Nature reviews. Genetics 7(1): 45–54. 100. Matsumoto Y, Miyamoto T, Sakamoto H et al. 2011. Two unrelated patients with MRE11A mutations and Nijmegen breakage syndrome-like severe microcephaly. DNA repair 10(3): 314–21. 118. Pannicke U, Hönig M, Schulze I et al. 2010. The most frequent DCLRE1C (ARTEMIS) mutations are based on homologous recombination events. Human mutation 31(2): 197–207. 85. Kolehmainen J, Black GCM, Saarinen A et al. 2003. Cohen syndrome is caused by mutations in a novel gene, COH1, encoding a transmembrane protein with a presumed role in vesiclemediated sorting and intracellular protein transport. American journal of human genetics 72(6): 1359–69. 101. Matsushita N, Kitao H, Ishiai M et al. 2005. A FancD2-monoubiquitin fusion reveals hidden functions of Fanconi anemia core complex in DNA repair. Molecular cell 19(6): 841–7. 119. Petty EM, Yanik GA, Hutchinson RJ et al. 2000. Successful bone marrow transplantation in a patient with Schimke immuno-osseous dysplasia. The Journal of pediatrics 137(6): 882–6. 102. Meier UT. 2006. How a single protein complex accommodates many different H/ACA RNAs. Trends in biochemical sciences 31(6): 311–5. 86. Kondo N, Motoyoshi F, Mori S et al. 1992. Long-term study of the immunodeficiency of Bloom’s syndrome. Acta paediatrica (Oslo, Norway: 1992) 81(1): 86–90. 103. Meindl A, Hellebrand H, Wiek C et al. 2010. Germline mutations in breast and ovarian cancer pedigrees establish RAD51C as a human cancer susceptibility gene. Nature genetics 42(5): 410–4. 120. Polityko A, Khurs O, Rumyantseva N et al. 2010. Two siblings with immunodeficiency, facial abnormalities and chromosomal instability without mutation in DNMT3B gene but liability towards malignancy; a new chromatin disorder delineation? Molecular cytogenetics 3:5. 87. Kranz C, Basinger AA, Güçsavaş-Calikoğlu M et al. 2007. Expanding spectrum of congenital disorder of glycosylation Ig (CDG-Ig): sibs with a unique skeletal dysplasia, hypogammaglobulinemia, cardiomyopathy, genital malformations, and early lethality. American journal of medical genetics. Part A 143A(12): 1371–8. 88. Kutler DI, Singh B, Satagopan J et al. 2003. A 20-year perspective on the International Fanconi Anemia Registry (IFAR). Blood 101(4): 1249–56. 89. Landmann E, Bluetters-Sawatzki R, Schindler D et al. 2004. Fanconi anemia in a neonate with pancytopenia. The Journal of pediatrics 145(1): 125–7. 90. Lavin MF and Khanna KK. 1999. ATM: the protein encoded by the gene mutated in the radiosensitive syndrome ataxia-telangiectasia. International journal of radiation biology 75(10): 1201–14. 91. Lenain C, Bauwens S, Amiard S et al. 2006. The Apollo 5’ exonuclease functions together with TRF2 to protect telomeres from DNA repair. Current biology: CB 16(13): 1303–10. 104. Meyn MS. 1999. Ataxia-telangiectasia, cancer and the pathobiology of the ATM gene. Clinical genetics 55(5): 289–304. 105. Michallet A-S, Lesca G, Radford-Weiss I et al. 2003. T-cell prolymphocytic leukemia with autoimmune manifestations in Nijmegen breakage syndrome. Annals of hematology 82(8): 515–7. 106. Michałkiewicz J, Barth C, Chrzanowska K et al. 2003. Abnormalities in the T and NK lymphocyte phenotype in patients with Nijmegen breakage syndrome. Clinical and experimental immunology 134(3): 482–90. 107. Mitchell JR, Wood E, and Collins K. 1999. A telomerase component is defective in the human disease dyskeratosis congenita. Nature 402(6761): 551–5. 108. Morimoto M, Kérourédan O, Gendronneau M et al. 2012. Dental Abnormalities in Schimke Immuno-osseous Dysplasia. Journal of dental research 91(7 Suppl): S29–37. 109. Nakanishi K, Taniguchi T, Ranganathan V et al. 2002. Interaction of FANCD2 and NBS1 in 121. Quarantelli M, Giardino G, Prinster A et al. 2012. Steroid treatment in Ataxia-Telangiectasia induces alterations of functional magnetic resonance imaging during prono-supination task. European journal of paediatric neurology: EJPN: official journal of the European Paediatric Neurology Society: 122. Rackoff WR, Orazi a, Robinson C a et al. 1996. Prolonged administration of granulocyte colony-stimulating factor (filgrastim) to patients with Fanconi anemia: a pilot study. Blood 88(5): 1588–93. 123. Ramocki MB, Peters SU, Tavyev YJ et al. 2009. Autism and other neuropsychiatric symptoms are prevalent in individuals with MeCP2 duplication syndrome. Annals of neurology 66(6): 771–82. 124. Ramocki MB, Tavyev YJ and Peters SU. 2010. The MECP2 duplication syndrome. American journal of medical genetics. Part A 152A(5): 1079–88. 125. Revesz T, Fletcher S, al-Gazali LI et al. 1992. Bilateral retinopathy, aplastic anaemia, and central nervous system abnormalities: a new syndrome? Journal of medical genetics 29(9): 673–5. Neuropädiatrie in Klinik und Praxis 12. Jg. (2013) Nr. 1 35 #6918_Neuropädiatrie_01-2013.indd 35 09.01.13 13:38 Originalien/Übersichten 126. Riballo E, Critchlow SE, Teo SH et al. 1999. Identification of a defect in DNA ligase IV in a radiosensitive leukaemia patient. Current biology: CB 9(13): 699–702. 143. Scheckenbach K, Morgan M, Filger-Brillinger J et al. 2012. Treatment of the bone marrow failure in Fanconi anemia patients with danazol. Blood cells, molecules & diseases 48(2): 128–31. 127. Rochowski A, Olson SB, Alonzo TA et al. 2012. Patients with Fanconi anemia and AML have different cytogenetic clones than de novo cases of AML. Pediatric blood & cancer: 144. Schimke RN, Horton WA, King CR et al. 1974. Chondroitin-6-sulfate mucopoly-saccharidosis in conjunction with lymphopenia, defective cellular immunity and the nephrotic syndrome. Birth defects original article series 10(12): 258–66. 128. Rochowski A, Rosenberg PS, Alonzo TA et al. 2012. Estimation of the prevalence of Fanconi anemia among patients with de novo acute myelogenous leukemia who have poor recovery from chemotherapy. Leukemia research 36(1): 29–31. 129. Rosenberg PS, Alter BP, and Ebell W. 2008. Cancer risks in Fanconi anemia: findings from the German Fanconi Anemia Registry. Haematologica 93(4): 511–7. 130. Saar K, Chrzanowska KH, Stumm M et al. 1997. The gene for the ataxia-telangiectasia variant, Nijmegen breakage syndrome, maps to a 1-cM interval on chromosome 8q21. American journal of human genetics 60(3): 605–10. 131. Salewsky B, Schmiester M, Schindler D et al. 2012. The nuclease hSNM1B/Apollo is linked to the Fanconi anemia pathway via its interaction with FANCP/SLX4. Human molecular genetics: 132. Sanal O, Ersoy F, Yel L et al. 1999. Impaired IgG antibody production to pneumococcal polysaccharides in patients with ataxia-telangiectasia. Journal of clinical immunology 19(5): 326–34. 133. Sandoval N, Platzer M, Rosenthal A et al. 1999. Characterization of ATM gene mutations in 66 ataxia telangiectasia families. Human molecular genetics 8(1): 69–79. 134. Saraiva JM, Dinis a, Resende C et al. 1999. Schimke immuno-osseous dysplasia: case report and review of 25 patients. Journal of medical genetics 36(10): 786–9. 135. Sasa GS, Ribes-Zamora A, Nelson ND et al. 2012. Three novel truncating TINF2 mutations causing severe dyskeratosis congenita in early childhood. Clinical genetics 81(5):470–8. 136. Sasaki MS and Tonomura A. 1973. A High Susceptibility of Fanconi’s Anemia to Chromosome Breakage by DNA Cross-linking Agents. Cancer Res. 33(8): 1829–1836. 137. Savage SA and Alter BP. 2009. Dyskeratosis congenita. Hematology/oncology clinics of North America 23(2): 215–31. 138. Savage SA and Bertuch AA. 2010. The genetics and clinical manifestations of telomere biology disorders. Genetics in medicine : official journal of the American College of Medical Genetics 12(12): 753–64. 139. Savage SA, Dokal I, Armanios M et al. 2009. Dyskeratosis congenita: the first NIH clinical research workshop. Pediatric blood & cancer 53(3): 520–3. 140. Savage SA, Giri N, Baerlocher GM et al. 2008. TINF2, a component of the shelterin telomere protection complex, is mutated in dyskeratosis congenita. American journal of human genetics 82(2): 501–9. 141. Savage SA, Giri N, Baerlocher GM et al. 2008. TINF2 , a Component of the Shelterin Telomere Protection Complex , Is Mutated in Dyskeratosis Congenita. (February): 501–509. 142. Savitsky K, Bar-Shira A, Gilad S et al. 1995. A single ataxia telangiectasia gene with a product similar to PI-3 kinase. Science 268(5218): 1749–1753. 145. Seeman P, Gebertová K, Paderová K et al. 2004. Nijmegen breakage syndrome in 13% of agematched Czech children with primary microcephaly. Pediatric neurology 30(3): 195–200. 146. Shimada A, Takahashi Y, Muramatsu H et al. 2012. Excellent outcome of allogeneic bone marrow transplantation for Fanconi anemia using fludarabine-based reduced-intensity conditioning regimen. International journal of hematology 95(6): 675–9. bone marrow failure syndromes: the Israeli Inherited Bone Marrow Failure Registry. Haematologica 95(8): 1300–7. 159. Taniguchi T and D’Andrea AD. 2006. Molecular pathogenesis of Fanconi anemia: recent progress. Blood 107(11): 4223–33. 160. Taniguchi T, Garcia-Higuera I, Andreassen PR et al. 2002. S-phase-specific interaction of the Fanconi anemia protein, FANCD2, with BRCA1 and RAD51. Blood 100(7): 2414–20. 161. Taniguchi T, Tischkowitz M, Ameziane N et al. 2003. Disruption of the Fanconi anemia-BRCA pathway in cisplatin-sensitive ovarian tumors. Nature medicine 9(5): 568–74. 162. Taylor AMR, Groom A, and Byrd PJ. Ataxiatelangiectasia-like disorder (ATLD)-its clinical presentation and molecular basis. DNA repair 3(8-9): 1219–25. 147. Shimamura A and Alter BP. 2010. Pathophysiology and management of inherited bone marrow failure syndromes. Blood reviews 24(3): 101–22. 163. Taylor AMR, Harnden DG, Arlett CF et al. 1975. Ataxia telangiectasia: a human mutation with abnormal radiation sensitivity. Nature 258(5534): 427–429. 148. Shprintzen RJ. 1994. Velocardiofacial syndrome and DiGeorge sequence. Journal of medical genetics 31(5): 423–4. 164. Taylor A and Byrd P. 2005. Molecular pathology of ataxia telangiectasia. Journal of clinical pathology 58(10): 1009–15. 149. Smogorzewska A, Matsuoka S, Vinciguerra P et al. 2007. Identification of the FANCI protein, a monoubiquitinated FANCD2 paralog required for DNA repair. Cell 129(2): 289–301. 165. Thiel C, Schwarz M, Hasilik M et al. 2002. Deficiency of dolichyl-P-Man: Man7GlcNAc2PP-dolichyl mannosyltransferase causes congenital disorder of glycosylation type Ig. The Biochemical journal 367(Pt 1): 195–201. 150. Socié G, Devergie A, Girinski T et al. 1998. Transplantation for Fanconi’s anaemia: longterm follow-up of fifty patients transplanted from a sibling donor after low-dose cyclophosphamide and thoraco-abdominal irradiation for conditioning. British journal of haematology 103(1): 249–55. 151. Soulas-Sprauel P, Rivera-Munoz P, Malivert L et al. 2007. V(D)J and immunoglobulin class switch recombinations: a paradigm to study the regulation of DNA end-joining. Oncogene 26(56): 7780–91. 152. Spranger J, Hinkel GK, Stöss H et al. 1991. Schimke immuno-osseous dysplasia: a newly recognized multisystem disease. The Journal of pediatrics 119(1 Pt 1): 64–72. 153. Stewart GS, Stankovic T, Byrd PJ et al. 2007. RIDDLE immunodeficiency syndrome is linked to defects in 53BP1-mediated DNA damage signaling. Proceedings of the National Academy of Sciences of the United States of America 104(43): 16910–5. 154. Stewart GS, Stankovic T, Byrd PJ et al. 2007. RIDDLE immunodeficiency syndrome is linked to defects in 53BP1-mediated DNA damage signaling. Proceedings of the National Academy of Sciences of the United States of America 104(43): 16910–5. 166. Tipping a J, Pearson T, Morgan NV et al. 2001. Molecular and genealogical evidence for a founder effect in Fanconi anemia families of the Afrikaner population of South Africa. Proceedings of the National Academy of Sciences of the United States of America 98(10): 5734–9. 167. Tolar J, Becker PS, Clapp DW et al. 2012. Gene therapy for fanconi anemia: one step closer to the clinic. Human gene therapy 23(2): 141–4. 168. Touzot F, Callebaut I, Soulier J et al. 2010. Function of Apollo (SNM1B) at telomere highlighted by a splice variant identified in a patient with Hoyeraal-Hreidarsson syndrome. Proceedings of the National Academy of Sciences of the United States of America 107(22): 10097–102. 169. Velazquez I and Alter BP. 2004. Androgens and liver tumors: Fanconi’s anemia and non-Fanconi‘s conditions. American journal of hematology 77(3): 257–67. 170. Vulliamy T, Marrone A, Goldman F et al. 2001. The RNA component of telomerase is mutated in autosomal dominant dyskeratosis congenita. Nature 413(6854): 432–5. 171. Vulliamy TJ, Marrone A, Knight SW et al. 2006. Mutations in dyskeratosis congenita: their impact on telomere length and the diversity of clinical presentation. Blood 107(7): 2680–5. 155. Stoepker C, Hain K, Schuster B et al. 2011. SLX4, a coordinator of structure-specific endonucleases, is mutated in a new Fanconi anemia subtype. Nature genetics 43(2): 138–41. 172. Vulliamy T, Marrone A, Dokal I et al. 2002. Association between aplastic anaemia and mutations in telomerase RNA. Lancet 359(9324): 2168–70. 156. Sznajer Y, Baumann C, David A et al. 2003. Further delineation of the congenital form of X-linked dyskeratosis congenita (HoyeraalHreidarsson syndrome). European journal of pediatrics 162(12): 863–7. 173. Vuong LG, Hemmati PG, Neuburger S et al. 2010. Reduced-intensity conditioning using fludarabine and antithymocyte globulin alone allows stable engraftment in a patient with dyskeratosis congenita. Acta haematologica 124(4): 200–3. 157. Takao A, Ando M, Cho K et al. 1980. Etiology and Morphogenesis of Congenital Heart Disease. Mount Kisco, N. Y.: Futura Publishing Company: 253–269. 158. Tamary H, Nishri D, Yacobovich J et al. 2010. Frequency and natural history of inherited 174. Walne AJ, Vulliamy T, Beswick R et al. 2008. TINF2 mutations result in very short telomeres: analysis of a large cohort of patients with dyskeratosis congenita and related bone marrow failure syndromes. Blood 112(9): 3594–600. 36 Neuropädiatrie in Klinik und Praxis 12. Jg. (2013) Nr. 1 #6918_Neuropädiatrie_01-2013.indd 36 09.01.13 13:38 Originalien/Übersichten 175. Walne AJ, Vulliamy T, Marrone A et al. 2007. Genetic heterogeneity in autosomal recessive dyskeratosis congenita with one subtype due to mutations in the telomerase-associated protein NOP10. Human molecular genetics 16(13): 1619–29. 176. Walne AJ, Vulliamy T, Marrone A et al. 2007. Genetic heterogeneity in autosomal recessive dyskeratosis congenita with one subtype due to mutations in the telomerase-associated protein NOP10. Human molecular genetics 16(13): 1619–29. 177. Waltes R, Kalb R, Gatei M et al. 2009. Human RAD50 Deficiency in a Nijmegen Breakage Syndrome-like Disorder: 605–616. 178. Weemaes CM, Hustinx TW, Scheres JM et al. 1981. A new chromosomal instability disorder: the Nijmegen breakage syndrome. Acta paediatrica Scandinavica 70(4): 557–64. FLIP & FLAP Eine Geschichte über Nervenzellen, Epilepsie und die Friedastraßen-Band von Sabine Jantzen und Tina Krisl, mit Bildern von Christiane Kafemann 2. überarb. Aufl. 2007, 84 Seiten, Erzählung mit vielen farbigen Comics, Format DIN A4, geheftet, ISBN 978-3-7950-7045-8, € 14,80 182. Wu P, Takai H, and de Lange T. 2012. Telomeric 3’ overhangs derive from resection by Exo1 and Apollo and fill-in by POT1b-associated CST. Cell 150(1): 39–52. Bereits in der 2. Auflage im Verlag Schmidt-Römhild erschienen: „Flip & Flap“– ein Buch für Kinder und Jugendliche zum Thema Epilepsie. Die Diplom-Psychologinnen Sabine Jantzen und Tina Krisl entwickelten „Flip & Flap“ im Rahmen eines gleichnamigen Schulungsprogramms für epilepsiekranke Kinder, Jugendliche und deren Eltern an der Lübecker Klinik für Kinder- und Jugendmedizin. Die Comic-Zeichnungen stammen von Christiane Kafemann. Diese Erzählung führt in die Welt der Nervenzellen Flip und Flap und ihrer Kollegen, die in der Kommandozentrale des Körpers rund um die Uhr ganze Arbeit leisten. Die Flaps jedoch sind manchmal unkonzentriert, und so kommt es zu Fehlern in der Informationsübertragung – zu einem Anfall. 183. Yaghmai R, Kimyai-Asadi A, Rostamiani K et al. 2000. Overlap of dyskeratosis congenita with the Hoyeraal-Hreidarsson syndrome. The Journal of pediatrics 136(3): 390–3. Eine wichtige Lektüre für betroffene Kinder ab 7 Jahren, Jugendliche und deren Eltern, für Schulklassen und für alle Kinder, die mehr über Epilepsie erfahren wollen. 179. Wegner R, Chrzanowska K, Sperling , et al. 1999. Ataxia-telangiectasia variants (Nijmegen breakage syndrome). In: Ochs HD, Smith CIE, Puck JM, eds. rimary Immunodeficiency Diseases, a Molecular and Genetic Approach. Oxford, UK: Oxford University Press;: 324–34. 180. Wilson DI, Burn J, Scambler P et al. 1993. DiGeorge syndrome: part of CATCH 22. Journal of medical genetics 30(10): 852–6. 181. de Winter JP and Joenje H. 2009. The genetic and molecular basis of Fanconi anemia. Mutation research 668(1-2):1 1–9. 184. Yakusheva TA, Shaikh AG, Green AM et al. 2007. Purkinje cells in posterior cerebellar vermis encode motion in an inertial reference frame. Neuron 54(6): 973–85. 185. Zdebska E, Bader-Meunier B, Schischmanoff P-O, et al. 2003. Abnormal glycosylation of red cell membrane band 3 in the congenital disorder of glycosylation Ig. Pediatric research 54(2): 224–9. 186. Zhong F, Savage S a, Shkreli M et al. 2011. Disruption of telomerase trafficking by TCAB1 mutation causes dyskeratosis congenita. Genes & development 25(1): 11–6. Bestellung Hiermit bestellen wir ............... Expl. „Flip & Flap. Eine Geschichte über Nervenzellen, Epilepsie und die Friedastraßen-Band“ á € 14,80 zzgl. Versand. Lieferungs- und Rechnungsanschrift: Vorname, Name Korrespondenzadresse: Dr. med. Sybille Kenzel oder PD Dr. med. Horst v. Bernuth Klinik für Pädiatrie mit Schwerpunkt Pneumologie und Immunologie Charité – Universitätsmedizin Berlin Campus Rudolf-Virchow-Klinikum Augustenburger Platz 1 D-13353 Berlin Email: [email protected] Email: [email protected] / [email protected] Interessenkonflikt Die Autoren geben an, dass kein Interessenkonflikt besteht. Firma oder Behörde Straße, Hausnummer PLZ, Ort Datum Unterschrift Bestellungen an: Verlag Schmidt-Römhild Vertrieb Mengstr. 16 23552 Lübeck Tel. 0451/70 31 – 267 Fax 0451/70 31 – 281 E-Mail: [email protected] Internet: www.schmidt-roemhild.de Neuropädiatrie in Klinik und Praxis 12. Jg. (2013) Nr. 1 37 #6918_Neuropädiatrie_01-2013.indd 37 09.01.13 13:38 Originalien/Übersichten Diagnostik bei Kindern mit primärer Mikrozephalie D. WIECZOREK1, H. VON BERNUTH2, 3, J. B. HENNERMANN4, R. JOHN5, C. BÜHRER6, A. M. KAINDL5, 7, 8* 1 Institut für Humangenetik, Universitätsklinikum Essen, Hufelandstr. 55, 45122 Essen 2 Klinik für Pädiatrie mit Schwerpunkt Pneumologie und Immunologie, Charité – Universitätsmedizin Berlin, Campus Virchow-Klinikum, Augustenburger Platz 1, 13353 Berlin 3 Labor Berlin, Charité Vivantes GmbH, Immunologie Campus Virchow-Klinikum, Augustenburger Platz 1, 13353 Berlin 4 Klinik für Pädiatrie mit Schwerpunkt Endokrinologie, Gastroenterologie und Stoffwechselmedizin, Charité – Universitätsmedizin Berlin, Campus Virchow-Klinikum, Augustenburger Platz 1, 13353 Berlin 5 SPZ Neuropädiatrie, Charité – Universitätsmedizin Berlin, Campus Virchow-Klinikum, Augustenburger Platz 1, 13353 Berlin 6 Klinik für Pädiatrie mit Schwerpunkt Neonatologie, Charité – Universitätsmedizin Berlin, Augustenburger Platz 1, 13353 Berlin 7 Klinik für Pädiatrie mit Schwerpunkt Neurologie, Charité – Universitätsmedizin Berlin, Campus Virchow-Klinikum, Augustenburger Platz 1, 13353 Berlin 8 Institut für Zell- und Neurobiologie, Charité – Universitätsmedizin Berlin, Campus Mitte, Charitéplatz 1, 10115 Berlin Zusammenfassung Eine primäre oder kongenitale Mikrozephalie kann sowohl isoliert als auch als Teil einer Erkrankung auftreten und geht oftmals mit einer mentalen Retardierung einher. Ursache ist eine Reduktion des Gehirnvolumens, dessen Pathogenese sowohl exogene Faktoren als auch genetische Ursachen beinhaltet. Im vorliegenden Artikel stellen wir unseren ersten Vorschlag zur diagnostischen Herangehensweise an ein Kind mit primärer Mikrozephalie vor. Schlüsselwörter a reduction of brain volume secondary to exogenous factors or genetic causes. Here, we propose a diagnostic approach to a child with primary microcephaly. Keywords primary microcephaly – intellectual disability – diagnostics Bibliography Neuropaediatrie 2013; 12: 38-50, © Schmidt-Roemhild-Verlag, Luebeck, Germany: ISSN 1619-3873; NLM ID 101166293; OCoLc 53801270 Einleitung Der Begriff Mikrozephalie (griechisch: mikros „klein“; kephale „Kopf“) bezeichnet das klinische Zeichen eines Kopfumfangs unterhalb der 3. Perzentile bzw. mindestens 2 Standardabweichungen (SD) unter dem alters- und geschlechtsbezogenen Mittelwert. Manche Autoren definieren eine Mikrozephalie als Kopfumfang, der mehr als 3 SD unterhalb des Mittelwerts liegt. Die meisten Autoren bezeichnen eine bereits bei Geburt vorliegende Mikrozephalie als primär und eine postnatal auftretende Mikrozephalie als sekundär (Abb. 1). Es sei hier Primäre Mikrozephalie – mentale Retardierung – geistige Behinderung – Diagnostik Diagnosis in children with primary microcephaly Abstract Primary or congenital microcephaly can appear as an isolated condition or as part of a disease and is often associated with intellectual disability. It is caused by Abb. 1: Terminologie Mikrozephalie 38 Neuropädiatrie in Klinik und Praxis 12. Jg. (2013) Nr. 1 #6918_Neuropädiatrie_01-2013.indd 38 09.01.13 13:38 Originalien/Übersichten I. Exogene Ursachen Intrauterine Infektion Toxoplasmose, Röteln, CMV, Herpes simplex, VZV, Syphilis, HIV Teratogene Alkohol, Kokain, Hydantoin, Antiepileptika, Blei/Quecksilbervergiftung, Bestrahlung Disruptives Ereignis Vaskuläres Ereignis (Stroke), intrauteriner Fruchttod eines Zwillings Maternale Erkrankung Hyperphenylalaninämie Extreme Plazentainsuffizienz II. Prämature Nahtsynostose III. Angeborene Stoffwechselerkrankungen Maternale Phenylketonurie Defekte in der Biosynthese von Serin Störungen der Sterol-Biosynthese Mitochondriopathien CDG-Syndrome Seltenere angeborene Stoffwechselerkrankungen (siehe Text) IV. Genetische Ursachen: Nicht-syndromale (isolierte) Mikrozephalie Autosomal-rezessive Mikrozephalie MCPH1-10, MCPHA Autosomal-dominante Mikrozephalie X-chromosomale Mikrozephalie Chromosomal (kleine Chromosomenabberationen) V. Genetische Ursachen: Syndromale Mikrozephalie Mikrozephaliesyndrome mit numerischen Chromosomenabberationen Trisomie 21, 13, 18, … Mikrodeletionssyndrome mit Mikrozephalie Wolf-Hirschhorn-Syndrom (4p16.3-Deletion; MIM#194190) Williams-Beuren-Syndrom (7q11.23-Deletion; MIM#194050) DiGeorge-Syndrom (CATCH22; 22q11-Deletion; MIM#188400) Mikrodeletion 1p36 (MIM#607872) Terminale Deletion 15q (MM#612626)... Monogenetische Mikrozephalien – mit autosomal-dominantem Erbgang Cornelia de Lange-Syndrom (MIM#122470, 610759, 614701; selten X- chr) Rubinstein-Taybi-Syndrom (MIM180849) Feingold-Syndrom (MIM#164280, 614326) Mowat-Wilson-Syndrom (MIM#235730)... – mit autosomal-rezessivem Erbgang Smith-Lemli-Opitz-Syndrom (MIM#270400) Aicardi-Goutières-Syndrom (MIM#225750, 610329, 610181, 610333, 612952) Seckel-Syndrom (MIM#210600, 606744, 608664, 613676, 613823, 614728) Nijmegen-Breakage-Syndrom (MIM#251260) Cockayne-Syndrom (MIM#216400, 133540) Ligase-IV-Syndrom (MIM 606593)… – mit X-chromosomalem Erbgang Mutationen im ATRX-Gen (MIM*300032; ‚alpha thalassemia X-linked mental retardation syndrome’) Mutationen im ARX-Gen (MIM*300382) Mutationen im PQBP1-Gen (MIM*300463) Borjeson-Forssman-Lehmann-Syndrom (MIM#301900) Rett-Syndrom (MIM#312750)... – mit komplexer Vererbung/nicht klassifizierbar Angelman-Syndrom (MIM#105830)... Tab. 1: Einteilung von primären Mikrozephalien anhand ihrer Ursache* *Obgleich Stoffwechselerkrankungen auch genetische Ursachen haben, werden diese hier separat geführt. Kein Anspruch auf Vollständigkeit darauf hingewiesen, dass die Bezeichnungen primäre und sekundäre Mikrozephalie durch wenige Autoren auch mit genetisch bedingter und durch exogene Faktoren verursachter Mikrozephalie gleichgesetzt werden. In der vorliegenden Arbeit distanzieren wir uns von letzterer Definition. Man spricht von einer isolierten Mikrozephalie, wenn diese als einzige Auffälligkeit vorliegt. Zudem wird zwischen einer proportionierten und einer dysproportionierten Mikrozephalie unterschieden, je nachdem, ob in gleichem Maße auch ein Kleinwuchs bzw. Untergewicht vorliegen. Eine Mikrozephalie geht mit einer Verringerung des Hirnvolumens sowie meist mit einer Entwicklungsverzögerung/geistigen Behinderung einher. Sie kann genetisch bedingt sein oder durch Umwelteinflüsse entstehen. In OMIM [Online Mendelian Inheritance in Man (www1)] findet man im Oktober 2012 circa 800 Einträge für das Leitsymptom Mikrozephalie und circa 360 Einträge bei Eingrenzung der Suche auf kongenitale Mikrozephalien. Eine Übersicht über exogene und genetische Ursachen der primären Mikrozephalie kann aus Tab. 1 entnommen werden. Hinsichtlich einer detaillierten Beschreibung von Erkrankungen und Hinweisen zur genetischen Diagnostik verweisen wir auf OMIM, GeneReviews (www2) und OrphaNet (www3). In der klinischen Praxis fehlt bisher ein Algorithmus für die Diagnostik bei Vorliegen einer Mikrozephalie. In Vorbereitung darauf stellen wir im vorliegenden Artikel ein Konzept zur diagnostischen Herangehensweise an ein Kind mit primärer Mikrozephalie vor. Messung und Beurteilung des Kopfumfangs Der fronto-okzipitale Kopfumfang sollte durch straffes Anlegen eines flexiblen aber nicht dehnbaren Zentimetermaßes um den Kopf, von der Stirn (direkt oberhalb der Augenbrauen) bis zur prominentesten Stelle des Hinterkopfs (Okziput), gemessen werden. Mehrfachmessungen sind erforderlich, um eine Mikrozephalie zu bestätigen. In jedem Fall sollte auch der Kopfumfang beider Eltern gemessen werden, um festzustellen, ob es sich um eine familiäre Mikrozephalie handelt. Die Werte für den Kopfumfang werden parallel zu den gleichzeitig gemessenen Werten für Länge und Gewicht in Perzentilenkurven eingetragen, die das Geschlecht und den ethnischen Hintergrund berücksichtigen. Für Neugeborene sollten die Perzentilenkurven aus dem Neugeborenenkollektiv der Bundesrepublik Deutschland von Voigt et al. 2006 (1) herangezogen werden. Nach der Neugeborenenperiode können Neuropädiatrie in Klinik und Praxis 12. Jg. (2013) Nr. 1 39 #6918_Neuropädiatrie_01-2013.indd 39 09.01.13 13:38 Originalien/Übersichten Abb. 2: Erfassungsbogen für Patienten mit primärer Mikrozephalie (erste Seite) 40 Neuropädiatrie in Klinik und Praxis 12. Jg. (2013) Nr. 1 #6918_Neuropädiatrie_01-2013.indd 40 09.01.13 13:38 Originalien/Übersichten Abb. 2: Erfassungsbogen für Patienten mit primärer Mikrozephalie (zweite Seite) Neuropädiatrie in Klinik und Praxis 12. Jg. (2013) Nr. 1 41 #6918_Neuropädiatrie_01-2013.indd 41 09.01.13 13:38 Originalien/Übersichten Abb. 3: Vorschlag zur Herangehensweise an ein Kind mit primärer Mikrozephalie. Wir plädieren für eine differenzierte Herangehensweise, wie im Text erläutert (*siehe Text) die aus der KiGGS-Studie hervorgegangenen Kopfumfangskurven nach Schienkiewitza et al. 2011 (2) zugrunde gelegt werden; oftmals werden noch ältere von Nellhaus et al. 1968 (3) oder Prader et al. 1989 (4) und Mitarbeitern aufgestellte Werte verwendet. Die bei Kindern in Deutschland gemessenen durchschnittlichen Kopfumfänge sind größer als die WHO-Standardwerte (www4, www5), was an ethnischen Unterschieden liegen kann. Für Letztere wurden die Kopfumfangsdaten von circa 8.500 Kindern aus Brasilien, Ghana, Indien, Oman und der USA herangezogen. Für einige syndromale Krankheitsbilder, wie beispielsweise dem Down-Syndrom (www6), gibt es syndrom-spezifische Perzentilenkurven. Eine Beurteilung des Kopfumfangs unter Angabe der Standardabweichung (oder ‚z-Score’) hat sich in Deutschland im Gegensatz zu anderen europäischen Ländern und den USA bisher nicht durchgesetzt. Die Standardabweichungen können aber anhand der unter www.who.int angegebenen Median- und Standardabweichungen einfach berechnet werden. Alterna- tiv können die Standardabweichungen auch aus älteren Kurven abgelesen werden (www7). Die StandardabweichungsScores (SDS, ‚z-Score’) können z. B. mit dem Excel Add-in LMSGrowth von Huigi Pan und Tim Cole berechnet werden (Excel Add-in unter www8). Wir plädieren für eine differenzierte, auf die Anamnese und Klinik eines Kindes zugeschnittene Diagnostik und gehen im Folgenden auf einzelne Aspekte ein. Anamnese und klinischer Untersuchungsbefund Bei jedem Kind mit primärer Mikrozephalie sollte anhand einer genauen Anamnese nach exogenen Schäden des sich entwickelnden Gehirns während der Schwangerschaft als zugrunde liegende Ursache gefahndet werden. Hierzu zählen eine pränatale Infektion (STORCH: Syphilis, Toxoplasmose, Röteln, Cytomegalie Virus, Herpes etc.), eine Exposition gegenüber Bestrahlung oder Toxinen, ein Drogenabusus der Mutter (z. B. Alkohol, Cocain, Toluole) sowie maternale Erkrankungen (z. B. maternale Phenylketonurie) (Tab. 1, 2). Kopfumfangs-Angaben im Mutterpass können Hinweise auf den Verlauf des Kopfwachstums in utero geben und damit auf den ungefähren Zeitpunkt einer ersten Abweichung von der Norm. Die Plazentahistologie sollte im Hinblick auf eine Um standardisierte Angaben bei allen Patienten mit primärer Mikrozephalie zur Verfügung zu haben, schlagen wir eine Dokumentation der anamnestischen Angaben, des klinischen Untersuchungsbefundes und weiterer Untersuchungen in einer Standardvorlage vor (Beispiel in Abb. 2). Diagnostische Herangehensweise bei Kindern mit primärer Mikrozephalie Unser Vorschlag zur diagnostischen Herangehensweise an ein Kind mit primärer Mikrozephalie ist in Abb. 3 aufgeführt. Erfragen und Untersuchung von exogenen Faktoren 42 Neuropädiatrie in Klinik und Praxis 12. Jg. (2013) Nr. 1 #6918_Neuropädiatrie_01-2013.indd 42 09.01.13 13:38 Originalien/Übersichten Weitere Hirnfehlbildungen* Gehirnverkalkung Nicht-neurologische Malformationen Cytomegalie Ventrikulomegalie, subependymale Zysten, Migrationsstörungen + Chorioretinitis, Hörstörung, intrauterine WR Herpes simplex Hydrozephalus, porenzephale Zysten + Chorioretinitis, Mikrophthalmie Röteln Subependymale Zysten + Herzfehler, Hörstörung, Katarakt, Retinopathie, intrauterine WR Toxoplasmose Hydrozephalus (Aquäduktstenose) + Chorioretinitis, Optikusatrophie Syphillis Hydrozephalus, Pseudoparalyse + Hörstörung, Lungenblutung, Zahnanomalien Varicella Zoster-Virus Hydrozephalus, kortikale Atrophie - Skelettanomalien, intrauterine WR, Extremitätenhypoplasien, Mikrophthalmie, Katarakt, Chorioretinitis, Narben AIDS (Acquired immunodeficiency syndrome) Hirnatrophie, Ventrikulomegalie, Auffälligkeiten der weißen Substanz + Intrauterine Infektionen Drogen und Medikamente Alkohol Corpus callosum Agenesie, abnorme Gyrierung - Herz- und Nierenfehlbildungen, Hörstörung, Skoliose, WR, Dysmorphien Kokain Zerebrale Infarkte, Enzephalozelen - Schädel- und Herzfehlbildungen Antiepileptika (Carbamazepin, Phenytoin, Barbiturate, Valproat) Spina bifida - Herzfehlbildungen, Dysmorphien, Anomalien der Finger, WR - Herzfehlbildungen, WR Maternale Erkrankung oder andere pränatale Faktoren Phenylketonurie Migrationsstörungen Abkürzungen: Wachstumsretardierung (WR); *außer Mikroenzephalie Tab. 2: Häufige Ursachen und klinische Zeichen einer erworbenen primären Mikrozephalie Erkrankung Begleitsymptome Diagnostik Maternale Phenylketonurie intrauterine Wachstunsverzögerung, faziale Auffälligkeiten, kongenitale Vitien, mentale Retardierung Phenylalanin im Plasma bei der Kindsmutter Serin-Biosynthese-Defekte Muskelhypotonie, zerebrale Krampfanfälle, mentale Retardierung Aminosäuren im Plasma (präprandiale Blutentnahme, sonst falsch hoher Serinwert) Aminosäuren im Liquor Störungen der SterolBiosynthese kraniofaziale Dysmorphien, Syndaktylie, Organfehlbildungen, Mittellinienfehlbildungen, Genitalfehlbidungen, NenbennierenInsuffizienz, mentale Retardierung Sterol-Analyse (7/8-Dehydrocholesterol) im Plasma Mitochondriopathien Laktatazidose Mitbefall weiterer Organsysteme (Enzephalopathie, Myopathie, Kardiomyopathie, zerebrale Malformationen u. a. ) Laktat, Pyruvat im Blut, organische Säuren im Urin, weiterführende Diagnostik je nach Klinik Kongenitale Glykosylierungsstörungen Mentale Retardierung, Dysmorphie, Epilepsie, muskuläre Hypotonie u. a. isoelektrische Fokussierung Transferrin im Serum (bei Neonaten nicht sicher auswertbar, da Mitbestimmung des maternalen Transferrins) Tab. 3: Übersicht über die häufigeren angeborenen Stoffwechselerkrankungen mit kongenitalem Mikrozephalus Neuropädiatrie in Klinik und Praxis 12. Jg. (2013) Nr. 1 43 #6918_Neuropädiatrie_01-2013.indd 43 09.01.13 13:38 Originalien/Übersichten Plazentainsuffizienz und Hinweisen auf eine Infektion berücksichtigt werden. Eine Untersuchung von Phenylalanin im Blut der Mutter kann eine Phenylketonurie der Mutter aufdecken; Letztere ist nicht immer anamnestisch eruierbar. Eine maternale Phenylketonurie kann im Neugeborenenscreening (bei zeitgerechter Abnahme ab der 36. Lebensstunde) nicht nachgewiesen werden. Bei Verdacht auf das Vorliegen eines Fetalen Alkohol-Syndroms (engl. ‚Fetal Alcohol Spectrum Disorder’, FASD) sollten entsprechende diagnostische Parameter bei der klinischen Untersuchung berücksichtigt werden (5). Im Einverständnis mit der Mutter kann hier der Ethylester-Gehalt im Mekonium als Hinweis auf eine AlkoholExposition des Kindes bestimmt werden. Entwicklungs-/Leistungsdiagnostik bei Kindern mit primärer Mikrozephalie Kinder mit einer Mikrozephalie tragen ein höheres Risiko als normozephale Kinder für das Vorhandensein einer Entwicklungsstörung. Deshalb sollte im Rahmen einer mehrdimensional angelegten entwicklungspsychologischen Untersuchung das Vorliegen einer drohenden oder manifesten Entwicklungs-, Verhaltens-, und/ oder emotionalen Störung geklärt werden [siehe auch Qualitätspapier zu Standards der psychologischen Diagnostik in Sozialpädiatrischen Zentren; (www9)]. Ziel sollte es insbesondere sein, Teilhabeeinschränkungen im alltäglichen Lebensvollzug zu erfassen und/oder zu prognostizieren, um (sofern notwendig) therapeutische Strategien abzuleiten. Zentral ist hierbei die psychologische Diagnostik des kognitiven Entwicklungsstandes. Beispielhaft sind die an unserm Zentrum (Charité – Universitätsmedizin Berlin) angewendeten Testverfahren zur Erfassung des kognitiven Entwicklungsstandes eines Kindes/ Jugendlichen in Abb. 4 aufgeführt. Stoffwechseldiagnostik bei Kindern mit einer primären Mikrozephalie Angeborene Stoffwechselerkrankungen führen selten zu einer primären Mikrozephalie, sondern sehr viel häufiger zu einer sekundären Mikrozephalie als Ausdruck einer nicht spezifischen Hirnatrophie. Ausnahmen bilden einige wenige Erkrankungen, die Diagnostik sollte in Abhängigkeit von der Klinik erfolgen (Tab. 3). Maternale angeborene Stoffwechselerkrankungen können während der Schwangerschaft einen schädigenden Abb. 4: Vorschlag zum Testverfahren zur Erfassung des kognitiven Entwicklungsstandes eines Kindes mit primärer Mikrozephalie. In den ersten beiden Lebensjahren lässt sich die die kognitive und motorische Entwicklung eines Kindes unter anderem mittels der Griffiths-Entwicklungsskalen und der Bayley Scales of Infant Development abschätzen. In Abhängigkeit dieser Befunde ist des Weiteren immer die Einschätzung der adaptiven Fähigkeiten zwingend (ggf. unter Hinzunahme zusätzlicher fremdanamnestischer Quellen, wie z. B. Kindergarten/Schule), um eine komplexe Entwicklungsstörung i.S. einer Intelligenzminderung (ICD-10 F70-F79) klassifizieren zu können. Die Begriffe „Intelligenzminderung“ und „geistige Behinderung“ werden erst ab dem Schulalter eingesetzt, für jüngere Kinder kann analog von kombiniert umschriebenen/komplexen/globalen Entwicklungsstörungen gesprochen werden (F83). Dieses Vorgehen ergibt sich u. a. aus dem Fakt der geringen Spezifität und hohen Entwicklungsdynamik einzelner kognitiver Funktionsbereiche in einem frühen Entwicklungsalter und der damit verbundenen geringeren Reliabilität und prognostischen Validität der zur Verfügung stehenden psychometrischen Instrumente. In Abhängigkeit der Befunde sind zusätzliche Untersuchungen zu spezifischeren Differenzierung der Entwicklung in den Dimensionen Motorik, Sprache und Wahrnehmung hinzuzuziehen, um ggf. die Umschriebenheit/Spezifik einer Entwicklungsstörung zu erfassen und die Indikation für entsprechende Behandlungen abzuleiten [siehe auch (www10-12)]. Einfluss im Sinne einer Feto- oder Embryopathie haben. Hier ist beispielsweise die maternale Phenylketonurie zu nennen, die bei unzureichender diätetischer Einstellung einer Schwangeren zu einer Phenylalaninembryopathie führen kann [primäre Mikrozephalie, geistiger Behinderung, Krampfanfälle, Wachstumsre- tardierung, faziale Dysmorphien, weitere Fehlbildungen u. a. des Herzens; (6, 7)]. Da die meisten Schwangeren in Deutschland bereits im Neugeborenenalter auf das Vorliegen einer Phenylketonurie untersucht wurden, sollte dies vorwiegend bei nicht in Screening-Ländern geborenen Schwangeren berücksichtigt werden. 44 Neuropädiatrie in Klinik und Praxis 12. Jg. (2013) Nr. 1 #6918_Neuropädiatrie_01-2013.indd 44 09.01.13 13:38 Originalien/Übersichten Angeborene Stoffwechselerkrankungen des Kindes können auch bereits intrauterin durch einen Mangel bestimmter Metabolite oder durch sich anstauende (neuro-)toxische Metabolite in einer Hirnschädigung mit konsekutivem kongenitalen Mikrozephalus resultieren. Dazu zählen insbesondere angeborene Defekte in der Biosynthese der Aminosäure Serin, nämlich der 3-Phosphoglyzerat-Dehydrogenase-Mangel sowie der PhosphoserinPhosphatase-Mangel (8) (Abb. 5). Neben einem kongenitalen Mikrozephalus weisen diese Patienten weitere neurologische Symptome wie Muskelhypotonie und zerebrale Krampfanfälle auf. Dementsprechend sollte bei Kindern mit einer kongenitalen Mikrozephalie und Krampfanfällen und/oder mit einer muskulären Hypotonie eine Liquorentnahme unter anderem mit Bestimmung der Aminosäuren im Liquor bei gleichzeitiger Analyse der Aminosäuren im Plasma erfolgen. Das SmithLemli-Opitz-Syndrom, eine Störung der Sterol-Biosynthese, ist in mehr als 80% mit einem kongenitalen Mikrozephalus assoziiert (9) (Abb. 6). Patienten mit diesen Erkrankungen weisen aber auch weitere typische Auffälligkeiten auf, wie kraniofaziale Dysmorphien, II/III-Syndaktylie der Füße und Organfehlbildungen. Bei einem Kind mit primärer Mikrozephalie ohne diese klinischen Auffälligkeiten muss demnach eine Sterol-Analyse nicht zu Beginn der diagnostischen Abklärung erfolgen. Auch die große Erkrankungsgruppe der Mitochondriopathien kann mit einem bereits bei Geburt manifesten Mikrozephalus einhergehen. Hierzu zählen u. a. Defekte der Pyruvat-Dehydrogenase, der verschiedenen Atmungsketten-Komplexe als auch der mitochondrialen Transportsysteme (10-12). Zu Letzterem zählt das SLC25A19-Gen, das einen mitochondrialen Transporter für Deoxynucleotide und Thiaminpyrophosphat kodiert. Klinisch zeigen diese Patienten, die Mutationen im SLC25A19-Gen aufweisen und an einer sogenannten ‚Amish lethal Microcephaly’ (MCPHA, MIM#607196) leiden, häufig eine persistierende Laktatazidose und zerebrale Malformationen wie Lissenzephalie oder Balkendysgenesie. Auch Patienten mit einer kongenitalen Glykosylierungsstörung (CDG-Syndrom) können bereits postnatal einen Mikrozephalus aufweisen, insbesondere Patienten mit einem CDG-Id (13, 14), aber auch Patienten mit einem anderen CDG-Syndrom, z. B. CDG-Ig, CDG-Ik (15), CDG-IIc oder CDG-IIe (16). Zur Abklärung eines CDG-Syndroms ist die Durchführung einer Transferrin-Elektrophorese erforderlich; hierbei ist jedoch zu beachten, dass die Aussagekraft dieser Untersuchung im Neugeborenenalter eingeschränkt ist. Abb. 5: Stoffwechselweg der Serin-Biosynthese. Serin-Biosynthese-Defekte führen zu einer verminderten Synthese von Serin, Glyzin, Phosphoserin u. a. Diese Defekte können mit einer primären Mikrozephalie und weiteren neurologischen Symptomen (Muskelhypotonie, Krampfanfälle) assoziiert sein. Hier ist insbesondere ein 3-Phosphoglyzerat-Dehydrogenase-Mangel und ein Phosphoserin-Phosphatase-Mangel hervorzuheben (rote Schrift) Abb. 6: Stoffwechselweg der Sterol-Biosynthese. Sterol-Biosynthese-Defekte können mit einer primären Mikrozephalie und weiteren Symptomen (Dysmorphien, Syndaktylie, Organfehlbildungen) assoziiert sein. Als klassisches Beispiel ist das Smith-Lemli-Opitz-Syndrom aufgrund eines 7-Dehydrocholesterol-Reduktase-Defekts hervorzuheben (rote Schrift) Neuropädiatrie in Klinik und Praxis 12. Jg. (2013) Nr. 1 45 #6918_Neuropädiatrie_01-2013.indd 45 09.01.13 13:38 Originalien/Übersichten Es gibt zudem einige angeborene Stoffwechselerkrankungen, bei denen nur selten ein Mikrozephalus bereits bei Geburt manifest ist, und einige sehr seltene angeborene Stoffwechselerkrankungen mit assoziierter kongenitaler Mikrozephalie, für die es nur vereinzelte Fallberichte gibt. Dennoch müssen diese Erkrankungen auch in die differentialdiagnostischen Erwägungen mit einbezogen werden. Zu der ersten Gruppe gehören Cobalamin-Defekte, wie der CblC- oder CblF Defekt (17, 18). Zur zweiten Gruppe gehören seltene Erkrankungen wie der Multiple SulfataseMangel (19), die kongenitale neuronale Ceroidlipofuszinose (20) oder der Leukotrien-C4-Synthese-Defekt (21). In diesem Kontext ist zu erwähnen, dass bei Patienten mit einem Molybdän-Kofaktor-Defekt oder einem Sulfitoxidase-Mangel bei Geburt zwar noch keine Mikrozephalie vorliegt, sich aber sehr schnell, d. h. bereits in den ersten Lebenswochen, ein sekundärer Mikrozephalus entwickelt (22). Keine der hier beschriebenen angeborenen Stoffwechselerkrankungen wird im erweiterten Neugeborenenscreening erfasst. Genetische Diagnostik bei Kindern mit einer primären Mikrozephalie Liegt eine isolierte Mikrozephalie vor, sollte die Indikation zur genetischen Diagnostik von zwei Punkten abhängig gemacht werden: Von der Familienanamnese und der Entwicklung des Kindes. Liegt bei einem Elternteil ebenfalls eine Mikrozephalie bei guter kognitiver Entwicklung vor, so sollte man mit einer umfangreichen genetischen Diagnostik zurückhaltend sein. Es handelt sich in diesem Fall dann am ehesten um eine autosomaldominante benigne Mikrozephalie. Dies bedeutet nicht, dass weitere Analysen auf Forschungsbasis (z. B. Exom-Sequenzierung) nicht ursachen-klärend sein können. Der zweite wichtige Punkt ist der Entwicklungsstand des Kindes. Die kognitive und motorische Entwicklung des Kindes sollte beurteilt werden, optimalerweise durch eine standardisierte Entwicklungsdiagnostik (siehe oben). Liegt eine altersentsprechende Entwicklung vor, so ist eine Zurückhaltung hinsichtlich genetischer Diagnostik sinnvoll. Liegt eine Entwicklungsverzögerung/geistige Behinderung vor, so sollte im ersten Schritt eine molekulare Karyotypisierung, d. h. eine Array-CGH, durchgeführt werden. Eine konventionelle Chromosomenanalyse ist weniger aussagekräftig und sollte nur dann zusätzlich durchgeführt werden, wenn der Verdacht auf eine balancierte strukturelle Chrosomenaberration besteht. Zudem sollte bei isolierter Mikrozephalie das Vorliegen einer primär autosomal-rezessiven Mikrozephalie [MCPH; siehe Tab. 4 und (23)] in Betracht gezogen werden sowie abhängig von weiteren klinischen Auffälligkeiten wie einem Kleinwuchs Erkrankungen aus dem Formenkreis des Seckel-Syndroms und der MOPD [siehe Tab. 5 und (24)]. Besteht der Verdacht auf ein syndromales Krankheitsbild, d. h. ist die Mikrozephalie nur eine von zahlreichen Auffälligkeiten, die das Kind aufweist, so sollte ein Neuropädiater und ggf. ein Humangeneti- MCPH Protein Gen Chromosom OMIM MCPH1 Microcephalin MCPH1 8p23.1 251200 MCPH2 WD repeat containing-protein 62 WDR62 19q13.12 604317 MCPH3 Cyclin dependent kinase 5 regulatory subunit-associated protein 2 CDK5RAP2 9q33.2 604804 MCPH4 Centrosomal protein 150 kD CEP152 15q21.1 604321 MCPH5 Abnormal spindle-like, microcephaly associated ASPM 1q31.1 608716 MCPH6 Centromeric protein J CENPJ 13q12.12 608393 MCPH7 SCL/TAL1 interrupting locus STIL 1p33 612703 MCPH8 Centrosomal protein 153 kDa CEP135 4q12 614673 - / / 10q11.2321.3 / - Cancer susceptibility candidate 5 CASC5 15q14 609173 Tab. 4: Genetische Formen der primär autosomal-rezessiven Mikrozephalie (MCPH). Wir verweisen auf „Primäre autosomal-rezessive Mikrozephalie (MCPH)“ von N. Krämer, D. J. MorrisRosendahl, A. M. Kaindl. Krankheitsbild Gen Chromosom OMIM MCPH Typ 1 ATR 3q23 #210600 Typ II RBPP8 18q11 #606744 Typ III / 14q21-q22 #608664 Typ IV CENPJ 13q12.12 #609279 MCPH6 Typ V CEP152 15q21 #613823 MCPH4 Typ VI CEP63 3q22.2 #614728 Typ VII NIN 14q22 #608684 MOPD1 U4atac 2q14.2 #210710 MOPD2 PCNT 21q22.3 #210720 Meier-Gorlin-Syndrom ORC1 ORC4 ORC6 CDT1 CDC6 1p32.3 2q22.2-q23.1 16q11.2 16q24.3 17q21.2 #224690 #613800 #613803 #613904 #613805 Seckel-Syndrom Tab. 5: Erkrankungen mit primordialem mikrozephalen Kleinwuchs und Überlappung zu MCPH4 und MCPH6. Wir verweisen auf “Diagnostik bei Kindern mit primärer Mikrozephalie“ von D. Wieczorek 46 Neuropädiatrie in Klinik und Praxis 12. Jg. (2013) Nr. 1 #6918_Neuropädiatrie_01-2013.indd 46 09.01.13 13:38 Originalien/Übersichten Syndrom Gen Vererbung Neurologische Zeichen* Hämatologische und immunologische Störungen Andere Eigenschaften OMIM Nijmegen-BreakageSyndrom NBS1 AR normaler IQ (oder milde MR) Immundefekt, Tumorprädisposition WR, Dystrophie, kraniofaziale Dysmorphien (Mikrogenie, gebogene Nase) 251260 LIG4-Syndrom LIG4 AR Entwicklungsstörungen (MR) Immundefekt, Panzytopenie, Lymphome WR, Dystrophie, faciale Auffälligkeiten ähnlich NBS, kutane Auffälligkeiten 606593 Schwerer kombinierter Immundefekt (Severe combined immunodeficiency; SCID) mit Mikrozephalie, Wachstumsretardierung und Sensitivität gegenüber ionisierender Bestrahlung NHEJ1 AR MR SCID, wiederholte Infektionen mit opportunistischen Organismen, Lymphopenie, Agammaglobulinemie WR und Dystrophie, Dysmorphien 611291 Fanconi-Anämie FANC A-N meist AR, selten AD MR Anämie, Tumorprädisposition, Myelodysplasien, Leukämie Herz-, Nieren- und Extremitätenfehlbildungen, kutane Pigmentierungsauffälligkeiten, niedriges Geburtsgewicht, Kleinwuchs 227650, 300514, 227645, 605724, 227646, 600901, 603467, 602956, 609053, 609054, 608111, 609644, 610832 Seckel-Syndrom ATR, 18p11q11, 14q AR MR, Epilepsie, cerebelläre Vermishypoplasie, Pachygyrie, Hyperaktivität Panzytopenie prä-/postnatale WR, ausgeprägter Kleinwuchs, kraniofaziale Dysmorphien 210600 Microcephaler osteodysplastischer primordialer Kleinwuchs Typ 2 (MOPD2) PCNT AR MR Moyamoya-Erkrankung, multiple Aneurysmata und Infarkte - Ausgeprägter Kleinwuchs, kraniofaziale Dysmorphien, Knochendysplasien, Typ II Diabetes mellitus, Café-au-laitFlecken 210720 Cockayne-Syndrom ERCC6/8 AR MR Neurodegeneration - Ausgeprägter Kleinwuchs, progrediente Retinopathie, sensoneurale Schwerhörigkeit, kutane Photosensitivität, dünne/trockene Haare, Progerie, Kontrakturen 216400, 133540 Xeroderma pigmentosum ERCC15, XPA/C, DDB2 AR MR, Hyporeflexie, Spastik, Ataxia, Choreoathetose Prädisposition zu kutanen Tumoren Ichthyosis, Photosensitivität, Kleinwuchs, Schwerhörigkeit 126380, 278700, 610651, 278720, 278730, 278740, 278760, 278780 Photosensitive Trichothiodystrophie ERCC2/3 AR MR Hypogammaglobulinämie Ichthyosis, Photosensitivität, Katarakt, brüchige Haare und Nägel 126340, 133510 Tab. 6: Mikrozephalien im Rahmen von Chromosomen-instabilitätssyndromen Abkürzungen: Wachstumsretardierung (WR), NBS1, Nibrin; LIG4, ATP-dependent-DNA-Ligase IV; NHEJ1, Nonhomologous-end-joining-Faktor 1; FANC A-N, Fanconi-Anämie A-N; ATR, Ataxia-telangiectasia-and-RAD3-related-Protein; PCNT, Pericentrin; ERCC, Excision-repair-cross-complementing-Protein; XP, Xeroderma pigmentosum; DDB2, DNA-damage-binding-Protein 2; MR, mentale Retardierung, AR: autosomal-rezessiv. *außer Mikrozephalie ker zu Rate gezogen und eine spezifische molekulargenetische Diagnostik in die Wege geleitet werden (Beispiele in Tab. 1). Eine Analyse der Chromosomenbrüchigkeit, die sehr aufwändig und kostenintensiv ist, sollte bei ausgeprägter Mikrozephalie in Kombination mit Kleinwuchs und Dystrophie und/oder nachgewiesenem Immundefekt durchgeführt werden. Es ist zu erwarten, dass dieses schrittweise Vorgehen innerhalb der nächsten Jahre durch die primäre Durchführung der Exom-Sequenzierung ergänzt oder ersetzt wird. Zum jetzigen Zeitpunkt ist eine An- wendung dieser Technik in Deutschland im Rahmen der Routinediagnostik noch nicht möglich. Immundefekt-Diagnostik bei Kindern mit primärer Mikrozephalie Eine Mikrozephalie kann in Verbindung mit Immundefekten und hämatologischen Erkrankungen auftreten. Die Konstellation „Mikrozephalie und Immundefekt“ kann insbesondere Hinweis auf ein Chro- mosomen-Instabilitätssyndrom sein. Die häufigsten dieser Entitäten (AT, NBS, XLF) sind exemplarisch in Tab. 6 aufgeführt. Wir verweisen zudem auf (25). Klinische hochprädiktive Warnzeichen für einen begleitenden Immundefekt sind mehrfache Infektionen, die intravenös mit Antibiotika, Virostatika oder Antimykotika im Krankenhaus behandelt werden mussten, Kleinwuchs und Dystrophie, Konsanguinität, plötzlicher Kindstod in der Familie oder ein familiär bekannter Immundefekt. Im Rahmen der klinischen Untersuchung beim Kind mit Mikrozephalie sollten im Neuropädiatrie in Klinik und Praxis 12. Jg. (2013) Nr. 1 47 #6918_Neuropädiatrie_01-2013.indd 47 09.01.13 13:38 Originalien/Übersichten I. Mikrozephalie mit normalem oder dünnem Neokortex (z. T. verplumpte Gyrierung („simplified gyration“), CCA, kortikale Dysgenesien, Heterotopien) • pMZ mit schwerer intrauteriner Wachstumsretardierung und ausgeprägtem Kleinwuchs – Seckel-Syndrom (Mutationen im ATR-Gen, MIM*601215) – MOPD Typ 1 (Mutationen im RNU4ATAC-Gen, MIM*601428) – MOPD Typ 2 (Mutationen im PCNT-Gen, MIM*605925) • pMZ mit variabel ausgeprägtem Kleinwuchs – Seckel-Syndrom (Mutationen im CENPJ, CEP152-Gen; MIM*609279, MIM*613529) – MCPH (Mutationen im CENPJ, CEP152-Gen) • pMZ mit leichtem Kleinwuchs oder normaler Körpergröße – MCPH (Mutationen in den MCPH-Genen) • pMZ mit leichtem Kleinwuchs oder normaler Körpergröße und schwerer Retardierung – Schwere MZ Amish-Typ MCPHA (Mutationen im SLC25A19-Gen, MIM*606521) – MZ mit periventrikulären nodulären Heterotopien (Mutationen im ARFGEF2-Gen, MIM*605371) – Warburg-Mikro-Syndrom (Mutationen im RAB3GAP-Gen, MIM*602536) • pMZ mit verplumpter Gyrierung und normaler Körpergröße – Schwere MZ mit Jejunum-Atresie (30) – MZ mit pontocerebellärer Hypoplasie • Nicht weiter klassifizierte pMZ II. Mikrolissenzephalien (MLIS) mit dickem Kortex • MLIS mit dickem Neokortex – Norman-Roberts-Mikrolissenzephalie-Syndrom • MLIS mit dickem Neokortex und schweren Hirnstamm- und Kleinhirnhypoplasien – Barth-Mikrolissenzephalie-Syndrom – MZ mit Lissenzephalie, cerebellärer Hypoplasie, Hirschsprung-Erkrankung • MLIS mit ausgeprägtem Kleinwuchs – Seckel-Syndrom (mit Mutationen im ATR-Gen) – MOPD Typ 1 Variante mit 3-Schichten-Lissenzephalie • MLIS mit leicht bis moderat verdicktem Neokortex (6-8 mm) und CCA III. Mikrozephalie mit Polymikrogyrie oder anderen kortikalen Dysplasien • MZ mit diffuser oder asymmetrischer Polymikrogyrie • MZ mit kortikaler Dysplasie und CCA IV. Mikrozephalie mit Hirnstamm- und/oder Kleinhirn-Fehlbildungen • MZ mit früher Letalität, bilateraler Polymikrogyrie, CCA und Kleinhirnhypoplasie (Mutationen im EOMES-Gen, MIM*604615) • MZ mit Pons- und Kleinhirnhypoplasie, dünnem Hirnstamm und verplumpter Gyrierung (Mutationen im CASK-Gen, MIM*300749) • MLIS mit perisylvanischen Pachygyrie, subkortikalen Heterotopien, CCA, Kleinhirn- und Hirnstammhypoplasie (Mutationen im TUBA1-Gen) • MZ mit asymmetrischen Polymikrogyrie, perisylvanischen Pachygyrie, subkortikalen Heterotopien, CCA, Kleinhirn- und Hirnstammhypoplasie (Mutationen im TUBB2B-Gen, MIM*612850) Tab. 7: Einteilung der primären Mikrozephalien (pMZ) anhand des cMRT-Befundes (morphologische Einteilung). Modifiziert nach Barkovich et al. 2005. Eine erweiterte Einteilung kortikaler Fehlbildungen anhand der Klinik, der Pathogenese und des cMRT-Befundes wurde kürzlich veröffentlicht (26) Abkürzungen: Mikrozephalie, MZ; primäre Mikrozephalie (pMZ); CCA, Corpus-callosum-Anomalien; CASK, calcium/calmodulin-dependent serine protein kinase; alpha tubulin 1A, TUBA1A; beta tubulin 2B, TUBB2B Hinblick auf mögliche immunologische oder hämatologische Grunderkrankungen insbesondere die folgenden Symptome protokolliert werden: Teleangiektasien (z. B. Ataxia teleangiectasia), fliehendes Kinn bei prominentem Nasenrücken (z. B. Seckel-Syndrom, Nijmegen-BreakageSyndrom), Radiusstrahl-/Daumenanomalien (z. B. Fanconi-Anämien), Café-aulait-Flecken (z. B. Nijmegen-BreackageSyndrom, Fanconi-Anämie, Dyskeratosis congenita), Nageldystrophien (z. B. Dyskeratosis congenita), orale Leukoplakie (z. B. Dyskeratosis congenita). Die orientierende Immundefektdiagnostik sollte in jedem Fall ein mikroskopisch differenziertes Blutbild (mit besonderem Augenmerk auf der Zahl der Lymphozyten unter Beachtung der Altersperzentilen), die Spiegel für IgG, IgA, IgM und IgE sowie Impfantikörper gegen Tetanus und Masern umfassen. Diese Untersuchungen erlauben, bereits viele der humoralen und zellulären Defekte der adaptiven Seite des Immunsystems zu diagnostizieren. Das Blutbild erfasst Anämie, Thrombozytopenie und Granulozytopenie und damit die meisten Formen einer Fanconi-Anämie (meist makrozytäre Anämie). Die Gesamtlymphozytenzahl orientiert über die Anzahl der T-Lymphozyten (zelluläre adaptive Immunität), da ca. 70% aller Lymphozyten T-Lymphozyten sind und diese bei klassischem schweren Immundefekt (SCID) deutlich vermindert sind (zelluläre adaptive Immunität). Die Spiegel für IgG, IgA und IgM orientieren über die Funktion der B-Lymphozyten (humorale adaptive Immunität) und die Impfantikörper über das Zusammenspiel antigen- 48 Neuropädiatrie in Klinik und Praxis 12. Jg. (2013) Nr. 1 #6918_Neuropädiatrie_01-2013.indd 48 09.01.13 13:38 Originalien/Übersichten präsentierender Zellen mit T-Lymphozyten und B-Lymphozyten (siehe Abb. 7). Die Bestimmung von Blutbild, globalen Immunglobulinspiegeln und Impfantikörpern erfasst vermutlich 40% aller bisher bekannten Immundefekte. Die Konstellation „Mikrozephalie mit Immundefekt“ ist jedoch besonders verdächtig für Immundefekte, die eine alleinige orientierende immunologische Diagnostik verpassen kann. Wir schlagen deshalb vor, jenseits der Neonatalperiode bei Kindern mit Mikrozephalie und klinischen Zeichen eines Immundefekts die Diagnostik um die Bestimmung der Chromosomenbrüchigkeit und weitere spezielle immunologische Untersuchungen zu erweitern [siehe (25)]. Bildgebung bei Kindern mit primärer Mikrozephalie Mikrozephalien können anhand des Schädel-MRT-Befunds in Anlehnung an die Einteilung der Kortex-Malformationen von Barkovich und Mitarbeitern (26, 27) eingeteilt werden in solche mit (i) normalem oder schmalem Neokortex, (ii) mit Lissenzephalie (verbreitertem Neokortex), (iii) mit Polymikrogyrien oder anderen kortikalen Dysplasien und (iv) mit weiteren schweren Hirnfehlbildungen (Tab. 7). In unserer Erfahrung weisen circa 60% aller Kinder mit einer Mikrozephalie einen abnormen cMRT-Befund auf (unpublizierte Daten), und dies ist auch im Einklang mit anderen Studien, in denen auffällige cMRT-Befunde bei 43-80% der Patienten mit Mikrozephalie und ca. 75-80% der Patienten mit schwerer Mikrozephalie (unter – 3 SD) (28). Diese Autoren wiesen auch auf die Überlegenheit einer MRTgegenüber einer CT-Untersuchung zur Detektierung zerebraler Anomalien hin. Die Identifizierung von Entwicklungsstörungen des Gehirns oder Hirndefekten kann die weitere Diagnostik signifikant lenken, da beispielsweise Gendefekte bei spezifischen Fehlbildungen beschrieben sind (z. B. Lissenzephalie, Schizenzephalie). Weitere Untersuchungen bei Kindern mit primärer Mikrozephalie Das Leitsymptom Mikrozephalie stellt einen Risikofaktor für das Vorkommen einer Epilepsie dar, wobei es keine größeren Studien hinsichtlich der Prävalenz gibt. Dementsprechend kann keine generelle Empfehlung zu einer routinemäßigen EEGUntersuchung bei allen Kindern mit Mikrozephalie ausgesprochen werden. Die Indikationsstellung folgt nach unserer Auffassung der bei Kindern ohne Mikrozephalie. Abb. 7: Schnittstelle zwischen „innate“ und „adaptive“ Immunität. Tetanustoxoid ist Bestandteil der Schutzimpfung gegen Tetanus. Tetanustoxoid, ein Peptid, das sich aus wenigen Aminosäuren zusammensetzt, wird von Antigen-präsentierenden Zellen (APZ) aufgenommen, prozessiert und MHC Klasse II vermittelt T-Zellen präsentiert. Für die optimale Aktivierung der T-Zellen ist neben der MHC-vermittelten Interaktion zwischen APZ und T-Zelle auch mindestens ein kostimulatorisches Signal nötig (hier CD80/CD28). Diese APZ/T-Zell-Interaktion ist Voraussetzung für die Bildung von Antikörpern gegen Tetanus durch B-Zellen. Modifiziert nach Prof. V. Wahn und (29) Obgleich es keine gute Datenlage zur Häufigkeit weiterer Anomalien bei Kindern mit Mikrozephalien gibt, empfehlen wir eine großzügige Indikationsstellung zur Durchführung einer ausführlichen augenärztlichen und kardiologischen Untersuchung und einer Abdomen-Sonographie mit der Frage nach dem Vorliegen weiterer Fehlbildungen als weitere Mosaikstein zur Diagnosestellung. Erste Diagnostik in der Neonatologie bei Kindern mit primärer Mikrozephalie In der Neonatalperiode steht die Abklärung intrauteriner Infektionen (Toxoplasmose, CMV) im Vordergrund, die Mikrozephalie geht in diesen Fällen mit sonographisch detektierbaren strukturellen Gehirndefekten (Narben) einher. Während die Wertigkeit der postnatalen Behandlung einer konnatalen Toxoplasmose umstritten ist, hat die Bedeutung einer konnatalen CMV-Infektion (PCR im Urin innerhalb der ersten Lebenswoche) therapeutische Konsequenzen (Verhinderung der progredienten Hörstörung durch Valganciclovir-Behandlung). Eine prämature Schädelnahtsynostose ist durch die klinische Untersuchung zu erfassen. Liegt bei einem Elternteil ebenfalls eine milde Mikrozephalie bei guter kognitiver Entwicklung vor, ist eine benigne familiäre Mikrozephalie in Betracht zu ziehen. Aufgund geburtsbedingter Schädelverformungen und extrakraniellen Blutungen (Caput succedaneum, Kephalhämatom) treten bei der Messung des Kopfumfangs in der Neonatalzeit Artefakte auf; Klarheit schaffen dann die Folgemessungen ab der U3. Zusammenfassung und Ausblick In diesem Beitrag stellen wir unseren Vorschlag zur Diagnostik bei Vorliegen einer primären Mikrozephalie vor. Wir weisen auf ein unterschiedliches Vorgehen bei Kindern mit primärer Mikrozephalie mit weiteren klinischen Auffälligkeiten im Vergleich zu Kindern mit einer unauffälligen neurologischen Entwicklung hin. Wird ein Kind erst im späteren Kindesalter mit der Diagnose einer kongenitalen Mikrozephalie vorgestellt, so kann man bei unauffälliger psychomotorischer Entwicklung des Kindes zunächst Abstand von weiterführender Diagnostik nehmen. Weitere Erfahrung mit diesem Vorgehen und Diskussionen mit Fachkollegen werden notwendig sein, um in der Zukunft eine entsprechende Leitlinie aufzustellen. Die Autoren bitten ausdrücklich um Resonanz von den Lesern. Danksagung Unsere Forschungsarbeiten wurden finanziell gefördert durch die Deutsche Forschungsgemeinschaft (DFG; SFB665), die Sonnenfeld-Stiftung, die Berliner Neuropädiatrie in Klinik und Praxis 12. Jg. (2013) Nr. 1 49 #6918_Neuropädiatrie_01-2013.indd 49 09.01.13 13:38 Originalien/Übersichten Krebsgesellschaft e. V, die Charité – Universitätsmedizin Berlin und das BMBF für CRANIRARE (01GM1211B). Literatur 1. Voigt M FC, Olbertz D, Hartmann K, Rochnow N, Renken C, Schneider KTM. Analyse des Neugeborenenkollektivs der Bundesrepublik Deutschland. Geburtsh Frauenheilk. 2006; 66(10): 956-70. 2. Schienkiewitz A, Schaffrath Rosario A, Dortschy R, Ellert U, Neuhauser H. German head circumference references for infants, children and adolescents in comparison with currently used national and international references. Acta Paediatr. 2011 Jul; 100(7): e28-33. 3. Nellhaus G. Head circumference from birth to eighteen years. Practical composite international and interracial graphs. Pediatrics. 1968 Jan; 41(1): 106-14. 4. Prader A, Largo RH, Molinari L, Issler C. Physical growth of Swiss children from birth to 20 years of age. First Zurich longitudinal study of growth and development. Helv Paediatr Acta Suppl. 1989 Jun; 52: 1-125. 5. Braillon A. Practice parameter: evaluation of the child with microcephaly (an evidence-based review): report of the quality standards subcommittee of the American Academy Of Neurology and the Practice Committee Of The Child Neurology Society. Neurology. 2010 Mar 30; 74(13): 1079-80; author reply 80. 6. Hanley WB, Platt LD, Bachman RP, Buist N, Geraghty MT, Isaacs J et al. Undiagnosed maternal phenylketonuria: the need for prenatal selective screening or case finding. Am J Obstet Gynecol. 1999 Apr; 180(4): 986-94. 7. Lenke RR, Levy HL. Maternal phenylketonuria and hyperphenylalaninemia. An international survey of the outcome of untreated and treated pregnancies. N Engl J Med. 1980 Nov 20; 303(21): 1202-8. 8. Tabatabaie L, Klomp LW, Berger R, de Koning TJ. L-serine synthesis in the central nervous system: a review on serine deficiency disorders. Mol Genet Metab. 2010 Mar; 99(3): 256-62. 9. Goldenberg A, Chevy F, Bernard C, Wolf C, Cormier-Daire V. [Clinical characteristics and diagnosis of Smith-Lemli-Opitz syndrome and tentative phenotype-genotype correlation: report of 45 cases]. Arch Pediatr. 2003 Jan; 10(1): 4-10. 10. Barnerias C, Saudubray JM, Touati G, De Lonlay P, Dulac O, Ponsot G et al. Pyruvate dehydrogenase complex deficiency: four neurological phenotypes with differing pathogenesis. Dev Med Child Neurol. 2010 Feb; 52(2): e1-9. 11. van Straaten HL, van Tintelen JP, Trijbels JM, van den Heuvel LP, Troost D, Rozemuller JM et al. Neonatal lactic acidosis, complex I/IV deficiency, and fetal cerebral disruption. Neuropediatrics. 2005 Jun; 36(3): 193-9. 12. Siu VM, Ratko S, Prasad AN, Prasad C, Rupar CA. Amish microcephaly: Long-term survival and biochemical characterization. Am J Med Genet A. 2010 Jul; 152A(7): 1747-51. 13. Kranz C, Sun L, Eklund EA, Krasnewich D, Casey JR, Freeze HH. CDG-Id in two siblings with partially different phenotypes. Am J Med Genet A. 2007 Jul 1; 143A(13): 1414-20. 14. Schollen E, Grunewald S, Keldermans L, Albrecht B, Korner C, Matthijs G. CDG-Id caused by homozygosity for an ALG3 mutation due to segmental maternal isodisomy UPD3(q21.3-qter). Eur J Med Genet. 2005 Apr-Jun; 48(2): 153-8. 15. Morava E, Vodopiutz J, Lefeber DJ, Janecke AR, Schmidt WM, Lechner S, et al. Defining the Phenotype in Congenital Disorder of Glycosylation Due to ALG1 Mutations. Pediatrics. 2012 Oct; 130(4): e1034-9. 16. Morava E, Zeevaert R, Korsch E, Huijben K, Wopereis S, Matthijs G et al. A common mutation in the COG7 gene with a consistent phenotype including microcephaly, adducted thumbs, growth retardation, VSD and episodes of hyperthermia. Eur J Hum Genet. 2007 Jun; 15(6): 638-45. 17. Chenel C, Wood C, Gourrier E, Zittoun J, Casadevall I, Ogier H. [Neonatal hemolytic-uremic syndrome, methylmalonic aciduria and homocystinuria caused by intracellular vitamin B 12 deficiency. Value of etiological diagnosis]. Arch Fr Pediatr. 1993 Nov; 50(9): 749-54. 18. Gailus S, Suormala T, Malerczyk-Aktas AG, Toliat MR, Wittkampf T, Stucki M et al. A novel mutation in LMBRD1 causes the cblF defect of vitamin B(12) metabolism in a Turkish patient. J Inherit Metab Dis. 2010 Feb; 33(1): 17-24. 19. Busche A, Hennermann JB, Burger F, Proquitte H, Dierks T, von Arnim-Baas A et al. Neonatal manifestation of multiple sulfatase deficiency. Eur J Pediatr. 2009 Aug; 168(8): 969-73. 24. D. Wieczorek, Diagnostik bei Kindern mit primärer Mikrozephalie, Neuropädiatrie in Klinik und Praxis. 2013. 25. Kenzel S SD, von Bernuth H. Mikrozephalie und angeborene Immundefekte. Neuropädiatrie in Klinik und Praxis. 2013. 26. Barkovich AJ, Kuzniecky RI, Jackson GD, Guerrini R, Dobyns WB. A developmental and genetic classification for malformations of cortical development. Neurology. 2005 Dec 27; 65(12): 1873-87. 27. Barkovich AJ, Guerrini R, Kuzniecky RI, Jackson GD, Dobyns WB. A developmental and genetic classification for malformations of cortical development: update 2012. Brain. 2012 May; 135(Pt 5): 1348-69. 28. Ashwal S, Michelson D, Plawner L, Dobyns WB. Practice parameter: Evaluation of the child with microcephaly (an evidence-based review): report of the Quality Standards Subcommittee of the American Academy of Neurology and the Practice Committee of the Child Neurology Society. Neurology. 2009 Sep 15; 73(11): 887-97. 29. Medzhitov R, Janeway C, Jr. Innate immunity. N Engl J Med. 2000 Aug 3; 343(5): 338-44. 30. Stromme P, Dahl E, Flage T, Stene-Johansen H. Apple peel intestinal atresia in siblings with ocular anomalies and microcephaly. Clin Genet. 1993 Oct; 44(4): 208-10. 20. Fritchie K, Siintola E, Armao D, Lehesjoki AE, Marino T, Powell C et al. Novel mutation and the first prenatal screening of cathepsin D deficiency (CLN10). Acta Neuropathol. 2009 Feb; 117(2): 201-8. 21. Mayatepek E, Flock B. Leukotriene C4-synthesis deficiency: a new inborn error of metabolism linked to a fatal developmental syndrome. Lancet. 1998 Nov 7; 352(9139): 1514-7. 22. Carmi-Nawi N, Malinger G, Mandel H, Ichida K, Lerman-Sagie T, Lev D. Prenatal brain disruption in molybdenum cofactor deficiency. J Child Neurol. 2011 Apr; 26(4): 460-4. 23. Kraemer N M-RD, Kaindl AM. Primäre autosomalrezessive Mikrozephalie (MCPH). Neuropädiatrie in Klinik und Praxis. 2013. * Korrespondenzadresse Priv.-Doz. Dr. med. Angela M. Kaindl Klinik für Pädiatrie mit Schwerpunkt Neurologie Charité – Universitätsmedizin Berlin Campus Virchow-Klinikum Augustenburger Platz 1 D-13353 Berlin, Germany Tel./Fax: +49 30 450 566112/920 Email: [email protected] Internetadressen (www1) www.ncbi.nlm.nih.gov/omim (www2) www.ncbi.nlm.nih.gov/books/NBK1116 (www3) www.orpha.net/consor/cgi-bin/index.php (www4) http://www.cdc.gov/growthcharts (www5) http://www.who.int/childgrowth/standards/en (www6) http://www.down-syndrom.at (www7) http://pediatrics.emory.edu.edu/divisions/neurology/hc.pdf (www8) http://www.healthforallchildren.co.uk/pro. epl?DO=USERPAGE&PAGE=lmsterms (www9) http://www.dgspj.de/media/QZ%20Psychologische%20Diagnostik%20Endversion.pdf (www10) www.awmf.org/uploads/tx_szleitlinien/022017l_S3_Umschriebene_ Entwicklungsst%C3%B6rungen_motorischer_Funktionen_2011-08.pdf (www11) www.awmf.org/uploads/tx_szleitlinien/049-006l_S2k_Sprachentwicklungsstoerungen_Diagnostik_2012.pdf (www12) www.awmf.org/uploads/tx_szleitlinien/022-020_S1_Visuelle_Wahrnehmungsstoerungen_06-2009_06-2014.pdf Interessenkonflikt Die Autoren geben an, dass kein Interessenkonflikt besteht. 50 Neuropädiatrie in Klinik und Praxis 12. Jg. (2013) Nr. 1 #6918_Neuropädiatrie_01-2013.indd 50 09.01.13 13:38 Originalien/Übersichten Moderne genetische Methoden zur Untersuchung von Patienten mit Mikrozephalie R. A. JAMRA, INSTITUT FÜR HUMANGENETIK, UNIVERSITÄT ERLANGEN-NÜRNBERG, SCHWABACHANLAGE 10, 91054 ERLANGEN Zusammenfassung Bibliography Die Ursachen für Mikrozephalien sind meist genetisch bedingt. Erst in jüngster Zeit erlauben moderne Technologien eine systematische Identifizierung beteiligter Gene. In dieser Übersicht werden zunächst die massiv parallelen Sequenzierungs-Technologien beschrieben. Dann werden die Vorgehensweisen bei den verschiedenen Formen (syndromal und nicht-syndromal) und Vererbungsmodi (autosomal-rezessiv, autosomal-dominant und X-chromosomal-rezessiv) der Mikrozephalien erläutert. Neuropaediatrie 2013; 12: 51-57, © Schmidt-Roemhild-Verlag, Luebeck, Germany: ISSN 1619-3873; NLM ID 101166293; OCoLc 53801270 Schlüsselwörter Next Generation Sequencing – massiv parallele Sequenzierung – Exomsequenzierung – Konsanguinität – De-novo-Mutation – Paneldiagnostik Current genetic investigation methods in microcephaly patients Abstract Causes of microcephaly are mostly genetic. Modern technologies allow systematic identification of involved genes. In this review, the technologies of next generation sequencing are shortly described. Furthermore, strategies to identify the involved genes causing non-syndromic (autosomal recessive, autosomal dominant, and X linked) and syndromic microcephaly are discussed. Keywords next generation sequencing – massive parallel sequencing – exome sequencing – consanguinity – de novo mutation – panel diagnostics Einleitung Mikrozephalie ist definiert durch einen Kopfumfang von weniger als drei Standardabweichungen. In Kliniken vorgestellte Betroffene haben in der Regel zudem eine Intelligenzminderung und teilweise zusätzliche Symptome im Sinne eines komplexeren Syndroms. [1] Bisher konnten nur relativ wenige Mikrozephalie-ursächliche Gene identifiziert werden. Gründe hierfür sind die genetische Heterogenität und ein unspezifischer klinischer Phänotyp bei den meisten Patienten, welche das Zusammenfassen unabhängiger Familien bei Kopplungsund anschließenden Mutationsanalysen erschweren. Durch die Entwicklung der neuen Technologien der massiv parallelen Sequenzierung (Next Generation Sequencing, NGS) wurden jedoch in den letzten zwei Jahren die technischen Grundlagen gelegt, die eine weitgehende Aufklärung der genetischen Ursachen für Mikrozephalie möglich machen. In den folgenden Abschnitten werden die Methoden der massiv parallelen Sequenzierung bzw. des NGS erklärt und die verschiedenen Strategien zur Identifizierung der ursächlichen Mikrozephalie-Mutationen diskutiert. Next Generation Sequencing (NGS) Seit Entwicklung der Sanger-Sequenzierung ist es relativ einfach geworden, Mutationen in einzelnen Genen zu finden. Anfang dieses Jahrhunderts wurde die erste vollständige Sequenzierung des gesamten Erbgutes eines Menschen, des sogenannten Genoms, durchgeführt. [2] Allerdings war die erste Sequenzierung zeit- und kostenaufwendig. Für die Sequenzierung vieler Genome und das Screenen von großen Kopplungsregionen mussten neue, schnelle und kosteneffektive Hochdurchsatzverfahren entwickelt werden: die nächste Generation der Sequenzierung (Next Generation Sequencing, NGS). Zwei NGS-Ansätze sind weit verbreitet: a) Sequenzierung durch Synthese: Es werden Millionen kurze DNA-Fragmente immobilisiert und klonal amplifiziert. Danach werden massiv parallele, millionenfache und gleichzeitige Sequenzierungen der immobilisierten Kolonien mit Hilfe reversibler Terminatoren durchgeführt. [3] Die genutzten fluoreszierenden dNTPs terminieren die Reaktion, um sicherzustellen, dass nur eine Base eingebaut wird. Nach Detektion wird die Fluoreszenz abgespalten und die Bindungsstelle damit für das nächste Nukleotid frei. 2007 kaufte die Firma Illumina die Rechte und entwickelt und vertreibt seitdem die kommerziellen Maschinen. Die neue Generation der Illumina-Maschinen können in einem Lauf 600 Gb (600.000.000.000 Basenpaare) lesen. [4] Ich verweise auch auf einen kurzen Film über die Chemie der Methode auf der Webseite der vertreibenden Firma. [5] b) Sequenzierung durch Ligation: Ein Beispiel für diesen Ansatz ist das System SOLiD (support oligonucleotide ligation detection) von Applied Biosystems. Hier werden zunächst kurze DNA-Fragmente an kleinen magnetischen Kügelchen gebunden, in einer Emulsions-PCR klonal amplifiziert und auf einen Träger verteilt. Für diese Sequenzierung werden auf vier verschiedenen Wellenlängen fluoreszierende Proben verwendet; die ersten beiden Basen sind dabei spezifisch, die drei Basen danach sind degeneriert und die letzen Neuropädiatrie in Klinik und Praxis 12. Jg. (2013) Nr. 1 51 #6918_Neuropädiatrie_01-2013.indd 51 09.01.13 13:38 Originalien/Übersichten drei Basen sind universal. Somit werden allein die ersten beiden Basen spezifisch erkannt. Eine DNA-Ligase verbindet die Sonde mit dem Primer, die Fluoreszenz wird abgespalten und die nächste Sonde kann binden. Auf diese Weise wird das Gesamt-DNA-Fragment abgelesen. Insgesamt müssen fünf Zyklen durchgeführt werden, damit eine genaue Bestimmung der Nukleotide erfolgen kann. [6, 7] Auch hier verweise ich auf die gut verständlichen Darstellungen auf der Webseite des Anbieters. [8] Anreicherungsmethoden und ExomSequenzierung: Obwohl es möglich ist, das gesamte Genom zu sequenzieren, ist dies wenig sinnvoll. Die Ermittlung der gesamten Sequenz einer Person ist auch mittels dieser neuen Technologie zeitund kostenaufwendig (niedrige 5-stellige Summe in Euro). Die gewonnenen Informationen sind größtenteils (über 98%) in nicht kodierenden Bereichen und somit derzeit kaum interpretierbar. Es macht daher Sinn, lediglich die kodierenden Bereiche (Exons) zu sequenzieren. Es wurden Methoden zur Anreicherung von kodierenden Fragmenten des Genoms in der Sequenzierreaktion entwickelt und sind kommerziell verfügbar. Eine Möglichkeit zur Anreicherung basiert auf der Genom-Partitionierung mittels Hybridselektionstechnik in Lösung, bei der komplementäre Oligonukleotid-Sonden die entsprechenden kodierenden DNAFragmente „fangen“. Dies wird z. B. von der Firma Agilent angeboten. Eine weitere Möglichkeit ist PCR-basiert. Hier werden Primer in großem Stil hergestellt und parallel (multiplex) angewendet, um bestimmte Areale des Genoms zu amplifizieren (z. B. von der Firma RainDance). In Abhängigkeit vom System, kann man mehrere Millionen Basenpaare erfassen. Alle Anbieter haben zudem „Von der Stange“-Produkte zur Anreicherung der gesamten kodierenden Sequenz im Genom (Exomanreicherung). Kritische Punkte bei dem NGS-Ansatz: Unabhängig von allen Unterschieden in Durchführung und Anwendung haben alle Plattformen für NGS eine schnellere und günstigere Sequenzierung einer großen Gen- und Probenzahl gegenüber der klassischen Sanger-Sequenzierung gemeinsam. [9] Allerdings gibt es ein paar Punkte zu beachten: • Beide Sequenzierungsansätze, Sequenzierung durch Synthese und Sequenzierung durch Ligation, produzieren kurze Sequenzfragmente (auch Reads genannt) von 30–100 Basenpaaren. Daher ist eine bekannte Referenzsequenz zum Vergleich und zur Kartierung der Sequenzen an der richtigen Stelle im menschlichen Genom wichtig. Es handelt sich hierbei also um eine so genannte Re-Sequenzierung. • In einem Read hat man im Vergleich zur Sanger-Sequenzierung häufig Sequenzierungsfehler bzw. Artefakte. Diese werden kompensiert, indem jedes Basenpaar von vielen Reads gelesen wird. Je besser die Abdeckung (deep sequencing) der zu sequenzierenden Abschnitte ist, desto zuverlässiger wird die Aussage über die tatsächliche Sequenz. Wenn eine genetische Veränderung identifiziert wird, ist daher auf die Abdeckung zu achten. Bei einer schwachen Abdeckung sollte zunächst Informationsbox 1: Strategie zur Identifizierung von Genmutationen bei autosomal-rezessiver Mikrozephalie 52 Neuropädiatrie in Klinik und Praxis 12. Jg. (2013) Nr. 1 #6918_Neuropädiatrie_01-2013.indd 52 09.01.13 13:38 Originalien/Übersichten Informationsbox 2: Strategie zur Identifizierung von Genmutationen bei X-chromosomal-rezessiver Mikrozephalie eine Bestätigung der Variante mittels Sanger-Sequenzierung erfolgen. • Die Anreicherungs- und Amplifizierungsschritte erfassen nicht alle Zielabschnitte, wahrscheinlich aufgrund der Sequenz oder der Lage des jeweiligen Abschnitts. Somit besteht in aller Regel keine 100%ige Abdeckung aller Zielsequenzen. Hierfür wird der Begriff Coverage verwendet. Ein Coverage von 90% bedeutet, dass 10% der Zielsequenzen nicht erfasst wurden. Dritte Generation der Sequenzierung (?): Inzwischen gibt es auch Ansätze zur zeitechten Sequenzierung. [10, 11] Dafür werden ebenfalls fluoreszierende dNTPs genutzt, die aber die Reaktion nicht terminieren. Hier steht die Geschwindigkeit, in der die Fluoreszenz detektiert werden kann, im Vordergrund, da der Einbau der Nukleotide sehr schnell erfolgt. Wissenschaftliche Arbeiten haben bewiesen, dass dieses Prinzip grundsätzlich erfolgreich sein kann. Eine weitere Entwicklung, an der gearbeitet wird, ist die zeitgleiche Sequenzierung ohne Amplifizierung der DNA und somit mit Zeitersparnis und ohne Verzerrungen durch Anreicherung. [12] Sollten diese wissenschaftlichen Ansätze in kommerziellen Maschinen umgesetzt werden, eröffnen sich ungeahnte Möglichkeiten zur Sequenzierung des gesamten Genoms eines Menschen binnen weniger als eine Stunde. Identifizierung neuer Gene bei autosomal-rezessiven Formen der Mikrozephalie Die autosomal-rezessiven Formen der Mikrozephalie sind besonders gut untersucht und auch funktionelle Untersuchungen über die zellulären und regulatorischen Mechanismen wurden publiziert. In den letzten Jahren wurden sieben Gene, MCPH1, WDR62, CDK5RAP2, CEP152, ASPM, CENPJ und STIL, für autosomal-rezessive Mikrozephalie diskutiert. [1, 13, 14] Allerdings erklären diese nur einen Teil aller Fälle, insbesondere wenn Mikrozephalie nicht das einzige Symptom ist. Zur Identifizierung von neuen Genen für die autosomal-rezessiven Formen stellt der positionelle Klonierungsansatz in großen konsanguinen Familien den entscheidenden ersten Schritt dar. Bei Patienten aus konsanguinen Familien sind in der Regel seltene oder private homozygote Mutationen für die Mikrozephalie ursächlich, die in durch Abstammung identischen genomischen Abschnitten (identical by descent, IBD) vorliegen. Die Untersuchung und Rekrutierung von solchen großen Familien erfolgt teilweise in den Ländern des sogenannten Konsanguinitätsgürtels, welcher sich von Nordafrika bis nach Indien streckt. [15] Es ist wich- tig, bei der Familie den Stammbaum und die Anamnese zu erheben, den klinischen Phänotyp fotografisch zu dokumentieren und die vorliegenden medizinischen Befunde erneut auszuwerten. Ausführliche Differentialdiagnosen sollten erwogen werden. Zudem ist es sinnvoll, die häufigsten bekannten genetischen Ursachen für Mikrozephalie vorab abzuklären (Chromosomenanalyse, Ausschluss der häufigen bekannten Gene usw.). Die Stammbäume sind von besonderer Wichtigkeit, um eine zuverlässige Annahme der Vererbung zu ermöglichen. Fälle mit einem Betroffenen sind möglicherweise aufgrund einer Denovo-Mutation und nicht aufgrund einer Gründer-Mutation entstanden (siehe folgende Abschnitte). Fälle mit nur männlichen Betroffenen können möglicherweise aufgrund von X-chromosomal-rezessiven Mutationen entstanden sein. Fälle mit betroffenen Cousins und Cousinen sind wiederum besonders vorteilhaft, weil die Kopplungsanalyse besonders informativ wird. Im ersten Schritt sollen genomweite Kopplungsanalysen durchgeführt werden. Dabei werden alle Betroffenen und deren gesunde Geschwister untersucht. Angewendet werden in der Regel SNP-Arrays mit einer hohen Dichte von genetischen Markern (in Abhängigkeit vom Anbieter zwischen 300.000 und 2.000.000 Markern). Die Analysen erfol- Neuropädiatrie in Klinik und Praxis 12. Jg. (2013) Nr. 1 53 #6918_Neuropädiatrie_01-2013.indd 53 09.01.13 13:38 Originalien/Übersichten Informationsbox 3: Strategie zur Identifizierung von Genmutationen bei autosomal-dominanter Mikrozephalie (De-novo-Mutationen) gen unter dem Modell einer autosomalrezessiven Vererbung. So können die Kandidatenregionen ermittelt und ggf. erste Gene untersucht werden. Hierzu sind einige Studien publiziert. In einer Studie von 2010 präsentieren Darwish und Kollegen die Ergebnisse der Kopplungsanalysen bei 112 konsanguinenen Familien mit Betroffenen mit Mikrozephalie (92 nicht-syndromal und 20 syndromal). In 81 Familien konnten sie keine Kopplung zu einem der bekannten Loci finden und von den Familien mit Kopplung konnte bei 20 eine ursächliche Mutation gefunden werden. [16] In einer weiteren Arbeit von 2011 an 57 konsanguinen Familien mit Mikrozephalie konnten die Autoren nach Kopplungsanalysen und gezielter Sanger-Sequenzierung in 27 Familien die ursächliche Mutation finden. [17] Nach Kopplungsanalysen werden die Exome der Indexpatienten angereichert und massiv parallel sequenziert. Meine bisherigen Erfahrungen am Humangene- Informationsbox 4: Strategie zur Identifizierung von Genmutationen bei syndromaler Mikrozephalie 54 Neuropädiatrie in Klinik und Praxis 12. Jg. (2013) Nr. 1 #6918_Neuropädiatrie_01-2013.indd 54 09.01.13 13:38 Originalien/Übersichten tischen Institut in Erlangen zeigen, dass pro sequenzierter Person exomweit ca. 35.000 Varianten identifiziert werden. Um die Zahl der in Frage kommenden Varianten zu reduzieren, werden mehrere Filterungsschritte durchgeführt (Informationsbox 1): • Zuerst werden nur Varianten in Betracht gezogen, welche in den vorab bestimmten Kopplungsregionen vorliegen. Je informativer die Familie ist, desto kleiner sind die Kopplungsregionen und somit die Zahl der Kandidatenvarianten. • Dann werden die Varianten ausgeschlossen, die basierend auf öffentlichen Datenbanken wie z. B. dbSNP, ESP und das 1000Genomes-Projekt bereits bekannt sind und häufig in der Allgemeinbevölkerung vorkommen. [18-20] • Die identifizierten Varianten werden mit verschiedenen ComputerProgrammen in silico analysiert (PolyPhen2 SIFT, MutationTaster, BDGP und NETGENE2, [21-26]). Anhand des Konservierungsgrads der Position und der Sequenz sowie der sekundären Strukturänderung der mRNA und des Proteins errechnen diese Programme, mit welcher Wahrscheinlichkeit eine Variante krankheitsverursachend ist. Solche Analysen dienen als Orientierungshilfe. • Identifizierte Varianten, die durch die obigen Filterungsschritte selektiert wurden, werden mittels Sanger-Sequenzierung validiert, um NGS-Artefakte auszuschließen, und auf Segregation in der Familie überprüft. In Abhängigkeit von der Lage der öffentlichen Datenbanken und der Ethnizität der untersuchten Familie könnten Genotypisierungen in Kontrollkollektiven auf die Prävalenz hin durchgeführt werden. Den übrig gebliebenen Kandidatenmutationen kommt eine hohe Wahrscheinlichkeit zu, krankheitsverursachend zu sein. Es wurden Arbeiten publiziert, welche bei einzelnen Familien mit Mikrozephalie nach Kopplung NGS angewendet haben, beispielsweise das Identifizieren des Gens CEP135. [27] Mithilfe von Kopplung und NGS haben wir am Humangenetischen Institut in Erlangen drei neue interagierende Gene identifiziert und das neue AP4-MangelSyndrom mit Intelligenzminderung, Mikrozephalie und spastischer Tetraplegie charakterisiert. [28] Es liegen keine systematischen Analysen mit Mikrozephalie als Leitsymptom vor, jedoch mit dem verwandten bzw. überlappenden Leitsymptom Intelligenzminderung. Unsere Pilot-Untersuchungen an 24 Familien mit Intelligenzminderung (mit und ohne Mikrozephalie) ergaben 4 Mutationen in bereits bekannten Genen und 9 überzeugende Kandidatenmutationen. [29] Auch andere Daten über autosomal-rezessive Intelligenzminderung mit und ohne Mikrozephalie ergeben ähnliche Ergebnisse. [30, 31] Es ist davon auszugehen, dass ähnliche Zahlen erzielt werden können, wenn Familien mit Mikrozephalie als Leitzsymptom systematisch untersucht werden. Weitere Evidenz, dass eine Variante tatsächlich die ursächliche Mutation ist und das entsprechende Kandidatengen mit dem Krankheitsbild in Zusammenhang steht, ist essentiell. Dies kann relativ zuverlässig durch die Identifizierung einer zweiten Mutation im selben Gen bei einer anderen Familie erzielt werden. Eine weitere Möglichkeit zur Überprüfung der Pathogenität sind funktionelle Analysen. Identifizierung neuer Gene bei X-chromosomal-rezessiven Formen der Mikrozephalie Auch für die X-chromosomal-rezessiven Formen stellt der positionelle Klonierungsansatz in großen, klinisch gut charakterisierten Familien den ersten Schritt dar. Bei einer wahrscheinlich X-gebundenen Vererbung wird ein speziell optimiertes NGS-Experiment angewendet. Besonders ist hierbei das Anreicherungssystem, welches lediglich die kodierenden Sequenzen des X-Chromosoms anreichert. Somit erreicht man eine beinahe komplette und auch tiefe Abdeckung aller Zielsequenzen. Die Filterungsschritte ähneln der bereits beschriebenen Strategie bei den autosomal-rezessiven Formen: Suche nach nicht annotierten Varianten auf dem X-Chromosom (ggf. in den Kopplungsregionen) mit in-silicopathogenem Effekt, welche in der Familie segregieren und in der Allgemeinbevölkerung nicht oder nur äußerst selten vorkommen (Informationsbox 2). Es sind bisher keine systematischen Studien mit Mikrozephalie als Leitsymptom und X-gebundener Vererbung publiziert worden, dafür aber zahlreiche und systematische Studien des überlappenden Phänotyps Intelligenzminderung. Der Erfolg dieser Strategie wurde dadurch belegt, dass Mutationen in über 100 Genen auf dem X-Chromosom bereits mit Intelligenzminderung assoziiert wurden und dass mittlerweile über die Hälfte aller X-Chromosom-gebundenen Fälle abgeklärt werden kann. [32] Identifizierung neuer Gene bei autosomal-dominanten Formen der Mikrozephalie Mikrozephalie mit Intelligenzminderung wird selten vererbt, weil die Reproduktion von Betroffenen eingeschränkt ist. Sollten geeignete Familien vorliegen, wäre als erster Schritt die Kopplungsanalyse indiziert, um die Zahl der Kandidatengene einzuschränken. Es folgt dann NGS, in diesem Fall nicht nur beim Indexpatienten, wie bei den rezessiven Formen, sondern auch bei den Eltern. Der Grund ist die große zu erwartende Zahl an heterozygoten Kandidatenvarianten, welche durch die gleichzeitige Untersuchung der Eltern direkt auf Segregation getestet werden können. Es folgen dann die im vorigen Abschnitt angesprochenen Filterungskriterien: in der Kopplungsregion, nicht annotiert, insilico-pathogen und „kommt in gesunden Kontrollen nicht vor“. Die Mehrheit der abklärungsbedürftigen autosomal-dominanten Formen tritt jedoch aufgrund De-novo-Mutationen auf. Hier stellt die exomweite Sequenzierung eines Trios, also vom Betroffenen und seinen gesunden Eltern, den ersten Schritt dar. Es werden nur die heterozygoten De-novo-Varianten in Erwägung gezogen, welche bei keinem Elternteil vorliegen, jedoch beim Betroffenen. Die identifizierten Varianten werden mit verschiedenen in-silico–Programmen als Orientierungshilfe analysiert und müssen mit Sanger-Sequenzierung validiert werden. Den übrig gebliebenen Kandidatenmutationen kommt eine hohe Wahrscheinlichkeit zu, krankheitsverursachend zu sein (Informationsbox 3). Studien mit Mikrozephalie als Leitsymptom gibt es bisher wenige (s. den nächsten Absatz Identifizierung neuer Gene bei syndromalen Formen der Mikrozephalie). Allerdings sind Studien mit dem verwandten Phänotyp Intelligenzminderung publiziert. Ein Beispiel ist eine große Studie des Forschungsverbunds MRNET mit Beteiligung des Instituts für Humangenetik in Erlangen, welche 51 sporadische Fälle mit Intelligenzminderung und gesunden Eltern untersuchte. Nur bei 7 Kindern wurden keine exonischen De-novo-Varianten identifiziert. Bei 16 Kindern wurden De-novo-Mutationen in bekannten Intelligenzminderungs-Genen identifiziert. Bei 7 Kindern wurden De-novo-Mutationen in unbekannten IntelligenzminderungsGenen identifiziert. Bei dem Rest wurden De-novo-Varianten identifiziert, welche jedoch nicht eindeutig als ursächlich eingestuft werden können, z. B. weil die in- Neuropädiatrie in Klinik und Praxis 12. Jg. (2013) Nr. 1 55 #6918_Neuropädiatrie_01-2013.indd 55 09.01.13 13:38 Originalien/Übersichten silico-Analyse oder die Genfunktion nicht überzeugend erscheinen. [33] Genau wie bei anderen Vererbungsmodi kann weitere Evidenz über die Pathogenität einer Mutation erzielt werden, indem eine zweite Mutation im selben Gen bei einer anderen Familie identifiziert wird oder funktionelle Analysen durchgeführt werden. Identifizierung neuer Gene bei syndromalen Formen der Mikrozephalie Ein gutes Beispiel für die Identifizierung von Ursachen syndromaler Formen der Mikrozephalie stellt eine Arbeit von Ostergaard und Kollegen dar. [34] Fünf unabhängige Patienten mit dem bekannten klinischen Syndrom MLCRD (Mikrozephalie, primäres Lymphödem, chorioretinale Dysplasie) wurden mittels NGS exomweit sequenziert. Die Sequenzierungsdaten wurden dahingehend untersucht, ob Mutationen im gleichen Gen bei mehreren Betroffenen auftreten. In drei der Betroffenen fand die Gruppe noch unbekannte Varianten in einem Gen, KIF11. Die Untersuchung von neun weiteren unabhängigen Patienten mit MLCRD bestätigte die Befunde; in sieben Patienten wurden weitere Mutationen im KIF11 gefunden. Nach Beobachtung, dass das Syndrom CDMMR [chroioretinale Dysplasie, Mikrozephalie und Intelligenzminderung (mentale Retardierung)] eine große Überlappung mit MLCRD zeigt, wurden sechs weitere unabhängige Patienten mit CDMMR untersucht und hierbei fünf Mutationen in KIF11 identifiziert. Dieses schöne Beispiel der Identifizierung von Genmutationen nach exomweiten Sequenzierungen von Indexpatienten mit ähnlichem Krankheitsbild wurde auch bei anderen Syndromen angewendet (Informationsbox 4). Beispielsweise wurden 2010 zwei Studien publiziert, in denen Patienten mit Schinzel-Giedion-Syndrom bzw. Kabuki-Syndrom untersucht wurden und die entsprechenden Gene identifiziert wurden. [35, 36] Molekulargenetische Diagnostik bei Mikrozephalie Bis vor wenigen Jahren beschränkten sich die molekulargenetischen Untersuchungen bei Mikrozephalie auf die Sanger-Sequenzierung zur Identifizierung von Punktmutationen und später zusätzlich auf MLPA-Untersuchungen zur Identifizierung von Deletionen und Duplikationen einzelner Exons. So wurden einzelne Kandidatengene für syndromale Formen nach ausführlichen differentialdiagnostischen Überlegungen oder die häufigen Gene für nicht-syndromale Formen untersucht. Rasch etablierten sich dann zudem die Array-Chips. Derzeit werden die ersten sogenannten PanelDiagnostiken angeboten. • Molekulare Karyotypisierung; Mikrozephalie-Diagnostik mittels Arrays: Molekulare Karyotypisierung umfasst Methoden zur Analyse von Kopienzahlveränderungen des genetischen Materials (copy number variants, CNV). Mittlerweile ist die Durchführung von molekularer Karyotypisierung Standard an vielen Standorten. Hierbei werden hundertausende Fluoreszenz-markierte Sonden (Array CGH (comparative genome hybridization) [37]) bzw. genetische Marker (single necleotide polymorphismen (SNP-)Arrays, z. B. [38]genomweit untersucht. Die Signalstärke des jeweiligen Markers entspricht der Zahl der Allele und eine Änderung dieser Zahl kann somit ermittelt werden. Bei einer Deletion, d. h. Verlust des Genmaterials, reduziert sich das Signal und bei einer Duplikation erhöht es sich. Die Analyse von bis zu zwei Millionen Markern ermöglicht eine genaue Aussage über kryptische chromosomale Veränderungen ab 100 kb (ein kb beträgt 100.000 Basenpaare). Eine Chromosomenanalyse würde chromosomale Aberrationen unter 5 Mb nur sehr unzuverlässig detektieren können (eine Mb beträgt 1.000.000 Basenpaare). Bei Verdacht auf eine chromosomale Aberration bzw. wenn keine Differentialdiagnosen zur Verfügung stehen, wird bei Mikrozephalie mit Intelligenzminderung eine molekulare Karyotypisierung durchgeführt. • Einsatz der Diagnostik-Panels bei Mikrozephalie: Die klassische Sequenzierung von mehreren Genen bei differentialdiagnostischen Überlegungen bzw. bei Krankheitsbildern mit genetischer Heterogenität ist mit hohen Kosten und enormem Zeitaufwand verbundenen. Oft werden die diagnostischen Möglichkeiten nicht ausgeschöpft, weil die Trefferrate pro Gen, d. h. die Wahrscheinlichkeit, eine Mutation im betreffenden Gen zu finden, niedrig ist. Beispiele sind zahlreich. So müssen trotz möglicher therapeutischer Konsequenzen bestimmte Kriterien erfüllt werden, bevor eine Diagnostik hinsichtlich eines familiären Brust- und Eierstockkrebs veranlasst wird. Bei Mikrozephalien werden aufgrund des hohen Kosten- und Arbeitsaufwandes daher auch häufig nur eine begrenzte Auswahl einer an sich größeren Zahl an in Frage kommenden Genen diagnostisch abgeklärt. Eine Trennung zwischen Kosten und Aufwand einerseits und umfassender medizinischer Versorgung andererseits ist daher ein erstrebenswertes Ziel. Mit der Entwicklung des NGS ist es nun möglich geworden, viele Gene gleichzeitig zu sequenzieren. Das so genannte DNA-Barcoding, eine Methode zur Markierung und somit zur Unterscheidung von DNAs verschiedener Personen in einem NGS-Lauf, ermöglicht die parallele Untersuchung mehrerer Individuen. Die praktische Umsetzung ist eine zukunftsträchtige Lösung: bei einer diagnostischen Fragestellung können Anreicherungssysteme angewendet werden, welche die kodierenden Bereiche aller in Frage kommenden Gene als Ziel haben. Ein darauf folgender NGS-Ansatz erlaubt die komplette Sequenzierung dieser Gene. Die Ziele der Diagnostik-Panels sind eine Sicherung der klinischen Diagnose in einem zeitgerechten Rahmen, um therapeutische bzw. Behandlungsoptionen zu optimieren und um den restlichen Familienmitgliedern eine suffiziente humangenetische Beratung anbieten zu können. Bei einer Panel-Diagnostik ist eine präzise Auswertung der Sequenzen von Fachleuten essentiell. Bei der parallelen Untersuchung von beispielsweise 50 Genen in einem Diagnostik-Panel erwartet man mehrere in Frage kommende Varianten. Eine Aussage bezüglich der Pathogenität kann nur gemacht werden, wenn eine Expertise über Genfunktion, Krankheitsbild und bisher bekannte Variationen am Genlocus vorhanden ist. Außerdem sind technische Daten über Coverage und die Sicherheit, mit der alle Abschnitte erfasst wurden, wichtig. Empirische Daten über die Wahrscheinlichkeit der Identifizierung einer Mutation in einer Gengruppe sind anzugeben, insbesondere bei negativen Befunden. Aufgrund dieser Einschränkungen wird Panel-Diagnostik vorsichtig eingeführt und es liegen, insbesondere für Mikrozephalie, bisher keine ausreichenden Erfahrungswerte vor. Die Sequenzierung der gesamten kodierenden Sequenz als diagnostische Maßnahme beim Vorliegen einer Mikrozephalie ist möglich. Gleichzeitig können dann im Rahmen von Zufallsbefunden jedoch auch Aussagen über andere Genorte und bezüglich Aspekte der zukünftigen Gesundheit der untersuchten Person gemacht werden, z. B. hinsichtlich eines Risikos für Alzheimer oder für monogene Krebserkrankungen. Da es sich hierbei um prädiktive Erkenntnisse handelt, sollten diese vorsichtig und nur unter 56 Neuropädiatrie in Klinik und Praxis 12. Jg. (2013) Nr. 1 #6918_Neuropädiatrie_01-2013.indd 56 09.01.13 13:38 Originalien/Übersichten rechtlichen Bestimmungen angewendet werden (Gendiagnostik-Gesetz). Literatur 1. Thornton GK and CG Woods, Primary microcephaly: do all roads lead to Rome? Trends Genet. 2009 25(11): p. 501-10. 2. International Human Genome Sequencing C, Finishing the euchromatic sequence of the human genome. Nature. 2004 431(7011): p. 931-45. 3. Bentley DR, S Balasubramanian, HP Swerdlow, GP Smith, J Milton, CG Brown et al., Accurate whole human genome sequencing using reversible terminator chemistry. Nature. 2008 456(7218): p. 53-9. 4. Illumina. History of Illumina Sequencing. 2012 [cited 2012 11. September]; Available from: http://www.illumina.com/technology/solexa_ technology.ilmn. 5. Illumina, Sequencing Video: The Genome Analyzer, 2012. 6. Valouev A, J Ichikawa, T Tonthat, J Stuart, S Ranade, H Peckham et al., A high-resolution, nucleosome position map of C. elegans reveals a lack of universal sequence-dictated positioning. Genome Res. 2008 18(7): p. 1051-63. 7. Shendure J, GJ Porreca, NB Reppas, X Lin, JP McCutcheon, AM Rosenbaum et al., Accurate multiplex polony sequencing of an evolved bacterial genome. Science. 2005 309(5741): p. 1728-32. 8. Biosystems A. Overview of SOLiD™ Sequencing Chemistry. 2012 [cited 2012 26.09.2012]; Available from: http://www.appliedbiosystems.com/ absite/us/en/home/applications-technologies/ solid-next-generation-sequencing/next-generation-systems/solid-sequencing-chemistry.html. 9. Shendure J and H Ji, Next-generation DNA sequencing. Nat Biotechnol. 2008 26(10): p. 113545. 10. Korlach J, KP Bjornson, BP Chaudhuri, RL Cicero, BA Flusberg, JJ Gray et al., Real-time DNA sequencing from single polymerase molecules. Methods Enzymol. 2010 472: p. 431-55. 11. Eid J, A Fehr, J Gray, K Luong, J Lyle, G Otto et al., Real-time DNA sequencing from single polymerase molecules. Science. 2009 323(5910): p. 133-8. 12. Song CX, TA Clark, XY Lu, A Kislyuk, Q Dai, SW Turner et al., Sensitive and specific single-molecule sequencing of 5-hydroxymethylcytosine. Nat Methods. 2012 9(1): p. 75-7. 13. Murray JE and AP Jackson, Exploring microcephaly and human brain evolution. Dev Med Child Neurol. 2012 54(7): p. 580-1. 14. Kaindl AM, S Passemard, P Kumar, N Kraemer, L Issa, A Zwirner et al., Many roads lead to primary autosomal recessive microcephaly. Prog Neurobiol. 2010 90(3): p. 363-83. 15. Bittles AH and ML Black, Evolution in health and medicine Sackler colloquium: Consanguinity, human evolution, and complex diseases. Proc Natl Acad Sci U S A. 2010 107 Suppl 1: p. 1779-86. 16. Darvish H, S Esmaeeli-Nieh, GB Monajemi, M Mohseni, S Ghasemi-Firouzabadi, SS Abedini et al., A clinical and molecular genetic study of 112 Iranian families with primary microcephaly. J Med Genet. 2010 47(12): p. 823-8. 17. Sajid Hussain M, S Marriam Bakhtiar, M Farooq, I Anjum, E Janzen, M Reza Toliat et al., Genetic heterogeneity in Pakistani microcephaly families. Clin Genet. 2012. 18. National Center for Biotechnology Information N, dbSNP, 2012. 19. 1000Genomes. 1000 Genomes. 2012; Available from: http://www.1000genomes.org/. 20. NHLBI Exome Sequencing Project E, Exome Sequencing Project, 2012. 21. Seelow D, M Schuelke, F Hildebrandt, and P Nurnberg, HomozygosityMapper – an interactive approach to homozygosity mapping. Nucleic Acids Res. 2009 37: p. W593-W599. 22. Adzhubei IA, S Schmidt, L Peshkin, VE Ramensky, A Gerasimova, P Bork et al., A method and server for predicting damaging missense mutations. Nat Methods. 2010 7(4): p. 248-9. 23. Ng PC and S Henikoff, SIFT: Predicting amino acid changes that affect protein function. Nucleic Acids Res. 2003 31(13): p. 3812-4. 24. Reese MG, FH Eeckman, D Kulp, and D Haussler, Improved splice site detection in Genie. J Comput Biol. 1997 4(3): p. 311-23. 25. Brunak S, J Engelbrecht and S Knudsen, Prediction of human mRNA donor and acceptor sites from the DNA sequence. J Mol Biol. 1991 220(1): p. 49-65. 26. Grillo G, A Turi, F Licciulli, F Mignone, S Liuni, S Banfi et al., UTRdb and UTRsite (RELEASE 2010): a collection of sequences and regulatory motifs of the untranslated regions of eukaryotic mRNAs. Nucleic Acids Res. 2010 38 (Database issue): p. D75-80. 27. Hussain MS, SM Baig, S Neumann, G Nurnberg, M Farooq, I Ahmad et al., A truncating mutation of CEP135 causes primary microcephaly and disturbed centrosomal function. Am J Hum Genet. 2012 90(5): p. 871-8. 28. Abou Jamra R, O Philippe, A Raas-Rothschild, SH Eck, E Graf, R Buchert et al., Adaptor protein complex 4 deficiency causes severe autosomalrecessive intellectual disability, progressive spastic paraplegia, shy character, and short stature. Am J Hum Genet. 2011 88(6): p. 788-95. 29. Abou Jamra R, R Buchert, AB Ekici, S Uebe, SH Eck, H Tawamie et al., High yield of massive parallel exome sequencing in 25 families with autosomal recessive intellectual disability, in European Human Genetics Conference 20122012, Euro- pean Society for Human Genetics: Nuremberg. p. 36. 30. Najmabadi H, H Hu, M Garshasbi, T Zemojtel, SS Abedini, W Chen et al., Deep sequencing reveals 50 novel genes for recessive cognitive disorders. Nature. 2011 478(7367): p. 57-63. 31. Dixon-Salazar TJ, JL Silhavy, N Udpa, J Schroth, S Bielas, AE Schaffer et al., Exome sequencing can improve diagnosis and alter patient management. Sci Transl Med. 2012 4(138): p. 138ra78. 32. Lubs HA, RE Stevenson and CE Schwartz, Fragile X and X-linked intellectual disability: four decades of discovery. Am J Hum Genet. 2012 90(4): p. 579-90. 33. Rauch A, D Wieczorek, E Graf, T Wieland, S Endele, T Schwarzmayr et al., Range of genetic mutations associated with severe non-syndromic sporadic intellectual disability: an exome sequencing study. Lancet. 2012. 34. Ostergaard P, MA Simpson, A Mendola, P Vasudevan, FC Connell, A van Impel et al., Mutations in KIF11 cause autosomal-dominant microcephaly variably associated with congenital lymphedema and chorioretinopathy. Am J Hum Genet. 2012 90(2): p. 356-62. 35. Hoischen A, BW van Bon, C Gilissen, P Arts, B van Lier, M Steehouwer et al., De novo mutations of SETBP1 cause Schinzel-Giedion syndrome. Nat Genet. 2010 42(6): p. 483-5. 36. Ng SB, AW Bigham, KJ Buckingham, MC Hannibal, MJ McMillin, HI Gildersleeve et al., Exome sequencing identifies MLL2 mutations as a cause of Kabuki syndrome. Nat Genet. 2010 42(9): p. 790-3. 37. Solinas-Toldo S, S Lampel, S Stilgenbauer, J Nickolenko, A Benner, H Dohner et al., Matrix-based comparative genomic hybridization: biochips to screen for genomic imbalances. Genes Chromosomes Cancer. 1997 20(4): p. 399-407. 38. Mei R, PC Galipeau, C Prass, A Berno, G Ghandour, N Patil et al., Genome-wide detection of allelic imbalance using human SNPs and high-density DNA arrays. Genome Res. 2000 10(8): p. 1126-37. Korrespondenzadresse Priv.-Doz. Dr. med. Rami Abou Jamra Institut für Humangenetik Universität Erlangen-Nürnberg Schwabachanlage 10 D-91054 Erlangen, Germany Tel./Fax: +49 9131 85 26477/-23232 Email: [email protected] Interessenkonflikt Der Autor gibt an, dass kein Interessenkonflikt besteht. Neuropädiatrie in Klinik und Praxis 12. Jg. (2013) Nr. 1 57 #6918_Neuropädiatrie_01-2013.indd 57 09.01.13 13:38 Mitteilungen Buchbesprechung Angeborene Fremdreflexe Haltung und Verhalten früh regulieren Robby Sacher (Hrsg.) Mit einem Geleitwort von Richard Michaelis, Urban & Fischer, Elsevier GmbH, München, 2012, 115 Seiten mit 40 Online-Filmen, ISBN Print 9783-437-21121-8, ISBN e-Book 978-3-437-59122-8 Die Wertung der Eigen- und Fremdreflexe stellt die Grundlage einer neurologischen Untersuchung dar. Es ist jedoch selten, dass Lehrbücher der Pädiatrie, Neuropädiatrie und Entwicklungsneurologie auf eine solche für die Praxis sehr wichtige Thematik „Bedeutung der angeborenen Fremdreflexe“ detailliert eingehen. Mit der vorliegenden Monographie ist es dem Herausgeber Robby Sacher gelungen, im deutschsprachigen Raum erstmals wesentliche Aspekte der angeborenen Fremdreflexe umfassend und doch konzis darzustellen. Das Buch vermittelt mit einem didaktisch klar strukturierten Aufbau Entstehung, Entwicklung und Bedeutung angeborener Fremdreflexe sowie Ursachen, Folgen und Behandlungsstrategien sensorischer Integrationsstörungen. Es fasst ferner spezifische Diagnostik und Therapie für das Säuglings- und frühe Kleinkindesalter sowie das Vorschul- und Schulalter in hervorragend lesbarer Form zusammen. Didaktisch sind hilfreich dabei zahlreiche kasuistische Illust- rationen, die in bewegten Bildern mit 40 Videos als „Plus im Web“ zu Reflexen, Haltung und Verhalten festgehalten sind. Sie regen die Leserinnen und Leser zur Reflexion an. Dieses Werk möge das Verständnis für entwicklungs- und neuropädiatrische Zusammenhänge vertiefen und vielleicht auch einen neurophysiologisch begründeten Ansatz für die manualmedizinische Behandlung von muskulo-skeletalen Ko- ordinationsstörungen bei Kindern bieten. Wer je an einem Lehrbuch geschrieben hat weiß, dass dies sich unversehens zu einer Lebensaufgabe auswachsen kann, immer verbesserungswürdig schon allein durch den Fortschritt der Wissenschaft. In diesem Sinne wünsche ich dem vorliegenden Buch eine weite Verbreiterung und viele Auflagen. Prof. Dr. Fuat Aksu, Datteln Personalia Priv.-Doz. Dr. med. Markus Blankenburg, Stuttgart (früher in Datteln) habilitierte sich im Oktober 2012 an der Universität Witten/Herdecke (Vestische Kinder- und Jugendklinik Datteln) für das Fach Kinder- und Jugendmedizin. Dr. med. Christian Fricke, Hamburg wurde auf der Jahrestagung der DGSPJ im September 2012 in Hamburg zum neuen Präsidenten der Deutschen Gesellschaft für Sozialpädiatrie und Jugendmedizin gewählt. Kongresse 23.-26.01.2013 Auskunft: www.seltene-erkrankungen-heidelberg.de Mannheim ANIM mit DGNI und NCS Auskunft: www.anim2013.de 22.-23.02.2013 Münster Kongress Kindheiten im 2. Weltkrieg in Europa Auskunft: www.franz-hitze-haus.de Rostock XXXIII. DGKJP-Kongress Rostock XXXIII. DGKJP-Kongress Jena 39. Jahrestagung der Gesellschaft für Neuropädiatrie Frühjahrestagung der AG Pädiatrie der DGSS Auskunft: www.neuropaediatriecongress.de/GNP2013 15.-17.03.2013 25.-28.04.2013 24.-30.03.2013 46. Oster-Seminar-Kongress für pädiatrische Fortbildung Bremen 60. Kindertherapietage An der Universität Bremen Auskunft: www.zrf.uni-bremen.de 15.-16.03.2013 Heidelberg Neurometabole Erkrankungen: Sinnvolle Diagnostik und Therapieansätze Potsdam 10. Assistentenkongress des BVKJ Auskunft: www.bvkj.de eMail: [email protected] Auskunft: www.akademie-muenchen.de 28.05.-01.06.2013 11.-14.04.2013 Istanbul th 7 World Congress on Controversies in Neurology (CONy) Auskunft: www.comtecmed.com/ cony/2013/ 23.-27.04.2013 Auskunft: www.dgkjp-kongress.de 07.-09.06.2013 Berlin Auskunft: www.conventus.de Auskunft: www.dgkjp-kongress.de 09.-10.03.2013 06.-09.06.2013 Innsbruck, Österreich Brixen (Südtirol)/Italien 06.-09.03.2013 25.-28.04.2013 43. Kinder- und Jugendärztetag des BVKJ: Migration Auskunft: www.bvkj.de 25.-28.09.2013 Brussels/Belgien EPNS Congress 2013 Auskunft: www.epns.info Mailand / Italien 31th Annual Meeting of ESPID Auskunft: www.kenes.com eMail: [email protected] 12.-15.09.2013 Düsseldorf 109. Jahrestagung der DGKJ Auskunft: www.dgkj.de 06.-09.06.2013 Mailand / Italien 06.-09.12.2013 Washington, DC 21. Jahrestagung der DGPI 4 th World Congress on ADHD - From Childhood to Adult Disease 67th Annual Meeting of the American Epilepsy Society Auskunft: www.dgpi2013.de Auskunft: www.adhd-congress.org Auskunft: www.aesnet.org/ Würzburg 58 Neuropädiatrie in Klinik und Praxis 12. Jg. (2013) Nr. 1 #6918_Neuropädiatrie_01-2013.indd 58 09.01.13 13:38 Mitteilungen Hinweise für die Autoren I. Allgemeines Die Zeitschrift „Neuropädiatrie in Klinik und Praxis“ veröffentlicht sowohl von dem Herausgeber angeforderte als auch unaufgefordert eingereichte Manuskripte über alle Themen der Neurologie des Kindes- und Jugendalters und ihrer Grenzgebiete. Die Publikationssprache ist deutsch und englisch. Die Manuskripte dürfen andernorts nicht publiziert oder zur Drucklegung angeboten sein. Die Zeitschrift und alle in ihr erhaltenen Beiträge und Abbildungen sind urheberrechtlich geschützt. Jede Verwertung außerhalb der engen Grenzen des Urheberrechtsgesetztes ist ohne Zustimmung des Verlags unzulässig und strafbar. Dies gilt insbesondere für Vervielfältigungen, Übersetzungen, Mikroverfilmungen und die Einspeicherung und Bearbeitung in elektronischen Systemen. Den Autoren stehen 25 Sonderdrucke ihrer Arbeiten kostenfrei zur Verfügung. II. Redaktionsanschrift Alle Manuskripte (per Email oder in Form einer CD im System Microsoft Word), einschl. Tabellen, Fotos und andere Bildvorlagen sind zu richten an Herrn Prof. Dr. Fuat Aksu Vestische Kinder- und Jugendklinik Datteln Zentrum für Neuropädiatrie, Entwicklungsneurologie und Sozialpädiatrie (Z.N.ES.) Postfach 1351 D-45704 Datteln Email: neuropaediatrie@ schmidt-roemhild.com III. Gestaltung der Manuskripte Manuskripte werden nur akzeptiert, wenn sie der folgenden Gliederung entsprechen: Titelblatt: Titel des Manuskriptes, Namen der Autoren (mit Initialen der Vornamen), Klinik/Institutsangaben und ggf. Danksagungen. Zusammenfassung: In deut- scher und englischer Sprache mit Schlüsselwörtern und Key words. Titel des Manuskriptes in englischer und deutscher Sprache. Text bei Originalarbeiten und Kasuistiken: Einleitung, Patienten/Methodik, Ergebnisse, Diskussion, Literatur, Adressen der Autoren, Email, Telefonund Fax-Verbindung des federführenden Autors, Tabellen und Legenden zu den Abbildungen. Abbildungen und Tabellen: Die Abbildungen sind arabisch zu nummerieren und vom Text getrennt zu halten. Die Legenden sind auf gesonderten Blättern aufzuführen. Alle Abbildungsvorlagen sind auf der Rückseite mit dem Namen des Erst-Autors sowie „oben“ und „unten“ zu bezeichnen. Der Autor ist verantwortlich, dass die Reproduktion von Abbildungen, auf denen ein Patient erkennbar ist, vom Dargestellten bzw. dessen gesetzlichem Vertreter genehmigt worden ist. Auch die Tabellen sind arabisch zu nummerieren. Jede Tabelle muss eine kurze erklärende Unterschrift enthalten. IV. Texterstellung Der gesamte Text, einschl. Literaturverzeichnis, Tabellen und Abbildungslegenden, ist auf DIN-A4-Papier, einseitig geschrieben, 1- oder 2-zeilig mit maximal 30 Zeilen je Seite, einzureichen. Der linke Rand soll 3 cm betragen. Die im Text zitierten Arbeiten sind nach dem jeweils ersten Autorennamen alphabetisch anzuordnen und arabisch durchzunumerieren. Im Text sind nur die Zitatnummern in Klammern zu verwenden. Beispiele für das Zitieren: Zeitschriften: Sassen R, Kuczaty S, Lendt M et al. (2001) Epilepsiechirurgie im Kindes- und Jugendalter. Monatsschr Kinderheilkd 149: 1180-1189 Bücher: Gross-Selbeck G, Boenigk HE (2000) Diagnostische und therapeutische Prinzipien bei Epilepsien im Kindesalter. Leitlinien Kinderheilkunde und Jugendmedizin. Urban & Fischer, München, Jena Buchbeiträge: Elger CE, Kurthen M (1999) Predicting surgical outcome in epilepsy: how good are we? In: Schmidt D, Schachter SC (eds) Epilepsy problems solving in clinical practice. Martin Dunitz, London, pp 399-410 V. Manuskripte auf CD Verwenden Sie möglichst weit verbreitete Textverar- beitungsprogramme (z. B. Microsoft Word). Speichern Sie Tabellen, Abbildungen und Grafiken als separate Dateien und binden Sie diese nicht in den Text ein. Folgende Dateiformate können dabei verwendet werden: *.ppt, *xls, *.eps, *tif, *jpg, *wmf, *cdr und *ai. Pixelorientierte Abbildungen sind mit folgenden Auflösungen zu speichern: Graustufenbilder: 150 dpi, Farbbilder: 300 dpi, Strich: 1000 dpi. Vorschau für das Heft 2/April 2013: D. Tibussek, Leverkusen und F. Distelmaier, Düsseldorf Klinik, Diagnostik und Therapie der idiopathisch intrakraniellen Hypertension im Kindesalter - Ein Update J. Klepper, Aschaffenburg et al. Positionspapier zur modifizierten Atkins Diät L. B. Dehn et al., Bielefeld-Bethel Einflussfaktoren der psychosozialen Belastungen von Eltern anfallskranker Kinder - Ergebnisse einer Studie mit einer Kurzform des FaBel-Fragebogens W. Girisch et al., Homburg/Saar The role of Cochrane reviews in child neurology S. Vieker et al., Herdecke Erstbeschreibung eines „Kearns-Sayre-like“ Syndroms mit ragged red fibers und cerebralem Folatmangel Anzeigeschluss: Datum 2013 Änderungen vorbehalten Neuropädiatrie in Klinik und Praxis 12. Jg. (2013) Nr. 1 59 #6918_Neuropädiatrie_01-2013.indd 59 09.01.13 13:38 Rund 70% aller Patienten konnten ihre Anfälle in einer klinischen Studie beeinflussen. Klinische Studien belegen, dass 62 Prozent aller epileptischen Anfälle mithilfe der VNS Therapy vermieden werden können. Auch die Anfallslänge und Schwere reduzierte sich. Deshalb nutzen heute weltweit mehr als 65.000 Patienten mit schwer behandelbarer Epilepsie das VNS Therapy System, welches vielen Patienten trotz ihrer Krankheit den Weg in ein aktives und erfülltes Leben ermöglicht. Weitere Informationen zur VNS Therapy finden Sie unter: GerAd12-11-2001-DE www.70prozent-vns.de #6918_Neuropädiatrie_01-2013.indd 60 ANZ_70_Prozent_Junge_210x297_20120420_v2_satz.indd 1 09.01.13 13:38 20.04.2012 09:41:52











