Grundwissen Chemie 8. Klasse - jhg
Werbung

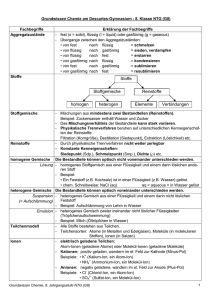
Grundwissenskatalog Chemie G8 8. Klasse nt 1. Wissenschaft Chemie: Chemie ist die Lehre von den Stoffen. Chemischer Vorgang: Stoffänderung Physikalischer Vorgang: Zustandsänderung 2. Unterteilung Stoffe: Stoff Reinstoff Verbindung Element Gemisch homogen heterogen Reinstoff: besteht aus lauter gleichartigen Teilchen mit gleichartigen Eigenschaften. Gemisch: besteht aus unterschiedlichen Teilchen mit unterschiedlichen Eigenschaften, meist Trennung auf physikalischem Weg möglich. Heterogen: sichtbar uneinheitlich. Homogen: erscheint einheitlich. Verbindung: kann durch eine chemische Reaktion zerlegt werden. Element: kann auch durch eine chemische Reaktion nicht zerlegt werden 3. heterogene Gemische: Suspension: Feststoffteilchen sind in einer Flüssigkeit fein verteilt. Emulsion: Flüssigkeitströpfchen sind in einer anderen Flüssigkeit fein verteilt. 4. Die Lösung: ist das wichtigste homogene Gemisch. Feststoffe, Flüssigkeiten oder Gase sind in einer Flüssigkeit homogen verteilt. 5. Möglichkeiten, den Ablauf einer chemischen Reaktion zu erkennen - Farbänderung - Gasentwicklung - Niederschlag - Wärmeentwicklung - Abkühlung - Feuererscheinung - Rauchentwicklung 6. Die Wortgleichung (Reaktionsschema): gibt den Ablauf einer chemischen Reaktion wieder, der Reaktionspfeil bedeutet „ergibt in einer chemischen Reaktion“. Ausgangsstoffe = Edukte, Produkte; 7. Energiebeteiligung bei chemischen Reaktionen Exotherm: Energie wird freigesetzt, die innere Energie nimmt ab. Endotherm: Energie wird zugeführt, die innere Energie nimmt zu. Aktivierungsenergie: Energie, die benötigt wird, um eine Reaktion zu starten. 8. Gesetz von der Erhaltung der Masse Bei chemischen Reaktionen im Labormaßstab kann mit einer Waage keine Massenänderung festgestellt werden, Einschränkung durch die Beziehung E = mc2 9. Gesetz der konstanten Proportionen Verbindungen enthalten die Elemente, aus denen sie bestehen, stets in einem konstanten Massenverhältnis. 10. Katalyse Ein Katalysator beschleunigt eine chemische Reaktion, er senkt die Aktivierungsenergie und liegt nach der Reaktion unverändert vor. 11. Das Teilchenmodell Alle Stoffe sind aus kleinsten Teilchen aufgebaut. Wenn man diese Teilchen noch einmal teilt, so hat man einen anderen Stoff. 12. Teilchenmodell und Aggregatzustand Aggregatzustand fest flüssig gasförmig Teilchenanordnung regelmäßig unregelmäßig, nah zusammen sehr unregelmäßig, großer Abstand 13. Arten von Teilchen Atome: Genaueres siehe später. Moleküle: sind aus mehreren Atomen aufgebaut. Ionen: geladene Teilchen, Genaueres siehe später. 14. Art der Teilchen bei Reinstoffen Elemente: einzelne Atome oder Moleküle aus einer Atomart. Verbindungen: Moleküle aus verschiedenartigen Atomen oder Ionen. 15. Die atomare Masseneinheit u Masse eines Wasserstoffatoms: etwa 1u, die übrigen Atommassen sind aus dem Periodensystem ersichtlich. Die Masse von Molekülen ergibt sich aus der Summe der Atommassen. 16. Elementsymbole: bedeuten das Element an sich oder ein Atom des Elements, sie sind im Periodensystem zu finden. 17. Chemische Formeln Sie beschreiben den Aufbau von Molekülen oder geben das Verhältnis an, in dem Ionen in einer Verbindung enthalten sind. Beispiele H2O: Ein Molekül, das aus zwei Wasserstoffatomen und einem Sauerstoffatom aufgebaut ist (Molekülformel) NaCl: Es liegen Natrium- und Chlor(id)ionen im Verhältnis 1:1 vor (Verhältnisformel). 18. Die chemische Gleichung Sie beschreibt den Ablauf chemischer Reaktionen, sie gibt also an, welche Teilchen zu welchen neuen Teilchen reagieren. Wichtig: Von jeder Atomart müssen auf beiden Seiten der Gleichung gleich viele Atome vorhanden sein. 19. Benennung von Verbindungen aus zwei Elementen Name des ersten Elements, Name des zweiten Elements mit der Endung –id; Das erste Element steht im Periodensystem weiter links bzw. weiter unten. Die Zahl der Atome wird durch die Vorsilben (Mono), di, tri, tetra, penta, bzw. hexa ausgedrückt. Zweites Element Sauerstoff = Oxid, bei Schwefel = Sulfid. 20. Die Wertigkeit Sie gibt an, wie viele Wasserstoffatome ein Atom binden oder ersetzen kann. Wasserstoff ist also immer einwertig, Sauerstoff ist meist zweiwertig, die meisten anderen Wertigkeiten können davon abgeleitet werden. Sie dient als Hilfsmittel zur Erstellung von Molekül- oder Verhältnisformeln. 21. Das Stoffgemisch Luft: besteht hauptsächlich aus Sauerstoff (21%) und Stickstoff (78%) 22. Die Oxidation: ist eine Reaktion mit Sauerstoff. Verbrennung: Oxidation unter Feuererscheinung 23. Nachweisreaktion für Sauerstoff: Glimmspanprobe. 24. Nachweisreaktion für Wasserstoff: Knallgasprobe. 25. Der Aufbau des Atoms aus Kern und Hülle Der Atomkern ist im Verhältnis zum gesamten Atom sehr klein, enthält aber fast die gesamte Masse des Atoms. 26. Der Atomkern Proton: Masse etwa 1u, Ladung positiv. Neutron: Masse etwa 1u, ungeladen. Die Atome eines Elements besitzen alle die gleiche Protonenzahl, die Neutronenzahl kann unterschiedlich sein. Bei unterschiedlicher Neutronenzahl unterscheidet man dann verschiedene Isotope. Protonen- (Ordnungszahl) und Nukleonenzahl (Protonen- + Neutronenzahl) sind aus dem Periodensystem ersichtlich. 27. Die Atomhülle Elektronen: Masse etwa 1/2000 u, Ladung negativ, Protonenzahl = Elektronenzahl, Anordnung der Elektronen in Schalen (K,L,M …. bzw. Hauptquantenzahl n = 1,2,3…..) Maximale Elektronenzahl in einer Schale: 2n2 . Elektronenkonfiguration: Besetzung der Schalen bei einem bestimmten Atom. 28. Elektronenkonfiguration und Periodensystem (Hauptgruppen): Elemente, die im Periodensystem untereinander stehen (=Gruppe), haben in der äußersten besetzten Schale die gleiche Anzahl von Elektronen (=Valenzelektronen). Die Valenzelektronen sind für das chemische Verhalten entscheidend. Bei Elementen, die im Periodensystem (=Periode) nebeneinander stehen, ist die äußerste besetzte Schale gleich. 29. Symbolische Schreibweise für Valenzelektronen: Ein Valenzelektron wird durch einen Punkt dargestellt, zwei Valenzelektronen (Elektronenpaare) werden durch einen Strich dargestellt. 30. Die unterschiedliche Reaktivität der Elemente: Halogene (Fluor, Chlor, Brom, Jod) sehr reaktiv, kleinste Teilchen: zweiatomige Moleküle; Edelgase (Helium, Neon, Argon, Krypton, Xenon) sehr reaktionsträge, kleinste Teilchen: Atome; 31. Die Oktettregel: Eine Elektronenkonfiguration von 8 Valenzelektronen ist besonders stabil (=Oktett, Edelgaskonfiguration). Alle Atome versuchen, durch eine chemische Reaktion 8 Valenzelektronen wie die Edelgase zu erreichen. Wichtige Einschränkung: In der ersten Periode werden 2 Valenzelektronen angestrebt (Heliumschale/Duett). 32. Zusammenhang zwischen Wertigkeit und Oktettregel: Häufig entspricht die Zahl der zum Oktett fehlenden Elektronen direkt der stöchiometrischen Wertigkeit. Beispiel: C fehlen 4 Elektronen zum Oktett, C ist somit meist vierwertig. 33. Metalle Eigenschaften: Feste Elemente, metallischer Glanz, verformbar, leiten den elektrischen Strom in festem Zustand. Es gibt edle und unedle Metalle. 34. Salze: sind Feststoffe mit hohem Schmelzpunkt, die als Schmelze oder in Lösung den elektrischen Strom leiten, sie bestehen aus Ionen (Kationen, Anionen), die sich zu einem Ionengitter zusammenlagern. Kationen sind positiv, Anionen sind negativ geladen. Salze entstehen aus einem Metall und einem Nichtmetall. 35. Das Kochsalz: Formel NaCl, es setzt sich zusammen aus Na+ - und Cl- -Ionen. Na+ besitzt 10 Elektronen (Edelgasschale des Neons). Cl- besitzt 18 Elektronen (Edelgasschale des Argons). Na+-Nachweis: Orangefärbung einer Bunsenbrennerflamme; Cl- -Nachweis: Bildung eines farblosen Niederschlags mit Silbernitratlösung; Ein Niederschlag entsteht allgemein als Feststoff aus klaren Lösungen. 36. Regeln zur Aufstellung von Ionenformeln Entscheidend ist die Oktettregel. Elemente der 1. bis 3. Hauptgruppe bilden Kationen: Gruppennummer = Ladung. Elemente der 5. bis 7. Hauptgruppe bilden Anionen: Ladung = 8 – Gruppennummer. Bei der 4. Hauptgruppe und bei den Nebengruppen lässt sich die Oktettregel nicht anwenden. 37. Salzformeln Die Summen der positiven und negativen Ladungen müssen sich aufheben. Beispiel: Aluminiumoxid enthält Al3+ und O2- -Ionen, Formel Al2O3. 38. Die Elektrolyse: ist die Umkehrung der Salzbildung aus den Elementen, die Salzbildung ist exotherm, die Elektrolyse ist endotherm, dabei entstehen die Elemente, aus denen das Salz aufgebaut ist. 39. Die Atombindung Sie wird durch ein oder mehrere Elektronenpaare bewirkt, die beiden Atomen, die durch sie verbunden werden, gemeinsam angehören. Entscheidend ist die Oktettregel. Das Wasserstoffatom strebt zwei Valenzelektronen an. 40. Die Einfachbindung Sie kommt durch ein Elektronenpaar zustande. Beispiel Chlormolekül (Cl2): jedem Chloratom fehlt ein Elektron zum Oktett. Das fehlende Elektron kommt jeweils vom anderen Chloratom. Formelschreibweise: freie Elektronenpaare Cl Cl Cl Cl bindendes Elektronenpaar Freie Elektronenpaare (hier bei jedem Cl-Atom drei) gehören nur einem Atom an, das bindende Elektronenpaar gehört beiden Cl-Atomen an. Somit hat jedes Cl-Atom acht Valenzelektronen. 41. Die Doppelbindung Sie kommt durch zwei bindende Elektronenpaare zustande. Beispiel: Sauerstoffmolekül Formelschreibweise: O O O O 42. Die Dreifachbindung Sie kommt durch drei bindende Elektronenpaare zustande. Beispiel Stickstoffmolekül (N2). Formelschreibweise: N N N N 43. Valenzstrichformeln (=Strukturformeln, Elektronenformeln) Sie geben an, durch welche Art von Bindung(en) die Atome in einem Molekül verbunden sind. Freie Elektronenpaare müssen nicht unbedingt angegeben werden, ihre Angabe ist aber zur Kontrolle recht hilfreich. 44. Regeln zur Aufstellung von Valenzstrichformeln 1. Jedes Atom muss ein Oktett besitzen. Bindende Elektronen werden beiden Atomen zugerechnet. H muss zwei Valenzelektronen besitzen. 2. Die Zahl der Valenzelektronen in einem Molekül muss gleich der Zahl der Valenzelektronen der einzelnen Atome sein. 3. Häufig entspricht die Zahl der Bindungen, die von einem Atom ausgehen, der Zahl der Elektronen, die zum Oktett fehlen. (siehe auch Wertigkeit, Pkt. 20). Beispiele: O geht meist zwei Bindungen ein (zweiwertig), C fast immer vier Bindungen (vierwertig).