Bundesrealgymnasium Imst Chemie 2010
Werbung

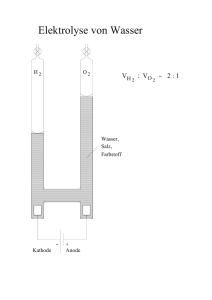
Bundesrealgymnasium Imst Chemie 2010-11 Klasse 7 Stöchiometrie Dieses Skriptum dient der Unterstützung des Unterrichtes - es kann den Unterricht aber nicht ersetzen, da im Unterricht der Lehrstoff detaillierter aufgearbeitet wird, als dies im Skriptum der Fall ist. Ergänzungen zum Skriptum werden während des Unterrichts durchgeführt. In diesem Skriptum sind nur wenige Diagramme und Zeichnungen enthalten. Die fehlenden Diagramme werden im Unterricht erarbeitet. Inhalt 5 Stöchiometrie .................................................................................................................. 36 5.1 Allgemeine Grundlagen ........................................................................................... 36 5.2 Gesetz von der Erhaltung der Masse ........................................................................ 36 5.3 Gesetz der konstanten Proportionen ......................................................................... 36 5.4 Gesetz von Avogadro ............................................................................................... 36 5.5 Allgemeines Gasgesetz ............................................................................................ 36 5.6 Molmasse ................................................................................................................. 37 5.7 Systematische Namen .............................................................................................. 37 Chemie Klasse 7 5 Stöchiometrie Stöchiometrie 5.1 Allgemeine Grundlagen Die Stöchiometrie ist die Lehre von der Berechnung der Zusammensetzung chemischer Verbindungen sowie von den Massen-, Volumen- und Ladungsverhältnissen chemischer Reaktionen. Die einzigen Elemente, die aus Einzelatomen bestehen, sind die Edelgase. Bei vielen anderen Elementen bestehen die kleinsten stabilen Teilchen aus zwei oder mehr Atomen. Sie heißen Moleküle. Die Anzahl der miteinander verbundenen Atome wird durch ein chemische Formel dargestellt. Eine kleine, tiefgestellte Zahl (Index) nach dem Elementsymbol gibt an, wie viele Atome jeweils beteiligt sind 5.2 Gesetz von der Erhaltung der Masse Das Massenerhaltungsgesetz wurde 1785 von Antoine Lavoisier als allgemein gültiges Naturgesetz formuliert. Bei einer chemischen Reaktion ist die Gesamtmasse der Ausgangsstoffe gleich der Gesamtmasse der Endstoffe. Wird die Masse eines Atoms in u angegeben, spricht man von der relativen Atommasse. Die relative Atommasse Ar gibt an, um wie viel Mal die Masse eines Atoms größer ist als die Atommasseeinheit u. Alle Atome eines chemischen Elements haben dieselben chemischen Eigenschaften, können aber unterschiedliche Massen besitzen. Atome eines Elements mit unterschiedlichen Massen werden als Isotope bezeichnet. Die relative Molekülmasse Mr gibt an, um wie viel Mal die Masse einer Verbindung größer ist als die Atommasseeinheit u. Man berechnet sie, indem man die Summe der relativen Atommasse Ar aus der chemischen Formel der Verbindung bildet. 5.3 Gesetz der konstanten Proportionen Ein abgegrenzter Stoffbereich (z. B. ein Stück Holz) wird als Stoffportion bezeichnet. Jede Stoffportion besitzt eine bestimmte Masse m, ein bestimmtes Volumen V und eine bestimmte Stoffmenge n. Stoffmenge n in mol: Zwei Stoffportionen bestehen aus derselben Stoffmenge, wenn sie dieselbe Anzahl an Teilchen besitzen. Ein Mol ist die Menge eines Stoffes, die aus ebenso vielen Teilchen besteht, wie Atome in 12 g des reinen Kohlenstoffisotops 12C. In jeder chemischen Verbindung sind die Elemente, aus denen die Verbindung besteht, in konstanten Proportionen (Massenverhältnissen) enthalten. 5.4 Gesetz von Avogadro Die Volumina der an einer Reaktion beteiligten Gase stehen im Verhältnis kleiner ganzer Zahlen Das Molvolumen VM eines Gases beträgt bei einer Temperatur von 0 °C und einem Druck von 1013,25 mbar genau 22,4 Liter. Liegen andere, als diese Normbedingungen vor, muss mit Hilfe des allgemeinen Gasgesetzes auf Normbedingung umgerechnet werden. 5.5 Allgemeines Gasgesetz p·V = k·T Der Wert der Konstanten k hängt von der Gasmenge und nicht von der Gasart ab. Allgemeine Gaskonstante Dr. K.-H. Offenbecher Seite 36 Chemie Klasse 7 Stöchiometrie Liegt ein Mol eines Gases vor, so hat diese Konstante einen bestimmten Wert R R = 0,083114 bar/(K · mol) p·V = R·T Für n Mol eines Gases muss die Konstante R mit n multipliziert werden. p·V =n·R·T 5.6 Molmasse Der Zahlenwert der relativen Atommasse Ar [u] eines Elements oder der relativen Molekülmasse Mr [u] einer Verbindung entspricht dem Zahlenwert der molaren Masse [g/mol]. Beispiel: Die relative Molekülmasse Mr von H2O ist 18 u. Nimmt man NA Wassermoleküle, ergibt sich eine Gesamtmasse von 18 g. Die molare Masse M der Verbindung Wasser beträgt daher 18 g/mol. Ar(H2O) = 18 u M(H2O) = 18 g/mol 5.7 Systematische Namen Verbindungen aus zwei Elementen heißen binäre Verbindungen. Sind die Elemente ein Metall und ein Nichtmetall, so steht das Metall unverändert an erster Stelle. An den Namen des Nichtmetalls oder an seine Wortwurzel wird die Endung -id angehängt. Bilden zwei Elemente mehr als eine Verbindung, wird die Zahl durch folgende Vorsilben angegeben: mono (für eins), di (für zwei), tri, tetra, penta, hexa. Namen mehratomiger Ionen (Komplexionen): Für sauerstoffhaltige Anionen verwendet man meist die Endung –at oder –it. Namen und Formeln einiger Salze mehratomiger Ionen H:H:Cl Ammoniumchlorid (Salmiak) NH4Cl Ammoniumsulfat (NH4)SO4 N:H:S:O Aluminiumsulfat Al2(SO4)3 Al:S:O Calciumcarbonat CaCO3 Ca:C:O Natriumnitrat (Chilisalpeter) NaNO3 Na:N:O Ca:N:O Calciumnitrat Ca(NO3)2 Verschiedene Salzkristalle enthalten pro Wassermoleküle (Kristallwasser, Hydratwasser). Beispiele: CuSO4 · 5 H2O Na2CO3 · 10 H2O CuSO4 Formeleinheit 1:4:1 2:8:1:4 2:3:12 1:1:3 1:1:3 1:2:6 eine bestimmteAnzahl Kupfersulfat/pentahydrat Natriumcarbonat/decahydrat Kupfersulfat (wasserfrei) Das Kristallwasser wird bei der Kristallisation aus wässriger Lösung in die Kristallstruktur eingebaut. Wird das Wasser durch Erwärmen ausgetrieben, bricht meist die Kristallstruktur zusammen. Dr. K.-H. Offenbecher Seite 37 Chemie Klasse 7 Stöchiometrie Anhang Verbindungen und Formeln Viele chemische Verbindungen bestehen aus Molekülen, deren Zusammensetzung durch Formeln angegeben wird. Diese Formeln werden ermittelt, indem man die Mengenverhältnisse der verschiedenen Elemente in den Verbindungen in einer Analyse bestimmt. Andere Verbindungen sind Gitter. Bei ihnen gibt die Formel das Atomzahlenverhältnis im Gitter an. Man spricht von Formeleinheiten. • Salzartige Verbindungen bilden immer Gitter. Sie bestehen aus Ionen. • Ionen sind geladene Atome oder Moleküle. • Kationen sind positiv geladen. • Anionen sind negativ geladen. • Metalle bilden immer Kationen. • Nichtmetalle bilden immer Anionen. • Eine Formeleinheit (z. B. NaCl, MgCl2)ist immer elektrisch neutral. Na+ + Cl- NaCl Kation Anion Neutral Reaktionen und Gleichungen Chemische Reaktionen, wie die Verbrennung von Schwefel kann man beschreiben: Schwefel + Sauerstoff Schwefeldioxid In der Sprache der Chemie: S + O2 SO2 Dr. K.-H. Offenbecher Seite 38 Chemie Klasse 7 Stöchiometrie Aufgaben Formeln 1. Welches der folgenden Spezies sind Moleküle, ein – oder mehratomige Kationen oder Anionen: SO3, SO32-, K+, Ca2+, NH4+, O22-, OH2. Welche Formeln haben die Verbindung, die aus Magnesium Ionen(Mg2+) mit folgenden Ionen gebildet werden: Chlorid, Cl-; Sulfat, SO42-; Nitrid, N33. Welche Formeln haben die Verbindungen, die aus Aluminium Ionen (Al3+) mit folgenden Ionen gebildet werden: Fluorid, F-; Oxid, O2-; Phosphat, PO434. Welche Formeln haben die Verbindungen, die aus Sulfat Ionen (SO42-) mit folgenden Ionen gebildet werden: Kalium, K+; Calcium, Ca2+; Eisen, Fe3+ 5. Welche empirischen Formeln haben die Verbindungen mit folgenden Molekularformeln: B9H15, C10H18, S2F10, I2O5, H4P4O12, Fe3(CO)12, P3N3Cl6 Stoffmengen 6. Wie viele Mol, Moleküle und Atome sind enthalten in 75,0 g von: H2, H2O, H2SO4, Cl2, HCl, CCl4 7. Welche Masse in Gramm haben: 3,00 ·1020 O2-Moleküle; 3,00 · 10-3 mol O2 8. Vom Cobalt kommt nur ein natürliches Isotop vor. Welche Masse hat ein einzelnes Atom davon? 9. Vom Element X kommt nur ein Isotop vor. Ein Atom davon hat die Masse 2,107 10-22 g. Welche relative Atommasse hat das Element X? 10. Das internationale Urmaß für das Kilogramm besteht zu 90,000 % Platin und zu 10,000 % Iridium. Wie viele Mol Pt und Ir sind enthalten? Wie viele Atome von jeder Sorte sind enthalten? 11. Sterling Silber besteht aus 92,5 % Silber und 7,5 % Kupfer. Wie viele Ag Atome kommen auf ein Cu Atom? 12. Welche Masse hat ein einzelnes Atom 126C? Welche Masse entspricht einer Atommasseeinheit von 1,000 u? 13. Welche Ladung hat ein Mol Elektronen? 14. Ein Reiskorn ist 7 mm lang. Der Abstand Erde – Sonne beträgt 150 Mio km. Wie weit würde man kommen, wenn man 1 mol Reiskörner hintereinander legen würde? Ein Reiskorn ist 2 mm breit und 2 mm hoch. Die Fläche von Europa und Asien beträgt 54 Mio km². Wie hoch könnte man hier 1 mol Reiskörner stapeln? Prozentuale Zusammensetzung 15. Ordnen sie folgende Verbindungen nach ansteigendem Schwefelgehalt: CaSO4, SO2, H2S, Na2S2O3 16. Wie viel % Arsen sind in As2S3 vorhanden? Wie viel % Cer sind in Ce2O3 vorhanden? Wie viel % Sauerstoff sind in KClO3 vorhanden? Wie viel % Chrom sind in BaCrO4 vorhanden? 17. Welche Masse Blei kann man aus 15,0 kg Bleiglanz-Erz erhalten, das 72 % PbS enthält. Dr. K.-H. Offenbecher Seite 39 Chemie Klasse 7 Stöchiometrie 18. Welche Masse Mangan kann man aus 25,0 kg Pyrolusit-Erz erhalten, das 65 % MnO2 enthält? 19. Wie viel Gramm Phosphor und Sauerstoff werden benötigt, um 6,000g P4O6 herzustellen? 20. Wie viel Gramm Schwefel und Chlor werden benötigt, um 5,000 g S2Cl2 herzustellen? 21. Zimtaldehyd enthält Kohlenstoff, Wasserstoff und Sauerstoff. Bei der Verbrennung einer Probe von 6,50 g werden 19,49 g CO2 und 3,54 g H2O erhalten. Welche prozentuale Zusammensetzung hat Zimtaldehyd? 22. Bei der Verbrennung von 12, 62 g Plexiglas entstehen 27,74 g CO2 und 9,12 g H2O. Wie viel Prozent C und H enthält Plexiglas? 23. Das Mineral Hämatit besteht aus Fe2O3. Hämatit Erz enthält weitere Minerale, die Gangart. Wenn 5,0 kg Erz 2,7845 kg Fe enthalten, wie viel Prozent Hämatit ist im Erz erhalten. 24. Schwefelverbindungen sind unerwünschte Bestandteile mancher Öle. Der Schwefelgehalt kann bestimmt werden, indem aller Schwefel in Sulfat-Ionen SO42überführt wird und diese als BaSO4 abgetrennt werden. Aus 6,3 g eines Öls wurden 1,063 g BaSO4 erhalten. Wie viel % Schwefel enthält das Öl? 25. Nicotin enthält Kohlenstoff, Wasserstoff und Stickstoff. Wenn 2,50 g Nicotin verbrannt werden, erhält man 6,78 g CO2, 1,94 g H2O und 0,432 g N2. Welche prozentuale Zusammensetzung hat Nicotin? Formelbestimmungen 26. Welche Molekülformeln haben die Verbindungen mit folgenden empirischen Formeln und relativen Atommassen? SNH, 188,32; PF2, 137,94; CH2, 70,15; NO2, 46,01; C2NH2, 120,15; HCO2, 90,04 27. Welche empirische Formeln haben die Verbindungen mit folgender Zusammensetzung? 31,29 % Ca; 18,75 % C; 49,96 % O 16,82 % Na; 2,95 % H; 15,82 % B; 64,40 % O 73,61 % C; 12,38 % H; 14,01 % O 60,00 % C; 4,48 % H; 35,52 % O; 63,14 % C; 5,31 % H; 31,55 % O 37,50 % C; 3,15 % H; 21,87 % N; 37,47 % O 28. Welche Molekularformel haben die Verbindungen mit folgender Zusammensetzung und relativen Molekülmassen? 45,90 % C; 2,75 % H; 26,20 % O; 17,50 % S; 7,65 % N; Mr = 183,18 83,9 % C; 12,0 % H; 4,1 % O; Mr = 386 29. Eine Verbindung die nur Kohlenstoff, Wasserstoff und Stickstoff enthält, ergibt beim Verbrennen 7,922 g CO2; 4,325 g H2O und 0,840 g N2. Wie viel Mol C- ,H- und N-Atome enthielt die Probe? Welche empirische Formel hat die Verbindung? Welche Masse hatte die Verbrannte Probe? 30. Hämoglobin enthält 0,342 % Fe. Wenn ein Molekül vier Fe Atome enthält, welches ist die Molmasse des Hämoglobins? 31. 6,65 g des Hydrats NiSO4 * xH2O geben beim Erhitzen im Vakuum Wasser ab und 3,67 g NiSO4 bleiben zurück. Welchen Wert hat x? 32. Zur Analyse einer Verbindung, die Chrom und Chlor enthält, wird das Chlor in die Verbindung AgCl überführt. Welche empirische Formel hat das Chromchlorid, wenn aus 8,61 g davon 20,08 g AgCl enthalten werden? Dr. K.-H. Offenbecher Seite 40 Chemie Klasse 7 Stöchiometrie 33. Ein Element X bildet mit Stickstoff eine Verbindung NX3. Wenn diese zu 40,21 % aus Stickstoff besteht, welche ist die relative Atommasse von X? Um welches Element handelt es sich? Dr. K.-H. Offenbecher Seite 41