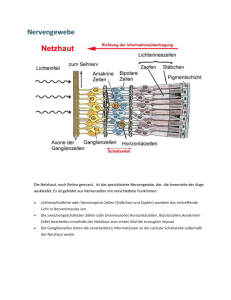
Lichtexposition bei vitreoretinaler Chirurgie I. Grundlagen
Werbung

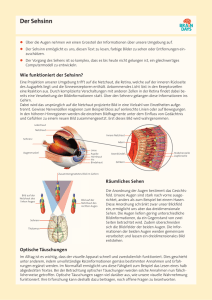
Leitthema Ophthalmologe 2008 DOI 10.1007/s00347-008-1794-z © Springer Medizin Verlag 2008 A.E. Höh1 · T. Ach1 · R. Amberger2 · S. Dithmar1 1 Leiter Schwerpunkt Retinologie, Universitäts-Augenklinik Heidelberg 2 Kirchhoff-Institut für Physik, Heidelberg Lichtexposition bei vitreoretinaler Chirurgie I. Grundlagen Physikalische Größen elektromagnetischer Strahlung Das Spektrum der elektromagnetischen Strahlung reicht von der Höhenstrahlung (Wellenlänge 10-12 m) bis hin zu hochfrequenten Wechselströmen (Wellenlänge 106 m)(. Abb. 1). UV-Strahlung, sichtbares Licht und Infrarotstrahlung werden auch als optische Strahlung bezeichnet. Das sichtbare Licht ist der Wellenlängenbereich zwischen 380 nm und 770 nm und stellt somit nur einen kleinen Teil der elektromagnetischen Strahlung dar. Bei der Messung elektromagnetischer Strahlung sind 2 Systeme zu nennen, die Fotometrie und die Radiometrie, wobei sich das fotometrische System auf die Messung von sichtbarer elektromagnetischer Strahlung beschränkt, die Radiometrie aber auch Ultraviolett (UV)-, Infrarot- und Gammastrahlung mit einbezieht. Die für beide Messsysteme gebräuchlichen Parameter und Einheiten sind in . Tab. 1 wiedergegeben. Dabei sind den fotometrischen Parametern die radiometrischen gegenübergestellt. Physiologischer Lichtschutz des Auges Der Aufbau des menschlichen Auges garantiert eine gute Filterung schädlicher elektromagnetischer Strahlung. Letztlich erreichen die Netzhaut nur Lichtwellen zwischen 380 und 780 nm. Die übrige Lichtstrahlung wird durch mehrere Schutzsysteme absorbiert. UVC und Teile der UVB- und Infrarotstrahlung werden in der Hornhaut, UVA und Teile der UVBStrahlung sowie nahe Infrarotstrahlung (bis 1400 nm) werden in der Linse absorbiert (. Abb. 2). Bis zum jugendlichen Alter besteht ein kleines Transmissionsfenster für UVB-Strahlen bei 320 nm, welches sich aufgrund der alterskorrelierten Veränderungen der Linse später schließt. Schützende Pigmente finden sich in der Iris (Melanin), Linse (gelbes Linsenpigment) und Makula (Lutein, Zeaxanthin). Antioxidative Enzyme (Glutathionperoxidase, Superoxiddismutase, Hämoxygenase), Radikalfänger (Vitamin C und E, Glutathion) und die Kofaktoren Zink und Selen unterstützen diese Schutzmechanismen (. Abb. 3 [36]). Mechanismen der Lichttoxizität Licht im sichtbaren Wellenlängenbereich kann über verschiedene Mechanismen zu einer Schädigung der Netzhaut führen. Die Wechselwirkung der Lichtstrahlen mit der Netzhaut hängt dabei im Wesentlichen von 3 Faktoren ab: der Wellenlänge (nm), der Expositionszeit (s) und der Bestrahlungsstärke (W/cm2) [40]. Man unterscheidet zwischen fotomechanisch, fotothermisch und fotochemisch induzierten Schäden [8, 40, 47]. Die fotomechanische Schädigung (Fotodisruption) entsteht durch eine hohe Energiezufuhr (kiloW- megaW/cm2) innerhalb einer sehr kurzen Zeitspanne im Nano- bis Picosekundenbereich. Dabei spielt die Wellenlänge des Lichts keine Rolle. Die zugeführte Energie führt zur explosionsartigen Verdampfung von Gewebswasser [2]. Durch die dabei entstehende Schockwelle kommt es zur Ruptur des Gewebes. Dieser Mechanismus wird bei der Nd:YAG-Laser-Kapsulotomie oder -Iridotomie genutzt. Eine fotothermische Schädigung der Netzhaut entsteht insbesondere durch die längeren Wellenlängen des sichtbaren Lichts und im Nah-Infrarot-Bereich (600–1400 nm) bei einer Expositionszeit von Mikrosekunden bis mehreren Sekunden. Durch die Absorption der Photonenenergie kommt es zu einer Anhebung des Energieniveaus der Moleküle und einem Ansteigen der kinetischen Energie, was einem Temperaturanstieg entspricht. Ab einem Temperaturanstieg von 10°C kommt es zu einem Aufbrechen von Bindungen in makromolekularen Strukturen und damit zu einer Zerstörung der Tertiärstruktur und Denaturierung der Proteine. Dieser Mechanismus wird bei der Argonlaserkoagulation der Netzhaut genutzt. Bei der fotochemischen Schädigung führen kürzere Wellenlängen des sichtbaren Lichtspektrums zu lichtinduzierten chemischen Reaktionen, wobei das Licht mit endogenen Chromophoren des Auges (Sehpigmente, Hämproteine, Flavoproteine, Melanin, Lipofuszin u. a.) interagiert. Dabei reicht eine deutlich niedrigere Bestrahlungsstärke aus als bei fotothermisch induzierten Schäden, während die Expositionsdauer in der Regel länger ist. Durch Absorption von Photonen werden die Moleküle in einen elektronisch angeregten Zustand gebracht, in welchem sie besonders reaktiv sind. Die angeregten Der Ophthalmologe 2008 | Leitthema sichtbarer Bereich des Spektrums Art der Strahlung Wellenlänge [m] Röntgenstrahlung UVStrahlung y-Strahlung 10-12 10-10 10-8 InfrarotStrahlung 10-6 TerrahertzStrahlung 10-4 Mikrowellen 10-2 100 Rundfunkwellen UKW MW LW 102 Wechselstrom 104 106 Abb. 1 8 Wellenlängenbereich elektromagnetischer Strahlung. Elektromagnetische Strahlung weist Wellenlängen von 10-12 bis 106 m auf. Der nur geringe Anteil von sichtbarer Strahlung (380–770 nm) ist zur Verdeutlichung vergrößert hervorgehoben Abb. 2 8 Absorption von elektromagnetischer Strahlung im menschlichen Auge. Nicht das gesamte Spektrum elektromagnetischer Wellen erreicht die Netzhaut. Bereits in Hornhaut, Iris und Linse werden Teile der Strahlung absorbiert rung spielt die fotochemisch induzierte Lipidperoxidation in der Netzhaut eine große Rolle. Der primäre Ort der fotochemischen Schädigung sind die Außensegmente der Fotorezeptoren und das RPE. Je nach Ausmaß der Schädigung, können die Läsionen klinisch sichtbar werden, was meistens 24 bis 48 h dauert [16]. In Untersuchungen an Rhesusaffen zeigte sich nach Bestrahlung mit 441 nm eine Disruption und Hypopigmentierung des retinalen Pigmentepithels und histologisch eine Vakuolisierung und Desorientierung der Fotorezeptoren. Im Verlauf kommt es zu einer Makrophageninvasion und RPE-Proliferation. Bei milden Läsionen kann sich die Architektur der Netzhaut nach 30 Tagen, abgesehen von einer bleibenden Hypopigmentierung [16, 44], wieder normalisieren. Faktoren der fotochemischen Lichttoxizität Abb. 3 8 Molekularbiologische Schutzmechanismen des menschlichen Auges. Neben den Pigmenten in Iris und Linse schützen auch die Radikalfänger Vitamin C und E sowie Glutathion. Gegen oxidativen Stress wirken verschiedene Enzyme wie Glutathionperoxidase, Superoxiddismutase und Hämoxygenase. Die Spurenelemente Zink und Selen wirken als Biokatalysatoren. Lutein und Zeaxanthin als Pigmente der Retina wird ein protektiver Wert zugeschrieben Elektronen dieser Moleküle können ihre Energie über verschiedene Wege wieder abgeben. Dazu gehören Reaktionen mit anderen Molekülen, in denen es zur Spaltung von Bindungen durch den Austausch von Elektronen oder Wasserstoff kommt, wodurch freie Radikale gebildet werden. Freie Radikale zerstören und inaktivieren | Der Ophthalmologe 2008 zahlreiche andere Moleküle, insbesondere Zellmembranen. Durch den Angriff freier Radikale auf mehrfach ungesättigte Fettsäuren kommt es zur Lipidperoxidation und einer Zerstörung von Membranstrukturen. Aufgrund der großen Menge an Membranen in den Fotorezeptoraußensegmenten und der hohen Oxygenie- Die fotochemische Lichttoxizität ist unter Alltagsbedingungen und bei der intraoperativen Nutzung von Lichtquellen der entscheidende Schädigungsmechanismus der Netzhaut. Das Ausmaß der Schädigung wird durch verschiedene Faktoren beeinflusst. Wellenlänge Bei der fotochemischen Lichttoxizität ist die Wellenlänge des Lichts von großer Bedeutung. Je kürzer die Wellenlänge, desto weniger Energie ist zur Schädigung der Netzhaut erforderlich. Bei Versuchen mit Ratten oder aphaken Rhesusaffen zeigten sich Wellenlängen im UV-Bereich (320– 380 nm) deutlich toxischer als Licht des sichtbaren blauen Spektrums (420– 480 nm). Im UV-Bereich waren nied- Zusammenfassung · Abstract rigere Dosen zur histologisch sichtbaren Schädigung der Fotorezeptoren erforderlich, hingegen ergab die Bestrahlung mit blauwelligem Licht eine stärkere Schädigung des RPE [9, 10, 15]. Bei Rhesusaffen, deren Augen mit 8 monochromatischen Wellenlängen zwischen 441,6 nm (blauwellige Strahlung) und 1064 nm (Infrarotstrahlung) bestrahlt wurde, war mit zunehmender Wellenlänge eine deutlich höhere Bestrahlungsstärke notwendig, um eine funduskopisch sichtbare Schädigung der Netzhaut zu induzieren [14]. Bei Ratten, deren Augen 120 Minuten lang mit tiefblauem Licht (403 nm) oder grünem Licht (550 nm) bestrahlt wurden, führte nur das tiefblaue Licht zu histologisch nachweisbaren Netzhautschäden [13]. Als Erklärung hierfür führen die Autoren die fotochemische Regeneration von Rhodopsin durch blaues Licht an („photoreversal of bleaching“). Während im normalen Sehzyklus Rhodopsin enzymatisch im RPE regeneriert wird, kommt es bei Bestrahlung mit blauwelligem Licht zusätzlich zu einer fotochemischen Regeneration des Rhodopsins in den Fotorezeptoren [12, 46]. Blaues Licht erhöht daher die Menge an vorhandenem Rhodopsin in der Netzhaut. Da Rhodopsin Photone absorbiert, steigert ein hoher Rhodopsinspiegel in der Retina die Empfindlichkeit der Netzhaut für eine Lichtschädigung. Diese positive Korrelation einer Schädigung der Netzhaut mit ihrem Rhodopsingehalt vor Lichtexposition konnte von mehreren Autoren gezeigt werden [28, 33]. Vice versa kann durch Inhibition des Sehfarbstoffzyklus (z. B. durch Halothan, 13-cis-Retinal, DHA- (Docosahexaenoic-acid-)Depletion oder durch Fehlen des Proteins RPE65, welches an der Regeneration von 11-cis-Retinal beteiligt ist) das Ausmaß der fotochemischen Schädigung reduziert werden [12, 20, 39]. Wahrscheinlich führt jedoch nicht Rhodopsin selbst zu einer Fotosensibilisierung, sondern seine gebleichten Produkte, die die Bildung fototoxischer Moleküle induzieren [5]. So steigert beispielsweise Alltrans-Retinal die retinale Fotosensitivität [4], indem es Strahlung im blauwelligen und UV-Lichtbereich absorbiert und zur Freisetzung freier Radikale [38] sowie zur schnelleren Akkumulation von A2e führt [19]. Ophthalmologe 2008 DOI 10.1007/s00347-008-1794-z © Springer Medizin Verlag 2008 A.E. Höh · T. Ach · R. Amberger · S. Dithmar Lichtexposition bei vitreoretinaler Chirurgie. I. Grundlagen Zusammenfassung Das Auge ist aufgrund seiner Funktion einer großen Strahlenbelastung im optischen Spektrum ausgesetzt. Der größte Teil der UVund Infrarotstrahlung wird in der Hornhaut und Linse absorbiert, sodass die Netzhaut fast nur durch Strahlung im sichtbaren Wellenlängenbereich gefährdet wird. Sichtbares Licht kann über fotomechanische, fotothermische oder fotochemische Mechanismen zu einer Schädigung der Netzhaut führen. Der wichtigste Schädigungsmechanismus in der Netzhaut ist dabei unter Alltagsbedingungen oder bei der Anwendung ophthalmologischer Lichtquellen die fotochemische Lichttoxizität, die durch lichtinduzierte chemische Reaktionen zustande kommt. Das Ausmaß der Schädigung wird entscheidend durch verschiedene Faktoren wie die Wellenlänge des Lichts, die Expositionszeit und die Bestrahlungsstärke beeinflusst. Insbesondere der kurzwellige Anteil des sichtbaren Lichts (blaues Licht) ist für die fotochemische Schädigung der Netzhaut von Bedeutung. Schlüsselwörter Licht · Fototoxizität · Fotochemische Schädigung · Retina · Optische Strahlung Light exposition in vitreoretinal surgery. I. Basics Abstract Due to its function of light perception, the eye is exposed to high levels of radiation of the optical spectrum. Most of the ultraviolet and infrared radiation is absorbed in the cornea and lens, and mostly only radiation of the visible spectrum can reach the retina. Visible light can cause retinal damage by photomechanical, photothermal, and photochemical mechanisms. The most important mechanism of light damage to the retina under daily conditions or when using ophthalmologic light sources is the photochemical light tox- icity caused by light-induced chemical reactions. The extent of damage depends on several factors, such as wavelength, exposure time, and irradiance. Particularly the shorter portion of the visible light spectrum (blue light) is responsible for photochemical damage to the retina. Keywords Light · Phototoxicity · Photochemical damage · Retina · Optical radiation Der Ophthalmologe 2008 | Leitthema Tab. 1 Physikalische Größen elektromagnetischer Strahlung Fotometrische Größen Einheit Lichtmenge lm s Beschreibung Produkt aus Lichtstrom und Zeit Radiometrische Größen Einheit Strahlungsenergie J Lichtstrom Beleuchtungsstärke lm lx Spektrale Strahlungsleistung Strahlungsleistung pro Fläche Strahlungsleistung Bestrahlungsstärke W W/m2 Lichtstärke cd Strahlstärke W/sr Leuchtdichte cd/m2 Strahlungsleistung einer Lichtquelle pro Raumwinkel Lichtstärke pro Fläche Strahldichte W/m2sr Beschreibung Energie einer Anzahl von Photonen Strahlungsenergie pro Zeiteinheit Strahlungsleistung pro Empfängerfläche Strahlungsleistung pro Raumwinkel Strahlungsleistung pro Fläche und Raumwinkel cd: Candela, J: Joule, lm: Lumen, lx: Lux, m: Meter, s: Sekunde, sr: Steradiant, W: Watt. Daneben existieren in der Netzhaut weitere Chromophore, die ebenfalls ein Absorptionsmaximum im blauwelligen Lichtbereich aufweisen und so zur Toxizität von blauem Licht beitragen können. Die Cytochromoxidase c, ein Schlüsselenzym der Atmungskette, absorbiert blaues Licht mit einem Absorptionspeak der oxidierten Form bei 420 nm und der reduzierten Form bei 440 nm [1]. In Ratten wird die Expression von Cytochromoxidase c in der Netzhaut und im RPE durch tiefblaues Licht (404 nm) irreversibel inhibiert, was zu einer lichtmikroskopisch sichtbaren Schädigung der Fotorezeptoren führt [3]. Auch A2e hat sein Absorptionsmaximum im blauwelligen Bereich des Spektrums (430 nm). A2e-beladene RPE-Zellen gehen bei Exposition mit blauem Licht oder weißem Licht des gesamten sichtbaren Spektrums verstärkt in Apoptose [41, 48]. Strahlungsenergie Das Risiko einer fotochemischen Schädigung der Netzhaut steigt mit zunehmender Strahlungsenergie und Dauer der Lichtexposition. Bezüglich der Bestimmung eines Schwellenwertes für eine Schädigung der Netzhaut existieren verschiedene tierexperimentelle Untersuchungen, zum Teil an Primaten. Die Untersuchungsergebnisse sind jedoch, je nach experimentellem Aufbau, Expositionsdauer oder verwendeter Lichtquelle sehr uneinheitlich. In einer tierexperimentellen Untersuchung wurden Affen mit erweiterter Pupille und fixiertem Kopf 12 h lang in rundum beleuchteten Käfigen einer Beleuchtungsstärke von bis | Der Ophthalmologe 2008 zu 24700 lx ausgesetzt. Dabei erfolgte eine Messung der Bestrahlungsstärke auf Höhe der Hornhaut und daraus die Berechnung der retinalen Bestrahlungsstärke. Es konnte gezeigt werden, dass bei Bestrahlung mit weißem Licht (mit einem Spektrum von 400–700 nm) der Schwellenwert für eine morphologische Schädigung der Zapfen zwischen 195 und 361 µW/cm2 und der Stäbchen zwischen 361 und 615 µW/ cm2 lag [43]. Zu anderen Werten kommt eine Studie von Ham et al. [14] bei der die Netzhaut von Affen mit weißem Licht mit einem Spektrum von 400–800 nm über mindestens 10 s bestrahlt wurde, wobei 400 J/cm2 für eine milde funduskopisch sichtbare fotochemische Läsion notwendig waren. Bei Bestrahlung mit Licht im blauen Wellenlängenbereich lag die schädliche Lichtdosis niedriger. So erfolgte bei Affen, bei denen eine monokulare Visuskontrolle mit Landoltringen möglich war, eine Beleuchtung der Fovea 1000 Sekunden lang mit 30, 60, 90 J/cm2 bei 441 nm. Bei 30 J/cm2 zeigte sich keine Visusreduktion, 60 J/cm2 führten zu einer temporären Visusreduktion nach 5 Tagen und einer Erholung nach 20-30 Tagen, bei 90 J/ cm2 kam es zu einer dauerhaften Visusreduktion ohne Erholungstendenz über 1 Jahr [14]. Bei Lichtschäden besteht ein additiver Effekt [14, 24], d. h. mehrere kurze Expositionen schaden genauso stark wie eine lange Exposition von gleicher Gesamtdauer. Bei lang andauernder Exposition oder langen Pausen zwischen einzelnen Lichtexpositionen trifft das nur teilweise zu, weil sich in diesem Fall die Lichtschäden aufgrund von Reparaturprozessen nur noch zum Teil aufsummieren [29]. Bei Rhesusaffen erzeugte eine zweimalige Bestrahlung mit 458 nm mit der halben Effektivdosis (ED50/2) im Abstand von 1 Tag nur 91% des Schadens, der durch eine einmalige Bestrahlung mit der vollen Dosis (ED50) verursacht wird. Bei einem Abstand von 2 Tagen beträgt der additive Effekt 57% und bei einem Abstand von 6 Tagen 23%. Es erfolgte ein exponentieller Reparaturprozess mit einer Zeitkonstante von 4 Tagen [11]. Im Widerspruch zu den hier genannten Untersuchungen stehen allerdings Ergebnisse anderer Autoren, die zeigen konnten, dass die intermittierende Lichtexposition sogar mehr schädigt als die kontinuierliche Exposition [32]. Temperatur Das Auftreten einer lichtinduzierten Schädigung ist auch von der Temperatur der Netzhaut während der Lichtexposition abhängig. Höhere Temperaturen beschleunigen das Auftreten von Netzhautschäden, während eine Absenkung der Temperatur protektiv wirkt. Bei Kaninchen, deren Netzhaut mit Lichtsonden (0,33 W/cm2) bestrahlt wurden, konnte die Expositionszeit von 25 auf 60 min verlängert werden, bevor funduskopisch und histologisch sichtbare Schäden auftraten, wenn die Vitrektomieinfusion eine Temperatur von 22° C anstatt von 39° C hatte [37]. In Ratten bewirkte eine Hyperthermie ein beschleunigtes Auftreten lichttoxischer Schäden durch Licht im grünen Wellenlängenbereich [31]. Adaptationsstatus und zirkardianer Rhythmus Klinische Manifestation lichttoxischer Schäden Auch der zirkardiane Rhythmus und der Adaptationsstatus spielen bei der Entstehung eines lichttoxischen Schadens eine Rolle. Ratten, die während der Dunkelperiode des Tag-Nacht-Rhythmus oder zu Beginn der Lichtperiode hellem weißem Licht ausgesetzt wurden, waren deutlich empfindlicher, als wenn die Exposition gegen Ende der täglichen hellen Phase stattfand [30, 45]. Ratten, die bei Dunkelheit aufgezogen wurden, waren ebenfalls empfindlicher für Lichtschäden und hatten einen höheren Rhodopsingehalt der Fotorezeptoren, als Ratten, die einem regelmäßigen Hell-Dunkel-Zyklus ausgesetzt waren [27]. Die Charakteristika lichtinduzierter Schäden der Netzhaut wurden insbesondere für die Retinopathia solaris und in zahlreichen Fallberichten nach operativen Eingriffen beschrieben. Funduskopisch findet sich ein helles gelbliches depigmentiertes Areal. Während es sich bei der Retinopathia solaris um eine kleine runde foveale Aufhellung handelt, ist das geschädigte Areal bei lichtinduzierten Schäden nach Operationen größer und weist oft eine ovale Form und RPE-Unregelmäßigkeiten mit Hyper- und Hypopigmentierungen auf. Diese Veränderungen können sowohl foveal als auch außerhalb der Fovea liegen, was v. a. nach Operationen des Vorderabschnitts häufiger der Fall ist. Fluoreszenzangiographisch zeigen sich hyperfluoreszente Läsionen im Sinne von Fensterdefekten mit unregelmäßigen fleckigen Hypofluoreszenzen [21, 23, 34]. Diese Veränderungen wurden nicht nur nach Vitrektomie und „membrane peeling“, sondern auch nach Vorderabschnittschirurgie beschrieben [18, 21, 34]. Eine Veränderung der Autofluoreszenz (AF) durch Lichteinwirkung wurde am menschlichen Auge bislang nur bei der Laserkoagulation der Netzhaut untersucht. Es zeigte sich eine sofortige Reduktion der Autofluoreszenz der Laserherde [7]. Hierbei handelt es sich um einen fotothermischen bzw. thermo-mechanischen Schädigungsmechanismus. Eine fotochemisch induzierte Reduktion der Autofluoreszenz konnte in vitro in humanen RPEZellen [17] und tierexperimentell in Affen nach Bestrahlung mit 568 nm nachgewiesen werden [26]. Bei Mäusen zeigten sich in der Autofluoreszenz nach Bestrahlung mit weißem Licht irreguläre punktförmige Hyperfluoreszenzen [6]. Veränderungen im OCT wurden bislang nur für die Retinopathia solaris beschrieben. Hier wurde von den meisten Autoren ein hyperreflektives Areal in der Fovea und zum Teil eine Unterbrechung im Bereich der äußeren Fotorezeptorschicht beschrieben. Teilweise fand sich auch eine Hyporeflektivität in der Schicht des retinalen Pigmentepithels [22, 42]. Funktionell lässt sich bei lichtinduzierten Schäden eine unterschiedlich stark Medikamente Verschiedene Medikamente können das Risiko fototoxischer Schäden am Auge steigern. Dazu gehören insbesondere chemische Verbindungen, die heterozyklische, trizyklische oder Porphyrin-ähnliche Strukturen aufweisen. Für die Netzhaut sind besonders Medikamente gefährlich, die sichtbares Licht absorbieren, da UV-Strahlung durch Hornhaut und Linse absorbiert wird. Daneben hängt die Gefahr fototoxischer Reaktionen jedoch auch von der Penetration des Medikaments in Strukturen des Auges ab und der Fähigkeit die Blut-Retina-Schranke zu überwinden [8]. Allerdings existieren trotz der großen Zahl an Medikamenten, die eine Fotosensibilisierung auslösen könnten, nur wenige Fallbeschreibungen zu lichtinduzierten Schäden der Netzhaut im Zusammenhang mit der Einnahme potenziell phototoxischer Medikamente. Dazu gehören Berichte über die Induktion fototoxischer retinaler Läsionen bei Patienten nach Einnahme von Allopurinol, Benzodiazepinen oder Diuretika nach Lichtexposition durch einen normalen Kamerablitz, Schweißarbeiten, Phakoemulsifikation und IOL-Implantation, sekundäre Linsenimplantation oder Keratoplastik plus Kataraktoperation [21, 25, 35]. Auch die Toxizität von Indocyanin-Grün bei Peeling-Operationen könnte durch Lichteinwirkung während der Operation verstärkt werden [49]. ausgeprägte Visusminderung nachweisen. Starke Visusverluste mit foveal gelegenen Läsionen traten häufiger bei Vitrektomie und Peeling als bei Operationen des Vorderabschnitts auf [34]. Ein Zentralskotom kann bei der Retinopathia solaris in der Mikroperimetrie oder im mfERG anhand einer zentralen Amplitudenreduktion nachgewiesen werden [22, 42]. Fazit für die Praxis Bei der Schädigung der Netzhaut durch sichtbares Licht spielen verschiedene Mechanismen (fotomechanisch, fotothermisch, fotochemisch) eine Rolle. Bei der Anwendung von Lichtquellen in der Ophthalmologie ist die fotochemische Lichttoxizität der entscheidende Mechanismus. Das Ausmaß der Schädigung wird durch verschiedene Faktoren beeinflusst. Dazu gehören die Wellenlänge des Lichts, die Expositionszeit, die Bestrahlungsstärke, die Temperatur des Auges und der Adaptationsstatus. Möglicherweise spielt auch die Einnahme von Medikamenten eine Rolle. Korrespondenzadresse Prof. Dr. S. Dithmar Leiter Schwerpunkt Retinologie, UniversitätsAugenklinik Heidelberg Im Neuenheimer Feld 400, 69120 Heidelberg [email protected] Interessenkonflikt. Der korrespondierende Autor gibt an, dass kein Interessenkonflikt besteht. Literatur 1. Bell JE, Hall C (1981) Hemoproteins. In: Bell JE (ed) Spectroscopy in Biochemistry. Boca Raton, FL, CRC Press 42–46 2. Brinkmann R, Huttmann G, Rogener J et al. (2000) Origin of retinal pigment epithelium cell damage by pulsed laser irradiance in the nanosecond to microsecond time regimen. Lasers Surg Med 27: 451–464 3. Chen E (1993) Inhibition of cytochrome oxidase and blue-light damage in rat retina. Graefes Arch Clin Exp Ophthalmol 231: 416–423 4. Delmelle M (1978) Retinal sensitized photodynamic damage to liposomes. Photochem Photobiol 28: 357–360 5. Demontis GC, Longoni B, Marchiafava PL (2002) Molecular steps involved in light-induced oxidative damage to retinal rods. Invest Ophthalmol Vis Sci 43: 2421–2427 6. Drumea-Mirancea M, Samardzija M, Beck SC et al. (2007) Temporal changes in autofluorescence following retinal light damage in mice. Invest Ophthalmol Vis Sci (ARVO-Poster) Der Ophthalmologe 2008 | Leitthema 7. Framme C, Schule G, Roider J et al. (2004) Online autofluorescence measurements during selective RPE laser treatment. Graefes Arch Clin Exp Ophthalmol 242: 863–869 8. Glickman RD (2002) Phototoxicity to the retina: mechanisms of damage. Int J Toxicol 21: 473–490 9. Gorgels TG, Van Norren D (1995) Ultraviolet and green light cause different types of damage in rat retina. Invest Ophthalmol Vis Sci 36: 851–863 10. Gorgels TG, Van Norren D (1998) Two spectral types of retinal light damage occur in albino as well as in pigmented rat: no essential role for melanin. Exp Eye Res 66: 155–162 11. Griess GA, Blankenstein MF (1981) Additivity and repair of actinic retinal lesions. Invest Ophthalmol Vis Sci 20: 803–807 12. Grimm C, Reme CE, Rol PO, Williams TP (2000) Blue light’s effects on rhodopsin: photoreversal of bleaching in living rat eyes. Invest Ophthalmol Vis Sci 41: 3984–3990 13. Grimm C, Wenzel A, Williams T et al. (2001) Rhodopsin-mediated blue-light damage to the rat retina: effect of photoreversal of bleaching. Invest Ophthalmol Vis Sci 42: 497–505 14. Ham WT jr, Mueller HA, Ruffolo JJ jr, Clarke AM (1979) Sensitivity of the retina to radiation damage as a function of wavelength. Photochem Photobiol 29: 735–743 15. Ham WT jr, Mueller HA, Ruffolo JJ jr et al. (1982) Action spectrum for retinal injury from near-ultraviolet radiation in the aphakic monkey. Am J Ophthalmol 93: 299–306 16. Ham WT jr, Ruffolo JJ jr, Mueller HA et al. (1978) Histologic analysis of photochemical lesions produced in rhesus retina by short-wave-length light. Invest Ophthalmol Vis Sci 17: 1029–1035 17. Hunter JJ, Morgan JI, Wolfe R et al. (2008) Ex vivo changes in retinal pigment epithelial autofluorescence with light exposure. Invest Ophthalmol Vis Sci (ARVO-Poster) 18. Karp KO, Flood TP, Wilder AL, Epstein RJ (1999) Photic maculopathy after pterygium excision. Am J Ophthalmol 128: 248–250 19. Katz ML, Gao CL, Rice LM (1996) Formation of lipofuscin-like fluorophores by reaction of retinal with photoreceptor outer segments and liposomes. Mech Ageing Dev 92: 159–174 20. Keller C, Grimm C, Wenzel A et al. (2001) Protective effect of halothane anesthesia on retinal light damage: inhibition of metabolic rhodopsin regeneration. Invest Ophthalmol Vis Sci 42: 476–480 21. Knox Cartwright NE, Tole DM, Haynes RJ et al. (2007) Recovery from macular phototoxicity after corneal triple procedure. Cornea 26: 102–104 22. Koinzer SO, Treumer F, Elsner H, Roider J (2007) Solar retinopathy: follow-up examinations with optical coherence tomography (OCT) and microperimetry. Klin Monatsbl Augenheilkd 224: 862–866 23. Kuhn F, Morris R, Massey M (1991) Photic retinal injury from endoillumination during vitrectomy. Am J Ophthalmol 111: 42–46 24. Lawwill T, Crockett S, Currier G (1977) Retinal damage secondary to chronic light exposure, thresholds and mechanisms. Doc Ophthalmol 44: 379–402 25. Mauget-Faysse M, Quaranta M, Francoz N, BenEzra D (2001) Incidental retinal phototoxicity associated with ingestion of photosensitizing drugs. Graefes Arch Clin Exp Ophthalmol 239: 501–508 26. Morgan JI, Hunter JJ, Masella B et al. (2008) Lightinduced retinal changes observed with high-resolution autofluorescence imaging of the retinal pigment epithelium. Invest Ophthalmol Vis Sci 49: 3715–3729 | Der Ophthalmologe 2008 27. Noell WK (1979) Effects of environmental lighting and dietary vitamin A on the vulnerability of the retina to light damage. Photochem Photobiol 29: 717–723 28. Noell WK, Albrecht R (1971) Irreversible effects on visible light on the retina: role of vitamin A. Science 172: 76–79 29. Noell WK, Walker VS, Kang BS, Berman S (1966) Retinal damage by light in rats. Invest Ophthalmol 5: 450–473 30. Organisciak DT, Darrow RM, Barsalou L et al. (2000) Circadian-dependent retinal light damage in rats. Invest Ophthalmol Vis Sci 41: 3694–3701 31. Organisciak DT, Darrow RM, Noell WK, Blanks JC (1995) Hyperthermia accelerates retinal light damage in rats. Invest Ophthalmol Vis Sci 36: 997– 1008 32. Organisciak DT, Jiang YL, Wang HM et al. (1989) Retinal light damage in rats exposed to intermittent light. Comparison with continuous light exposure. Invest Ophthalmol Vis Sci 30: 795–805 33. Organisciak DT, Noell WK (1977) The rod outer segment phospholipid/opsin ratio of rats maintained in darkness or cyclic light. Invest Ophthalmol Vis Sci 16: 188–190 34. Postel EA, Pulido JS, Byrnes GA et al. (1998) Longterm follow-up of iatrogenic phototoxicity. Arch Ophthalmol 116: 753–757 35. Power WJ, Travers SP, Mooney DJ (1991) Welding arc maculopathy and fluphenazine. Br J Ophthalmol 75: 433–435 36. Reme C, Grimm C, Wenzel A, Hafezi F (2006) UVund Lichtschäden des Auges. In: Dummer R (Hrsg) Physikalische Therapiemaßnahmen in der Dermatologie. Steinkopff, Darmstadt S 51–55 37. Rinkoff J, Machemer R, Hida T, Chandler D (1986) Temperature-dependent light damage to the retina. Am J Ophthalmol 102: 452–462 38. Rozanowska M, Wessels J, Boulton M et al. (1998) Blue light-induced singlet oxygen generation by retinal lipofuscin in non-polar media. Free Radic Biol Med 24: 1107–1112 39. Sieving PA, Chaudhry P, Kondo M et al. (2001) Inhibition of the visual cycle in vivo by 13-cis retinoic acid protects from light damage and provides a mechanism for night blindness in isotretinoin therapy. Proc Natl Acad Sci U S A 98: 1835–1840 40. Solley WA, Sternberg P jr (1999) Retinal phototoxicity. Int Ophthalmol Clin 39: 1–12 41. Sparrow JR, Nakanishi K, Parish CA (2000) The lipofuscin fluorophore A2E mediates blue light-induced damage to retinal pigmented epithelial cells. Invest Ophthalmol Vis Sci 41: 1981–1989 42. Stangos AN, Petropoulos IK, Pournaras JA et al. (2007) Optical coherence tomography and multifocal electroretinogram findings in chronic solar retinopathy. Am J Ophthalmol 144: 131–134 43. Sykes SM, Robison WG jr, Waxler M, Kuwabara T (1981) Damage to the monkey retina by broadspectrum fluorescent light. Invest Ophthalmol Vis Sci 20: 425–434 44. Tso MO (1973) Photic maculopathy in rhesus monkey. A light and electron microscopic study. Invest Ophthalmol 12: 17–34 45. White MP, Fisher LJ (1987) Degree of light damage to the retina varies with time of day of bright light exposure. Physiol Behav 39: 607–613 46. Williams TP (1964) Photoreversal of rhodopsin bleaching. J Gen Physiol 47: 679–689 47. Wu J, Seregard S, Algvere PV (2006) Photochemical damage of the retina. Surv Ophthalmol 51: 461– 481 48. Yanagi Y, Inoue Y, Jang WD, Kadonosono K (2006) A2e mediated phototoxic effects of endoilluminators. Br J Ophthalmol 90: 229–232 49. Yip HK, Lai TY, So KF, Kwok AK (2006) Retinal ganglion cells toxicity caused by photosensitising effects of intravitreal indocyanine green with illumination in rat eyes. Br J Ophthalmol 90: 99–102