PRA-ENK-Heizwert-Musterprotokoll - lehrer.uni
Werbung

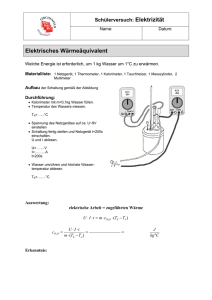
LK CH / Bs PRAKTIKUM: MUSTERPROTOKOLL HEIZWERT BESTIMMUNG DES HEIZWERTES VON KERZENWACHS Grundlagen: Geräte: Der Heizwert H* eines Stoffes gibt an, welche Wärmemenge Q (in kJ oder MJ) die Verbrennung von 1 kg dieses Stoffes liefert. Im folgenden Versuch soll der Heizwert von Kerzenwachs bestimmt werden. Verbrennungskalorimeter, Thermometer mit 1/100-Einteilung, Stativmaterial, Analysenwaage, Wasserstrahlpumpe, Warmwasserboiler, Messzylinder, Waschflasche, Schlauchstücke. Teelicht, Wasser. Chemikalien: Durchführung: V1. Bestimmung der Temperaturerhöhung von Wasser in Abhängigkeit von der Masse des verbrannten Kerzenwachses. Bauen Sie das Verbrennungskalorimeter gemäß nebenstehender Skizze an ein Stativ und schließen Sie die Wasserstrahlpumpe an. In die Waschflasche füllen Sie etwas dest. Wasser, so dass das längere Rohr in das Wasser eintaucht. Notieren Sie: Wasser im Kalorimeter: V0(Wasser) = _400___ml m0(Wasser) ____400_ g Wiegen Sie nun das Teelicht auf der Analysenwaage möglichst genau ab. Notieren Sie: mA (Teelicht) = _______19,35____ g Bringen Sie mit Hilfe entsprechenden Stativmaterials das Teelicht unter die Öffnung des Verbrennungskalorimeters. Geben Sie das Thermometer in das Wasser im Kalorimeter und messen Sie die Anfangstemperatur 1. Notieren Sie: A = ___16,2______ 0C Drehen Sie nun den Wasserhahn mit der Wasserstrahlpumpe vorsichtig auf, so dass ein schwacher Gasstrom durch die Waschflasche und das Kalorimeter gesaugt wird. Entzünden Sie nun das Teelicht. Stellen Sie dieses unter die Kalorimeteröffnung und rühren Sie das Wasser im Kalorimeter langsam mit Hilfe des Rührers durch. Beobachten Sie das Thermometer und stoppen Sie die Verbrennung (Teelicht weg und ausblasen – vorsichtig, damit kein Wachs verlorengeht), wenn das Thermometer um etwa 100C gestiegen ist. Beobachten Sie unter weiterem Rühren die Anzeige des Thermometers. Ermitteln Sie so das Maximum der Temperatur. Notieren Sie die Endtemperatur E = __27,1_______ 0C Wiegen Sie nun das Teelicht zum zweiten Mal auf der Analysenwaage. Notieren Sie die Masse des Teelichtes nach dem Verbrennungsvorgang. mE(Teelicht) = _18,27_____ g. D:\841123022.doc Seite 1 von 3 LK CH / Bs PRAKTIKUM: MUSTERPROTOKOLL HEIZWERT V2. Bestimmung der Wärmekapazität des verwendeten Kalorimeters. Da die Kalorimeteranordnung selbst einen Teil der freigesetzten Wärme aufgenommen hat – die Temperatur der Kalorimeteranordnung ist ja ebenfalls gestiegen – muss für exakte Messungen nun ermittelt werden, welchen Anteil der freigesetzten Wärme das Kalorimeter aufgenommen hat. Dies geschieht durch ein zweites Experiment: Gießen Sie das Wasser aus dem Kalorimeter ab. Messen Sie nun mit einem Messzylinder Leitungswasser (1/2 V0, also die Hälfte des in Versuch 1 eingemessenen Volumens) im Messzylinder ab und geben Sie dieses in das Kalorimetergefäß. Notieren Sie: Volumen V1 des Leitungswassers = ____200_________ ml Masse m1 des Leitungswassers = ____200_________ g 0 Temperatur K im Kalorimeter = ____17,1_________ C Messen Sie nun dieselbe Menge warmen Wassers (aus dem Boiler entnehmen) in einem Messzylinder ab. Bestimmen Sie dessen Temperatur und geben Sie dieses gleich nach der Temperaturmessung zu dem kalten Wasser im Kalorimeter; rühren Sie kurz durch und ermitteln sie die Mischungstemperatur im Kalorimeter. Notieren Sie: Volumen V2 des warmen Wassers = _____200________ ml Masse m2 des warmen Wassers = _____200________ g 0 Temperatur W des warmen Wassers = _____35,8________ C Mischungstemperatur M im Kalorimeter = ______25,4_______ 0 C Nachbereitung und Entsorgung: Kalorimeteranordnung gründlich mit destilliertem Wasser spülen und auf das Trockengestell hängen. Auswertung: A1 Berechnen Sie die Kapazität CKAL des Kalorimeters aus den Messwerten von V2. Anleitung: Das warme Wasser gibt Energie an das kalte Wasser und an die Kalorimeteranordnung ab. Für die abgegebene Wärmemenge gilt: QAB = cWasser mW (W - M ) Das kalte Wasser und das Kalorimeter, welches sich ja zunächst auch auf der Temperatur des kalten Wassers befindet, nehmen Energie auf. Für die vom Kalorimeter bei der Erwärmung aufgenommene Wärmemenge gilt: QKAL = CKAL (M - K) Für die vom kalten Wasser bei der Erwärmung aufgenommene Wärmemenge gilt: QAUF = cWasser mK (M - K) Aufgrund der Energieerhaltung muss also gelten: QAB = QKAL + QAUF QKAL = QAB – QAUF = CKAL = QKAL / (M - K‘) [CKAL] in kJ K-1 A2 Berechnen Sie anhand des Ergebnisses von A1 und der Messwerte von V1 die Wärmemenge QKAL1, welche das Kalorimeter in V1 aufgenommen hat. A3 Berechnen Sie anhand der Messwerte von V1 die Wärmemenge QW1, welche das Wasser im Kalorimeter aufgenommen hat. A4 Berechnen Sie anhand der Ergebnisse von A2 und A3 die gesamte bei der Verbrennung freigesetzte Wärme Q und bestimmen Sie den Heizwert des Kerzenwachses in MJkg-1. D:\841123022.doc Seite 2 von 3 LK CH / Bs D:\841123022.doc PRAKTIKUM: MUSTERPROTOKOLL HEIZWERT Seite 3 von 3