Konduktometrische Titration - lehrer.uni
Werbung

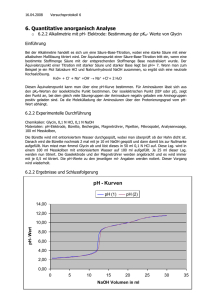
CH / Bs PRAKTIKUM: PROTOLYSE KONDUKTOMETRIE 3 Grundlagen: Die Leitfähigkeit eines Elektrolyten ändert sich, wenn Ionen durch Fällungsreaktionen oder Bildung von Molekülen entfernt bzw. leichtbeweglichen Ionen (z.B. Hydroxid-Ionen oder Oxonium-Ionen gegen Ionen kleinerer Beweglichkeit ausgetauscht werden. Dies kann ausgenutzt werden, um bei einer Titration den Endpunkt (Äquivalenzpunkt) zu erkennen, da hier ein Minimum der Leitfähigkeit der Lösung vorliegt (KONDUKTOMETRIE). Versuch Ermittlung der Konzentration von Oxalsäure-Lösung durch konduktometrische Titration Geräte und Chemikalien: Leitfähigkeitsprüfer (alternativ zwei Platinelektroden in Stopfen), Netzgerät (Wechselspannung), Strommessgerät, Kabel, Bürette (50 ml), Bürettenhalter, Stativmaterial, Glasstab zum Rühren, Becherglas (100 ml, hohe Form), Pipette (10 ml), Pipettierhilfe. Oxalsäure (Ethandisäure; HOOC-COOH2H2O);Xi, Natronlauge c = 1 mol/ Durchführung: Bauen Sie die Apparatur gemäß nebenstehender Skizze zusammen; befestigen Sie die Platin-Elektroden an einem Stativ, so dass sich ihr Abstand und die Eintauchtiefe in die Lösung während der Messung nicht verändern können. Wiegen Sie m = 1,25 g der Oxalsäure ab und lösen Sie diese in Wasser zum Volumen V = 50 mL Lösung. Geben Sie diese in das Becherglas und füllen Sie ggf. mit dest. Wasser auf, bis die Platin-Elektroden vollständig in die Lösung eintauchen. Füllen Sie die Bürette mit Natronlauge (c = 1 molL-1) und befestigen Sie diese ebenfalls an dem Stativ. Stellen Sie das Strommessgerät auf WECHSELSTROM ein, wählen Sie als Messbereich 200 mA. Schließen Sie den Spannungsmesser an die Quelle an, Messbereich 30 V -- ggf. empfindlicher. LASSEN SIE DIE SCHALTUNG VOM LEHRER PRÜFEN !! Regulieren Sie nun die WECHSELSPANNUNG am Netzgerät so ein, dass das Strommessgerät ca. 30 mA anzeigt. Ab jetzt dürfen Sie die angelegte Spannung nicht mehr verändern! Legen Sie folgende Wertetabelle an: Volumen zugegebener Natronlauge in ml | ----------------------------------------------------------- |-----------------------------------------------------------Stromstärke im mA | ----------------------------------------------------------- |-----------------------------------------------------------Spannung in V | ----------------------------------------------------------- |-----------------------------------------------------------Elektr. Leitfähigkeit in Siemens | ----------------------------------------------------------- |------------------------------------------------------------ Tropfen Sie nun in Schritten von jeweils 0,5 ml Natronlauge zu und rühren Sie die Lösung mit dem Glasstab um, bis der Strommesser wieder einen konstanten Wert anzeigt. Notieren Sie jeweils die Werte in der Wertetabelle. Führen Sie die Messung solange fort, bis der Strommesser wieder ca. den Anfangswert anzeigt. D:\841122430.doc Seite 1 von 3 CH / Bs PRAKTIKUM: PROTOLYSE KONDUKTOMETRIE 3 Entsorgung und Nachbereitung: Die Natronlauge aus der Bürette in die Vorratsflasche zurückgeben. Inhalt des Becherglases in den Entsorgungsbehälter LAUGEN geben. Alle Glasgeräte gründlich reinigen, mit dest. Wasser ausspülen und zum Trocknen aufhängen. Auswertung: 1. Zeichnen Sie eine Titrationskurve, indem Sie die Stromstärke in Abhängigkeit vom Volumen der zugegebenen Natronlauge in ein Diagramm übertragen (mm-Papier). 2. Formulieren Sie eine Reaktionsgleichung in Ionenschreibweise und erklären Sie den Kurvenverlauf des Diagramms. 3. Bestimmen Sie den Äquivalenzpunkt aus dem Diagramm gemäß nebenstehender Abbildung (die Ihrer Kurve nicht unbedingt ähnlich sieht). 4 Berechnen Sie die Stoffmengenkonzentration c der Oxalsäure-Lösung.. BEREITEN SIE EINE KURZE PRÄSENTATION (Versuchsaufbau, Versuchsdurchführung, Ergebnisse, Auswertung) ZUR INFORMATION IHRER MITSCHÜLER VOR. D:\841122430.doc Seite 2 von 3 CH / Bs D:\841122430.doc PRAKTIKUM: PROTOLYSE Seite 3 von 3 KONDUKTOMETRIE 3