Übungsklausur zum chemischen Praktikum für Studierende mit
Werbung

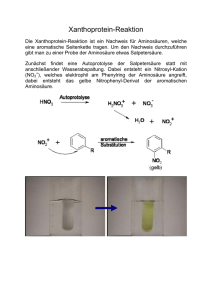
Übungsklausur zum chemischen Praktikum für Studierende mit Chemie als Nebenfach 1. (10P) Was ist richtig (mehrere Richtige sind möglich)? a) Fructose besitzt 5 Kohlenstoffatome. b) Die alpha- und beta-Ringform eines Zuckers liegen in wässriger Lösung im Gleichgewicht vor. c) Die D- und L-Form eines Zuckers liegen in wässriger Lösung im Gleichgewicht vor. d) Saccharose ist ein Disaccharid. e) Glucose und Fructose sind Konstitutionsisomere. 2. (8P) a) Zeichnen Sie D-Glucose in der Fischer-Projektion. b) Zeichnen Sie L-alpha-Idopyranose in der Haworth-Projektion. 3. (10P) a) Welche Funktion hat ein Scheidetrichter? (ein Satz) b) Welche der folgenden Lösungsmittel sind mit Wasser mischbar? Bitte einkreisen. n-Pentan, Aceton, Ethanol, Benzen (Benzol), Chloroform c) Welche der folgenden Lösungsmittel sind mit n-Hexan mischbar? Bitte einkreisen. n-Pentan, Aceton, Ethanol, Benzen (Benzol), Chloroform d) Nennen Sie drei Methoden mit denen Sie die Konzentration einer Salzsäurelösung bestimmen können. e) Mit welcher Methode können Sie ein Aminosäuregemisch trennen? 4. (10P) Was ist richtig (mehrere Richtige sind möglich)? a) Konzentrierte Natronlauge zerstört die Sekundärstruktur von Proteinen. b) Die Tertiärstruktur besteht aus mehreren Proteinen. c) Die alpha-Helix wird durch Disulfidbrücken zwischen den Cystein-Bausteinen stabilisiert. d) Die Hitzedenaturierung eines Proteins kann reversibel sein. e) Die Aminosäuren in einem Protein sind über Imid-Bindungen miteinander verküpft. 5. (10P) Zeichnen Sie die Valenzstrichformel des Tripeptids Glutaminsäure-Alanin-Prolin. Für den Notall: Falls Sie eine der Aminosäuren nicht kennen, ersetzen Sie diese durch eine andere proteinogen Aminosäure Ihrer Wahl (-1P pro ersetzter Aminosäure; es nicht erlaubt zweimal durch die gleiche Aminosäure zu ersetzen). 6. (14P) Zeichnen Sie die Titrationskurven von 100 mL 1 molarer Salzsäure + 200 mL 1 molarer Ammoniaklösung UND 100 mL 1 molarer Ammoniaklösung + 200 mL 1 molarer Salzsäure (pKB(NH3) = 4,75). a) Welche pH-Werte liegen jeweils zu Beginn und zum Ende der Titration vor? (Rechnung!) c) Welcher pH-Wert liegt am Äquivalenzpunkt vor? (Rechnung!) d) Markieren Sie (falls vorhanden) den Pufferbereich. e) Markieren Sie die Neutralpunkte. 7. (8P) a) Wie ist die Summenformel von Kalk? b) Zeichnen Sie die Valenzstrichformel von Kohlenstoffdioxid. c) Zeichnen Sie die Valenzstrichformel des Hydrogencarbonatanions. d) Wieso geht Kalk in Lösung, wenn Sie Kohlenstoffdioxid in die Lösung einleiten? Argumentieren Sie mit Hilfe von Reaktionsgleichungen und Gleichgewichten. 8. (12P) a) Zeichnen Sie ein Schema eines „Nickel-Cadmium“-Akkumulators während des Entladevorgangs. Beschriften Sie Anode und Kathode. Als Elektrolyt wird Kaliumhydroxidlösung verwendet. 0 2+ E (Cd/Cd ) = −0,81 V 0 E (NiO(OH)/Ni(OH)2) = +0,49 V b) Geben Sie die Oxidations- und Reduktionsteilgleichung, sowie die Gesamtgleichung während des Entladevorgangs an. 9. (8P) Ordnen Sie die folgenden Substanzen nach Nucleophilie. Begründen Sie die Reihenfolge mit Stichworten. 10. (10P) Beschreiben Sie den Mechanismus der sauer katalysierten Estersynthese detailliert mit Hilfe von Valenzstrichformeln.