Protokoll Brennstoffzelle
Werbung

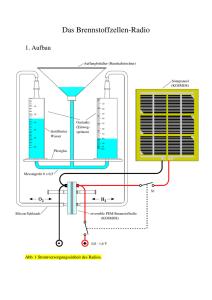
TU Bergakademie Freiberg ‐ Institut für Werkstofftechnik Schülerlabor „science meets school“ ‐ Werkstoffe und Technologien in Freiberg PROTOKOLL SEKUNDARSTUFE II Modul: Elektrochemie Versuch: Brennstoffzelle 1 Abbildung 1: Brennstoffzelle [1] I. HINTERGRUND Brennstoffzellen sind aktueller Gegenstand der Forschung und könnten bald in vielen Bereichen herkömmliche Verbrennungsmotoren ersetzen. Durch die Reaktion von Wasserstoff und Sauerstoff zu Wasser kann mit ihnen chemische Energie in elektrische Energie umgewandelt werden. Ein wichtiger Aspekt ist dabei die Betrachtung des Wirkungsgrads dieser Reaktion. In diesem Versuch soll ein Überblick über dieses Thema gegeben werden. Weitere Informationen sind in „Grundlagen Brennstoffzelle“ zu finden. II. Versuchsziel und Aufgabenstellung Mit der PEM‐Brennstoffzelle soll Wasserstoff und Sauerstoff zu Wasser umgesetzt und die dabei freiwerdende elektrische Energie gemessen werden. Dazu werden folgende Aufgaben ausgeführt: • • • • Aufbau des Versuchs zur Aufnahme der I‐U‐ und der P‐I‐Kennlinien der Brennstoffzelle Erzeugung von Wasserstoff und Sauerstoff mit dem Elektrolyseur Umbau des Versuchs zur Aufnahme der 2HV‐t‐Kennlinien Berechnung des energetischen und des faradayschen Wirkungsgrads der Brennstoffzelle Brennstoffzelle www.schuelerlabor.tu‐freiberg.de III. Durchführung Aufnahme der I‐U‐Kennlinie • Benötigte Geräte und Materialien: 1 PEM‐Elektrolyseur 1 2 V Netzteil 1 PEM‐Brennstoffzelle 1 Platine mit Widerstandsdekade 1 Amperemeter 1 Voltmeter diverse Kabel mit Steckverbindern destilliertes Wasser zum Nachfüllen des PEM‐Elektrolyseurs • Die Schaltung wird wie in Abbildung 2 aufgebaut: 2 Abbildung 2: Aufbau der Schaltung zur Aufnahme der I‐U‐ und P‐I‐Kennlinien [1] • Aufnahme der Messwerte: Der Elektrolyseur wird über ein 2 V‐Netzteil an das Netz geschlossen. Die Schläuche des Wasserstoffspeichers und des Sauerstoffspeichers werden mit den dafür vorgesehenen Anschlüssen an der Brennstoffzelle verbunden. Die Ausgangsventile der Brennstoffzelle werden geschlossen und mit dem Elektrolyseur einige Zeit Wasser zersetzt, bis die Gasvolumina in den Speichern etwa 20 ml betragen. Danach werden die Ausgangsventile der Brennstoffzelle kurz geöffnet, um Restluft auszuspülen. Nach dem erneuten Verschließen der Ventile wird die Widerstandsdekade auf Leerlauf (R=∞) gestellt und weiter Gas am Elektrolyseur produziert. Wenn genug Sauerstoff und Wasserstoff vorhanden sind, wird mit der Messung begonnen. Dazu wird R zu kleineren Widerständen durchgeschaltet und dabei jeweils der Strom I und die Spannung U in Tabelle 1 notiert. Wichtig ist eine Wartezeit von etwa 20 s zwischen den Messungen, damit das System wieder den statischen Zustand erreicht. Achtung: Keine Spannungen über 2 V verwenden, sonst wird der Elektrolyseur beschädigt! Brennstoffzelle www.schuelerlabor.tu‐freiberg.de • Messwertetabelle Tabelle 1: Messwerte der I‐U‐ und P‐I‐Kennlinien Aufnahme der VH2‐t‐Kennlinien • Benötigte Geräte und Materialien wie im ersten Teil des Versuchs • Die Schaltung wird wie im ersten Teil des Versuchs aufgebaut (s. Abb. 1). • Aufnahme der Messwerte: Wie im ersten Teil des Experiments wird mit dem Elektrolyseur erst einige Zeit Wasserstoff produziert und dann das System entlüftet. Danach werden im Elektrolyseur genau 20 ml Wasserstoff produziert und die Spannungsversorgung abgestellt. Jetzt kann der Stromkreis der Brennstoffzelle geschlossen und dabei zeitgleich der Auslöser der Stoppuhr betätigt werden. Bei einem Füllstand des Speichers von V=15, 10 und 5 ml wird jeweils die Zeit gestoppt und Stromstärke und Spannung in Tabelle 2 notiert. Die Messung sollte mit drei verschiedenen Lastwiderständen durchgeführt werden. Brennstoffzelle www.schuelerlabor.tu‐freiberg.de 3 Tabelle 2: Messwerte der Messwerte der VH2‐t‐Kennlinien IV. Auswertung 4 Darstellung der Kennlinien Die I‐U‐Kennlinie der Brennstoffzelle (s. Abb. 3) ergibt sich aus den Messwerten der Tab. 1. Zum besseren Vergleich mit der Leistungskurve sind die Achsen vertauscht. Bei kleinen Spannungen fließt ein ………… Strom und bei großen Spannungen ein ……….. Strom. Wenn der Lastwiderstand R gegen ∞ geht, dann liegt eine Leerlaufspannung von …… V an und es fließt ………. Strom. Wird der Lastwiderstand sehr klein (R→0), so fließt der Kurzschlussstrom IK= …… A. Der Verlauf der Leistungskennlinie (s. Abb. 4) hat bei ………. A ein …………….. An diesem Punkt besitzt die Brennstoffzelle die ………… Leistung. Der dafür nötige Lastwiderstand beträgt ……… Ω. Die 2HV‐t‐Kennlinien der Brennstoffzelle (s. Abb. 4) ergeben sich aus den Messwerten der Tab. 2. Das verbrauchte Gasvolumen VH2 ist der Zeit t dabei…………….. Je höher die elektrische Leistung der Zelle, desto ………… ist der Gasverbrauch. Brennstoffzelle www.schuelerlabor.tu‐freiberg.de Abbildung 3: I‐U‐Kennlinie der Brennstoffzelle 5 Abbildung 4: P‐I‐Kennlinie der Brennstoffzelle Brennstoffzelle www.schuelerlabor.tu‐freiberg.de Abbildung 5: VH2‐t‐Kennlinie der Brennstoffzelle Berechnung des Energetischen Wirkungsgrads 6 Der energetische Wirkungsgrad wird mit Formel (1) berechnet. HU unterer Brennwert des Wasserstoffs [10,8∙W∙s∙ml‐1] Setzt man Werte aus Tab. 2 ein, so ergibt sich z.B. ein energetischer Wirkungsgrad von: Faradayscher Wirkungsgrad Der Faradaysche Wirkungsgrad ηF wird mit Formel (2) berechnet. Brennstoffzelle www.schuelerlabor.tu‐freiberg.de T n p R NA z absolute Temperatur Stoffmenge des Gases Luftdruck universelle Gaskonstante Avogadrokonstante Anzahl der Elektronen die zur Bildung eines Moleküls H2 benötigt werden Elementarladung [K] [mol] [Pa] [8,315 J∙K‐1∙mol‐1] [6,022∙1023 mol‐1] [2 Elektronen] e [1,602∙10‐19 A∙s] Setzt man Werte aus Tabelle 2 ein, so ergibt sich z.B. ein faradayscher Wirkungsgrad von: Fragen 1. Warum muss deionisiertes Wasser verwendet werden? 2. Welche Anforderungen an den Lastwiderstand ergeben sich aus der Leistungskurve, wenn die Brennstoffzelle mit maximaler Leistung betrieben werden soll? 3. Welcher Wirkungsgrad ist bei Wasserstoff‐Sauerstoff‐Brennstoffzellen prinzipiell erreichbar und wodurch wird er limitiert? 4. Was sagt der energetische Wirkungsgrad aus? Wovon hängt er ab und warum ist er deutlich kleiner als der ideale Wirkungsgrad? 5. Was sagt der faradaysche Wirkungsgrad aus? 6. Welche Fehler können während der Messung auftreten und die Ergebnisse beeinflussen? LITERATUR [1] Schülerexperimente Brennstoffzelle, h‐tec, 2003 Brennstoffzelle www.schuelerlabor.tu‐freiberg.de 7