doc
Werbung

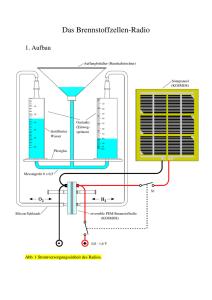
Brennstoffzelle I: Wie funktioniert die Brennstoffzelle? Deine Brennstoffzelle ist eine reversible PEMBrennstoffzelle. Die Abkürzung PEM bezieht sich auf die Membran, die die Sauerstoffseite der Zelle von der Wasserstoffseite trennt. Die Buchstaben PEM stehen für Proton-Exchange-Membrane (englisch; zu deutsch: Protonen-Austausch-Membran). Als Membran für deine Brennstoffzelle wird eine Folie aus dem Polymer Nation verwendet. Es gibt auch andere Verfahren, Wasserstoff- und Sauerstoffseite voneinander zu trennen (siehe Box Brennstoffzelle II). Reversibel bedeutet, dass die Prozesse, die darin ablaufen, in beide Richtungen möglich sind, die Zelle also sowohl als Brennstoffzelle als auch als Elektrolyseur arbeiten kann. Die elektrischen Kontaktplatten (Elektroden) in deiner Brennstoffzelle haben verschiedene Namen schließlich passiert an ihnen auch ganz Unterschiedliches: •. die Elektrode an der Wasserstoffseite wird als Anode bezeichnet, die Elektrode an der Sauerstoffseite als Kathode. An der Anode werden elektrisch neutrale Wasserstoffmoleküle (die im Wasserstofftank gespeichert werden) unter Elektronenabgabe zu Wasserstoffionen oxidiert. Die somit positiv gela-denen Wasserstoffionen wandern („diffundieren") durch die PolymerelektrolytMembran hindurch zur negativ geladenen Kathode. Die Membran ist so beschaffen, dass die Wasserstoffionen, die auch als Protonen bezeichnet werden, hindurch passen, die größeren Sauerstoffionen jedoch nicht (deswegen der Name Protonen-AustauschMembran). An der Kathode reagieren die Wasserstoffionen mit dem dort vorhandenen Sauerstoff und den Elektronen, die aus dem elektrischen Leiter zugeführt werden, zu Wasser. Die Wasserstoffionen und Sauerstoffionen werden gewissermaßen wieder zu Wassermolekülen zusammengesetzt. War es bei der Elektrolyse notwendig, Energie in die Trennung der Wassermoleküle zu stecken, erhält man jetzt beim Zusammensetzen der Ionen zu Wasser wieder Energie zurück. Auf diese Weise kommt es zu einer elektrischen Spannung, die an der Brennstoffzelle anliegt. Wird nun an Anode und Kathode ein elektrischer Verbraucher angeschlossen, z. B. ein Elektromotor, dann fließen die Elektronen von der Anode zur Kathode, es fließt also ein elektrischer Strom und der Motor läuft. Die Elektroden selbst werden bei den stattfindenden Reaktionen nicht verändert, da die Umsetzung von Sauerstoff und Wasserstoff kata-lytisch abläuft. Man spricht von einer „kalten Verbrennung", denn es entsteht keine Flamme. Wärme wird bei der Reaktion aber schon freigesetzt. Vielleicht spürst du eine Erwärmung der Brennstoffzelle. Chemisch laufen folgende Vorgänge an den Elektroden ab der Brennstoffzelle ab: Anode: 2 H2 4H + + 4e Elektronenabgabe (Oxidation) Kathode: O2 + 4 H+ + 4 e- 2 H2O Elektronenaufnahme (Reduktion) Gesamtreaktion: 2 H 2 + O2 2 H2O Die Bildung des Wassers an der Kathode (Sauerstoffseite) lässt sich übrigens sehr schön beobachten. Achte mal darauf, wenn die Brennstoffzelle Strom erzeugt. Je stärker der Strom ist, der fließt, desto schneller wird das Wasser aus den Gasen Wasserstoff und Sauerstoff zurück gebildet (siehe auch Versuch 32). Abb. 120: Wasserstoff- und Sauerstoffmoleküle verbinden sich zu Wasser (schematische Darstellung) Brennstoffzelle II: Verschiedene Brennstoffzellentypen Zusätzlich zu deiner Brennstoffzelle gibt es auch noch andere Typen von Brennstoffzellen (englisch: Fuel Cell, FC). Sie unterscheiden sich in den Elektrolyten und eingesetzten Gasen, wodurch sich wiederum unterschiedliche Betriebstemperaturen ergeben. Zu den Niedertemperatur-Brennstoffzellen gehören die alkalische Brennstoffzelle (AFC), deine MembranBrennstoffzelle (PEMFC), die Direkt-MethanolBrennstoffzelle (DMFC) und die phosphorsaure Brennstoffzelle (PAFC). Sie werden mit Wasserstoff betrieben, der z. B. über Elektrolyse von Wasser oder Reformierung von Erdgas, Biogas (Methan) oder Methanol erzeugt wird. Zu den Hochtemperatur-Brennstoffzellen gehören die Karbonatschmelze-Brennstoffzelle (MCFC) und die oxidkeramische Brennstoffzelle (SOFC), die auch für den direkten Einsatz von Kohlegas geeignet sind. Im Überblick sind die verschiedenen Typen in der rechtsstehenden Tabelle aufgeführt: Abb. 121: William Grove Vielleicht kannst du noch etwas feststellen: Fühle mal die Temperatur der Brennstoffzelle. Ist sie höher oder niedriger als vor dem Betrieb? Die Zelle ist wärmer geworden. Bei der Umwandlung der Gase ist nicht nur Strom erzeugt worden, sondern auch Wärme/Weitere Erläuterungen dazu findest du bei Versuch 33. Fassen wir also zusammen. Wird an die Brennstoffzelle der Motor angeschlossen (die Gastanks müssen natürlich mit Wasserstoff und Sauerstoff gefüllt sein), dann • beginnt der Motor sich zu drehen und • die Gasvorräte nehmen ab. Abb. 123 : Brennstoffzelle (1839) von William Grove Abb. 122: Verschiedene Brennstoffzellentypen (deutsche Bezeichnungen siehe Box Brennstoffzelle II) Bezeichnung Elektrolyt Anodengas Kathodengas Betriebs temperatur Stand AFC Alcaline Fuel Cell Kalilauge Wasserstoff Sauerstoff unter 80°C Kommerziell Entwicklung PEMFC Proton Exchange Membrane Fuel Cell Polymermembran Wasserstoff (direkt oder Sauerstoff aus Reformierung von Methan oder Methanol 120 °C Entwicklung DMFC Polymermembran Direct Methanol Fuel Cell Methanol Luftsauerstoff 90 – 120°C Entwicklung PAFC Phosphorsäure Phosphoric Acid Fuel Cell Wasserstoff (direkt aus Methanreformierung) Luftsauerstoff 200 °C Kommerziell MCFC Molten Carbonate Fuel Cell Alkalikarbonatschmelzen Wasserstoff Methan, Kohlegas Luftsauerstoff 650 °C Entwicklung SOFC Solid Oxid Fuel Cell Oxidkeramischer Elektrolyt Wasserstoff Methan, Kohlegas Luftsauerstoff 900 – 1000 °C Entwicklung 79