Thermodynamik - Uni Salzburg
Werbung

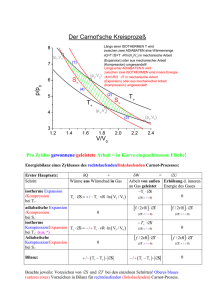
Musso: Physik I Teil 19 Zweiter Hauptsatzt Seite 1 THERMODYNAMIK Tipler-Mosca 19. Der Zweite Hauptsatz der Thermodynamik 19.1 Wärmekraftmaschinen und der Zweite Hauptsatz 19.2 Kältemaschinen und der Zweite Hauptsatz 19.3 Die Gleichwertigkeit der Formulierung des Zweiten Hauptsatzes 19.4 Der Carnot'sche Kreisprozess 19.5 Wärmepumpen 19.6 Irreversibilität und Unordnung 19.7 Entropie 19.8 Entropie und die Verfügbarkeit der Energie 19.9 Entropie und Wahrscheinlichkeit 19.10 Der Dritte Hauptsatz Universität Salzburg Seite 1 27.01.2007 Musso: Physik I Alonso-Finn Teil 19 Zweiter Hauptsatzt Seite 2 16. Thermodynamik 16.1 Einführung 16.2 Innere Energie und Arbeit 16.3 Vielteilchensysteme: Arbeit 16.4 Vielteilchensysteme: Wärme 16.5 Vielteilchensysteme: Energetisches Gleichgewicht 16.6 Spezielle Prozesse 16.7 Wärmekapazität 16.8 Reversible und irreversible Prozesse 16.9 Entropie und Wärme 16.10 Effizienz einer thermischen Maschine arbeitend in einem Carnot-Cyclus 16.11 Das Entropiegesetz 17. Statistische Mechanik 17.1 Einführung 17.2 Statistisches Gleichgewicht 17.3 Maxwell-Boltzman-Verteilungsgesetz 17.4 Statistische Definition der Temperatur 17.5 Energie- und Geschwindigkeitsverteilung der Moleküle in einem idealen Gas 17.6 Experimentelle Überprüfung des Maxwell-Boltzmann-Verteilungsgesetzes 17.7 Termisches Gleichgewicht 17.8 Entropie 17.9 Gesetz der Entropiezunahme Universität Salzburg Seite 2 27.01.2007 Musso: Physik I Teil 19 Zweiter Hauptsatzt Seite 3 Der erste Hauptsatz der Thermodynamik besagt, daß die Gesamtenergie in einem abgeschlossenen System erhalten bleibt. Zwar bleibt die Gesamtenergie stets dieselbe, aber es gibt nutzbare und weniger nutzbare Energieformen. Die Möglichkeit oder die Unmöglichkeit, eine vorhandene Energiemenge zu nutzen, ist Gegenstand des zweiten Hauptsatzes der Thermodynamik. Der Wirkunsgrad einer Dampfmaschine gehorcht dem zweiten Hauptsatz der Thermodynamik. Zwischen den Rollen, die Wärme und Arbeit spielen, herrscht eine Art Unsymmetrie, die aber aus dem ersten Hauptsatz nicht hervorgeht. Diese Unsymmetrie hängt mit der Tatsache, daß manche Prozesse irreversibel sind. Alle irreversible Prozesse gehorchen dem zweiten Hauptsatz. Universität Salzburg Seite 3 27.01.2007 Musso: Physik I Teil 19 Zweiter Hauptsatzt 19.1 Wärmekraftmaschinen und der Zweite Hauptsatz (Heat engines and the second law of thermodynamics) Seite 4 Wärmekraftmaschine: zyklisch arbeitende Vorrichtung ausgestattet mit einer Arbeitssubstanz, mit der möglichst viel Wärme in mechanische Arbeit umgesetzt wird. Die Arbeitssubstanz nimmt bei der Temperatur Th die Wärmemenge Qh auf, verrichtet die Arbeit W und gibt bei der tieferen Temperatur Tc die Wärmemenge Qc ab. Dann kehrt sie in den Anfangszustand zurück, so daß sich insgesamt ein Kreisprozess vollzieht. Das Prinzip der Dampmaschine: Der unter hohem Druck erzeugte Dampf verrichtet Arbeit am Kolben. Dampfmaschinen, erfunden Mitte des 18. Jahrhunderts, waren die ersten Wärmekraftmaschinen. Verwendung: früher ⇒ Abpumpen von Wasser aus Schächten, Antrieb von Lokomotiven heute ⇒ Antrieb von Generatoren zur Erzeugung von elektrischen Strom. Universität Salzburg Seite 4 27.01.2007 Musso: Physik I Teil 19 Zweiter Hauptsatzt Seite 5 Ottomotor: Wärmekraftmaschine mit innerer Verbrennung (im Gegensatz zur Dampfmaschine, bei der die Wärmerezeugung außerhalb des Arbeitsvolumen stattfindet) Zündung adiabatische Expansion Abkühlung bei V = konst Kompression Schematisches p-V-Diagramm für die Vorgänge im Otto-Motor: "Otto-Kreisprozess". Funktionsweise des Viertakt-Ottomotors. Universität Salzburg Seite 5 27.01.2007 Musso: Physik I Das Prinzip der Wärmekraftmaschine Teil 19 Zweiter Hauptsatzt Seite 6 Wärmereservoir: idealisierte Vorrichtung, deren Wärmekapazität so groß ist, daß sie Wärme aufnehmen oder abgeben kann, ohne daß sich ihre Temperatur merklich ändert. In der Praxis: wärmeres Reservoir = verbrennender Brennstoff oder Kraftstoff, kälteres Reservoir =umgebende Atmosphäre oder auch ein Gewässer. Anwendung des ersten Hauptsatzes der Thermodynamik auf die Kraftmaschine: aus ΔU = Q + W = 0 da Anfangszustand und Endzustand nach dem Durchlauf eines vollständigen Zyklus identisch sind ⇒ W = Qh − Qc wobei W : Betrag der von der Wärmekraftmaschine in einem vollständigen Zyklus netto verrichtete Arbeit, Qh − Qc : die dem System in einem vollständigen Zyklus netto zugeführte Wärmeenergie. Wirkungsgrad ε einer Wärmekraftmaschine: Verhältnis der abgegebenen Arbeit W zu der aus dem Wärmereservoir zugeführte Wärmemenge Qh : Universität Salzburg Seite 6 27.01.2007 Musso: Physik I Beispiel 19.1: Wirkungsgrad einer Wärmekraftmaschine Teil 19 Zweiter Hauptsatzt Seite 7 Wärmekraftmaschine, während eines jeden Zyklus Qh = 200 J, Qc = 160 J, gesucht Wirkungsgrad ε : aus Gl. (19.2) ε = ε= W Qh = W Qh ⇒ mit W = Qh − Qc = 200 J − 160 J = 40 J ⇒ 40 J = 0.20 oder 20% 200 J Beispiel 19.2: Wirkungsgrad eines idealen Verbrennungsmotors mögliches Prüfungsbeispiel Universität Salzburg Seite 7 27.01.2007 Musso: Physik I Teil 19 Zweiter Hauptsatzt Seite 8 Aufgrund von Kosten-Nutzen-Rechnungen ist man bestrebt einen möglichst hohen Wirkungsgrad zu erreichen. Dampfmaschinen: ε ≤ 40%, Verbrennungsmotoren ε ≤ 50%. Bei ε = 100% würde die gesamte dem Wärmereservoir entnommene Wärmemenge Qh in Arbeit umgesetzt, und es würde keine Wärme an das kältere Reservoir abgegeben; dies ist aber unmöglich bei zyklisch arbeitende Wärmekraftmaschinen: Der zweite Hauptsatz besagt also: Wollen wir in einem zyklischen Prozess die einem Wärmereservoir entnommene Wärmeenergie in Arbeit umsetzen, so muß ein kälteres Wärmereservoir vorhanden sein, um einen Teil der dem wärmeren Reservoir entnommenen Energie aufzunehmen. Universität Salzburg Seite 8 27.01.2007 Musso: Physik I Teil 19 Zweiter Hauptsatzt 19.2 Kältemaschinen und der Zweite Hauptsatz (Refrigerators and the second law of thermodynamics) Seite 9 Eine Kältemaschine ist im Prinzip eine Wärmekraftmaschine mit umgekehrter Arbeitsrichtung. Das Prinzip der Kältemaschine Leistungszahl ε KM > 1, üblicherweise zwischen 5 und 6; je höher die Leistungszahl, desto effizienter arbeitet die Kältemaschine. Wegen des zweiten Hauptsatzes kann die Leistungszahl nicht unedlich groß werden. Universität Salzburg Seite 9 27.01.2007 Musso: Physik I Beispiel 19.3: Eiswürfel produzieren Teil 19 Zweiter Hauptsatzt Seite 10 Wasser mit ti =10°C, Gefrierschrank mit Leistungszahl 5.5, aufgenommene Leistung P=550 W, davon 10% verwendet zum Kühlen des Wassers; gesucht: Dauer des Kühlprozesses bis Eiswürfel produziert werden W W ⇒ t= aus der Definition der Leistung P = , t P Q Q aus der Leistungszahl COP = ε KM = c ⇒ W = c , W ε KM aus Qc = Q10→0 + Qeis ( ( mit t = W P Qc ε KM = ) 375 kJ = 68.2 kJ 5.5 ⇒ Qc = Q10→0 + Qeis = 41.8 kJ + 333.5 kJ = 375 kJ ⇒ ⇒ und P = 10% von 550 W = 55 W ⇒ t = Universität Salzburg ) mit Q10→0 = mcW ΔT = (1 kg) 4.18 kJ kg-1 K -1 (10 K ) = 41.8 kJ und Qeis = mLf,W = (1 kg) 333.5 kJ kg-1 = 333.5 kJ daraus W = ⇒ 68.2 kJ 68.2 kJ = = 1260 s = 0.34 h 55 W 55 J s -1 Seite 10 27.01.2007 Musso: Physik I Teil 19 Zweiter Hauptsatzt 19.3 Die Gleichwertigkeit der Formulierung des Zweiten Hauptsatzes (Equivalence of the heat-engine and refrigerator statements) Seite 11 Die beiden vorher angegebenen Formulierungen des zweiten Hauptsatzes - die für Wärmekraftmaschinen und die für Kältemaschinen - sind absolut gleichwertig. Zum Beweis der Gleichwertigkeit der Wärmekraftmaschinen- und der Kältemaschinen-Formulierung des Zweiten Hauptsatzes der Thermodynamik: Wenn die Wärmekraftmaschinen-Formulierung des zweiten Hauptsatzes falsch ist, muss es auch die Kältemaschinen-Formulierung ⇒ Somit sind beide Formulierungen gleichwertig. Universität Salzburg Seite 11 27.01.2007 Musso: Physik I 19.4 Der Carnot'sche Kreisprozess (The Carnot engine) Teil 19 Zweiter Hauptsatzt Seite 12 Wie hoch ist der maximale Wirkungsgrad einer Wärmekraftmaschine? Carnot-Prinzip Eine zwischen zwei gegebenen Wärmereservoiren zyklisch und vollständig reversibel arbeitende Maschine nennt man Carnot-Maschine, und ihr Arbeitszyklus Carnot-Kreisprozess. Zum Carnot-Prinzip: die zwischen den beiden Reservoiren reversibel arbeitende Maschine hat den maximalen Wirkungsgrad. Jeder Prozess, der auch nur eine dieser Bedingungen nicht erfüllt, ist irreversibel. Universität Salzburg Seite 12 27.01.2007 Musso: Physik I Teil 19 Zweiter Hauptsatzt Seite 13 Der Carnot-Kreisprozess besteht aus vier reversibel ablaufenden Schritten: Der Carnot-Kreisprozess, durchgeführt mit einem idealen Gas. Universität Salzburg Seite 13 27.01.2007 Musso: Physik I Teil 19 Zweiter Hauptsatzt Seite 14 Wirkungsgrad ε C des Carnot-Kreisprozesses mit der Arbeitssubstanz ideales Gas: aus Gl. (19.2) ε = 1 − Qc Qh ⇒ Isotherme Expansion vom Zustand 1 zum Zustand 2 ⇒ Aufnahme von Qh isotherme Expansion bei Th ⇒ ΔU = 0 ⇒ Qh = −W1→2 V2 ⇒ aus ΔU = Q + W und V2 V 2 nRTh V dV = ∫ pdV = ∫ = nRTh ln 2 ; dV = nRTh ∫ V V1 V1 V1 V1 V Isotherme Kompression vom Zustand 3 zum Zustand 4 ⇒ Abgabe von Qc isotherme Kompression bei Tc ⇒ ΔU = 0 ⇒ Qc = −W3→4 = V4 ∫ pdV V3 nRTc ln V4 V = nRTc ln 3 ; V3 V4 = V4 ∫ V3 ⇒ aus ΔU = Q + W und V 4 nRTc dV dV = nRTc ∫ = V V3 V V3 Qc V4 ⇒ = V Qh Th ln 2 V1 Tc ln adiabatische Expansion ⇒ mit Gl. (18.35) ⇒ TV γ −1 = konstant ⇒ ThV2γ −1 = TcV3γ −1 adiabatische Kompression ⇒ TV γ −1 = konstant ⇒ TcV4γ −1 = ThV1γ −1 γ −1 γ −1 ⎛V ⎞ ⎛V ⎞ daraus Tc und Th durch Division eliminiert ⇒ ⎜ 2 ⎟ = ⎜ 3 ⎟ ⎝ V1 ⎠ ⎝ V4 ⎠ V Tc ln 3 Qc V4 Tc T = = ⇒ Carnot-Wirkungsgrad ε C = ε max = 1 − c V Th Qh Th Th ln 2 V1 ⇒ ⇒ V2 V3 = V1 V4 ⇒ Der Carnot-Wirkungsgrad gibt eine theoretische Obergrenze für die Effizienz von Wärmekraftmaschinen an. Universität Salzburg Seite 14 27.01.2007 Musso: Physik I Beispiel 19.4: Der Wirkungsgrad einer Dampfmaschine Teil 19 Zweiter Hauptsatzt Seite 15 Dampfmaschine, heißes Wärmereservoir bei Th = 373 K, kaltes Wärmereservoir bei Tc = 273 K: Teil a) gesucht maximaler Wirkungsgrad ε max = ε C ⇒ εC = 1− Tc 273 K = 1− = 0.268 = 26.8%; 373 K Th Teil b) Wärmekraftmaschine umgekehrt betrieben, gesucht Leistungszahl der Kältemaschine: für Kältemschine ε KM = COP = Qc W , für Wärmekraftmaschine ε = W Qh Wirkungsgrad reversibel arbeiten ε KM = COP = ⇒ ε KM = COP = Qc Qc = W ε Qh ⇒ die Maschine muß bei maximalem ⇒ mit Gl. (19.5) Qc Qh = Tc Th ⇒ Tc 273 K = = 2.73 ε CTh 0.268 ( 373 K ) Beispiel 19.5: In einer Maschine "verlorene" Arbeit Mögliches Prüfungsbeispiel Die Temperaturskala der thermodynamischen oder der absoluten Temperatur Weil der Wirkungsgrad der Carnot-Kreisprozesses nur von den Temperaturen der Wärmereservoire abhängt, kann er dazu dienen, das Verhältnis der beiden Reservoirtemperaturen unabhängig von den Eigenschaften irgendwelcher Arbeitssubstanzen zu definieren ⇒ Gl. (19.5) Q Tc = c Th Qh ⇒ Wenn man Tc Th ermitteln will, dann setzt man eine reversibel arbeitende Wärmekraftmaschine ein und mißt die Energiemengen, die als Wärme in einem Zyklus von bzw. zu einem der Reservoire übertragen werden. Universität Salzburg Seite 15 27.01.2007 Musso: Physik I Teil 19 Zweiter Hauptsatzt Seite 16 Kohlekraftwerk (USA) Geothermisches Kraftwerk (Neuseeland) Heliostaten (USA) http://energylan.sandia.gov/sunlab/ Universität Salzburg Kernreaktor (Belgien) Seite 16 Stromerzeugung mittels Windenergie (USA) http://www.sandia.gov/wind/ 27.01.2007 Musso: Physik I 19.5 Wärmepumpen (Heat pumps) Teil 19 Zweiter Hauptsatzt Seite 17 Eine Wärmepumpe ist eine Kältemaschine mit dem Zweck Gegenstände oder Räume zu erwärmen ⇒ man ist an der dem wärmeren Reservoir zugeführte Wärmemenge interessiert Qh und nicht an der dem kälteren Reservoir entzogenen Wärmemenge Qc ⇒ Definition der Leistungszahl der Wärmepumpe (der die Arbeit W zugeführt wird): ε WP = COPHP = Qh W Aus dem ersten Hauptsatz für eine zyklisch arbeitende Wärmekraftmaschine ⇒ Gl. (19.1) W = Qh − Qc ε WP = COPHP = mit Gl. (19.5) Qh W = Qh Qh − Qc Tc Q = c Qh Th = 1 Q 1− c Qh ⇒ ⇒ bei vollständig reversibler Prozessführung ⇒ ⇒ ε WP,max = COPHP,max = Th T 1 = = h . T Th − Tc ΔT 1− c Th Die Leistungszahl ε KM der Kältemaschine und die Leistungszahl ε WP der Wärmepumpe hängen miteinander zusammen: ε WP = Universität Salzburg Qh W = Qc + W W = 1+ Qc = 1 + ε KM W Seite 17 27.01.2007 Musso: Physik I Beispiel 19.7: Eine ideale Wärmepumpe Teil 19 Zweiter Hauptsatzt Seite 18 Ideal (=vollständig reversibel) arbeitende Wärmepumpe damit Wärme von der Außenluft (tc = -5°C) auf den Heizkessel (th = 40°C) eines Hauses übertragen wird. Gesucht Arbeit W , um der Heizung eine Wärmemenge Q = 1 kJ zuzuführen: aus Gl. (19.11) bzw. (19.8) ε WP = W = Qh Th ΔT = Universität Salzburg Qh Th ΔT = (1 kJ ) Qh W ⇒ W = Qh ε WP ⇒ mit Gl. (19.10) ε WP,max = COPHP,max = Th ΔT ⇒ 45 K = 0.144 kJ 313 K Seite 18 27.01.2007 Musso: Physik I 19.6 Irreversibilität und Unordnung (Irreversibility and disorder) Teil 19 Zweiter Hauptsatzt Seite 19 Alle irreversible Prozesse haben etwas gemeinsam: Durch sie geht die Gesamtheit aus System und Umgebung in einen Zustand geringerer Ordnung über. Die Bewegung eines Behälters und der Gasmoleküle in ihm. Beispiel: Ein Behälter mit vernachlässigbarer Masse enthält eine Gasmenge mit Masse mGas , und bewegt sich bei der Temperatur T mit der Geschwindigkeit v CM, gas reibungsfrei auf eine Unterlage ⇒ 1 2 mGasv cm,gas aus der Bewegung des Massenmittelpunktes des Gases 2 + Beitrag aus der ungeordneten Bewegung der Moleküle im Gas. ⇒ erstgenannte Komponente = geordnete mechanische Energie ⇒ kann direkt in Arbeit umgesetzt werden, Gesamte kinetische Energie des Gases = zweitgenante Komponente = Wärmeenergie des Gases, kann nicht vollständig in Arbeit umgesetzt werden. Annahme: Der Behälter stößt unelastisch auf eine ruhende Wand ⇒ irreversibler Prozess ⇒ 1 2 die geordnete kinetische Energie mGasv cm,gas wird in ungeordente innere Energie umgesetzt ⇒ 2 Gesamtenergie = konstant, aber T steigt ⇒ Die Gasmenge hat jetzt einen Zustand höherer Unordnung und hat einen Teil ihrer Fähigkeit verloren, Arbeit zu verrichten (vergleiche auch Beispiel 18.5). Universität Salzburg Seite 19 27.01.2007 Musso: Physik I 19.7 Entropie (Entropy) Teil 19 Zweiter Hauptsatzt Seite 20 Als Maß für die Unordnung eines Systems verwendet man die Zustandsfunktion Entropie S. Sie hängt nur vom Zustand des Systems ab, aber nicht vom Weg, auf dem dieser Zustand erreicht wurde. Wie bei der potentiellen Energie ist die Entropieänderung interessant: dQrev ist die Energie, die dem System in einem reversiblen System netto als Wärme zugeführt wird, wenn es vom Anfangs- in den Endzustand übergeht. Die Entropie des idealen Gases dQrev für ein ideales Gas: gegeben sein ein reversibler Prozess, bei dem das System die T aufnimmt ⇒ nach dem ersten Hauptsatz d U = d Qrev + d W = d Qrev − pd V ⇒ Berechnung von dS = Wärmemenge dQrev ideales Gas ⇒ mit dU = nCV dT und pV = nRT dQrev dT dV = nCV + nR T T V ⇒ nCV dT = dQrev − nRT dV V ⇒ dQrev = dS das Differential der Zustandsfunktion S ist ⇒ T dQrev T V sei CV konstant ⇒ Integration ⇒ ΔS = ∫ =nCV ln 2 + nR 2 T T1 V1 wobei Entropieänderung eines idealen Gases bei einer reversiblen Expansion oder Kompression vom Anfangszustand mit V1 und T1 zum Endzustand mit V2 und T2 . Universität Salzburg Seite 20 27.01.2007 Musso: Physik I Entropieänderungen bei verschiedenen Prozessen: Teil 19 Zweiter Hauptsatzt Seite 21 Entropieänderung bei der isothermen Expansion eines idealen Gases Aus Gl. (19.16) mit T1 = T2 = T ⇒ ΔS = nR V2 > 0 weil Expansion V2 > V1, dabei wird Qrev vom V1 Wärmereservoir auf das Gas übertragen; aus ΔU = Qrev + W = 0 ⇒ Qrev = −W = V2 V2 V dV = nRT ln 2 V1 V1 V ∫ pdV = nRT ∫ V1 Entropieänderung des Gases ΔSGas = + Q T ⇔ weil dieselbe Wärmemenge das Reservoir bei T verläßt, ist die Entropieänderung des Reservoires ΔSReser = − Gesamtentropieänderung ΔSUniv = ΔSGas + ΔSReser ⇒ Q T =0 ⇒ Im Folgenden: Wärme ⇒ Symbol Q, wobei Annahme ⇔ erforderliche Prozesse reversibel Universität Salzburg Seite 21 27.01.2007 Musso: Physik I Entropieänderung bei der freien Expansion eines idealen Gases Teil 19 Zweiter Hauptsatzt Seite 22 Freie Expansion eines idealen Gases (siehe auch Teil 18): Gesamte Anordnung hat starre Wände und ist von der Umgebung thermisch isoliert ⇒ ΔU = Q + W = 0 wobei Q = 0 und W = 0 ⇒ ideales Gas ΔT = 0 nach der Expansion. Prozess nicht reversibel, jedoch Anfangs- und Endzustand des Gases sind hier die selben wie bei der isothermen Expansion eines idealen Gases. Weil die Entropieänderung eines Systems infolge irgendeines Prozesses nur vom Anfangs- und vom Endzustand des Systems abhängt, ist die Entropieänderung des Gases bei der freien Expansion ebenso groß wie bei der reversiblen Expansion ⇒ V Gl. (19.17) ΔSgas = nR ln 2 ⇒ V1 Gas von der Umgebung isoliert ⇒ ΔSReser = 0 ⇒ Gesamtentropieänderung ΔSUniv = ΔSGas ≠ 0 ⇒ wegen V2 >V1 ⇒ ΔSUniv = ΔSGas > 0 bei einem irreversiblen Prozess. Beispiel 19.8: Freie Expansion eiens idealen Gases Expansion von n = 0.75 mol eines idealen Gases von V1 = 1.5 L auf V2 = 3 L, gesucht Entropieänderung: da T1 = T2 = T = konstant ⇒ ΔS bei der freien Expansion = ΔSisotherm bei der isothermen Expansion, dabei ΔU = 0 ⇒ Q = -W = nRT ln V2 V1 ⇒ ΔS = V ( 3.0 L ) = 4.32 J K -1 Q = nR ln 2 = ( 0.75 mol) 8.31 J mol-1 K -1 ln T V1 (1.5 L ) ( ) Aus der Tatsache, daß ein Gas sich niemals von selbst auf ein geringeres Volumen komprimiert ⇒ Universität Salzburg Seite 22 27.01.2007 Musso: Physik I Entropieänderung bei Prozessen mit konstantem Druck Teil 19 Zweiter Hauptsatzt Seite 23 Eine Substanzprobe wird bei p = konstant von T1 auf T2 erwärmt ⇒ Aufnahme der Wärme dQ = nCp dT ⇒ Eine reversible Wärmeübertragung kann angenähert realisiert werden, indem die Temperaturdifferenz zwischen T1 auf T2 in sehr viele sehr kleine Intervalle aufteilen und für jede Zwischentemperatur ein Wärmereservoir verwenden ⇒ dQ nCp dT = dS = T T T2 T dT =nCpln 2 T T1 T1 ⇒ ΔS = nCp ∫ gilt auch für eine Abkühlung ⇒ T2 <T1 ⇒ ln T2 <0 ⇒ ΔS < 0. T1 Beispiel 19.9: Entropieänderung bei einer Wärmeübertragung m1 = 1 kg Wasser bei T1 = 30°C wird in ein Kalorimeter mit m2 = 2 kg Wasser bei T1 = 90°C gegeben. Teil a) gesucht: Entropieänderung des Systems ⇒ Abgegebene Wärmemenge = − Aufgenommene Wärmemenge m1 (Tf − T1 ) = −(Tf − T2 ) m2 Tf = m1 m Tf − 1 T1 = −Tf + T2 m2 m2 ⇒ ⇒ Qab = m1c p,w (Tf − T1 ) = −Qauf = −m2c p,w (Tf − T2 ) ⇒ ⎛ m ⎞ m ⇒ Tf ⎜ 1 + 1 ⎟ = 1 T1 + T2 m2 ⎠ m2 ⎝ (1 kg)( 303 K ) + ( 2 kg)( 363 K ) = 343 K, ⇒ 3 kg aus Gl. (19.20): ΔSab = n1Cp,W ln ΔSauf = m2c p,W ln m1 T + T2 m2 1 m T + m2T2 ⇒ Tf = = 1 1 m m1 + m2 1+ 1 m2 mc ( 343 K ) = 0.519 kJ K -1 Tf T T = n1 1 p,W ln f = m1c p,W ln f = (1 kg ) 4.18 kJ kg-1 K -1 ln T1 n1 T1 T1 ( 303 K ) ( ( 343 K ) = −0.474 kJ K -1 Tf = ( 2 kg ) 4.18 kJ kg-1 K -1 ln T2 ( 363 K ) ( ) ) ⇒ ΔSsys = ΔSab + ΔSauf = 0.0453 kJ K -1 Teil b) gesucht: Entropieänderung des Universums ⇒ aus dem Kalorimeter entweicht keine Wärme ⇒ ΔSUniv = ΔSSys + ΔSUmgeb = 0.0453 kJ K -1 + 0 kJ K -1 = 0.0453 kJ K -1 > 0 Universität Salzburg Seite 23 27.01.2007 Musso: Physik I Entropieänderung bei einem unelastischen Stoß Teil 19 Zweiter Hauptsatzt Seite 24 Bei einem unelastischen Stoß ⇒ mechanische Energie in thermische Energie umgewandelt ⇒ irreversibler Prozess ⇒ Zunahme der Entropie des Universums. Ein Block mit Masse m fällt aus der Höhe h und schlägt unelastisch auf den Boden. Annahme: überall gleiche Temperatur T; Block, Boden und Atmosphäre als isoliertes System, kein Wärmeaustausch mit der Umgebung ⇒ Q = mgh ⇒ Q mgh = = ΔSUniv . aus Gl. (9.12) ΔS = T T Entropieänderung bei der Wärmeleitung zwischen Wärmereservoiren Die Wärmeleitung ist ein irreversibler Prozess ⇒ die Entropie des Universums nimmt zu. Eine Wärmemenge Q wird von einem wärmeren Reservoir mit Th zu einem kälteren Reservoir mit Tc übertragen, wobei der Zustand des Reservoir durch T und U beschrieben wird Bei Wärmeleitung ⇒ das wärmere Reservoir gibt Q ab ⇒ ΔSh = − Q auf ⇒ ΔSc = Universität Salzburg Q Tc ⇒ Q Th ⇒ und das kältere Reservoir nimmt Entropieänderung des Universums ΔSUniv = ΔSh + ΔSc = − Seite 24 Q Th + Q Tc > 0 da Tc <Th 27.01.2007 Musso: Physik I Entropieänderung bei einem Carnot-Prozess Teil 19 Zweiter Hauptsatzt Seite 25 Ein Carnot-Prozess besteht aus reversibel durchlaufenen Schritten ⇒ Entropieänderung des Universums = 0. Wärmeres Reservoir: ΔSh = − mit Gl. (19.7) Q Tc = c Th Qh bzw. Qh Th Qh Th kälteres Reservoir ΔSc = , = Qc Tc ⇒ Qc Tc ΔSUniv = ΔSh + ΔSc = − ⇒ Qh Th + Qc Tc =− Qh Th + Qh Th =0 Beispiel 19.10: Entropieänderung in einem Carnot-Kreisprozess Wärmekraftmaschine mit Carnot-Wirkungsgrad, entnimmt aus dem wärmeren Reservoir Qh = 100 J bei Th = 400 K, verrichtet Arbeit, und gibt Qc bei Tc = 300 K an das kältere Reservoir ab. Gesucht: Entropieänderung ΔSh = − Qh Th =− Qc = Qh − W ⇒ es gilt ΔSUniv = ΔSh + ΔSc 100 J = −0.250 J K -1 400 K ⇒ ΔSc = Qc Tc = Qh − W Tc mit Carnot-Zyklus Gl. (19.6) ε max = ε C = 1 − ⇒ Tc Th mit Wirkungsgrad ε = W Qh der Wärmekraftmaschine Gl. (19.2) ⎛ T ⎞ ⇒ W = ε max Qh = ⎜ 1 − c ⎟ Qh ⎝ Th ⎠ ⇒ ⎛ T ⎞ Qh − ⎜ 1 − c ⎟ Qh Q 100 J ⎝ Th ⎠ ΔSc = = h = = 0.250 J K -1 Tc Th 400 K ⇒ ΔSUniv = ΔSh + ΔSc = −0.250 J K -1 + 0.250 J K -1 = 0 J K -1 Universität Salzburg Seite 25 27.01.2007 Musso: Physik I Beispiel 19.11: Das Temperatur-Entropie-Diagramm Teil 19 Zweiter Hauptsatzt Seite 26 Entropie ist eine Zustandsfunktion ⇒ Thermodynamische Prozesse können in einem S -T -, S -V -, oder S -p-Diagramm dargestellt werden ⇒ gesucht: S-T-Diagramm für den Carnot-Kreisprozess: Carnot-Kreisprozess: (a) reversible isotherme Expansion von 1 nach 2 ⇒ (b) reversible adiabatische Expansion von 2 nach 3 ⇒ (c) reversible isotherme Kompression von 3 nach 4 ⇒ (d) reversible adiabatische Kompression von 4 nach 1: Während der isothermischen Vorgänge T = konstant ⇒ Q aufgenommen (von 1 nach 2) oder abgegeben (von 3 nach 4) ⇒ S steigt (von 1 nach 2) oder sinkt (von 3 nach 4); während der adiabatischen Vorgänge ΔQ = 0 ⇒ S = konstant, aber T steigt (von 4 nach 1) oder sinkt (von 2 nach 3) adiabatische Expansion isotherme Expansion isotherme Kompression adiabatische Kompression Universität Salzburg Seite 26 27.01.2007 Musso: Physik I Teil 19 Zweiter Hauptsatzt 19.8 Entropie und die Verfügbarkeit der Energie (Entropy and the availability of energy) Seite 27 Bei einem irreversiblen Prozess bleibt gemäß dem ersten Hauptsatz der Thermodynamik die Gesamtenergie erhalten, aber ein Teil von ihr geht in eine Form über, in der sie nicht mehr als Arbeit nutzbar ist ⇒ sie wird "entwertet". Beispiel herabfallender und unelastich aufschlagender Block ⇒ Block in der Höhe h ⇒ potentielle Energie mgh, die zum Verrichten von Arbeit genutzt werden kann ⇒ nach dem Aufschlag ⇒ mgh Entropieänderung ΔS = und Energie nicht mehr als Arbeit verfügbar, da umgewandelt in innere Energie T des Blocks und seiner Umgebung ⇒ entwertete Energiemenge = mgh = T ΔSUniv ⇒ Beispiel 19.12: Noch einmal: der anstoßende Behälter mit Gas Behälter mit vernachlässigbarer Masse und Gasfüllung mit mGas = 2.4 kg und T = 293 K, gleitet auf Tischplatte mit v = 3 m s-1, und prallt unelastisch gegen die Wand. Gesucht: Entropieänderung des Universums Anfängliche Bewegungsenergie Ekin = 1 mGasv 2 2 aus Behälter, Wand und Umgebung ⇒ Entropieänderung des Universums ΔSUniv Universität Salzburg ⇒ ⇒ Aufprall ⇒ Umsetzung in innere Energie des Systems Wärmemenge Q = 1 mGasv 2 dem System reversibel zugeführt ⇒ 2 ( 1 1 mGasv 2 ( 2.4 kg) 3 m s-1 Q 2 = = = 2 T T 293 K Seite 27 ) 2 = 0.0369 J K -1 27.01.2007 Musso: Physik I 19.9 Entropie und Wahrscheinlichkeit (Entropy and the probability) Teil 19 Zweiter Hauptsatzt Seite 28 Entropie ist ein Maß dafür, wie hoch der Odnungsgrad des betrachteten Systems ist. Ein Zustand höherer Ordnung tritt mit geringerer Wahrscheinlichkeit auf, ein Zustand geringerer Ordnung dagegen mit einer höheren Wahrscheinlichkeit ⇒ bei irreversiblen Prozessen geht das Universum stets von einem Zustand geringerer Wahrscheinlichkeit in einen Zustand höherer Wahrscheinlichkeit über. Berechnung der Wahrscheinlichkeit, daß eine Gasmenge mit m Teilchen spontan von V1 auf V2 < V1 kontrahiert: ⎛V ⎞ Wahrscheinlichkeit p, daß die n Teilchen in V2 befinden p = ⎜ 2 ⎟ ⎝ V1 ⎠ m Entropieänderung ΔS bei Kompression von V1 auf V2 < V1 ΔS = nR ln ΔS = nR ln V2 nR = ln p = kB ln p V1 nNA ⇒ da p ≈ 0 ⇒ ΔS < 0 ⇒ ln p = m ln V2 V = nNA ln 2 , V1 V1 V2 R < 0 ⇒ mit kB = V1 NA ⇒ ⇒ die spontane Kompression von V1 auf V2 < V1 ist nach dem zweiten Hauptsatz der Thermodynamik praktisch unmöglich. Thermodynamische Gesetzmäßigkeiten dürfen nur auf makroskopische Systeme angewendet werden (also Systeme mit sehr vielen Teilchen, zur Erinnerung 1 Mol = 6 × 10 23 Teilchen) Universität Salzburg Seite 28 27.01.2007 Musso: Physik I 19.10 Der Dritte Hauptsatz Teil 19 Zweiter Hauptsatzt Seite 29 Je niedriger die Temperatur Tc des kälteren Reservoir ist, desto geringer ist die nach dem Carnot-Prinzip maximal mögliche Leistungszahl ε KM einer Kältemaschine: aus Beispiel 19.4 ε KM = Qc Tc Tc = = W ε maxTh ⎛ Tc ⎜1− ⎝ Th ⎞ ⎟ Th ⎠ = Tc ∼ Tc Th − Tc ⇒ Dritter Hauptsatz der Thermodynamik: Unerreichbarkeit des absoluten Nullpunkts Es ist unmöglich, durch irgendeinen Prozess, und sei er noch so idealisiert, die Temperatur irgendeines Systems in einer endlichen Anzahl von Schritten auf den absoluten Temperaturnullpunkt zu senken ⇒ Dritter Hauptsatz der Thermodynamik: Nernst'sches Theorem Am absoluten Nullpunkt der Temperatur ist die Entropie völlig geordneter Kristalle der chemischen Elemente gleich null. Daher hat jede Verbindung von Elementen eine positive Entropie. Universität Salzburg Seite 29 27.01.2007