Aromaten - bei DuEPublico
Werbung
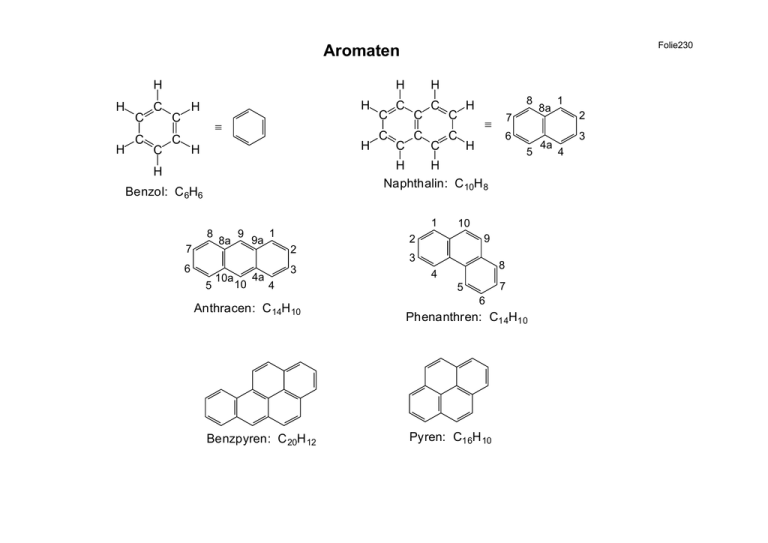
Folie230 Aromaten H H H C C C C H H C ≡ C H H C C H H C C C C C C 8 H C 7 ≡ C 6 H 5 H H Naphthalin: C 10H 8 H Benzol: C 6H6 8 7 6 5 8a 10a 9 10 9a 4a 1 1 2 3 4 Anthracen: C 14H 10 Benzpyren: C 20H 12 10 9 2 3 8 4 7 5 6 Phenanthren: C14H10 Pyren: C16H 10 8a 4a 1 2 3 4 Vergleich der reaktiven Eigenschaften von Cyclohexen und Benzol 2 H Reagenz / Reaktion Cyclohexen: Benzol: 1 H KMnO4 Oxidation HO OH 2 H H cis-1,2-Cyclohexandiol keine Reaktion 1 Br H Br2 / CCl4 2 1 Br keine Reaktion H trans-1,2-Dibromcyclohexan H I H-I elektrophile Addition H2 / Ni katalytische Hydrierung H keine Reaktion H Iodcyclohexan Cyclohexan rasch bei 25°C, 1 atm. H2-Druck Cyclohexan langsam bei 100-200°C, 100 atm. H2-Druck Folie231 Folie232 Die Reaktion und Resonanzenergie von Benzol Br H + H Br elektrophile Substitution ∆ Br 2 FeBr3 H H ∆H [kcal/mol] [kJ/mol] Br Br elektrophile Addition ^ 4.184 kJ) (1 kcal = ber.: 1,3,5-Cyclohexatrien + 3 H2 Benzol R.E. = -36.0 (151) + 3 H2 1,3-Cyclohexadien ber.: 1,3-Cyclohexadien + 2 H2 + 2 H2 R.E. = 1.8 3 × 28.6 = 85.8 (359) 2 × 28.6 = 57.2 (239) Cyclohexen + H2 55.4 (232) 49.8 (208) 28.6 (120) Resonanzenergie: R.E. = ∆ Hexp. - ∆H ber. = 49.8 - 85.8 = -36 kcal/mol Folie233 H 120° 134pm 147pm H H 6 gleiche CC-Bindungslängen: 139pm H <) CCC und <) 120° H 134pm 1,3-Butadien (alternierende Bindungslängen) HCC 120° H 139pm Benzol Kreis symbolisiert das delokalisierte π-Elektronensystem Resonanzstrukturen energetisch niedrigste, bindende π-MO des Benzols (ohne Knotenebene) Folie234 Hückel-Regel (E. Hückel 1933) Eine Verbindung wird als aromatisch bezeichnet, wenn folgende Bedingungen erfüllt sind: 1. Cyclisch konjugiertes π-System. (die Konjugation darf nicht durch sp3-hybridisierte Kohlenstoffe unterbrochen sein.) 2. Das System muss [4n+2] π-Elektronen enthalten (n = 0, 1, 2, 3,...) 3. Das Gebot der Planarität der Ringe, damit eine maximale Überlappung aller p-Atomorbitale erreicht wird. cyclisch konjugiert (+) cyclisch konjugiert (+) 6π: [4n+2], n=1 planar (+) ⇒ aromatisch (+) 4π: nicht [4n+2] planar (-) ⇒ antiaromatisch (+) Folie235 π-MO-Schema von Benzol S - Symmetrisch A - Antisymmetrisch Symmetrieebene (1) Symmetrieebene (2) π6* SA AA π4* SS π5* 3 2 2 AS π2 SA π3 SS 1 Zahl der Knotenebenen: 1 0 π1 Der Grundzustand besitzt eine abgeschlossene Elektronenschale (Singulett-Grunzustand). π-MO-Schema von 1,3-Cyclobutadien 2 1 1 Zahl der Knotenebenen: 0 quadratisches Cyclobutadien: jedoch wird als Triplett erwartet rechteckig, ⇒ oszillierende Doppelbindungen Folie236 Nicht-benzoide Aromaten (cyclisch konjugierte [4n+2] π-Systeme) Cyclopentadienyl-Anion Cyclopropyl-Kation H H H ≡ H H + H H C5 H5 C3 H3 : 2 π-Elektronen (n = 0) Furan Pyrrol S Thiophen 5-Ring-Heterocyclen (Heteroaromaten) Cycloheptatrienyl-Kation Tropylium-Kation H H H H ≡ H H + H C7 H7 : 6 π-Elektronen (n = 1) - H : 6 π-Elektronen (n = 1) N H O ≡ Folie237 Nicht-benzoide Aromaten (cyclisch konjugierte [4n+2] π-Systeme) Folie238 n = 2: 10 π-Elektronen HH 1,6-Methano[10]annulen planar, stabil, aromatisch [10] Annulen nicht planar und nicht stabil 1 2 3 4 5 6 7 H H 8 18 H H 9 17 16 15 H H 14 13 12 11 Cyclooctadecanonaen [18] Annulen C18H 18 : 18 π-Elektronen (n = 4) N N Porphin konjugiertes 18 π-Elektronensystem H H N N 10 CH 3 H3 C N N CH 2CH3 CH3 H3C Mg N N H3 C O CH 2 RO C CH 2 H O COOCH3 Chlorophyll a: grünes Pflanzenpigment N N Fe CH 3 H3C N HOOC CH2 CH2 N CH3 CH2CH2COOH Häm: roter Blutfarbstoff Folie239 Cycloalkene (die cyclische Konjugation ist durch sp3-Zentren unterbrochen) sp 3 sp 3 H H H H H H sp 3 C3 H4 : Cyclopropen C5 H6 : 1,3-Cyclopentadien C7 H8 : 1,3,5-Cycloheptatrien Elektrophile aromatische Substitution Friedel-Crafts-Acylierung O C R HCl + Halogenierung: X = Cl, Br X + HX X = Cl: Chlorbenzol C6H 5Cl X = Br: Brombenzol C6 H5Br Keton R C Friedel-Crafts-Alkylierung R + HCl O AlCl3 Fe oder FeX3 Cl R Cl AlCl3 Benzol: C6 H6 AlCl3 - HCl H + H2 C CH CH 3 Nitrierung N HNO3 Alkylbenzol Beispiel: Cl + H3 C CH CH 3 Folie240 H2 O CH 3 CH O O H2 SO 4 (konz.) + H2 O Nitrobenzol: C 6H5 NO 2 SO 3 H2 SO 4 (konz.) Sulfonierung SO 3H CH 3 Benzolsulfonsäure: C6 H5 SO 3H Isopropylbenzol: Cumol Benzolsulfonsäure: O S OH + H2 O O O S O + O + H3 O starke Säure vgl. O HO S OH O Folie241 Mechanismus der elektrophilen aromatischen Substitution Allgemein: 3 H sp H + E E HO NO 2 + 2 HOSO 3H H3 O H H + NO 2 langsam + H H E E NO 2 O N O Elektrophil H O N + 2 -H OSO3 H H NO 2 NO 2 O ≡ Resonanzstrukturen H NO 2 H ≡ 2 HOSO3 H H3 O NO 2 + SO 3 OSO3 H SO 3 + H3 O + HOSO 3H SO 3 + OSO3 H SO 3H SO 3 NO 2 + SO 3 + OSO3 H Elektrophil H H + schnell + H2 O + HOSO 3H Benzolsulfonsäure -starke Säurein H2O vollständig dissoziiert! E Mechanismus der elektrophilen aromatischen Substitution H H D D +D O 2 + D3 O FeX3 + X2 X3 Fe X X + H OD2 Elektrophil X = Cl, Br H H + X X FeX3 langsam X + X FeX schnell 3 X H X + HFeX3 + FeX3 (Katalysator) X R Cl + AlCl3 R + AlCl4 H H + R langsam R + R + HAlCl4 H Cl + AlCl3 AlCl4 Folie242 Elektrophile aromatische Substitution von Naphthalin H 1 8 H2 SO 4 7 2 (SO3) 80°C 6 3 5 4 H H (SO3) 160°C SO 3 1-Naphthalinsulfonsäure (kinetisch kontrolliert) SO 3H H2 SO 4 H SO 3H H SO 3 2-Naphthalinsulfonsäure (thermodynamisch kontrolliert) H SO 3 Allylresonanz keine Allylresonanz, weniger stabil Folie243 Folie244 ortho X CH 3 ortho o-Bromtoluol para H3 C CH 3 Br meta meta CH 2CH3 SO 2- NO 2 m-Ethylnitrobenzol SO 3H p-Toluolsulfonsäure p-Toluolsulfonylrest = Tosylrest Ts- CH 2 Phenyl- Benzyl- 1-Naphthyl- 2-Naphthyl- Rest Folie245 Alkohole und Phenole Alkohol δO + + δ Hδ R Wasser δO + δ+ Hδ H δ + Ar Alkylrest O δ- Hδ + Ar = Arylrest R Nomenklatur der Alkohole H3 C OH Methanol Methylalkohol H3 C CH 2 OH Ethanol Ethylalkohol H3 C CH 2 CH 2 OH 1-Propanol n-Propylalkohol H3 C CH CH 3 2-Propanol Isopropylalkohol H3 C CH CH 2 OH CH 3 2-Methyl-1-propanol Isobutylalkohol H3 C CH CH CH 2 OH 3-Buten-2-ol OH CH 2 OH Benzylalkohol C OH Triphenylmethanol 3 2 1 CH 2 CH 2 OH 2-Phenylethanol Folie246 Nomenklatur der Alkohole Glykole (2 OH-Funktionen) CH 2 CH 2 OH OH H3 C CH CH 2 OH OH CH 2 CH 2 CH 2 OH H H OH OH OH Ethylenglykol 1,2-Ethandiol Propylenglykol 1,2-Propandiol Trimethylenglykol 1,3-Propandiol Glycerine (3 OH-Funktionen) CH 2 CH CH 2 OH OH OH Glycerin 1,2,3-Propantriol cis-1,2-Cyclopentandiol Folie247 Phenole 8 OH 7 6 5 OH α 9 1 β 2 10 α β OH 3 O 2N 4 2-Naphthol (β-Naphthol) 1-Naphthol (α-Naphthol) Phenol OH p-Nitrophenol O OH O C CH 3 CO 2H CO 2H Salicylsäure (o-Hydroxybenzoesäure) Analgetikum, Antipyretikum, Antirheumatikum (Verzögerung der Blutgerinnung) Acetylsalicylsäure (Handelsname: Aspirin, ASS) Zweiwertige Phenole OH OH Brenzkatechin OH OH OH Resorcin OH Hydrochinon Folie248 Cl 5 6 1 OH 2 Cl 4 3 2 Cl 2,4,5-Trichlorphenol Ausgangsstoff für Herbizide (Unkrautbekämpfungsmittel) ∆T K2 CO 3 - 2 HCl Cl O Cl Cl O Cl „Dioxin“ (2,3,7,8-Tetrachlordibenzo-p-dioxin, TCDD) „Seveso-Gift“ ca. 100000x toxischer als NaCN Folie249 Physikalische Eigenschaften der Alkohole Die Struktur von Alkoholen ist ähnlich der von Wasser. 96pm O H 110pm 143pm O H H 109° 104.5° 96pm C H H H 108.9° Methanol Wasserstoffbrückenbindungen R H O BDE = 21 kJ/mol 207pm R BDE = 435 kJ/mol O 96pm H H H O O R R zwischen Alkoholmolekülen H R O R O H H O H H O H zwischen Alkohol- und Wassermolekülen Physikalische Eigenschaften der Alkohole Gute Löslichkeit in H2O: bis C3 und (CH3)3COH vollkommen mischbar C4 gut löslich ab C5 weniger löslich Hohe Siedepunkte: Molmasse Siedepunkt [°C] Dipolmoment [D] CH3OH 32 +64.5 CH 3 CH 3 30 -88.5 CH3F 34 -79.0 CH 3 CH 2 CH 2 CH 2 OH 74 118 CH 3 CH 2 CH 2 CH 2 CH 3 72 36 0 CH 3 CH 2 O CH 2 CH 3 74 35 1.18 CH 3 CH 2 CH 2 CH O 72 76 2.72 1.63 Folie250 Industrielle Erzeugung von Alkoholen Erdöl Crackprozess R CH CH 2 Alken + H2 O R CH CH 2 (H +) OH H R = H: Ethanol-Synthese CH 2 CH 2 OH H Wasser-Addition: MarkownikowOrientierung Methanol-Synthese (katalytische Hydrierung von Kohlenmonoxid) 350-400°C CO + 2 H 2 Katalysator CH 3OH Methanol Methanol ist äußerst toxisch, da beim Abbau im Körper Ameisensäure entsteht, die nur langsam weiter abgebaut wird und den pH-Wert der Zellen empfindlich stört ⇒ Erblindung. CH 3OH H2 C O Formaldehyd Fette CH 2 CH 2 H C O OH Ameisensäure Reduktion Ziegler- CH 3(CH2 CH2 )nCH2 OH geradkettige Alkohole mit gerader Anzahl von C-Atomen Natta-Oligomerisation + Luft Verwendung: Waschmittel und Detergentien Folie251 Folie252 Industrielle Erzeugung von Alkoholen Rohrzucker Melasse CH 3 CH 2OH Zucker Getreide Stärke Fuselöle Vergärung mit Hefe Fuselöle: Propanol, 2-Methyl-1-propanol, Isopentylalkohol, optisch aktiver Amylalkohol CH 3 CH 2 CH CH 2OH CH 3 Ethanol: Hypnotikum; Esterkomponente für CH 3 C Basis für Acetaldehyd: CH 3 C Isopropanol: CH 3 CH CH 3 OH O H O „Essigester“; Lösungsmittel; O CH 2 CH 3 und Essigsäure: CH 3 C O OH : Frostschutzadditiv (verhindert Vergaservereisung); Basis für Aceton: CH 3 C CH 3 O Chemische Reaktionen von Alkoholen und Phenolen Folie253 Alkohole und Phenole sind Brønstedt-Säuren und Basen (Ampholyte). O +H R O R H Base H H Oxoniumion [H 3O +] [RO ] O R H + H2O Säure R O + H 3O + KS = O Ar H + H2O Phenol Ar O + H 3O + Ar OH : CH 3OH : KS = 10-15.5 M; pKS = 15.5 : : KS = 10-15.7 M; pKS = 15.7 H2 O [ROH] KS = 10-10 M; pKS = 10 OH Phenol NO 2 OH KS = 5.6 10-1 M; pKS = 0.25 Phenole sind stärkere Säuren als Alkohole oder Wasser. O 2N OH O + + Na + OH NO 2 2,4,6-Trinitrophenol Pikrinsäure + Na+ + H2O Einfluss der Nitrogruppe in o- oder p-Stellung. Phenolat-Anion ist resonanzstabilisiert. O O O O O O N O O N O O Herstellung von Natrium- und Kaliumalkoholaten (starke Basen) H3 C CH 2 OH + Na Ethanol H3 C CH 2 O t-Butanol + ½ H2 Natriumethoxid NatriumMetall CH 3 H3 C C OH CH 3 Na Folie254 CH 3 + ½ H2 H3 C C O K CH 3 Kalium-t-butoxid + K KaliumMetall Oxidation von Alkoholen R CH 2 OH primär R1 R 2 CH OH sekundär 1 R R2 C OH R3 tertiär [O] R C -2H O H [O] R C O [O] ≡ Oxidationsmittel OH z. B. CrO 3 ; K2 Cr2 O7 Aldehyd Carbonsäure meist nicht stabil, wird weiter oxidiert R1 R 2 C O Keton +6 Aufstellung der Redox-Gleichung -1 3× R CH 2 OH +6 R C 2× CrO3 + 3 e- + 6 H+ orangerot 3 R CH 2 OH + 2 CrO 3 + 6 H + +1 O + 2 H+ + 2 e- (Oxidation) H Cr 3+ + 3 H2 O (Reduktion) grün 3 R C O + 2 Cr3+ + 6 H2 O H Stellen Sie die Redox-Gleichung für die Oxidation von primären Alkoholen zu Carbonsäuren auf. Folie255 Mehrwertige Alkohole (gut wasserlöslich) O O2 H2 C CH 2 Ag-Kat. Ethen H2 C OH OH CH 2 CH 2 H2 O CH 2 (NaOH) Ethylenoxid Oxiran Epoxid Ethylenglykol (zweiwertiger Alkohol) ca. 50% in H2O ⇒ Frostschutzmittel H2O: Schmp. 0°C, HO–CH2–CH2–OH: Schmp. -11.5°C (1:1) Mischung: Schmp. -40°C ⇒ Polyesterfaser, Polyethylenglykol (Kunststoff) R1 O R2 O R3 O C C C O O O CH 2 CH CH 2 3 Na+ OH EsterVerseifung OH CH 2 CH CH 2 5 OH 6 OH myo-Inosit + Glycerin Basisalkohol für Fette und Phospholipide (Zellmembran) Fett (Ester) HO OH 3 2 OH 4 OH 1 OH OH H ≡ OH OH 2 4 H3 HO H HO OH 6 5 1 OH H H H Sesselkonformation Cyclohexanhexol (im Stoffwechsel bedeutsam) sechswertiger Alkohol R1 C O O Na + 2 + R C O O Na + 3 + R Natriumsalz der Fettsäuren ⇒ Seife H HO HO OH H O OH H OH H H β-D-Glucose (Traubenzucker) Kohlenhydrat: C6(H2O)6 C O O Na +