Kompendium 10.2.1 Alkohole
Werbung
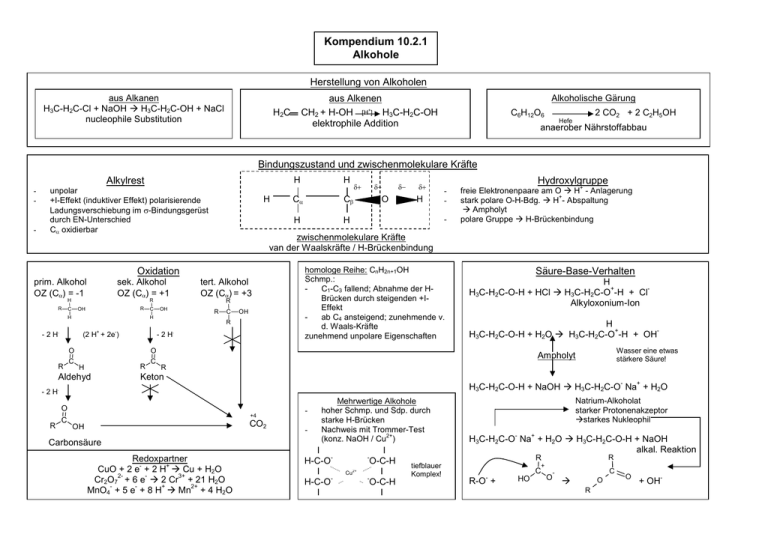
Kompendium 10.2.1 Alkohole Herstellung von Alkoholen aus Alkanen H3C-H2C-Cl + NaOH H3C-H2C-OH + NaCl nucleophile Substitution aus Alkenen CH2 + H-OH [H+] H3C-H2C-OH elektrophile Addition H2C Alkoholische Gärung C6H12O6 2 CO2 + 2 C2H5OH Hefe anaerober Nährstoffabbau Bindungszustand und zwischenmolekulare Kräfte H Alkylrest - - unpolar +I-Effekt (induktiver Effekt) polarisierende Ladungsverschiebung im σ-Bindungsgerüst durch EN-Unterschied Cα oxidierbar H sek. Alkohol OZ (Cα) = +1 R R H C R OH H C H - 2 H. (2 H+ + 2e-) R OH O C R H Aldehyd tert. Alkohol OZ (Cα) = +3 R R C OH R - 2 H. O C δ+ Cα Cβ H H δ− O δ− δ+ H - homologe Reihe: CnH2n+1OH Schmp.: C1-C3 fallend; Abnahme der HBrücken durch steigenden +IEffekt ab C4 ansteigend; zunehmende v. d. Waals-Kräfte zunehmend unpolare Eigenschaften + freie Elektronenpaare am O H - Anlagerung + stark polare O-H-Bdg. H - Abspaltung Ampholyt polare Gruppe H-Brückenbindung Säure-Base-Verhalten H + H3C-H2C-O-H + HCl H3C-H2C-O -H + Cl Alkyloxonium-Ion H + H3C-H2C-O-H + H2O H3C-H2C-O -H + OH Wasser eine etwas stärkere Säure! Ampholyt R Keton - + H3C-H2C-O-H + NaOH H3C-H2C-O Na + H2O - 2 H. R Hydroxylgruppe - zwischenmolekulare Kräfte van der Waalskräfte / H-Brückenbindung Oxidation prim. Alkohol OZ (Cα) = -1 H O C +4 CO2 OH Carbonsäure Redoxpartner + CuO + 2 e + 2 H Cu + H2O 23+ Cr2O7 + 6 e 2 Cr + 21 H2O + 2+ MnO4 + 5 e + 8 H Mn + 4 H2O - Mehrwertige Alkohole hoher Schmp. und Sdp. durch starke H-Brücken Nachweis mit Trommer-Test 2+ (konz. NaOH / Cu ) I H-C-O I H-C-O I I O-C-H I O-C-H I Natrium-Alkoholat starker Protonenakzeptor starkes Nukleophil - + H3C-H2C-O Na + H2O H3C-H2C-O-H + NaOH alkal. Reaktion Cu 2+ R R - tiefblauer Komplex! + C - R-O + HO O C - O R O - + OH











