Vorlesung Biochemie
Werbung

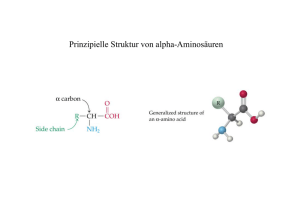
Einführung in die Biochemie, Aminosäuren Prof. Dr. Albert Duschl Themen der Vorlesung Einführung in die Biochemie; Aminosäuren Peptide und Proteine Enzyme Proteinfunktionen Kohlenhydrate Lipide Nukleotide und Nukleinsäuren Proteinbiosynthese Bioenergetik Primärstoffwechsel Antikörper Molekulare Medizin Allgemeine Informationen Die Vorlesung findet als Doppelstunde (90 min) an 12 Terminen statt. Diese Präsentation ist als pdf-file über die Homepage meiner Arbeitsgruppe erhältlich: www.uni-salzburg.at/tapir Die Vorlesung wird von einer Multiple Choice Prüfung abgeschlossen. Dabei müssen nur die Lösungsblätter abgegeben werden, so dass alte Klausuren frei erhältlich sind. Bestehen der Prüfung ist Voraussetzung für die Teilnahme an den Molekularbiologischen und Biochemischen Übungen. Es gibt keine Anwesenheitspflicht, aber wenn Sie nicht kommen und nachher durchfallen schieben Sie es bitte nicht auf die Vorlesung. Die pdf-files reichen zur Prüfungsvorbereitung alleine nicht aus, ohne biochemisches Lehrbuch werden Sie also nicht auskommen. Weitere Fragen? Zum Inhalt der Vorlesung: [email protected] oder lieber gleich nach der Vorlesung Zum Organisatorischen: [email protected] oder über PLUSonline FAQ Wann ist die nächste Prüfung? In PLUSonline steht noch kein Termin. Dann steht noch keiner fest. Wir können Räume nicht so lang im Voraus buchen. Wann ist aber ungefähr Prüfung? Normal sind zwei Termine direkt nach Ende der Vorlesungsserie, einer Ende des Semesters oder Anfang der Semesterferien, und einer Ende der Semesterferien. Ich habe noch nicht alle Voraussetzungen laut STEOP, kann ich Prüfung schreiben? Das ist leider vom Studienrecht her nicht möglich. Ich hätte gerne eine mündliche Prüfung. Machen Sie sowas? In gut begründeten Ausnahmefällen, etwa bei körperlicher Behinderung. Sonst nicht. Ich muss die Prüfung bestanden haben um die Übungen „Molekularbiologie und Biochemie“ zu machen, richtig? Richtig. Das stand übrigens schon auf der letzten Folie. Ich habe gehört bei Ihnen und manchen anderen Leuten kann man nur arbeiten wenn man Molekularbiologie studiert hat, aber nicht mit Biologie. Stimmt das? Nein, die beiden Studien werden überall gleichwertig behandelt. Entscheidend ist nur was Sie können. Der Zugang zu Modulen, Bachelor- und Masterarbeiten ist gleich. Empfohlene Lehrbücher Umfangreichere Lehrbücher: Löffler/Petrides: Biochemie und Pathobiochemie Stryer: Biochemie Nelson/Cox: Lehninger Biochemie Voet/Voet/Pratt: Lehrbuch der Biochemie Horton et al.: Biochemie Billigere Alternativen: Löffler: Basiswissen Biochemie Walker/McMahon: Biochemistry Demystified Gar nicht schlecht: Biochemie für Dummies Eher ein Nachschlagewerk, aber auch nicht teuer: Koolman/Röhm: Taschenatlas der Biochemie Die gleichen Bücher brauchen Sie für weitere Veranstaltungen, z.B. VO Biochemie des Stoffwechsels und UE Molekularbiologie und Biochemie, beide im 3. Semester Grundlagen der Biochemie Biochemie untersucht die molekularen Grundlagen des Lebens. Eine Art Gegenpol bildet die Morphologie, die die strukturellen Grundlagen des Lebens untersucht. Die Disziplin ist als selbständiges Fach um 1900 entstanden als Synthese aus der physiologischen Chemie und der Naturstoffchemie. In Salzburg wird die Biochemie am Fachbereich Molekulare Biologie vertreten. So sieht ihr Professor aus "Biowissenschaften und Gesundheit" Gemäldesammlung des Fachbereichs Molekulare Biologie Universität Salzburg Das wichtigste Molekül: Wasser Dipol Hohe spezifische Wärme (Wärmekapazität) Hohe Verdunstungswärme Bildet Wasserstoffbrückenbindungen Bildet Hydrathüllen Gut wasserlösliche Substanzen: Hydrophil Gemischte Löslichkeit: Amphiphil Schlecht wasserlösliche Substanzen: Hydrophob Dissoziiert in OH- (Hydroxyl-Ionen) und H+ (Protonen) Die Protonenkonzentration wird durch den pH-Wert angegeben: Der pH-Wert ist der negative dekadische Logarithmus der H+-Konzentration. Beispiel: [H+] = 10-7 mol/l → pH = 7 © Voet/Voet/Pratt: Lehrbuch der Biochemie Mol? van-der-Waals-Radius? 1 Mol = 6.023 ∙ 1023 Moleküle (Avogadro-Zahl, Loschmidt-Zahl) 1-molal = 1 Mol Substanz pro 1 l (kg) Lösungsmittel 1-molar = 1 Mol Substanz pro 1 l Lösung 1 Mol H2O = 18.016 g Der van-der-Waals-Abstand ist die kürzest mögliche Entfernung zwischen zwei nicht gebundenen Atomen. Die Distanz einer Bindung muss also geringer sein als die Summe der beiden van-der-Waals-Radien. Bei einer Wasserstoffbrückenbindung zwischen H und O zweier unterschiedlicher Wassermoleküle ist der Abstand voneinander 180 pm, der van-der-Waals-Abstand wäre 260 pm. Van-der-Waals Bindungen sind nicht-kovalente Bindungen. In der Reihenfolge abnehmender Stärke gehören dazu ionische Wechselwirkungen, Wasserstoffbrückenbindungen, Dipol-Dipol-Wechselwirkungen und LondonDispersionskräfte. Wasserstoffbrücken Wasserstoffbrücken beruhen auf elektrostatischer Interaktion zwischen H und den stärker elektronegativen Atomen O oder N (oder F, aber das ist biologisch nicht relevant) Bindungsenergien im Vergleich: Wasserstoffbrücken 20 kJ /mol Kovalent C-C Kovalent C-H Kovalent O-H 348 kJ/mol 414 kJ/mol 460 kJ/mol © Nelson/Cox: Lehninger Principles of Biochemistry Wasserstoffbrücken werden schnell gebildet und wieder gelöst Dissoziationskonstante Die Reaktion HA + H2O ↔ A- + H3O+ wird beschrieben durch v1 = k1 [HA] [H2O] (Geschwindigkeit der Hinreaktion) und v2 = k2 [H3O+] [A-] (Geschwindigkeit der Rückreaktion) Im Gleichgewicht ist v1 = v2, also ist k1 [HA] [H2O] = k2 [H3O+] [A-] oder anders ausgedrückt k1/k2 = [H3O+] [A-] / [HA] [H2O] k1/k2 ergibt die Gleichgewichtskonstante K Statt [H3O+] kann man [H+] schreiben und [H2O] ändert sich praktisch nicht, also gilt: K' = [H+] [A-] / [HA] K' ist die Dissoziationskonstante einer Säure. Je höher K', desto stärker ist die Säure. Dissoziationskonstante 2 Säuren mit K > 10-1 gelten als stark, 10-1 - 10-5 haben mittelstarke Säuren, unter 10-5 sind Säuren schwach. Biologisch wichtige Säuren sind meistens mittel bis schwach, aber es gibt auch Ausnahmen: Magensaft hat durch HCl einen pH-Wert unter 2. Dissoziationskonstanten für biologisch wichtige Säure/Basen-Paare bei 25°C: Statt K kann man bequemer pK angeben: -log K = pK Wasser ist eine Brönsted-Säure! © Löffler/Petrides: Biochemie und Pathobiochemie pH-Wert von Wasser H2O zerfällt spontan in H+ und OH-. Das Gleichgewicht der Reaktion H2O ↔ H+ + OHliegt aber stark auf der linken Seite, d.h. Wasser ist überwiegend doch einfach Wasser. So schön ist Biochemie. Die Gleichgewichtskonstante K beträgt bei 25°C 1.8 x 10-16 Also: K = 1.8 x 10-16 = [H+] [OH-] / [H2O] Sie erinnern sich daß 1 mol Wasser 18.016 g sind? Da 1 l Wasser ca. 1 kg Wasser entspricht, enthält 1 l Wasser 55.5 mol Wasser. Reines H2O ist also 55.5-molar. Daher: [H+] [OH-] = 1.8 x 10-16 ∙ 55.5 = 10-14 Von H+ und OH- müssen gleichviel Moleküle vorhanden sein, und das Produkt ihrer Konzentrationen ist 10-14. Man kann also die Konzentration der beiden Moleküle festlegen auf 10-7, da 10-7 x 10-7 = 10-14 Die Konzentration von H+ wird angegeben durch den pH-Wert (analog zu pK), der definiert ist als - log [H+]. Der pH-Wert von Wasser ist bei den angegebenen Bedingungen also 7. Aminosäuren und Proteine Protein – vom griechischen proteios, "von herausragender Bedeutung" Jöns J. Berzelius, 1838 Proteine bestehen aus Aminosäuren. Von den unbegrenzt vielen möglichen Aminosäuren kommen 20 normalerweise in Proteinen vor ("proteinogene Aminosäuren„) Proteine können weitere assoziierte Komponenten haben. Zum Beispiel - Glycoproteine (mit kovalent gebundenen Kohlenhydraten) - Lipoproteine (mit kovalent gebundenen Lipiden) - viele Enzyme (mit Coenzymen oder Ionen) Proteine haben normalerweise - eine bestimmte Aminosäuresequenz - definierbare Struktur - spezifische Expression in bestimmten Zellen oder Geweben © Nature, 413, 365 (2001) Allgemeine Struktur von Aminosäuren Prüfer: "Können Sie mir sagen was eine Aminosäure ist?" Student: "Nein." Aminosäuren sind Carbonsäuren die eine Aminogruppe enthalten. Sie besitzen also immer die funktionellen Gruppen -COOH und -NH2. Aminosäuren sind meist ionisiert, liegen also mit NH3+, COO-, oder beidem vor. © Nelson/Cox: Lehninger Principles of Biochemistry Die C-Atome werden nummeriert (incl. COOH-Gruppe, oder mit griechischen Buchstaben bezeichnet (ohne COOH). Deutsch: Lysin Englisch: Lysine © Nelson/Cox: Lehninger Principles of Biochemistry Eine Aminosäure kann mehrere Carboxyloder Aminogruppen haben. Chiralität Eine Aminosäure mit 4 verschiedenen Liganden am α-C-Atom hat ein chirales Zentrum: Es sind zwei verschiedene Stereoisomere möglich. Chiralität ("Händigkeit") bedeutet Spiegelsymmetrie: Zwei Objekte sind identisch wie Bild und Spiegelbild, können aber nicht miteinander zur Deckung gebracht werden. Stellen Sie sich zwei Handschuhe vor. Spiegelisomere dieses Typs bezeichnet man als Enantiomere. Sie haben biologisch oft ganz unterschiedliche Eigenschaften, z.B. bei Thalidomid oder bei Carvon. Alle Moleküle mit einem chiralem Zentrum sind optisch aktiv, d.h. sie drehen die Schwingungsebene von polarisiertem Licht. © John Tenniel © BioSite, www.biosite.dk D- und L-Aminosäuren Aminosäuren werden nach Emil Fischer als D-und L-Formen unterschieden. Die entsprechende zweidimensionale Auftragung heisst Fischer-Projektion. Die Aminosäuren in Proteinen sind L-Stereoisomere. © all figures Nelson/Cox: Lehninger Principles of Biochemistry Jäger und Sammler Mehrere Millionen Jahre lang lebten alle Menschen als Mitglieder von Jäger/Sammler-Gesellschaften. Sammler bringen mehr Kalorien nach Hause. Aber Jäger versorgen die Gesellschaft mit essentiellen Aminosäuren, für die Fleisch die beste Quelle ist. Absolut essentiell sind in Erwachsenen Lysin, Methionin, Threonin, Isoleucin, Valin, Leucin, Phenylalanin, Tryptophan und Histidin. Bedingt essentiell sind Tyrosin (Synthese aus Phenylalanin) und Cystein (Synthese aus Methionin) wenn viel davon benötigt wird. Arginin ist vor allem in Kindern essentiell. Wir produzieren zwar Arginin, der größte Teil davon wird aber bei der Bildung von Harnstoff gespalten (zur Aminosäuresynthese siehe Vorlesung 10). © TIME-LIFE: Die ersten Menschen Die 20 proteinogenen Aminosäuren © Nelson/Cox: Lehninger Principles of Biochemistry Spezifische Eigenschaften © Nelson/Cox: Lehninger Principles of Biochemistry Was sollten Sie wissen? Versuchen Sie sich doch mal an einigen Übungsfragen zu Aminosäuren: Welche drei Aminosäuren sind aromatisch? Was ist die kleinste proteinogene Aminosäure und was die größte? Was haben Arginin, Histidin und Lysin gemeinsam? Welche Aminosäuren enthalten Schwefel? Was unterscheidet Prolin von den andern 19 proteinogenen Aminosäuren? Welche Aminosäuren können phosphoryliert werden? Welche sind sauer? Was ist die häufigste Aminosäure in Proteinen? Und die seltenste? ABCDEFGHI – welche Aminosäuren sind das (und welcher Buchstabe davon bezeichnet keine Standard-Aminosäure)? Was ist der Unterschied zwischen Glutamin, Glutamat und Glutaminsäure? Zeichnen Sie die Strukturformel von Alanin! Zeichnen Sie die Strukturformel von Tyrosin! Seltene Aminosäuren In Proteinen kommen außer den 20 normalen Aminosäuren auch noch weitere Aminosäuren vor. Bis auf zwei entstehen sie alle durch posttranslationale Modifikation. Nicht-Standard Aminosäuren werden nach der Translation (Synthese eines Proteins auf Grundlage einer mRNASequenz) durch spezifische Enzyme modifiziert. Die Modifikation der Aminosäuren ist für die Funktion der Proteine erforderlich (Bsp.: 4-Hydroxyprolin in Kollagen). © Nelson/Cox: Lehninger Principles of Biochemistry © Stryer: Biochemistry 21. und 22. Aminosäure Normal werden Nicht-Standard Aminosäuren über posttranslationale Modifikation eingefügt. Die einzigen bekannten Ausnahmen sind Selenocystein (Sec, U) und Pyrrolysin (Pyl, O), deren Verwendung schon auf DNA-Ebene festgelegt wird. In diesen Fällen wird ein Stopcodon durch die Nukleinsäuresequenz in der Umgebung umdefiniert, so dass während der Translation eine spezielle tRNA bindet und dadurch eine seltene Aminosäure eingefügt wird. (Siehe Vorlesung 8.) Beide Aminosäuren sind sehr selten. © Nature Nicht-proteinogene Aminosäuren Viele Aminosäuren kommen im Stoffwechsel vor, ohne daß sie in Proteine eingebaut werden. © Löffler/Petrides: Biochemie und Pathobiochemie Aminosäuren in Wasser Wir werden noch viel über Aminosäuren hören, aber vergessen Sie das Wasser nicht. Auch bei den Aminosäuren ist das Lösungsverhalten in Wasser ganz entscheidend. Der menschliche Körper besteht zu etwa 70% aus Wasser. Wenn Sie 70 Kilo wiegen sind also ca. 49 Kilo davon Wasser. Ein Verlust von 10% der Körpermasse an Wasser ruft schwere Dehydration hervor, ein Verlust von 20% verläuft tödlich. Wie vor der Erfindung von Einweg-PlastikGetränkeflaschen Menschen überleben konnten, bleibt ungeklärt. David Hockney: A bigger splash