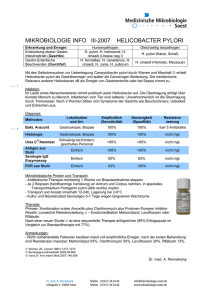
Genetische Prädisposition für eine Infektion mit Helicobacter pylori
Werbung

Aus der Humangenetik Ruhr-Universität Bochum Direktor: Prof. Dr. med. J. T. Epplen Genetische Prädisposition für eine Infektion mit Helicobacter pylori und deren Folgeerkrankungen im Gen von Interleukin 1 Inaugural-Dissertation zur Erlangung des Doktorgrades der Medizin einer Hohen Medizinischen Fakultät der Ruhr-Universität Bochum vorgelegt von Kerstin Brommont aus Essen 2007 Dekan: Prof. Dr. med. G. Muhr Referent: PD Dr. med. E. M. Kunstmann Koreferent: Fr. Dr. med. B. Miterski Tag der mündlichen Prüfung: 20.05.2008 Meinen Eltern in Dankbarkeit gewidmet 4 Inhaltsverzeichnis Seite 1. Einleitung 8 1.1 Der Erreger Helicobacter pylori 8 1.1.2 Pathogenese 10 1.1.3 Nachweisverfahren 12 1.2 12 Interleukine 1.2.1 Interleukin 1/(Protein-)Struktur 13 1.2.2 Biologische Wirkungen 16 1.3 Zielsetzung der Arbeit 20 2. Material und Methoden 21 2.1 Material 21 2.1.1 DNA 21 2.1.2 Oligonukleotide 21 2.1.3 Chemikalien 23 2.1.4 Lösungen 24 2.1.5 Enzyme 26 2.1.6 DNA-Längenstandards 26 2.1.7 Nukleotide 27 2.1.8 Kits 27 2.1.9 Sonstige Materialien 27 2.2 28 Methoden 2.2.1 DNA-Isolierung aus EDTA-Blut 28 2.2.2 Photometrische Bestimmung der DNA-Konzentration 29 2.2.3 DNA-Amplifikation mittels PCR 29 2.2.4 Spaltung der PCR-Produkte mit Restriktionsendonukleasen 31 2.2.5 Agarosegelelektophorese 31 2.2.6 SSCP-Analyse 32 5 2.2.7 Mikrosatellitenanalyse 33 2.2.8 Sequenzanalyse 34 2.2.9 Statistische Auswertung 36 3. Ergebnisse 37 3.1 Untersuchung der beta-Untereinheit 39 3.1.1 Analyse des Systems IL1b-511 40 3.1.2 Analyse des Systems IL1b-31 46 3.1.3 Analyse des Systems IL1bex5/int4 51 3.2. 55 Untersuchung der alpha-Untereinheit 3.2.1 Analyse des Systems IL1a-889 55 3.2.2 Analyse des Systems IL1a ex5 60 3.2.3 Analyse des Systems IL1a int5 64 4. Diskussion 67 4.1 Sensitivität und Reproduzierbarkeit der SSCP-Gelanalyse 68 4.2 Studienpopulation 68 4.3 IL-1 beta Gen 69 5. Zusammenfassung 76 6. Literaturverzeichnis 77 7. Anhang 92 8. Danksagung 9. Lebenslauf 6 Abkürzungsverzeichnis A Adenin Abb. Abbildung ABI Applied Biosystems GmbH APS Ammoniumpersulfat bp Basenpaare BSA Bovinserumalbumin bzw. beziehungsweise C Cytosin °C Grad Celsius ca. circa cag A cytotoxin associated gene Ci Curie CLO campylobacter like organism ddNTP 2’,3’-Didesoxynukleosid-5’-triphosphat d.h. das heißt DMSO Dimethylsulfoxid DNA Desoxyribonukleinsäure dNTP 2’-Desoxynukleosid-5’-triphosphat EDTA Ethylendiamintetraessigsäure ELISA enzyme linked immuno sorbant assay et al. und andere G Guanin HCl Salzsäure H. pylori Helicobacter pylori IL Interleukin kb Kilobasenpaare LPS Lipopolysaccharide m milli M molar MALT mucosa associated lymphoid tissue MgCl2 Magnesiumchlorid 7 min. Minuten mRNA messenger RNA n nano NaAc Natriumacetat NaCl Natriumchlorid NF-kappaB nuclear factor kappa B n.s. nicht signifikant p pico PAA Polyacrylamid PAGE Polyacrylamid-Gelelektrophorese PAI Pathogenitätsinsel PCR Polymerasekettenreaktion RFLP restriction fragment length polymorphism ss-DNA Einzelstrang-DNA SSCP single-strand-conformation-polymorphism T Thymin TA Primeranlagerungstemperatur Tab. Tabelle Taq Thermophilus aquaticus TAE Tris-Acetat-EDTA TBE Tris-Borat-EDTA Temp. Temperatur TEMED N,N,N’N’-Tetramethylethyldiamin TM Schmelztemperatur TNF-alpha Tumornekrosefaktor alpha TRIS Tris-hydroxymethyl-aminomethan u Unit, Einheit UV ultraviolett V Volt vac A Vakuolenbildendes Zytotoxin A W Watt z. B. zum Beispiel 8 1. Einleitung 1.1 Der Erreger Helicobacter pylori Helicobacter pylori (H. pylori), für den der Mensch nach bisherigem Erkenntnisstand das einzige Erregerreservoir darstellt, ist ein gramnegatives, begeißeltes Bakterium. Der Erreger konnte erstmals 1983 von Warren und Marshall aus Antrumbiopsien magenkranker Patienten isoliert werden. Der primäre Infektionsweg ist zur Zeit noch nicht vollständig geklärt, wahrscheinlich ist aber ein fäkal-oraler Übertragungsmodus (Thomas et al., 1992, Kelly et al., 1994, Sokic-Milutinovic et al., 2004). Epidemiologische Studien zeigen eine Durchseuchungsrate der Weltbevölkerung mit H. pylori von 40-50 % in Industrienationen sowie über 90 % in Entwicklungsländern (Nomura et al., 1991, Suerbaum et al., 2002). Damit stellt diese Infektion möglicherweise die am meisten verbreitete bakterielle Erkrankung des gastrointestinalen Traktes dar. Nachgewiesen ist ein Zusammenhang zwischen dem sozioökonomischen Status und der Infektion. In niedrigeren soziologischen Schichten ist die Infektion mit H. pylori häufiger als in höheren Schichten (Correa et al., 1990). H. pylori ist obligat pathogen und induziert eine chronische Entzündung der Magenschleimhaut (Typ B Gastritis). Die Entzündung ist zunächst gekennzeichnet durch eine Infiltration der Magenmukosa mit Plasmazellen und T-Lymphozyten. Je nach Aktivitätsgrad der Entzündung (Ausmaß der Dichte der Infiltration) wird die Mukosa zusätzlich mit Monozyten und neutrophilen Granulozyten infiltriert (Prinz et al., 2001, Basak et al., 2005). Das klinische Korrelat der chronischen Entzündung ist durch unspezifische Oberbauchbeschwerden gekennzeichnet, in den meisten Fällen bleiben die betroffenen Patienten aber asymptomatisch. 9 Einige Patienten entwickeln typische Folgeerkrankungen der bakteriell bedingten chronischen Gastritis. Hierzu zählt unter anderem das Ulcus ventriculi und das Ulcus duodeni (Hunt, 1996). Bei Ulcera duodeni ist H. pylori in ca. 95 % der Fälle nachweisbar (Tytgat, 1996, Calam, 1998). Bei Patienten mit Ulcus ventriculi ist der Erregernachweis in über 70 % der betroffenen Patienten positiv (Garcia-Gonzalez 2001, Zhang et al., 2005). Auch andere Erkrankungen wie das Magen-Karzinom und das niedrig-maligne MALT-Lymphom sind mit der H. pylori-Infektion assoziiert. Bei mehr als 80-90 % der an einem Magen-Karzinom erkrankten Patienten kann eine H. pylori-assoziierte Gastritis nachgewiesen werden (Nomura et al., 1991, Houghton et al., 2005). Für das niedrig maligne MALTLymphom besteht ebenfalls eine starke Assoziation mit einer H. pyloriInfektion. In über 95 % der Fälle wird hier der Erreger nachgewiesen (Bayerdörffer et al., 1995, Farthing, 1998, Stolte et al., 2002). Die verschiedenen Virulenzfaktoren von H. pylori ermöglichen dem Erreger, sich trotz Immunantwort und der unspezifischen Abwehrmechanismen des Wirtsorganismus zu vermehren. Das vakuolisierende Zytotoxin vac A bewirkt beispielsweise eine Vakuolisierung von Magenepithelzellen sowie deren gesteigerte Permeabilität für Ionen (Szabo, 1999). Obwohl alle Stämme von H. pylori das vac A-Gen besitzen, wird nicht von allen Organismen ein funktionelles vakuolisierendes Zytotoxin produziert, welches zum Zelltod der Zielzelle führt (Atherton et al., 1995, Farinha et al., 2005). Das cag A-Gen ist Teil einer 40 kb umfassenden Pathogenitätsinsel (PAI), auf der u.a. ein Typ IV Sekretionssystem kodiert ist. Das cag A-Protein wird durch das Typ IV Sekretionssystem in das Zytosol der Wirtszelle transloziert (Argent et al., 2004). Cag A wird in der Epithelzelle phosphoryliert und führt zu Veränderungen im Zellstoffwechsel und Zellproliferation (Nilsson et al., 2003). Das cag A-Protein stellt ein Marker- 10 protein für die PAI dar und wird von virulenten Stämmen statistisch signifikant häufiger exprimiert. In verschiedenen Arbeiten konnte nachgewiesen werden, daß cag-A-Protein signifikant häufiger in Patienten mit einem peptischen Ulkus oder einer schweren Gastritis sowie einer erhöhten Assoziation für ein Magenkarzinom gefunden wurde (Shimoyana et al., 1998, Smith et al., 2002, Rieder et al., 2005). Zwischenzeitlich wurden weitere Virulenzfaktoren von H. pylori beschrieben, wie zum Beispiel das Adhäsionsprotein Bab A, welches an Lewis B Blutgruppenantigene bindet. Auch hier gibt es Hinweise dafür, daß die beiden vorhandenen Isoformen unterschiedlichen Einfluß auf die Schwere der durch H. pylori induzierten Erkrankungen haben (Suerbaum et al., 2002, Zagari et al., 2004). Daneben scheinen das Lebensalter zum Zeitpunkt der Infektion sowie umweltabhängige Faktoren wie Ernährungsgewohnheiten für die Krankheitsausprägung eine Rolle zu spielen (Graham et al., 1991). Somit ergibt sich für das Entstehen einer Infektion mit diesem Erreger ein multifaktorielles Geschehen. 1.1.2 Pathogenese Die Pathogenese der Infektion mit H. pylori ist ein komplexes Geschehen, das gekennzeichnet ist durch das Zusammenspiel verschiedener Virulenzfaktoren des Erregers mit genetischen Prädispositionsfaktoren des Wirts und Umwelteinflüssen (Graham, 1997, Bodger and Crabtree, 1998). Eine ausgezeichnete Beweglichkeit durch die Begeißelung und der Besitz einer starken Ureaseaktivität ermöglichen dem Keim nach Aufnahme in den Magen ein Überleben im sauren Magenmilieu. Durch die Ureaseaktivität wird Harnstoff zu Ammoniak und CO2 abgebaut, was ein günstiges alkalisches Milieu für H. pylori schafft (Marshall et al., 1990). 11 Der direkte Kontakt des Erregers mit der Zelloberfläche führt zu einer Gewebsschädigung durch freigesetzte bakterieneigene Enzyme wie Proteasen, Phosphatasen und Phospholipase A und C (Tannaes et al., 2005) sowie die in Abschnitt 1.1 beschriebenen Zytotoxine vac A und cag A. Zusätzlich kommt es bei Kontakt des Erregers mit der Zelloberfläche zur Freisetzung von chemotaktischen Faktoren durch die Epithelzellen, die zur Aktivierung und zum Einwandern von Monozyten und neutrophilen Granulozyten führen (Suerbaum et al., 2002). Verschiedene mikrobielle Produkte wie die Lipopolysaccharide der Bakterienwand oder die bakterieneigene Urease führen ebenfalls zum Anlocken und zur Aktivierung von neutrophilen Granulozyten und Monozyten und damit zum Start der unspezifischen Immunreaktion. Die aktivierten Monozyten stellen hierbei eine Quelle für pro-inflammatorische Mediatoren wie die Zytokine dar (Harris et al., 1996). Die spezifischen Immunabwehrmechanismen durch Aktivierung von Tund B-Lymphozyten werden durch antigene Eigenschaften von H. pylori in Gang gesetzt. Auch hier spielen die Zytokine eine entscheidende Rolle in der Kommunikation der Zellen untereinander (Bodger et al., 1998). Trotz Stimulation der angeborenen und antigeninduzierten Immunabwehr in der Magenschleimhaut kann H. pylori im Großteil der Fälle nicht eliminiert werden, so daß sich eine chronische Entzündung entwickelt. Einströmende Granulozyten setzen aggressive Enzyme und Sauerstoffradikale frei, die selbst eine mukosaschädigende Wirkung entfalten. Auch außerhalb des Magens ist dieser Pathomechanismus wirksam, wenn aufgrund einer gastralen Metaplasie die Voraussetzung für eine H. pyloriBesiedlung gegeben ist, was gelegentlich im Duodenum und selten im Ösophagus oder in Meckelschen Divertikeln der Fall ist. 12 1.1.3 Nachweisverfahren Die Besiedlung des Magens durch H. pylori kann invasiv und nicht-invasiv nachgewiesen werden. Gängige Nachweismethode des Erregers an einem Magenbiopsat ist zum einen der histologische Nachweis des Erregers sowie eine kulturelle Anzucht von H. pylori. Zusätzlich besteht die Möglichkeit eines indirekten Nachweises an der Schleimhautbiopsie mittels CLO-Test. Hierbei wird die starke Ureaseaktivität des Erregers ausgenutzt, die zu einer Änderung des pH-Wertes mit nachfolgendem Farbumschlag führt. Außerdem besteht die Möglichkeit eines nicht-invasiven Verfahrens mittels 13 C-Atemtest durch orale Gabe von 13 C-markiertem Harnstoff, der durch die bakterielle Urease in Kohlendioxid gespalten und in der Ausatemluft gemessen werden kann. Eine andere Möglichkeit bietet der serologische Nachweis spezifischer Antikörper mittels ELISA-Test. 1.2 Interleukine Die Interleukine (Lymphokine) gehören zur Gruppe der Zytokine. Zytokine sind Proteine mit niedrigem Molekulargewicht, die die Immunantwort regulieren und mit anderen Zytokinen, die entweder einen additiven bzw. synergistischen oder antagonistischen Effekt haben in Wechselwirkung treten können. Zytokine sind schon in sehr geringen Mengen wirksam und können eine Zytokinkaskade in Gang setzten, bei der ein Zytokin durch ein anderes freigesetzt wird. Eine erfolgreiche Immunantwort erfordert ein optimales Zusammenspiel zwischen den einzelnen Zytokinen. Das Zusammenspiel verschiedener Zytokine bewirkt einen Gesamteffekt, der 13 nicht zu beobachten ist, wenn man die Effekte eines einzelnen Zytokins isoliert betrachtet. Am Anfang der Zytokinwirkung steht die Bindung des Zytokins an spezifische Rezeptoren auf der Oberfläche der Zielzelle. Die Rezeptoren weisen oft eine sehr hohe Affinität für ihre Liganden auf. Die meisten Zytokinwirkungen sind mit der Transkription verschiedener Gene und/oder der Expression von Oberflächenrezeptoren verknüpft, und man nimmt an, daß diese durch zytokininduzierte Aktivierung spezifischer DNABindungsproteine (Transkriptionsfaktoren) zustande kommen (Dinarello, 1996). IL-1 zum Beispiel besitzt die Fähigkeit, die rasche Verschiebung eines vorbestehenden NF-kappaB-Komplexes aus dem Zytoplasma in den Zellkern zu bewirken, der dann an spezifische DNA-Regulatorsequenzen der Promotoren verschiedener Gene bindet (Hiscott et al., 1993, Abbas et al., 1994). 1.2.1 Interleukin 1/(Protein-)Struktur Interleukin 1 (IL-1) zählt zu den pro-inflammatorischen Zytokinen. Es wurde erstmals 1972 von Gery und Waksmen beschrieben (Gery et al., 1972). Es besteht aus zwei Proteinuntereinheiten, einer alpha- und einer betaUntereinheit (Abb. 1 und Abb. 2), deren Gene auf dem langen Arm von Chromosom 6 lokalisiert sind (2q12-q21) (Nicklin et al., 1994). Die beiden Untereinheiten zeigen weniger als 30 % strukturelle Homologie (Patterson et al., 1993), aber beide Proteine binden jeweils an den gleichen Rezeptor auf der Zelloberfläche, und ihre biologische Funktionen sind im wesentlichen identisch (Billingham, 1987, Schepp et al., 1998), wenn es auch 14 Unterschiede in der Stärke der Aktivität bzw. Effektivität gibt. IL-1 alpha ist im Vergleich zu IL-1 beta z. B. effektiver in der Induktion von TNFalpha aus epidermalen Zellen (Beissert et al., 1998). Im Vergleich dazu ist IL-1 beta aber wirksamer in der Stimulation von IL-6 aus Gliazellen (Andre et al., 2005). Die alpha-Untereinheit umfaßt bei einer Länge von über 10 kb 7 exonische und 6 intronische Sequenzen. Eine typische TATA-Box oder CAT-Box im Bereich vor dem Transkriptionsstartpunkt ist bei dieser Untereinheit nicht bekannt. Allerdings enthält sie eine TATA-Box-ähnliche Sequenz in diesem Bereich (Furutani et al., 1986). Die beta-Untereinheit mit einer Länge von über 7,5 kb besteht ebenfalls aus 7 Exons und 6 Introns. Sie enthält im Vergleich zur alpha-Untereinheit das typische TATA-Box-Motiv im Promoterbereich. Abb. 1: Schematischer Überblick über das pro-IL-1 alpha Gen Abb. 2: Schematischer Überblick über das pro-IL-1 beta Gen Die exonischen Sequenzen sind durch römische Zahlen gekennzeichnet. Die dicken Pfeile zeigen die Position der Alu repetitiven Sequenzen an, die dünnen Pfeile kennzeichnen direkt repetitive Sequenzen. Innerhalb der exonischen Sequenzen geben die weiß eingezeichneten Boxen die kodierenden, die schwarz ausgefüllten Boxen die nicht kodierenden Bereiche an. 15 Abb. 3: Übersicht über die Aminosäuresequenz von IL-1 des Menschen im Vergleich zur Maus. Die homologen Aminosäuren sind mit Kästchen umrandet, das kleine Sternchen markiert das N-terminale Ende der Sequenz und beginnt bei ALA 117. Ebenfalls enthalten in der Abb. ist die N-terminale Sequenz des Interferon inducing factor, die eine gewisse Sequenzhomologie zeigt und Hinweis dafür sein kann, daß IL-1 Teil einer Gen-Familie ist (Cameron et al., 1985). 16 1.2.2 Biologische Wirkungen Die verschiedenen Wirkungen von IL-1 stellen aufgrund der vielen verschiedenen Zielzellen von IL-1 ein sehr komplexes Geschehen dar (s. Abb. 4). Abb. 4: Schematische Darstellung der Vernetzung des Nervensystems und anderer Organe mit dem Immunsystem über Interleukine und andere Botenstoffe (aus: Kurzlehrbuch der Immunologie, Thieme Verlag, Seite 117) ACTH: Adrenocorticotropes Hormon, B: B-Lymphozyten, CSFS: Koloniestimulierende Faktoren, IFN: Interferon, LAK: Lymphokinaktivierende Zelle, NK: Natürliche Killerzelle, T: T-Lymphozyten, TNF: Tumor Nekrose Faktor Eine der wichtigsten Funktionen des IL-1 ist die Vermittlung einer Entzündungsantwort bei der natürlichen Immunität. Mikrobakterielle Produkte wie z. B. das in der Zellwand gramnegativer Bakterien enthaltene Lipo- 17 polysaccharid stimulieren Makrophagen direkt zur Sekretion von Zytokinen, z. B. IL-1 (Abb. 5). Abb. 5: Die frühe und späte Phase der Immunantwort in einer durch H. pylori hervorgerufenen Entzündung des Magens (Bodger and Crabtree, 1998) Ag: Antigen, APC: Antigenpräsentierende Zelle, GROα: Protein der GRO-Gen Chemokine, LPS: Lipopolysaccharide, MIP1α: Makrophagenentzündungs-Protein 1 alpha, MO: Monozyten, PMN: Polymorphkernige Granulozyten, RANTES: Mitglied der Interleukin 8-Superfamilie; induziert Chemotaxis der Memory-T-Zellen und Monozyten Die Makrophagen stellen damit die wichtigste zelluläre Quelle von IL-1 in der frühen Phase der Immunantwort dar. Durch das sezernierte IL-1 kommt es neben dem von Makrophagen ebenfalls sezernierte IL-6 im Rahmen der 18 spezifischen Immunantwort zur Aktivierung von T-Lymphozyten als hauptsächliche Antwort auf eine spezifische Erkennung von Fremdantigen (Bodger and Crabtree, 1998, Abbas et al., 1994). CD4-T-Helferzellen wiederum sezernieren B-Zell-aktivierende Zytokine, z. B. IL-4 und IL-10, so daß es nach Differenzierung der B-Lymphozyten zu Plasmazellen zur Produktion von Antikörpern kommt. Dieser Mechanismus stellt die späte Phase der Immunantwort dar. Beide Mechanismen sind schematisch in Abb. 5 dargestellt. Die Zielzellen von IL-1 sowie seine einzelnen Wirkungen sind in Tab. 1 aufgeführt. Die biologische Wirkung hängt von der freigesetzten Zytokinmenge ab. Bei niedrigen Konzentrationen wirkt IL-1 hauptsächlich als Mediator einer lokalen Entzündung, bei hohen Konzentrationen gelangt es in das Blut und kann eine endokrine Wirkung, z. B. Induktion von Fieber bewirken (s. Tab. 1). IL-1 spielt aufgrund seiner inflammatorischen Wirkung in vielen Erkrankungen eine bedeutsame Rolle. Daher beschäftigen sich zahlreiche Studien mit der Rolle des IL-1 insbesondere bei chronisch entzündlichen Erkrankungen wie Colitis Ulcerosa und Morbus Crohn sowie der chronischen Polyarthrose (Mc Dowell et al., 1995, Nemetz et al., 1999, Heresbach et al., 1997, Stokkers et al., 1998). Aufgrund der oben aufgeführten Pluripotenz von IL-1 und der in verschiedenen Arbeiten nachweislich erhöhten Produktion unter dem Einfluß bakterieller Erkrankungen ist dieses Zytokin ein geeigneter Kandidat zur Untersuchung einer Assoziation mit einer H. pylori-Infektion (Dinarello et al., 1996). 19 Tab. 1: Zytokine als inflammatorische Mediatoren (nach Billingham, 1987) Zielzelle Biologische Effekte Neutrophile Makrophagen Chemotaxis, Aktivierung zur Zerstörung infektiöser Agenzien Natürliche Killerzellen Zytotoxische Aktivität T-Lymphozyten IL-2-Produktion, Expression von IL-2Rezeptor B-Lymphozyten Produktion von B-Zellen-Wachstumsfaktor, Antikörper-Produktion Zellen des ZNS Fieber, Anorexie, Prostaglandinfreisetzung Tumorzellen Wachstumsinhibierung und Zerstörung Epitheliale Zellen Proliferation, Steigerung der Synthese von Kollagen Typ IV Endotheliale Zellen Proliferation, Freisetzen von Prostaglandinen Fibroblasten Proliferation, Freisetzung proteolytischer Enzyme, Freisetzung von PlasminogenAktivator Synoviale Zellen Proliferation, Freisetzung von PlasminogenAktivator, Prostaglandinen und proteolytischen Enzymen Chondrozyten Inhibierung der Proteoglycansynthese, Freisetzung von proteolytischen Enzymen, Prostaglandinen und Plasminogen-Aktivator Osteoblasten und Osteoklasten Freisetzung von Plasminogen Aktivator Hepatozyten Freisetzung von Akute-Phase-Proteinen Fettzellen Inhibierung von Lipoprotein-Lipase, Kachexie, Hyperlipidämie Muskelzellen Freisetzung von Prostaglandinen 20 1.3 Zielsetzung Eine Infektion mit H. pylori stellt ein multifaktorielles Geschehen dar, in dem neben sozioökonomischen und nutritiven Faktoren genetische Wirtsfaktoren sowie genetische Faktoren des Erregers Einfluß haben (Rosenstock et al., 1998, Tsugane et al., 1994, Rad et al., 2004, Zagari et al., 2004). Pro-inflammatorische Zytokine wie das IL-1 als Teil der spezifischen und unspezifischen Immunität spielen eine entscheidende Rolle in der Entstehung einer Entzündung der Magenschleimhaut durch den Erreger H. pylori. Aus diesem Grund sollten genetische Polymorphismen in den Genen IL-1 alpha und -beta typisiert und die Verteilung der einzelnen Allele in Bezug auf eine mögliche Assoziation mit der Infektion sowie ihren Folgekrankheiten Ulcus duodeni und Ulcus ventriculi geprüft werden. Das zu untersuchende Kollektiv bestand aus 392 deutschen Individuen, deren H. pyloriStatus zuvor mit den oben beschriebenen Methoden bestimmt worden war (s. 1.1.3). Unterschiede in der Allelverteilung sollten mittels χ²-Test auf statistische Signifikanz untersucht werden. 21 2. Material und Methoden 2.1 Material 2.1.1 DNA Die molekulargenetischen Analysen wurden entweder mit bereits isolierter genomischer DNA durchgeführt, oder die DNA wurde zuvor aus PatientenEDTA-Blut eigenständig gewonnen. 2.1.2 Oligonukleotide Die in Tab. 2 aufgelisteten Oligonukleotide wurden als Primer für die Polymerasekettenreaktion (PCR) verwendet und von der Firma Metabion GmbH (Deutschland) bezogen. Sämtliche Primer wurden anhand der veröffentlichten Gensequenz von Interleukin 1 (Nucleid acid research) entworfen (außer IL-1A-889, s. Jouvenne, 1999). Die jeweilige Schmelztemperatur der Primer (Tm) ergibt sich aus der Summe der Temperaturen, wenn man für Guanin und Cytosin jeweils 4°C und für Adenin und Thymin jeweils 2°C einsetzt. 22 Tab. 2: PCR-Primer System Primer Sequenz (5’→ 3’) IL1b-511 IL1b-511 3’ AAGTGGGAAGATTCCTAAACT IL1b-511 5’ TGGCATTGATCTGGTTCATC IL1b-31 3’ TGTATGCATATTCTCTCTC IL1b-31 5’ TTTAACTTGATTGTGAAATC IL1b-31 IL1b ex2 IL1b ex3 IL1b ex4 IL1b ex5/int4 IL1b ex6 IL1b ex7.1 IL1b ex7.2 IL1b ex7.3 IL1b ex7.4 IL1a-889 IL1a ex5 IL1a int5 IL1a ex7.1 IL1a ex7.2+3 IL1a ex7.4 IL1a ex7.5 IL1bex2 3’ ATGAGCAGGTCTCCTCTTTCA IL1bex2 5’ GGATACTGCTTATCTAACAGGT IL1bex3 3’ TTCCAGTGAGACACAGGCTG IL1bex3 5’ GAGGTTAGGCCTCAAGATCC IL1bex4 3’ GTCCTCTTGGAAGTCATCAA IL1bex4 5’ TCTCTGATGTCAAAGCATGG IL1bex5/int4 3’ CCTGGCAGCTTGCTAATTCT IL1bex5/int4 5’ GTTGTCATCAGACTTTGACC IL1bex6 3’ ACCACTTATTCCCAGACAAT IL1bex6 5’ TACATGTATCCTACTCTCGG IL1bex7.1 3’ GCAATTTGTGTCTTCCTAAAG IL1bex7.1 5’ ACATCTTTCCCCATAGGCATC IL1bex7.2 3’ CCTACTCACTTAAAGCCCGC IL1bex7.2 5’ GTCTTCCTGGGAGGGACCA IL1bex7.3 3’ GAAGTAGCAGTGTCTGTAAAA IL1bex7.3 5’ TTTTGTTGAGCCAGGCCTCT IL1bex7.4 3’ CATTGACTGTCTGGATTGAC IL1bex7.4 5’ GAAACCCTCTGTCATTCGC IL1a-889 3’ CATGGAAGGCTCATATGTAA IL1a-889 5’ ACTCCAACTGGGAACCCA IL1aex5 3’ ACATTTCTGTCATCCTCCCCT IL1aex5 5’ GAAATCATCAAGCCTAGGTCA IL1aint5 3’ GCACACACAATCTACATCAACAC IL1aint5 5’ CCTGCCTAGTGAGTGTGGAAG IL1aex7.1 3’ CCAACACTAACATATAATGTTGTTA IL1aex7.1 5’ CCATGTACATGAAGAAGCTAAAT IL1aex7.2+3 3’ TTATGCTAATCAGGGAGGTCAT IL1aex7.2+3 5’ CAGATGGGCAAATTAAGGCAT IL1aex7.4 3’ AAGGCAAAGCACGAAATGTT IL1aex7.4 5’ AAATGGAGGGAATAATACCT IL1aex7.5 3’ GACCATAATGTTACATTATTATCA IL1aex7.5 5’ GTCCTACAAGCTAAAATTAGAT 23 2.1.3 Chemikalien Aceton Merck Acrylamid Fluka Agarose Gibco BRL AG-801-x8 Biorad Ammoniumpersulfat (APS) Baker Borsäure Baker Bovinserumalbumin (BSA) Fluka Bromphenolblau Merck Chloroform Merck DE-53-Cellulose Whatman Dichlordimethylsilan Merck Dimethylsulfoxid (DMSO) Sigma Ethanol Riedel-de-Haen Essigsäure Merck Ethidiumbromid Sigma Ethylendiamintetraessigsäure Merck Ficoll 400 Pharmacia Formaldehyd Baker Glycerin Riedel-de-Haen Harnstoff Baker Isopropanol Riedel-de-Haen Magnesiumchlorid (MgCl2) Merck Mineralöl Sigma Natriumacetat (NaAc) Riedel-de-Haen Natriumchlorid (NaCl) Riedel-de-Haen N,N’-Methylen-bis-acrylamid Fluka 24 N,N,N’N’-Tetramethylethyldiamin (TEMED) Riedel-de-Haen Polyvinyl Sigma Polyoxy-ethylen(20)sorbitanmonolaurat (Tween 20) Sigma Salzsäure (HCl) Baker Tris-hydroxymethyl-aminomethan (TRIS) Riedel-de-Haen Xylencyanol FF Bio-Rad Xylol Baker 2.1.4 Lösungen Alle Lösungen wurden mit bidestilliertem Wasser angesetzt und bei Bedarf autoklaviert. APS-Lösung 10 % (w/v) (NH4)2S2O8 in H2O Ethidiumbromidlösung 0,5 mg/ml Ethidiumbromid (ad 1000 ml 1x TBE) Ladepuffer für Agarosegele 0,25 % (w/v) Bromphenolblau 0,25 % (w/v) Xylencyanol FF 15 % (w/v) Ficoll Typ 400 Ladepuffer für denaturierte 95 % Formamid Polyacrylamidgele 20 mM EDTA 0,05 % (w/v) Bromphenolblau 0,05 % (w/v) Xylencyanol FF 25 Ladepuffer für native Polyacrylamidgele 95 % Formamid 10 mM NaOH 0,25 % (w/v) Bromphenolblau 0,25 % Xylencyanol FF Polyacrylamid-Stammlösung (40 %) 38 % (w/v) Acrylamid 1 % (w/v) Bisacrylamid PCR-Puffer (10x) für DNA-Polymerase 160 mM (NH4)2SO4 670 mM Tris/HCl (pH 8,8) 0,1 % Tween-20 Proteinkinase-K-Puffer 20 mM Tris/HCl (pH 7,4) 4 mM EDTA 100 mM NaCl Silanisierungslösung 5 % (v/v) Dichlordimethylsilan in Chloroform SSC-Puffer (20x) 3 M NaCl 0,3 mM Na Citrat (pH 7,0) SSPE-Puffer (1x) (pH 7,4) 0,18 M NaCl 0,1 M NaPhosphat 1 mM NaCl 26 TBE-Gelelektrophoresepuffer (1x) 89 mM Tris 89 mM Borsäure 2 mM EDTA TAE-Gelelektrophoresepuffer (1x) 40 mM Tris 35 mM Essigsäure 1 mM EDTA TE-Puffer 10 mM Tris/HCl (pH 8,0) 10 mM EDTA 2.1.5 Enzyme Alle Enzyme wurden in den von den Herstellern empfohlenem Puffer verwendet. Im Fall eines Doppelverdaus wurde der gemeinsame Puffer gewählt, in dem beide Enzyme ihre höchstmögliche Aktivität zeigten. Big Dye TM Terminator with Amp II-Taq PE Appl. Bios. Bio Therm Taq-DNA-Polymerase Gene Craft Proteinkinase K Merck Restriktionsendonukleasen: Alu I, Eco 130 I, Mbo I, Mbo II, Msp I, RSA I MBI Fermentas Ava I, Dde I, Fnu 4 HI, Hinf I, Nco I, Sac I, Taq I NEB Biolabs 2.1.6 DNA-Längenstandards pUC 19 DNA/Msp I (Hpa II)-Marker MBI Fermentas Lambda-DNA/Hind III-Marker MBI Fermentas 27 2.1.7 Nukleotide Desoxyribonukleotid-Triphosphate (dNTP) dATP, dCTP, dGTP, dTTP MBI Fermentas (alpha-32 p)-dATP (10 mCi/ml, 6000 Ci/mmol) Amersham (alpha-32 p)-dCTP (10 mCi/ml, 3000 Ci/mmol) Amersham 2.1.8 Kits QIA quick Agarose Gel Extraction Kit Qiagen Easy Pure DNA Purification Kit Biozym Ampli Taq DNA Polymerase Dye Terminator Sequencing Kit Amersham Sequenase Version 2.0 DNA Sequencing Kit Amersham 2.1.9 Sonstige Materialien Röntgenfilm Hyperfilm TM Mp Amersham Hybond TM-N Nylonmembranen Amersham 96-Loch-Mikrotiterplatten Thermowell CoStar Thermocycler Biometra DNA-Sequenzierautomat (Model 373 XL) Applied Biosystems 28 2.2 Methoden 2.2.1 DNA-Isolierung aus EDTA-Blut Für die DNA-Isolierung wurden zunächst Leukozyten aus 10 ml peripher venösem Patientenblut gewonnen. Die Granulozyten wurden dazu zusammen mit den Erythrozyten mittels eines Ficollgradienten von Lymphozyten und Monozyten getrennt. Letztere wurden nach Zugabe von Einfriermedium in flüssigem Stickstoff tiefgefroren und standen so für eine mögliche EBV-Transformation zur Verfügung. Das Erythrozyten-Granulozyten-Gemisch wurde mit Aqua bidest auf ein Volumen von 45 ml aufgefüllt und die Erythrozyten dadurch lysiert. Anschließend erfolgte eine 15 minütige Zentrifugation bei 3300xg und 4°C, bei der ein Sediment aus kernhaltigen Granulozyten entstand. Diese wurde zur Lyse der Zellmembran in 20-30 ml 0,1 % NP 40 resuspendiert. Die frei gewordenen Zellkerne wurden wie oben beschrieben abzentrifugiert. Die Kernmembranen wurden durch Resuspension in 3 ml TEN und 200 µl 10 % igem SDS aufgebrochen. Nach Zugabe von 100 µl Proteinkinase K (10 ng/ml) wurden die Proteine von der DNA über Nacht voneinander getrennt. Anschließend wurden die Proben auf 4°C gekühlt und 1 ml gesättigte NaCl-Lösung zum Aussalzen der Proteine hinzugefügt und zentrifugiert (3300xg, 15 min.). Der Überstand wurde in 8 ml Ethanol absolut aufgenommen. Nach 15 min. konnte die ausgefällte DNA in 70 % igem Ethanol gewaschen, bei 6000xg für 8 min. abzentrifugiert und anschließend in der Vakuumzentrifuge getrocknet werden. Das DNA-Pellet wurde mit 200 µl TE-Puffer in Lösung gebracht. 29 2.2.2 Photometrische Bestimmung der DNA-Konzentration Nach der DNA-Isolierung aus EDTA-Blut wurde die erhaltene DNAKonzentration in 200-facher Verdünnung bei einer Wellenlänge von 260 nm mit einem Uvicon 930 Kontron-Spekralphotometer gemessen und die Gesamt-DNA-Menge nach folgender Berechnung ermittelt: DNA [ng/µl] = OD (260 nm) x Verdünnungsfaktor x 50 µg OD = optische Dichte Für nachfolgende PCR-Untersuchungen wurde die DNA mit TE-Puffer auf eine Konzentration von 50 ng/µl eingestellt. 2.2.3 DNA-Amplifikation mittels PCR Die zu untersuchenden DNA-Abschnitte wurden jeweils mit Hilfe der in Tab. 2 aufgeführten spezifischen Primer in einem Gesamtansatz mit 12,5 µl Volumen amplifiziert. Ansatz für PCR (12,5 µl): genomische DNA 50 ng 10x PCR-Puffer 1x dNTP 0,2 mM Primer I (5') 10 pmol Primer II (3') 10 pmol MgCl2 0,5-4 mMol Taq-DNA-Polymerase 0,5 U 30 Für radioaktiv markierte PCR's wurde zusätzlich 0,1-0,2 µCi [α-32 P]-dCTP hinzugegeben. Zum Schutz gegen Verdunstung wurden die Proben mit einem Tropfen Mineralöl überschichtet. Bei Bedarf wurden die Reaktionsansätze mit Stringenzien wie Formamid oder DMSO in einer möglichst geringen Konzentration zur Erhöhung der Spezifität versetzt. Die Reaktion wurde in Mikrotiterplatten in einem Uno-Thermoblock durchgeführt. Um eine möglichst hohe Produktausbeute bei fehlenden oder nur geringen unspezifischen Nebenbanden zu erzielen, wurden die MgCl2Konzentration sowie die Temperatur für die Primeranlagerung (AnnealingTemperatur) und gegebenenfalls die Konzentration der Stringenzien variiert. Die Amplifikation erfolgte mit einem Temperatur-3-Step-Schritt-Programm, bei dem die Temperatur für die Primeranlagerung in der ersten Schleife 6°C, in der zweiten Schleife 3°C über der Schmelztemperatur lag. Dies bewirkt eine Erhöhung der Spezifität der Reaktion. Die für die einzelnen Systeme optimierten Bedingungen sind im Ergebnisteil aufgeführt. Tab. 3: PCR-Programm auf dem Thermocycler (Biometra): Zyklusschritt Temp. in °C Dauer in min Anzahl der Schleifen Denaturieren 94 5 1 Denaturieren Primer-Anlagerung Kettenverlängerung 94 TA 72 0,5 1 1 28-30 Kettenverlängerung 72 5 1 Abkühlung 4 ∞ TA Annealing-Temperatur: Temperatur, bei der sich die Primer optimal anlagern. Die ersten beiden Schleifen werden jeweils mit TA + 6°C und TA + 3°C durchlaufen, um eine unspezifische Anlagerung der Oligonukleotide an die DNA zu verhindern. 31 2.2.4 Spaltung der PCR-Produkte mit Restriktionsendonukleasen PCR-Produkte, die der in 2.2.6 aufgeführten SSCP-Gelanalyse unterzogen werden sollten und länger als 200 Basenpaare waren, wurden mit Hilfe von Restriktionsenzymen in kleinere Fragmente geschnitten. PCR-Produkte, deren Sequenz einen der vorbeschriebenen Schnittstellenpolymorphismen enthielt, wurden mit den entsprechenden Restriktionsenzymen geschnitten, deren Erkennungssequenz den Polymorphismus beinhaltete. Die Bedingungen für das Restriktionsmedium sowie die Inkubationszeit und Temperatur wurden wie vom Hersteller angegeben gewählt. Die eingesetzte Enzymmenge wurde folgendermaßen errechnet: E = P x LR x EP/LP x ER E: einzusetzende Enzymmenge [U/µl PCR-Ansatz] P: PCR-Produktmenge [µg DNA/µl PCR-Ansatz] LR: Länge der Referenz-DNA [bp] EP: Anzahl der Erkennungsstellen im PCR-Produkt LP: Länge des PCR-Produkts [bp] ER: Anzahl der Erkennungsstellen in der Referenz-DNA 2.2.5 Agarosegelelektrophorese Zur Kontrolle einer PCR-Reaktion wurden die PCR-Produkte mit 2 µl Ladepuffer für Agarosegele versetzt und in Abhängigkeit ihrer Größe auf 1-3 % igen Agarosegelen mit dem Laufpuffer bei 100 bis 200 mV 32 elektrophoretisch aufgetrennt. Ein Längenstandard (s. 2.1.6) wurde zur Abschätzung der DNA-Menge und Länge ebenfalls mit aufgetragen. Nach Anfärbung der DNA mit Ethidiumbromid wurde diese auf einem UV-Transluminator sichtbar gemacht und konnte mittels eines Geldokumentationssystems zur anschließenden Auswertung fotografiert werden. 2.2.6 SSCP-Analyse Mit dieser Methode werden Änderungen in der Basensequenz durch Konformationsänderungen in der Sekundärstruktur der Einzelstränge detektiert. Die Methode nutzt den Umstand aus, daß Einzelstrang-DNA unter nativen Bedingungen eine einzigartige sequenzabhängige Konformation einnimmt. Sequenzabweichungen bewirken eine Konformationsänderung, die im nativen Gel erhalten bleibt und die Laufgeschwindigkeit des Einzelstranges bestimmt (Orita et al., 1989). Unterschiede in der Konformation können gut bei DNA-Fragmenten bis zu einer Länge von 200 Basen detektiert werden, bei Längen über 200 bp sinkt die Effizienz (Jäckel et al., 1998, Sheffield et al., 1993). Deshalb wurden größere PCR-Fragmente vor der SSCP-Analyse mittels Restriktionsendonukleasen in kleinere Fragmente gespalten. Die Auftrennung der radioaktiv markierten PCR-Produkte erfolgte in vertikalen Elektrophoresesystemen. Alle Proben wurden mit 3µl Ladepuffer für denaturierte Polyacrylamidgele versetzt und für 5 Minuten bei 95°C denaturiert. Die Proben wurden sofort nach Denaturierung auf Eis gekühlt, um ein mögliches Wiederaneinanderlagern der Einzelstränge zu verhindern. Zur Unterscheidung von ss-DNA zu renaturierten doppelsträngigen Fragmenten wurden jeweils zwei nicht denaturierte Proben mit aufgetragen. Alle Proben wurden mit folgenden drei Gelzusammensetzungen analysiert: 33 Tab. 4: Gelzusammensetzung der SSCP-Gele Bedingung 1 Bedingung 2 Bedingung 3 4 g Glycerin 6 g Glycerin 8 g Glycerin 8 ml 10x TBE 8 ml 10x TBE 8 ml 10x TBE 12 ml 40 % PAA 12 ml 40 % PAA 16 ml 40 % PAA 4 g Harnstoff Alle Ansätze wurden auf 80 ml mit Aqua bidest aufgefüllt. Die Umgebungstemperatur betrug jeweils 4°C, die Laufzeit und die elektrische Leistung wurde in Abhängigkeit der Fragmentgrößen variiert. Die Ergebnisse wurden mittels Autoradiographie festgehalten. 2.2.7 Mikrosatelliten-Analyse Mikrosatelliten-DNA besteht aus sich wiederholenden Einheiten, die aus 110 Basenpaaren bestehen. Da Mikrosatelliten hoch polymorph sein können, kann man aufgrund der Variabilität in der Anzahl der repetitiven Elemente Allele mit unterschiedlicher Länge durch Auftrennung in denaturierenden Polyacrylamidgelen unterscheiden. Mit den zu untersuchenden Proben wurde verfahren wie in der unter 2.2.6 erwähnten SSCP-Analyse. Nicht denaturierte Proben wurden nicht mit aufgeführt. Als Längenstandard wurde eine radioaktive Sequenzierung des Bakteriophagen M13mp18 aufgetragen. Die Gelelektrophorese erfolgte bei 55 Watt bei Raumtemperatur. 34 2.2.8 DNA-Sequenzanalyse Laufunterschiede in der SSCP-Analyse wurden durch Sequenz-Analyse weiter abgeklärt. Zur Aufreinigung der PCR-Produkte wurden 4 Reaktionsansätze vereinigt und auf einem 1,5 % igen Agarosegel aufgetragen. Nach elektrophoretischer Auftrennung und Anfärbung mit Ethidiumbromid wurde das PCRProdukt unter UV-Licht aus dem Gel ausgeschnitten und mit einem DNA Purification Kit nach Angaben des Herstellers isoliert. Zur Abschätzung der Konzentration der eluierten DNA wurden jeweils 3 µl sowie 200 ng eines Markers mit definierten DNA-Konzentrationen (pUC 19 DNA/MspI Marker) auf das Agarosegel aufgetragen. Die Sequenzierreaktion wurde als sogenannte zyklische Sequenzierung durchgeführt, bei der das Kettenabbruchverfahren nach Sanger et al., unter Einsatz einer hitzestabilisierenden DNA-Polymerase wie unten beschrieben zur Anwendung kommt (Sanger et al., 1977). Da in jedem Ansatz jeweils nur ein Primer enthalten ist, wird die DNA linear und nicht wie in einer PCR exponentiell amplifiziert. Der Einbau der im Sequenzier-Mix enthaltenen fluoreszenzmarkierten ddNTPs führt bei der Kettenverlängerung zum Abbruch, so daß Fragmente mit unterschiedlicher Länge entstehen. Der Reaktionsmix (10 µl-Ansatz) enthielt folgende Komponenten: DNA-Menge 50 ng Primer (entweder 3' oder 5') 10 pmol Big Dye Terminator ready reaction mix 2 µl ad 10 µl mit Aqua bidest 35 Zum Schutz vor Verdunstung wurden die Proben mit einem Tropfen Mineralöl überschichtet. Tab. 5: Programm des Thermocyclers für Sequenzierreaktion: Zeit in min. Anzahl der Schleifen Zyklusschritt Temperatur in °C Denaturieren 94 5 1 Denaturieren Primer-Anlagerung Kettenverlängerung 94 50 60 0,5 0,75 4 30 Lagerung 4 ∞ Im Anschluß an die Sequenzier-Reaktion wurde die DNA in 4-fachem Volumen 95 % igem Ethanol gefällt, abzentrifugiert und mit 70 % igem Ethanol gereinigt. Nach erneutem Zentrifugieren und Trocknen wurde die DNA in 4,5 µl Formamid Loading Dye gelöst und die Proben vor Gelelektrophorese bei 95°C für 3 Minuten denaturiert. Gelzusammensetzung für Sequenzanalyse: 7 % Acrylamid/Bisacrylamid (19:1) 8 M Harnstoff 10 % TBE (10x) 0,03 % APS 0,4 ‰ TEMED Die DNA-Fragmente wurden mit Hilfe eines ABI-Sequenzierautomaten 373 analysiert. 36 2.2.9 Statistische Auswertung Die individualspezifischen Genotypen der untersuchten Population wurden in das Datenbank-Computerprogramm dBase V eingegeben und die Allel-, Genotyp- und Phänotypfrequenzen, die erwartete Heterozygotierate nach dem Hardy-Weinberg-Gesetz sowie der Informationsgehalt eines Polymorhismus mit Hilfe eines in dBase V geschriebenen Computerprogramms nach der Formel von Botstein et al., 1980 berechnet. Die Genfrequenz von homo- und heterozygoten Polymorphismen in der Studienpopulation war zuvor mittels des Programms GENEPOP Version 3.1c (Version 1.2 beschrieben von Raymond and Rousset, 1995) auf Hardy-Weinberg-Gleichgewicht getestet worden, um methodische Fehler auszuschließen. Die gewonnenen Allel-, Genotyp- und Phänotypfrequenzen der H. pylori infizierten Patienten und gesunden Kontrollen wurden auf Abweichungen und damit mögliche Prädispositionsfaktoren hin untersucht. Differenzen in den ermittelten Frequenzen wurden mittels χ²-Test (nach Pearson et al.) auf statistische Signifikanz hin überprüft. Als statistisch signifikant wurden Unterschiede mit einem p-Wert kleiner 0,05 angesehen. Hierbei handelt es sich um die Irrtumswahrscheinlichkeit, mit der man gerade noch die Nullhypothese hätte widerlegen können. Um zufällige Assoziationen auszuschließen, wurden die p-Werte einer Korrektur für Vielfachvergleiche (Bonferroni-Korrektur) unterzogen, bei der das einfache Signifikanzniveau p mit der Anzahl der Tests multipliziert wird. Der korrigierte p-Wert (pc) berechnet sich nach der Gleichung pc = 1-(1-p)ⁿ, wobei n die Anzahl der unabhängigen Vergleiche darstellt (Svejgaard and Ryder, 1994). Das relative Risiko wurde nach der Formel von Svejgaard et al. berechnet (Svejgaard et al., 1983). 37 3. Ergebnisse In der vorliegenden Arbeit wurden genetische Polymorphismen der IL-1Familie auf einen Zusammenhang mit einer H. pylori-Infektion sowie deren Folgeerkrankungen untersucht. IL-1 beta hat für die Entwicklung H. pylori-assoziierter Erkrankungen eine große Bedeutung und wurde bereits von zahlreichen Autoren beschrieben (El-Omar et al., 2001). Das pro-inflammatorische Zytokin wird mit einer stark erhöhten Rate in einer mit H. pylori befallenen Magenschleimhaut exprimiert. Es stellt einen der potentesten Inhibitoren der Magensäureproduktion dar und ermöglicht dadurch anderen Bakterien, die karzinogene Nitrosamine produzieren können, sich in der Magenschleimhaut anzusiedeln (El-Omar et al., 2003). Dem IL-1 alpha konnte im Vergleich zum IL-1 beta bislang noch kein so großer Einfluß nachgewiesen werden, was möglicherweise damit zusammenhängt, daß IL-1 alpha unter normalen Bedingungen nicht ins Serum ausgeschüttet wird, sondern im Zytosol der Zelle oder membrangebunden an der Zelloberfläche verbleibt (Dinarello, 1996, Humajima et al., 2001). Im Mittelpunkt des Interesses standen in der Literatur beschriebene Polymorphismen von IL-1 beta sowie die gezielte Suche nach bislang unbekannten Polymorphismen in den exonischen Sequenzen der beta-Untereinheit. Die Untersuchung von Polymorphismen in der alpha-Untereinheit beschränkte sich auf bislang bekannte Polymorphismen (Bidwell et al., 1999). Die Exone der beta-Untereinheit und polymorphen Sequenzen des IL-1 alpha und beta wurden in insgesamt 18 verschiedenen PCR-Systemen mit geeigneten Primern amplifiziert. Dazu wurden die PCR-Bedingungen gemäß Tab. 3 variiert und die optimalen Versuchsbedingungen für das jeweilige System ermittelt. 38 Tab. 6 enthält die optimalen Versuchsbedingungen für die einzelnen Systeme. Tab. 6: Versuchsbedingungen der einzelnen Systeme System Primer Position Fragmentgröße PCR-Bedingung Restriktion IL1b-511 IL1b-511 3’ -511 117 bp, 189 bp TA = 52°C, 28 Z. AVA I IL1b-511 5’ IL1b-31 IL1b-31 3’ 1mMol MgCl2 -31 69 bp, 190 bp IL1b-31 5’ IL1b ex2 IL1b ex4 IL1bex2 3’ 160 bp, 127 bp, 84 bp TA = 57°C, 28 Z. Mbo I, RSA I 1 mMol MgCl2 IL1bex3 3’ 118 bp, 146 bp, 77 bp, TA = 60°C, 30 Z. Il1bex3 5’ 86 bp 1 mMol MgCl2 IL1bex4 3’ 117 bp, 72 bp, 138 bp TA = 57°C, 28 Z. IL1bex4 5’ Alu I Alu I 1,5 mMol MgCl2 IL1b ex5/int4 IL1bex5 3’ +3877 IL1bex5 5’ +3954 IL1b ex6 IL1bex6 3’ 200 bp, 143 bp TA = 58°C, 28 Z. Msp I 1 mMol MgCl2 62 bp, 106 bp, 110 bp IL1bex6 5’ IL1b ex7.1 Alu I 1,5 mMol MgCl2 IL1bex2 5’ IL1b ex3 TA = 52°C, 28 Z. TA = 60°C, 28 Z. RSA I 2 mMol MgCl2 IL1bex7.1 3’ 82 bp, 175 bp IL1bex7.1 5’ TA = 49°C, 30 Z. RSA I 3 mMol MgCl2 DMSO 5 % IL1b ex7.2 IL1bex7.2 3’ 52 bp, 110 bp, 170 bp IL1bex7.2 5’ IL1b ex7.3 TA = 49°C, 28 Z Mbo I, Mbo II 1 mMol MgCl2 IL1bex7.3 3’ 77 bp, 134 bp IL1bex7.3 5’ TA = 54°C, 28 Z. Dde I 1,5 mMol MgCl2 Formamid 5 % IL1b ex7.4 IL1bex7.4 3’ 75 bp, 125 bp, 150 bp IL1bex7.4 5’ IL1a-889 IL1a-889 3’ IL1aex5 3’ -889 20 bp, 122 bp TA = 50°C, 30 Z. Nco I 1 mMol MgCl2 +4845 124 bp, 67 bp, 20 bp IL1aex5 5’ IL1a int5 Alu I 2,5 mMol MgCl2 IL1a-889 5’ IL1a ex5 TA = 53°C, 30 Z. TA = 65°C, 30 Z. 1 mMol MgCl2 IL1aint5 3’ +7695 bis IL1aint5 5’ +7742 159 bp bis 177 bp TA = 63°C, 30 Z. 1,25 mMol MgCl2 TA : Primeranlagerungs-Temperatur, Z : Zyklen Fnu4HI 39 Die angeschlossene SSCP-Methode wurde gewählt, um sowohl die bekannten Sequenzvariationen zu bestätigen als auch bislang unbekannte darstellen zu können. PCR-Produkte, die länger als 200 Basenpaare waren, wurden vorher mit den in Tab. 6 angeführten Restriktionsendonukleasen geschnitten. Um die Wahrscheinlichkeit einer Polymorphismendetektion zu erhöhen, wurde die Konzentration der SSCP-Gele sowie der Zusatz an Harnstoff variiert (s. Tab. 4). Zeigte sich im SSCP-Gel ein Laufunterschied innerhalb der Proben, wurde eine Sequenzanalyse angeschlossen, in der die einzelnen Polymorphismen lokalisiert werden konnten. Hierzu wurde die DNA einzelner Individuen sequenziert, die nach dem Bandenmuster im SSCP-Gel als homo- bzw. heterozygot einzuordnen waren. Für die Untersuchungen des Patientenkollektivs auf die entsprechenden Polymorphismen wurde die jeweils am meisten geeignete Untersuchungsmethode ausgesucht. Sie ist an den entsprechenden Stellen jeweils angeführt. 3.1 Untersuchung der beta-Untereinheit Mit den SSCP-Gelen der Systeme IL1b-511, IL1b-31 und IL1b ex5/int4 konnten Laufunterschiede sichtbar gemacht werden und 4 bereits beschriebene Polymorphismen in der anschließenden Sequenzanalyse bestätigt werden. 40 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 3233 34 35 36 37 38 39 40 41 259 bp 190 bp Abb. 6: Ausschnitt aus einer Autoradiographie eines SSCP-Gels des Systems IL1b-31. Der Polymorphismus an der Position -31 im IL-1 beta Gen wurde mittels RFLP detektiert (siehe Tab. 6). Die Zahlen am rechten Rand der Abb. geben die Größen der nach der Restriktion des PCR-Produktes entstandenen Fragmente in Basenpaaren an. Von links nach rechts sind die zu untersuchenden Proben aufgetragen. Spur 1 und 2 enthalten nicht denaturierte Proben, Spur 3 enthält einen Leerwert, die übrigen Proben wurden vor dem Auftragen hitzedenaturiert. Spur 5 enthält eine homozygote Probe für das C-Allel, Spur 8 zeigt eine heterozygote Probe und Spur 13 enthält eine homozygote Probe für das T-Allel (die diskrete Bande auf Höhe des 259 bp großen Fragments entspricht einem partiellen Verdau). 3.1.1 Analyse des Systems IL1b-511 Bei dem in der Literatur beschriebenen Polymorphismus (Di Giovine et al., 1992) handelt es sich um einen einzelnen Basenaustausch an der Stelle –511 relativ zum Transkriptionsstartpunkt von C nach T, der die Erkennungssequenz des Restriktionsenzyms AVA 1 verändert. Ist die Sequenz an dieser Stelle unverändert (Allel C), so wird das 306 bp große PCR-Produkt in zwei Fragmente der Größe 117 bp und 189 bp restringiert. Bei Vorliegen des T-Allels ist das Erkennungsmotiv für AVA 1 nicht enthalten. 41 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 306 bp 189 bp 117 bp Abb. 7: Ausschnitt aus einem 2 % igen Agarosegel des Systems IL1b-511. Der Polymorphismus an der Position -511 im IL-1 beta Gen wurde mittels RFLP detektiert (siehe Tab. 6). Die Zahlen am rechten Rand der Abb. geben die Größen der nach der Restriktion des PCR-Produktes entstandenen Fragmente in Basenpaaren an. Von links nach rechts sind die zu untersuchenden Proben aufgetragen. Spur 1 enthält einen pUC 19 DNA/MspI-Längenstandard (Marker). Spur 3, 10 und 11 zeigen eine homozygote Probe für das T-Allel, die Spuren 2, 8, 9, 13, 14, 17, 19 und 20 zeigen homozygote Proben für das C-Allel (die diskreten Banden auf Höhe des 306 bp großen Fragments entsprechen einem partiellen Verdau), die Proben in den übrigen Spuren sind heterozygot. Insgesamt wurden 383 Individuen auf diesen Polymorphismus untersucht und typisiert. Anschließend wurden die Allel- und Genotypenfrequenzen von H. pylori infizierten Patienten und Kontrollen (H. pylori negative Individuen) berechnet. Außerdem wurde die Gruppe der Infizierten in H. pylori bedingte Folgeerkrankungen wie Ulcus ventriculi und Ulcus duodeni unterteilt und die errechneten Allel- und Genotypenfrequenzen ebenfalls mit denen der Kontrollen verglichen. 42 0,8 0,7 0,6 rel. Häufigkeit 0,5 Hp positiv Hp negativ 0,4 0,3 0,2 0,1 0 T C IL-1 beta -511 Allele 0,6 0,5 rel. Häufigkeit 0,4 Hp positiv Hp negativ 0,3 0,2 0,1 0 TT TC CC IL-1 beta -511 Genotypen Abb. 8 a) und b): Allel- und Genotypverteilung des -511 C/T-Polymorphismus im IL-1 beta Gen. Die vergleichende Betrachtung der Allel- und Genotypverteilung zwischen H. pylori negativen (Kontrollen) und positiven Individuen zeigte keinen signifikanten Unterschied bei einem gehäuften Auftreten des T-Allels bzw. des T/T-Genotypen bei den H. pylori positiven Patienten. 43 0,8 0,7 0,6 rel. Häufigkeit 0,5 Kontrollen (Hp neg.) Ulcus duodeni 0,4 0,3 0,2 0,1 0 T C IL-1 beta -511 Allele 0,6 0,5 rel. Häufigkeit 0,4 Kontrollen (Hp neg.) Ulcus duodeni 0,3 0,2 0,1 0 TT TC CC IL-1 beta -511 Genotypen Abb. 9 a) und b): Allel- und Genotypverteilung des -511 C/T-Polymorphismus im IL-1 beta Gen. Die vergleichende Betrachtung der Allelverteilung zwischen H. pylori negativen Individuen (Kontrollen) und Individuen mit einem Ulcus duodeni (H. pylori positiv) wies einen signifikanten Unterschied mit einem gehäuften Auftreten des TAllels bei den Ulkus-Patienten auf (p = 0,0405), während die vergleichende Betrachtung der Genotypverteilung keinen signifikanten Unterschied zeigte. 44 0,8 0,7 0,6 rel. Häufigkeit 0,5 Kontrollen (Hp neg.) Ulcus ventr. 0,4 0,3 0,2 0,1 0 T C IL-1 beta -511 Allele 0,6 0,5 rel. Häufigkeit 0,4 Kontrollen (Hp neg.) Ulcus ventr. 0,3 0,2 0,1 0 TT TC CC IL-1 beta -511 Genotypen Abb. 10 a) und b): Allel- und Genotypverteilung des -511 C/T-Polymorphismus im IL-1 beta Gen. Die vergleichende Betrachtung der Allelverteilung zwischen H. pylori negativen Individuen (Kontrollen) und Individuen mit einem Ulcus ventriculi (H. pylori positiv) wies einen signifikanten Unterschied mit einem gehäuften Auftreten des TAllels bei den Ulkus-Patienten auf (p = 0,0252), während die vergleichende Betrachtung der Genotypverteilung keinen signifikanten Unterschied zeigte. 45 0,7 0,6 rel. Häufigkeit 0,5 0,4 Gastritis Ulcus ventriculi Ulcus duodeni 0,3 0,2 0,1 0 T C IL-1 beta -511 Allele 0,6 0,5 rel. Häufigkeit 0,4 Gastritis Ulcus ventriculi Ulcus duodeni 0,3 0,2 0,1 0 TT TC CC IL-1 beta -511 Genotypen Abb. 11 a) und b): Allel- und Genotypverteilung des -511 C/T-Polymorphismus im IL-1 beta Gen. Die vergleichende Betrachtung der Allel- und Genotypverteilung zwischen Individuen mit einer Gastritis, einem Ulcus ventriculi und einem Ulcus duodeni (alle H. pylori positiv) zeigte keinen signifikanten Unterschied. 46 3.1.2 Analyse des Systems IL1b-31 Auch hier wurde die Agarosegelelektrophorese zur Typisierung des in der Literatur beschriebenen Polymorphismus (Guash et al., 1996) gewählt, der die Sequenz für eine TATA-Box enthält. Durch einen Basenaustausch von T nach C wird gleichzeitig die Erkennungssequenz des Restriktionsenzyms Alu I so verändert, daß bei Vorliegen des C-Allels das 259 bp große PCRFragment nicht gespalten werden kann. Liegt hingegen das T-Allel vor, so entstehen ein 69 bp und 190 bp großes Fragment. Insgesamt wurden 389 Individuen auf diesen Polymorphismus untersucht und typisiert. 0,8 0,7 0,6 rel. Häufigkeit 0,5 Hp positiv Hp negativ 0,4 0,3 0,2 0,1 0 C T IL-1 beta -31 Allele Abb. 12: Allelverteilung des -31 T/C-Polymorphismus im IL-1 beta Gen. Die vergleichende Betrachtung der Allelverteilung zwischen H. pylori negativen (Kontrollen) und positiven Individuen zeigte keinen signifikanten Unterschied bei einem gehäuften Auftreten des T-Allels bei den H. pylori negativen Patienten. 47 0,6 0,5 rel. Häufigkeit 0,4 Hp positiv Hp negativ 0,3 0,2 0,1 0 CC CT TT IL-1 beta -31 Genotypen Abb. 13: Genotypverteilung des -31 T/C-Polymorphismus im IL-1 beta Gen. Die vergleichende Betrachtung der Genotypverteilung zwischen H. pylori negativen (Kontrollen) und positiven Individuen zeigte keinen signifikanten Unterschied bei einem gehäuften Auftreten des T-Allels bei den H. pylori negativen Patienten. 48 0,8 0,7 0,6 rel. Häufigkeit 0,5 Kontrollen (Hp neg.) Ulcus ventriculi 0,4 0,3 0,2 0,1 0 C T IL-1 beta -31 Allele 0,5 0,45 0,4 rel. Häufigkeit 0,35 0,3 Kontrollen (Hp neg.) Ulcus ventriculi 0,25 0,2 0,15 0,1 0,05 0 CC CT TT Il-1 beta -31 Genotypen Abb. 14 a) und b): Allel- und Genotypverteilung des -31 T/C-Polymorphismus im IL-1 beta Gen. Die vergleichende Betrachtung der Allelverteilung zwischen H. pylori negativen Individuen (Kontrollen) und Individuen mit einem Ulcus ventriculi (H. pylori positiv) wies einen signifikanten Unterschied mit einem gehäuften Auftreten des CAllels bei den Ulkus-Patienten auf (p = 0,041), während die vergleichende Betrachtung der Genotypverteilung keinen signifikanten Unterschied zeigte. 49 0,8 0,7 0,6 rel. Häufigkeit 0,5 Kontrollen (Hp neg.) Ulcus duodeni 0,4 0,3 0,2 0,1 0 C T IL-1 beta -31 Allele 0,5 0,45 0,4 rel. Häufigkeit 0,35 0,3 Kontrollen (Hp neg.) Ulcus duodeni 0,25 0,2 0,15 0,1 0,05 0 CC CT TT IL-1 beta -31 Genotypen Abb. 15 a) und b): Allel- und Genotypverteilung des -31 T/C-Polymorphismus im IL-1 beta Gen. Die vergleichende Betrachtung der Allelverteilung zwischen H. pylori negativen Individuen (Kontrollen) und Individuen mit einem Ulcus duodeni (H. pylori positiv) zeigte keinen signifikanten Unterschied bei einem gehäuften Auftreten des CAllels bei den Ulkus-Patienten. 50 0,7 0,6 rel. Häufigkeit 0,5 0,4 Gastritis Ulcus ventriculi Ulcus duodeni 0,3 0,2 0,1 0 C T IL-1 beta -31 Allele 0,6 0,5 rel. Häufigkeit 0,4 Gastritis Ulcus ventriculi Ulcus duodeni 0,3 0,2 0,1 0 CC CT TT IL-1 beta -31 Genotypen Abb. 16 a) und b): Allel- und Genotypverteilung des -31 T/C-Polymorphismus im IL-1 beta Gen. Die vergleichende Betrachtung der Allel- und Genotypverteilung zwischen Individuen mit einer Gastritis, einem Ulcus ventriculi und einem Ulcus duodeni (alle H. pylori positiv) zeigte keinen signifikanten Unterschied. 51 3.1.3 Analyse des Systems IL1b ex5/int4 Die Primer und das Restriktionsenzym Msp I (s. Tab. 2 und Tab. 6) wurden für das System IL1b ex5/int4 so gewählt, daß die bekannten Austausche IL-1b+3877 (Guash et al., 1996) und IL-1b+3954 (Pociot et al., 1992) beide auf dem gleichen Fragment (143 bp) lagen und damit mit Hilfe der SSCP-Methode Haplotypen ausgewertet werden konnten. Es handelt sich um zwei Polymorphismen in der Erkennungssequenz für das Restriktionsenzym BsoFI an der Stelle +3877 sowie Taq I an der Stelle +3954, der mit der Transition C/T das auf die Proteinsequenz bezogene Codon 105 von TTC (Phe) zu TTT (Phe) verändert und damit einen stillen Austausch in Phenylalanin darstellt. Mit Hilfe der SSCP-Methode konnten die Haplotypen bei 386 Individuen bestimmt werden. Die SSCP-Analyse erfolgte mit einer Gelbedingung von 10 % Glycerin und 8 % PAA bei 35 Watt über 10 Std. bei einer Raumtemperatur von 4°C. 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 200 bp 143 bp Abb. 17: Ausschnitt aus einer Autoradiographie eines SSCP-Gels des Systems IL1b ex4/int5. Die Polymorphismen an der Position +3877 sowie +3954 im IL-1 beta Gen 52 wurden mittels RFLP detektiert (siehe Tab. 6). Die Zahlen am rechten Rand der Abb. geben die Größen der nach der Restriktion des PCR-Produktes entstandenen Fragmente in Basenpaaren an. Von links nach rechts sind die zu untersuchenden Proben aufgetragen. Alle in der Abb. zu erkennenden Proben wurden vor dem Auftragen hitzedenaturiert. Laufunterschiede im Gel, die den Haplotypen aus den Polymorphismen +3877 und +3954 entsprechen, sind durch Pfeile gekennzeichnet. Folgende vier Haplotypen sind möglich: IL-1b+3877G+3954C, IL1b+3877G+3954T, IL-1b+3877A+3954C sowie IL-1b+3877A+3954T. Es gibt insgesamt zehn verschiedene Typisierungsvariationen, da pro Individuum jeweils zwei Haplotypen möglich sind. Unter den 386 Individuen wurden von den zehn möglichen sechs Variationen gefunden. Einzelne Variationen sind in Abb. 16 mit Pfeilen gekennzeichnet. Die Variationen +3877A/A+3954T/T, +3877A/G+3954T/T, +3877A/A+3954T/C und +3877A/G+3954C/T (hier läßt sich allerdings nicht differenzieren, ob die veränderten Sequenzen auf demselben Allel liegen oder auf beide Allele verteilt sind) konnten nicht gefunden werden. 53 0,35 0,3 rel. Häufigkeit 0,25 0,2 Hp positiv Hp negativ 0,15 0,1 0,05 0 +3877G/G+3954T/T +3877G/G+3954C/T +3877A/G+3954C/T +3877G/G+3954C/C +3877A/G+3954C/C +3877A/A+3954C/C Haplotypen Abb. 18: Haplotypverteilung des +3877- und +3954-Polymorphismus im IL-1 beta Gen. Die vergleichende Betrachtung der Haplotypverteilung zwischen H. pylori negativen (Kontrollen) und positiven Individuen zeigte keinen signifikanten Unterschied bei einem gehäuften Auftreten der Variation +3877A/G+3954C/C T bei den H. pylori positiven Patienten. 0,35 0,3 rel. Häufigkeit 0,25 0,2 Kontrollen Ulcus duod 0,15 0,1 0,05 0 +3877G/G+3954T/T +3877G/G+3954C/T +3877A/G+3954C/T +3877G/G+3954C/C +3877A/G+3954C/C +3877A/A+3954C/C Haplotypen Abb. 19: Haplotypverteilung des +3877- und +3954-Polymorphismus im IL-1 beta 54 Gen. Die vergleichende Betrachtung der Haplotypverteilung zwischen H. pylori negativen (Kontrollen) und Individuen mit einem Ulcus duodeni (H. pylori positiv) zeigte keinen signifikanten Unterschied bei einem gehäuften Auftreten der Variation +3877A/G+3954C/C T bei den Ulkus-Patienten. 0,35 0,3 rel. Häufigkeit 0,25 0,2 Kontrollen Ulcus vent. 0,15 0,1 0,05 0 +3877G/G+3954T/T +3877G/G+3954C/T +3877A/G+3954C/T +3877G/G+3954C/C +3877A/G+3954C/C +3877A/A+3954C/C Haplotypen Abb. 20: Haplotypverteilung des +3877- und +3954-Polymorphismus im IL-1 beta Gen. Die vergleichende Betrachtung der Haplotypverteilung zwischen H. pylori negativen (Kontrollen) und Individuen mit einem Ulcus ventriculi (H. pylori positiv) zeigte keinen signifikanten Unterschied bei einem gehäuften Auftreten der Variation +3877G/G+3954C/T bei den Ulkus-Patienten. Die Variation +3877G7G+3954T/T trat in der Ulkus-Gruppe nicht auf, aber auch hier zeigte sich kein signifikanter Unterschied in der Verteilung. Für die Systeme IL1b ex2, IL1b ex3, IL1b ex4, IL1b ex6 und IL1b ex7 konnten in allen 3 SSCP-Gelbedingungen keine Laufunterschiede festgestellt und keine neuen Polymorphismen detektiert werden. Die folgende Abbildung zeigt einen Ausschnitt der Autoradiographie des SSCP-Gels des Systems von IL1b ex2. 55 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 Abb. 21: Ausschnitt aus einer Autoradiographie eines SSCP-Gels des Systems IL1b ex2. Hier sind keine Laufunterschiede im SSCP-Gel zu erkennen. 3.2 Untersuchung der alpha-Untereinheit 3.2.1 Analyse des Systems IL1a-889 Die Promotorsequenz des Gens von IL-1 alpha enthält einen publizierten Polymorphismus mit einem Nukleotidaustausch von C nach T an der Stelle –889 relativ zum Transkriptionsstartpunkt (Mc Dowell et al., 1995). Die Starteroligonukleotide für dieses System wurden so gewählt, daß eine Schnittstelle für das Restriktionsenzym Nco I entsteht (s. Tab. 2 und Tab. 6). Bei Erkennen der Sequenz durch das Enzym liegt das Allel C vor und es 56 entstehen Fragmente einer Größe von 20 bp und 122 bp, bei Nichterkennen (Allel T) ein einzelnes Fragment von 142 bp. Die Typisierung für 391 Individuen erfolgte mittels Agarosegelelektrophorese. 1 2 3 4 5 6 7 8 9 10 11 12 13 14 142 bp 122 bp Abb. 22: Ausschnitt aus einem 3 % igen Agarosegel des Systems IL1a-889. Der Polymorphismus an der Position -889 im IL-1 alpha Gen wurde mittels RFLP detektiert (siehe Tab. 6). Die Zahlen am rechten Rand der Abb. geben die Größen der nach der Restriktion des PCR-Produktes entstandenen Fragmente in Basenpaaren an. Das kleine Fragment (20 bp) ist auf Grund seiner geringen Größe in dem Gel nicht mehr zu erkennen. Von links nach rechts sind die zu untersuchenden Proben aufgetragen. Spur 9 enthält einen pUC 19 DNA/MspI-Längenstandard (Marker). Spur 1, 3, 4, 6, 8, 10, 12, 13 und 14 zeigen eine homozygote Probe für das C-Allel, Spur 7 zeigt eine homozygote Probe für das T-Allel, die Proben in den übrigen Spuren sind heterozygot. 57 0,8 0,7 0,6 rel. Häufigkeit 0,5 Hp positiv Hp negativ 0,4 0,3 0,2 0,1 0 T C IL-1 alpha -889 Allele 0,6 0,5 rel. Häufigkeit 0,4 Hp positiv Hp negativ 0,3 0,2 0,1 0 TT TC CC IL-1 alpha -889 Genotypen Abb. 23 a) und b): Allel- und Genotypverteilung des -889 C/T-Polymorphismus im IL-1 alpha Gen. Die vergleichende Betrachtung der Allel- und Genotypverteilung zwischen H. pylori negativen (Kontrollen) und positiven Individuen zeigte keinen signifikanten Unterschied. 58 0,8 0,7 0,6 rel. Häufigkeit 0,5 Kontrollen (Hp neg.) Ulcus ventriculi 0,4 0,3 0,2 0,1 0 T C IL-1 alpha -889 Allele 0,6 0,5 rel. Häufigkeit 0,4 Kontrollen (Hp neg.) Ulcus ventriculi 0,3 0,2 0,1 0 TT TC CC IL-1 alpha -889 Genotypen Abb. 24 a) und b): Allel- und Genotypverteilung des -889 C/T-Polymorphismus im IL-1 alpha Gen. Die vergleichende Betrachtung der Allel- und Genotypverteilung zwischen H. pylori negativen Individuen (Kontrollen) und Individuen mit einem Ulcus ventriculi (H. pylori positiv) zeigte keinen signifikanten Unterschied. 59 0,8 0,7 0,6 rel. Häufigkeit 0,5 Kontrollen (Hp neg.) Ulcus duodeni 0,4 0,3 0,2 0,1 0 T C IL-1 alpha -889 Allele 0,6 0,5 rel. Häufigkeit 0,4 Kontrollen (Hp neg.) Ulcus duodeni 0,3 0,2 0,1 0 TT TC CC IL-1 alpha -889 Genotypen Abb. 25 a) und b): Allel- und Genotypverteilung des -889 C/T-Polymorphismus im IL-1 alpha Gen. Die vergleichende Betrachtung der Allel- und Genotypverteilung zwischen H. pylori negativen Individuen (Kontrollen) und Individuen mit einem Ulcus duodeni (H. pylori positiv) zeigte keinen signifikanten Unterschied. 60 3.2.2 Analyse des Systems IL1a ex5 Ein bereits in der Literatur veröffentlichter Polymorphismus liegt im Exon 5 der Alpha-Untereinheit an der Stelle +4845 (A.v.d. Velden et al., 1993). Auch hier handelt es sich um einen einzelnen Basenaustausch. Durch die Transition G/T kommt es auf die Proteinsequenz bezogen in der Aminosäure 112 zu einem Austausch von Alanin zu Serin. Anlehnend an Jouvenne et al. wurden PCR-Primer synthetisiert, die eine zusätzliche Erkennungssequenz für das Restriktionsenzym Fnu4HI enthielten, so daß insgesamt zwei Schnittstellen vorhanden sind. Ist die neu synthetisierte Schnittstelle für das Enzym vorhanden (Allel G), erhielt man ein 124 bp und 20 bp sowie ein 67 bp großes Fragment. Fehlt die zweite Schnittstelle, entstanden ein 144 bp und das 67 bp große Fragment. 387 Individuen wurden mit der Agarosegelelektrophorese typisiert. 1 2 3 4 5 6 7 8 9 10 11 12 13 14 144 bp 124 bp Abb. 26: Ausschnitt aus einem 3 % igen Agarosegel des Systems IL1a ex5. Der Polymorphismus an der Position +4845 im IL-1 alpha Gen wurde mittels RFLP detektiert (siehe Tab. 6). Die Zahlen am rechten Rand der Abb. geben die Größen der nach der Restriktion des PCR-Produktes entstandenen Fragmente in Basenpaaren an. Die kleineren Fragmente sind auf Grund ihrer geringen Größe in dem Gel nicht mehr zu erkennen. Von links nach rechts sind die zu untersuchenden Proben aufgetragen. Spur 6 enthält einen pUC 19 DNA/MspI-Längenstandard (Marker). Spur 2, 4, 5, 7, 9 und 11 zeigen eine homozygote Probe für das G-Allel, die übrigen Spuren enthalten heterozygote Proben. 61 0,8 0,7 0,6 rel. Häufigkeit 0,5 Hp positiv Hp negativ 0,4 0,3 0,2 0,1 0 T G IL-1 alpha exon 5 Allele 0,6 0,5 rel. Häufigkeit 0,4 Hp positiv Hp negativ 0,3 0,2 0,1 0 TT TG GG IL-1 alpha exon 5 Genotypen Abb. 27 a) und b): Allel- und Genotypverteilung des +4845 G/T-Polymorphismus im IL-1 alpha Gen. Die vergleichende Betrachtung der Allel- und Genotypverteilung zwischen H. pylori negativen (Kontrollen) und positiven Individuen zeigte keinen signifikanten Unterschied. 62 0,8 0,7 0,6 rel. Häufigkeit 0,5 Kontrollen (Hp neg.) Ulcus ventriculi 0,4 0,3 0,2 0,1 0 T G IL-1 alpha exon 5 Allele 0,6 0,5 rel. Häufigkeit 0,4 Kontrollen (Hp neg.) Ulcus ventriculi 0,3 0,2 0,1 0 TT TG GG IL-1 alpha exon 5 Abb. 28 a) und b): Allel- und Genotypverteilung des +4845 G/T-Polymorphismus im IL-1 alpha Gen. Die vergleichende Betrachtung der Allel- und Genotypverteilung zwischen H. pylori negativen Individuen (Kontrollen) und Individuen mit einem Ulcus ventriculi (H. pylori positiv) zeigte keinen signifikanten Unterschied. 63 0,8 0,7 0,6 rel. Häufigkeit 0,5 Kontrollen (Hp neg.) Ulcus duodeni 0,4 0,3 0,2 0,1 0 T G Il-1 alpha exon 5 Allele 0,6 0,5 rel. Häufigkeit 0,4 Kontrollen (Hp neg.) Ulcus duodeni 0,3 0,2 0,1 0 TT TG GG IL-1 alpha exon 5 Genotypen Abb. 29 a) und b): Allel- und Genotypverteilung des +4845 G/T-Polymorphismus im IL-1 alpha Gen. Die vergleichende Betrachtung der Allel- und Genotypverteilung zwischen H. pylori negativen Individuen (Kontrollen) und Individuen mit einem Ulcus duodeni (H. pylori positiv) zeigte keinen signifikanten Unterschied. 64 Der Aminosäureaustausch von Alanin zu Serin in Exon 5 des IL-1 alpha Gens scheint damit ohne Einfluß auf das Entstehen einer H. pyloriInfektion oder eine ihrer Folgeerkrankungen zu sein. 3.2.3 Analyse des Systems IL1a int5 Im fünften Intron des IL-1 alpha Gens wurde ein Mikrosatellit (AC)n zwischen Position 7695 bis 7742 in der publizierten Sequenz von Furutani et al., 1986 identifiziert.Die Starternukleotide wurden nach Epplen, C. et al. so gewählt, daß je nach Anzahl der Wiederholungseinheit AC Fragmente einer Größe von 159 bis 177 bp entstanden. Zur Typisierung des Patientenkollektivs wurden die radioaktiv markierten PCR-Produkte auf einem denaturierenden 6 % igen Polyacrylamidgel bei 65 Watt bei Raumtemperatur elektrophoretisch aufgetrennt. Die Ergebnisse wurden mittels Autoradiographie festgehalten. 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 41 42 Abb. 30: Ausschnitt aus einer Autoradiographie eines PAA-Gels zur Typisierung eines IL-1a Mikrosatelliten. Die Proben sind von links nach rechts aufgetragen. Spur 35 und 36 enthalten z. B. eine Probe, die die Allele mit 163 und 169 bp tragen. 65 0,45 0,4 0,35 rel. Häufigkeit 0,3 0,25 Hp positiv Hp negativ 0,2 0,15 0,1 0,05 0 177 bp 175 bp 173 bp 171 bp 169 bp 167 bp 165 bp 163 bp 161 bp 159 bp Allele Abb. 31: Allelverteilung des IL-1a Mikrosatelliten im IL-1 alpha Gen. Die vergleichende Betrachtung der Allelverteilung zwischen H. pylori negativen (Kontrollen) und positiven Individuen zeigte keinen signifikanten Unterschied bei einer dreigipfligen Verteilung mit einem Maximum des Allels mit einer Länge von 163 bp. 0,45 0,4 0,35 rel. Häufigkeit 0,3 0,25 Kontrollen (Hp neg.) Ulcus ventriculi 0,2 0,15 0,1 0,05 0 177 bp 175 bp 173 bp 171 bp 169 bp 167 bp 165 bp 163 bp 161 bp 159 bp Allele Abb. 32: Allelverteilung des IL-1a Mikrosatelliten im IL-1 alpha Gen. Die vergleichende Betrachtung der Allelverteilung zwischen H. pylori negativen Individuen (Kontrollen) und Individuen mit einem Ulcus ventriculi (H. pylori positiv) zeigte keinen signifikanten Unterschied. 66 0,45 0,4 0,35 rel. Häufigkeit 0,3 0,25 Kontrollen (Hp neg.) Ulcus duodeni 0,2 0,15 0,1 0,05 0 177 bp 175 bp 173 bp 171 bp 169 bp 167 bp 165 bp 163 bp 161 bp 159 bp Allele Abb. 33: Allelverteilung des IL-1a Mikrosatelliten im IL-1 alpha Gen. Die vergleichende Betrachtung der Allelverteilung zwischen H. pylori negativen Individuen (Kontrollen) und Individuen mit einem Ulcus duodeni (H. pylori positiv) zeigte keinen signifikanten Unterschied. Der Mikrosatellit im IL-1 alpha Gen hat somit keine Assoziation zu einer H. pylori-Infektion oder deren Folgeerkrankung. 67 4. Diskussion Eine Infektion mit H. pylori stellt eine multifaktorielle Erkrankung dar, deren Pathogenese bislang noch nicht in allen Einzelheiten geklärt werden konnte. Verschiedene Einflußgrößen wie bakterielle Virulenz- und Umweltfaktoren sowie Wirtsgene können auf die Infektion Einfluß nehmen (Graham, 1997). Die vorliegende Arbeit untersucht einen Aspekt dieser Interaktionen, eine mögliche Assoziation von Sequenzvariationen im IL-1-Gen mit der H. pylori-Infektion sowie deren Folgeerkrankungen Ulcus ventriculi und Ulcus duodeni. Dazu wurden die exonischen DNA-Abschnitte des IL-1Gens mit den angrenzenden intronischen Bereichen sowie die Promotorregion des IL-1 beta Gens mittels SSCP-Gelanalyse auf Sequenzvariationen durchgemustert. Zahlreiche in vitro und in vivo-Studien von Machado et al., 2001, Kato et al., 2001 sowie El-Omar et al., 2000 haben sich mit dem Einfluß von Polymorphismen im IL-1 beta-Gen auf die Entstehung des Magenkarzinoms beschäftigt, da IL-1 beta eine zentrale Rolle in der Infektion mit H. pylori durch Unterstützung der Immunantwort und gleichzeitigen Säuresuppression spielt. Die chronische Infektion mit H. pylori ist ein aber auch wesentlicher pathogenetischer Faktor der Ulkuskrankheit (Garcia-Gonzalez et al., 2001, Hellmig et al., 2005, Kuipers et al., 1995). Für das IL-1-Gen sind verschiedene Polymorphismen in der Literatur beschrieben worden, die im Rahmen dieser Arbeit mittels SSCP-Gelanalyse und anschließender Sequenzanalyse allesamt bestätigt werden konnten (Bidwell et al., 1999). Dies erlaubt eine Diskussion zur Anwendbarkeit und Verläßlichkeit dieser Methode. 68 4.1 Sensitivität und Reproduzierbarkeit der SSCP-Gelanalyse Unter optimalen Bedingungen wird die Detektionsrate für Punktmutationen bei der SSCP-Analyse mit ca. 90 % angegeben (Hayashi, 1992). Die Sensitivität hängt von der Temperatur ab, bei der die Gelelektrophorese durchgeführt wird, von Zusätzen in der Gelmatrix und der Fragmentgröße der zu untersuchenden DNA-Abschnitte. Bei der Durchführung der Arbeit wurde viel Wert darauf gelegt, die Untersuchungsbedingungen optimal zu gestalten. PCR-Produkte, die größer als 200 bp waren, wurden mit Restriktionsendonukleasen in kleinere Fragmente gespalten, da bei einer Größe über 200 bp die Effizienz der Mutationsdetektion sinkt (Jäckel et al., 1998, Sheffield et al., 1993). Die gelelektrophoretische Auftrennung erfolgte unter konstanter Umgebungstemperatur (4°C), um eine geringe Reproduzierbarkeit aufgrund von Temperaturschwankungen auszuschließen. Der Glyceringehalt des Gels, der eine schwach denaturierende Wirkung hat (Hayashi, 1992), wurde zwischen 5 % und 10 % variiert, um die Wahrscheinlichkeit für die Detektion einer Sequenzvariation zu erhöhen (Jäckel et al., 1998). Für die hohe Sensitivität und Reproduzierbarkeit der in der vorliegenden Arbeit angewandten SSCP-Bedingungen spricht, daß alle in der Literatur beschriebenen Polymorphismen nachgewiesen werden konnten. Die Reproduzierbarkeit der einzelnen elektrophoretischen Analysen wurde anhand verschiedener Kontrollproben überprüft. 4.2 Studienpopulation Alle Studienteilnehmer wurden einer Ösophago-Gastroduodenoskopie unterzogen. Personen, die in den letzten 4 Wochen eine antibiotische The- 69 rapie oder Medikamente zur Säure-Suppression erhalten hatten, wurden nicht in die Studie eingeschlossen. Auch Patienten mit Malignitätsnachweis oder Immunsuppression sowie Patienten, die einem chirurgischen Eingriff am Magen-Darm-Trakt unterzogen worden waren, wurden nicht in die Studie eingeschlossen. Der H. pylori-Status wurde mittels CLO-Test, Erregerkultur und Histologie bestimmt. Fielen zwei der Untersuchungen positiv aus, so wurden die Patienten als H. pylori infiziert eingestuft. Die Patienten wurden als nicht infiziert eingestuft, wenn alle Tests negativ ausfielen. Die Diagnose eines Magen- oder Duodenalulkus wurde aufgrund des endoskopischen Befundes gestellt. An dieser Stelle ist zu diskutieren, ob Unterschiede in den verschiedenen Assoziationsstudien der H. pylori-Folgeerkrankungen sowie in der vorliegenden Arbeit nicht auch durch die Untersuchungsmethode bedingt sind, da die Einschätzung und Beurteilung des makroskopischen Gastroskopiebefundes vom Untersucher selbst abhängig ist. 4.3 IL-1 beta Gen In der vorliegenden Arbeit wurden zwei Promoterpolymorphismen im IL-1 beta Gen an der Position -511 und -31 untersucht. Diese stehen im Kopplungsungleichgewicht, die Variation IL-1 beta-511-T tritt gemeinsam mit der Variation IL-1 beta-31-C auf. Dies wurde in zahlreichen Studien bestätigt (Hwang et al., 2002, Machado et al., 2001, Hamajima et al., 2001). Die Variation IL-1 beta-511 T und die Variation IL-1 beta-31 C stellen dabei die seltenere der jeweils zwei Variationen dar (Furuta et al., 2002). Eine der zahlreichen Studien, die sich mit dem Einfluß von Polymorphismen im IL-1-beta Gen auf die Entstehung der Folgeerkrankungen einer 70 H.pylori-Infektion beschäftigt haben, ist eine Studie von El-Omar von 2000. Der Haplotyp IL-1 beta-511 T/-31 C zeigte im homozygoten Zustand eine Assoziation zu Personen mit erniedrigter Magensäurekapazität (El-Omar et al., 2000, correction published in Nature 2001). Funktionelle Untersuchungen haben ergeben, daß der Promoterpolymorphismus IL-1 beta-31 an der Regulation der Transkription von IL-1 beteiligt ist. So zeigten beide Allele signifikante Unterschiede in der DNA-Bindungskapazität für Kernextrakte von humanen Monozyten nach der Stimulation mit Lipopolysacchariden (El-Omar et al., 2000). Eine funktionelle Studie aus Indien hatte ebenfalls Unterschiede in der Menge der produzierten mRNA in Abhängigkeit der Promoterpolymorphismen von IL-1-beta nachweisen können (Chakravorty et al., 2006). IL-1 beeinflußt die Magensäuresekretion über verschiedene Zielzellen. So konnten Prinz et al. nachweisen, daß in vitro enterochromaffinähnliche Zellen aus Ratten nach Inkubation mit IL-1 beta nach initialer erhöhter Histaminfreisetzung im weiteren Verlauf eine reduzierte Ausschüttung von Histamin zeigen. Dadurch wird in der Folge die Säuresekretion durch Parietalzellen verringert (Prinz et al., 1997). Die Infektion mit H. pylori ihrerseits moduliert die Expression von IL-1 beta. In einer Arbeit von Takashima et al., 2001 konnte im Tiermodell (Mongolian gerbil) gezeigt werden, daß es nach der Aufnahme von H. pylori in den Magen zu einem Anstieg von IL-1 beta-mRNA in der Magenschleimhaut kommt. Dadurch wird in der Folge die Produktion der Magensäure einige Monate später signifikant reduziert (Takashima et al., 2001). IL-1 beta stellt damit einen der potentesten Inhibitoren der Magensäuresekretion dar (Shang, 2005, Wolfe et al., 1992). In der vorliegenden Arbeit konnte ein vermehrtes Auftreten des Haplotyps IL-1 beta-511 T/-31 C bei Patienten mit Ulcus ventriculi im Vergleich zur 71 H. pylori negativen Kontrollgruppe nachgewiesen werden. Hellmig et al. hatten 2005 in ihrer Kohorte ein ähnliches Ergebnis gefunden. Hier hatten Träger des Haplotypen IL-1 beta-31 C/IL-1RN 2 ein erhöhtes Risiko für ein Ulcus ventriculi gezeigt, ohne daß das Ergebnis statistische Signifikanz erreichte (Hellmig et al., 2005). Die fehlende Signifikanz ist möglicherweise dadurch zu erklären, daß in unserer Kontrollgruppe eine negative Serologie für H. pylori nachgewiesen wurde, während die Kontrollgruppe der Studie von Hellmig et al. aus Blutgruppenspendern ohne Infektionskriterium für H. pylori bestand. Man muß jedoch davon ausgehen, daß Teilnehmer dieser Kontrollgruppe in Abhängigkeit von Alter und ethnischer Herkunft zu einem gewissen Prozentsatz infiziert sind. Über die Regulation der Säuresuppression durch endogenes IL-1 wird das Ausmaß der Kolonisierung durch H. pylori sowie die nachfolgende Entwicklung einer Gastritis beeinflußt (Moorchung et al., 2007). In seiner Studie von 2002 hatten Furuta et al. vermutet, daß der proinflammatorische Genotyp IL-1 beta-511 T/T durch eine funktionelle Inhibierung der Säuresekretion H. pylori eine Ausdehnung bis in die Korpusmukosa ermöglicht. Dort führt ein verstärkter Zellschaden der dort überwiegend vorhandenen Parietalzellen zu einer fortschreitenden Atrophie und einer permanenten Hypochlorhydrie (Furuta et al., 2002, On On Chan et al., 2007). Die Studiengruppe hatte gezeigt, daß dieser Genotyp mit dem höchsten mittleren Magensäure-pH-Wert assoziiert war und die ausgeprägtesten Zeichen einer Gastritis und Atrophie aufwies. Auch andere Studiengruppen hatten gezeigt, daß das Ulcus ventriculi vermehrt mit einer Korpusgastritis, einer verringerten Säuresekretion und gehäuft mit einer Atrophie auftritt (El-Omar et al., 1993, El-Omar et al., 2000, Hwang et al., 2002) Ein möglicher Interpretationsansatz für die Entstehung eines Ulcus ventriculi bei Trägern des Haplotypen IL-1 beta-511 T/-31 C in der vorliegenden 72 Arbeit könnte die sich aus der erniedrigten Säurekapazität entwickelnde Hypochlorhydrie sein, die anderen Bakterien ebenfalls die Besiedlung des Magens ermöglicht, was zu einem weiteren Zellschaden führen und die Entwicklung eines Ulcus ventriculi begünstigen kann. Das saure Magenmilieu mit einem pH-Wert von 1 bis 2 läßt normalerweise keine bakterielle Kolonialisierung der Magenschleimhaut zu. Eine Ausnahme bildet H. pylori aufgrund seiner besonderen Adaptation an dieses Habitat (siehe 1.1). Weil im Antrum höhere pH-Werte herrschen, siedelt sich H. pylori bei Aufnahme bevorzugt im Antrum an. Die chronische Infektion der Antrumschleimhaut führt zu einer vermehrten Ausschüttung von Gastrin aus den im Antrum lokalisierten G-Zellen. Hierdurch wird die Säuresekretion entweder direkt durch Stimulation der überwiegend im Magenfundus und -korpus befindlichen Parietalzellen oder indirekt über eine vermehrte Histaminfreisetzung erhöht (Malfertheimer et al., 1994, Calam et al., 1997). Dieser Effekt wird außerdem verstärkt durch die aufgrund der H. pylori-Infektion reduzierten Expression von Somatostatin, einem gastrin- und magensäurehemmendem Hormon in der Magenmukosa (Malfertheimer et al., 1994, Calam et al., 1997). Durch sezernierten Magenschleim wird die Kolonisation der Magenmukosa mit H. pylori erschwert, weil der Erreger in diesem von der Peristaltik des Magens in tiefer gelegene Darmabschnitte transportiert wird. Gelingt dem Erreger jedoch die Kolonisation der Magenmukosa, entsteht in der infizierten Magenschleimhaut ein verstärkter Zellschaden aufgrund der vermehrten Ansammlung bakterieller Toxine und Entzündungsprodukte. Die durch den Mukosaschaden verringerte Sekretion von Magenschleim führt zudem zur Ansammlung von Sauerstoffradikalen und karzinogenen Nitrosaminen, die zudem mit einer Hypochlorhydrie einhergeht. In der Folge kommt es zur Kolonisierung des Corpus ventriculi durch H. pylori mit dem Risiko einer weiteren Schädigung von Mukosazellen in diesem 73 Bereich, die möglicherweise einen Risikofaktor für die Entstehung eines Ulcus ventriculi oder eines Magenkarzinoms darstellt (Furuta et al., 2002). Die zu Beginn erwähnte Untersuchung von El-Omar et al. erbrachte neben der Assoziation mit einer verringerten Magensäurekapazität auch eine Assoziation des Haplotypen IL-1 beta-511 T/-31 C zu Patienten mit Magenkarzinom (El-Omar et al., 2000, correction published in Nature 2001). Zahlreiche neuere Studien haben die Bedeutung des Allels IL-1 beta-511 T bei der Entstehung des Magenkarzinoms bestätigt (Li et al., 2007). Weitere Studien, die eine höhere Zahl an H. pylori negativen Individuen einschließen, sind aber notwendig, um die Rolle des IL-1-Gen-Cluster in der kaukasischen Bevölkerung genauer zu untersuchen, da sich Hinweise auf eine Ulcus ventriculi-Karzinom-Sequenz häufen. In einer Studie von Hansson et al., 1996 mit über 29.000 Patienten konnte ein möglicher Zusammenhang zwischen der Entstehung eines Magenkarzinoms aus einem Ulcus ventriculi nachgewiesen werden (Hansson et al., 1996). So zeigten Patienten mit Ulcus ventriculi ein etwa 4 mal so hohes Erkrankungsrisiko für ein Magenkarzinom wie die Vergleichsgruppe. Auch andere Studien haben gezeigt, daß es histologische und physiologische Gemeinsamkeiten zwischen Patienten mit Ulcus ventriculi und Magenkarzinompatienten in Form einer schweren Korpusgastritis gibt (Furuta, T. et al., 2002, Imatani, A. et al., 2004). Die schwere Korpusgastritis kann zu einer Hypochlorhydrie durch den Verlust an Parietalzellen führen und begünstigt die Entstehung einer atrophischen Gastritis und intestinalen Metaplasie als Vorläufer eines möglichen Karzinoms (Graham et al., 1997, Moorchung et al., 2007). Die Ergebnisse der vorliegenden Arbeit unterstreichen damit die Vermutung für eine gemeinsame Entwicklungsstufe des Ulcus ventriculi und des 74 Magenkarzinoms, die durch das Auftreten bestimmter Allele im Promoterbereich von IL-1 beta in den beiden Erkrankungen moduliert wird. Zur Klärung der genauen pathophysiologischen Vorgänge bedarf es jedoch weiterer invasiver Untersuchungen. Die vorliegende Arbeit hat nicht nur ein vermehrtes Auftreten des Allels IL-1 beta-511 T bei Patienten mit Ulcus ventriculi gezeigt. Auch bei Patienten mit einem Ulcus duodeni trat dieses Allel in unserer Studienpopulation signifikant verstärkt auf, auch wenn der Trend nicht so ausgeprägt war, wie in der Ulcus-ventriculi-Gruppe. Das Ulcus duodeni ist nach den Untersuchungen von Furuta et al. und ElOmar et al. im Vergleich zum Ulcus ventriculi, das vermehrt im Korpus auftritt (s.o.), eher auf das Magenantrum lokalisiert, wo eine normale oder sogar erhöhte Säuresekretion vorliegt (El-Omar et al., 1993, El-Omar et al., 2000, Furuta et al., 2002, Hwang et al., 2002). Aus den Ergebnissen der vorliegenden Arbeit würde sich zumindest vom Trend her die Vermutung ergeben, daß der pro-inflammatorische Genotyp IL-1 beta-511 T/T überwiegend bei Patienten mit Ulcus ventriculi und weniger bei Patienten mit Ulcus duodeni auftritt, ohne daß das Ergebnis statistische Signifikanz erreicht. Nach Furuta et al. hat dieser Genotyp eine verringerte Säuresekretion zur Folge, was wiederum das vermehrte Auftreten des Ulcus ventriculi im Korpusbereich und das vermehrte Auftreten des Ulcus duodeni im Magenantrum erklären könnte. In einem Vergleich der Untergruppen der beiden Ulkusformen hatten Furuta et al. aber keinen signifikanten Unterschied in der Genotypenverteilung nachweisen können, was mit den Ergebnissen der vorliegenden Arbeit übereinstimmt (s.o.). Im Subgruppenvergleich nach Altersgruppen hatte sich aber ein signifikanter Unterschied in der Verteilung gezeigt. Der proinflammatorische Genotyp IL-1 beta-511 T/T zeigte einen protektiven Effekt auf das Auftreten eines Ulcus duodeni bei älteren Patienten über 60 75 Jahre (Furuta et al., 2002). Die Subgruppe der über 60-jährigen war allerdings mit 20 bzw. 36 Individuen verhältnismäßig klein. Einen möglichen Erklärungsansatz für die relativ homogene Verteilung in den beiden Ulkusgruppen sahen Furuta et al. darin, daß die japanische Bevölkerungsgruppe im Vergleich zu Europäern generell auch bei einer niedrigeren Säuresekretion ein Ulcus duodeni entwickeln könnte, was eine Studie von Chiba et al., 2001 nachgewiesen hatte. Die Ergebnisse der vorliegenden Arbeit würden diese Vermutung insofern nicht unterstützen, da auch in dieser Kohorte keine signifikanten Unterschiede im Verteilungsverhalten der Allele zwischen Ulcus ventriculi und Ulcus duodeni besteht. Dies ist möglicherweise aber auch auf die kleine Anzahl der Untersuchungsgruppe zurückzuführen. Zwischen ethnischen Gruppen bestehen bereits Unterschiede in der Anfälligkeit für eine Infektion mit H. pylori. Studien, die sich mit HLA-KlasseII-Genen in der Genese der H. pylori-Infektion beschäftigt haben, zeigen große Unterschiede in der Häufigkeit der HLA-DRB1-, HLA-DQA- und HLA-DQB-Allele in japanischen und europäischen Kohorten. Während der Haplotyp DRB1*1501-DQA1*01021-DQB1*0602 in der japanischen Gruppe einen protektiven Effekt für eine Infektion mit H. pylori zeigt, ist in der europäischen Gruppe kein protektiver Effekt für diesen Haplotypen zu erkennen (Kunstmann et al., 2002). Weitere Studien, die eine höhere Zahl an H. pylori negativen Individuen einschließen, sind daher notwendig, um die Rolle des IL-1-Gen-Cluster in der kaukasischen Bevölkerung zu untersuchen. Insbesondere Studien, die die Assoziation zum Ulcus ventriculi untersuchen, sind notwendig, da das Wissen über die Rolle der IL-1 beta-Polymorphismen beim Ulcus ventriculi im Vergleich zum Ulcus duodeni verhältnismäßig gering ist. 76 5. Zusammenfassung Eine Infektion mit H. pylori stellt eine verbreitete bakterielle Erkrankung des gastrointestinalen Traktes dar. In der vorliegenden Arbeit wurden genetische Polymorphismen in den Genen von IL-1 alpha und beta mittels SSCP-und Agarosegelelektrophorese typisiert und die Verteilung der einzelnen Allele in 392 deutschen Individuen in Bezug auf eine mögliche Assoziation mit einer H. pylori-Infektion sowie ihre Folgekrankheiten Ulcus duodeni und Ulcus ventriculi untersucht. Dabei trat der Haplotyp IL-1 beta-511 T/-31 C vermehrt bei Patienten mit Ulcus ventriculi im Vergleich zur H. pylori negativen Kontrollgruppe auf. Verursacht wird dies vermutlich durch die vom Genotyp IL-1 beta-511 T/T bedingte funktionelle Inhibierung der zellulären Säuresekretion. Die mit der Hypochlorhydrie möglicherweise im Zusammenhang stehende vermehrte bakterielle Besiedlung des Magens kann zu einem weiteren Zellschaden führen und somit die Entstehung eines Ulcus ventriculi fördern. Infolge dieses Zellschadens kann auch die Entstehung einer intestinalen Metaplasie mit möglichem Übergang in ein Magenkarzinoms begünstigt werden. Die Ergebnisse der vorliegenden Arbeit unterstreichen damit die Vermutung für eine gemeinsame Entwicklungsstufe des Ulcus ventriculi und des Magenkarzinoms, die durch das Auftreten bestimmter Allele im Promoterbereich von IL-1 beta in den beiden Erkrankungen moduliert wird. Hier bedürfen die genauen pathophysiologischen Vorgänge in Form weiterer invasiver Untersuchungen jedoch weiterer Klärung. 77 6. Literaturverzeichnis Abbas, A. K., Lichtman, A. H., Pober, J. S. (1994). Immunologie. Verlag Hans Huber, Seite 289-303 Andre, R., Pinteaux, E., Kimber, I., Rothwell, N. J. (2005). Differential actions of IL-1 alpha and IL-1 beta in glial cells share common IL-1 signalling pathways. Neuroreport 16(2), 153-157 Argent, R. H., Kidd, M., Owen, R. J., Thomas, R. J., Limb, M. C., Atherton, J. C. (2004). Determinants and consequences of different levels of CagA phophorylation for clinical isolates of Helicobacter pylori. Gastroenterology 127, 514-523 Atherton, J. C., Cao, P., Peek, R. M., Jr., Tummuru, M. K., Blaser, M. J., Cover, T. L. (1995). Mosaicism in vacuolating cytotoxin alleles of Helicobacter pylori. Association of specific vacA types with cytotoxin production and peptic ulceration. J Biol Chem 270(30), 1771-1777 A.v.d. Velden, P. and Reitsma, P. H. (1993). Amino acid dimorphism in IL1A is detectable by PCR amplification. Hum Mol Gen; 2(10), 1753 Basak, C., Pathak, S. K., Bhattachary, A., Mandal, D., Pathak, S., Kundu, M. (2005). NF-kappaB- and C/EBPbeta-driven interleukin-1beta gene expression and PAK1-mediated caspase-1 activition play essential roles in interleukin-1beta release from Helicobacter pylori lipopolysaccharidestimulated macrophages. J Biol Chem 280(6), 4279-4288 78 Bayerdörffer, E., Neubauer, A., Rudolph, B., Thiede, C., Lehn, N., Eidt, S., Stolte, M. (1995). Regression of primary gastric lymphoma of mucosaassociated lymphoid tissue type after cure of Helicobacter pylori infection Lancet 345, 1591-1594 Beales, I. L. P. and Calam, J (1998). Interleukin 1 beta and tumor necrosis factor alpha inhibit acid secretion in cultured rabbit parietal cells by multiple pathways. Gut 42(2), 227-234 Beissert, S., Hosoi, J., Stratigos, A., Brisette, J., Grabbe, S., Schwarz, T., Granstein, R. D. (1998). Differential regulation of epidermal cell tumorantigen presentation by IL-1 alpha and IL-1 beta. J Invest Dermatol 111(4), 609-615 Bidwell, J., Keen, L., Gallagher, G., Kimberly, R., Huizinga, T., McDermott, M. F., Oksenberg, J., McNicholl, J., Pociot, F., Hardt, C., D`Alfonso, S. (1999). Cytokine gene polymorphism in human disease: online databases. Genes and Immunity 1, 3-19 Billingham, M. E. J. (1987). Cytokines as inflammatory mediators. Brit Med Bull 43(2), 351-370 Bodger, K. and Crabtree, J.E. (1998). Helicobacter pylori and gastric inflammation. Brit Med Bull 54(1), 139-150 Calam, J., Gibbons, A., Healey, Z. V., Bliss, P., Arebi, N. (1997). How does Helicobacter pylori cause mucosal damage? Its effects on acid and gastrin physiology. Gastroenterology 113, 43-49 79 Calam, J. (1998). Clinical science of Helicobacter pylori infection: ulcers and NSAIDs. Brit Med Bull 54, 55-62 Cameron, P., Limjuco, G., Rodkey, J., Bennett, C., Schmidt, J. A. (1985). Amino acid sequence analysis of human interleukin 1 (IL-1). Evidence for biochemically distinct forms of IL-1. J Exp Med. 162(3), 790-801 Chakravorty, M., Gosh, A., Choudhury, A., Santra, A., Hembrun, J., Roychoudhury, S. (2006). Interaction between IL B promoter polymorphisms in determining susceptibility to Helicobacter pylori associated duodenal ulcer. Hum. Mutat. 27(5), 411-419 Chiba, T., Watanabe, T., Ito, T. (2001). Helicobacter pylori infection and acid secretion in patients with duodenal ulcer in Japan. Gut 48, 871-872 Clark, B. D., Collins, K. L., Gandy, M. S., Webb, A. C., Auron, P. E. (1986). Genomic sequence for human prointerleukin 1 beta: possible evolution from a reverse transcribed prointerleukin 1 alpha gene. Nucl. Acid Res. 14(20), 7897-7914 Correa, P. (1990). A human model of gastric carcinogenesis. Cancer 66, 2569-2574 Di Giovine, F. S. , Takhsh, E., Blakemore, A. I. F., Duff, G. W. (1992). Single base polymorphism at -511 in the human interleukin-1ß gene (IL1ß). Hum Mol Genet 1, 450-451 Dinarello, C.A. (1996). Biologic basis for interleukin-1 in disease. Blood 87(6), 2095-2147 80 El-Omar, E. M., Pennman, I., Dorrian, C. A., Ardill, J. E., McColl, K. E. (1993). Eradicating Helicobacter pylori infection lowers gastrin mediated acid secretion by two thirds in patients with duodenal ulcer. Gut 34(8), 1060-1065 El-Omar, E. M., Penman, I., Ardill, J. E., Mc Coll, K. E. L. (1995). Helicobacter pylori infection and Gastroenterology. Gastroenterology 109(3), 681-691 El-Omar, E. M., Carrington, M., Chow, W. H., Mc Coll, K. E., Bream, J. H., Young, H.A., Herrera, J., Lissowska, J., Yuan, C. C., Rothman, N., Lanyon, G., Martin, M., Fraumeni, J. F. Jr., Rabkin, C. S. (2000). Interleukin-1 polymorphisms associated with increased risk of gastric cancer. Nature Mar 23, 398-402 (correction published in Nature 2001, 412, 99). El-Omar, E. M. (2001). The importance of interleukin 1ß in Helicobacter pylori associated disease. Gut 48, 743-747 El-Omar, E. M., Rabkin, C. S., Gammon, M. D., Vaughan, T. L., Risch, H. A., Schoenberg, J. B., Stanford, J. L., Mayne, S. T., Goedert, J., Blot, W. J., Fraumeni, J. F., Chow, W.-H. (2003). Increased risk of noncardia gastric cancer associated with proinfalmmatory cytokine gene polymorphisms. Gastroenterology 124, 1193-1201 Epplen, C., Frank, G., Gomolka, M., Albert, E., Nurnberg, P., Epplen, J. T. (1994). Dinucleotide repeat polymorphism in the human IL1A gene. Hum Mol Gen 3, 1710 81 Farinha, P. and Gascoyne, R. D. (2005). Helicobacter pylori and lymphoma. Gastroenterology 128, 1579-1605 Farthing, M. J. G. (1998). Helicobacter pylori infection: an overview. Brit Med Bull 54, 1-6 Furuta, T., El-Omar, E. M., Xiao, F., Shirai, N., Takashima, M., Sugimurra, H. (2002). Interleukin 1ß polymorphisms increase risk of hypochlorhydria and atrophic gastritis and reduce risk of duodenal ulcer recurrence in Japan. Gastroenterology 123, 92-105 Furutani, Y., Notake, M., Fukui, T., Ohue, M., Nomura, H., Yamada, M., Nakamura, S. (1986). Complete nuceotide sequence of the gene for human interleukin 1 alpha. Nucl Acid Res Vol 14(8), 3167-3179 Garcia-Gonzalez, M. A., Lanas, A., Santolaria, S., Crusius, J. B. A., Serrano, M. T. (2001). The polymorphic IL-1B genes in the aetiopathogenesis of peptic ulcer. Clin Exp Immunol 125, 368-375 Garza-Gonzalez, E., Bosques-Padilla, F. J., El-Omar, E., Hold, G., Tijerina-Menchaca, R., Maldonado-Garza, H. J., Perez-Perez, G. I. (2005). Int J Cancer 114(2), 237-241 Gery, I., Gershon, R. K., Waksman, B. H. (1972). Potentiation of the TLymphocyte response to mitogens. J Exp Med 136, 143-155 82 Graham, D.Y., Malaty, H. M., Evans, D. G., Evans, D. J. Jr., Klein, P. D., Adam, E. (1991). Epidemiology of helicobacter pylori in an asymptomatic population in the United States. Effect of age, race, and socioeconomic status. Gastroenterology 100, 1495-1501 Graham, D.Y. (1997). Helicobacter pylori infection in the pathogenesis of duodenal ulcer and gastric cancer: a model. Gastroenterology 113, 19831989 Guash, J. F., Bertina, R. M., Reitsma, P. H. (1996). Five novel intragenic dimorphisms in the human interleukin-1 genes combine to high informativity. Cytokine 8, 598-602 Hansson, L.-E., Nyren, O., Hsing, A. W., Bergström, R., Josefsson, S., Chow, W.-H., Fraumeni, J. F. Jr., Adami, H.-O. (1996). The risk of stomach cancer in patients with gastric or duodenal ulcer disease. New Engl J Med 335, 242-249 Harris, P. R., Mobley, H. L. T., Perez-Perez, G. I., Blaser, M. J. (1996).Helicobacter pylori urease is a potent stimulus of mononuclear phagozyte activation and inflammatory cytokine production. Gastroenterol 111, 419-425 Hayashi, K. (1992). PCR-SSCP: A method for detection of mutations. GATA 9, 73-79 83 Hellmig, S., Titz, A., Steinel, S., Ott, S., Folsch, U. R., Hampe, J., Schreiber, S. (2005). Influence of IL-1 gene cluster polymorphisms on the development of H. pylori associated gastric ulcer. Immunol Lett. 100(2), 107-112 Heresbach, D., Alizadeh, M., Dabadie, A., Le Berre, N., Colombel, J. F., Yaouanq, J., Bretagne, J. F., Semana, G. (1997). Significance of interleukin-1beta and interleukin-1 receptor antagonist genetic polymorphism in inflammatory bowel diseases. Am J Gastroenterol 92(7), 1164-1169 Hiscott, J, Marois, J., Garoufalis, J., D’Addario, M., Roulston, A., Kwan, I., Pepin, N., Lacoste, J., Nguyen, H., Bensi, G., Fenton, M. (1993). Characterization of a functional NF-kappaB site in the human interleukin 1 beta promoter: evidence for a positive autoregulary loop. Mol Cell Biol 13(10), 6231-6240 Houghton, J. and Wang, T. C. (2005). Helicobacter pylori and gastric cancer: a new paradigm for inflammation-associated epithelial cancers. Gastroenterology 128, 1567-1578 Humajima, N., Matsuo, K., Saito, T., Tajima, K., Okuma, K., Yamao, K., Tominaga, S. (2001). Interleukin 1 polymorphisms, lifestyle factors, and Helicobacter pylori infection. Jpn. J. Cancer Res. 92, 383-389 Hunt, R. H. (1996). The role of helicobacter pylori in pathogenesis: the spectrum of clinical outcomes. Scand J Gastroenterol Suppl 220, 3-9 84 Hwang, I.-R., Kodoma, T., Kikuchi, S., Sakai, K., Peterson, L. E., Graham, D. Y., Yamaoka, Y. (2002). Effect of interleukin 1 polymorphisms on gastric mucosal interleukin 1ß production in Helicobacter pylori infection. Gastroenterology 123, 1793-1803 Imatani, A., Ohara, S., Yonechi, M., Ohyauchi, M., Shimosegawa, T. (2004). Helicobacter pylori-related cytokines influence gastric acid secretion and gastric mucosal inflammation in gastroduodenal ulcers. Nippon Rinsho 62(3), 442-447 Jäckel, S, Epplen, J. T., Kauth, M., Miterski, B., Tschentscher, F., Epplen, C. (1998). Polymerase chain reaction-single strand conformation polymorphism or how to detect reliably and efficiently each sequence variation in many samples and many genes. Electrophoresis 19(18), 30553061 Jouvenne, P., Chaudhary, A., Buchs, N., di Giovine, F. S., Duff, G. W., Miossec, P. (1999). Possible genetic association between interleukin-1α gene polymorphism and the severity of chronic polyarthritis. Eur Cytokine Netw 10, 33-36 Kelly, S. M., Pitcher, M. C., Farmery, S. M., Gibson, G. R. (1994). Isolation of Helicobacter pylori from feces of patients with dyspepsia in the United Kingdom. Gastroenterology 107(6), 1671-1674 Kuipers, E. J., Thijs, J. C., Festen, H., P., M., (1995). The prevalenc of Helicobacter pylori in peptic ulcer disease. Aliment Pharmacol Ther 9 (Suppl. 2), 59-69 85 Kunstmann, E., Hardt, C., Treitz, H., Suerbaum, S., Faller, G., Peitz, U., Schmiegel, W., Epplen, J. T.(2002). In the European population HLA-class II genes are not associated with Helicobacter pylori infection. Eur J of Gastroenterol and Hepathol 14(1), 49-53 Li, C., Xia, H. H., Xie, W., Hu, Z., Ye, M., Li, J., Cheng, H., Zhang, X., Xia, B. (2007). Association between interleukin-1 gene polymorphisms and Helicobacter pylori infection in gastric carcinogenesis in a Chinese population. J Gastroenterol Hepatol 22(2), 234-239 Machado, J. C., Pharoah, P., Sousa, S., Carvalho, R., Oliveira, C., Figueiredo, C., Amorim, A., Seruca, R., Caldas, C., Carneiro, F., SobrinhoSimoes, M. (2001). Interleukin 1ß and interleukin 1RN polymorphisms are associated with increased risk of gastric carcinoma. Gastroenterology 121(4), 823-829 Malaty, H. M., Pedersen, N. L., Engstrand, L., Isaksso, I., Graham, D. Y. (1996). Genetic and envirement influences of peptic ulcer disease. Gastroenterology 110, A 184 Malfertheimer, P., Bayerdörffer, E., Birkholz, S., Börsch, G., Geis, G., Labenz, J., Mannes, G., Nilius, M., Opferkuch, W., Seifert, E., Stadelmann, O., Stolte, M., Suerbaum, S. (1994). Helicobacter pylori-Von der Grundlage zur Therapie. Thieme Verlag Stuttgart New York Marshall, B. J., Barret, L. J., Prakash, C., McCallum, R. W., Guerrant, R. L. (1990). Urea protects Helicobacter (Campylobacter) pylori from the bactericidal effect of acid. Gastroenterol 99(3), 697-702 86 Mc Dowell, T.L., Symons, J. A., Ploski, R., Forre, O., Duff, G. W. (1995). A genetic association between juvenile rheumatoid arthritis and a novel interleukin-1 alpha polymorphism. Arthritis Rheum 38(2), 221-228 Moorchung, N., Srivastava A. N., Gupta N. K., Ghohal, U. C., Achyut, B. R., Mittal, B. (2007). Cytokine gene polymorphisms and pathology of chronic gastritis. Singapore Med. J. 48(5), 447-454 Nemetz, A., Nosti-Escanilla, M. P., Molnar, T., Kope, A., Kovacs, a., Feher, J., Tulassay, Z., Nagy, F., Garcia-Gonzalez, M. A., Pena, A. s. (1999). IL1B gene polymorphisms influence the course and severity of inflammatory bowel disease. Immunogenetics 49(6), 527-531 Nicklin, M. J. H., Weithe, A., Duff, G. W. (1994). A physical map of the region encompassing the human interleukin-1 alpha, interleukin-1 beta, and the interleukin-1 receptor antagonist genes. Genomics 19(2), 382-384 Nomura, A., Stemmermann, G. N., Chyou, P. H., Kato, I., Perez-Perez, G. I., Blaser, M. J. (1991). Helicobacter pylori infection and gastric carcinoma among Japanese Americans in Hawaii. N Eng J Med 325, 1132-1136 On On Chan, A., Chu, K.-M., Huang, C., Lam, K. F., Leung, S. Y., Sun, Y. W., Ko, S., Hia, H. H., Cho, C. H., Hui, W. M., Lam, S. K., Rashid, A. (2007). Association between Helicobacter pylori infection and interleukin 1ß polymorphism predispose to CpG island methylation in gastric cancer. Gut 56, 595-597 87 Orita M, Suzuki Y, Sekiya T, Hayashi K. (1989). Rapid and sensitive detection of point mutations and DNA polymorphisms using the polymerase chain reaction. Genomics 5(4), 874–879 Parsonnet, J., Freidman G. D., Vandersteen, D. P.(1991). Helicobacter pylori infection and the risk of gastric carcinoma. N Engl J Med 325, 11271131 Patterson, D., Jones, C., Hart, I., Bleskan, J., Berger, R., Geyer, D., Eisenberg, S. P., Smith, M. F., Jr., Arend, W. P. (1993). The human interleukin-1 receptor antagonist (IL1RN) gene is located in the chromosome 2q14 region. Genomics 15, 173-176 Pociot, F., Molvig, J., Wogensen, L., Worsaae, H., Nerup, J. (1992). A TaqI polymorphism in the human interleukin-1ß (IL-1ß) gene correlates with IL-1ß secretion in vitro. Eur J Clin Invest 22, 396-402 Prinz, C., Neumayer, N., Mahr, S., Classen, M., Schepp, W. (1997). Functional impairment of rat enterochromaffin-like cells by interleukin 1 beta. Gastroenterology 112(2), 364-375 Prinz, C., Schöniger, M., Rad, R., Becker, I., Keiditsch, E., Wagenpfeil, S., Classen, M., Rösch, T., Schepp, W., Gerhard, M. (2001). Key importance of the Helicobacter pylori adherence factor blood group antigen binding adhesin during chronic gastric inflammation. Cancer Research 61, 19031909 88 Rad, R., Dossumbekova, A., Neu, B., Lang, R., Bauer, S., Saur, D., Gerhard, M., Prinz, C.(2004). Cytokine gene polymorphisms influence mucosal cytokine expressions, gastric inflammation, and host specific colonisation during Helicobacter pylori infection. Gut 53, 1082-1089 Raymond, M. and Rousset, F. (1995). Testing heterocygote excess and deficiency. Genetics 140, 1413-1419 Rieder, G., Merchant, J, L., Haas, R. (2005). Helicobacter pylori cag-type IV secretion system faciliates corpus colonization to induce precancerous conditions in Mongolian gerbils. Gastroenterology 128(5), 1229-1242 Roilt, I. M., Brostoft, J., Male, D. K. (1995). Kurzlehrbuch der Immunologie, Thieme Verlag Stuttgart New York, Seite 116-119 Rosenstock, S. J., Andersen, L. P., Rosenstock, C. V., Bonnevie, O., Jorgensen, T. (1998). Helicobacter pylori infection and socioeconomic factors among adult Danes. Ugeskr Laeger 160(14), 2109-2115 Sanger, F., Nicklen, S., Coulson, A. R. (1977). DNA sequencing with chain-terminating inhibitors. Proc. Natl Acad Sci 74, 5463-5467 Schepp, W., Dehne, K., Herrmuth, H., Pfeffer, K., Prinz, C. (1998). Identification and functional importance of IL-1 receptors on rat parietal cells. Am J Physiol 275, G1094-1105 Shang, J. and Pena, A. S. (2005). Multidisciplinary approach to understand the pathogenesis of gastric cancer. World J of Gastroenterol 11(27), 41314139 89 Sheffield, V. C., Beck, J. S., Kwitek, A. E., Sandstrom, D. W., Stone, E. M. (1993). The sensitivity of single-strand conformation polymorphism analysis for the detection of single base substitutions. Genomics 16, 325332 Shimoyana, T. and Crabtree, J. E. (1998). Bacterial factors and immune pathogenesis in Helicobacter pylori infection. Gut 43(Suppl. 1), 2-5 Smith, S. I., Kirsch, C., Oyedeji, K. S., Arigbabu, A. O., Coker, A. O., Bayerdörffer, E., Miehlke, S. (2002). Prevalence of Helicobacter pylori vacA, cagA and iceA genotypes in Nigerian patients with duodenal ulcer disease. J. Med. Microbiol. Vol. 51(10), 851-854 Sokic-Milutinovic, A., Todorovic, V., Milosavljevic, T. (2004). Pathogenesis of Helicobacter pylori infection-bacterium and host relationship. Srp Arh Celok Lek 132(9-10), 340-344 Stokkers, P. C., van Aken, B. E., Basoski, N., Reitsma, P. H., Tygat, G. N., van Deventer, S. J. (1998). Five genetic markers in the interleukin 1 family in relation to inflammatory bowel disease. Gut 43(1), 33-39 Stolte, M., Bayerdörffer, E., Morgner, A., Alpen, B., Wündisch, T., Thiede, C., Neubauer, A. (2002). Helicobacter and gastric MALT lymphoma. Gut 50, 1919-1924 Suerbaum, S. and Michetti, P. (2002). Helicobacter pylori infection. N Engl J Med 347, 1175-1186 90 Svejgaard, A., Platz, P., Ryder, L.P. (1983) HLA and disease 1982- A survey. Immunol. Rev. 70, 193-218 Svejgaard, A., Ryder, L.P. (1994). HLA and disease associations: Detecting the strongest association. Tissue Antigens 43, 18-21 Takashima, M., Furuta, T., Hanai, H., Sugimura, H., Kaneko, E. (2001). Effects of Helicobacter pylori infection on gastric acid secretion and serum gastrin levels in Mongolian gerbils. Gut 48, 765-773 Tannaes, T., Bukholm, I. K., Bukholm, G. (2005). High relative content of lysophospholopids of Helicobacter pylori mediates increased risk for ulcer disease. FEMS Immunol Med Microbiol 44(1), 17-23 Thomas, J. E., Gibson, G. R., Darboe, M. K., Dale, A., Weaver, L. T. (1992). Isolation of Helicobacter pylori from human faeces. Lancet 340, 1194-1195 Tsugane, S., Tei, Y., Takahashi, T., Watanabe, S., Sugano, K. (1994). Salty food intake and risk of Helicobacter pilori infection. Jpn J Cancer Res 85(5), 474-478 Tytgat, G. N. (1996). Duodenal ulcer disease. Eur J Gastroenterol Hepatol 8(8), 829-833 Wolfe, M. M. and Nompleggi, D. J. (1992). Cytokine inhibition of gastric acid secretion- a little goes long away. Gastroenterology 102, 2177-2178 91 Zagari, R.M. and Bazzoli, F. (2004). Gastric cancer: who is at risk?. Dig Dis 22(4), 302-305 Zhang, C., Yamada, N., Min, Y.-L., Wen, M., Matsuhisa, T., Matsukura, N. (2005). Helicobacter pylori infection, glandular atrophy and intestinal metaplasia in superficial gastritis, gastric ulcer and early gastric cancer. World J Gastroenterol 11(6), 791-796 92 7. Anhang 93 Abb. A 1: Vollständige Nukleotidsequenz des IL-1 alpha Gens (Furutani et al., 1986). Die exonischen Sequenzen sind mit Kästchen umrandet. Die TATA-ähnliche Sequenz, Alu repetitive Sequenzen sowie alternative Purin- und Pyrimidinsequenzen sind unterstrichen. Direkt repetitive Sequenzen sind durch durchgehende Pfeile, indirekt repetitive Sequenzen durch gestrichelte Pfeile gekennzeichnet. 94 95 Abb. A 2: Nukleotidsequenz des pro-IL-1 beta Gens im Vergleich zur cDNA (Clark et al., 1986). Direkt und indirekt repetitive Sequenzen sind durch gepunktete Pfeile markiert, solide Pfeile kennzeichnen potentielle Enhancer-Elemente. Die eingezeichneten Striche oberhalb der Sequenz zeigen Alu repetitive Sequenzen sowie die TATA- und CAT-Boxen an. 8. Danksagung An dieser Stelle möchte ich allen danken, die zur Entstehung dieser Arbeit beigetragen haben. Mein primärer Dank gilt Herrn Prof. Dr. med. J. T. Epplen für die Möglichkeit, die Arbeit in der von ihm geführten Abteilung durchzuführen. Mein besonderer Dank gilt Frau PD Dr. med. E. M. Kunstmann für die intensive Betreuung während meiner Arbeit und die zahlreichen Diskussionen und Anregungen zum vorliegenden Manuskript. Mein weiterer Dank gilt allen Mitarbeitern der Abteilung für Molekulare Humangenetik, die mich mit ihren Ratschlägen und Tips unterstützt haben. Ebenfalls bedanken möchte ich mich bei Eduard Ungemach für seine Unterstützung bei den statistischen Auswertungen im Rahmen dieser Arbeit. Zum Schluß möchte ich noch Marcus Gerhardt für seine Geduld bei der Bearbeitung des Layouts danken. 9. Lebenslauf Name Kerstin Brommont Geburtsdatum 03.08.1973 Geburtsort Essen Familienstand ledig Nationalität deutsch Ausbildungswerdegang 1980 - 1984 Gemeinschaftsgrundschule HattingenNiederwenigern 1984 - 1993 Gymnasium Waldstraße, Hattingen 1993 Abitur 1993 - 1995 Lessing-Kollegschule, Düsseldorf 1995 Staatl. geprüfte Biologisch-Technische Assistentin 1995 - 2002 Studium der Humanmedizin, Ruhr-Universität Bochum 2002 Staatsexamen 07/2002 - 12/2003 Ärztin im Praktikum in der Abteilung für Kardiologie des St. Josef-Hospitals Bochum, Klinikum der Ruhr-Universität Bochum 01/2004 – 06/2005 Assistenzärztin in der Abteilung für Innere Medizin des Marienhospitals Marl 07/2005 – 03/2006 Assistenzärztin in der Abteilung für Innere Medizin des Lutherhauses Essen Seit 04/2006 Assistenzärztin in der Abteilung für Innere Medizin/Kardiologie des Marienhospitals Marl