1. Klausur zum Organisch-Chemischen Grundpraktikum des WS
Werbung
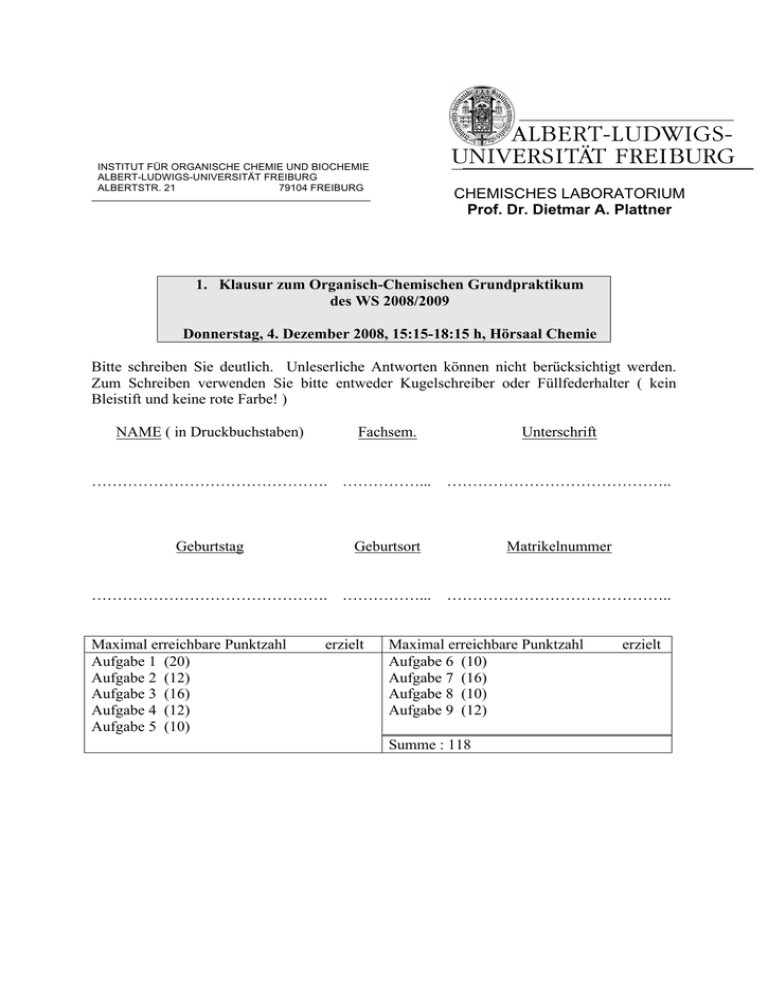
INSTITUT FÜR ORGANISCHE CHEMIE UND BIOCHEMIE ALBERT-LUDWIGS-UNIVERSITÄT FREIBURG ALBERTSTR. 21 79104 FREIBURG CHEMISCHES LABORATORIUM Prof. Dr. Dietmar A. Plattner 1. Klausur zum Organisch-Chemischen Grundpraktikum des WS 2008/2009 Donnerstag, 4. Dezember 2008, 15:15-18:15 h, Hörsaal Chemie Bitte schreiben Sie deutlich. Unleserliche Antworten können nicht berücksichtigt werden. Zum Schreiben verwenden Sie bitte entweder Kugelschreiber oder Füllfederhalter ( kein Bleistift und keine rote Farbe! ) NAME ( in Druckbuchstaben) Fachsem. ………………………………………. ……………... Geburtstag …………………………………….. Geburtsort ………………………………………. ……………... Maximal erreichbare Punktzahl Aufgabe 1 (20) Aufgabe 2 (12) Aufgabe 3 (16) Aufgabe 4 (12) Aufgabe 5 (10) Unterschrift erzielt Matrikelnummer …………………………………….. Maximal erreichbare Punktzahl Aufgabe 6 (10) Aufgabe 7 (16) Aufgabe 8 (10) Aufgabe 9 (12) Summe : 118 erzielt Aufgabe 1 : Welche Produkte erwarten Sie bei folgenden Umsetzungen? Geben Sie für jeden Fall den detaillierten Mechanismus der Produkt(e)bildung an. a) b) CO2Me 1 Äquiv. NBS Bz2O2, CCl4 ∆ Br2 hν c) 1. BH3, THF 2. NaOH, H2O2 2 1. BH3, THF d) 2. NaOH, H2O2 1. O3 e) f) 2. Zn, AcOH 1. Br2, H2O 2. KOtBu, tBuOH (20 Pt.) 3 Aufgabe 2: a) Erklären Sie kurz, welches von den beiden gezeigten Substraten unter nucleophilen Substitutionsbedingungen mit Wasser deutlich schneller (Faktor 104!) reagiert als das andere und warum. OTos OTos b) Können Sie aus diesem Befund ableiten, ob diese Reaktion eher nach einem SN1oder nach einem SN2–artigen Mechanismus verläuft? (12 Pt.) 4 Aufgabe 3: Epoxidierungen von Olefinen mit Wasserstoffperoxid unter basischen Bedingungen verlaufen in Anwesenheit von Nitrilen (z.B. Acetonitril als Lösungsmittel) besonders gut. Die beobachtete Reaktionsgeschwindigkeit gehorcht dabei einer Kinetik 3.Ordnung: k[RCN][H2O2][Olefin]. a) Formulieren Sie einen Reaktionsmechanismus, der diesen Gegebenheiten gerecht wird. (Hinweis: der Schritt der Sauerstoffübertragung auf das olefinische Substrat kann in Analogie zur Epoxidierung mit Persäuren aufgefaßt werden) b) Verwendet man kein Olefin, sondern DMSO als Substrat, ist die Reaktionsgeschwindigkeit unabhängig von der DMSO Konzentration. Erklären Sie diesen Unterschied! (16 Pt.) 5 Aufgabe 4: Eine radikalische Defunktionalisierung von aliphatischen Alkoholen kann via Transformation in das von Imidazol abgeleitete Thiocarbamat erreicht werden. Geben Sie alle dazu nötigen Reagentien, Reaktionsbedingungen und den genauen Reaktionsmechanismus an. (12 Pt.) 6 Aufgabe 5: Die Oxymercurierung/Reduktion ist ein alternatives Verfahren zur Hydratisierung von Alkenen. Schlagen Sie einen Mechanismus für die folgende Reaktion vor: HO 1. Hg(OAc)2, H2O 2. NaBH4, H2O (Hinweis: das intermediär auftretende Alkyl-Quecksilberhydrid zerfällt via Radikalfragmentierung) (10 Pt.) 7 Aufgabe 6: Entwerfen Sie eine vernünftige (!) Synthese dieser beiden mehrfach substituierten Aromaten aus Benzol. O I NH2 Br (10 Pt.) 8 Aufgabe 7: a) Geben Sie alle möglichen Produkte an, die bei der Reaktion von (2R)-(2Pentyl)methansulfonat mit DBU entstehen können und erklären Sie, welches davon warum als Hauptprodukt entstehen sollte. b) Sie haben DBN und DBU als nützliche Basen für die organische Synthese kennengelernt. Zeichnen Sie die Strukturformeln dieser beiden Verbindungen und geben Sie zusätzlich den systematischen Namen nach IUPAC für DBN und DBU an. Ordnen Sie die Basizität dieser Verbindungen im Vergleich zu Morpholin und Anilin ein. (16 Pt.) 9 Aufgabe 8: Formulieren Sie die Synthese von 9-Anthracencarbonitril ausgehend von Anthracen und Chlorsulfonylisocyanat. Geben Sie alle Reagentien, die Reaktionsbedingungen sowie den detaillierten Reaktionsmechanismus an. (10 Pt.) 10 Aufgabe 9: a) Die relativen Solvolysegeschwindigkeiten von β-Phenylethyltosylat und Ethyltosylat zeigen eine bemerkenswerte Variation in Abhängigkeit vom Lösungsmittel. In Ethanol reagiert β-Phenylethyltosylat ca. 4x langsamer, in Trifluoressigsäure über 1000x schneller als Ethyltosylat! Geben Sie wenigstens zwei Gründe für diese scheinbare Anomalie an. b) Erklären Sie kurz, warum überhaupt in Ethanol β-Phenylethyltosylat etwas langsamer solvolysiert als Ethyltosylat! (12 Pt.) 11