Get cached PDF
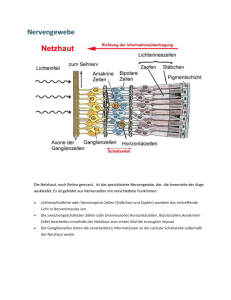
Werbung

Serumalbumin bewirkt eine osmotische Schwellung der Müllerschen Gliazellen in der Netzhaut der Ratte Dissertation zur Erlangung des akademischen Grades Dr. med. an der Medizinischen Fakultät der Universität Leipzig eingereicht von: Silvana Löffler geboren am 11.11.1983 in Burgstädt angefertigt am: Paul-Flechsig-Institut für Hirnforschung der Medizinischen Fakultät der Universität Leipzig Betreuer: Prof. Dr. rer. nat. habil. A. Bringmann Prof. Dr. rer. nat. habil. A. Grosche Prof. Dr. med. habil. A. Reichenbach Beschluss über die Verleihung des Doktorgrades vom: 23.06.2015 Vorbemerkung Bei der vorliegenden Arbeit handelt es sich um eine kumulative Form der Promotion. Die erforderliche Publikation mit Erstautorenschaft erschien im März 2010 in der Zeitschrift „Brain Research". Bibliographischer Nachweis der Publikation: Silvana Löffler, Antje Wurm, Franziska Kutzera, Thomas Pannicke, Katja Krügel, Regina Linnertz, Peter Wiedemann, Andreas Reichenbach, Andreas Bringmann, 2010. Serum albumin induces osmotic swelling of rat retinal glial cells. Brain Research 1317, 268-276. 1 I Inhaltsverzeichnis I Inhaltsverzeichnis _________________________________________________________ 2 II Abbildungsverzeichnis _____________________________________________________ 3 III Bibliographische Beschreibung _____________________________________________ 4 IV Abkürzungsverzeichnis ____________________________________________________ 5 V Einleitung _______________________________________________________________ 6 1 2 3 4 Die Netzhaut ___________________________________________________________ 6 1.1 Aufbau und Funktion der Netzhaut _________________________________________ 6 1.2 Die Netzhaut als Modell für intrakranielle Prozesse ___________________________ 6 Die Müllerzelle - eine besondere Gliazelle ___________________________________ 7 2.1 Die Neuroglia ___________________________________________________________ 7 2.2 Morphologie der Müllerzellen _____________________________________________ 8 2.3 Stoffwechseleigenschaften und Unterstützung neuronaler Funktionen ____________ 9 2.4 Ionen- und Wasserhomöostase ____________________________________________ 10 Bedeutung von Gliazellen bei Netzhaut- und Hirnödemen _____________________ 12 3.1 Pathophysiologie der Ödementstehung _____________________________________ 12 3.2 Der glutamaterg-purinerge Signalweg______________________________________ 13 3.3 Das Netzhautödem - Therapiemöglichkeiten durch Glukokortikoide ____________ 13 Albumin _____________________________________________________________ 14 4.1 Eigenschaften des Albumins ______________________________________________ 14 4.2 Albumin – neuroprotektiv oder neurotoxisch? _______________________________ 14 4.3 Albumin und epileptiforme Aktivität_______________________________________ 15 VI Publikation ____________________________________________________________ 16 VII Zusammenfassung der Arbeit _____________________________________________ 26 VIII Literaturverzeichnis ____________________________________________________ 31 IX Eigenständigkeitserklärung _______________________________________________ 37 X Lebenslauf______________________________________________________________ 38 XI Danksagung____________________________________________________________ 39 2 II Abbildungsverzeichnis Abbildung 1: Der Aufbau der Netzhaut ..................................................................................... 7 Abbildung 2: Morphologie und Anordnung der Müllerzellen ................................................... 8 Abbildung 3: Kalium- und Wasserhomöostase der Müllerzellen ............................................ 11 3 III Bibliographische Beschreibung Löffler, Silvana Serumalbumin bewirkt eine osmotische Schwellung der Müllerschen Gliazellen in der Netzhaut der Ratte. Universität Leipzig, Doktorarbeit 39 S., 51 Lit., 3 Abb. REFERAT Für die visuelle Wahrnehmung im Gehirn spielt die ungestörte Funktion von Neuronen und Gliazellen in der Netzhaut eine entscheidende Rolle. Viele schädigende Prozesse wie Entzündungen, Ischämien oder Traumata können zur Ödementstehung in der Netzhaut führen. Da die Netzhaut entwicklungsgeschichtlich einen vorverlagerten Teil des Zwischenhirns darstellt, lassen sich die pathophysiologischen Zusammenhänge, die zur Entstehung eines Netzhautödems führen, auch auf die Ödementstehung im Gehirn übertragen. Diese Arbeit beschäftigt sich mit dem Phänomen der Zellvolumenregulation von Müllerzellen – den hauptsächlich in der Netzhaut anzutreffenden Gliazellen – und leistet damit einen Beitrag zur Grundlagenerforschung der Ödementstehung in neuronalen Geweben. Die im Rahmen von Ödementstehungen regelmäßig zu beobachtenden Gefäßpermeabilitätserhöhungen führen in neuronalen Geweben auch zur Extravasation von Albumin. Unter diesem Gesichtspunkt untersucht die vorliegende Arbeit den Einfluss von bovinem Serumalbumin auf die Müllerzellen und die damit verbundenen Mechanismen am Modell der Netzhaut von Ratten. 4 IV Abkürzungsverzeichnis AG Astroglia/Astrozyten ÄKS äußere Körnerschicht ÄPS äußere plexiforme Schicht ATP Adenosintriphosphat AQP Aquaporin BSA bovines Serumalbumin CO2 Kohlenstoffdioxid EZR Extrazellularraum GK Glaskörper GZS Ganglienzellschicht HSA humanes Serumalbumin IKS innere Körnerschicht IPS innere plexiforme Schicht K+ Kaliumion Kir einwärts-gleichrichtende Kaliumkanäle LT Leukotriene MZ Müllerzelle MG Mikrogliazelle Na+ Natriumion NFS Nervenfaserschicht PG Prostaglandine RPE retinales Pigmentepithel VEGF vascular endothelial growth factor ZNS zentrales Nervensystem 5 Aufbau und Funktion der Netzhaut V Einleitung 1 Die Netzhaut 1.1 Aufbau und Funktion der Netzhaut Die Netzhaut als Sinnesepithel des Auges wandelt Lichtsignale in elektrische Impulse um, die dann über den Sehnerven in die Sehrinde des Okzipitallappens weitergeleitet werden und dort für die Entstehung des Seheindruckes verantwortlich sind. Der Aufbau der Netzhaut zeigt eine übersichtliche Schichtung mit für die jeweilige Schicht typischen Zellen (Abb. 1). Die Schichtung ist dabei invers aufgebaut, was bedeutet, dass das Licht alle Schichten der Netzhaut durchdringen muss, ehe es die Photorezeptoren (Stäbchen und Zapfen) erreicht, die dann das Licht in elektrische Signale umwandeln. Diese Impulse werden über die Bipolarzellen zu den Ganglienzellen weitergeleitet, deren Axone die Nervenfaserschicht und schließlich den Nervus opticus bilden. Horizontal- und amakrine Zellen tragen über laterale Hemmungsprozesse zur Modulierung der Signale bei. Außerdem findet man in der Netzhaut auch Gliazellen (Mikrogliazellen, Müllerzellen und Astrozyten) (Reichenbach, 1999). 1.2 Die Netzhaut als Modell für intrakranielle Prozesse Da die Netzhaut aus entwicklungsbiologischer Sicht einem in die Peripherie vorverlagerten Teil des Zwischenhirns entspricht, erscheint es nachvollziehbar, weshalb die sich im Verlauf der Ontogenese aus dem Ektoderm herausbildenden Neuronen und Makrogliazellen gleichermaßen in der Netzhaut als auch im Zentralnervensystem (ZNS) vorkommen. Auch die Existenz einer der Blut-Hirn-Schranke entsprechenden Blut-Retina-Schranke der Netzhaut lässt sich mit der embryonalen Abstammung erklären. Aufgrund dieses Zusammenhangs sowie der leichten Zugänglichkeit und Übersichtlichkeit, stellt die Netzhaut ein gebräuchliches Modell für die Beschreibung und Untersuchung von Abläufen im ZNS dar (Reichenbach, 1999). In beiden Geweben existieren morphologisch und funktionell ähnliche Krankheitsbilder. So beobachtet man beispielsweise bei schweren Leberschäden sich entsprechende Veränderungen von Astrozyten im Gehirn (hepatische Enzephalopathie) und von Müllerzellen in der Netzhaut (hepatische Retinopathie) (Reichenbach, 1999). Auch pathologische Veränderungen, wie sie im Rahmen von bestimmten Gefäßerkrankungen, Entzündungsreaktionen oder bei degenerativen Prozessen entstehen, lassen sich gleichermaßen bei Müllerzellen wie auch bei Astrozyten im Gehirn nachweisen. 6 Die Neuroglia Abbildung 1: Der Aufbau der Netzhaut Die äußere Schicht der Retina wird durch das einschichtige retinale Pigmentepithel (RPE) gebildet, das von der eigentlichen neuralen Netzhaut durch den Subretinalraum (SRR) getrennt ist. In den Subretinalraum ragen auch die Außenglieder der Stäbchen und Zapfen (violett), in denen sich der Sehfarbstoff befindet. Ihre Zellkörper befinden sich in der äußeren Körnerschicht (ÄKS). In der sich anschließenden äußeren plexiformen Schicht (ÄPS) befinden sich die synaptischen Kontakte zwischen den Stäbchen und Zapfen sowie den Bipolarzellen (B) und den Horizontalzellen (H). Die Somata der Müllerzellen (M), der Horizontalzellen sowie der Amakrin (A)- und Bipolarzellen befinden sich in der inneren Körnerschicht (IKS). Es folgt die innere plexiforme Schicht (IPS) mit synaptischen Kontakten zwischen Bipolarzellen, Ganglienzellen (G) und amakrinen Zellen. In dieser Schicht liegen außerdem Mikrogliazellen (MG). Die Zellkörper der Ganglienzellen befinden sich wiederum in der Ganglienzellschicht (GZS). Den Abschluss zum Glaskörper bildet schließlich die Nervenfaserschicht (NFS). In der NFS vaskularisierter Säugetiernetzhäute kommen außerdem Astrozyten (AG) vor (modifiziert nach Reichenbach und Bringmann, 2010). 2 Die Müllerzelle - eine besondere Gliazelle 2.1 Die Neuroglia Gliazellen wurden bereits von Rudolf Virchow (1821 – 1902) beschrieben. Sehr lange wurden sie nur als Stützgerüst aufgefasst und es wurden ihnen keine darüber hinausgehenden Funktionen zugeordnet. Heute weiß man, dass Gliazellen ein vielfältiges Aufgabenspektrum erfüllen und längst noch nicht vollständig verstanden sind. Auch im Rahmen von pathophysiologischen Vorgängen spielen Gliazellen eine wichtige Rolle, z.B. bei der Ödembildung der Netzhaut und des Gehirns (Bringmann et al., 2006; Reichenbach und Bringmann, 2010), bei der Entstehung der hepatischen Enzephalopathie oder der Multiplen Sklerose (Reichenbach, 1999) sowie bei der Entstehung von Epilepsie (Ivens et al., 2007; Seifert et al., 2010). 7 Morphologie der Müllerzellen Im Zentralnervensystem kommen Gliazellen etwa doppelt so häufig wie Neuronen vor. Man teilt sie in die beiden Haupttypen Makro- und Mikrogliazellen ein. Die Makrogliazellen des Gehirns umfassen die Astrozyten, die Oligodendrozyten und die Ependymozyten (Reichenbach, 1999). In der Netzhaut kommen vor allem die vielfältige Funktionen wahrnehmenden Müllerzellen als wichtigster Makrogliazelltyp vor. Weiterhin gibt es in vaskularisierten Säugetiernetzhäuten noch die Astrozyten. Mikrogliazellen nehmen vor allem immunologische Funktionen wahr. Sie wandern während der Ontogenese aus dem Blut als Makrophagen in das ZNS ein (Reichenbach und Bringmann, 2010). 2.2 Morphologie der Müllerzellen Müllerzellen stellen die häufigsten Makrogliazellen der Netzhaut dar und wurden 1851 von Heinrich Müller erstmals beschrieben (Müller, 1851). Müllerzellen durchspannen alle Schichten der Netzhaut und stehen sowohl mit den Neuronen als auch mit Blutgefäßen, dem Glaskörper und dem Subretinalraum in Kontakt. Sie formen mit den sie umgebenden Neuronen anatomisch und funktionell eine säulenförmige Einheit, die als „micro unit“ bezeichnet wird (Reichenbach und Robinson, 1995) (Abb. 2). Ihre Zellsomata befinden sich in der inneren Körnerschicht. Mit dem Vitalfarbstoff Mitotracker Orange lassen sich Müllerzellen selektiv anfärben (Uckermann et al., 2004b). MZ MZ MZ BG NZ 20µm Abbildung 2: Morphologie und Anordnung der Müllerzellen (A) Kaninchen-Müllerzelle (Golgi-Färbung), (B) Müllerzellen Darstellung mit Mitotracker Orange Färbung an der Meerschweinchennetzhaut. (C) Modell der Müllerzellen-Einheit. (A, B) Die Müllerzellen (MZ) durchspannen alle Schichten der Netzhaut. Ihre Somata liegen in der inneren Körnerschicht (IKS). (B) Müllerzellen sind selektiv anfärbbar. (C) Eine Müllerzelle (MZ, blau) bildet gemeinsam mit den von ihr versorgten Neuronen (NZ, grün) anatomisch und funktionell eine säulenförmige Einheit, die als „micro unit“ bezeichnet wird und steht in engen Kontakt zu Blutgefäßen (BG; rot). NFS: Nervenfaserschicht, GZS: Ganglienzellschicht, IPS: innere plexiforme Schicht, IKS: innere Körnerschicht, ÄPS: äußere plexiforme Schicht, ÄKS: äußere Körnerschicht (modifiziert nach Bringmann et al., 2006). 8 Stoffwechseleigenschaften und Unterstützung neuronaler Funktionen 2.3 Stoffwechseleigenschaften und Unterstützung neuronaler Funktionen Müllerzellen übernehmen in der Netzhaut zahlreiche Aufgaben. Sie stehen mit den Neuronen nicht nur morphologisch, sondern auch funktionell in enger Beziehung. Sie sind unentbehrlich für die Aufrechterhaltung der ungestörten neuronalen Signalübertragung, wirken neuroprotektiv und unterstützen Stoffwechselvorgänge. Müllerzellen können Neurotransmitter aufnehmen, recyceln und den Neuronen als Substrat für die Neugenerierung wieder zur Verfügung stellen (Matsui et al., 1999). Verbleibt von Neuronen zur Signalübertragung freigesetztes Glutamat in zu hoher Konzentration im Extrazellularraum, wirkt es neurotoxisch und führt zur Übererregung der Neuronen (sogenannte Exzitotoxizität) (Barnett und Pow, 2000). Für das Neurotransmitterrecycling besitzen Müllerzellen verschiedene Enzyme. Mit der Glutaminsynthetase wird zum einen der Neurotransmitter Glutamat in Glutamin umgewandelt, zum anderen spielt dieses Enzym auch eine wesentliche Rolle bei der Entsorgung des Stoffwechselprodukts Ammoniak. Müllerzellen stellen damit die einzigen Zellen der Netzhaut dar, die in der Lage sind, Ammoniak zu entsorgen (Riepe und Norenburg, 1977). Müllerzellen schützen sich und Neuronen außerdem vor oxidativem Stress. Sie fangen freie Radikale mittels Glutathion ab und verhindern so Zellschädigungen (Pow und Crook, 1995). Weiterhin produzieren und sezernieren Müllerzellen eine Reihe von Wachstumsfaktoren und Zytokinen. Dadurch modulieren sie Entzündungsprozesse und nehmen an der Regulation von Immunantworten teil (Drescher und Whittum-Hudson, 1996). Die Stoffwechselprozesse von Neuronen und Müllerzellen sind eng miteinander verbunden. So dienen die Stoffwechselendprodukte der Müllerzellen - Laktat und Pyruvat - den Neuronen als Substrat für ihren Citratzyklus (Poitry-Yamate et al., 1995; Tsacopoulos und Magistretti, 1996). Im Gegenzug nehmen Müllerzellen Stoffwechselendprodukte der Nervenzellen wie CO2 auf und wandeln es mit Hilfe des Enzyms Carboanhydrase in Bikarbonat um und transportieren es in den Glaskörper oder in die Blutgefäße (Newman, 1996). Damit besitzen die Müllerzellen auch eine wichtige Pufferfunktion im Säure-Basen-Haushalt und nehmen damit eine wichtige Aufgabe in der Aufrechterhaltung eines physiologischen Mikromilieus wahr. Gleichzeitig verwenden Müllerzellen das Bikarbonat auch selbst für ihre eigene Lipidsynthese (Reichenbach, 1999), was den symbiotischen Effekt dieser Partnerschaft weiter untermauert. 9 Ionen- und Wasserhomöostase 2.4 Ionen- und Wasserhomöostase Neben erhöhten extrazellulären Transmitterkonzentrationen, Neurotoxinen, oxidativem Stress oder pH-Verschiebungen können weiterhin Veränderungen der Ionenkonzentrationen zu Funktionsstörungen der Neuronen führen. Bei neuronaler Aktivität kommt es zu schnellen Ionenbewegungen zwischen intra- und extrazellulärem Raum. Natrium-, Calcium- und Chlorid-Ionen fließen in aktivierte Neuronen, während Kaliumionen freigesetzt werden. Bei Belichtung der Netzhaut erhöht sich dadurch die extrazelluläre Kaliumionenkonzentration in den plexiformen (synaptischen) Schichten der Netzhaut (Karwoski et al., 1989). Deregulierte Ionenkonzentrationen im Extrazellularraum können über Beeinflussung von Membranpotentialen und damit spannungsabhängiger Membrankanäle die synaptische Übertragung stören und damit die neuronale Funktion behindern. Bei der Konstanthaltung der extrazellulären Kaliumionenkonzentration kommt den Müllerzellen enorme Bedeutung zu. Aufgrund ihrer Ausstattung mit Kaliumkanälen sind sie in der Lage, Kaliumionen in den plexiformen Schichten aufzunehmen und diese in die Blutgefäße, in den Glaskörper oder in den Subretinalraum, abzugeben. Wichtig ist dafür die Gruppe der einwärts rektifizierenden Kaliumkanäle (inwardly rectifying, Kir-Kanäle), von denen speziell die Kir4.1-Kanäle auch Auswärtsströme von Kaliumionen zulassen. Diesen Typ findet man vor allem dort, wo die Müllerzellen Kontakte zu Blutgefäßen und zum Glaskörper ausbilden, also an den Stellen, an denen Kaliumionen abgegeben werden sollen (Nagelhus et al., 1999; Kofuji und Newman, 2004). Einwärts rektifizierende Kaliumkanäle führen zu einer hohen Kaliumleitfähigkeit der Müllerzellen und sind hauptverantwortlich für das die Müllerzellen auszeichnende hohe Ruhemembranpotential von etwa -80 mV (Witkovsky et al., 1985). Aus osmotischen Gründen sind Bewegungen von Ionen auch mit Bewegungen von Wasser verbunden. Wasser sammelt sich aus verschiedenen Gründen im Netzhautgewebe an: Wasser entsteht im Prozess der biologischen Oxidation von Glukose, es dringt bei der Aufnahme von Substraten aus dem Blut ins Gewebe ein und schließlich gelangt Wasser auch durch den intraokulären Druck ins Netzhautgewebe (Marmor, 1999). Während der Abtransport von Wasser in der äußeren Netzhaut vor allem durch die retinalen Pigmentepithelzellen realisiert wird, spielen in der inneren Netzhaut die Müllerzellen eine wichtige Rolle. Um den Transport von Wasser über die Zellmembran zu erleichtern, besitzen Zellen Wasserkanäle, die Aquaporine (AQP). In Müllerzellen findet man Aquaporin-4 (AQP-4) an den gleichen Stellen der Zelle, wo auch die Kir4.1-Kanäle lokalisiert sind (Nagelhus et al., 1999). Dies deutet auf eine Kopplung von Kaliumionen- und Wasserströmen hin (Abb. 3A). 10 Ionen- und Wasserhomöostase Arachidonsäure Arachidonsäure Glutamat Adenosin Abbildung 3: Kalium- und Wasserhomöostase der Müllerzellen (A) Müllerzellen nehmen überschüssiges K+ auf und geben es über Kir4.1 K+-Kanäle an Blutgefäße ab, Wasser (H2O) folgt passiv unterstützt durch Aquaporin-Kanäle (AQP-4). (B) Im Rahmen von pathologischen Veränderungen wie Entzündungsprozessen werden die Kir4.1 K+-Kanäle vermindert exprimiert und es kommt zur intrazellulären K+ Ansammlung. Da der Wassertransport an K+ gekoppelt ist, akkumuliert ebenfalls Wasser in den Zellen. Der veränderte osmotische Gradient bewirkt die Bildung von Arachidonsäure. Aus dieser werden Prostaglandine sowie Leukotriene gebildet (PG, LT), die über die Hemmung der Na+-K+ Pumpe eine intrazelluläre Na+- Akkumulation und daran gekoppelt einen zusätzlichen Wassereinstrom in die Müllerzellen bewirken. Es kommt zur Gliazellschwellung. (C) Substanzen wie Glutamat, ATP/ADP oder Adenosin wirken einer Schwellung der Müllerzellen durch den teilweise autokrinen glutamaterg-purinergen Signalweg entgegen. In dessen Verlauf kommt es über eine Kaskade verschiedener Rezeptoren (Glutamatrezeptoren (mGluR), ADP Rezeptoren (P2Y1)) zur Aktivierung von Adenosin-A1-Rezeptoren, die wiederum zur Öffnung von spezifischen Kaliumkanälen (vermutlich TASK) und Chloridkanälen führen. Dadurch können die entsprechenden Ionen die Zellen verlassen, der osmotische Gradient wird ausgeglichen und die Schwellung der Zelle verhindert (modifiziert nach Bringmann et al., 2006). 11 Pathophysiologie der Ödementstehung 3 Bedeutung von Gliazellen bei Netzhaut- und Hirnödemen 3.1 Pathophysiologie der Ödementstehung Zahlreiche Erkrankungen des Auges bzw. des Gehirns, wie Entzündungen, Störungen der Gewebedurchblutung, Traumata und angeborene Defekte können mit einem Ödem einhergehen. Auch im Rahmen systemischer Veränderungen, wie beispielsweise Hypertension, Hyponatriämie oder Hypoalbuminämie kann es zur Ödementstehung in Netzhaut und Gehirn kommen (Gardner et al., 2002, Reichenbach und Bringmann, 2010). Grundsätzlich kann man von zwei pathophysiologischen Mechanismen der Ödementstehung ausgehen. Zum einen können Permeabilitätsstörungen des Gefäßendothels zu Wasseraustritt und Ansammlungen im Interstitium führen (vasogenes oder extrazelluläres Ödem), zum anderen können aber auch Wassereinlagerungen in den Zellen auftreten (cytotoxisches Ödem) (Kimelberg, 2004). Da das Gefäßendothel im ZNS bzw. im retinalen Gewebe durch tightjunctions fest verbunden ist, können Substanzen aus dem Blut normalerweise nur schwer ins Gewebe übertreten. Beim vasogenen Ödem kommt es zu Störungen der Blut-Retina-Schranke bzw. der Blut-Hirn-Schranke. In der Folge können auch Substanzen, wie Serumproteine aus dem Blut ins Gewebe übertreten und osmotisch Wasser mit sich ziehen. Beim cytotoxischem Ödem der Netzhaut ist die Wasser- und Ionenhomöostase von Müllerzellen, die normalerweise das extrazelluläre Wasser durch Kopplung an Ionenströme abtransportieren, gestört (Abb. 3B). Man geht davon aus, dass pathologische Prozesse (z. B. Entzündungsprozesse, Ischämien, diabetische Retinopathie usw.) zu einer Herunterregulierung von Kir4.1-Kaliumkanälen in den Müllerzellmembranen führen und diese in ihren Funktionen beeinträchtigen (Pannicke et al., 2004, 2005, 2006). Da die Kaliumionen nicht mehr ins Blut abgegeben werden können, kommt es zur Akkumulation von Kaliumionen in den Müllerzellen (Bringmann et al., 2004), was aufgrund des entstehenden osmotischen Gradienten Wasser nach intrazellulär zieht und die Müllerzellen anschwellen lässt (cytotoxisches Ödem). Der osmotische Stress führt weiterhin zur Aktivierung der Phospholipase A2 und Bildung von Entzündungsmediatoren (Bringmann et al., 2006), die die Funktion der Na+-K+-ATPasen auf den Müllerzellmembranen hemmen. Dadurch kommt es zu einer intrazellulären Anreicherung von Natriumionen, was zusätzlich Wasser nach intrazellulär zieht (Abb. 3B). Vasogenes Ödem und cytotoxisches Ödem können sowohl nebeneinander als auch isoliert auftreten (Marmor, 1999), wobei das Zusammenspiel zwischen vasogenem und cytotoxischem Ödem bislang noch nicht abschließend verstanden ist. 12 Der glutamaterg-purinerge Signalweg 3.2 Der glutamaterg-purinerge Signalweg In Experimenten an Netzhautschnitten konnte die Müllerzellschwellung durch die Aktivierung des autokrinen glutamaterg-purinergen Signalwegs verhindert werden (Uckermann et al., 2006; Wurm et al., 2008). Endogen freigesetztes Glutamat aus Neuronen oder Müllerzellen - welches durch Aktivierung der Phospholipase C und calciumabhängiger Exozytose freigesetzt wird - aktiviert Glutamatrezeptoren. Daraufhin wird ATP calciumunabhängig aus Müllerzellen freigesetzt und extrazellulär durch die Ecto-ATPase zu ADP umgewandelt. ADP aktiviert seinerseits Nukleotidrezeptoren (P2Y1) der Müllerzellen, woraufhin diese Adenosin (wahrscheinlich über einen Nukleosid-Transporter) freisetzen. Nach der Aktivierung von Adenosin-A1-Rezeptoren kommt es unter anderem zur Öffnung von Tandemporen-Kaliumkanälen (TASK) sowie von Chlorid-Kanälen auf den Müllerzellen. Durch die Öffnung dieser Kanäle können die entsprechenden Ionen die Zellen verlassen und der osmotische Gradient wird ausgeglichen, was die Schwellung der Zellen verhindert (Wurm et al., 2008) (Abb. 3C) und das Zellvolumen bereits geschwollener Müllerzellen vermindert (Uckermann et al., 2006). Dieser Signalweg konnte experimentell durch verschiedene Stoffe aktiviert werden, so z. B. durch VEGF (Wurm et al., 2008; Reichenbach und Bringmann, 2010). 3.3 Das Netzhautödem - Therapiemöglichkeiten durch Glukokortikoide Bei Patienten mit Uveitis oder diabetischer Retinopathie stellt das Makulaödem die häufigste Erblindungsursache dar (Rothova et al., 1996; Reichenbach und Bringmann, 2010). Neben chirurgischen Maßnahmen wie der Lasertherapie kommen auch antiinflammatorisch wirkende Substanzen wie Glukokortikoide (z.B. Triamcinolon) zum Einsatz (Fraser-Bell et al., 2008). Triamcinolon beeinflusst dabei zum einen über die Verbesserung der Barrierefunktion des Endothels das vasogene Ödem (Penfold et al., 2000), zum anderen fanden Uckermann et al. (2005) heraus, dass sich Triamcinolon zusätzlich günstig auf die Müllerzellschwellung und damit gegen die Entstehung des cytotoxischen Ödems auswirkt. Sie konnten zeigen, dass Triamcinolon wahrscheinlich über eine Förderung der endogenen Adenosin-Stimulation die Müllerzellschwellung nach Ischämie oder Injektion proinflammatorischer Substanzen verhindert (Uckermann et al., 2005). Der genaue Wirkmechanismus von Triamcinolon ist allerdings noch nicht abschließend verstanden. 13 Eigenschaften des Albumins 4 Albumin 4.1 Eigenschaften des Albumins Albumin ist ein in der Leber hergestelltes, negativ geladenes Akute-Phase-Protein von ca. 66 kDa. Über 50% der Plasmaproteine des Blutes gehören zu den Albuminen. Serumalbumin dient vor allem als Transportprotein, weist aber auch antioxidative und enzymatische Eigenschaften auf. Es ist weiterhin hauptverantwortlich für den kolloidosmotischen Druck des Plasmas, wirkt als Puffer und wird in der klinischen Praxis unter anderem als natürliches Kolloid zur Flüssigkeitssubstitution oder zur Korrektur von Hypoalbuminämien eingesetzt (Gregory at al., 2005; Fanali et al., 2012). Rinderalbumin (bovine serum albumin, BSA) wird in experimentellen Arbeiten als Ersatz für humanes Serumalbumin (HSA) verwendet. 4.2 Albumin – neuroprotektiv oder neurotoxisch? Bei erhöhter Gefäßdurchlässigkeit tritt Albumin aus den Blutgefäßen aus und lagert sich im Gewebe ab. Aufgrund seiner osmotischen Potenz zieht Albumin Wasser mit sich, was zur Ödementstehung führen kann. Zusätzlich gelangt bei Störungen der Blut-Netzhaut-Schranke das extrazelluläre Albumin durch Phagozytose auch direkt in die Müllerzellen (Claudio et al., 1994). Zahlreiche kontroverse Studien existieren zum Albumin, die sowohl neuroprotektive Eigenschaften als auch schädigenden Einflüsse aufzeigen. So beschrieb Emerson bereits 1989 die Fähigkeit des Albumins, die Permeabilität der Gefäße zu stabilisieren, toxische Substanzen zu binden und ihre schädigende Wirkung zu inaktivieren sowie freie Radikale abzufangen (Emerson, 1989). Belayev et al. (2001) konnten tierexperimentell zeigen, dass moderate Dosen von Albumin das neurologische Outcome nach einem ischämischen Apoplex in einem gewissen Zeitfenster verbessern und sowohl das Infarktvolumen als auch das Hirnödem signifikant reduzieren können. Ginsberg et al. (2008) schilderten einen durch Albumin verbesserten Blutfluss bei mikrovaskulären Läsionen. Auch die Eigenschaft von Albumin, die Apoptose von Endothelzellen verhindern zu können, wurde beschrieben (Zoellner et al., 1996). Demgegenüber beschreiben Moser und Humpel (2007), dass BSA zu Neurodegeneration führen kann und Zhao et al. (2009) konnten eine BSA-induzierte Freisetzung pro-inflammatorischer Zytokine wie IL-1-β und TNF-α durch Mikrogliazellen zeigen. Basierend auf der SAFE-Studie wird klinisch empfohlen, auf den Einsatz von Humanalbuminlösungen zur Flüssigkeitssubstitution bei Patienten mit Schädel-Hirn-Trauma zu verzichten, da eine erhöhte Sterblichkeit dieser Patientengruppe bei Einsatz von Humanalbumin gezeigt werden konnte (The SAFE Study Investigators, 2007). 14 Albumin und epileptiforme Aktivität 4.3 Albumin und epileptiforme Aktivität Pathophysiologisch liegt epileptischen Anfällen eine unkontrollierte Erregung einzelner Neuronen oder Neuronengruppen zugrunde. Da Neuronen elektrische Signale durch Ionenströme über Zellmembranen generieren, können sich auf die Weiterleitung elektrischer Signale auswirkende Störungen des Ionengleichgewichts eine Übererregbarkeit von Neuronen zur Folge haben. Müllerzellen sorgen dafür, dass übermäßiges Kalium aus dem EZR um Neuronen entfernt wird und tragen so zur Aufrechterhaltung des Ionengleichgewichts und damit zur Vermeidung von Übererregbarkeit der Neuronen in der Netzhaut bei. Im Gehirn scheinen ähnliche pathophysiologische Abläufe zu existieren. Es konnte z. B. gezeigt werden, dass Mäuse, denen Aquaporin-4 fehlt und deren Wasser- und der daran gekoppelte K+ Transport gestört ist, eine verlängerte Krampfdauer aufweisen (Manley et al., 2004; Binder et al., 2006). Bei Ratten konnte nachgewiesen werden, dass Störungen der Blut-Hirn-Schranke zur Entwicklung epileptiformer Aktivität führen können (Seiffert et al., 2004). Hervorgerufen wird dieser Effekt unter anderem durch eine TGF-β-Rezeptor-vermittelte Endozytose von Albumin durch Astrozyten, die mit einer Gliose der Astrozyten und mit einer Herunterregulation der glialen Kir-Kanäle einhergeht, was wiederum die gliale KaliumPufferkapazität mindert und eine Akkumulation des bei Aktivität von Neuronen frei werdenden Kaliums bewirkt. Die extrazelluläre Anhäufung von Kalium führt schließlich zu neuronaler Übererregbarkeit mit gesteigerter epileptiformer Aktivität (Ivens et al., 2007). Chebabo et al. (1995) berichteten, dass eine Verringerung des extrazellulären Volumens durch Gliazellschwellung neuronale Übererregbarkeit begünstigt. Neuronale Aktivität ruft wiederum ihrerseits eine aktivitätsabhängige Schwellung neuronaler Zellkörper und Synapsen hervor, was die Verkleinerung des extrazellulären Volumens aggraviert (Uckermann at al., 2004a). 15 VI Publikation Serum albumin induces osmotic swelling of rat retinal glial cells. Silvana Löffler, Antje Wurm, Franziska Kutzera, Thomas Pannicke, Katja Krügel, Regina Linnertz, Peter Wiedemann, Andreas Reichenbach, Andreas Bringmann Brain Research 1317 (2010), 268-276. 16 17 18 19 20 21 22 23 24 25 VII Zusammenfassung der Arbeit Serumalbumin bewirkt eine osmotische Schwellung der Müllerschen Gliazellen in der Netzhaut der Ratte Dissertation zur Erlangung des akademischen Grades Dr. med. eingereicht von Silvana Löffler angefertigt am Paul-Flechsig-Institut für Hirnforschung an der Medizinischen Fakultät der Universität Leipzig betreut von: Prof. Dr. rer. nat. habil. A. Bringmann Prof. Dr. rer. nat. habil. A. Grosche Prof. Dr. med. habil. A. Reichenbach Leipzig, November 2014 Bei der Entstehung von Netzhautödemen und Hirnödemen spielen verschiedene pathophysiologische Vorgänge eine Rolle. Zum einen kommt es zur erhöhten Durchlässigkeit von Gefäßen mit Wasseransammlungen im Extrazellularraum (vasogenes Ödem), zum anderen tragen auch intrazelluläre Wasseransammlungen (cytotoxisches Ödem) zur Ödementstehung bei. Die erhöhte Gefäßpermeabilität bewirkt neben dem Einstrom von Wasser auch den Einstrom von Serumproteinen, z. B. von Albumin, aus den Gefäßen in die Gewebe. Am Beispiel der Retina konnte gezeigt werden, dass es z. B. bei Entzündungsprozessen zu einem vesikulären Transport von Albumin durch das Gefäßendothel und zu einer Akkumulation von Serumproteinen in retinale Glia- (Müller-) zellen kommt (Claudio et al., 1994). Gliazellen bilden damit neben dem Gefäßendothel eine zweite Barriere gegen den Einstrom von Serumproteinen aus den Gefäßen in das neurale Gewebe. Das Zusammenwirken von vasogenem und cytotoxischem Ödem sowie die genaue Wirkung von Albumin auf Gliazellen sind jedoch nur unzulänglich verstanden und werden in dieser Arbeit näher untersucht. 26 Der dominierende Gliazelltyp der Netzhaut des Auges ist die Müllersche Gliazelle. Müllerzellen durchspannen alle Schichten der Netzhaut und stehen mit Blutgefäßen, dem Subretinalraum sowie dem Glaskörper in Kontakt. Dabei nehmen sie weitreichende homöostatische Aufgaben wahr, die für die Funktionen und die Integrität der Nervenzellen unentbehrlich sind. Retinale Müllerzellen transportieren überschüssiges Wasser aus dem Gewebe in das Blut und können unter hypotonen Bedingungen ihr Zellvolumen regulieren. Unter Einwirkung von oxidativem Stress, Einfluss von Entzündungsmediatoren oder bei Blockade bzw. Downregulation von Kaliumkanälen schwellen allerdings auch Müllerzellen unter hypotonen Bedingungen an (Reichenbach und Bringmann, 2010). Insgesamt spielen Gliazellen bei der Entstehung von Ödemen in neuronalen Geweben eine wichtige pathophysiologische Rolle. Auch zahlreiche weitere Erkrankungen, wie z. B. die hepatische Enzephalopathie bzw. die hepatische Retinopathie sowie die diabetische Retinopathie oder auch die Netzhautablösung sind von pathologischen Veränderungen der Gliazellen begleitet (Reichenbach, 1999). Bei der Entstehung von Epilepsie wird sowohl eine Beteiligung von Gliazellen als auch ein Einfluss durch Albumin diskutiert (Ivens et al., 2007; Seifert et al., 2010). Da die Netzhaut entwicklungsgeschichtlich einen Teil des Zwischenhirns darstellt, laufen viele Prozesse analog in der Netzhaut und im ZNS ab bzw. sind übertragbar. Aus diesem Grund ist die Netzhaut als gut zugängliches Modell hervorragend auch für die Erforschung intrakranieller Prozesse geeignet. Vor diesem Hintergrund besteht das Ziel der vorliegenden Arbeit in der Untersuchung des Einflusses von BSA (bovines Serumalbumin) auf die Volumenregulation der Müllerschen Gliazelle unter hypotonen Bedingungen am Modell der Rattennetzhaut. Weiterhin wird die Beeinflussbarkeit der bei Müllerzellen zu beobachtenden Albumin-induzierten Schwellung durch den glutamaterg-purinergen Signalweg überprüft. Schließlich soll geklärt werden, inwieweit das in der klinischen Routine zur Therapie von Ödemen eingesetzte Triamcinolon mit den beschriebenen Mechanismen interagiert. Die Experimente erfolgten an frisch präparierten, 1 mm dünnen Netzhautschnitten von Ratten. Zunächst wurden die Müllerzellen mit dem Vitalfarbstoff Mitotracker Orange selektiv angefärbt (Uckermann et al., 2004b). Die Querschnittsflächen der Müllerzellsomata der einzelnen Netzhautschnitte wurden während der Versuche mit einem Laser-ScanningMikroskop (LSM 510 Meta, Zeiss) aufgezeichnet. Nachdem die Netzhautschnitte mit einer isotonen Extrazellularlösung superfundiert wurden, schlossen sich Perfusionen mit hypotonen Lösungen (60 % der Kontrollosmolarität) an, in der die Testsubstanzen appliziert wurden. Die Flächeninhalte der Müllerzellsomata wurden ermittelt und mit Graphpad Prism ausgewertet. 27 Um die Effekte von Albumin auf die Müllerzellen zu untersuchen, wurde den Lösungen bovines Serumalbumin (BSA; 5µM) hinzugesetzt. Die Zugabe von BSA bewirkte eine Schwellung der Müllerzellsomata unter hypotonen, nicht aber unter isotonen Bedingungen. Da bekannt ist, dass Entzündungsmediatoren wie Arachidonsäure und Prostaglandine eine Müllerzellschwellung unter hypotonen Bedingungen hervorrufen können (Uckermann et al., 2005), wurde geprüft, ob die Albumin-induzierte Müllerzellschwellung über eine Produktion von inflammatorischen Faktoren vermittelt wird. Der Einsatz des Cyclooxygenase-Inhibitors Indomethacin sowie des Glukokortikoids Triamcinolon verhinderten die BSA-induzierte osmotische Schwellung der Müllerzellen. Als bekannte Inhibitoren der Na+-K+-ATPase können Entzündungsmediatoren zu einem Anstieg der intrazellulären Natriumkonzentrationen und damit zu einem konsekutiven osmotischen Wassereinstrom in die Zellen mit Zellschwellung führen (Staub et al., 1994). Zur Überprüfung dieser Mechanismen bei der Albumin-induzierten Schwellung wurde Monensin eingesetzt. Monensin ist eine Natriumionophore und bewirkt eine Schwellung der Gliazellen unter hypotonen Bedingungen. Es zeigte sich eine gleiche Schwellungsamplitude wie bei Verwendung von BSA. Bei gleichzeitiger Zugabe von Monensin und BSA erhöhte sich die Schwellungsamplitude nicht weiter. Bei Verwendung einer natriumfreien Extrazellularlösung war keine Albumin-induzierte Müllerzellschwellung zu beobachten. Die vorliegenden Ergebnisse lassen vermuten, dass Albumin unter hypotonen Bedingungen die Bildung von Entzündungsmediatoren induziert, die dann die Na+-K+-ATPase hemmen und zu einem intrazellulären Natrium-Anstieg mit konsekutivem Wassereinstrom und Zellschwellung führen. Es ist bekannt, dass Albumin über vesikelähnliche Strukturen von Astrozyten rezeptorvermittelt endozytiert wird (Tabernero et al., 2002; Ivens et al., 2007). Um zu überprüfen, ob die Endozytose-vermittelte Albuminaufnahme bei der Müllerzellschwellung eine Rolle spielt, wurden Netzhäute mit dem Inhibitor der rezeptorvermittelten Endozytose Phenylarsinoxid vorinkubiert. Dies verhinderte die Albumin-induzierte Schwellung unter hypotonen Bedingungen. Auf der Suche nach einem als Rezeptor für die Endozytose wirkenden Albumin-bindenden Protein in der Zellmembran von Müllerzellen wurde das Lectin Limax-flavus-Agglutinin genutzt, das bereits durch Schnitzer et al. (1988) eingesetzt wurde, um den von ihnen identifizierten Albumin-bindenden 60-kDa-Glykoprotein-Rezeptor zu hemmen. Limax-flavus-Agglutinin verhinderte vollständig die Albumin-induzierte Müllerzellschwellung, was nahelegt, dass die Endozytose-vermittelte Albuminaufnahme einen Schritt in der Kaskade der Albumin-induzierten Gliazellschwellung darstellt. 28 Wurm et al. (2008) beschrieben einen endogenen glutamaterg-purinergen Signalweg, dessen Aktivierung die Schwellung Müllerscher Gliazellen unter hypotonen Bedingungen verhindert. Dieser teilweise autokrin funktionierende Mechanismus wird durch Glutamatausschüttung aktiviert und umfasst die sequenzielle Freisetzung von ATP, das in ADP konvertiert wird und eine Aktivierung von P2Y1-Rezeptoren bewirkt und schließlich von Adenosin, das AdenosinA1-Rezeptoren aktiviert (Wurm et al., 2008). Es wurde untersucht, ob die BSA-induzierte Müllerzellschwellung durch eine Aktivierung dieser Signalkaskade verhindert wird. Durch die Zugabe von Glutamat, ATP oder Adenosin konnte die Albumin-induzierte Schwellung jeweils verhindert werden. Eine Blockade von Glutamat-Rezeptoren mit LY341495 führte zu einer Aufhebung des schwellungs-inhibierenden Effektes von Glutamat, aber nicht von ATP und Adenosin. Eine Blockade von ADP- (P2Y1) Rezeptoren mit MRS2179 hob die schwellungs-inhibierenden Effekte von ATP auf, jedoch nicht von Adenosin. Damit konnte gezeigt werden, dass durch Aktivierung des glutamaterg-purinergen Signalweges auch die Albumin-induzierte Schwellung verhindert werden kann. Die Signalkaskade wurde unter dem Einfluss von BSA weiter untersucht und es zeigte sich, dass Adenosin wahrscheinlich nicht durch weitere Hydrolysierung aus ADP gebildet wird, da AOPCP, ein Hemmer des hierfür erforderlichen Enzyms Ektonukleotidase, den Glutamat Effekt nicht veränderte. Vielmehr scheint das Adenosin aus den Zellen freigesetzt zu werden, da der Hemmer des NukleosidTransporters NBTI den schwellungs-inhibierenden Effekt von Glutamat aufhob. Weiterhin konnte gezeigt werden, dass die selektive Hemmung der Proteinkinase A durch H-89 die schwellungshemmenden Effekte von Adenosin verhinderte. Dies lässt vermuten, dass die Proteinkinase A in der dem Adenosin-A1-Rezeptor nachgeschalteten Kaskade beteiligt ist. Um zu überprüfen, ob neben Adenosin-A1-Rezeptoren auch Adenosin-A2-Rezeptoren beteiligt sind, wurde der Adenosin-A2-Rezeptorblocker CSC eingesetzt. Dieser konnte die schwellungs-inhibierende Wirkung von Adenosin und Glutamat nicht verhindern, was gegen eine Beteiligung von Adenosin-A2-Rezeptoren spricht. Es wurde beschrieben, dass der glutamaterg-purinerge Signalweg zur Öffnung von Chlorid- und Kaliumkanälen führt (Wurm et al., 2008). Es zeigte sich, dass sowohl unter Einsatz des Chloridkanalblockers NPPB als auch des Kaliumkanalblockers Clofilium die hemmenden Effekte des Adenosins auf die Albumin-induzierte Schwellung aufgehoben wurden, was dafür spricht, dass die Aktivierung dieses Signalweges auch die BSA-vermittelte Müllerzellschwellung über die Öffnung von Kalium- und Chloridkanälen verhindert. Um zu untersuchen, ob die inhibierende Wirkung von Glutamat auf die Albumin-induzierte Schwellung kalziumabhängig ist, wurden der Hemmer der Phospholipase C (U73122) und der membrangängige Kalziumchelator 29 BAPTA/AM getestet. Beide Substanzen zeigten keine Wirkung auf den Glutamateffekt, was gegen eine Kalziumabhängigkeit der Glutamatwirkung spricht. BAPTA/AM verhinderte weiterhin auch nicht die schwellungs-inhibierende Wirkung von Adenosin, was die Kalziumunabhängigkeit der Adenosinwirkung ebenfalls bestätigt. Die schwellungsinhibierende Wirkung des Endozytoseinhibitors Phenylarsinoxid wurde durch Blockade von Glutamatrezeptoren, von ADP- (P2Y1) Rezeptoren und auch von Adenosin-A1-Rezeptoren jeweils aufgehoben. Dies lässt vermuten, dass auch die Wirkung von Phenylarsinoxid über den glutamaterg-purinergen Signalweg vermittelt wird. Uckermann et al. (2005) beschrieben die Hemmung der Triamcinolonwirkung durch Blockade des Adenosin-A1-Rezeptors mittels DPCPX. Auch die schwellungs-inhibierende Wirkung des Triamcinolons auf die Albumininduzierte Schwellung konnte durch eine Blockade des Adenosin-A1-Rezeptors aufgehoben werden, was den Schluss nahelegt, dass Triamcinolon unter den gegebenen Bedingungen eine Freisetzung von endogenem Adenosin bewirkt. Zusammenfassend konnte mit dieser Arbeit gezeigt werden, dass Albumin eine Gliazellschwellung unter hypotonen rezeptorvermittelter Endozytose von Bedingungen den hervorruft. Gliazellen Albumin aufgenommen. wird Dies via bewirkt wahrscheinlich über die Bildung von Entzündungsmediatoren eine Hemmung der Na+-K+Pumpen, sodass es zu einer Natriumüberladung der Müllerzellen mit konsekutivem Wassereinstrom und Zellschwellung kommt. Damit wird ein Beitrag zum pathophysiologischen Verständnis von schädigenden Albumineinflüssen auf neuronale Gewebe unter hypotonen Bedingungen geleistet. Weiterhin konnte gezeigt werden, dass über die Aktivierung des glutamaterg-purinergen Signalweges eine Öffnung von Ionenkanälen bewirkt wird. Der resultierende Ionenausstrom kompensiert den Albumin-induzierten Natriumeinstrom und kann so einer Zellschwellung entgegenwirken. Möglicherweise kann diese Signalkaskade auch medikamentös induziert werden. Die schwellungs-inhibierende Wirkung von Triamcinolon auf die Albumin-induzierte Schwellung ist wahrscheinlich zumindest teilweise auf eine Aktivierung der glutamaterg-purinergen Signalkaskade zurückzuführen. Die vorliegenden Ergebnisse machen es wahrscheinlich, dass der Einstrom von Albumin aus den Gefäßen in die Netzhaut die Entstehung eines Netzhautödems unter osmotischem Stress begünstigen kann. Dies könnte sich vermutlich auch auf das Hirnödem übertragen lassen. Die Ergebnisse liefern weiterhin einen möglichen Mechanismus, über den Albumin durch Beeinflussung der Ionenhomöostase epileptogen wirken könnte. Inwieweit diese Ergebnisse klinisch bedeutsam sind, muss in weiteren Experimenten näher untersucht werden. 30 VIII Literaturverzeichnis Barnett, N.L., Pow, D.V., 2000. Antisense knockdown of GLAST, a glial glutamate transporter, compromises retinal function. Invest. Ophthalmol. Vis. Sci. 41, 585–591. Belayev, L., Liu, Y., Zhao, W., Busto, R., Ginsberg, M.D., 2001. Human albumin therapy of acute ischemic stroke: marked neuroprotective efficacy at moderate doses and with a broad therapeutic window. Stroke 32, 553–560. Binder, D.K., Yao, X., Zador, Z., Sick, T.J., Verkman A.S., Manley G.T., 2006. Increased seizure duration and slowed potassium kinetics in mice lacking aquaporin-4 water channels. Glia 53(6), 631-636. Bringmann, A., Reichenbach, A., Wiedemann, P., 2004. Pathomechanisms of cystoid macular edema. Ophthalmic Res. 36, 241–249. Bringmann, A., Pannicke, T., Grosche, J., Francke, M., Wiedemann, P., Skatchkov, S.N., Osborne, N.N., Reichenbach, A., 2006. Müller cells in the healthy and diseased retina. Progress in Retinal and Eye Research 25, 397-424. Chebabo, S.R., Hester, M.A., Aitken, P.G., Somjen, G.G., 1995. Hypotonic exposure enhances synaptic transmission and triggers spreading depression in rat hippocampal tissue slices. Brain Res. 695, 203–216. Claudio, L., Martiney, J.A., Brosnan, C.F., 1994. Ultrastructural studies of the blood–retina barrier after exposure to interleukin-1β or tumor necrosis factor-α. Lab. Invest. 70, 850–861. Drescher, K.M., Whittum-Hudson, J.A., 1996. Herpes simplex virus type 1 alters transcript levels of tumor necrosis factor-alpha and interleukin-6 in retinal glial cells. Invest. Ophthalmol. Vis. Sci. 37, 2302–2312. Emerson Jr, T.E., 1989. Unique features of albumin: a brief review. Crit. Care Med. 17, 690– 694. 31 Fanali, G., di Masi, A., Trezza, V., Marino, M., Fasano, M., Ascenzi, P., 2012. Human serum albumin: From bench to bedside. Molecular Aspects of Medicine 33, 209–290. Fraser-Bell, S., Kaines, A., Hykin, P. G., 2008. Update on treatments for diabetic macular edema. Curr. Opin. Ophthalmol. 19, 185–189. Gardner, T.W., Antonetti, D.A., Barber, A.J., LaNoue, K.F., Levison, S.W., The Penn State Retina Research Group, 2002. Diabetic retinopathy: more than meets the eye. Surv. Ophthalmol. 47, S253–S262. Ginsberg MD., 2008. Neuroprotection for ischemic stroke: past, present and future. Neuropharmacology 55, 363–389. Gregory J. Quinlan, Greg S. Martin, Timothy W. Evans, 2005. Albumin: Biochemical properties and therapeutic potential. Hepatology 41(6), 1211-1219. Ivens, S., Kaufer, D., Flores, L.P., Bechmann, I., Zumsteg, D., Tomkins, O., Seiffert, E., Heinemann, U., Friedman, A., 2007. TGF-β receptor-mediated albumin uptake into astrocytes is involved in neocortical epileptogenesis. Brain 130, 535–547. Karwoski, C.J., Lu, H.K., Newman, E.A., 1989. Spatial buffering of light-evoked potassium increases by retinal Müller (glial) cells. Science 244, 578-580. Kimelberg, H.K., 2004. Water homeostasis in the brain: basic concepts. Neuroscience 129, 851-860. Kofuji, P., Newman, E.A., 2004. Potassium buffering in the central nervous system. Neuroscience 129, 1045-1056. Manley, G.T., Binder, D.K., Papadopoulos, M.C., Verkman, A.S., 2004. New insights into water transport and edema in the central nervous system from phenotype analysis of aquaporin-4 null mice. Neuroscience 129, 983–991. 32 Marmor, M.F., 1999. Mechanisms of fluid accumulation in retinal edema. Doc Ophthalmol 97(3-4), 239-249. Matsui, K., Hosoi, N., Tachibana, M., 1999. Active role of glutamate uptake in the synaptic transmission from retinal nonspiking neurons. J. Neurosci. 19(16), 6755-6766. Moser K.V., Humpel C., 2007. Blood-derived serum albumin contributes to neurodegeneration via astroglial stress fiber formation. Pharmacology 80(4), 286-292. Müller H., 1851. Zur Histologie der Netzhaut. Z. Wiss. Zool. 3, 234–277. Nagelhus, E.A., Horio, Y., Inanobe, A., Fujita, A., Haug, F.M., Nielsen, S., Kurachi, Y., Ottersen, O.P., 1999. Immunogold evidence suggests that coupling of K+ siphoning and water transport in rat retinal Müller cells is mediated by a coenrichment of Kir4.1 and AQP4 in specific membrane domains. Glia 26, 47–54. Newman, E.A., 1996. Acid efflux from retinal glial cells generated by sodium bicarbonate cotransport. J. Neurosci. 16, 159–168. Pannicke, T., Iandiev, I., Uckermann, O., Biedermann, B., Kutzera, F., Wiedemann, P., Wolburg, H., Reichenbach, A., Bringmann, A., 2004. A potassium channel-linked mechanism of glial cell swelling in the postischemic retina. Mol. Cell. Neurosci. 26, 493–502. Pannicke, T., Uckermann, O., Iandiev, I., Wiedemann, P., Reichenbach, A., Bringmann, A., 2005. Ocular inflammation alters swelling and membrane characteristics of rat Müller glial cells. J. Neuroimmunol. 161, 145–154. Pannicke, T., Iandiev, I., Wurm, A., Uckermann, O., vom Hagen, F., Reichenbach, A., Wiedemann, P., Hammes, H.-P., Bringmann, A., 2006. Diabetes alters osmotic swelling characteristics and membrane conductance of glial cells in rat retina. Diabetes 55, 633–639. 33 Penfold P.L., Wen L., Madigan M.C., Gillies M.C., King N.J., Provis J.M., 2000. Triamcinolone acetonide modulates permeability and intercellular adhesion molecule-1 (ICAM-1) expression of the ECV304 cell line: implications for macular degeneration. Clin. Exp. Immunol. 121, 458-465. Poitry-Yamate, C.L., Poitry, S., Tsacopoulos, M., 1995. Lactate released by Müller glial cells is metabolized by photoreceptors from mammalian retina. J. Neurosci. 15, 5179–5191. Pow, D.V., Crook, D.K., 1995. Immunocytochemical evidence for the presence of high levels of reduced glutathione in radial glial cells and horizontal cells in the rabbit retina. Neurosci. Lett. 193, 25–28. Reichenbach, A., Robinson, S.R., 1995. Phylogenetic constraints on retinal organization and development: an Haeckelian perspective. Prog. Retin. Eye Res. 15, 139–171. Reichenbach, A., 1999. Neuroglia - das andere zelluläre Element im Nervensystem: Die Müllersche Gliazelle. 1. ed. Erlangen: Pharmacia & Upjohn. Reichenbach, A., Bringmann A., 2010. Müller Cells in the Healthy and Diseased Retina. 1. ed. Springer Verlag. Riepe R.E., Norenburg M.D., 1977. Müller cell localisation of glutamine synthetase in rat retina. Nature 268, 654–655. Rothova, A., Suttorp-van Schulten M.S.A., Treffers W.F., Kijlstra A., 1996. Causes and frequency of blindness in patients with intraocular inflammatory disease. Br. J. Ophthalmol. 80(4), 332-336. Schnitzer, J.E., Carley, W.W., Palade, G.E., 1988. Albumin interacts specifically with a 60kDa microvascular endothelial glycoprotein. Proc. Natl. Acad. Sci. U. S. A. 85, 6773–6777. Seifert, G., Carmignoto, G., Steinhäuser, C., 2010. Astrocyte dysfunction in epilepsy. Brain Res Rev. 63, 212-21. 34 Seiffert, E., Dreier, J.P., Ivens, S., Bechmann, I., Tomkins, O., Heinemann, U., Friedman, A., 2004. Lasting blood–brain barrier disruption induces epileptic focus in the rat somatosensory cortex. J. Neurosci. 24, 7829–7836. Staub, F., Winkler, A., Peters, J., Kempski, O., Kachel, V., Baethmann, A., 1994. Swelling, acidosis, and irreversible damage of glial cells from exposure to arachidonic acid in vitro. J. Cereb. Blood Flow Metab. 14, 1030–1039. Tabernero, A., Velasco, A., Granda, B., Lavado, E.M., Medina, J.M., 2002. Transcytosis of albumin in astrocytes activates the sterol regulatory element-binding protein-1, which promotes the synthesis of the neurotrophic factor oleic acid. J. Biol. Chem. 277, 4240–4246. The SAFE Study Investigators, 2007. Saline or albumin for fluid resuscitation in patients with traumatic brain injury. N Engl J Med 357, 874-884. Tsacopoulos, M., Magistretti, P.J., 1996. Metabolic coupling between glia and neurons. J. Neurosci. 16, 877–885. Uckermann, O., Vargová, L., Ulbricht, E., Klaus, C., Weick, M., Rillich, K., Wiedemann, P., Reichenbach, A., Syková, E., Bringmann, A., 2004a. Glutamate-evoked alterations of glial and neuronal cell morphology in the guinea-pig retina. J. Neurosci. 24, 10149–10158. Uckermann, O., Iandiev, I., Francke, M., Franze, K., Grosche, J., Wolf, S., Kohen, L., Wiedemann, P., Reichenbach, A., Bringmann, A., 2004b. Selective staining by vital dyes of Müller glial cells in retinal wholemounts. Glia 45, 59–66. Uckermann, O., Kutzera, F., Wolf, A., Pannicke, T., Reichenbach, A., Wiedemann, P., Wolf, S., Bringmann, A., 2005. The glucocorticoid triamcinolone acetonide inhibits osmotic swelling of retinal glial cells via stimulation of endogenous adenosine signaling. J. Pharmacol. Exp. Ther. 315, 1036–1045 35 Uckermann, O., Wolf, A., Kutzera, F., Kalisch, F., Beck-Sickinger, A., Wiedemann, P., Reichenbach, A., Bringmann, A., 2006. Glutamate release by neurons evokes a purinergic inhibitory mechanism of osmotic glial cell swelling in the rat retina: activation by neuropeptide Y. J Neurosci Res 83, 538-550. Witkovsky P, Stone S, Ripps H., 1985. Pharmacological modification of the light-induced responses of Müller (glial) cells in the amphibian retina. Brain Res. 328,111-120. Wurm, A., Pannicke, T., Wiedemann, P., Reichenbach, A., Bringmann, A., 2008. Glial cellderived glutamate mediates autocrine cell volume regulation in the retina: activation by VEGF. J. Neurochem. 104, 386–399. Zhao, T.Z., Xia, Y.Z., Li, L., Li, J., Zhu, G., Chen, S., Feng, H., Lin, J.K., 2009. Bovine serum albumin promotes IL-1beta and TNF-alpha secretion by N9 microglial cells. Neurol. Sci. 30, 379–383. Zoellner, H., Hofler, M., Beckmann, R., Hufnagl, P., Vanyek, E., Bielek, E., Wojta, J., Fabry, A., Lockie, S., Binder, B.R., 1996. Serum albumin is a specific inhibitor of apoptosis in human endothelial cells. J. Cell. Sci. 109, 2571–2580. 36 IX Eigenständigkeitserklärung Hiermit erkläre ich, dass ich die vorliegende Arbeit selbstständig und ohne unzulässige Hilfe oder Benutzung anderer als der angegebenen Hilfsmittel angefertigt habe. Ich versichere, dass Dritte von mir weder unmittelbar noch mittelbar geldwerte Leistungen für Arbeiten erhalten haben, die im Zusammenhang mit dem Inhalt der vorgelegten Dissertation stehen, und dass die vorliegende Arbeit weder im Inland noch im Ausland in gleicher oder ähnlicher Form einer anderen Prüfungsbehörde zum Zweck einer Promotion oder eines anderen Prüfungsverfahrens vorgelegt wurde. Alles aus anderen Quellen und von anderen Personen übernommene Material, das in der Arbeit verwendet wurde oder auf das direkt Bezug genommen wird, wurde als solches kenntlich gemacht. Insbesondere wurden alle Personen genannt, die direkt an der Entstehung der vorliegenden Arbeit beteiligt waren. Datum Unterschrift 37 X Lebenslauf Persönliche Daten Name: Silvana Löffler Geburtsdatum: 11.11.1983 in Burgstädt Nationalität: deutsch Familienstand: ledig Schulbildung 1990-1994 Grundschule Chemnitz 1995-2000 Gottfried-Keller-Mittelschule 2000-2003 Berufliches Schulzentrum für Wirtschaft Chemnitz Werdegang 2003-2010 Studium Humanmedizin (Approbation 10.08.2010) seit 2007 Promotion am Paul-Flechsig-Institut für Hirnforschung in Leipzig (Serumalbumin bewirkt eine osmotische Schwellung der Müllerschen Gliazellen in der Netzhaut der Ratte) seit 2010 Assistenzärztin für Anästhesie und Intensivmedizin am Klinikum St. Georg in Leipzig Publikation Löffler S, Wurm A, Kutzera F, Pannicke T, Krügel K, Linnertz R, Wiedemann P, Reichenbach A, Bringmann A, 2010. Serum albumin induces osmotic swelling of rat retinal glial cells. Brain Research 1317, 268-276. 38 XI Danksagung Ich möchte mich an dieser Stelle bei Prof. Dr. rer. nat. A. Bringmann sowie bei Prof. Dr. med. A. Reichenbach für die Ermöglichung dieser Arbeit bedanken. Besonderer Dank für die Betreuung und Diskussion der Ergebnisse gilt Prof. Dr. rer. nat. A. Wurm und Dr. T. Pannicke, die mir mit Gesprächen und Hinweisen immer geholfen haben und jederzeit als Ansprechpartner zur Verfügung standen. Auch allen anderen Mitarbeitern der Abteilung Pathophysiologie der Neuroglia des PaulFlechsig-Instituts für Hirnforschung möchte ich für die gute Zusammenarbeit danken. Besonderer Dank gilt auch meiner Mutter für die aufmunternden Worte sowie ihre Unterstützung, die zur Vervollständigung dieser Arbeit unentbehrlich waren. 39