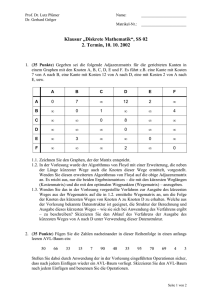
Klinischer Vergleich zweier multifokaler Intraokularlinsen aus Silikon
Werbung

Aus der Klinik für Augenheilkunde im Knappschaftskrankenhaus Bochum-Langendreer -Universitätsklinikder Ruhr-Universität Bochum Direktor: Prof. Dr. med. H. B. Dick Klinischer Vergleich zweier multifokaler Intraokularlinsen aus Silikon und hydrophobem Acrylat Inaugural-Dissertation zur Erlangung des Doktorgrades der Medizin einer Hohen Medizinischen Fakultät der Ruhr-Universität Bochum vorgelegt von Wladislaw Giesbrecht aus Roshdestwenka (Kasachstan) 2007 Dekan: Referent: Koreferent: Prof. Dr. med. G. Muhr Prof. Dr. med. B. Dick Prof. Dr. med. K. Funke Tag der Mündlichen Prüfung: 24.01.2008 Inhaltsverzeichnis 1. Einleitung Seite 1.1. Historischer Überblick 1 1.2. Pathogenese der Katarakt 4 1.3. Intraokularlinsenimplantation 6 1.4. Multifokale Intraokularlinsen 9 1.5. Photopische Phänomene 2. Ziel der Untersuchung 3. Patienten, Material und Methoden 12 14 3.1. Studiendesign 15 3.2. Studienpopulation 16 3.2.1 Einschlusskriterien 16 3.2.2 Ausschlusskriterien 16 3.3. Untersuchungsplan 17 3.4. Klinische Untersuchungen 18 3.5. Operationsablauf und Operationstechnik 27 3.6. Linsendesign 29 3.7. Linsenmaterial 32 3.8. Statistik 33 4. Ergebnisse 4.1. Patientenkollektiv 34 4.2. Visusentwicklung 35 4.2.1 Entwicklung des Fernvisus 35 4.2.2 Entwicklung des Nahvisus 38 4.3. Brillenabhängigkeit postoperativ 41 4.4. Analyse der photopischen Phänomene 44 4.4.1 Nächtliches Sehen 45 4.4.2 Blendeffekte Glare/Flare 46 4.4.3 Halos 47 4.4.4 Farbwahrnehmung/Stereosehen 48 4.4.5 Verzerrtes Sehen in der Nähe 48 4.4.6 Verschwommenes Sehen in der Nähe 48 4.4.7 Verschwommenes Sehen in der Ferne 48 4.4.8 Doppelsehen 49 4.4.9 Photophobie 49 4.4.10 Evaluation anhand der Bildertafel 49 4.5. 52 Zufriedenheit mit der Multifokallinse 5. Diskussion 53 6. Zusammenfassung 70 7. Literaturverzeichnis 73 8. Danksagung 9. Lebenslauf 1.1 Historischer Überblick 1. Einleitung 1.1 Historischer Überblick Die Geschichte der Kataraktchirurgie hat sehr tiefe Wurzeln. Bereits um 1000 v. Chr. lieferte Susruta, ein Chirurg aus Indien die erste Beschreibung der Reklination - einer gezielten Versenkung der eingetrübten Linse in den Glaskörperraum. Allerdings gilt die Festlegung einer Strafe für eine erfolglose Staroperation in den Gesetzbüchern des Hamurabi (ca. 1800 v. Chr.) als erster Hinweis auf den Starstich. Die Behandlungsversuche bei Katarakt stammen damit aus der viel früheren Zeit als die Vorstellungen über die Physiologie des Sehens und die Rolle der eingetrübten Linse. Hippokrates beschrieb das Auge um 400 v. Chr. noch ohne die Linse überhaupt zu erwähnen. Aristoteles (350 v. Chr.) glaubte, sie sei eine „postmortale Veränderung“. Celsus vermutete in der Linse den Sitz des Sehens: „Gutta, a qua videndi facultas profiscitur“ - „Ein Tropfen, von dem das Sehen seinen Ursprung nimmt“. Der Star, von Celsus mit dem griechischen Wort „Hypochysis“ oder auch lateinisch „Suffusio“ („Das Herabgeflossene“) bezeichnet, wurde als Schleimfluss aus dem Gehirn oder als Membranbildung vor der Linse, und nicht als Trübung der Augenlinse selbst vermutet. Diese Anschauung konnte sich bis in das 17. und sogar 18. Jahrhundert erhalten. Der Begriff „Katarakt“ (man sagt die Katarakt) taucht zum ersten Mal um etwa 1000 n. Chr. in der Literatur auf, entstammt dem Griechischen und heißt in der Übersetzung „Wasserfall“ (griech. katarrhaktes=herabstürzend), was dem von Celsus benutzten lateinischen Begriff „Suffusio“ entspricht und auf dem Glauben beruhte, dass es sich hierbei um eine geronnene Flüssigkeit handelt, die sich vom Gehirn her kommend vor die Linse ergossen habe. Im deutschsprachigen Raum wird die Katarakt auch „Grauer Star“ genannt. Nach einer Theorie stammt diese Bezeichnung des Krankheitsbildes von einem „starren“ Blick des blinden Patienten. Ein weiterer Erklärungsversuch ist die Ableitung vom althochdeutschen „stara plint“ - Erblindung durch das Erstarrte, womit der erstarrte Gehirnschleim vor der Linse ähnlich dem lateinischem Begriff „Suffusio“ als Erblindungsursache angenommen wird. Die Entdeckung, dass Katarakt eine getrübte Linse selbst, und nicht ein Häutchen vor ihr sei, wurde vom Pariser Chirurgen Lasnier gemacht, blieb aber weitgehend unbe- 1 1.1 Historischer Überblick kannt und wurde erst einige Jahre später, im Jahre 1705 durch Michel Pierre Brisseau und Antoine Maître-Jan „wiederentdeckt“. Die chirurgische Technik eines Starstichs wurde von Celsus in seinem Buch „Von der Chirurgie“ im 7. Kapitel „Von denjenigen Leiden der Augen, welche mittels chirurgischer Eingriffe geheilt werden“ ausführlich beschrieben. Dabei wird bei einem sitzenden Patienten, dessen Kopf durch einen Gehilfen gefasst und unbeweglich gehalten wird, eine scharfe Nadel ins Auge „zwischen dem Schwarzen des Auges und dem Schläfenwinkel des Auges“ gestochen. Danach bringt der Chirurg die Nadel an den Star heran, und schiebt ihn allmählich bis unter die Pupille herunter. (Münchow, W., 1984) Diese von Celsus beschriebene Staroperation hat sich mit nur wenigen Änderungen in ihren Grundzügen bis ins 19. Jahrhundert erhalten. Eine weitere Möglichkeit der Starentfernung ist aus der antiken arabischen Medizin bekannt. Dabei wurde die Trübung durch eine Hohlnadel aus dem Auge abgesaugt. Eine echte Revolution auf dem Gebiet der Kataraktchirurgie war die Einführung der extrakapsulären Starextraktion durch Jacques Daviel. Im Jahre 1693 geboren, erlernte er zuerst die Wundarzneikunst und studierte danach Anatomie und Chirurgie in Paris. Etwa ab 1728 beschäftigte er sich vorwiegend mit Augenkrankheiten und wurde bald als geschickter Operateur berühmt. Auslöser, der ihn dazu bewegt hatte nach einem besser kontrollierbaren und schonenden Operationsverfahren zu suchen, war ein misslungener Starstich bei einem Patienten, der bereits am anderen Auge nach der gleichen Operation erblindet war. Es kam zu einer massiven Einblutung in die Vorderkammer mit anschließender Vereiterung, die auch durch Eröffnung der Hornhaut und Ablassung der Linsenteile (zuerst beschrieben von M. Petit, 1708) nicht zu beherrschen war. Im April 1752 erstattet Daviel einen ausführlichen Bericht an die Acadèmie Royale de Chirurgie in Paris mit detaillierter Beschreibung des Instrumentariums, Methode und Erfolge seines neuen Operationsverfahrens. Bei dieser Operation wird nach einem unblutigen limbusparallelen Hornhautschnitt in der unteren Zirkumferenz die Linsenkapsel eröffnet und die Linse durch leichten Druck mit den Fingern auf den Bulbus „entbunden“. Die hintere Linsenkapsel als wichtige anatomische Barriere zwischen dem hinteren und vorderen Augenabschnitt bleibt dabei erhalten. Diese neue Methode wurde mit Begeisterung aufgenommen und fand große Anerkennung bei den praktizierenden Augenchirurgen. Parallel dazu wurde aber auch die intrakapsuläre Kataraktextraktion entwickelt. Die Technik wurde zum ersten Mal 1722 von Charles St. Yves und von Samuel Sharp vor2 1.1 Historischer Überblick gestellt. Die Linse löste sich vom Zonularapparat allein durch Expression, was mit deutlichem Risiko eines Glaskörperverlustes verbunden war. Um diesen komplikationsträchtigen Druck auf den Bulbus zu vermeiden, wurde die Pinzettenextraktion (Terson, 1870, Kalk, 1894, Elschnig, 1922) eingeführt. Albrecht von Graefe (1867) löste die Linse mit einem speziellen scharfen Löffelchen, das hinter die Linse eingeführt wurde und erfand ein spezielles schwertförmiges Messer für den Hornhautschnitt. Stöwer (1902) und Barraquer (1917) verwendeten bereits Vakuuminstrumente mit einer breitflächigen Ansaugfläche, um das für die Pinzettenextraktion typische Risiko einer Kapselruptur zu minimieren. In der zweiten Hälfte des letzten Jahrhunderts entstand nach Einführung der fermentativen Zonulolyse mit Alpha-Chymotrypsin (Barraquer, 1958) und der Kryoextraktion mit einem Kältestift (Krwawicz, 1961) eine nahezu perfekte Operationstechnik. Erst in den letzten 30 Jahren hat die extrakapsuläre Staroperation die intrakapsuläre Technik weit zurückgedrängt. Der Grund ist eine rasante Entwicklung der Ophthalmomikrochirurgie, die Einführung der Ultraschall-Phakoemulsifikation und Implantation einer Hinterkammerlinse, die eine intakte Linsenkapsel erfordert. Die intrakapsuläre Linsenextraktion wird heutzutage nur noch in besonderen Fällen bei entsprechender Indikationsstellung verwendet, z. B. bei der Extraktion von maturen Katarakten oder bei vorbestehenden Defekten des Linsenaufhängeapparates - der Zonula zinnii. Die Technik der Zertrümmerung vom harten eingetrübten Linsenkern mit Hilfe von Ultraschallenergie wurde von Charles D. Kelman aus USA im Jahr 1967 vorgestellt. Trotz anfänglicher Skepsis konnte sich diese Operationsmethode nach Überwindung der technischen Probleme relativ schnell durchsetzen und wurde seit den 70er Jahren in den USA, später seit den 80er Jahren zunehmend auch in Europa zur Operationstechnik der ersten Wahl bei normalen Kataraktoperationen. Die großen Vorteile dieser Technik sind das relativ kleine Operationstrauma durch einen kleinen, ca. 2-3 mm schmalen sklerokornealen oder kornealen Schnitt mit entsprechend seltenen Schnittkomplikationen und nur geringem chirurgisch induzierten Astigmatismus. Weitere Meilensteine in der Entwicklung der modernen Katarakt-OP-Technik waren die Erfindung der Kapsulorhexis durch Gimbel und Neuhann (1990) sowie der so genannten „non stitch“ - Technik mit selbstdichtender Inzision durch Anlegen einer Hornhautlippe durch McFarland (1991). Nach statistischen Daten wurden weltweit bereits ca. 80 Millionen Patienten mit Hilfe der Ultraschall-Phakoemulsifikation operiert und jährlich kommen etwa 12 Millionen hinzu. 3 1.2 Pathogenese der Katarakt 1.2. Pathogenese der Katarakt Mit etwa 600 000 Eingriffen, die jährlich alleine in Deutschland durchgeführt werden, ist die Kataraktoperation weltweit eine der häufigsten Operationen überhaupt. Die dadurch im Gesundheitssystem entstehenden Kosten sind nicht unerheblich. Dieser Umstand erklärt auch das Interesse an Pathophysiologie der Kataraktentwicklung. Das Auge ist ein kompliziertes Organ, das aus einem ausgeklügelten optischen und sensorischen System besteht, was sehr vereinfacht dargestellt oft mit einer Fotokamera verglichen wird. Dabei bilden die brechenden Medien: Hornhaut und kristalline Linse zusammen mit der Iris, die als Diaphragma fungiert und dem Glaskörper das „Objektiv“, während die Netzhaut dem lichtempfindlichen Film der Kamera entspricht. Als Katarakt, auch Grauer Star genannt, wird eine Trübung der kristallinen Linse im menschlichen Auge durch Änderung der molekularen Struktur bezeichnet. Dabei kommt es zu einer Abnahme des Wassergehalts, während der Anteil der unlöslichen Proteine (Albuminoid) zunimmt. Als Folge wird die Linse härter, unelastischer und verliert dann langsam an Transparenz. Die Auslöser für die Entstehung der Linsentrübungen sind vielfältig. So wird zwischen kongenitalen und erworbenen Katarakten unterschieden. Die kongenitalen Linsentrübungen sind entweder Folge einer frühembryonalen Schädigung durch virale oder bakterielle Infektion oder eines vererbten genetischen Defekts. Die erworbenen Katarakte resultieren aus einer Stoffwechselstörung bei vielen systemischen Erkrankungen (am häufigsten bei Diabetes mellitus), bei Augenerkrankungen (rezidivierende Uveitiden, z.B. Heterochromiekatarakt), bei Verletzungen (Cataracta traumatica) oder nach Intraoculareingriffen (besonders mit Einsatz von Silikonöl in der Glaskörper- und Netzhautchirurgie) und als Nebenwirkung einiger Medikamente (z.B. Kortisonkatarakt). Den größten Teil der erworbenen Linsentrübungen bildet die altersbedingte Katarakt (lat. Cataracta senilis) – eine Trübung der Linsenrinde und des Linsenkerns, deren Inzidenz mit zunehmend älter werdenden Bevölkerung der Industrieländer kontinuierlich ansteigt. Dabei handelt es sich nicht um ein einheitliches Krankheitsbild. Die Trübungen unterscheiden sich in ihrer Lokalisation und Ausprägung. Als gesicherte Faktoren, die die Entwicklung einer Linsentrübung beschleunigen können, gelten nicht nur das fortgeschrittene Alter sondern auch Umwelteinflüsse in Form von UV-B-Strahlung und oxidativer Stress bei Kettenrauchern. Des Weiteren spielt die bisher unterschätzte geneti- 4 1.2 Pathogenese der Katarakt sche Veranlagung eine wichtige Rolle. So konnte die Twin Eye Study nachweisen, dass die Hälfte aller nuklearen und zwei Drittel aller kortikalen Katarakte durch genetischen Einfluss erklärt werden können. Während des Alterungsprozesses kommt es zunächst zu einer Verdichtung des Linsenkerns. Ursache ist eine lebenslang anhaltende Proliferation des Linsenepithels im Bereich des Linsenäquators. Durch dieses appositionelle Wachstum kommt es zu einer Sklerosierung. Diese natürliche Degeneration alleine führt zu einer Myopisierung, aber noch nicht zu einer Katarakt. Die kristalline Linse ist mit 35% Proteingehalt das eiweißreichste Organ des Körpers. Die linsenspezifischen Proteine (sog. Kristalline) sind in einer transparenten kindlichen Linse wasserlöslich und zudem regelmäßig angeordnet. Erst durch die Glykolisierungs- und Quervernetzungsprozesse als Folge der photooxidativen Reaktionen kommt es zur Akkumulation unlöslicher, Licht streuender Proteinaggregate. Die bisher durchgeführten Studien konnten zwar eine positive Wirkung von bestimmten antioxidativen Substanzen zusammen mit Vermeidung der UV-Expositionsprophylaxe zeigen. Doch erstens ist die Zufuhr von erforderlichen Substanzmengen problematisch und teuer, zweitens sind die bekannten Therapiemöglichkeiten mit einem erhöhten Risiko von z.B. Bronchialkarzinom bei Rauchern und Ex-Rauchern verbunden. (Kottler et al., 2003) 5 1.3 Intraokularlinsenimplantation 1.3. Intraokularlinsenimplantation Die Linse ist ein wichtiger Bestandteil des optischen Systems des menschlichen Auges. Sie hat eine Brechkraft von durchschnittlich 21 Dioptrien, die auch durch entsprechende Veränderung der Kapselspannung über den Strahlenkörpermuskel (Musculus ciliaris) variieren kann. Dies im Zusammenspiel mit der Änderung des Pupillendurchmessers ermöglicht eine wichtige Funktion der Linse: die Akkommodation. Nach einer erfolgten Kataraktextraktion entsteht eine Aphakie (griech. Linsenlosigkeit). Es kommt zu einem massiven Refraktionsdefizit. Das Auge ist damit extrem weitsichtig, parallel einfallende Lichtstrahlen haben ihren Brennpunkt erst weit hinter der Netzhaut. Um diesen Zustand zu korrigieren wurden Katarakt-Patienten früher mit einer so genannten „Starbrille“ versorgt - einem massiven konvexen Sammelglas mit +11 bis +13 Dioptrien Brechkraft. Diese Starbrille hatte ein hohes Gewicht und führte zudem auf Grund der „prismatischen Nebenwirkung“ einer Sammellinse zu einer deutlichen Verkleinerung des Gesichtfeldes des Patienten im Sinne von einem Ringskotom. (Lachenmayr B., Hartmann E., 1999) Eine weitere Alternative ist die Versorgung mit einer weichen oder harten Kontaktlinse, die aber von den meistens älteren und dadurch deutlich gehandicapten Patienten ein nicht unerhebliches Grad an Geschicklichkeit erfordert und zudem hygienisch nicht ganz unbedenklich (man denke nur an die Hornhautulcera, die zu 90% kontaktlinsenbedingt sind!) erscheint. Die ersten Versuche eine Aphakie mit intraokularen künstlichen Linsen zu behandeln, wurden bereits im 18. Jahrhundert unternommen. Giacomo Casanova berichtet in seinen Memoiren von einem italienischen Augenarzt Tadini, den er im Jahre 1764/65 in Warschau kennen gelernt und später 1768 in Barcelona (ironischerweise in einem Gefängnis) wieder getroffen hatte. Tadini besaß kleine Linsen aus Glas und behauptete: „Ich besitze die Kunst, eine solche Kugel unter die Hornhaut anstelle der Linse zu setzen“. Verschiedene Indizien sprechen aber dafür, dass er sein Vorhaben nie in Wirklichkeit umsetzen konnte und eine Linsenimplantation niemals vorgenommen hat. (Fechner et al., 1980) Nicht Erfinder, aber der erste Exekutor der Intraokularlinsenimplantation war der Dresdner Augenarzt Casaamata, Hofokulist des Kurfürsten Friedrich August III. und später sächsischen Königs August I. Den Anstoß für diesen Versuch wird wohl Casano6 1.3 Intraokularlinsenimplantation va gegeben haben, der während seiner vielfachen Besuche in Dresden die lustige Geschichte von den gläsernen Kugeln des Tadini erzählt hatte. Einen Hinweis auf Casaamatas Pioniertat gibt die Dissertation „De Cataracta“ von Rudolph Abraham Schiferli aus Bern. Laut Schiferli hat Casaamata 1795 „den Versuch gemacht, eine gläserne Linse durch die Wunde der Hornhaut ins Auge zu bringen. Er merkte aber, dass diese gläserne Linse nicht anstatt der natürlichen dienen könne, da bei dem Versuch das Glas sogleich auf den Boden des Auges fiel.“ (zit. nach Schiferli, Münchow W., 1984) Erst mehr als 150 Jahre später, am 23. November 1949 implantierte Harold Ridley in Londoner St. Thomas Hospital die erste künstliche Linse aus Plexiglas (Polymethylmetacrylat [PMMA]). Bei verwundeten Kriegspiloten hatte er beobachtet, dass Teile der aus Plexiglas bestehenden Flugzeugkanzeln, die als Fremdkörper ins Auge eingedrungen waren und nicht entfernt werden konnten, komplett einheilten und über Jahre keinen Reizzustand verursachten. So wurde der erste geeignete Grundstoff für die Herstellung der Intraokularlinsen gefunden. Genau wie Casaamata operierte Ridley extrakapsulär und setzte die Linse in die sauber gespülte Kapsel ein. Und musste genauso feststellen, dass die Linse wieder herausfiel. Erst nach mehreren erfolglosen Versuchen gelang es ihm, die Halterung der Intraokularlinse (IOL) so zu verbessern, dass sie am Ort blieb. Nach etwa 1000 von Ridley und seinen Mitarbeitern implantierten Linsen gab er jedoch auf - zahlreiche Komplikationen, wie Dislokationen, Uveitiden, Sekundärglaukome aber auch die hohe Myopie auf Grund der Brechkraft-Fehleinschätzung waren die Ursache. Doch die Idee war geboren, und wurde von vielen Ophthalmochirurgen mit Begeisterung aufgenommen und weiterentwickelt. Es wurden verschiedene Linsendesigns erfunden - Vorder- und Hinterkammerlinsen mit verschiedensten Fixationstechniken: vorderkammerwinkelfixierte (VKL), irisfixierte, hinterkammerwinkel-(sulkus-)-fixierte und hinterkapselfixierte IOL. Als Meilensteine der Entwicklung gelten die Choyce Mark I - eine starre kammerwinkelfixierte VKL mit Plattenhaptiken (Peter Choyce, England 1956), die irisfixierte 4-Schlaufen-Binkhorst-VKL (Cornelius D. Binkhorst, Niederlande 1957), Sputnik Iris Clip-VKL (Fyodorov, UdSSR 1968). Ein interessantes VKL-Design mit offenen J-Haptikschlaufen wurde von Barraquer 1959 entworfen. Auf Grund des starren Haptikmaterials kam es oft zu Erosionen des Ciliarkörpers mit Linsenluxation und schweren Uveitiden. Jahre später wurde dieses Konzept der offenen Haptikschlaufen von Shearing „wiederbelebt“ und mit Verwendung von flexiblen Haptikmaterialien weiterentwickelt. 7 1.3 Intraokularlinsenimplantation Doch fast alle Vorderkammerlinsen hatten einen bedeutenden Nachteil: sehr hohe Komplikationsraten durch den Kontakt mit dem Hornhautendothel und dadurch ausgelöste Endotheldekompensation bis hin zur bullösen Keratopathie sowie Iritiden und Pigmentdispersionsglaukome, was in vielen Fällen eine Explantation der Kunstlinse erforderlich machte. Binkhorst war der erste, der es versuchte, die Kunstlinse wieder an ursprünglichen Ort des Linsensitzes - die Linsenkapsel - zu bringen. Seine modifizierte IOL mit nun 2 Ringhaptiken wurde im Kapselsack befestigt (1965). Shearing setzte 1977 als erster eine PMMA-IOL mit offenen elastischen JHaptikschlaufen aus Prolene in die Hinterkammer ein. Zur Vermeidung von Gewebekontakt wurde dann zunehmend in die Linsenkapsel implantiert. Das von Barraquer eingeführte und von Shearing durch den Einsatz von flexiblen Materialien weiterentwickelte Design der IOL mit zwei J- oder C-förmigen offenen Haptikschlaufen findet man bei dem Großteil der heutzutage sich auf dem Markt befindlichen Intraokularlinsen. 8 1.4 Multifokale Intraokularlinsen 1.4. Multifokale Intraokularlinsen Der Verlust von Akkommodation bedeutet eine deutliche Einbuße an Lebensqualität. Ein durchschnittlicher Kataraktpatient steht heutzutage nicht selten noch „mitten im Leben“ und entsprechend hoch ist die Erwartungshaltung in Bezug auf postoperative Sehschärfe. Um den Traum von einer weitgehenden Brillenfreiheit zu ermöglichen, wurden bereits in den 80er Jahren vergangenen Jahrhunderts die ersten multifokalen Intraokularlinsen eingesetzt. Die optischen Prinzipien der heutzutage verwendeten Multifokallinsen lassen sich in folgende Gruppen unterteilen: • Diffraktive bifokale IOL • Refraktive bi- oder multifokale IOL • Sonstige Konzepte (Kombinationen von diffraktiven und refraktiven Prinzipien sowie „Pseudoakkommodierende“ IOL) Diffraktive IOL beruhen auf dem Prinzip der Beugung (Diffraktion, s. Abb. 1). Sie bestehen in der Regel aus einer sphärischen Vorderfläche und einer diffraktiv wirksamen Rückfläche mit ca. 30 konzentrischen Ringen zur Beugung der Lichtstrahlen, die als Phasengitter funktioniert. Je nach Phasenbeziehung und Amplitudenstärke können sich die Lichtwellen dabei verstärken oder gegenseitig auslöschen. Dabei entfallen jeweils 41% des Lichtes auf Fern- und Nahpunkt, die restlichen 18% gehen allerdings als Streulicht verloren (Abb. 2). Ein großer Vorteil der diffraktiven Optik ist, dass der bifokale Effekt unabhängig von der Pupillengröße und der Zentrierung ist. Die erste diffraktive Linse auf dem Markt war 1987 die 815E - eine konvex-konkave Dreistücklinse von der Firma 3M. Abb. 1 Prinzip des Phasengitters (aus G. Auffarth) Abb. 2 Lichtverteilung der diffraktiven IOL 9 1.4 Multifokale Intraokularlinsen Refraktive IOL funktionieren ganz anders. Sie bestehen meistens aus einer sphärischen Rückfläche und einer Vorderfläche mit mehreren konzentrischen ringförmigen Zonen unterschiedlicher Refraktion. Die erste Zweizonenlinse mit zentralem Nahteil (Addition +4 dpt) und peripherem Fernteil wurde 1986 von John Pearce implantiert. Die Funktionsweise der refraktiven MIOL beruht auf dem Phänomen der Nahmiosis der Pupille. So wird beim Blick in die Nähe das zentrale, stärker brechende Teil der Linse benutzt, während beim Fernblick die physiologische Mydriasis die Nutzung des schwächeren peripheren Teils der IOL-Optik ermöglicht. Das Problem dieses Linsentyps ist die Abhängigkeit von der exakten Zentrierung der IOL im Kapselsack und dem Pupillendurchmesser. Eine der erfolgreichsten refraktiven MIOL ist die Array der Firma AMO, die 1992 als einteilige PMMA-IOL vorgestellt wurde. Das Besondere an dieser IOL ist die sphärisch-asphärische progressive Optik mit 5 refraktiven Zonen auf der wellenförmigen Vorderfläche (Abb. 3). Die zentrale Zone ist als Fernteil mit einigen intermediären Brennpunkten angelegt, jede weitere Zone erzeugt zur Peripherie hin eine progressive Addition bis +3,5 Dioptrien (Abb. 4). Dies ermöglicht eine nahezu „echte“ Akkommodation mit fließendem Übergang zwischen verschiedenen IOL-Bereichen. Abb. 3 Multizonal-progressive Array-IOL Abb. 4 Lichtverteilung der Array-IOL 10 1.4 Multifokale Intraokularlinsen Eine weitere Möglichkeit der Aphakiekorrektur mit Kunstlinsen ist die Kombination aus zwei asymmetrischen MIOL, eine von denen, mit Betonung des Fernpunktes mit ca. 70 % des einfallenden Lichts für die Implantation in das führende Auge bestimmt ist, während die zweite 70 % des Lichts auf den Nahteil betont. Ein Vertreter dieser IOLGattung ist z.B. die TwinSet - eine diffraktiv-refraktive Linse von Acri.Tec GmbH. Ein gänzlich anderes Konzept vertreten die so genannten „akkommodierenden“ Intraokularlinsen, z.B. die 1CU - eine Acryllinse der Fa. HumanOptics. Deren Besonderheit besteht in einem sehr flexiblen Haptik-Optik-Übergang, der als „Sollknickstelle“ dient, was eine „echte“ Akkommodation mit Hilfe des Ciliarkörpers und des intakten Zonulaapparats erlauben soll. Das Funktionsprinzip dieser Linsen beruht auf dem FokusShift-Prinzip. Darunter versteht man eine anteriore Verschiebung der IOL bei Anspannung des Strahlenkörpermuskels, was mit den zurzeit auf dem Markt befindlichen Implantaten eine Akkommodationsbreite von 0,75 bis maximal 1,5 Dioptrien erlaubt. Diese Ergebnisse sind vielversprechend, bleiben aber leider noch weit hinter den Erwartungen zurück. Hinzu kommt eine deutliche Abhängigkeit der erzielten Akkommodationsbreite vom Alter des Patienten und Abnahme der Akkommodationsfähigkeit mit fortschreitender Fibrosierung der Linsenkapsel. Zusätzlich wurde über eine sehr hohe Nachstarrate (bis zu 50% innerhalb von 2 Jahren nach der Implantation) und Verformungen/Verkippungen der IOL mit daraus folgenden Astigmatismus und Fehlrefraktion bei fibrotischer Kontraktion des Kapselsacks berichtet. (Menapace, R., 2005) 11 1.5 Photopische Phänomene 1.5. Photopische Phänomene Als pseudophake photopische Phänomene (PPP) werden eine Reihe von verschiedenen Erscheinungen bezeichnet, die nach der Implantation einer Intraokularlinse auftreten und subjektiv als zum Teil sehr störend empfunden werden können. Seit der Mitte der 90er Jahre ist eine Vielzahl an Arbeiten verschiedener Autoren erschienen, die sich mit den physikalischen Grundlagen und Klassifikation dieser Nebeneffekte befasst haben. Als Auslöser der photopischen Phänomene kommen demnach mehrere Faktoren in Frage. Unter anderem ist bekannt, dass moderne IOL-Materialen (insbesondere Acryl) mit sehr hohem Brechungskoeffizient durch die inneren Lichtreflexionen zwischen vorderer und hinterer Linsenoberfläche, oder moderne Linsendesigns mit scharfer Optikkante zur Nachstarvermeidung zu unerwünschten Lichteffekten führen können. Des Weiteren gelten Linsen mit kleinem Optikdurchmesser oder mit höherer Dioptriezahl (ab ca. +25 dpt und höher) als potenzielle PPP-Quelle. (Tariq Mehmood Aslam, Balejan Dhillon, 2004) Doch diese störenden Lichtphänomene sind keinesfalls nur ein Problem der Multifokallinsen. Es wurde bereits mehrmals nachgewiesen, dass es auch unter Verwendung von konventionellen monofokalen IOL durchaus zum Auftreten von unerwünschten Effekten kommen kann. So zeigte eine Studie von Dick et al. bei der die Größe des Halos mit Hilfe eines Computerprogramms objektiviert wurde keinen wesentlichen Unterschied zwischen monofokalen und multifokalen Linsen. Generell lässt sich sagen, dass die diffraktiven MIOL mehr Lichtstreuung als die refraktiven MIOL verursachen, was auf dem Prinzip der Diffraktion mit gleichzeitig zwei Brennpunkten und großem Anteil des Streulichts von 18% beruht. Im Vergleich dazu sind die multizonal-progressiven refraktiven MIOL etwas besser, wenngleich auch hier eine ähnliche Problematik besteht. (Dick H.B. et al., 1999) Nach Dick und Auffarth lassen sich die häufigsten photopischen Phänomene in folgende Gruppen unterteilen: Lichtringe, Lichtbögen, Lichtblitze, Blendphänomene, Bildüberlagerungsphänomene, Lichtschweife und Nachbilder. Die damit verbundenen Probleme gehen weit über rein subjektive Befindlichkeitsstörung der betroffenen Patienten hinaus. Es kommt zur objektiven Minderung der wichtigen visuellen Funktionen (Visus, Kontrastsehen, Blendempfindlichkeit, Adaptationsstörungen, Doppelbilder) mit dadurch entstehenden rechtlichen und sozialen Folgen für 12 1.5 Photopische Phänomene betroffene Patienten (Fahruntauglichkeit, Berufsunfähigkeit). (Auffarth, G., Dick, H. B., 2001) Eine wichtige Rolle in der präoperativen Vorbereitung spielt die sorgfältige Patientenselektion. Überzogene Erwartungshaltung oder ein Hang zur sehr kritischen Selbstbeobachtung sowie Zugehörigkeit zu einer bestimmten Berufsgruppe mit sehr hohen Anforderungen an das Sehvermögen (z.B. Bus- oder Taxifahrer) sind weniger indiziert für die Implantation einer MIOL oder bedürfen einer eingehenden Aufklärung des Patienten über eventuelle Reduktion des Kontrastsehens oder deutliche Erhöhung der Blendempfindlichkeit. Nicht weniger wichtig ist auch der organische präoperative Befund: es sollte kein Astigmatismus von mehr als 1,5 dpt bestehen und keine Pupillenweite oder Pupillenreaktion beeinflussende Erkrankung oder Medikation vorliegen. Das Patientenalter und Zustand der Hornhautoberfläche sollen ebenfalls berücksichtigt werden. Bei intraoperativen Komplikationen, welche die MIOL-Fixation oder Zentrierung beeinflussen, sollte von einer MIOL-Implantation abgesehen werden. Die angestrebte postoperative Refraktion sollte möglichst im emmetropen oder leicht hyperopen Bereich liegen. (Auffarth, G., Dick, H. B., 2001, Ravalico et al., 1999) Die postoperativ aufgetretenen pseudophaken photopischen Phänomene wurden im Rahmen dieser Studie auf ihre Gestalt, Häufigkeit und Intensität unter Verwendung von standardisierten Fragebögen untersucht. Um die Kommunikation zwischen dem Untersucher und Patient zu erleichtern und dem Untersucher den subjektiven Seheindruck zu verdeutlichen, wurden auch Fotographien der verschiedenen visuellen Effekte benutzt. 13 2. Ziel der Untersuchung 2. Ziel der Untersuchung Multifokale Intraokularlinsen gehören bereits seit einigen Jahren fest zur modernen Kataraktchirurgie. Im Vergleich zu konventionellen monofokalen Linsen bieten sie eine, besonders bei bilateraler Implantation, weitgehende Brillenunabhängigkeit. Doch diese wird oft um den Preis der herabgesetzten Kontrastempfindlichkeit und besonders bei Gegenlicht auftretenden störenden Lichtphänomene (sog. photopische Phänomene) wie Halos, Lichtringe, Lichtschweife, Nachbilder usw. erkauft. Das Ziel dieser Studie ist der klinische Vergleich von zwei refraktiven multifokalen Intraokularlinsen mit multizonal-progressiver Optik aus Silikon vom Typ Array SA40N als Kontrolllinse und neuer Acrylat-IOL vom Typ ReZoom. Beide MIOL kommen vom gleichen Hersteller, der Firma AMO Advanced Medical Optics, Santa Ana, Ca, USA, und stellen das Ergebnis einer kontinuierlichen Weiterentwicklung der im Jahre 1992 präsentierten ersten Array MIOL (Modell MPC-25NB) aus PMMA dar. Die teilnehmenden Patienten wurden nach sorgfältiger Aufklärung über Besonderheiten der MIOL im Vergleich zur konventionellen monofokalen Kunstlinsen jeweils beidseitig operiert und per Zufallsverfahren mit Silikon- oder Acryl-MIOL versorgt. Die wichtigsten Untersuchungsinhalte waren die präoperative und die postoperativ erreichte korrigierte und unkorrigierte Sehschärfe in der Ferne und im Nahbereich, Häufigkeit des Brilletragens nach der Operation und subjektive Zufriedenheit der Patienten. Besondere Aufmerksamkeit galt den postoperativ aufgetretenen photopischen Phänomenen, die mit Hilfe von Bildmaterial auf ihre Art, Intensität, Häufigkeit des Auftretens und subjektive Beeinträchtigung des Patienten untersucht wurden. 14 3. Patienten, Material und Methoden 3. Patienten, Material und Methoden 3.1. Studiendesign Als Studiendesign wurde eine bilaterale klinische Anwendungsbeobachtung verwendet, um die Art und Häufigkeit des Auftretens der photopischen Phänomene nach Implantation einer Multifokalintraokularlinse in Abhängigkeit vom postoperativ erzielten Visus und verwendetem Linsenmaterial zu evaluieren. Bei insgesamt 20 Patienten (insgesamt 40 Augen) wurde nach einer ausführlichen Aufklärung über eingriffstypische Risiken und Komplikationen einer Kataraktoperation sowie Vor- und Nachteile der Multifokallinsen gegenüber konventionellen monofokalen IOL wahlweise eine Silikon-MIOL (Array SA40N) oder Acryl-MIOL (ReZoom) der Firma AMO, Santa Ana, Ca. bilateral implantiert. Der Abstand zwischen der Operation des ersten Auges zum zweiten Auge betrug durchschnittlich eine Woche. Der Beobachtungszeitraum nach der initialen präoperativen Untersuchung erstreckte sich postoperativ auf insgesamt 12 Monate. Die postoperativen Untersuchungen fanden jeweils einen Tag und eine Woche nach der Operation statt. Es wurden die postoperative Refraktion, der Fern- und Nahvisus sowie das Auftreten von Komplikationen kontrolliert. Weitere Kontrolluntersuchungen wurden nach Ablauf von einem Monat nach der Operation des zweiten Auges, danach sechs Monate und ein Jahr postoperativ vorgenommen. Dabei wurde außer obligatorischer Refraktions- und Visusbestimmung sowie Spaltlampenbiomikroskopie eine intensive Befragung der Patienten zu postoperativ aufgetretenen photopischen Phänomenen und subjektiver Beeinträchtigung durchgeführt. In einem mündlichen Interview anhand standardisierter Fragebögen wurden die Patienten aufgefordert die aufgetretenen photopischen Phänomene nach ihrer Art und Intensität zu beschreiben. Die Lichteindrücke wurden mit Hilfe einer Bildertafel mit den simulierten häufigsten Lichtphänomenen ermittelt. Ebenfalls wurde die Sehqualität im Nahbereich und subjektive Zufriedenheit der Patienten mit der implantierten Intraokularlinse evaluiert. 15 3. Patienten, Material und Methoden 3.2. Studienpopulation Die Teilnehmer für diese Studie wurden aus dem konsekutiven Patientenkollektiv der Universitäts-Augenklinik rekrutiert, die den nachfolgenden Ein- und Ausschlusskriterien entsprachen. Es wurden nur Patienten eingeschlossen, die sich zum ersten Mal einer Phakoemulsifikation und Linsenimplantation unterzogen, unter keiner wesentlichen Pathologie der Augen litten und für die Implantation einer Multifokallinse geeignet waren. 3.2.1. Einschlusskriterien • Alter: 18 Jahre oder älter • Bilaterale Katarakt, für die eine Phakoemulsifikation mit Implantation einer Hinterkammer-IOL geplant ist • Keine bekannte Erkrankung der Augen, welche die Sehkraft beeinträchtigen könnte • Beidseitiges geschätztes potenzielles Sehvermögen von 0,7 Dezimalen oder besser, bestimmt durch Retinometrie (Laserinterferometrie) und die Einschätzung des Operateurs • Eignung als Kandidat zur Multifokallinsenimplantation • Verfügbarkeit, Bereitwilligkeit und ausreichende kognitive Fähigkeit, um bei den Untersuchungen zu kooperieren 3.2.2. Ausschlusskriterien • Gleichzeitige oder weniger als 30 Tage zurückliegende Teilnahme an einer anderen klinischen Studie • Bekannte Erkrankungen des Auges, welche die Sehkraft beeinflussen können • Ein okuläres Trauma oder Augenoperation in der Vorgeschichte, welche das Sehvermögen beeinträchtigen könnten • Einnahme von systemischen oder lokalen Medikamenten, welche die Sehfähigkeit beeinträchtigen können • Frauen, wenn sie schwanger sind oder stillen, oder während des Studienzeitraumes eine Schwangerschaft planen 16 3. Patienten, Material und Methoden 3.3. Untersuchungszeitplan Die in die Studie eingeschlossenen Patienten wurden nach der präoperativen Untersuchung bis zu 12 Monate nach der Operation des zweiten Auges auf das Auftreten von photopischen Phänomenen, postoperativen Komplikationen und ihre Sehschärfe hin kontrolliert. Die ersten zwei postoperativen Untersuchungen dienten in erster Linie der Erkennung von postoperativen Komplikationen sowie zur Refraktions- und Visuskontrolle. Evaluation der Lichtphänomene und subjektiver Beeinträchtigung wurde bei den Kontrollen nach Ablauf von 1, 6 und 12 Monaten anhand der Fragebögen durchgeführt. Folgender Zeitplan gibt Aufschluss über die Einteilung der Untersuchungen. Tabelle Nr. 1 Untersuchungszeitplan Untersuchung Anzahl der Augen Zeitraum 1 Beide Augen Präoperative Untersuchung 2 Erstes Auge Operation 3 Erstes Auge Postop. Visite 1 (1 Tag nach der Operation) 4 Erstes Auge Postop. Visite 2 (1 Woche nach der Operation) 5 Zweites Auge Operation 6 Zweites Auge Postop. Visite 1 (1 Tag nach der Operation) 7 Zweites Auge Postop. Visite 2 (1 Woche nach der Operation) 8 Beide Augen Postop. Visite 3 (1 Monat nach der Operation) 9 Beide Augen Postop. Visite 4 (4-6 Monate nach der Operation) 10 Beide Augen Postop. Visite 5 (1 Jahr nach der Operation) 17 3. Patienten, Material und Methoden 3.4. Klinische Untersuchungen Tabelle 2 gibt Aufschluss über die klinischen Untersuchungen, die für diese Studie notwendig sind. Die wichtigsten von ihnen werden auf den folgenden Seiten genauer erklärt. Tabelle Nr. 2 Erforderliche Untersuchungen Untersuchungen Anamnese/ Präop. Postop. 1 Postop. 2 Postop. 1 Postop. 2 Postop. 3 Postop. 4 Postop. 5 Beide Erstes Erstes Zweites Zweites Beide Beide Beide Augen Auge Auge Auge Auge Augen Augen Augen X X X X X X X X X X X X X X X X X X Aufklärung Einverständniserklä- X rung des Patienten Retinometrie X Keratometrie X Pupillometrie X Tonometrie X Fundusuntersuchung X Biomikroskopie X Biometrie/IOL- X X X X X X X X X X X X Kalkulation Refraktion X X X X X X X X Unkorrigierter Visus X X X X X X X X X X X X X X X X (Ferne) Korrigierter Visus (Ferne) Unkorrigierter Visus X X X X X X X X X X X X X X X X X X X X X X X X X X X (Nähe) Fernkorrigierter Visus (Nähe) Nahkorrigierter Visus (Nähe) Lichtphänomene/ Fragebogen Medikation X X X X Zwischenfälle X X X X 18 3. Patienten, Material und Methoden 3.4.1. Potentielle Sehschärfe Liegen Trübungen der brechenden Medien vor (Hornhaut, Linse, Glaskörper), so kann selbst bei optimalem Ausgleich des Refraktionsfehlers keine normale Sehschärfe erzielt werden. Hinzu kommt, dass die subjektive Refraktionsbestimmung bei Vorliegen stärkerer Medientrübungen ungenau wird, da der Patient aufgrund der schlechten optischen Qualität seines Netzhautbildes keine zuverlässigen Angaben machen kann. Bei dichten Trübungen der optischen Medien ist eine Refraktionsbestimmung im herkömmlichen Sinne nicht mehr möglich. Vor der Planung von den operativen Eingriffen zur Beseitigung der getrübten Medien ist es daher wichtig, herauszufinden, wie gut das Sehvermögen des betroffenen Auges werden kann, wenn die Störung in der Optik behoben ist. (Lachenmayr, B. et al., 1999) Eine nicht nur qualitative, sondern auch quantitative Funktionsprüfung erlaubt das Interferenzverfahren. Der Laser-Interferenztest (Retinometer) erzeugt von einem schwachen Helium-Neon-Laser zwei Lichtpunkte von 0,05 mm Durchmesser in der Pupillenebene des zu untersuchenden Auges. Im Überlappungsbereich der beiden Bündel entsteht aufgrund der Kohärenz der Teilstrahlen eine Figur aus abwechselnd roten (oder grünen) und schwarzen Streifen, deren Liniendichte nur vom Abstand der beiden Lichtpunkte in der Patientenpupille, nicht jedoch von der optischen Abbildung des untersuchten Auges abhängt. Die mit dem Gerät mögliche Variation der Liniendichte erlaubt eine quantitative Korrelation der feinsten erkannten Interferenzstreifen mit dem erreichbaren Visus. Zur Verringerung der Ratewahrscheinlichkeit können die Streifen in verschiedener Orientierung (vertikal, horizontal und diagonal) angeboten werden. Der Vorteil der Interferometer ist, dass sie unabhängig von der Refraktion des Auges und vom Vorliegen von Abbildungsfehlern sind. (Straub, W. et al., 1995) Aufgrund der sehr strengen Einschlusskriterien wurden in diese Studie nur Patienten eingeschlossen, deren potenzielle Sehschärfe auf beiden Augen mindestens 0,7 Dezimal betrug. Zur Messung wurde das Retinometer der Firma Rodenstock verwendet, das bereits in klinischen Studien seine Zuverlässigkeit und Überlegenheit gegenüber Geräten anderer Hersteller bewiesen hat. (Behrens-Baumann, W. et al., 1998) 19 3. Patienten, Material und Methoden 3.4.2. Keratometrie (Hornhauttopographie) Eine Messung der Hornhautkrümmungsradien (Keratometrie) wurde bei den in die Studie eingeschlossenen Patienten prä- und postoperativ mittels C-Scan Farb-Ellipsoid Videokeratoskop der Firma Technomed, Baesweiler durchgeführt. Im Rahmen der präoperativen Untersuchung dient sie der Bestimmung von Brechkraft der zentralen Hornhaut und Linsenberechnung, sowie zum Ausschluss von hochgradigem oder irregulärem Astigmatismus und organischer Hornhauterkrankungen (z.B. Keratokonus). Patienten mit präoperativem Astigmatismus von > 1,5 Dioptrien wurden aus der Studie ausgeschlossen, da es bei ihnen bekanntermaßen zu einer deutlichen Zunahme von photopischen Phänomenen kommen kann. (Dick, B., Auffarth, G., 2001) Die postoperative Keratometrie erlaubte zusätzlich eine Aussage über den chirurgisch induzierten Astigmatismus. Das Funktionsprinzip der Hornhauttopographie basiert auf der sog. Placido-Scheibe (Antonio Placido, 1882). Sie projiziert konzentrische weiße und schwarze Ringe auf die gesamte Hornhautoberfläche und erlaubt durch das Loch in der Mitte die Betrachtung des Spiegelbildes. Vom Mittelpunkt ausgehend zur Peripherie hin lassen sich die Abstände zwischen den Ringen bestimmen. Aus diesen Daten lassen sich für jeden Abstand in jeder Rotationsachse die Steigung, also der Radius und somit die Brechkraft errechnen. Das verwendete moderne Hornhauttopgraphiegerät C-Scan Farb-Ellipsoid Videokeratoskop der Fa. Technomed benutzt dazu Ringe in verschiedenen Farben, was zu einer besseren Separation bei Unterbrechungen/Überlappungen oder Irregularitäten in der Abbildung führt. (Koop, N. et. al, 1997) Die Fokussierung erfolgt über Laserpunkt, die Positionierung des Patienten ist wie an einer Spaltlampe. Eine wichtige Bedingung für die erfolgreiche und aussagekräftige Keratometrie stellt gleichmäßige Benetzung der Hornhautoberfläche mit dem Tränenfilm dar. Eine hoch auflösende Digitalkamera liefert das Bild an den Computer, der mittels geeigneter Software dieses analysiert und in numerische Werte umsetzt. Das Ergebnis ist ein mit Falschfarben kodiertes Bild. Das mittlere Farbspektrum (grün, gelb) wird in der Regel für normale, kühle Farben (blau, schwarz) für geringere und warme Farben (rot, orange, weiß) für höhere Brechwerte gewählt. (Dick, B., 1998) Eine normal gewölbte Hornhaut zeigt geringe Farbunterschiede. Ein regulärer Astigmatismus bildet dabei eine schmetterlingsartige Figur. Die Hornhautradien der zentralen Zone (0-3 mm) 20 3. Patienten, Material und Methoden wurden für die Kalkulation von der Brechkraft der zu implantierenden Intraokularlinse verwendet. 3.4.3. Pupillometrie Viele bereits erschienene Arbeiten verschiedener Autoren konnten zeigen, dass der Pupillengröße eine entscheidende Rolle beim Auftreten von unerwünschten photopischen Phänomenen nach der Implantation einer multifokalen Intraokularlinse zukommt. Die Gefahr ist proportional zur Größe die Pupillen im skotopischen und mesopischen Bereich. Daher ist es besonders wichtig die Pupillengröße unter unterschiedlichen Lichtverhältnissen präoperativ genau zu vermessen. Einerseits werden dadurch die postoperativen Ergebnisse positiv beeinflusst, andererseits bleiben dem ungeeigneten Patienten dadurch die Unannehmlichkeiten der postoperativen Problematik bis hin zur Arbeitsunfähigkeit (z.B. bei Taxifahrern) erspart. Zur Messung wurde das standardisierte Colvard-Pupillometer der Firma OASIS Medical Inc., Glendora, verwendet. Jedes Auge wird dabei einzeln vermessen. Um die Belichtungssituation einer nächtlichen Autofahrt zu simulieren wird die Untersuchung in einem abgedunkelten Raum durchgeführt. Patienten mit Pupillenmotilitätsstörungen oder Pupillenanomalien wurden gemäß den strengen Einschlusskriterien aus der Studie ausgeschlossen. 3.4.4. Tonometrie Der Augeninnendruck wurde bei den teilnehmenden Patienten mittels GoldmannApplana-tionstonometer gemessen. Das Prinzip dieser Messmethode beruht auf dem Imbertschen Gesetz: der Druck in einem mit Flüssigkeit gefüllten kugelförmigen Hohlraum entspricht dem Gegendruck, der eine bestimmte Fläche dieser Kugel abplattet. Bei dieser Untersuchung wird gegen anästhesierte und mit Fluoreszein angefärbte Hornhaut ein Messzylinder mit 3,06 mm Durchmesser gedrückt und eine Fläche von 7,35 mm2 applaniert. Bei dieser Applanationsfläche heben sich zwei systemische Fehler gegenseitig auf: der Widerstand der Hornhaut gegen die Verformung wird von Oberflächenspannung der in der Peripherie zusammengedrängten Tränenflüssigkeit kompensiert. Die Messung erfolgt an der Spaltlampe bei nicht dilatierter Pupille. 21 3. Patienten, Material und Methoden 3.4.5. Biomikroskopie/Funduskopie Das Funktionsprinzip der Biomikroskopie basiert auf der von Allvar Gullstrand in Zusammenarbeit mit der Firma Karl Zeiss entwickelten und 1911 in Heidelberg präsentierten Spaltlampe zur Untersuchung der vorderen Augenabschnitte mit fokaler Beleuchtung. Diese Untersuchungsmethode erlaubt eine genaue Beurteilung des Zustandes des vorderen Augenabschnittes und insbesondere der brechenden Medien (Hornhaut und Linse). Zur Untersuchung der Studienpatienten wurde eine Spaltlampe der Fa. HaagStreit, Bern benutzt. Die Untersuchung des Augenhintergrunds (Funduskopie) erfolgte direkt mit einem Kopfophthalmoskop und einer +20 dpt Lupe, sowie indirekt an der Spaltlampe mit Verwendung einer zusätzlichen +90 dpt Lupe. Diese Untersuchung wurde bei allen Patienten im Rahmen der präoperativen Vorbereitung mit erweiterter Pupille vorgenommen. Das Ziel der präoperativen Funduskopie ist die rechtzeitige Erkennung von potentiell gefährdeten Arealen der peripheren Netzhaut (Degenerationsareale) sowie die Beurteilung des Zustandes von Sehnervenkopf (Papilla nervi optici) und zentraler Netzhaut mit der Stelle des schärfsten Sehens (Macula lutea). 3.4.6. A-Scan Biometrie/IOL-Berechnung Unter „A-Scan-Biometrie“ versteht man die Messung von Längen und Distanzen in biologischen Geweben mit Hilfe von Ultraschall. Die Grundlage dieser, auch „Echometrie“ genannten Messmethode, ist das „Impuls-Echo-Prinzip“, bei dem aus der Messung von Echolaufzeiten Distanzen abgeleitet werden. Die Einführung der UltraschallBiometrie in die Ophthalmologie geschah 1956 durch Mundt und Hughes aus Amerika und fand zunehmend weltweite Verbreitung. Die Achsenlänge des Augapfels besteht aus den Teilstrecken Hornhaut, Vorderkammer, Linse und Glaskörper. Aus der Summe der Laufzeiten in diesen Teilstrecken unter Berücksichtigung unterschiedlicher Schallgeschwindigkeiten in Geweben wird von einem Computer die gesamte Achsenlänge des Bulbus berechnet. Zur Messung wurde das Kontaktverfahren nach Oberflächenanästhesie der Hornhaut mit dem A-Scan Gerät A+ Auto-Scan der Firma Sonomed gewählt. Eine zusätzliche neuartige Möglichkeit die Augapfellänge zu vermessen, bietet das auf dem Prinzip der teilkohärenten Laser-Interferometrie (partial coherence inteferometry, 22 3. Patienten, Material und Methoden PCI) basierende IOLMaster der Fa. Zeiss an. Dieses „All-in-one“-Gerät erlaubt eine genaue Messung der Achsenlänge im non-Kontakt Verfahren, sowie Bestimmung der Hornhautkrümmungsradien und der Vorderkammertiefe. Die Anwendung der LaserInterferometrie geht auf den Wiener Physiker Prof. Fercher zurück, der bereits Mitte der 80er die ersten menschlichen Bulbusachsenlängen in vivo bestimmte. Das IOLMaster der Fa. Carl Zeiss Jena ist bereits seit Herbst 1999 auf dem Markt und wurde auch bei Untersuchungen der Patienten aus der Studiengruppe eingesetzt. Die IOL-Kalkulation erfolgte mittels physikalisch-optischer Formel der 2. Generation SRK/T (Sanders, D. R. et al., 1990) unter Einbeziehung der Hornhautkrümmungsradien, Vorderkammertiefe und Bulbusachsenlänge sowie der vom Linsenhersteller empfohlenen IOL-spezifischen A-Konstanten (118,0 für SA40N und 118,4 für ReZoom). Als postoperative Zielrefraktion wurde die Emmetropie bzw. leichte Hyperopie angestrebt. 3.4.7.1. Bestimmung des Fernvisus Vor der Bestimmung der subjektiven Refraktion wurde bei jedem Patienten ein Ausgangswert mittels objektiver Refraktion mit Hilfe des Autorefraktometers Modell 599 der Firma Humphrey Instruments Inc. der Carl Zeiss Group gemessen. Für die Untersuchung des Fernvisus wurde eine ETDRS-Chart Nr. 2 Lesetafel der Firma AMO, Santa Ana, Ca. verwendet (Bailey et al., 1982). Diese retroilluminierte Lesetafel wird in einem Abstand von genau 4 Metern von Patienten entfernt aufgestellt. Zuerst wurde das rechte Auge, dann das linke Auge und zuletzt beide Augen gleichzeitig dem Sehtest unterzogen. Das nicht geprüfte Auge wurde routinemäßig okkludiert. Die Visusprüfung erfolgte mit standardisierter Beleuchtung gemäß DIN 58 220. Zur statistischen Auswertung wurden sowohl unkorrigierter als auch der korrigierte Fernvisus verwendet. 3.4.7.2. Bestimmung des Nahvisus Für die Untersuchung des Nahvisus wurde die 100% Lesetafel des Contrast Acuity Test (CAT-Chart) nach Holladay der Firma AMO, Santa Ana, Ca, verwendet. Zuerst wurde das rechte Auge, dann das linke Auge und zuletzt beide Augen getestet. Das nicht untersuchte Auge wurde routinemäßig okkludiert. Die Distanz zur Lesetafel betrug genau 40 cm. Um eine ausreichende Raumbeleuchtung zu gewährleisten, wurde eine 75Watt 23 3. Patienten, Material und Methoden Glühbirne als Deckenbeleuchtung verwendet und mit dem Preset Lichtmessgerät der Firma AMO, Santa Ana, Ca, überprüft. Für die statistische Auswertung wurden der unkorrigierte Nahvisus, der fernkorrigierte Nahvisus und der korrigierte Nahvisus (Fernkorrektur mit Nahaddition) verwendet. 3.4.7.3. Fragebogen zur Qualifizierung und Quantifizierung photopischer Phänomene. Die ausführliche Evaluation der postoperativ aufgetretenen photopischen Phänomene erfolgte mit einem vorgegebenen Fragebogen der Firma AMO, Santa Ana, Ca. Diese Bögen wurden präoperativ und bei den postoperativen Visiten Nr. 3, 4, 5 in Zusammenarbeit mit dem Untersucher ausgefüllt. In Folgenden ein Beispiel des Fragebogens: 1. Kommen Sie ohne Brille zurecht? Ferne: ja/nein mittlere Entfernung: ja/nein Nähe: ja/nein 2. Wie zufrieden sind Sie mit Ihrer Sehkraft? Sehr zufrieden/Mäßig zufrieden/Nicht zufrieden (Rechtes Auge, Linkes Auge, Beide Augen) 3. Könnten Sie jetzt noch mal wählen, würden Sie sich wieder für den gleichen Linsentyp entscheiden? Ja/Nein 4a. Benötigen Sie eine Sehhilfe? Immer/Manchmal/Nie 4b. Falls Sie eine Sehhilfe benötigen, welcher Art?(mehrere Antworten möglich) Fernbrille/Lesebrille/Bifokalbrille/Trifokalbrille/Gleitsichtbrille/Kontaktlinsen/Andere 4c. Falls Sie eine Sehhilfe benötigen, aus welchem Grund?(nur eine Antwort möglich) Um Fernvisus zu verbessern O Um Fern- und Nahvisus zu verbessern O Nur beim Lesen O Aus kosmetischen Gründen, als Modeartikel O Aus Gewohnheit O Andere Gründe O 5. Schätzen Sie Ihre Sehqualität (Schärfe, Klarheit)in der Nähe (ggf. mit Brille) ein: A. Drinnen B. Draußen bei Tag C. Draußen bei Nacht: Gut/Ausreichend/Schlecht 24 3. Patienten, Material und Methoden 6. Schätzen Sie Ihre Sehqualität in der Ferne (ggf. mit Brille) ein: A. Drinnen B. Draußen bei Tag C. Draußen bei Nacht: Gut/Ausreichend/Schlecht 7. Wie gut können Sie folgenden Aktivitäten ohne Ihre Brille nachgehen: Zeitungslesen/Buchlesen/Lesen der Medikamenten- Packungsbeilage/Kartenspielen/ Kochen, Essen/Einkaufen/Spazieren gehen/Gesichter erkennen/Autofahren/FernsehenStraßenschilder lesen usw. Mögliche Antworten: Mühelos möglich/Manchmal möglich/Nicht möglich 8. Schätzen Sie den Schweregrad folgender Sehproblemen ein (ggf. mit Brille): A. Sehstörung bei Nacht/Dämmerung B. Blendeffekte/starke Blendung C. Lichthöfe (sog. Halos) D. Störung der Farbwahrnehmung E. Störung des Stereosehens F. Verzerrtes Sehen in der Nähe G. Verschwommenes Sehen in der Nähe H. Verschwommenes Sehen in der Ferne I. Doppelbilder Mögliche Antworten: Keine Schwierigkeiten/Mäßige Schwierigkeiten/Massive Probleme 9. Falls andere Probleme aufgetreten sind, unter welchen Bedingungen? 10. Kommentare Anschließend wurden Patienten, die bei der Frage Nr. 8B (Blendung) und 8C (Lichthöfe) eine leichte bis schwere Störung angaben gebeten, ihren Seheindruck mit Hilfe einer speziellen Bildertafel genau zu definieren. Diese Tafel besteht aus insgesamt 6 Abbildungen eines in der Nacht entgegenkommenden Fahrzeugs (Abb. 5). Jedes Bild dieser Tafel zeigt ein anderes Lichtphänomen: Bild Nr. 1: normaler nächtlicher Seheindruck Bild Nr. 2: Lichthöfe (Single Halos) Bild Nr. 3: Farbringe (Double Halo) Bild Nr. 4: Strahlenkränzchen (Starburst) Bild Nr. 5: Blendeffekt (Starburst+Halos) Bild Nr. 6: starker Blendeffekt 25 3. Patienten, Material und Methoden Fragen zu der Bildertafel: Frage 1: Welches Bild entspricht am ehesten Ihrem nächtlichen Seheindruck? Frage 2: Vergleichen Sie Ihren eigenen Seheindruck (Größe, Intensität) mit dem Bild. Mögliche Antworten: Kleiner als auf dem Bild/Größer als auf dem Bild/Vergleichbar mit dem Bild Abb. 5 Verwendete Bildertafel mit photopischen Phänomenen 26 3.5 Operationsablauf und Operationstechnik 3.5. Operationsablauf und Operationstechnik Für alle teilnehmenden Patienten in dieser Studie wurde eine moderne Technik der Katarakt-Operation angewendet - die sog. Phakoemulsifikation. Diese 1967 von Charles Kelman präsentierte Methode der Entfernung von hartem Linsenkern durch seine Zerkleinerung (Emulsifikation) mit Hilfe von Ultraschall mit anschließender Absaugung der weichen Linsenrinde ist eine Weiterentwicklung der altbekannten ECCE-Technik und wurde in vergangenen Jahrzehnten kontinuierlich verbessert und modernisiert. Die Einführung von Viskoelastika auf Basis von Hyaluronsäure erleichterte die Arbeit des Ophthalmochirurgen enorm. Erstens, indem sie für stabile intraoperative Verhältnisse durch visköse Materialeigenschaften sorgte. Zweitens bietet eine Viskoelastikumschicht einen gewissen Schutz für das Hornhautendothel vor intraoperativem Trauma durch herumfliegende Trümmerteile und schädliche Einwirkung von intraokular abgegebener Ultraschallenergie. Die Entwicklung von faltbaren Intraokularlinsen war der nächste entscheidende Schritt, der es erlaubte, den operativen Zugang zu verkleinern und damit das Risiko von Schnittkomplikationen aber auch den chirurgisch induzierten Astigmatismus zu minimieren. Die Anzahl der gefürchteten Komplikationen, wie Hornhautendotheldekompensation mit Hornhauödem als Folge oder zystoiden Makulaödems (sog. Irvine-Gass-Syndrom) konnte durch die Einführung von Phakomaschinen mit fraktionierter Abgabe von Utraschallimpulsen (z.B. „White Star“-Technologie) drastisch reduziert werden. Zusammenfassend lässt es sich sagen, dass damit eine nahezu perfekte Operationsmethode entstanden ist, die sicher und für den Patienten wenig belastend ist. In Händen eines versierten Chirurgen ist sie sogar dazu geeignet, Augen mit klaren Linsen im Rahmen eines refraktiv-chirurgischen Eingriffs (Clear-Lens-Exchange) zu behandeln. Im Folgenden werden die einzelnen Schritte einer Katarakt-Operation erläutert. Zur Operationsvorbereitung wird die Pupille mit mydriatischen Augentropfen (Mydriatikum Stulln + Neosynephrine-POS 5%) erweitert und die Konjunktiva mit Proparakain-Augentropfen anästhesiert. Danach erfolgt die retrobulbäre Injektion eines Lokalanästhetikums zum Ausschalten der Schmerzempfindung und der Motilität des Auges mit Lidakinäsie. Als eine äußerst effektive Maßnahme der Endophthalmitisprophylaxe hat sich eine Ausspülung des Bindehautsacks mit jodhaltiger Braunol-Lösung erwiesen. (Behrens-Baumann, W., 2004) 27 3.5 Operationsablauf und Operationstechnik 1. Nach steriler Abdeckung des Operationsfeldes erfolgt die Präparation eines temporalen kornealen (sog. Clear-Cornea-Schnitt) Tunnelschnitts mit Hilfe eines Diamantmessers. Dieser Schnitt ist durch seine Form selbstdichtend (sog. „No-Stitch“-Technik) und praktisch astigmatismusneutral. (Anders, N. et al., 1997) Zusätzlich werden zwei Hilfszugänge (Parazentesen) in der Regel peripher bei 6h und 12h limbusnah angelegt. 2. Nach Eingabe von Viskoelastikum (z.B. Healon o.ä.) wird eine kreisrunde vordere Kapsulotomie (Kapsulorhexis nach Gimbel/Neuhann) mit einer zurechtgebogenen Kanüle durchgeführt. 3. Danach erfolgt die Hydrodissektion. Dazu wird die BSS-Lösung mit einer stumpfen Kanüle unter die Vorderkasel am Rhexisrand injiziert. Dies erleichtert später die Mobilisierung des Linsenkerns. 4. Mit einem Ultraschallhandstück mit integrierter Irrigations-/Aspirations-Vorrichtung wird der harte Linsenkern zerkleinert, emulsifiziert und abgesaugt. 5. Anschließend erfolgt die Rindenabsaugung bimanuell über die Parazentesen bei 6h und 12h mit Hilfe spezieller Irrigations-/Aspirationshandstücke. 6. Die Vorderkammer und die Linsenkapsel werden mit Viskoelastikum gefüllt und der Tunnelschnitt auf ca. 3 mm erweitert. 7. Die Linse wird in gefaltetem Zustand mit Hilfe eines Injektors (z.B. UnFolder, Fa. AMO, Santa Ana, Ca) in die Linsenkapsel gebracht, wo sie sich entfaltet und über ihre Haptiken fixiert und gleichzeitig zentriert. 8. Zum Schluss erfolgen die Aspiration des verbliebenen Viskoelastikums und die Tonisierung des Bulbus mit BSS-Lösung. 9. Prüfung des Tunnels auf Dichtigkeit. Zur postoperativen Nachbehandlung wurden antibiotische Augentropfen (Gentamicin) in Kombination mit steroidhaltigen Augentropfen (Inflanefran forte) 3 x täglich verabreicht. Alle Operationen verliefen planmäßig und komplikationsfrei. Postoperative Komplikationen wie z.B. Infektion, Endophthalmitis, Endotheldekompensation, Tensioentgleisung, Netzhautablösung, Linsendislokation oder Makulaödem sind innerhalb des Nachbeobachtungszeitraumes nicht aufgetreten. 28 3.6 Linsendesign 3.6. Linsendesign In unserer Zeit scheint es nicht ausreichend, den Mensch von seiner Katarakt zu befreien. Eine möglichst perfekte optische Rehabilitation bei weitgehender Brillenfreiheit ist das Ziel der modernen Kataraktchirurgie. Bereits seit den 80er des letzten Jahrhunderts werden deswegen immer häufiger multifokale Linsen eingesetzt. Die in dieser Studie quasi als „Kontrolllinse“ eingesetzte Array SA40N ist eine dreiteilige faltbare IOL aus Silikonelastomer. Der Gesamtdurchmesser beträgt 13 mm, das Optikdurchmesser 6 mm, die Angulation (Optik-Haptik-Winkel) misst 10°. Die Optik ist bikonvex mit glatter Rückfläche und welliger multizonaler Vorderfläche. Diese Vorderfläche besteht aus insgesamt 5 refraktiven Zonen unterschiedlicher Brechkraft mit fließenden asphärischen Übergängen (Abb. 6). Der zentrale Teil mit einem Durchmesser von 2 mm ist ferndominant. Die Zonen 2 und 4 sind nahdominant und beinhalten eine Addition von +3,5 dpt, um dem Patienten gutes Sehen im Nahbereich zu ermöglichen. Die Zone 3 und periphere Zone 5 sind wiederum als ferndominant konzipiert (Abb. 7). Die asphärischen Übergänge zwischen den Zonen erlauben außerdem das Sehen im intermediären Bereich. Dank dieses Designs ist die Array-IOL weitgehend unabhängig vom Pupillendurchmesser und vermag leichte Dezentrierungen zu kompensieren. Abb. 6 Array SA40N Abb. 7 Refraktionszonenverteilung der Array-IOL 29 3.6 Linsendesign Die ReZoom-IOL ist ebenfalls eine dreiteilige Linse mit einem optischen Teil aus Acrylpolymer der 2. Generation und zwei C-förmigen Haptiken aus PMMA. Die Maße sind identisch mit denen der Array SA40N (Optikdurchmesser 6 mm, Gesamtdurchmesser 13 mm). Der optische Teil besteht auch aus insgesamt 5 konzentrisch ringförmig angeordneten refraktiven Zonen mit asphärischen Übergängen (Abb. 8). Die Verteilung der Zonen mit großer zentraler ferndominanter Zone und einer Nahaddition von +3,5 dpt entspricht weitgehend derjenigen der Array-IOL. Gegenüber dem Vorgängermodell wurde die Brechkraft der Zone 4 um 55% reduziert und die von Zone 3 um 80% erhöht. Eine Besonderheit der ReZoom ist die sog. „Balanced View Optics“ - die Zonen sind laut Hersteller so proportioniert, dass ein guter Visus in unterschiedlichen Entfernungen bei unterschiedlichen Lichtverhältnissen erzielt wird. Der Optikrand im „OptiEdge“Design wurde ebenfalls neu konzipiert. Er weist eine scharfe hintere Kante zur Minimierung des Nachstar-Risikos, seitlich abgeschrägte Kante zur Verringerung der Reflexionen auf die Netzhaut und abgerundete Vorderkante zur Verminderung von Kantenspiegelungen auf (Abb. 9). Abb. 8 ReZoom Abb. 9 OptiEdge™ -Kantendesign 30 3.6 Linsendesign Die Lichtenergieverteilung ist variabel und hängt von der Pupillengröße ab. Bei hellen Lichtverhältnissen und enger Pupille mit 2 mm Durchmesser werden ca. 84% des Lichtes auf die ferndominante zentrale Zone verteilt. Bei wenig Licht und einer mittelweiten Pupille mit 5 mm Durchmesser entfallen ca. 60% des Lichts auf die ferndominanten Zonen und 40% auf die mittel- und nahdominanten Zonen. Das beiden Linsen gemeinsame dreiteilige Design mit faltbarer Optik und rigider PMMA-Haptik hat sich bereits als optimal bei monofokalen wie multifokalen IOL erwiesen. Es sorgt für gute Zentrierung auch dann, wenn eine Schädigung der Kapsel vorliegt. (Dick, H. B. et al., 1999) Sofern keine medizinischen Kontraindikationen einerseits und eine Einverständniserklärung des Patienten andererseits vorlagen, wurde nach objektiver und vorbehaltloser Aufklärung über Vor- und Nachteile der multifokalen IOL bilateral eine von beiden getesteten multifokalen Intraokularlinsen implantiert. Die Verteilung erfolgte per Zufall, die Patienten wurden nicht über den Typ der eingesetzten Linse informiert. 31 3.7 Linsenmaterial 3.7. Linsenmaterial Der „Klassiker“ unter den Linsenmaterialien - PMMA - gilt immer noch als „Goldstandard“ und steht heute in hoch gereinigter Form zur Verfügung. Der große Vorteil einer ausgezeichneten Biokompatibilität steht der Tatsache gegenüber, dass die Linsen aus diesem Material nicht faltbar sind, was immer eine große Inzision erfordert. Das führt zu einem hohen chirurgisch induzierten Astigmatismus und hat einen schlechteren postoperativen unkorrigierten Visus zur Folge. Bereits seit den 70er Jahren des vergangenen Jahrhunderts werden deswegen zunehmend Intraokularlinsen aus faltbarem Material eingesetzt. Der Vorteil dieser Linsen ist die Möglichkeit einer Implantation durch einen kleinen Schnitt von ca. 2 bis 3,5 mm Länge. Dies geschieht mit Hilfe von speziellem Instrumentarium (Falt- und Implantationspinzette) oder noch sicherer und bequemer mit einem von vielen Linsenherstellern angebotenen Injektor. Verwendete Grundstoffe können in 3 Gruppen eingeteilt werden: Silikonkautschuk, Acrylpolymer und Hydrogel. In dieser Studie wurden Intraokularlinsen aus Silikon und Acryl eingesetzt und miteinander verglichen. Die Optik der Array SA40N besteht aus einem SLM-2/UV Elastomer. Das ist ein modernes und in klinischem Alltag bewährtes Material, das sehr gute optische Eigenschaften (Transparenz, Brechungskoeffizient) mit gleichzeitig exzellenten mechanischen Charakteristiken (Faltbarkeit, Zug- und Reißfestigkeit) verbindet. Die beiden Haptiken bestehen aus monofilamentärem PMMA, was eine gute Fixation und Zentrierung der IOL im Kapselsack ermöglicht. Bei der ReZoom handelt es sich ebenfalls um eine dreistückige IOL. Die Optik besteht aus hydrophobem Acrylat der 2. Generation. Das Material der faltbaren Acryllinsen wird bei einer quervernetzenden Polymerisation von Acrylsäure und Methacrylsäure gewonnen. Die Quervernetzung verleiht dem Material dabei seine elastischen Eigenschaften und gibt die dreidimensionale Stabilität. Die Haptiken sind wie bei der SA40N aus monofilamentärem PMMA gefertigt. 32 3.8 Statistik 3.8. Statistik Für beide untersuchte Patientengruppen erfolgte die statistische Auswertung folgender Parameter: verwendeter Linsentyp, prä- und postoperative Sehschärfe, intraindividuelle Verbeserung der Sehschärfe durch Operation, Patientenalter und Geschlecht. Als statistischer Test auf Signifikanz der intraindividuellen Visusbesserung zwischen zwei untersuchten IOL-Modellen erfolgte der nichtparametrische Gruppenvergeich für verbundene Messreihen mittels Mann-Whitney und Wilcoxon Tests. Als Indikator für statistische Signifikanz wurde ein Wert von <0,05 interpretiert. Auf Grund des Entfallens eines Patienten (2 Augen) für postoperative Kontrollen wird durch die Verwendung von gültigen Häufigkeiten (%) im followup stets der Bezug auf das präoperative Kollektiv ermöglicht. Als deskriptive statistische Angaben wurden in der Regel das arithmetische Mittel, die Standardabweichung, der Median sowie das 1. und das 3. Quartil ermittelt. Das im Ergebnisteil oft verwandte Boxplot-Diagramm ist wie folgt aufgebaut: der „Kasten“ liegt zwischen dem 1. und 3. Quartil, der Median ist durch einen horizontalen Strich in diesem Kasten gekennzeichnet. Die „Schnurrhaare“ reichen nach oben und unten von maximalem bis zum minimalen ermittelten Wert. Die statistische Auswertung erfolgte mit Hilfe von Datenverarbeitungsprogramm SPSS (Statistical Package for the Social Sciences). Die Eingabe der Patientendaten sowie die Erstellung von Tabellen und Säulen- bzw. Boxplotdiagrammen erfolgte mit Hilfe von Microsoft Excel 2002 SP3, der Haupttext entstand mittels Microsoft Word 2002 SP3 für Windows XP. 33 4.1 Ergebnisse, Patientenkollektiv 4. Ergebnisse 4.1. Patientenkollektiv Insgesamt wurden in diese Studie 20 Patienten in einem Zeitraum von 12 Monaten eingeschlossen. Es wurden 40 Augen mit den multifokalen Intraokularlinsen der Firma AMO, Santa Ana, Ca, versorgt. Bei 6 Patienten (30%) wurde eine IOL vom Typ Array SA40N implantiert. Bei 14 (70%) Patienten wurde die IOL vom Typ ReZoom eingesetzt. Die präoperativen Daten konnten bei allen teilnehmenden Patienten erhoben werden. Für die statistische Auswertung der postoperativen Ergebnisse wurden die Daten der Kontrolluntersuchung nach Ablauf von 6 Monaten post operationem genommen. Die dahinter stehende Idee war, den Einfluss von eventuell auftretendem Nachstar auf das Sehvermögen und Lichtempfindlichkeit möglichst gering zu halten. Eine Patientin aus der ReZoom-Gruppe konnte auf Grund eines Herzinfarkts nicht zur geplanten postoperativen Untersuchung nach Ablauf von 6 Monaten erscheinen. Geschlechtsverteilung. Die Gruppe der Array-IOL mit 6 Teilnehmern bestand ausschließlich aus Frauen. Die ReZoom-Gruppe mit 14 Teilnehmern bestand zu jeweils 50% aus Männern und Frauen. Patientenalter Das Alter der Patienten in der Array-Gruppe lag zwischen 51 und 78 Jahren mit dem arithmetischen Mittelwert von 68,2 und dem Medianwert von 75 Jahren. Teilnehmer der ReZoom-Gruppe waren zwischen 63 und 86 Jahre alt. Der arithmetische Mittelwert beläuft sich dabei auf 75,6 und der Medianwert auf 76 Jahre. Bei einer Differenz der Medianwerte von nur 1 Jahr sind die Gruppen von ihrer Alterstruktur her durchaus vergleichbar. Linsenstärke Die verwendeten Array-IOL hatten eine Brechkraft von 19,5 bis 23,5 dpt mit dem Mittelwert von 21,3 dpt. Die ReZoom-IOL lagen im Mittel bei 21,0 dpt mit der Spannbreite zwischen 16,0 und 25,0 dpt. 34 4.2 Visusentwicklung 4.2. Visusentwicklung Bei allen Patienten wurde die Sehschärfe präoperativ und postoperativ für beide Augen einzeln und anschließend beidäugig für die Ferne und Nähe kontrolliert. Alle Visuskontrollen mit Ausnahme der 1. postoperativen Visite beinhalteten sowohl die Bestimmung der unkorrigierten als auch der korrigierten Sehschärfe nach vorausgegangener objektiver und subjektiver Refraktionsbestimmung. Der Fernvisus wurde mit einer speziellen Lesetafel, der sog. ETDRS-Chart Nr. 2 der Firma AMO, Santa Ana, Ca, in einer Entfernung von genau 4 Metern vom Patienten bei standardisierter Beleuchtung ermittelt. Zuerst wurde das rechte Auge, dann das linke Auge und zuletzt beide Augen gleichzeitig dem Test unterzogen. Für die Untersuchung des Nahvisus wurde eine 100% Lesetafel des CAT (Contrast Acuity Test nach Holladay) der Firma AMO, Santa Ana, Ca, verwendet. Die statistische Auswertung bezieht sich auf den unkorrigierten und korrigierten Fernvisus, sowie den unkorrigierten, fernkorrigierten und nahkorrigierten (damit ist die Fernkorrektur plus Nahaddition gemeint) Nahvisus. Zwecks Vereinfachung der Statistik erfolgte nur die Auswertung der Testergebnisse von einzelnen Augen ohne Seitenaufteilung und ohne Berücksichtigung der beidäugigen Sehschärfe. 4.2.1. Entwicklung des Fernvisus Tabelle Nr. 3 Anzahl der präoperativ gelesenen Buchstaben in der Ferne (ETDRSChart) Fernvisus Patientenzahl ETDRS-Mittelwert ETDRS-Minimum ETDRS-Maximum ETDRS-Median Array unkorrigiert 6 25,25 0 55 25,5 Array korrigiert 6 41,25 23 59 41 ReZoom unkorrigiert 14 26,94 0 54 23,5 ReZoom korrigiert 14 42,82 0 56 47 Zur Veranschaulichung der ermittelten Daten wurde der Anzahl von gelesenen Buchstaben, die bei ETDRS oder CAT-Test üblich ist, in die in Europa gebräuchliche logarithmische Visusstufen der Dezimalskala umgerechnet. Die folgende Tabelle zeigt den präoperativen Fernvisus der beiden Gruppen, jeweils mit und ohne Korrektur durch ein Brillenglas. 35 4.2 Visusentwicklung Tabelle Nr. 4 Präoperativer Visus in der Ferne in logarithmischen Dezimalstufen Fernvisus Mittelwert Median Standardabweichung Minimum Maximum Quantil Q1 25% 50% Quantil Q3 75% Array unkorrigiert 0,2 0,25 0,068 0,02 1,0 0,142 0,25 0,423 Array korrigiert 0,55 0,5 0,034 0,25 1,25 0,4 0,5 0,9 ReZoom unkorrigiert 0,26 0,22 0,048 0,02 1,0 0,16 0,22 0,474 ReZoom korrigiert 0,53 0,63 0,044 0,02 1,0 0,423 0,63 0,8 Vor der Operation betrug also der korrigierte Fernvisus der Array-Gruppe im Median 0,5 auf der Dezimalskala mit einer Streuungsbreite von 0,4 (25%-Quantil Q1) bis 0,9 (75%-Quantil Q3). Die ReZoom-Gruppe zeigte einen Medianwert von 0,63 mit einem Streuungsmaß von 0,423 (25%-Quantil Q1) bis 0,8 (75%-Quantil Q3). Folgende Tabellen zeigen die Ergebnisse der Visusprüfung 6 Mon. nach der Operation. Tabelle Nr. 5 Anzahl der postoperativ in der Ferne gelesenen Buchstaben (ETDRSChart). Fernvisus Patientenzahl ETDRS-Mittelwert ETDRS-Minimum ETDRS-Maximum ETDRS-Median Array unkorrigiert 6 53,17 42 59 54,5 Array Korrigiert 6 55,67 49 63 55 ReZoom unkorrigiert 13 46,46 21 61 49 ReZoom korrigiert 13 53,23 31 65 55 Tabelle Nr. 6 Postoperativer Fernvisus mit und ohne Korrektur (logarithmische Stufen). Fernvisus Mittelwert Median Standardabweichung Minimum Maximum Quantil Q1 25% 50% Quantil Q3 75% Array unkorrigiert 0,91 1,0 0,025 0,5 1,25 0,8 1,0 1,0 Array Korrigiert 1,062 1,0 0,275 0,8 1,6 0,8 1,0 1,25 ReZoom unkorrigiert 0,69 0,8 0,033 0,2 1,25 0,6 0,8 1,0 ReZoom korrigiert 0,925 1,0 0,028 0,32 1,6 0,8 1,0 1,06 36 4.2 Visusentwicklung Erwartungsgemäß kam es postoperativ zu einem deutlichen Anstieg der Sehschärfe. Die Array-Gruppe zeigte ohne Korrektur der Restfehlsichtigkeit einen Medianvisus von 1,0 mit einem Streuungsmaß von 0,8 (25%-Quantil Q1) bis 1,0 (75%-Quantil Q3), der arithmetische Mittelwert lag bei 0,91 mit einem Minimum von 0,5 und Maximum von 1,25. Der Medianvisus der ReZoom-Gruppe lag ohne Korrektur bei 0,8 mit einer Streuung zwischen 0,6 (25%-Quantil Q1) bis 1,0 (75%-Quantil Q3), der arithmetische Mittelwert lag bei 0,69, Minimum bei 0,2 und Maximum bei 1,25. Das folgende BoxplotDiagramm (Abb. 10) verdeutlicht noch mal die positive Entwicklung des unkorrigierten Fernvisus in beiden Gruppen. Visusentwicklung in der Ferne (ohne Korrektur) 1,4 1,2 Visus log. 1 0,8 0,6 0,4 0,2 0 Array präop. ReZoom präop. Array postop. ReZoom postp. Abb. 10 Entwicklung des unkorrigierten Fernvisus Der postoperativ ermittelte Fernvisus mit Korrektur der Restfehlsichtigkeit zeigte ein homogeneres Ergebnis mit einem Medianvisus von 1,0 in beiden Gruppen. Dabei lag das Streuungsmaß der Array-Gruppe zwischen 0,8 (25%-Quantil Q1) bis 1,25 (75%Quantil Q3) mit arithmetischem Mittelwert von 1,062, Minimum von 0,8 und Maximum von 1,6. Die Gruppe der mit ReZoom versorgten Patienten zeigte eine Streuung zwischen 0,8 (25%-Quantil Q1) bis 1,06 (75%-Quantil Q3), Mittelwert 0,925 mit Minimum von 0,32 und Maximum von 1,6. (Abb. 11) 37 4.2 Visusentwicklung Visusentwicklung in der Ferne (mit Korrektur) 1,8 1,6 1,4 Visus log. 1,2 1 0,8 0,6 0,4 0,2 0 Array präop. ReZoom präop. Array postop. ReZoom postp. Abb. 11 Entwicklung des korrigierten Fernvisus 4.2.2. Entwicklung des Nahvisus Für die Visusbestimmung in der Nähe (normaler Leseabstand, 40 cm) wurde der Contrast Acuity Test nach Holladay verwendet. Folgende Tabelle gibt einen Überblick über die präoperative Sehschärfe in der Nähe, bestimmt für beide Gruppen jeweils ohne Brillenkorrektur und mit optimaler Brillenkorrektur (Fernkorrektur mit Nahaddition). Tabelle Nr.7 Anzahl der gelesenen Buchstaben in der Nähe (CAT-Chart) präoperativ. Nahvisus Patientenzahl CAT-Mittelwert CAT-Minimum CAT-Maximum CAT-Median Array unkorrigiert 6 29,75 0 54 30 Array korrigiert 6 48,83 32 64 48 ReZoom unkorrigiert 14 28,96 0 50 31,5 ReZoom korrigiert 14 49,75 0 63 53 Ähnlich wie bei dem Fernvisus wurde auch hier eine Umrechnung der CATBuchstabenzahl in die gängige logarithmische Dezimalskala durchgeführt. 38 4.2 Visusentwicklung Tabelle Nr. 8 Präoperativer Nahvisus in logarithmischen Visusstufen Nahvisus Mittelwert Median Standardabweichung Minimum Maximum Quantil Q1 25% 50% Quantil Q3 75% Array unkorrigiert 0,142 0,16 0,059 0,02 0,5 0,084 0,16 0,356 Array korrigiert 0,384 0,4 0,031 0,16 0,8 0,32 0,4 0,474 ReZoom unkorrigiert 0,149 0,178 0,039 0,02 0,4 0,1 0,178 0,25 ReZoom korrigiert 0,395 0,5 0,04 0,02 0,8 0,32 0,5 0,63 Die Patienten der Array-Gruppe hatten vor der Operation also einen unkorrigierten Nahvisus im Median von 0,16 (Streuungsbreite von Q1=0,084 bis Q3=0,356) und einen Medianwert für entsprechend korrigierten Nahvisus von 0,4 (bei Q1=0,32 und Q3=0,474). Der präoperative Nahvisus von den Patienten aus der ReZoom-Gruppe lag unkorrigiert im Median bei 0,178 auf der Dezimalskala mit einem Streuungsmaß von Q1=0,1 und Q3=0,25. Mit der Brillenkorrektur wurde der Medianwert 0,5 bei Q1=0,32 und Q3=0,63 erreicht. Tabelle Nr. 9 Anzahl der postoperativ gelesenen Buchstaben in der Nähe (CAT-Chart) Array Nahvisus Patientenzahl CAT-Mittelwert CAT-Minimum CAT-Maximum CAT-Median unkorrigiert 6 51,83 43 64 52 Array fernkorrigiert 6 53,33 40 62 55 Array ReZoom nahkorrigiert 6 65,25 60 72 64 unkorrigiert 13 42,12 25 63 41,5 ReZoom ReZoom fernkorrigiert nahkorrigiert 13 13 46,77 60,16 40 46 62 75 45 60,5 Tabelle Nr. 10 Postoperativer Nahvisus in log. Visusstufen. Array Array Array ReZoom ReZoom ReZoom Nahvisus unkorrigiert fernkorrigiert nahkorrigiert unkorrigiert fernkorrigiert nahkorrigiert Mittelwert 0,44 0,47 0,81 0,29 0,352 0,65 Median 0,45 0,5 0,8 0,25 0,32 0,63 Standardabweichung 0,028 0,027 0,024 0,031 0,03 0,03 Minimum 0,32 0,25 0,63 0,125 0,2 0,32 Maximum 0,8 0,63 1,0 0,8 0,8 1,25 Quantil Q1 25% 0,32 0,4 0,67 0,238 0,25 0,5 50% 0,45 0,5 0,8 0,25 0,32 0,63 Quantil Q3 75% 0,6 0,63 1,0 0,4 0,42 0,8 39 4.2 Visusentwicklung Da es sich bei den eingesetzten IOL um sog. „multifokale“ Linsen handelt, was im Idealfall einem operierten Patienten das Lesen ohne Lesebrille ermöglichen soll, wurde der Nahvisus postoperativ unter 3 verschiedenen Bedingungen untersucht: ohne Brille, mit einer Fernbrille und dann mit einer Lesebrille. (Abb. 12) Entwicklung des Nahvisus mit und ohne Korrektur 1,4 1,2 Visus log. 1 0,8 0,6 0,4 0,2 NB NB it .m .m st op st op po po om y Re Zo ra Ar m R eZ oo ra Ar it it .m op st po po y po om Zo Re FB B .m st st op op .u .u op st po y ra Ar it F nk or nk it m p. äo pr m oo R eZ r. r. or NB NB it m p. äo pr y ra Ar Zo Re Ar ra om y pr pr äo äo p. p. un un ko r ko r r. r. 0 Abb. 12 Entwicklung der Nahsehschärfe. Hier wird deutlich, dass das postoperative Ergebnis in der Array-Gruppe etwas besser ausfiel. Der unkorrigierte Mediannahvisus betrug in der Array-Gruppe 0,4 (Q1=0,32 und Q3=0,6). Die ReZoom-Gruppe erreichte 0,25 (Q1=0,238 und Q3=0,4). Die Korrektur mit einer Fernbrille erhöhte den Medianvisus der Array-Patienten auf 0,5 (Q1=0,4 bis Q3=0,63), wobei die ReZoom-Gruppe auf einen Medianvisus von 0,32 (Q1=0,25 bis Q3=0,42) kam. Die besten Ergebnisse wurden mit einer Nahkorrektur (Fernkorrektur plus Nahaddition) erreicht. Die Array-Gruppe zeigte dabei einen Medianvisus von 0,8 (Q1=0,67 und Q3=1,0); bei der ReZoom-Gruppe wurde ein Medianvisus von 0,63 (Q1=0,5 und Q3=0,8) ermittelt. 40 4.3 Ergebnis, postoperative Brillenabhängigkeit 4.3 Postoperative Sehqualität und Abhängigkeit von einer Brille Die Verbesserung der Sehqualität stand im Zentrum dieser Studie. Die Patienten wurden daher ganz intensiv nach ihren Erfahrungen mit den neuen Linsen, ihrer Zufriedenheit und der Abhängigkeit von einer zusätzlichen Sehhilfe in Form einer Brille oder Kontaktlinse gefragt. Folgende Tabelle gibt eine Übersicht über Häufigkeit des postoperativen Brillentragens bei den Patienten beider Gruppen. Die Antworten wurden unterteilt in Kategorien nie, manchmal und immer. Tabelle Nr. 11 Wie oft tragen Sie eine Brille? Linsentyp Nie Manchmal Immer Gesamtzahl Array Häufigkeit (N) 0 6 0 6 Prozent (%) 0% 100% 0% 100% ReZoom Häufigkeit (N) 1 11 2 14 Prozent (%) 7,1% 78,6% 14,3% 100% Dabei stellte sich heraus, dass alle Teilnehmer der Array-Gruppe ihre Brille nur manchmal tragen, während in der ReZoom-Gruppe 1 Teilnehmer ganz auf eine Sehhilfe verzichten konnte und 2 Teilnehmer immer auf ihre Brille angewiesen waren. Ein Großteil der ReZoom-Patienten (ca. 79%) trägt eine Brille auch nur manchmal. Des Weiteren wurde auch die Art der getragenen Brille bei beiden Patientenkollektiven ermittelt. Zur Vereinfachung wurden nur 3 Kategorien untersucht. Die ersten zwei waren reine Fern- oder Lesebrille. Die dritte Kategorie beinhaltet alle Formen der „multifokalen“ Korrektur: Bifokalbrille, Trifokalbrille, Gleitsichtbrille sowie Fern- und Nahbrille wenn sie von einer Person abwechselnd getragen werden. Tabelle Nr. 12 Brillentyp postoperativ. Linsentyp nur Fernbrille nur Lesebrille Bifo/Gleitsicht keine Brille Gesamtzahl Array Häufigkeit (N) 0 4 2 0 6 Prozent (%) 0% 66,6% 33,4% 0% 100% ReZoom Häufigkeit (N) 0 8 5 1 14 Prozent (%) 0% 57,1% 35,8% 7,1% 100% 41 4.3 Ergebnis, postoperative Brillenabhängigkeit Brille Postoperativ 70% 67% 60% 57% Häufigkeit 50% 40% 36% Array Prozent (%) ReZoom Prozent (%) 33% 30% 20% 10% 7% 0% 0% 0% 0% nur Fernbrille nur Lesebrille Bifo/Gleitsicht keine Brille Brillentyp Abb. 13 Postoperativ getragene Brille Wie die o. a. Tabelle und Diagramm (s. Abb. 13) zeigen, konnten alle Teilnehmer der Array-Gruppe nach der Katarakt-Operation auf eine Fernbrille verzichten, was ja mit der ausgezeichneten Visus-entwicklung (Fernvisus im Median=1,0) sehr gut korreliert. Der einzige Patient in dieser Gruppe, der eine Bifokalbrille trägt, erreichte allerdings auch einen unkorrigierten Fernvisus von 1,11 mit 57 gelesenen Buchstaben auf beiden Augen und gab zu, die Brille nur beim Lesen zu tragen. Der korrigierte Fernvisus lag sogar rechts und links bei 63 Buchstaben der ETDRS-Tafel, was einer Sehschärfe von 1,43 auf der Dezimalskala entspricht. Der Besitzer einer PC-Brille wurde auch in der Kategorie Bifo/Gleitsicht gezählt. Die Brille wird aber nur manchmal beim Lesen getragen. Alle Teilnehmer dieser Gruppe haben nach der Operation ausnahmslos eine Nahsehhilfe in Form einer Lese- oder Bifokalbrille besessen. In der Gruppe der mit ReZoom-Linse versorgten Patienten trugen 57,1% eine Lesebrille, die restlichen 35,8% eine Bifokal- oder Gleitsichtbrille. Ein Patient (7,1%) konnte nach der Operation ganz auf eine Brille verzichten. Das postoperative Visusergebnis mit einem Median- Fernvisus ohne Korrektur von 0,8 und korrigiertem Visus von 1,0 erklärt einen etwas höheren Anteil der Bifokalbrillenträger in diesem Kollektiv. Gefragt nach Häufigkeit des Brillentragens antworteten mit „manchmal“ 11 Patienten (78,6%), „immer“ 2 Patienten (14,3%) und „nie“ 1 Patient (7,1%). 42 4.3 Ergebnis, postoperative Brillenabhängigkeit Ein möglicher Grund für einen insgesamt doch noch ziemlich hoch erscheinenden Anteil der Träger von Lesebrille ist die Tatsache, dass manche Menschen sich auf Grund einer Gewohnheit einer Lesebrille „verpflichtet“ fühlen. So gaben immerhin 10 Teilnehmer (50% des Studienkollektivs) an, auch ohne eine Lesebrille problemfrei oder mit geringen Einschränkungen (z. B. beim Lesen von kleingeschriebenen Medikamentenpackungsbeilagen) lesen zu können. Es ist denkbar, dass diese Patienten nach einer Umgewöhnungsphase den Brillengebrauch einstellen werden. 43 4.4 Analyse der photopischen Phänomene 4.4 Analyse der photopischen Phänomene Einer der Schwerpunkte dieser Studie war die Bestimmung von postoperativem Auftreten der sog. photopischen Phänomene, die bekanntermaßen ein Problem der Kataraktchirurgie und insbesondere der multifokalen Intraokularlinsen darstellen. Es wurden mit Hilfe von speziellen standardisierten Fragebögen und einer Bildertafel die Art, Häufigkeit und Intensität dieser Erscheinungen sowie die subjektive Beeinträchtigung der Patienten evaluiert (mehr dazu s. auch Kapitel 3.4.7.3). Die Patienten wurden zuerst gefragt „Haben Sie irgendwelche Schwierigkeiten beim Sehen mit dem operierten Auge?“. Als mögliche Antwort konnte hierbei der Patient aus einer Reihe von Sehstörungen wie Schwankungen der Sehschärfe, Doppelbilder, Gesichtsfeldeinschränkungen, Photophobie sowie den photopischen Phänomenen wie Halos, Blendungsempfindlichkeit und Strahlenkränzchen (mit Angabe des Schweregrades der Beeinträchtigung) wählen. Danach erfolgte eine gezielte Befragung nach den Erfahrungen des Patienten mit bestimmten visuellen Problemen wie Nächtliches Sehen, Glare/Flare (Probleme beim Erkennen der Straßenschilder bei hellem oder entgegenkommendem Licht), Halos (Lichtringe um Lichtquellen), Farberkennungsstörung, Störung des räumlichen Sehens, verzerrtes Nahsehen, verschwommenes Sehen in der Ferne und Nähe und Doppelsehen. Bei der Angabe des Schweregrades musste der Befragte jeweils einen Schweregrad angeben zwischen „keine Schwierigkeiten“, „mäßige Schwierigkeiten“ und „massive Schwierigkeiten“. Anschließend wurden die Teilnehmer aufgefordert ihren eigenen Seheindruck bei Nacht für den Untersucher sichtbar zu machen, indem sie ein oder ggf. mehrere Bilder von der Bildertafel aussuchten. Zusätzlich musste der Untersuchte seinen eigenen visuellen Eindruck mit dem ausgesuchten Bild vergleichen und ihn als kleiner, gleich oder größer als auf dem Bild einstufen. Diese Frage entfiel, wenn der Patient sich für das Bild Nr. 1 mit normalem nächtlichen Seheindruck entschieden hatte. Kategorien bei denen alle teilnehmenden Personen mit „nicht aufgetreten“ oder „keine Schwierigkeiten“ antworteten wurden nicht ausgewertet. 44 4.4 Analyse der photopischen Phänomene 4.4.1 Sehen bei Nacht (Night Vision) Als erstes wurden die Patienten gefragt, ob sie überhaupt Probleme beim Sehen nachts haben. Es stellte sich heraus, dass in der Gruppe der mit der Array-IOL versorgten Patienten kein einziger sich über solche Problematik beschweren konnte. In der ReZoomGruppe haben 8 Teilnehmer über keine Schwierigkeiten berichtet. Dagegen gaben 4 Patienten mäßige und 1 Patient sogar massive Schwierigkeiten bei Nacht an. Dieser Patient gab bei weiterer Befragung auch an, massiv durch Blendung, Halos und verschwommenes Sehen in der Ferne gestört zu sein. Tabelle Nr. 13 Sehen bei Nacht (Night Vision) Patientenzahl Keine Schwierigkeiten Mäßige Schwierigkeiten Massive Schwierigkeiten Array SA40N N=6 6 0 0 % 100 0 0 ReZoom N=13 8 4 1 % 61,5 30,8 7,7 Wie die vorhergehende Tabelle noch einmal verdeutlicht, war also die Array-Gruppe zu 100% mit ihrem nächtlichen Seheindruck insgesamt zufrieden und beschwerdefrei. Unter den Teilnehmern aus der ReZoom-Gruppe waren 61,5% frei von Schwierigkeiten, 30,8% berichteten über mäßige und 7,7% über massive Problematik. Das folgende Diagramm (Abb. 14) stellt die Verteilung der Antworten in beiden Gruppen grafisch dar. 100 90 80 %der Beteiligten 70 60 Keine Schwierigkeiten Mäßige Schwierigkeiten Massive Schwierigkeiten 50 40 30 20 10 0 Array n=6 ReZoom n=13 Abb. 14 Sehen bei Nacht (Night Vision) 45 4.4 Analyse der photopischen Phänomene 4.4.2. Blendeffekte Als nächstes erfolgte die Evaluierung der Beeinträchtigung durch sog. Blendeffekte und Lichtflimmern (Glare/Flare). Die Patienten mussten dabei auch den Schweregrad der Beeinträchtigung als unproblematisch, mäßig gestört und massiv gestört beurteilen. Tabelle Nr. 14 Blendeffekte (Glare/Flare) Patientenzahl Keine Beeinträchtigung Mäßige Beeinträchtigung Massive Beeinträchtigung Array N=6 6 0 0 % 100 0 0 ReZoom N=13 6 6 1 % 46,15 46,15 7,7 Bei diesem Punkt der Befragung gaben wieder alle 100% der Patienten aus der ArrayGruppe an, keine Schwierigkeiten zu haben. In der ReZoom-Gruppe waren 6 Patienten (46,15%) beschwerdefrei, andere 6 (46,15%) hatten mäßige und 1 Patient (7,7%) massive Schwierigkeiten durch Blendeffekte. (Abb. 15) 100 90 80 % der Beteiligten 70 60 Keine Schwierigkeiten Mäßige Schwierigkeiten Massive Schwierigkeiten 50 40 30 20 10 0 Array ReZoom Abb. 15 Blendeffekte 46 4.4 Analyse der photopischen Phänomene 4.4.3 Halos Lichtringe um die Lichtquelle (sog. Halos) stellen ein häufiges Problem der multifokalen Intraokularlinsen dar. Daher war es besonders interessant herauszufinden, ob es einen Unterschied zwischen den verwendeten Linsentypen gibt. Alle Patienten wurden nach ihren Erfahrungen mit Halos gefragt und mussten dabei den Grad der visuellen Beeinträchtigung als unproblematisch, mäßig oder schwer beschreiben. Folgende Tabelle zeigt die Verteilung der erhobenen Antworten. Tabelle Nr. 15 Beeinträchtigung durch Halos Patientenzahl Keine Mäßig Schwer Array N=6 4 2 0 % 66,7 33,3 0 ReZoom N=13 4 7 2 % 30,8 53,8 15,4 Demnach hatten 66,7% (n=4) der Array-Patienten keine Probleme mit Halos bemerkt. Über mäßige Beeinträchtigung berichteten 33,3% (n=2) und zu massiven Beschwerden kam es bei keinem Patienten. In der ReZoom-Gruppe waren es 30,8% (n=4) der Teilnehmer, die keine Probleme hatten. Weitere 53,8% (n=7) zeigten eine mäßige Ausprägung der Problematik und immerhin 15,4% (n=2) berichteten von einer massiven visuellen Beeinträchtigung durch Halos. (Abb. 16) 100 90 80 Teilnehmer in % 70 60 Keine Schwierigkeiten Mäßige Schwierigkeiten Massive Schwierigkeiten 50 40 30 20 10 0 Array ReZoom Abb. 16 Beeinträchtigung durch Halos 47 4.4 Analyse der photopischen Phänomene 4.4.4 Störungen der Farbwahrnehmung oder des Stereosehens In diesen Kategorien wurden von den teilnehmenden Patienten in beiden Gruppen keine Beeinträchtigungen der Farbwahrnehmung und des räumlichen Sehens angegeben. 4.4.5 Verzerrtes Sehen in der Nähe Keiner der Patienten aus beiden Gruppen konnte über verzerrtes Sehen im Nahbereich berichten. 4.4.6 Verschwommenes Sehen in der Nähe Hierzu wurden die Patienten gebeten über ihre Erfahrungen mit der Problematik des Verschwommensehens im Nahbereich und zwar mit oder ohne einer Brille, falls eine erforderlich, zu berichten. Tabelle Nr. 16 Verschwommenes Sehen in der Nähe Patientenzahl Keine Schwierigkeiten Mäßige Schwierigkeiten Massive Schwierigkeiten Array N=6 6 0 0 % 100 0 0 ReZoom N=13 12 1 0 % 92,3 7,7 0 Es hat sich gezeigt, dass keiner der Array-Patienten sich über solche Problematik beschweren konnte. Ein Patient (7,7%) aus der ReZoom-Gruppe gab eine mäßige Beeinträchtigung an. 4.4.7 Verschwommenes Sehen in der Ferne Ähnlich wie bei der vorherigen Frage mussten die Teilnehmer hierzu über Erfahrungen mit dem Problem des Verschwommensehens in der Ferne (falls erforderlich auch mit einer Fernbrille) berichten. Tabelle Nr. 17 Verschwommenes Sehen in der Ferne Patientenzahl Keine Schwierigkeiten Mäßige Schwierigkeiten Massive Schwierigkeiten Array N=6 6 0 0 % 100 0 0 ReZoom N=13 12 0 1 % 92,3 0 7,7 48 4.4 Analyse der photopischen Phänomene Die Array-Gruppe war in dieser Hinsicht absolut beschwerdefrei, ein Teilnehmer (7,7%) aus der ReZoom-Gruppe beschwerte sich über massive Störung. 4.4.8 Doppelsehen (Diplopie) Das Phänomen des Doppelsehens ist nur bei einem Patienten (7,7%) der ReZoomGruppe aufgetreten und wurde von ihm als mäßig störend empfunden. Alle Teilnehmer der Array-Gruppe waren beschwerdefrei. Tabelle Nr. 18 Doppelsehen Patientenzahl Keine Beeinträchtigung Mäßige Beeinträchtigung Massive Beeinträchtigung Array N=6 6 0 0 % 100 0 0 ReZoom N=13 12 1 0 % 92,3 7,7 0 4.4.9 Photophobie (Lichtscheu) Das Vorliegen der Photophobie als eine Extremform der erhöhten Lichtempfindlichkeit wurde von allen Patienten der Array-Gruppe verneint. Dagegen gaben 3 von den 13 Studienteilnehmern (23,1%), die mit einem ReZoom-Implantat versorgt wurden an, unter Lichtscheue zu leiden. Dies ist kein überraschendes Ergebnis und korreliert gut mit dem höheren Prozentsatz der Beschwerden bei nächtlichem Sehen, Auftreten von Halos und Blendungseffekten in dieser Patientengruppe. 4.4.10 Auswertung der Lichtsensationen anhand der Bildertafel In diesem Teil der Untersuchung wurde den Patienten, die bei vorhergehender Befragung das Auftreten von Lichtphänomenen in Form von z.B. Blendung (Glare/Flare) oder Halos mit einer Intensität von „leicht“ bis „schwer“ angegeben haben, eine Bildertafel mit insgesamt 6 Aufnahmen eines entgegenkommenden Fahrzeugs unter nächtlichen Bedingungen gezeigt. Das erste Bild entsprach einem normalen Seheindruck, jedes weitere Bild zeigte ein anderes Lichtphänomen. Die genaue Zuordnung der einzelnen Bilder zu den photopischen Phänomenen wurde bereits im Kapitel 3.4 erwähnt. Die Untersuchten mussten ein Bild auswählen, das ihrem eigenen nächtlichen Seheindruck am ehesten entsprach. Zusätzlich wurden sie gebeten zu beurteilen, ob die Größe 49 4.4 Analyse der photopischen Phänomene oder Intensität des subjektiv empfundenen Lichtphänomens kleiner, größer oder gleich mit dem abgebildeten ist. Die Verteilung der Antworten demonstriert folgende Tabelle. Tabelle Nr.19 Analyse der photopischen Phänomene anhand der Bildertafel. Patientenzahl Normal Halo Farbringe (Double Halo) Strahlenkränzchen (Starburst) Blendeffekt (Starburst+Halo) Starker Blendeffekt Array N=6 1 4 1 1 0 0 % 16,7 66,7 16,7 16,7 0 0 ReZoom N=13 1 4 4 3 2 0 % 7,7 30,77 30,77 23,08 15,38 0 Etwas irritierend ist die Summe der Prozentzahlen von mehr als 100% in beiden Gruppen. Sie kommt dadurch zustande, dass zwei Patienten (je einer pro Gruppe) das Auftreten von zwei verschiedenen Lichtphänomenen z.B. Halos und Farbringen (Array, abhängig von der Entfernung zum Objekt) oder Halos und Strahlenkränzchen (ReZoom, gleichzeitig) angegeben hat. Das Säulendiagramm dazu (Abb. 17) zeigt folgendes Bild: 100 90 80 % der Patienten 70 60 Array % ReZoom % 50 40 30 20 10 0 Normal Halo Farbringe Strahlenkränzchen Blendeffekt Starker Blendeffekt Abb. 17 Evaluation der photopischen Phänomene anhand von Bildmaterial 50 4.4 Analyse der photopischen Phänomene Bei der Befragung nach der Größe und Intensität des eigenen Seheindrucks im Vergleich mit dem vorgehaltenen Bild ergab sich folgende Verteilung der Antworten: Tabelle Nr. 20 Vergleich des eigenen Seheindrucks mit dem Bildmaterial Größe des Seheindrucks Array Häufigkeit N ReZoom Häufigkeit N Vergleichbar mit dem Bild 5 6 Kleiner als das Bild 1 0 Größer als das Bild 0 7 Patienten Insgesamt 6 13 Wie man der Tabelle entnehmen kann, war der subjektiv wahrgenommne Seheindruck in der Array-Gruppe bei immerhin 5 (83,3%) Patienten gleich groß und bei einem Patienten sogar kleiner als auf dem Bild. Unter den ReZoom-Patienten fanden 6 Personen (46,2%), dass das Bild genau dem eigenen Seheindruck entspricht und dagegen 7 Patienten (53,8%) meinten subjektiv eher größere/intensivere Lichteffekte wahrzunehmen. 51 4.5 Zufriedenheit mit der Multifokallinse 4.5 Zufriedenheit mit der Multifokallinse Im Anschluss an die Untersuchung wurde eine Befragung der Studienteilnehmer bezüglich ihrer Zufriedenheit mit der eingesetzten Multifokallinse durchgeführt. Die Patienten wurden gebeten ihre Zufriedenheit als „Sehr zufrieden“, „Recht zufrieden“ oder „Nicht zufrieden“ zu bezeichnen. Die Antworten verteilten sich wie folgt: alle 100% der Patienten aus der Array-Gruppe zeigten sich mit der Implantierten MIOL sehr zufrieden. Die Verteilung in der ReZoomGruppe war nicht so homogen ausgefallen. Ein Großteil der Patienten war ebenfalls mit der eingesetzten Linse sehr zufrieden (76,9%, n=10 von 13 Teilnehmer), 2 Patienten zeigten sich mit der MIOL recht zufrieden (15,4%) und nur ein Patient (7,7%) äußerte sich als nicht zufrieden auf Grund von subjektiver Störung durch Blendeffekte (Glare/Flare). (Abb. 18) 100 100 90 80 76,9 Teilnehmer in % 70 60 Array ReZoom 50 40 30 20 15,4 7,7 10 0 0 0 Nicht zufrieden Recht zufrieden Sehr zufrieden Abb. 18 Zufriedenheit mit der MIOL Des Weiteren wurden die Patienten mit der Frage „Würden Sie nach Ihrer Erfahrung, bei einer bevorstehender Kataraktoperation sich erneut für eine Multifokallinse entscheiden?“ konfrontiert. In der Array-Gruppe haben alle 6 Patienten (100%) diese Frage mit „Ja“ beantwortet. Von den mit ReZoom versorgten Patienten antworteten 11 von 13 mit „Ja“ (84,6%) und 2 mit „Nein“ (15,4%). Der Grund für eine Entscheidung gegen die Multifokallinse waren bei einem Patienten die Halos und bei dem zweiten erhöhte Blendungsempfindlichkeit (Glare/Flare). 52 5. Diskussion 5. Diskussion 5.1 Demographische Daten Die Studienteilnehmer entstammten dem regulären Patientengut der Universitätsaugenklinik und wurden unter Beachtung strenger medizinischer Ein- und Ausschlusskriterien ausgesucht. Als wichtiges Ausschlusskriterium wurde eine Altersgrenze von mindestens 18 Jahren festgelegt, jedoch lag erwartungsgemäß das mittlere Alter deutlich darüber. In Bezug auf das Durchschnittsalter zeigte sich folgende Verteilung: die Patienten der Array-Gruppe waren im Schnitt 68,2 Jahre alt mit einer Streubreite zwischen 51 und 78 Jahren. Die ReZoom-Gruppe bestand aus Personen zwischen 63 und 86 Jahren mit einem durchschnittlichen Alter von 75,6 Jahren. Vergleicht man die Medianwerte so ergeben sich Werte von 75 Jahren in der Array-Gruppe und 76 Jahren in der ReZoom-Gruppe. Eine gleichartige Untersuchung an mit einer Multifokallinse versorgten Kataraktpatienten von Auffarth et al. präsentierte ein deutlich niedrigeres durchschnittliches Alter von Array-Patienten von 54,7 Jahren (24 – 76 J.) und ReZoom-Patienten von 54,3 Jahren (20 – 76 J.). Eine andere groß angelegte Studie zur Kataraktchirurgie in Deutschland mit insgesamt 1292 Eingriffen zeigte ein medianes Alter von 75 Jahren (Krummenauer et al., 2006), was ziemlich genau dem eigenen Ergebnis entspricht. Ein hohes Patientenalter an sich war auch kein Ausschlusskriterium. Sofern keine weiteren Ausschlusskriterien bestanden, wurden alle untersuchten Patienten auf die Teilnahme in der Studie angesprochen. Das Geschlechterverhältnis weiblich zu männlich gestaltete sich folgendermaßen: in der Array-Gruppe waren 100% der Teilnehmer weiblich (n=6). In der ReZoom-Gruppe bestand ein Verhältnis von 1:1 (n=14). Nimmt man das gesamte Patientenkollektiv, so ergibt sich ein Anteil der weiblichen Patienten von 65%. Dieses Ergebnis ist keinesfalls verwunderlich. Die mittlere Lebenserwartung der Frauen ist bekanntermaßen höher als die der Männer, somit steigt auch die Wahrscheinlichkeit mit fortschreitendem Alter von der häufigsten Form des Grauen Star - der Cataracta senilis - betroffen zu werden. Die eigenen Resultate korrelieren in diesem Punkt sehr gut mit den Angaben in den Literaturquellen. So berichtet Krummenauer in der bereits erwähnten Benchmarkstudie zur ambulanten Kataraktchirurgie in Deutschland über 53 5. Diskussion 62% weibliche Patienten. Lewallen et al. fanden 63%, Behrens-Baumann et al. 62% Frauen in regulärem Patientenkollektiv mit geplanter Kataraktextraktion. Eine retrospektive Analyse der kataraktoperierten schwedischen Bevölkerung aus dem Jahre 1999 von Lundstrom et al. zeigte einen Anteil von Frauen von 66,8%. (Behrens-Baumann, W., 2004, Lewallen, S. et al., 2002, Lundstrom, M. et al., 1999) 5.2 Funktionelle Aspekte/Visusentwicklung Das Ziel der modernen Kataraktchirurgie ist nicht mehr nur die einfache Beseitigung von Trübungen der Linse. Vielmehr strebt man neben der Wiederherstellung von klaren optischen Medien eine nahezu ideale Korrektur aller, auch bereits präoperativ vorhandenen Fehlsichtigkeiten an. Die multifokalen Intraokularlinsen erlauben ein gutes Sehen im Fern-, Zwischen- und Nahbereich, was dem operierten Patienten in vielen Fällen ein weitgehend brillenfreies Leben ermöglicht. (Javitt, J. C. et al., 2000, Sen, H. N. et al., 2004, Steinert, R. F. et al., 1999) Eine unabdingbare Voraussetzung dafür ist die sorgfältige Operationsplanung hinsichtlich der Wahl einer richtigen IOL. So wurden immer präzisere Geräte zur Messung der biometrischen Parameter wie Hornhautradien und Achsenlänge des Augapfels entwickelt. Der bei der OP-Vorbereitung im Rahmen dieser Studie eingesetzte IOLMaster der Fa. Zeiss erlaubt eine im Vergleich zum konventionellen Ultraschall mehr als 10-mal genauere und zudem untersucherunabhängige, gut reproduzierbare Messung der Bulbuslänge, was zu deutlicher Besserung von der Vorhersagbarkeit postoperativer Refraktion führt. Dies wurde mittlerweile von zahlreichen klinischen Studien (Olson, R. J. et al., 2002, Rajan, M. S. et al., 2002, Drexler, W. et al., 1998, Findl, O. et al., 2001) nachgewiesen. Die Sehschärfe der Studienteilnehmer wurde prä- sowie mehrmals postoperativ mit und ohne Brillenkorrektur in der Ferne und in der Nähe kontrolliert. Obwohl der Nachbeobachtungszeitraum sich auf ein Jahr postoperativ erstreckte, haben wir uns auf die Ergebnisse der Kontrolle 6 Monate nach der Operation des zweiten Auges konzentriert. Damit war einerseits die stabile postoperative Refraktion garantiert, und eine von einigen Patienten benötigte Eingewöhnungszeit berücksichtigt. Andererseits konnte dadurch die Visusminderung bzw. Induktion von photopischen Phänomenen durch eine Trübung der hinteren Linsenkapsel (Nachstar, Cataracta secundaria) ausgeschlossen werden. 54 5. Diskussion Präoperativ hatten die Patienten der Array-Gruppe im Median einen unkorrigierten Fernvisus von 25,5 ETDRS-Buchstaben (entspr. 0,25 log. Stufen oder Snellen 20/80). Die ReZoom-Gruppe erreichte 23,5 ETDRS-Buchstaben (log. 0,22; Snellen 20/100). Sechs Monate nach Kataraktoperation mit bilateraler Implantation einer MIOL betrug der unkorrigierte Fernvisus in der Array-Gruppe im Median 54,5 ETDRS-Buchstaben (log. 1,0; Snellen 20/20) und in der ReZoom-Gruppe 49 ETDRS-Buchstaben (log. 0,8; Snellen 20/25). Eine statistische Signifikanz im Vergleich der intraindividuellen Visubesserung zwischen beiden Gruppen konnte nicht nachgewiesen werden (pWert=0,138). Die korrigierte präoperative Sehschärfe in der Ferne lag im Median in der ArrayGruppe bei 41 ETDRS-Buchstaben (log. 0,5; Snellen 20/40) und in der ReZoomGruppe bei 47 ETDRS-Buchstaben (log. 0,63; Snellen 20/32). Bei der postoperativen Untersuchung der korrigierten Sehschärfe wurden folgende Medianwerte ermittelt: Array-Gruppe 55 ETDRS-Buchstaben (log. 1,0; Snellen 20/20), ReZoom-Gruppe 55 ETDRS-Buchstaben (log. 1,0; Snellen 20/20). In der Nähe wurden präoperativ der unkorrigierte und der mit der Lesebrille korrigierte Visus untersucht. Die Patienten der Array-Gruppe kamen dabei auf eine unkorrigierte Sehschärfe im Median von 30 CAT-Buchstaben (log. 0,16; Snellen 20/126), mit Korrektur wurden 48 CAT-Buchstaben gelesen (log. 0,4; Snellen 20/50). Die ReZoomGruppe erreichte unkorrigiert im Median 31,5 (log. 0,178; Snellen 20/115) und korrigiert 53 CAT-Buchstaben (log. 0,5; Snellen 20/40). Die Besonderheit der postoperativen Kontrolle bestand darin, dass hierbei die unkorrigierte, die fernkorrigierte und die nahkorrigierte (Fernkorrektur mit Nahaddition) Sehschärfe ermittelt wurden. Die Array-Patienten hatten im Median einen unkorrigierten Nahvisus von 52 CAT-Buchstaben (log. 0,45; Snellen 20/44), mit Fernkorrektur 55 CAT-Buchstaben (log. 0,5; Snellen 20/40) und mit Nahkorrektur 64 CAT-Buchstaben (log. 0,8; Snellen 20/25). Das Kollektiv der ReZoom-Gruppe las postoperativ im Median ohne Korrektur 41,5 CAT-Buchstaben (log. 0,25; Snellen 20/73), mit Fernkorrektur 45 CAT-Buchstaben (log. 0,32; Snellen 20/63) und mit Nahkorrektur 60,5 CATBuchstaben (log. 0,63; Snellen 20/32). Vergleicht man die intraindividuelle Änderung des nicht korrigierten Nahvisus durch die Kataraktoperation mittels nichtparametrischer Tests, so zeigt sich mit einem p-Wert=0,130 kein statistisch signifikanter Unterschied zwischen beiden untersuchten Gruppen. 55 5. Diskussion Die guten eigenen Ergebnisse korrelieren ausgezeichnet mit einer Vielzahl an bisher in der ophthalmologischen Fachliteratur veröffentlichter Studien anderer Arbeitsgruppen und sind das Resultat sowohl einer ständigen Weiterentwicklung auf dem Gebiet der multifokalen IOL-Optik als auch einer strengen Patientenselektion. Bekanntermaßen eignet sich nicht jeder Kataraktpatient für die Implantation einer multifokalen Intraokularlinse. So wurde bereits bei der Rekrutierung der Studienteilnehmer ein großer Wert darauf gelegt, alle mögliche sehmindernden Augenerkrankungen außer Katarakt wie z.B. Hornhautnarben, hochgradiger Hornhautastigmatismus, Affektionen des Sehnerven sowie degenerative Netzhauterkrankungen wie z.B. alterbedingte Makuladegeneration auszuschließen. Ein weiteres wichtiges Kriterium war eine geforderte Mindestsehschärfe am Retinometer von 0,7, um starke Visusabweichungen von vorneherein zu vermeiden. Aus einer Studie von Steinert et al. aus dem Jahr 1992 geht hervor, dass bereits die frühen Modelle der multizonal-progressiven MIOL zu guten funktionellen Visusergebnissen im Nahbereich führten. Der unkorrigierte Nahvisus betrug im Schnitt 0,67 versus 0,33 mit monofokalen IOL. Fernkorrigiert war der Nahvisus 0,8 versus 0,5 und mit Nahkorrektur erreichten alle Patienten 1,0. Doppelt so viele Patienten (52% gegen 25%) in der MIOL-Gruppe konnten postoperativ bei allen Tätigkeiten auf das Tragen einer Brille verzichten. (Steinert, R. F. et al., 1992) Eine Untersuchung der AMO Array-IOL von Jacobi und Konen (Jacobi, P. C., Konen, W., 1995) zeigte einen durchschnittlichen unkorrigierten Fernvisus von 0,56 (Snellen 20/32) und 0,54 (Snellen 20/40) in der Nähe. Der fernkorrigierte Nahvisus betrug 0,72 (20/25) und stieg mit Nahaddition auf 0,89 (20/22). Es fällt auf, dass die eigenen Ergebnisse beim unkorrigierten Fernvisus deutlich besser ausfielen, während der unkorrigierte Nahvisus hinter den Werten von Jacobi et al. blieb. Die Ursache dieser Differenzen liegt offensichtlich im Durchschnittsalter der Patienten. Die eigenen Patienten waren im Schnitt mit 68,2 Jahren (Array) und 75,6 Jahren (ReZoom) deutlich älter als die von Jacobi et al. untersuchten (Durchschnittsalter 60,8 J.). Zudem konnte Jacobi eindeutig nachweisen, dass die maximale erreichbare Nahsehschärfe für jüngere Patienten (46+/-6 J.) um zwei gelesene Zahlenreihen besser war als die von den älteren (71+/-7 J.), was auch in einer höheren subjektiven Zufriedenheit der jüngeren Patienten mit der MIOL resultierte. In einer prospektiven Studie kontrollierten Steinert et al. ein Jahr nach Implantation die Effektivität einer Array-MIOL im Vergleich mit einer Monofokallinse und kamen zu 56 5. Diskussion folgenden Resultaten. Die unkorrigierte Sehschärfe in der Ferne lag in der Multifokalgruppe bei 0,63 (20/32), in der Monofokalgruppe bei 0,67 (20/30) und stieg bei multifokalen IOL mit Korrektur auf 0,8 (20/25) an. Die unkorrigierte Nahsehschärfe betrug 0,63 (20/33) bei Augen mit MIOL und 0,37 (20/54) bei Augen mit monofokaler IOL. Der Unterschied betrug durchschnittlich 2 Linien im Snellenäquivalent und war statistisch signifikant (p<0,0001). Auch die fernkorrigierte Nahsehschärfe war bei multifokalen IOL um 2 Reihen besser, und die Differenz blieb signifikant. (Steinert, R. F. et al., 1999) Liekfeld et al. verglichen diffraktive und refraktive MIOL. Im Fernbereich wurde kein signifikanter Unterschied festgestellt bei einem durchschnittlichen unkorrigierten Visus mit diffraktiver IOL von 0,8 und mit refraktiver MIOL von 0,75. Der unkorrigierte Nahvisus mit diffraktiver IOL lag bei 0,9 und mit der refraktiven IOL bei 0,48. Die Differenz zu Gunsten der diffraktiven IOL erreichte statistische Signifikanz. (Liekfeld et al., 1998) Eine Untersuchung der Visusbesserung durch diffraktive IOL (Pharmacia 811E) von Avitabile et al. zeigte ebenfalls gute Resultate. Der unkorrigierte Fernvisus war durchschnittlich 0,79 und nahezu alle Patienten (97%) erreichten einen unkorrigierten Nahvisus von 0,67 oder besser. (Avitabile, T. et al., 1999) Dieser in der Literatur oft beschriebenen Tatsache, dass diffraktive IOL einen besseren unkorrigierten Nahvisus als multifokale IOL erlauben, steht ein Nachteil der größeren Einbußen im Bereich der Kontrastempfindlichkeit gegenüber. (Walkow, T. et al., 1997, Olsen, T. et al., 1990, WintherNielsen, A. et al., 1993, Pieh, S. et al., 1998) Die Hypothese eines altersabhängigen Visusergebnisses nach Implantation einer Multifokallinse wird auch durch eine Arbeit von Dick und Marx-Gross unterstützt. So berichten sie über einen durchschnittlichen unkorrigierten Nahvisus von 0,8 in einem jungen Kollektiv von 25 Patienten, bei denen bilateral eine Array SA40N im Rahmen eines refraktiven Linsenaustauschs eingesetzt wurde. (Dick, H. B., Marx-Gross, S., 2004) Lee et al. untersuchten 2005 retrospektiv die Ergebnisse nach Implantation einer Array SA40N in 188 Augen von 163 Patienten in Abhängigkeit von der postoperativen Refraktion. Es stellte sich heraus, dass die besten Resultate in der Gruppe mit emmetropen Augen (+/-0,5 dpt) zu finden waren. Der beste unkorrigierte Fernvisus betrug durchschnittlich 0,74+/-0,2 und der beste unkorrigierte Nahvisus 0,68+/-0,08. (Lee, E. S. et al, 2005) 57 5. Diskussion Eine Untersuchung der ersten Erfahrungen mit der ReZoom-IOL von Hettlich und AlSarrage 2006 zeigte, dass ein Großteil der Patienten einen guten unkorrigierten Fernvisus mit einem Mittelwert von 0,69 und ausreichende unkorrigierte Sehschärfe von durchschnittlich 0,55 im Nahbereich aufwies. (Hettlich, H. J., Al-Sarrage, H., 2006) Limberger et al. berichteten 2006 nach einem Vergleich von Array SA40N und ReZoom bei 17 Patienten über folgende Ergebnisse. In der Array-Gruppe lag das Durchschnittsalter bei 54,72 Jahren. Der postoperative Fernvisus betrug unkorrigiert 0,84 und mit einer Korrektur 1,02. Der unkorrigierte Nahvisus war 0,48 +/-0,2 und stieg nach 2 Jahren auf 0,52+/-0,2 an. In der ReZoom-Gruppe betrug das Durchschnittsalter 54,3Jahre. Der postoperative Fernvisus ohne Korrektur lag bei 0,74 und mit einer Korrektur bei 0,94. Der unkorrigierte Nahvisus war 0,41+/- 0,14 und stieg nach 1 bis 2 Jahren auf 0,67+/-0,17 an. Bezüglich des Fernvisus ergeben sich also keine signifikanten Unterschiede im Vergleich zu unseren Ergebnissen. Lediglich der unkorrigierte Nahvisus der ReZoom-Gruppe war in der Studie von Limberger et al. besser mit 0,41 log. versus 0,29 (Mittelwert) hier. Eine naheliegende und plausible Erklärung scheint auch hier die Alterdifferenz zwischen den untersuchten Kollektiven zu sein (54,3 J. vs. 75,6 J.). Interessant erscheint auch der von Limberger festgestellte Anstieg des unkorrigierten Nahvisus in der ReZoom-Gruppe nach Ablauf von 1 bis 2 Jahren und damit im Endeffekt ein besserer funktioneller Erfolg im Vergleich zur herkömmlichen Array-IOL. Alle oben genannten klinischen Studien bestätigen gute eigene Visusergebnisse und übertreffen manchmal diese sogar insbesondere in Bezug auf den unkorrigierten Nahvisus. Das bewährte Funktionsprinzip einer multizonal-progressiven Linsenoptik ermöglicht eine gute Sehschärfe im Fern-, Intermediär- und Nahbereich, was eine größere Unabhängigkeit von einer Brille und damit eine Steigerung der Lebensqualität und der Patientenzufriedenheit bedeutet. Im Unterschied zur klassischen monofokalen IOL erlaubt eine multifokale IOL einem deutlich größeren Teil der Patienten ein komplett brillenfreies Leben. So konnten 32% der Multifokallinsenträger auf ihre Brille in allen Lebenssituationen verzichten im Gegensatz zu 8% der Monofokallinsenträger. (Javitt, J. C., Steinert, R. F., 2000) Im Rahmen dieser Studie konnte kein statistisch signifikanter Unterschied hinsichtlich der postoperativen Sehschärfe zwischen Array SA40N und ReZoom festgestellt werden. Eine mögliche Erklärung dafür mag die gleiche Funktionsweise der multizonalprogressiven Optik beider MIOL-Modelle und über Jahre ausgereiftes Design der Array-IOL sein. Andererseits liegt die Vermutung nahe, dass die erwartete Besserung auf 58 5. Diskussion Grund des höheren Durchschnittsalters der ReZoom-Patienten in unserem Studienkollektiv (vergl. Limberger et al.) ausgeblieben ist. Auf jeden Fall zeigte die neue ReZoom-IOL sehr gute funktionelle Resultate und wird wohl auch nicht zuletzt wegen der besseren Materialeigenschaften hinsichtlich der Linsenkapselfibrose und der Möglichkeit einer späteren Hinterabschnittschirurgie mit Silikonöl zu einem festen Bestandteil im Repertoire der Ophthalmochirurgen werden. 5.3 Evaluation der photopischen Phänomene Der Begriff „Photopische Phänomene“ beinhaltet eine Vielzahl an Blendeffekten, die die subjektive visuelle Wahrnehmung des Individuums beeinflussen. Ursächlich kommen natürliche Gegebenheiten des gesunden menschlichen Auges sowohl anatomischer (optische Aberrationen der Lens crystallina und der Hornhaut) wie auch physiologischer Natur (Pupillenlichtreaktion, retinale Lichtadaptation) in Frage. Zusätzlich können pathologische Veränderungen der brechenden optischen Medien wie Astigmatismus, Hornhautnarben, Grauer Star, Trübungen des Glaskörpers oder Netzhauterkrankungen (z.B. epiretinale Gliose, Makuladegeneration) zu einer erhöhten Blendempfindlichkeit führen. Einer der Schwerpunkte dieser Arbeit ist die Analyse von sogenannten „pseudophaken photopischen Phänomenen“. Als „pseudophake photopische Phänomene“ (engl. pseudophakic photic phenomena, PPP) wird eine ganze Reihe von unerwünschten Lichteffekten bezeichnet, die nach der Implantation einer Intraokularlinse auftreten können. Einige der möglichen Quellen für die Entstehung der PPP sind bekannt. Dazu zählen ovale Linsenform, kleiner Optikdurchmesser, hoher Brechungskoeffizient des Linsenmaterials, Positionslöcher der älteren IOL-Modelle, scharfkantiges Design des Optikrandes „Square Edge Design Lenses“ (Ellis, M. F., 2001). Es ist auch allgemein bekannt, dass multifokale Intraokularlinsen oft zu einer Herabsetzung der Kontrastempfindlichkeit und verstärkten Wahrnehmung von störenden Blendeffekten führen können. Zusätzlich können IOL-Dezentrierung und Trübung der Linsenkapsel zum Auftreten neuer oder Verstärkung vorbestehender Lichtphänomene führen. (Häring et al., Dick, H. B., Gills, J. P., Arnold, P. N.) Die subjektive Beeinträchtigung der Patienten durch PPP kann in Ausnahmefällen sogar zu der Explantation einer MIOL zwingen. (Mamalis, N., 2000, Ellingson, F. T., 1990) 59 5. Diskussion Die Evaluation erfolgte mittels speziell entwickelter Fragebögen im Rahmen der postoperativen Kontrollen. Folgende Varianten von Beeinträchtigung durch Lichtphänomene wurden untersucht: Störungen des Dämmerungs-/Nachtsehens (Night Vision), Blendeffekte (Glare/Flare), Halos, verschwommenes Sehen in Ferne und/oder Nähe, Diplopie und Photophobie. Im Falle einer positiven Antwort musste auch die Schwere der Beeinträchtigung als mäßig oder massiv beurteilt werden. Da kein Studienteilnehmer über Verzerrtsehen sowie Störungen der Farbwahrnehmung oder der Stereopsis berichtete, wurden diese Kategorien nicht analysiert. In der Kategorie Störung des Dämmerung-/Nachtsehens gab es folgende Ergebnisse: Array SA40N: 100% der Patienten gaben keine Störung an. ReZoom: 61,5% der Patienten waren absolut beschwerdefrei, 30,8% hatten eine mäßige und 7,7% eine massive Störung angegeben. Bei den Blendeffekten (Glare/Flare) zeigte sich folgende Verteilung: wieder waren alle 100% der Array-Patienten absolut beschwerdefrei. In der ReZoom-Gruppe hatten 46,2% keine Beschwerden, genauso viele Teilnehmer berichteten über mäßige, und restliche 7,7% über massive Störungen. Die Beeinträchtigung durch Halos wurde von 33,3% der Array-Patienten festgestellt und als mäßig empfunden, restliche 66,7% kannten das Problem nicht. Von den ReZoom-Patienten waren 30,8% in dieser Kategorie beschwerdefrei, 53,8% gaben mäßige und 15,4% massive Probleme an. Das Verschwommensehen in Ferne und Nähe wurde von keinem Patienten der ArrayGruppe berichtet. Ein Patient der ReZoom-Gruppe (7,7%) gab an, unter mäßigem Verschwommensehen in der Nähe und massivem Verschwommensehen in der Ferne zu leiden. Das Doppeltsehen wurde von allen Array-Patienten verneint, ein ReZoom-Patient berichtete von mäßigen Schwierigkeiten. Die Photophobie war in der Array-Gruppe nie aufgetreten, dagegen berichteten drei der ReZoom-Patienten (23,1%) über eine Erfahrung mit dieser Extremform von Lichtempfindlichkeit. Die Evaluierung von Lichtphänomenen mittels einer farbigen Bildertafel mit sechs Motiven eines in der Nacht entgegenkommenden Fahrzeugs zeigte folgende Verteilung: 60 5. Diskussion Seheindruck Patientenzahl Normal Lichthof (Halo) Farbringe (Double Halo) Strahlenkränzchen (Starburst) Blendeffekt (Starburst+Halo) Starker Blendeffekt Array N=6 1 4 1 1 0 0 % 16,7 66,7 16,7 16,7 0 0 ReZoom N=13 1 4 4 3 2 0 % 7,7 30,77 30,77 23,08 15,38 0 Nun sollte man sich nicht über die Summe der Prozentzahlen in beiden Gruppen von mehr als 100% wundern. Sie kommt durch mehrfache Antworten mancher Teilnehmer zustande, was bei Wahrnehmung von mehreren PPP-Formen ausdrücklich erlaubt war. Fünf Patienten der Array-Gruppe (83,3%) fanden, dass das Bild genau dem eigenen Seheindruck entspricht, bei einem waren die subjektiv wahrgenommenen Lichterscheinungen sogar kleiner als auf dem Foto. Unter den ReZoom-Patienten fanden 6 Personen (46,2%), dass das Bild genau dem eigenen Seheindruck entspricht und dagegen 7 Patienten (53,8%) meinten subjektiv eher größere/intensivere Lichteffekte wahrzunehmen. Eine genaue Übereinstimmung der Statistiken zwischen Evaluation mittels Fragebogen und mittels Bildertafel war nicht zu erwarten, weil nur Patienten, die sich bei der Befragung über Blendeffekte oder Halos beschwert hatten, anschließend mit den Testbildern konfrontiert wurden. Dennoch fällt auf, dass die von Array-Patienten bei der Befragung am häufigsten angegebene Störung durch Halos (33,3%) sich auch bei Auswahl des Testbilds bestätigte (66,7%). Alle Patienten beider Gruppen waren der Meinung, dass das Bildmaterial weitgehend den in natura gesehenen Lichtphänomenen entspricht und die subjektive Empfindung durchaus realistisch zu wiedergeben vermag. Es existieren in der Fachpresse sehr viele Berichte über Studien, die sich mit dem altbekannten Problem der pseudophaken photopischen Phänomene bei mono- und multifokalen Intraokularlinsen beschäftigten. Eine der umfangreichsten und was nicht weniger wichtig ist, vom Befragungsmuster her vergleichbare Arbeit wurde 1999 von Steinert et al. veröffentlicht. Diese prospektive Studie schloss insgesamt 456 Patienten ein, davon 123 mit einer Multifokallinse vom Typ Array SSM 26NB und einer Monofokallinse im zweiten Auge versorgt wurden. Teilnehmer mit multifokalen Implantaten berichteten über eine statistisch signifikant höhere Präsenz von störenden photopischen Phänomenen (p≤0,014). Vergleicht man die einzelnen Subformen der PPP, so zeigten sich folgende Ergebnisse. Eine Beeinträchtigung durch Halos gaben 38,8% der multifokalen 61 5. Diskussion Patienten (davon 23,5 mäßig und 15,3% massiv) im Gegensatz zu 28,5% der monofokalen (22,4% mäßig, 6,1% massiv), der Unterschied war statistisch signifikant. (Steinert, R. F. et al., 1999) In unserer Studie konnten also in der Array-Gruppe weniger und in der ReZoom-Gruppe mehr Halos als bei Steinert gefunden werden. Vergleichbar groß war der Anteil der massiven Halos mit ca. 15% in unserem ReZoom-Kollektiv und in der Array-Gruppe von Steinert. 11% Patienten mit der Array und 1% mit der Monofokal-IOL berichteten von starken Blendeffekten (Glare/Flare). Hier zeigte sich eine höhere Rate als in unserer Studie (7,7% in der ReZoom und 0% in der Array-Gruppe). Man muss an dieser Stelle erwähnen, dass Steinert eine Array vom Typ SSM 26NB aus anderem Silikonmaterial als SA40N verwendete, was eine Erklärung für die vorliegenden Unterschiede sein könnte. Von der stark verschwommenen Sicht in der Ferne waren 4% in der Multifokalgruppe und 1% der Monofokalgruppe betroffen. Fälle von Verschwommensehen in der Nähe, verzerrter Sicht in der Ferne, Problemen mit der Tiefenschärfe, mono- oder binokularen Doppeltsehen sowie in der Farbwahrnehmung waren in beiden Studiengruppen nicht aufgetreten. Insgesamt stellte sich eine hohe Zufriedenheit der Patienten mit der eingesetzten Multifokallinse heraus, die wohl nicht unerheblich durch eine signifikant größere Brillenunabhängigkeit zustande kam. Es lässt sich daraus schlussfolgern, dass das gelegentliche Auftreten dieser photopischen Phänomene einen akzeptablen Kompromiss für die Vorteile der Multifokalität darstellt. Hunkeler et al. analysierten die postoperativen Erfahrungen mit PPP nach bilateraler Arrayimplantation. Dazu wurden insgesamt 22 Patienten rekrutiert von denen 13 mit der MIOL nicht zufrieden (Gruppe 1) und 9 zufrieden bis sehr zufrieden (Gruppe 2) waren. Es wurden Sehschärfe und PPP mittels einer Lichtquelle und einer Bildertafel (identisch mit der von uns verwendeten) sowie die Änderung/Besserung von PPP (insbesondere Halos) durch Vorschalten von Gläsern unterschiedlicher Brechkraft untersucht. Der unkorrigierte Fernvisus war in beiden Gruppen ausgezeichnet und betrug durchschnittlich 20/17. Bei der Betrachtung der Bildertafel kam es zur folgenden Verteilung der Antworten (Gruppe 1/Gruppe 2): Normaler Seheindruck 0/11,1%; Halo 7,7/11,1%; Double Halo 0/0%; Strahlenkränzchen 53,9/55,6%; Starburst+Halos 38,5/22,2%; massive Blendung 0/0%. Ein Vergleich mit unseren Ergebnissen zeigt, dass deutlich seltener Halo und Double Halo, dafür aber häufiger Starburst und Starburst + Halo ausgewählt wurden. Ähnlich wie in unserer Studie, hat sich auch hier kein Teilnehmer über massive Blendung beschwert. Die Unzufriedenen bezeichneten ihren 62 5. Diskussion subjektiven Seheindruck größer, und die Zufriedenen kleiner als in der Abbildung auf der Testtafel. Interessanterweise ließ sich die Störung durch PPP bei fast allen Patienten in beiden Gruppen durch das Vorschalten eines -1,0 dpt Glases etwas bis deutlich bessern. Diese Erkenntnis bestätigt die gängige Praxis, als Zielrefraktion für MIOL eine leichte Hyperopie anzustreben. (Hunkeler, J. D. et al., 2002) Sen et al. untersuchte die Sehqualität nach der Array SA40N-Implantation im Vergleich mit einer monofokalen IOL. Durch Selbstevaluation wurden 1 Monat postoperativ Daten über Probleme durch PPP erhoben. Mäßige bis massive Blendung (Glare) wurde von 34,7% multifokalen gegenüber 29,9% der monofokalen Augenpatienten berichtet, mit einem p-Wert von 0,85 war die Differenz nicht signifikant, der Rest hatte nur minimale oder gar keine Blendung zu beklagen. Störende Halos beklagten 11,6% der multifokalen und 3,0% der monofokalen Patienten - hier war der Unterschied statistisch signifikant (p<0,001). Die Zufriedenheit mit der IOL war in der multifokalen Gruppe insgesamt höher als in der monofokalen: 94,4% vs. 94,0%, wenn auch keine statistische Signifikanz vorlag. (Sen, H. N. et al., 2004) Javitt et al. kontrollierte im Rahmen einer retrospektiven Studie klinische, funktionelle und „quality-of-life“-Ergebnisse im Vergleich zwischen multifokaler (SA40N) und monofokaler (SI40NB) IOL. Patienten mit Multifokallinse berichteten häufiger als diejenigen mit einer Monofokallinse über photopische Phänomene in Form von Halos oder Glare mit und ohne Korekturglas. Der Unterschied war statistisch signifikant. Es fanden sich dagegen keine Differenzen in der Häufigkeit des Auftretens von Doppelbildern oder verzerrten Sehens mit oder ohne Brille. Aufschlussreich war die hohe Zufriedenheit der Patienten mit der Multifokallinse von denen alle, einschließlich derjenigen, die sich über Halos etc. beschwerten, sich für die Implantation einer MIOL in das zweite Auge entschieden hatten. (Javitt, J. et al., 2000) Über Ergebnisse einer multizentrischen Studie in Deutschland berichteten Häring et al., 2001. Es wurden insgesamt 138 Patienten mit einer Multifokallinse (Array SN40N) und 96 Patienten mit einer Silikonmonofokallinse (SI40NB) eingeschlossen und mit Hilfe eines modifizierten Fragebogens nach Arnold (Arnold, P. N., 1994) zu ihren Erfahrungen mit photopischen Phänomenen und Schweregrad der Beeinträchtigung dadurch befragt. Das Auftreten von präoperativ nicht vorhandenen Lichtphänomenen wurde von 9% der monofokalen und 41% der multifokalen Patienten beobachtet. Das Vorhandensein von Halos wurde von 32% der multifokalen und 4% der monofokalen Patienten 63 5. Diskussion zugegeben. Blendeffekte in Form von Glare/Flare traten bei 19% der multifokalen und nur 2% der monofokalen Augen. Deutlich unterschieden sich auch die Gruppen im Schweregrad der Beeinträchtigung. Während monofokale Patienten höchstens nur leicht bis mäßig gestört waren, gaben multifokale in 18% der Fälle leichte bis mäßige und in 5% sogar eine massive Störung durch PPP an. Einen Rückgang und zum Teil ein komplettes Verschwinden dieser Lichtphänomene beobachteten 76% der monofokalen und 33% der multifokalen Patienten. In einer Studie von Dick et al. wurde eine Evaluierung von photopischen Phänomenen mit Hilfe einer speziellen Computersoftware durchgeführt. Das Studienkollektiv bestand aus 28 Patienten mit einer SA40N und 28 Patienten mit einer AMO SI 40NB einer monofokalen IOL, die bis auf die Vorderfläche identisches Design besitzt. Größe und Häufigkeit von Halo, Intensität von Glare und Flicker wurden in Abhängigkeit vom Linsentyp, Patientenalter, Qualität der Hornhautoberfläche und Astigmatismus bestimmt. Der Unterschied in der Halogröße bzw. Intensität von Glare/Flicker zwischen beiden Gruppen war nicht signifikant, allerdings zeigte sich in beiden Gruppen eine deutliche Zunahme der Halogröße und der Blendung bei den über 70-Jährigen und erreichte in dieser Altersklasse für Halos statistische Signifikanz. Patienten der Multifokalgruppe mit einem Astigmatismus <1,0 dpt hatten signifikant größere Halos als Monofokalgruppe. Bei Astigmatismus >1,0 dpt war der Unterschied zwischen mono- und multifokal nicht signifikant. Multifokalpatienten mit einem Astigmatismus von mehr als 1,0 dpt oder Hornhautirregularitäten hatten signifikant größere Halos als Patienten mit regulärer Hornhaut und mit einem Astigmatismus unter 1,0 dpt. Die Evaluierung der Erfahrungen mittels Fragebogen zeigte, dass 3 (11%) monofokale und 9 (32%) multifokale Patienten photopische Phänomene registrierten, die präoperativ nicht vorhanden waren. Es handelte sich ausnahmslos um Halos, dabei gaben 2 von 3 monofokalen und 5 von 9 multifokalen Patienten an, dass diese innerhalb von 2 bis 4 Monaten nach der OP deutlich an Intensität verloren bzw. gänzlich verschwunden waren. Alle Patienten mit Multifokallinse, die über Halos berichteten waren myop bis emmetrop mit einem mittleren sphärischen Äquivalent von -0,7 dpt. Aus den gesammelten Erfahrungen entstanden konkrete Empfehlungen für die Wahl einer Multifokallinsenimplantation. Es soll eine leicht hyperope Zielrefraktion und ein Astigmatismus <1,0 dpt angestrebt werden, was durch eine entsprechende Schnittführung bzw. zusätzliche limbusparallele relaxierende Inzisionen (LRI) zu erreichen ist. Des Weiteren sollen das Patientenalter, Komorbidität, Beschaffenheit der Hornhautoberfläche aber auch der Wunsch nach mehr 64 5. Diskussion Brillenunabhängigkeit, Kompromissbereitschaft, individuelle Ansprüche an die Sehqualität und Persönlichkeitsstruktur berücksichtigt werden. (Dick, H. B. et al., 1999) Im Rahmen unserer Studie konnte festgestellt werden, dass die ReZoom-IOL ein anderes Verteilungsmuster der photopischen Phänomene als die Array-IOL aufweist. So wurden Halos nach Evaluation mit der Bildertafel mit 30 % gegen 67% nur halb so oft angegeben, dafür zeigte sich eine Häufigkeitszunahme bei den Strahlenkränzchen mit 23% versus 17% und den Blendeffekten mit 15% versus 0% in der Array-Population. Als Erklärung hierfür könnte einerseits das moderne Design der ReZoom mit „Balanced view optic“ für weniger Halos verantwortlich sein, andererseits kann das verwendete Acryl wegen seines höheren Refraktionsindex mehr Innenreflexionen und somit stärkere Strahlenkranzbildung verursachen. Zusammenfassend lässt sich sagen, dass die pseudophaken photopischen Phänomene zwar nach wie vor ein Problem der multifokalen Intraokularlinsen in den ersten Wochen und Monaten nach der Kataraktoperation darstellen können, jedoch hilft eine genaue Kenntnis der Ursachen dieses zu lösen. So gehören neben der sorgfältigen Vorbereitung mit akkurater Biometrie und Astigmatismusmanagement eine sorgfältige Patientenselektion und Aufklärung über Besonderheiten der Multifokaloptik und Grenzen heutiger Linsentechnologie zur Operationsplanung dazu. Ebenfalls scheint die bilaterale Verwendung von Multifokallinsen das Auftreten von photopischen Phänomenen positiv zu beeinflussen. Nicht zu vergessen ist auch die postoperative Führung der Patienten, um im Falle von einer IOL-Dezentrierung oder einer Kapseleintrübung adäquate chirurgische Maßnahmen zu ergreifen. Die Erfahrung zeigt, dass ein Großteil der Patienten, die die oben erwähnten Kriterien erfüllen und motiviert sind ihr Leben weitgehend brillenfrei leben zu können, nach wenigen Monaten diese Lichtphänomene zu ignorieren lernen und sich nur minimal oder gar nicht mehr dadurch gestört fühlen. 5.4 Sehqualität in der Nähe und Brillenabhängigkeit. Die Messlatte für die postoperative Sehqualität nach einer Kataraktoperation liegt heutzutage hoch. Durch die fortschreitende Perfektionierung der Operationstechniken, wie z.B. Mikroinzisionschirurgie und astigmatismusneutrale Schnittführung sowie eine Optimierung der Linsenberechnung mit Hilfe der optischen Kohärenzbiometrie und moderner Kalkulationsformeln hat ein pseudophaker Patient meistens eine gute bis sehr 65 5. Diskussion gute unkorrigierte Sehschärfe im Fernbereich. Doch die fehlende Akkommodationsfähigkeit einer klassischen monofokalen IOL zwingt ihn zum Tragen einer Nahsehhilfe, um lesen bzw. im Nahbereich arbeiten zu können. Eine Multifokallinse soll basierend auf dem Prinzip mehrerer Brennweiten das Sehen in allen Entfernungen ohne zusätzliche Sehhilfe ermöglichen und dabei eine im Idealfall komplette Brillenfreiheit erlauben. Nun schauen wir uns einmal unsere Ergebnisse an. Zuerst die Array-Gruppe: als erstes fällt auf, dass alle Patienten dieses Kollektivs eine Brille besitzen, 4 Patienten davon haben eine Lesebrille (66,6%) und tragen sie nur manchmal, 1 Patient (16,7%) hat eine Bifokalbrille und 1 (16,7%) Patient eine sog. PC-Brille (Gleitsichtbrille für Intermediärund Nahbereich). Diese zwei letzten Patienten gaben allerdings an, ihre Brillen auch nur manchmal und nur beim Lesen zu tragen. Die Tatsache, dass keiner der Probanden eine Sehhilfe für den Fernbereich benötigte korreliert sehr gut mit einem unkorrigierten Nahvisus von 1,0 in dieser Gruppe. Auch wenn auf den ersten Blick alle Patienten eine Nahsehhilfe benutzen, darf man die Tatsache nicht außer Acht lassen, dass 50% der Patienten nach ihrer Aussage auch problemlos Zeitungstext ohne Brille lesen konnten. In der ReZoom-Gruppe brauchte ebenfalls kein Teilnehmer eine Fernbrille. Eine Lesebrille wurde von 8 Patienten (57,1%), eine Bifokalbrille bzw. Gleitsichtbrille benötigten 5 Patienten (35,8%). Die Differenz zwischen mittlerer unkorrigierter (0,8) und korrigierter (1,0) Sehschärfe in der Ferne erklärt einen etwas höheren Anteil der Bifokalbrillenträger in diesem Kollektiv. Ein Patient brauchte postoperativ überhaupt keine Brille (7,1%). Auch hier konnten 50% der Teilnehmer nach ihrer Aussage ohne eine Nahbrille Zeitungstext lesen. Die Häufigkeit des Brillentragens verteilte sich folgendermaßen: „immer“ 14,3%, „manchmal“ 78,6%, „nie“ 7,1%. Eine Untersuchung der Lebensqualität nach Implantation von Array SA40NMultifokallinse von Javitt und Mitarbeiter zeigte eine deutliche Überlegenheit der MIOL gegenüber der Monofokallinse. In seinem Patientenkollektiv trugen nur 5% ständig und 55% manchmal eine Brille. Komplett auf eine Sehhilfe verzichten konnten 41% der Teilnehmer. (Javitt, J. et al., 2000) In einer anderen Arbeit aus demJahr 2000 berichtet Javitt über 32% der Patienten, die nach der MIOL-Implantation nie eine Brille tragen. In einem Vergleich von 3 Patientengruppen mit einer Monofokallinse sowie ArrayMIOL und bifokaler „Truvista“ Linse der Fa. Storz von Leyland et al. konnte 12 Wochen postoperativ kein einziger Patient mit der monofokalen IOL auf seine Brille verzichten. Von den multifokalen brauchten 24% und von bifokalen 7% keine Brille mehr. 66 5. Diskussion Die Abschlusskontrolle nach 50 Wochen zeigte eine Zunahme der Brillenunabhängigkeit bei multifokalen und bifokalen mit 28% bzw. 27%. Der unkorrigierte Fernvisus war gleich gut in allen Gruppen; die bifokale IOL führte zu den besten Ergebnissen bei unkorrigiertem Nahvisus aber gleichzeitig zu dem schlechtesten Kontrastsehen. (Leyland, M. D. et al., 2002) Shoji und Shimizu berichteten über Ergebnisse 12 Monaten postoperativ nach Implantation einer refraktiven IOL UV360M4-07 der Fa. Ioptex Research Inc. In der Gruppe der unilateral operierten trugen 50% der Patienten nie eine Brille, bei den bilateral operierten stieg die Anzahl sogar auf 88,5% und nur die restlichen 11,5% haben eine Lesebrille gebraucht. (Shoji, N., Shimizu, K., 2002) Klinische Vergleiche zwischen multizonal-refraktiven und diffraktiven Multifokallinsen konnten zeigen, dass diffraktive Optik mit ihrer strengen Teilung in Nah- und Fernzone häufig zu besseren funktionellen Ergebnissen im Bereich der unkorrigierten Nahsehschärfe führt. So berichteten Richter-Müksch et al. über deutliche Überlegenheit der diffraktiven IOL (in diesem Fall einer 811E der Fa. Pharmacia) gegenüber der Array SA40N in Bezug auf die unkorrigierte Nahsehschärfe und Lesefähigkeit. Schmiedinger et al. stellten ebenfalls bessere Nahvisuswerte bei diffraktiven IOL (Acri.Twin und 811E) fest. (Richter-Müksch, S. et al., 2002) Ist also die Diffraktion der bessere Weg, um eine Brillenfreiheit zu erreichen? Eine Entscheidungshilfe, um diese Frage zu beantworten, liefert die Arbeit von Ravalico et al. Sie untersuchten mittels hochauflösender Perimetrie den Schwellenwert der räumlichen Auflösung und damit die Sehqualität bei Patienten mit monofokalen, multifokalen und diffraktiven Intraokularlinsen. In der Ferne waren multifokale und monofokale IOL gleich gut, die diffraktive IOL war signifikant schlechter. Im Intermediärbereich war die multifokal-refraktive IOL vom Typ Array signifikant besser als alle anderen Linsentypen. Im Nahbereich zeigte die diffraktive Linse das beste Ergebnis und war signifikant (p<0,001) besser als andere Linsenmodelle. (Ravaliko, G. et al., 1998). Die „Array lens safety and efficacy study“ hat demonstriert, dass 81% der operierten Patienten komfortabel ohne Brille in der Nähe sehen konnten. Im Intermediärbereich und in der Ferne stieg diese Zahl auf jeweils 93%. Diese Publikationen legen die Vermutung nahe, dass eine Kombination aus diffraktiver und multizonal-refraktiver MIOL wahrscheinlich die besten funktionellen Resultate in allen Entfernungen und damit auch die größte Brillenunabhängigkeit in allen erdenkli67 5. Diskussion chen Lebenssituationen bieten würde. Dabei profitiert der operierte Patient von der Unempfindlichkeit der diffraktiven Linse gegenüber Dezentrierungen und Pupillengröße bei besserem Nahvisus auf der einen, und minimaler Reduktion des Kontrastsehens ohne prinzipbedingten Helligkeitsverlust der multizonalrefraktiven Linse sowie besserem Intermediärvisus auf der anderen Seite. Es wird generell empfohlen, eine multizonalrefraktive Linse in das dominante und eine diffraktive in das nicht dominante Auge zu implantieren. Die Ausnahme von dieser Regel bilden Personen mit ausgeprägtem Wunsch nach langem Lesen ohne Brille. In solchen Fällen sollte eine diffraktive Linse in das dominante Auge eingesetzt werden. Dieses Vorgehen wird mittlerweile von einigen Linsenherstellern propagiert und als „mix match“ bzw. „custom match“ bezeichnet. 5.5 Patientenzufriedenheit Eine der wichtigen Aufgaben dieser Studie war die Bestimmung der subjektiven Patientenzufriedenheit mit beiden verwendeten Linsenmodellen. Als erstes mussten die Patienten ihre Zufriedenheit als „nicht zufrieden“, „recht zufrieden“ oder „sehr zufrieden“ einstufen. Die Befragung der mit einer Array-SA40N versorgten Patienten führte zu einem bemerkenswert homogenen positiven Ergebnis: alle Teilnehmer aus dieser Gruppe (100%) waren sehr zufrieden mit der verwendeten Linse. Das Ergebnis in der ReZoom-Gruppe war bei doppelt so großem Kollektiv erwartungsgemäß weniger einheitlich. Die Antworten verteilten sich folgendermaßen: als „sehr zufrieden“ haben sich 76,9% der teilnehmenden Patienten geäußert, immerhin „recht zufrieden“ waren weitere 15,4%. Lediglich ein Patient, also 7,7%, war mit der ReZoomIOL nicht zufrieden. Als Begründung für diese negative Bewertung wurden von ihm subjektiv störende photopische Phänomene in Form von Blendeffekten (Glare/Flare) angegeben. Dieser Patient hatte einen schlechten unkorrigierten Visus und hatte postoperativ eine Restrefraktion von etwa +1,5 dpt. Danach mussten sie zur Frage „Wenn sie noch einmal die Wahl hätten, würden Sie sich nach Ihren Erfahrungen bei einer bevorstehenden Kataraktoperation erneut für die Implantation der gleichen Multifokallinse entscheiden?“ Stellung nehmen und mit „Ja“ oder „Nein“ antworten. 68 5. Diskussion Hierbei zeigte sich wieder eine sehr hohe Akzeptanz der Array SA40N-Linse in unserem Kollektiv, alle 100% der Teilnehmer würden sich erneut für die gleiche IOL entscheiden. In der ReZoom-Gruppe hätten 84,6% der Patienten wieder das gleiche Linsenmodell gewählt. Die restlichen 15,4% würden auf Grund der Erfahrung mit störenden Lichtphänomenen (Halos bzw. Glare/Flare) sich gegen die Implantation einer ReZoom entscheiden. Die hohe Zufriedenheit der Patienten und die Akzeptanz der multifokalen Intraokularlinsen wurden bereits im Rahmen der „Array lens safety and efficacy study“ von Steinert et al. festgestellt. Von 119 bilateral multifokalen Patienten waren 100% recht bis sehr zufrieden mit dem Ergebnis und 98% würden sich erneut für die Multifokallinse entscheiden. Typischerweise waren es auch hier die Patienten mit massiven Halos, die nie wieder eine Multifokallinse wählen würden. Ebenso waren alle 50 Patienten in der Studie von Vaquero-Ruano mit der Array-IOL zufrieden, weil sie von einer verbesserten Sehschärfe in allen bereichen profitierten, auch wenn sie nicht komplett brillenfrei waren. Avitabile et al. evaluierten den Zufriedenheitsgrad der Patienten nach Implantation einer diffraktiven CeeOn 811E und fanden heraus, dass 69% zufrieden bis sehr zufrieden, aber 31% unzufrieden waren. Die Autoren vermuteten den Zusammenhang zwischen diesem relativ schlechten Resultat und unilateraler Implantation in dieser Studie. Mit Fernkorrektur stieg die Zufriedenheit an: nur noch 6% blieben unzufrieden, dafür waren 57% recht zufrieden und 37% sehr zufrieden. Von 35 Patienten würden 89% (n=31) sich bei der Kataraktoperation am zweiten Auge für die gleiche Linse entscheiden. (Vaquero-Ruano, M. et al., 1998, Avitabile, T. et al., 1999) Walkow und Klemen stellten in einer Untersuchung der Patientenzufriedenheit nach Implantation von MIOL fest, dass diese signifikant mit der Häufigkeit des Brillentragens, Alter, postoperativem Astigmatismus und sphärischem Äquivalent und als wichtigster Parameter mit unkorrigiertem Visus korrelierte. (Walkow, L., Klemen, U., 2001) Die naturgemäß größere Streuung in größerem Kollektiv und besonders die schlechte Bewertung durch einen Patienten mit großem postoperativen Refraktionsdefizit haben das Resultat der ReZoom-Gruppe etwas negativ beeinflusst. Die Ergebnisse dieser Studie stimmen sonst mit anderen vergleichbaren Arbeiten darin überein, dass die Multifokallinsen zu einer sehr hohen Zufriedenheit der operierten Patienten beitragen. Die neue ReZoom-IOL bewies eine hohe Akzeptanz, etwa 85% der Teilnehmer würden sich im Falle einer bevorstehenden Linsenoperation wieder für die gleiche Linse entscheiden. 69 6. Zusammenfassung 6. Zusammenfassung Die extrakapsuläre Kataraktextraktion mittels minimalinvasiver Kleinschnitttechnik mit Ultraschall-Phakoemulsifikation und Implantation einer faltbaren künstlichen Intraokularlinse stellt heute die Standardtechnik der Kataraktchirurgie dar. Wesentliche Meilensteine in der Entwicklung dieser Operationsmethode, die mittlerweile zu dem weltweit am häufigsten durchgeführten chirurgischen Eingriff in der Humanmedizin avancierte, waren die Erfindung der künstlichen Intraokularlinse aus PMMA von Sir Harold Ridley im Jahre 1949 sowie die Einführung der Linsenkernzertrümmerung unter Verwendung der Ultraschallenergie (sog. Phakoemulsifikation) durch Charles Kelman im Jahre 1967. Astigmatismusneutrale Schnittführung und hochpräzise Biometrie sowie genaue Linsenkraftberechnungsformeln führen heutzutage zu ausgezeichneten postoperativen funktionellen Ergebnissen in Bezug auf den unkorrigierten Fernvisus. Doch bleibt ein Patient nach der Implantation einer konventionellen monofokalen Intraokularlinse in der Regel weiterhin auf eine Sehhilfe für den Intermediär- und Nahbereich in Form einer Bifokalbrille oder einer Lesebrille angewiesen. Eine Lösung dieses Problems bieten die bereits seit 80er Jahren vergangenen Jahrhunderts auf dem Markt befindlichen multifokalen Intraokularlinsen an. Diese Linsen besitzen eine Optik, die basierend auf dem Prinzip der Lichbeugung (Diffraktion) oder Lichtbrechung (Refraktion) gleichzeitig mehrere Brennpunkte aufweist und dadurch eine gute Sehschärfe in unterschiedlichen Entfernungen ohne zusätzliche Brillenkorrektur erlaubt. Im Rahmen dieser klinischen Studie wurde ein Vergleich zweier Multifokallinsenmodelle vom Typ Array SA40N und ReZoom des Herstellers AMO Advanced Medical Optics, Inc., Santa Ana, Ca, hinsichtlich der postoperativer Visusentwicklung und der pseudophaken photopischen Phänomene (PPP) nach bilaterealer Implantation durchgeführt. Des Weiteren wurden die Häufigkeit des Brillentragens nach der Operation und die Zufriedenheit der Patienten mit der verwendeten Multifokallinse untersucht. Die Repräsentativität dieser Studie ist zwar auf Grund der geringen Fallzahl insbesondere in der Array-Gruppe als eingeschränkt zu betrachten, jedoch existieren in der Fachliteratur Ergebnisse vieler Arbeitsgruppen, die sich bereits mit dem gleichen IOL-Modell beschäftigten, was eine gute Vergleichsmöglichkeit erlaubt und eigene Resultate weitgehend bestätigt. 70 6. Zusammenfassung Es wurden initial 40 Augen von 20 Patienten eingeschlossen, davon 6 Patienten in der Array- und 14 Patienten in der ReZoom-Gruppe. Wegen eines Herzinfarkts konnte ein Teilnehmer aus der ReZoom-Gruppe zu den postoperativen Kontrollen nicht erscheinen. Die postoperative Sehschärfe in der Ferne wurde unkorrigiert und korrigiert bestimmt. Der Nahvisus wurde unkorrigiert, mit Fernkorrektur und mit Nahkorrektur bestimmt. Der Fernvisus 6 Monate nach der Operation betrug in der Array-Gruppe unkorrigiert durchschnittlich 1,0 (20/20) und in der ReZoom-Gruppe 0,8 (20/25). Der korrigierte Fernvisus betrug postoperativ in beiden Gruppen durchschnittlich 1,0 (20/20). Der unkorrigierte Nahvisus 6 Monate postoperativ lag in der Array-Gruppe bei 0,45 (20/44) und in der ReZoom-Gruppe bei 0,25 (20/73). Der Nahvisus mit bester Fernkorrektur lag in der Array-Gruppe bei 0,5 (20/40) und in der ReZoom-Gruppe bei 0,32 (20/63). Der Nahvisus mit einer Nahkorrektur (Fernkorrektur plus Nahaddition) betrug bei Array-Patienten 0,8 (20/25) und bei ReZoom-Patienten 0,63 (20/32). Die Evaluation von pseudophaken photopischen Phänomenen erfolgte mittels Fragebögen und einer standardisierten Bildertafel. Hierbei zeigten sich zum Teil deutliche Diskrepanzen zwischen den angegebenen Häufigkeiten des Auftretens von gleichen Lichtphänomenen innerhalb einer Gruppe. Basierend auf der Annahme, dass visualisierte PPP auf der Bildertafel eher weniger Raum für Missverständnisse zwischen dem Untersucher und dem Untersuchten als die Fragebögen zulassen sowie nach Meinung der Teilnehmer durchweg dem subjektiven Seheindruck entsprechen, werden sie an dieser Stelle aufgeführt. Einen absolut normalen Seheindruck bei Nacht hatten 16,7% der Array- und 7,7% der ReZoom-Patienten. Über einfache Halos berichteten 66,7% der Array- und 30,8% der ReZoom-Patienten. Die Farbringe (auch Double Halo genannt) sahen 16,7% der Array-Patienten und 30,8% in der ReZoom-Gruppe. Eine Erfahrung mit Strahlenkränzchen (Starbursts) hatten 16,7% der Array-Patienten und 23% der ReZoom-Patienten. Über Blendeffekte (Glare/Flare) berichteten 15,4% der Teilnehmer in der ReZoomGruppe, von den Array-Patienten gab es in dieser Kategorie keine Beschwerden. Ein starker Blendeffekt wurde von keinem Teilnehmer beider Gruppen berichtet. Ein Patient mit der Array-IOL wählte die Kombination aus Halo und Starburst, um seinen Seheindruck zu beschreiben. 71 6. Zusammenfassung Die subjektiv wahrgenommene Größe der PPP entsprach in der Array-Gruppe in 83,3% der Fälle der Abbildung und war in 16,7% als kleiner beschrieben. In der ReZoomGruppe empfanden 46,2% der Teilnehmer eigenen Seheindruck durch PPP als vergleichbar und in 53,8% der Fälle größer als auf der Abbildung. Die Abhängigkeit von einer Brille und Häufigkeit des Brillentragens verteilten sich in der Array-Gruppe folgendermaßen: alle Teilnehmer besaßen zwar eine Sehhilfe in Form von Bifokal- oder Lesebrille, diese wurde aber ausnahmslos nur beim Lesen gebraucht. Die Hälfte des Kollektivs gab an, auch ohne eine Lesehilfe bequem Zeitungstext lesen zu können. In der ReZoom-Gruppe besaßen 57% eine Lesebrille, 36% eine Bifokal- bzw. Gleitsichtbrille und 7% keine Brille. Immer auf die Brille angewiesen waren 14%, manchmal 79% und nie 7% des Kollektivs. Auch in diesem Kollektiv konnten 50% der Teilnehmer ohne eine Lesehilfe bequem Zeitungstext lesen. Die Zufriedenheit mit der eingesetzten MIOL war in der Array-Gruppe höher. Hier waren 100% der Teilnehmer mit der MIOL „sehr zufrieden“. In der ReZoom-Gruppe waren 76,9% „sehr zufrieden“, 15,4% „recht zufrieden“ und 7,7% aufgrund der störenden Blendeffekte „nicht zufrieden“. Erneut sich für die gleiche Linse entscheiden würden 100% der Array-Patienten. Im ReZoom-Kollektiv hätten 84,6% die gleiche Linse wieder gewählt und 15,4% würden sich aufgrund der störenden Lichtphänomene gegen eine ReZoom entscheiden. Die Ergebnisse dieser Studie bestätigen bereits oftmals gezeigte gute funktionelle Resultate nach Implantation einer modernen multifokalen Intraokularlinse. Die ReZoomIOL zeigte eine gute postoperative Sehschärfe und hohe Patientenzufriedenheit bei im Vergleich zur Array SA40N etwas verändertem Verteilungsmuster der photopischen Phänomene. Es wurden vor allem deutlich weniger Halos, dafür aber mehr Starbursts und Blendungseffekte wie Glare/Flare festgestellt. 72 7. Literaturverzeichnis 7. Literaturverzeichnis Anders, N., Pham, DT., Wollensak, J. (1997). Prospektive Langzeitstudie zur kornealen Astigmatismus-entwicklung bei der No-stitch-Kataraktchirurgie. Der Ophthalmologe 94, 506-508 Apple, DJ., Federman, JL., Krolicki, TJ., Sims, JC., Kent, DG., Hamburger, HA., Smiddy, WE., Cox, MS. Jr, Hassan, TS., Compton, SM., Thomas, SG. (1996). Irreversible silicone oil adhesion to silicone intraocular lenses. A clinicopathologic analysis. Ophthalmology 103, 1555-1561 Arnold, PN. (1994). Photic phenomena after phacoemulsification and posterior chamber lens implantation of various optic sizes. Journal of Cataract and Refractive Surgery 20, 446-450 Auffarth, GU. (2004). Kunstlinse und visuelle Rehabilitation. Möglichkeiten und Grenzen der modernen Kataraktchirurgie. Zeitschrift für praktische Augenheilkunde 25, 381384 Avitabile, T., Marano, F., Canino, EG., Biondi, S., Reibaldi, A. (1999). Long-term visual results of bifocal intraocular lens implantation. Journal of Cataract and Refractive Surgery 25, 1263-1269 Barraquer, J. (1958). Totale Linsenextration nach Auflösung der Zonula durch alphaChimotrypsin enzymatische Zonulyse. Klinische Monatsblätter der Augenheilkunde 133, 609-611 Behrens-Baumann, W. (2004). Evidenz-basierte Prophylaxe der postoperativen Endophthalmitis. 18. Kongress der Deutschsprachigen Gesellschaft für Intraokularlinsenimplantation und refraktive Chirurgie. Abstract in: Klinische Monatsblätter der Augenheilkunde Heft S 1, 221 73 7. Literaturverzeichnis Buehl, W., Findl, O., Menapace, R., Sacu, S., Kriechbaum, K., Koeppl, C., Wirtitsch, M. (2005). Long-term effect of optic edge design in an acrylic intraocular lens on posterior capsule opacification. Journal of Cataract and Refractive Surgery 31, 954-961 Claoue, C., Parmar, D. (2002). Multifocal intraocular lenses. Developments in Ophthalmology 34, 217-237 Collins, J. F., Augustin, A. J. (1997). Augenheilkunde. Springer Verlag Connors, R. 3rd, Boseman, P. 3rd, Olson, RJ. (2002). Accuracy and reproducibility of biometry using partial coherence interferometry. Journal of Cataract and Refractive Surgery 28, 235-238 Dick, HB., Schwenn, O., Pfeiffer, N. (2001). Refraktion, Vorderkammertiefe, Dezentrierung und Tilt nach Implantation monofokaler und multifokaler Silikonintraokularlinsen. Der Ophthalmologe 98, 380-386 Dick, HB., Auffarth, GU. (2001). Multifokale Intraokularlinsen: Eine Übersicht. Der Ophthalmologe 98, 127-137 Dick, HB., Marx-Gross, S. (2004). Refraktiver Linsenaustausch. 13 Jahrestagung der Gesellschaft der Augenärzte Sachsen-Anhalts und Thüringens e.V. Abstract in: Klinische Monatsblätter der Augenheilkunde Heft S 5, 221 Dick, HB. (2005). Accommodative intraocular lenses: current status. Current Opinion in Ophthalmology 16, 8-26 Dick, HB., Krummenauer, F., Schwenn, O., Krist, R., Pfeiffer, (1999). N. Objective and subjective evaluation of photic phenomena after monofocal and multifocal lens implantation. Ophthalmology 106, 1878-1886 Drexler, W., Findl, O., Menapace, R., Rainer, G., Vass, C., Hitzenberger, CK., Fercher, AF. (1998). Partial coherence interferometry: a novel approach to biometry in cataract surgery. American Journal of Ophthalmology 126, 524-534 74 7. Literaturverzeichnis Ellingson, FT. (1990). Explantation of 3M diffractive intraocular lenses. Journal of Cataract and Refractive Surgery 16, 697-702 Ellis, MF. (2001). Sharp-edged intraocular lens design as a cause of permanent glare. Journal of Cataract and Refractive Surgery 27, 1061-1064 Ferris, FL 3rd., Kassoff, A., Bresnick, GH., Bailey, I. (1982). New visual acuity charts for clinical research. American Journal of Ophthalmology 94, 91-96 Findl, O., Drexler, W., Menapace, R., Heinzl, H., Hitzenberger, CK., Fercher, AF. (2001). Improved prediction of intraocular lens power using partial coherence interferometry. Journal of Cataract and Refractive Surgery 27, 861-867 Fish, JR. (1991). Creation of a no-stitch cataract incision. Journal of Cataract and Refractive Surgery 17, 713-715 Friedrich, A., Motschmann, M., Kuchenbecker, J., Behrens-Baumann W. (1998). Validität der Interferenzsehschärfe zur prognostischen Visusbeurteilung bei Kataraktpatienten - ein Vergleich zweier Retinometer. Jahrestagung der DOG 1998 (Vortrag) Gills, JP. (2001). Subjective photic phenomena with refractive multifocal and monofocal IOLs. Journal of Cataract and Refractive Surgery 27, 1148 Gimbel, HV., Neuhann, T. (1990). Development, advantages, and methods of the continuous circular capsulorhexis technique. Journal of Cataract and Refractive Surgery 16, 31-37 Häring, G., Dick, HB., Krummenauer, F., Weissmantel, U., Kröncke, W. (2001). Subjective photic phenomena with refractive multifocal and monofocal intraocular lenses. Results of a multicenter questionnaire. Journal of Cataract and Refractive Surgery 27, 245-249 75 7. Literaturverzeichnis Hettlich, HJ., Al-Sarrage, H. (2006). Klinische Erfahrungen mit der ReZoomMultifokallinse. 20. Kongress der Deutschsprachigen Gesellschaft für IntraokularlinsenImplantation und refraktive Chirurgie. Abstract in: Klinische Monatsblätter der Augenheilkunde Heft S 1, 223 Hunkeler, JD., Coffman, TM., Paugh, J., Lang, A., Smith, P., Tarantino, N. (2002). Characterization of visual phenomena with the Array multifocal intraocular lens. Journal of Cataract and Refractive Surgery 28, 1195-1204 Jakobi, PC., Konen, W. (1995). Effect of age and astigmatism on the AMO Array multifocal intraocular lens. Journal of Cataract and Refractive Surgery 21, 556-561 Javitt, J., Brauweiler, HP., Jacobi, KW., Klemen, U., Kohnen, S., Quentin, CD., Teping, C., Pham, T., Knorz, MC., Poetzsch, D. (2000). Cataract extraction with multifocal intraocular lens implantation: clinical, functional, and quality-of-life outcomes. Multicenter clinical trial in Germany and Austria. Journal of Cataract and Refractive Surgery 26, 1356-1366 Javitt, JC., Steinert, RF. (2000). Cataract extraction with multifocal intraocular lens implantation: a multinational clinical trial evaluating clinical, functional, and quality-oflife outcomes. Ophthalmology 107, 2040-2048 Kelman, CD. (1967). Phaco-emulsification and aspiration. A new technique of cataract removal. A preliminary report. American Journal of Ophthalmology 64, 23-35 Koop, N., Langholz, M. et. al. (1997). Vergleichende Untersuchungen verschiedener kornealer Topographiemessgeräte. Der Ophthalmologe 94, 120-126 Kottler, UB., Dick, HB., Augustin, AJ. (2003). Ist die Katarakt vermeidbar? Eine aktuelle Bestandsaufnahme unter Berücksichtigung der Pathophysiologie oxidativer Linsenschäden, nutritiver Einflussfaktoren und der ARED-Studie. Der Ophthalmologe 100, 190-196 76 7. Literaturverzeichnis Kruger, AJ., Schauersberger, J., Abela, C., Schild, G., Amon, M. (2000). Two year results: sharp versus rounded optic edges on silicone lenses. Journal of Cataract and Refractive Surgery 26, 566-570 Krummenauer, F., Hahn, U., Gerl, R., Weindler, J., Scharrer, A., Bull, H., Kölbl, B., Neuhann, T. (2006). Benchmarks zur Ergebnisqualität in der ambulanten Kataraktchirurgie - was ist möglich, was ist realistisch? 19. Jahrestagung der Deutschen Ophthalmochirurgen (DOC). (Vortrag) Lachenmayr, B., Friedburg, D., Hartmann, E. (1999). Auge - Brille - Refraktion. Begleitheft zum „Schober-Kurs“. 2. Auflage. Enke Verlag, Stuttgart. Lee, ES., Lee, SY., Jeong, SY., Moon, YS., Chin, HS., Cho, SJ., Oh, JH. (2005). Effect of postoperative refractive error on visual acuity and patient satisfaction after implantation of the Array multifocal intraocular lens. Journal of Cataract and Refractive Surgery. 31, 1960-1965 Lewallen, S., Courtright, P. (2002). Gender and use of cataract surgical services in developing countries. Bulletin of the World Health Organization 80, 300-303 Leyland, MD., Langan, L., Goolfee, F., Lee, N., Bloom, PA. (2002). Prospective randomised double-masked trial of bilateral multifocal, bifocal or monofocal intraocular lenses. Eye 16, 481-490 Liekfeld, A., Walkow, T., Anders, N., Pham, DT., Wollensak, J., (1998). Prospektiver Vergleich zweier Multifokallinsenmodelle. Der Ophthalmologe 95, 253-256 Limberger, I.-J., Rabsilber, TM., Auffarth, GU. (2006) Vergleich von den AMOMultifokallinsen: SA 40N und ReZoom. 20. Kongress der Deutschsprachigen Gesellschaft für Intraokularlinsen-Implantation und refractive Chirurgie. Abstract in: Klinische Monatsblätter der Augenheilkunde Heft S 1, 223 Lundstrom, M., Stenevi, U., Thorburn, W. (1999). Outcome of cataract surgery considering the preoperative situation: a study of possible predictors of the functional outcome. British Journal of Ophthalmology 83, 1272-1276 77 7. Literaturverzeichnis Mamalis, N. (2000). Explantation of intraocular lenses. Current Opinion in Ophthalmology 11, 289-295. Menapace, R., Findl, O., Kriechbaum, K., Leydolt-Koeppl, Ch. (2007). Accommodating intraocular lenses: a critical review of present and future concepts. Graefe`s Archive for Clinical and Experimental Ophthalmology 245, 473-489 Menapace, R. (2005). Akkomodative IOL - Was leisten sie heute, was bringt die Zukunft? Der Augenspiegel 07-08, 20-23 Mester, U., Dillinger, P., Anterist, N., Kaymak, H. (2005). Funktionelle Ergebnisse nach Implantation multifokaler Intraokularlinsen (MIOL). Der Ophthalmologe 102, 1051-1056 Münchow, W. (1984). Geschichte der Augenheilkunde. Enke, Stuttgart Negishi, K., Ohnuma, K., Ikeda, T., Noda, T. (2005). Visual simulation of retinal images through a decentered monofocal and a refractive multifocal intraocular lens. Japanese Jornal of Ophthalmology 49, 281-286 Olsen, T., Corydon, L. (1990). Contrast sensitivity as a function of focus in patients with the diffractive multifocal intraocular lens. Journal of Cataract and Refractive Surgery 16, 703-706 Pieh, S., Weghaupt, H., Skorpik, C. (1998). Contrast sensitivity and glare disability with diffractive and refractive multifocal intraocular lenses. Journal of Cataract and Refractive Surgery 24, 659-662 Rajan, MS., Keilhorn, I., Bell, JA. (2002). Partial coherence laser interferometry vs. conventional ultrasound biometry in intraocular lens power calculations. Eye 16, 552556 Ravalico, G., Parentin, F., Baccara, F. (1999). Effect of astigmatism on multifocal intraocular lenses. Journal of Cataract and Refractive Surgery 25, 804-807 78 7. Literaturverzeichnis Ravalico, G., Parentin, F., Pastori, G., Baccara, F. (1998). Spatial resolution threshold in pseudophakic patients with monofocal and multifocal intraocular lenses. Journal of Cataract and Refractive Surgery 24, 244-248 Retzlaff, JA., Sanders, DR., Kraff, MC. (1990). Development of the SRK/T intraocular lens implant power calculation formula. Journal of Cataract and Refractive Surgery 16, 333-340 Erratum in: Journal of Cataract and Refractive Surgery 16, 528 Richter-Mueksch, S., Weghaupt, H., Skorpik, C., Velikay-Parel, M., Radner, W. (2002). Reading performance with a refractive multifocal and a diffractive bifocal intraocular lens. Journal of Cataract and Refractive Surgery 28, 1957-1963 Ridley, H. (1952). Intra-ocular acrylic lenses after cataract extraction. Lancet 1, 118-121 Sanders, DR., Retzlaff, JA., Kraff, MC., Gimbel, HV., Raanan, MG. (1990). Comparison of the SRK/T formula and other theoretical and regression formulas. Journal of Cataract and Refractive Surgery 16, 341-346 Schmack, I., Becker, K. A., Auffarth, G. U. (2002). Ursachen für Explantationen von Silikon- Multifokallinsen (Allergan SA 4N). DOG-Jubiläumstagung, Vortrag Schmidinger, G., Geitzenauer, W., Hahsle, B., Klemen, UM., Skorpik, C., Pieh, S. (2006). Depth of focus in eyes with diffractive bifocal and refractive multifocal intraocular lenses. Journal of Cataract and Refractive Surgery 32, 1650-1656 Schwiegerling, J. (2006). Recent developments in pseudophakic dysphotopsia. Current Opinion in the Ophthalmology 17, 27-30 Sen, HN., Sarikkola, AU., Uusitalo, RJ., Laatikainen, L. (2004). Quality of vision after AMO Array multifocal intraocular lens implantation. Journal of Cataract and Refractive Surgery 30, 2483-2493 Shoji, N., Shimizu, K. (2002). Binocular function of the patient with the refractive multifocal intraocular lens. Journal of Cataract and Refractive Surgery 28, 1012-1017 79 7. Literaturverzeichnis Spraul, W. (2005). Innovative Intraokularlinsen und Injektorsysteme. Der Augenspiegel 07-08, 16-19 Steinert, RF., Aker, BL., Trentacost, DJ., Smith, PJ., Tarantino, N. (1999). A prospective comparative study of the AMO ARRAY zonal-progressive multifocal silicone intraocular lens and a monofocal intraocular lens. Ophthalmology 106, 1243-1255 Steinert, RF., Post, CT. Jr, Brint, SF., Fritch, CD., Hall, DL., Wilder, LW., Fine, IH., Lichtenstein, SB., Masket, S., Casebeer, C. et al. (1992). A prospective, randomized, double-masked comparison of a zonal-progressive multifocal intraocular lens and a monofocal intraocular lens. Ophthalmology 99, 853-860 Straub, W., Kroll, P., Küchle, H.J. (Hrsg.) (1995). Die ophthalmologischen Untersuchungsmethoden. Ferdinand Enke Verlag, Stutgart, 112-137 Tariq Mehmood Aslam, Balejan Dhillon. (2004). Principles of pseudophakic photic phenomena. Ophthalmologica 218, 4-13 Tehrani, M., Krummenauer, F., Kumar, R., Dick, HB. (2003). Comparison of biometric measurements using partial coherence interferometry and applanation ultrasound. Journal of Cataract and Refractive Surgery 29, 747-751 Vaquero-Ruano, M., Encinas, JL., Millan, I., Hijos, M., Cajigal, C. (1998). AMO array multifocal versus monofocal intraocular lenses: long-term follow-up. Journal of Cataract and Refractive Surgery 24, 118-123 Walkow, L., Klemen, UM. (2001). Patient satisfaction after implantation of diffractive designed multifocal intraocular lenses in dependence on objective parameters. Graefes Archive for Clincal and Experimental Ophthalmology 239, 683-687 Walkow, T., Liekfeld, A., Anders, N., Pham, DT., Hartmann, C., Wollensak, J. (1997). A prospective evaluation of a diffractive versus a refractive designed multifocal intraocular lens. Ophthalmology 104, 1380-1386 80 7. Literaturverzeichnis Winther-Nielsen, A., Corydon, L., Olsen, T. (1993). Contrast sensitivity and glare in patients with a diffractive multifocal intraocular lens. Journal of Cataract and Refractive Surgery 19, 254-257 81 8. Danksagung 8. Danksagung Mein ganz besonderer Dank für die Bereitstellung des Themas und die Möglichkeit zur Promotion, für hervorragend operierte Augen und die intensive und stets greifbare Beratung gilt meinem Betreuer, Herrn Professor Dr. med. H. B. Dick. Für die gewissenhafte Durchführung von zahlreichen Untersuchungen und Befragungen des Patientenkollektivs, sowie kompetente Beratung möchte ich der Augenoptikermeisterin Frau Sabine Buchner ganz herzlich danken. Frau Stephanie Korn danke ich für die ausgezeichnete Betreuung der statistischen Auswertung und viele hilfreiche Hinweise. Bei allen Patienten, die durch ihre Teilnahme die Studie erst möglich machten, sowie dem Personal der Universitäts-Augenklinik, insbesondere den Stationsärzten, möchte ich mich bedanken. Herrn Dr. K. Schayan-Araghi danke ich für die Anregung zur Promotion und stetige Motivation. Zuletzt danke ich meinen Eltern, die mir das Studium der Medizin ermöglicht haben und ohne deren Motivation und Unterstützung es nicht möglich wäre, diese Dissertation zu vollenden. 9. Lebenslauf 9. Lebenslauf Persönliche Daten Name: Giesbrecht Vorname: Wladislaw Geburtsdatum: 28.07.1973 Geburtsort: Roshdestwenka, Kasachstan Familienstand: ledig, keine Kinder Staatsangehörigkeit: deutsch Vater: Harry Giesbrecht, geb. 10.06.1949, Diplom-Ingenieur (FH) Mutter: Tamara Giesbrecht, geb. Schmunk, geb. 17.09.1952, Diplom-Ingenieurin (FH) Geschwister: Bruder Leo Giesbrecht, geb. 26.11.1976 Ausbildung Schule September 1980 – Juni 1990, Grund- und Realschule, Zelinograd, Kasachstan Hochschulstudium September 1990 – August 1993, Studium der Humanmedizin an der medizinischen Fachhochschule in Zelinograd, 6 Fachsemester, Studiumsabbruch wegen der Ausreise nach Deutschland Oktober 1994 – Mai 2000, Studium der Humanmedizin an der Johann-Wolfgang-GötheUniversität in Frankfurt am Main März 2006, Facharztprüfung und Anerkennung als Facharzt für Augenheilkunde (Landesärztekammer Hessen, Frankfurt) Seit dem 02.05.2002 bin ich als Augenarzt in der Augenpraxisklinik „Artemis“ in Dillenburg, Hessen tätig.