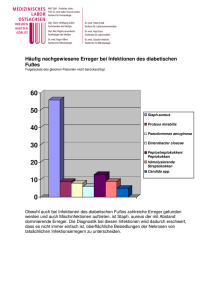
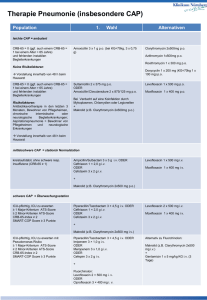
anhang ii wissenschaftliche schlussfolgerungen und
Werbung

ANHANG II WISSENSCHAFTLICHE SCHLUSSFOLGERUNGEN UND BEGRÜNDUNG FÜR DIE ÄNDERUNGEN DER ZUSAMMENFASSUNG DER MERKMALE DER ARZNEIMITTEL UND DER PACKUNGSBEILAGE 9 WISSENSCHAFTLICHE SCHLUSSFOLGERUNGEN KOMPLETTE ZUSAMMENFASSUNG DER WISSENSCHAFTLICHEN BEURTEILUNG VON ORALEN DARREICHUNGSFORMEN VON ARZNEIMITTELN, DIE MOXIFLOXACIN ENTHALTEN (siehe Anhang I) Moxifloxacin ist ein Fluorchinolon-Antibiotikum mit breitem Wirkungsspektrum und bakterizider Wirkung. In der Europäischen Union (EU) sind Moxifloxacin Filmtabletten für die Behandlung der akuten bakteriellen Sinusitis (ABS), der akuten Exazerbation der chronischen Bronchitis (AECB) und der ambulant erworbenen Pneumonie (CAP) mit Ausnahme von schweren Fällen in der Dosis von 400 mg täglich für 7 Tage bei ABS, 5-10 Tage bei AECB und 10 Tage bei CAP angezeigt. Moxifloxacin ist in der EU in allen Mitgliedstaaten gemäß dem Verfahren der gegenseitigen Anerkennung oder durch nationales Verfahren zugelassen. Erhebliche Risiken der Behandlung mit Moxifloxacin, die bereits in der Produktinformation (PI) beschrieben und streng überwacht werden, sind schwere Hepatotoxizität, kardiale Toxizität, einschließlich Verlängerung des QTc-Intervalls, schwere Hautreaktionen, Clostridium-difficile­ assoziierte Kolitis, Sehnen- und Muskeltoxizität (einschließlich Rhabdomyolyse). Im Oktober 2007 ergab die Bewertung des 15. und 16. PSUR für Moxifloxacin große Sicherheitsbedenken, einschließlich lebensbedrohlicher Fälle von Hepatotoxizität. Es wurde eine Gesamtüberprüfung aller hepatischen Reaktionen (schwerwiegende und nicht schwerwiegende) bis zum 30. September 2007 und eine allgemeine Bewertung des Nutzen-Risiko-Verhältnisses der Behandlung mit Moxifloxacin durchgeführt. Acht von insgesamt 48 ermittelten Fällen von möglicherweise mit Moxifloxacin im Zusammenhang stehenden Lebererkrankungen mit tödlichem Ausgang beliebiger Ursache waren Verdachtsfälle für eine durch Moxifloxacin induzierte tödliche Hepatotoxizität. In 3 dieser Fälle wurde Moxifloxacin zur Behandlung weniger schwerer Indikationen (Sinusitis, Pharyngitis und akute Bronchitis) eingesetzt. Diese Befunde und weitere verfügbare Daten (Beobachtungsstudie und klinische Prüfungen) deuteten darauf hin, dass schwerwiegende Leberschädigungen unter Moxifloxacin häufiger auftraten als unter Vergleichsmedikamenten. Daraufhin gab das Vereinigte Königreich am 2. Juni 2008 eine Schnellwarnung heraus und informierte die Mitgliedstaaten, die Europäische Arzneimittel-Agentur (EMEA) und die Europäische Kommission gemäß Artikel 107 der Richtlinie 2001/83/EG in der geänderten Fassung über seine Absicht, die Genehmigung für das Inverkehrbringen aller oralen Darreichungsformen von Arzneimitteln, die Moxifloxacin enthalten, zu ändern, um die Indikationen ABS und AECB zu streichen und die Indikation CAP einzuschränken. Der CHMP prüfte sämtliche Informationen, die von Inhabern der Genehmigung für das Inverkehrbringen zur Bilanz der Vorteile und Risiken von oralem Moxifloxacin bei den oben genannten Indikationen vorgelegt wurden. Moxifloxacin hat sich bei allen zugelassenen Indikationen als wirksam erwiesen. Ungeachtet dieser Tatsache ist das Sicherheitsprofil des Arzneimittels jedoch besorgniserregend. Der CHMP stellte Folgendes fest: ABS Die ABS ist im Allgemeinen eine nicht schwerwiegende Infektion mit hohen Spontanheilungsraten (90 %). Ein wesentlicher Teil der Verordnungen wegen Sinusitis scheint in der klinischen Praxis auf empirischer Basis und ohne Bestätigung einer bakteriellen Ursache zu erfolgen. Moxifloxacin hat sich zwar als wirksam erwiesen, doch die verfügbaren Daten sind begrenzt, weil vor allem Studien mit Vergleichspräparaten durchgeführt wurden und die einzige placebokontrollierte Studie statistisch keine Überlegenheit gegenüber dem Placebo zeigte. Die höhere Inzidenz von schwerwiegenden und sogar lebensbedrohlichen Risiken bei der Behandlung einer Infektion, die ohne Antibiotikatherapie 10 eine hohe Spontanheilungsrate hat, wurde als besorgniserregend betrachtet. Das Nutzen-RisikoVerhältnis von Moxifloxacin könnte jedoch günstig sein, wenn andere Antibiotikatherapien versagt haben oder nicht angewendet werden können. AECB Der Nutzen einer antibiotischen Behandlung der AECB wurde durch verschiedene Veröffentlichungen gestützt, u. a. eine Metaanalyse sowie eine kürzliche systematische Übersicht des Cochrane-Zentrums, die auf einen Mortalitätsvorteil der Anwendung von Antibiotika bei dieser Indikation im Vergleich zu Placebo sowie eine günstige Wirkung auf die Lungenfunktion hinweist. Es wurde jedoch darauf hingewiesen, dass bis vor kurzem in Vergleichsstudien mit Antibiotika bei AECB, die eine Äquivalenz zwischen Arzneimitteln aufzeigen sollten, keine klinische Überlegenheit irgendeiner Klasse von Antibiotika gegenüber einer anderen belegt wurde. Außerdem verwendeten die meisten Phase-III-Studien, die für den Nachweis der Nichtunterlegenheit von Moxifloxacin konzipiert wurden, nicht das empfohlene Arzneimittel der Wahl. Deshalb muss das Sicherheitsprofil der verschiedenen Optionen von Antibiotikatherapien berücksichtigt werden, weil die Auswirkung der Wahl einer bestimmten antibiotischen Therapie gegen AECB auf das Behandlungsergebnis der Patienten nach wie vor unklar ist. In Übereinstimmung mit dem Sicherheitsprofil und in Anbetracht dessen, dass die AECB eine weniger schwere Infektion mit einer hohen Spontanheilungsrate sein kann, bei der nur in 50 % aller Exazerbationen Bakterien nachgewiesen werden können, kann das Nutzen-RisikoVerhältnis nur dann als günstig angesehen werden, wenn Moxifloxacin nicht als Behandlung der ersten Wahl eingesetzt wird. CAP Klinische Studiendaten und andere veröffentlichte Daten weisen darauf hin, dass Moxifloxacin im Allgemeinen einen Nutzen bei der Indikation CAP hat. Außerdem werden unter Berücksichtigung der Verfügbarkeit anderer Antibiotika und bestehender Resistenzen mitunter Vorteile gegenüber anderen Therapien bei der Behandlung von leichten bis mittelschweren CAP beobachtet. In Anbetracht des Sicherheitsprofils mit einer beobachteten erhöhten Inzidenz von Risiken sollte Moxifloxacin jedoch nur angewendet werden, wenn die allgemein für die Erstbehandlung dieser Infektion empfohlenen Antibiotika als ungeeignet erachtet werden. In Anbetracht der obigen Ausführungen empfahl der CHMP die Beschränkung auf die sekundäre Behandlung bei den Indikationen für Arzneimittel, die Moxifloxacin enthalten (orale Darreichungsform), und weitere Änderungen der PI, um die Fälle von tödlicher Hepatotoxizität, die Risikofaktoren für eine Verlängerung des QTc-Intervalls aufzunehmen und die Warnhinweise auf Clostridium-difficille-assoziierte Kolitis und bullöse Hautreaktionen zu verschärfen. BEGRÜNDUNG DER ÄNDERUNG DER ZUSAMMENFASSUNGEN DER MERKMALE DER ARZNEIMITTEL UND PACKUNGSBEILAGEN In Erwägung folgender Gründe: Der Ausschuss befasste sich mit dem Verfahren gemäß Artikel 107 der Richtlinie 2001/83/EG in der geänderten Fassung für orale Darreichungsformen von Arzneimitteln, die Moxifloxacin enthalten. In Anbetracht der verfügbaren Daten gelangte das Gremium zu dem Schluss, dass das Nutzen-RisikoVerhältnis von oralen Darreichungsformen von Arzneimitteln, die Moxifloxacin enthalten, bei den überprüften zugelassenen Indikationen als Arzneimittel der zweiten Wahl günstig ist. Bei ABS und AECB sollte Moxifloxacin nur angewendet werden, wenn die allgemein für die Erstbehandlung dieser Infektionen empfohlenen Antibiotika als ungeeignet erachtet werden oder wenn die Infektion mit diesen Arzneimitteln nicht abgeklungen ist. Bei CAP sollte es nur angewendet werden, wenn die allgemein für die Erstbehandlung dieser Infektion empfohlenen Antibiotika als ungeeignet erachtet werden. 11 In Anbetracht der verfügbaren Sicherheitsdaten gelangte der Ausschuss zu dem Schluss, dass die Fälle von tödlicher Hepatotoxizität und die Risikofaktoren für eine Verlängerung des QTc-Intervalls in die Produktinformation aufgenommen und die Warnhinweise auf Clostridium-difficille-assoziierte Kolitis und bullöse Hautreaktionen verschärft werden sollten. Der CHMP empfahl infolgedessen Änderungen der betreffenden Abschnitte der Zusammenfassung der Merkmale des Arzneimittels und der Packungsbeilage für die Arzneimittel, die Moxifloxacin enthalten (siehe Anhang III). 12 ANHANG III ÄNDERUNGEN DER ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS UND PACKUNGSBEILAGE 13 ÄNDERUNGEN, DIE IN DEN RELEVANTEN ABSCHNITTEN DER ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS FÜR MOXIFLOXACIN-ENTHALTENDE ARZNEIMITTEL ZU BERÜCKSICHTIGEN SIND Das Folgende sollte in geeigneter Form wiedergegeben werden (neuer Text ist fett und unterstrichen und zu löschender Text ist durchgestrichen dargestellt): 4.1 Anwendungsgebiete [Phantasiebezeichnung] 400 mg Filmtabletten sind angezeigt zur Behandlung von folgenden bakteriellen Infektionen bei Patienten ab 18 Jahren (siehe Abschnitte 4.4, 4.8 und 5.1): Akute, bakterielle Sinusitis (ABS) Akute Exazerbation der chronischen Bronchitis (ACEB) Moxifloxacin sollte zur Behandlung von entsprechend diagnostizierter ABS und AECB nur angewendet werden, wenn andere Antibiotika, die für die initiale Behandlung dieser Infektionen üblicherweise empfohlen werden, für ungeeignet erachtet werden oder wenn diese versagt haben. Ambulant erworbene Pneumonie, ausgenommen schwere Formen Moxifloxacin sollte nur angewendet werden, wenn andere Antibiotika, die für die initiale Behandlung dieser Infektion üblicherweise empfohlen werden, für ungeeignet erachtet werden. (...) Offizielle Empfehlungen zum angemessenen Gebrauch von Antibiotika sollten berücksichtigt werden. 4.2 Dosierung, Art und Dauer der Anwendung (...) Dauer der Anwendung (...) Akute bakterielle Sinusitis 7 Tage (...) 4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung - Bei einigen Patienten verursacht Moxifloxacin eine Verlängerung des QTc-Intervalls im EKG. Die Auswertung der im Rahmen des klinischen Prüfprogramms aufgezeichneten EKGs zeigte unter Moxifloxacin eine QTc-Verlängerung von 6 msec ± 26 msec, 1,4 % des Ausgangswertes. Da Frauen im Vergleich zu Männern zu einem verlängerten QTc-Ausgangswert neigen, reagieren sie möglicherweise empfindlicher auf QTc-verlängernde Begleitmedikationen. Ebenso können ältere Patienten empfindlicher für Arzneimittel-assoziierte Einflüsse auf das QT-Intervall sein. Begleitmedikation, die den Kaliumspiegel vermindern kann, sollte bei Patienten unter Moxifloxacin-Behandlung mit Vorsicht eingesetzt werden. Moxifloxacin sollte mit Vorsicht eingesetzt werden bei Patienten mit Prädisposition zu Arrhythmien (insbesondere Frauen und ältere Patienten) wie z. B. mit akuter Myokardischämie oder QT-Verlängerung, da diese zu einem gesteigerten Risiko ventrikulärer Arrhythmien (einschließlich Torsade de pointes) und Herzstillstand führen können (siehe auch 14 Abschnitt 4.3). (...) - Fälle von fulminanter Hepatitis, möglicherweise bis hin zum Leberversagen (einschließlich Todesfälle), sind im Zusammenhang mit Moxifloxacin berichtet worden (siehe Abschnitt 4.8). (...) - Für Moxifloxacin wurden Fälle von bullösen Hautreaktionen wie Stevens-JohnsonSyndrom oder toxisch-epidermaler Nekrolyse berichtet (siehe Abschnitt 4.8). Patienten sind darauf hinzuweisen, sich ärztlichen Rat einzuholen bevor sie die Behandlung fortsetzen, wenn Haut- und/oder Schleimhautreaktionen auftreten. (...) - - Antibiotika-assoziierte Diarrhoe (AAD) und Antibiotika-assoziierte Kolitis (AAC) einschließlich pseudomembranöser Kolitis und Clostridium difficile-assoziierter Diarrhoe sind im Zusammenhang mit der Anwendung von Breitspektrum-Antibiotika, einschließlich Moxifloxacin, beschrieben und können von einer leichter Diarrhoe bis zur tödlicher Kolitis reichen. Daher ist es wichtig, dies bei der Diagnose bei Patienten in Betracht zu ziehen, die während oder nach der Anwendung von Moxifloxacin eine schwere Diarrhoe entwickeln. Wenn eine AAD oder AAC vermutet oder nachgewiesen ist, sollte die derzeitige Behandlung mit Antibiotika, einschließlich Moxifloxacin, abgebrochen werden und angemessene Therapiemaßnahmen unverzüglich ergriffen werden. Außerdem sollten geeignete Maßnahmen zur Infektionskontrolle durchgeführt werden, um das Übertragungsrisiko zu mindern. Arzneimittel, die die Darmtätigkeit hemmen, sind bei Patienten, die eine schwere Diarrhoe entwickeln, kontraindiziert. Moxifloxacin sollte bei Patienten mit Myasthenia gravis mit Vorsicht angewendet werden, da sich die Symptome verschlimmern können. (...) 4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen (...) Allerdings können Fluorchinolone, einschließlich Moxifloxacin, die Fähigkeit des Patienten, Auto zu fahren oder Maschinen zu bedienen, aufgrund von ZNS-Reaktionen (z. B. Benommenheit, siehe Abschnitt 4.8) oder plötzlicher und kurzfristiger Bewusstlosigkeit (Synkope, siehe Abschnitt 4.8) beeinträchtigen. (...) 4.8 (...) Nebenwirkungen 15 Systemorganklasse Häufig ≥ 1/100 bis < 1/10 Herzerkrankungen QT-Intervall­ verlängerung bei Patienten mit gleichzeitig bestehender Hypokaliämie (siehe Abschnitt 4.4) Leber- und Gallenerkran­ kungen Transaminasen­ anstieg Erkrankungen der Haut und des Unterhautzell­ gewebes Skelettmuskulatur-, Bindegewebs- und Knochenerkran­ kungen Gelegentlich ≥ 1/1.000 bis < 1/100 QT-Intervall­ verlängerung (siehe Abschnitt 4.4) Palpitationen Tachykardie Vorhofflimmern Angina pectoris Vasodilatation Leberfunktionsstö­ rung (inkl. LDHAnstieg) Bilirubinanstieg gamma-GT-Anstieg Anstieg der alkalischen Phosphatase Pruritus Rash Urtikaria Hauttrockenheit Selten ≥ 1/10.000 bis < 1/1.000 ventrikuläre Tachyarrhythmien Synkope (d.h. plötzliche und kurzfristige Bewusstlosigkeit) Hypertonie Hypotension Ikterus Hepatitis (überwiegend cholestatisch) Arthralgie Myalgie Tendinitis (siehe Abschnitt 4.4) Muskelkrämpfe Muskelzucken Sehr selten < 1/10.000 unspezifische Arrhythmien Torsade de pointes (siehe Abschnitt 4.4) Herzstillstand (siehe Abschnitt 4.4) fulminante Hepatitis, möglicherweise bis hin zum lebensbedrohlichen Leberversagen (inkl. Todesfälle, siehe Abschnitt 4.4) bullöse Hautreaktionen wie Stevens-JohnsonSyndrom oder toxisch-epidermale Nekrolyse (möglicherweise lebensbedrohlich, siehe Abschnitt 4.4) Sehnenruptur (siehe Abschnitt 4.4) Arthritis gesteigerte Muskelspannung Verschlimmerung der Symptome einer Myasthenia gravis (siehe Abschnitt 4.4) Bei der Behandlung mit anderen Fluorchinolonen wurden sehr selten folgende Nebenwirkungen beobachtet, die möglicherweise auch bei einer Anwendung von Moxifloxacin auftreten können: vorübergehender Verlust des Sehvermögens, Hypernatriämie, Hyperkalzämie, Hämolyse, Rhabdomyolyse, photosensitive Reaktionen (siehe Abschnitt 4.4). 16 ÄNDERUNGEN, DIE IN DEN RELEVANTEN ABSCHNITTEN DER PACKUNGSBEILAGE FÜR MOXIFLOXACIN-ENTHALTENDE ARZNEIMITTEL ZU BERÜCKSICHTIGEN SIND Das Folgende sollte in geeigneter Form wiedergegeben werden (neuer Text ist fett und unterstrichen und zu löschender Text ist durchgestrichen dargestellt): 1. WAS IST [PHANTASIEBEZEICHNUNG] 400 MG FILMTABLETTEN UND WOFÜR WIRD ES ANGEWENDET? [Phantasiebezeichnung] ist ein Antibiotikum aus der Chinolonfamilie und enthält den Wirkstoff Moxifloxacin, der zu der Gruppe der Fluorchinolone gehört. Bakterielle Krankheitserreger werden durch [Phantasiebezeichnung] abgetötet, sofern sie gegen den Wirkstoff Moxifloxacin empfindlich sind. [Phantasiebezeichnung] wird bei Patienten ab 18 Jahren angewendet für die Behandlung von folgenden bakteriellen Infektionen, wenn sie durch bakterielle Krankheitserreger hervorgerufen werden, gegen die Moxifloxacin empfindlich ist: Entzündung der Nasennebenhöhlen, akute Verschlechterung einer chronischen Entzündung der Luftwege oder außerhalb des Krankenhauses erworbene Lungenentzündung (Pneumonie, ausgenommen schwere Formen). [Phantasiebezeichnung] sollte zur Behandlung dieser Infektionen nur angewendet werden, wenn die üblichen Antibiotika nicht angewendet werden können oder versagt haben. (...) 2. WAS MÜSSEN SIE VOR DER EINNAHME VON [PHANTASIEBEZEICHNUNG] 400 MG FILMTABLETTEN BEACHTEN? (...) Bevor Sie [Phantasiebezeichnung] 400 mg Filmtabletten einnehmen [Phantasiebezeichnung] kann eine bestimmte Veränderung des EKGs verursachen, insbesondere wenn Sie eine Frau oder ein älterer Patient sind. Wenn Sie gleichzeitig Arzneimittel einnehmen, die Ihren Kaliumspiegel im Blut erniedrigen können, sprechen Sie bitte vor der Einnahme von [Phantasiebezeichnung] mit Ihrem Arzt. Falls Sie während der Behandlungsdauer Herzklopfen oder Herzrhythmusstörungen bemerken, suchen Sie bitte sofort Ihren Arzt auf. Dieser wird gegebenenfalls ein EKG durchführen, um Ihren Herzrhythmus zu bestimmen. (...) Wenn Sie an Myasthenia gravis leiden, kann die Einnahme von [Phantasiebezeichnung] die Symptome Ihrer Erkrankung verschlimmern. Wenn Sie das Gefühl haben, dass das bei Ihnen zutrifft, sprechen Sie bitte sofort mit Ihrem Arzt. (...) Wenn Sie [Phantasiebezeichnung] 400 mg Filmtabletten bereits einnehmen (...) - [Phantasiebezeichnung] kann eine sehr schnell verlaufende und schwere Leberentzündung bis hin zum lebensbedrohlichem Leberversagen verursachen (einschließlich Todesfälle, siehe Abschnitt 4. WELCHE NEBENWIRKUNGEN SIND MÖGLICH?). Bitte sprechen Sie mit Ihrem Arzt bevor Sie die Behandlung fortsetzen, wenn Sie Anzeichen wie z. B. sehr schnell auftretendes Unwohlsein und/oder Übelkeit zusammen mit Gelbfärbung Ihrer Augen, Dunkelfärbung des Urins, Juckreiz, erhöhte Blutungsneigung oder eine durch die Leber verursachte nichtentzündliche Erkrankung des Gehirns bemerken (Symptome für eine eingeschränkte Leberfunktion oder eine schnell verlaufende und schwere Leberentzündung). 17 - Wenn Sie eine Hautreaktion oder Blasenbildung und/oder „Pellen“ der Haut und/oder Schleimhautreaktionen bemerken (siehe Abschnitt 4. WELCHE NEBENWIRKUNGEN SIND MÖGLICH?), sprechen Sie sofort mit Ihrem Arzt bevor Sie die Behandlung fortsetzen. (...) Verkehrstüchtigkeit und das Bedienen von Maschinen Falls Sie sich nach der Einnahme von [Phantasiebezeichnung] benommen fühlen oder kurz bewusstlos werden, nehmen Sie bitte nicht aktiv am Straßenverkehr teil oder bedienen Maschinen. (...) 3. (...) - WIE IST [PHANTASIEBEZEICHNUNG] 400 MG FILMTABLETTEN EINZUNEHMEN? Akute Verschlechterung einer chronischen Entzündung der Bronchien (Bronchitis) 5 bis 10 Tage (...) 4. WELCHE NEBENWIRKUNGEN SIND MÖGLICH? (...) Leber (...) Sehr selten: Heftige und schnell verlaufende Leberentzündung bis hin zum lebensbedrohlichen Leberversagen (einschließlich Todesfälle) (...) Bewegungsapparat (...) Sehr selten: Sehnenrisse, Gelenkentzündung, gesteigerte Muskelspannung, Verschlimmerung der Symptome einer Myasthenia gravis (...) Bei der Behandlung mit anderen Chinolonen wurden darüber hinaus sehr selten folgende Nebenwirkungen beobachtet, die möglicherweise auch bei der Einnahme von [Phantasiebezeichnung] auftreten können: Vorübergehender Verlust des Sehvermögens, erhöhter Natriumspiegel, erhöhter Kalziumspiegel, Abbau roter Blutkörperchen, Muskelreaktionen mit Schädigung der Muskelzellen, Lichtempfindlichkeitsreaktionen der Haut. (...) 18