Dynamics of the Sodium-D-Glucose co
Werbung

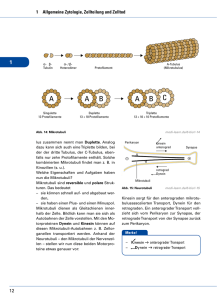
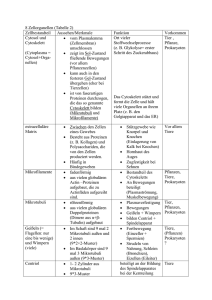
Zusammenfassung 6 Zusammenfassung In vorangegangenen Studien konnte gezeigt werden, dass das trafficking von SGLT1 zwischen der Plasmamembrane und intrazellulären Kompartimenten eine wichtige Rolle bei der Regulation der D-Glukose Aufnahme durch SGLT1 spielt. Die Erbkrankheit Glukose-Galaktose-Malabsorption hat ihre Ursache in Mutationen des SGLT1 Gens. Diese Mutation führt dazu, dass das trafficking von SGLT1 zur Plasmamembran unterbunden wird. Daher ist das Verständnis der Mechanismen die dem trafficking von SGLT1 zu Grunde liegen von größter Bedeutung, um neue Ansätze zur Behandlung von GGM oder ähnlicher Krankheiten zu finden. Der intrazelluläre SGLT1-Pool wurde mit Hilfe immunzytochemischer Methoden unter Verwendung von spezifischen Antikörpern gegen SGLT1 charakterisiert. Dabei wurde SGLT1 in zwei Fraktionen detektiert. Eine Fraktion wurde in intrazellulären Kompartimenten lokaliziert und die andere Fraktion in der Plasmamembran. Die weitere Charakterisierung der intrazellulären SGLT1 Fraktion ergab eine Lokalisierung dieser Fraktion in Endosomen. Desweiteren konnte gezeigt werden, dass die SGLT1- enthaltenden Endosomen mit dem Mikrotubuli-Netzwerk verknüpft sind. Da die Mikrotubuli als „Eisenbahnschienen“ des intrazellulären Transport von Makromolekülen und Organellen fungieren, wurde die Möglichkeit der intrazellulären Bewegung von SGLT1 postuliert. Die Eigenschaften der Bewegung von SGLT1 wurde mit Hilfe einer Fusion aus GFP und SGLT1 in lebenden Zellen analysiert. Es konnte gezeigt werden, dass sich das GFP-SGLT1 Fusionsprotein in Abhängigkeit von intakten Mikrotubuli innerhalb der Zelle bewegt. Außerdem wurde die 71 Zusammenfassung Dynamik von GFP-SGLT1 an der Zelloberläche untersucht. Dabei konnte gezeigt werden, das GFP-SGLT1 kontinuierlich in der Zellmembran auftaucht und von der Zellmembran verschwindet. Daher wurde ein recycling von SGLT1 zwischen der Plasmamembran und intrazellulären Kompartimenten diskutiert. Die Eigenschaften des recycling von GFP-SGLT1 wurden durch Vergleich mit dem Transferrinrezeptor Kompartimenten weiter detektiert, die analysiert. nicht mit GFP-SGLT1 dem wurde in Transferrinrezeptor kolokalizierten. Außerdem waren die Bewegungen von GFP-SGLT1 im Vergleich zum Transferrinrezeptor langsamer. Desweiteren zeigten die beiden Membranproteine eine unterschiedliche Abhängigkeit von intakten Mikrotubuli. Während die Bewegung von GFP-SGLT1 durch Abbau der Mikrotubuli unterbunden wurde, zeigten die Bewegungen des Transferrinrezeptors keine Veränderung. Dieser Vergleich ergab, dass die Bewegung von Transferrinrezeptor und SGLT1 unterschiedliche Eigenschaften aufweisen und daher entlang verschiedener Wege innerhalb der Zelle abläuft. In der vorliegenden Arbeit wurden daher weitere Beweise für die Lokalizierung des Na+-D-Glukose Transporters SGLT1 in intracellulären Edosomen vorgelegt. Desweiteren konnte die kontinuierliche Bewegung zwischen der Plasmamembran und intrazellulären Kompartimenten gezeig werden. Die beschriebenen Eigenschaften der Dynamik von SGLT1 bieten Ansatzpunkte zur Erfoschung der Rolle von intrazellulärem recycling bei der Regulierung des Natrium-abhängigen Glukosetransports. 72