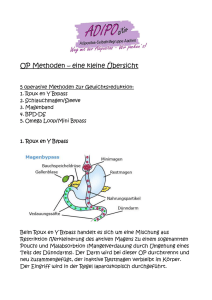
Dissertation: Versorgung infrarenal gelegener, infizierter
Werbung

Aus dem Zentrum Chirurgie Klinik für Herz-, Thorax-, Transplantations- und Gefäßchirurgie (Direktor: Professor Dr. med. Axel Haverich) Kryokonservierte humane Allografts zur In-situGefäßrekonstruktion nach Protheseninfektion Dissertation zur Erlangung des Doktorgrades der Medizin an der Medizinischen Hochschule Hannover vorgelegt von Stephan Brand aus Oldenburg Hannover 2008 2 Angenommen vom Senat der Medizinischen Hochschule Hannover am 10.06.2008 Gedruckt mit Genehmigung der Medizinischen Hochschule Hannover Präsident: Prof. Dr. med. Dieter Bitter-Suermann Betreuer der Arbeit: PD Dr. med. Omke E. Teebken Referent/Referentin: Prof. Dr. med. Wolfgang Harringer Korreferenten/Korreferentinnen: Prof. Dr. med. Thomas Weiss Tag der mündlichen Prüfung: 10.06.2008 Promotionsausschussmitglieder: Prof. Dr. med. Johann Karstens Prof. Dr. med. Benno Ure Prof. Dr. med. Hüseyin Bektas 3 Sarah, meinen Eltern und meiner Schwester in Liebe und Dankbarkeit gewidmet. 4 0. Inhalt 0. Inhalt........................................................................................................................4 0.1 Abkürzungsverzeichnis..........................................................................................................7 1. Einleitung.................................................................................................................9 1.1 Problemstellung......................................................................................................................9 1.2 Allografts in der Vaskularchirurgie......................................................................................9 1.2.1 Die Entwicklung der arteriellen Allografts........................................................................9 1.2.2 Herkunft und Konservierung der Allografts....................................................................12 1.3 Entwicklung von synthetischen Gefäßprothesen...............................................................13 1.4 Nomenklatur und Klassifizierung der arteriellen Infektionen.........................................14 1.4.1 Klassifikationen von Gefäßinfektionen...........................................................................14 1.4.2 Klassifikationen von Prothesen- und Wundinfektionen in der Gefäßchirurgie...............14 1.5 Ursachen und Entstehungswege der Protheseninfektion..................................................16 1.6 Zielsetzung und Fragestellung der Arbeit..........................................................................17 2. Patienten und Methoden.........................................................................................18 2.1 Vorstellung des Patientenkollektives .................................................................................18 2.1.1 Statistische Methoden......................................................................................................18 2.1.2 Studieneinschlusskriterien...............................................................................................19 2.2 Präoperative Befunde...........................................................................................................19 2.3 Operationsindikationen........................................................................................................20 2.4 Operationstechniken.............................................................................................................21 2.5 Herkunft und präoperative Präparation der Aortenallografts........................................23 3. Ergebnisse..............................................................................................................25 3.1 Demographische Daten und Indikationen..........................................................................25 3.2 Voroperationen ....................................................................................................................26 3.3 Präoperative Diagnostik.......................................................................................................29 3.4 Bakteriologische Befunde.....................................................................................................31 5 3.5 Zeitspanne zwischen Voroperation und Allograftimplantation.......................................31 3.6 Intraoperative Befunde........................................................................................................32 3.6.1 Infektlokalisationen.........................................................................................................32 3.7 Art des implantierten arteriellen Allografts.......................................................................34 3.8 Perioperative Begleitmaßnahmen ......................................................................................34 3.9 Mortalität...............................................................................................................................35 3.9.1 Dreißig-Tage-Mortalität..................................................................................................35 3.9.2 Gesamtmortalität..............................................................................................................35 3.10 Mortalität in Abhängigkeit von unterschiedlichen Komorbiditäten.............................40 3.10.1 Einflusses eines Staphylokokken-Nachweises auf Mortalität und Morbidität..............40 3.10.2 Einfluss eines bekannten Diabetes mellitus Typ 2 auf Mortalität und Morbidität........42 3.10.3 Einfluss einer pAVK-Erkrankung auf Mortalität und Morbidität.................................42 3.10.4 Einfluss einer arteriellen Hypertonie auf Mortalität und Morbidität.............................44 3.10.5 Einfluss des Geschlechts auf Mortalität und Morbidität...............................................45 3.10.6 Einfluss der Reoperationen auf Mortalität und Morbidität............................................46 3.10.7 Einfluss des Lebensalters auf die Mortalität..................................................................46 3.11 Verweildauer auf der Intensivstation...............................................................................46 3.12 Dauer des postoperativen Krankenhausaufenthaltes......................................................46 4. Diskussion..............................................................................................................48 4.1 Ergebnisse nach Gefäßersatz mit kryokonservierten arteriellen Allografts...................48 4.2 Vergleich der Therapiekonzepte ........................................................................................53 4.3 Limitationen der Studie.......................................................................................................59 4.4 Konsequenzen für die Praxis...............................................................................................59 5. Zusammenfassung..................................................................................................61 6. Literaturverzeichnis...............................................................................................63 7. Anhang...................................................................................................................72 7.1 Tabellenverzeichnis..............................................................................................................72 7.2 Abbildungsverzeichnis.........................................................................................................72 6 8. Lebenslauf..............................................................................................................79 9. Publikationen:........................................................................................................80 10. Erklärung nach § 2 Abs. 2 Nrn. 5 und 6 PromO 79..........................................81 11. Danksagung..........................................................................................................82 7 0.1 Abkürzungsverzeichnis A. Arteria AEF Aorto-enterische Fistel AURC l'Association Universitaire de Recherche en Chirurgie aorto-biprof. Aorto-biprofundal BAA Bauchaortenaneurysma Bd. beidseits Biprof. biprofundal CMV Cytomegalievirus com. communis comm. communes CRP c-reaktives Protein CT Computertomographie D2 Digitus 2 dl Deziliter DMSO Dimethylsulfoxid DSA digitale Subtraktionsangiographie E. coli Escherichia coli EKG Elektrokardiogramm Ent. faecalis Enterococcus faecalis fem. femoral fem.-pop. femoro-popliteal Gram-neg. gram-negativ HLA Human Leukozyte Antigene HIV Human Immundeficiency Virus HCV Hepatitis C Virus HBV Hepatitis B Virus I.E. internationale Einheiten iliaco-fem. iliaco-femoral iliaco-prof. iliaco-profundal ITN Intubationsnarkose i.v. intravenös KHK koronare Herzkrankheit 8 kg Kilogramm KG Körpergewicht li. links M. Musculus MHC Major Histokompatibilitätskomplex MA mykotisches Aneurysma mg Milligramm ml Milliliter MRT Magnetresonanztomographie ORSA Oxacillin resistenter Staphylococcus aureus OSSA Oxacillin sensibler Staphylococcus aureus Pat. Patient pAVK periphere arterielle Verschlusskrankheit PDS Polydioxanon PGI Primärgraftinfektion POD postoperativer Tag pop. popliteal prof. profundal PTFE Polytetrafluorethylen re. rechts Staph. aureus Staphyloccocus aureus Staph. epidermidis Staphyloccocus epidermidis SFPV superfiziale femoropopliteale Venen V. Vena 9 1. Einleitung 1.1 Problemstellung Prothesen- und Gefäßinfektionen stellen auch heute noch eine der gravierendsten Komplikationen der rekonstruktiven Gefäßchirurgie dar, insbesondere bei Mitbeteiligung der Aorta. Trotz optimierter chirurgischer Technik und einer adäquaten systemischen Antibiotikaprophylaxe ist weiterhin mit einer Inzidenz zwischen 0,2 und 5% zu rechnen 1-12. Auch nach kontinuierlicher Verbesserung der Resultate während des letzten Jahrzehnts sind Protheseninfektionen immer noch mit einer hohen Morbidität und Mortalität verbunden 13. Die traditionelle Therapie zur Behandlung und Rekonstruktion der arteriellen Gefäßstrombahn bei einer Primär- oder Sekundärinfektion ist die komplette Exzision des Fremdmaterials, gefolgt von einem ausgiebigen Debridement und der Anlage eines extraanatomischen Bypasses oder eines Insitu-Bypasses, jeweils unter Verwendung von Kunststoffprothesen. Bedingt durch die unzufriedenstellenden Ergebnisse, insbesondere die hohe Sterblichkeit, die hohen Amputationsraten sowie das Problem persistierender Infektionen mit der Folge wiederholter Gefäßrupturen, sind die Bemühungen verstärkt worden, biologische Materialien in Form von autologen Venen oder humanen Allografts für In-situ-Rekonstruktionen heranzuziehen. Die vermeintlich höhere Infektionsresistenz der biologischen Materialien spielte auf dem Weg zu einem idealen Gefäßsubstitut eine entscheidende Rolle. 1.2 Allografts in der Vaskularchirurgie 1.2.1 Die Entwicklung der arteriellen Allografts Unter dem Begriff Allotransplantation versteht man die Übertragung eines Organs oder Gewebes von einem Individuum zu einem anderen der identischen Spezies mit einem unterschiedlichen Genotyp, dabei wird das zu transplantierende Organ als Allograft bezeichnet. Die Transplantation eines Gewebes oder Organs zwischen eineiigen Zwillingen wird als Isotransplantation, die zwischen Individuen unterschiedlicher Spezies als Xenotransplantation bezeichnet. Autotransplantation bezeichnet eine Transplantation im selben Individuum. Allografts werden im Rahmen unterschiedlicher Transplantationen am Menschen verwendet, einschließlich Organ- und Gewebeentnahmen von Kadaverspendern als auch Lebendspendern. Bereits in den 1950ern wurden arterielle Allografts für den operativen Einsatz bei aneurysmatischen und obliterativen Läsionen der Aorta eingesetzt. Die ersten Implantationen von arteriellen Allografts im Bereich der thorakalen Aorta wurden 1948 von Gross bei zwölf Patienten publiziert 14. Über den erstmaligen Ersatz der Bauchaorta berichtet im Jahre 1950 Dubost et al. 15. 10 Dabei wurden gekühlte Allografts ohne Blutgruppenkompatibilität transplantiert. Der Gebrauch arterieller oder venöser, gekühlter Allografts geht bis in das Jahr 1912 zurück, als Alexis Carrel über die Zweijahresoffenheitsdauer eines venösen Allografts berichtete, das er in die thorakale Aorta eines Hundes implantiert hatte 16. Bei den von Carrel 1912 durchgeführten Experimenten wurden frische, lediglich gekühlt gelagerte allogene Grafts verwendet. Es erfolgte damals keine blutgruppenkompatible Transplantation. Bei einem ersten Experiment hatte Carrel einen arteriellen Xenograft verwendet, als er ein Segment einer humanen Poplitealarterie, gekühlt konserviert für 24 Tage, in den Bereich der Aorta abdominalis eines Tieres transplantierte. Dieses Tier überlebte vier Jahre und zwei Monate in gutem Allgemeinzustand. Aufgrund dieser neuartigen Vorgehensweise mit dem Gebrauch arterieller Allografts kam es zu einer raschen Entwicklung der Gefäßchirurgie, die allerdings neue Probleme aufwarf. Es wurde schnell deutlich, dass bei dem steigenden Interesse eine große Anzahl von Allografts notwendig war, und dieses wiederum ließ die unterschiedlichen Aufbewahrungsmöglichkeiten für humane Gefäße in den Mittelpunkt des Interesses rücken. Als Konservierungsmethoden kamen die Lagerung in einer 4°C kalten Lösung 17, die Tiefkühllagerung bei -20°C 18 und die Lyophilisation (Gefriertrocknung) 19 zum Einsatz. Allerdings konnte für keine Art der Tiefkühlkonservierung eine Viabilität, also das Vorhandensein lebender Zellen im jeweiligen Allograft sicher nachgewiesen werden. Eine kurze Lagerung der Transplantate bei 4°C beeinflusste zwar nicht die vorhandene Viabilität, bot jedoch keine längerfristige Konservierungsmöglichkeit. Als sich dann nach den anfänglichen Erfolgen zunehmende Komplikationen wie Aneurysmabildungen, Kalzifikationen und Thrombosen zeigten 20, 21, schwand das Interesse an Allografts als Gefäßersatz relativ rasch wieder, zumal annähernd parallel die Entwicklung synthetischer Gefäßprothesen einsetzte 22. Aufgrund der häufig minderwertigen Qualität der autologen Venengrafts bzw. ihrer Verwendung für bereits stattgefundene Operationen am Herzen oder Bein einhergehend mit der zunehmenden Multimorbidität der Patienten, keimte das Interesse an arteriellen Allografts in den 1980er Jahren wieder auf 23-28. Dafür waren insbesondere Fortschritte in der Konservierungstechnik verantwortlich. Im Jahre 1994 berichteten da Gama et al. über den Gebrauch von arteriellen Allografts zur Gefäßrekonstruktion bei Patienten, die aufgrund einer vorangegangenen Organtransplantation immunsuppressiv behandelt wurden 29. Dreizehn Patienten nach Nierentransplantation und einer Immunsuppression mit Azathioprin, Cyclosporin A und Prednison erhielten sechzehn kryokonservierte arterielle Allografts zur Gefäßrekonstruktion im infrarenalen Stromgebiet. Der durchschnittliche postoperative Nachbeobachtungszeitraum betrug 20 Monate. In dieser Zeit wurden keine Zeichen der akuten Graftinsuffizienz beobachtet. 11 Schon sechs Jahre zuvor machten Schmitz-Rixen et al. im Rattenmodell eine ähnliche Aussage bezüglich der Verzögerung von aneurysmatischen Dilatationen, zellulärer Infiltration, Ausdünnung und Nekrose der Tunica media unter einer kontrollierten und regelmäßigen Gabe von Cyclosporin A 30. Sie folgerten, dass eine kontinuierliche Low-Dose-Medikation mit Cyclosporin A (5mg/kg) nach Implantation von arteriellen Allografts eine signifikante Verbesserung hinsichtlich der Ausbildung aneurysmatischer Dilatationen erbringen kann. Anzumerken ist hier, dass es sich wie bereits oben erwähnt hierbei um einen tierexperimentellen Ansatz handelte, der schwer auf den Menschen übertragbar ist und dass es sich nicht um ein Infektmodell handelte. Eine weitere Publikation untersucht die Funktion und die endotheliale Integrität von kryokonservierten arteriellen Allografts mit und ohne Immunsuppression mit Cyclosporin A in einem hundeexperimentellen Ansatz 31. Die Tiere in Gruppe A wurden mit kryokonservierten arteriellen Autografts behandelt, die Tiere in Gruppe B erhielten kryokonservierte arterielle Allografts ohne Immunsuppression, die Tiere in Gruppe C kryokonservierte arterielle Allografts mit Immunsuppression mit Cyclosporin A (25mg/kg/Tag). Allen kryokonservierten Arterien war gemein, dass sie nach dem Auftauvorgang vor der Implantation einen Verlust der Funktion und endothelialen Integrität zeigten. Drei Monate nach Implantation zeigten die arteriellen Autografts sowie die unter Immunsuppression implantierten kryokonservierten, arteriellen Allografts eine Wiederbesiedlung des Implantats durch Empfängerendothelzellen bedingt durch eine medikamentöse Induktion mit gefäßaktiven Substanzen. Die in Gruppe B implantierten Grafts zeigten keine derartige Rekolonialisierung, zudem erschien die Tunica media in den untersuchten Gefäßen deutlich ausgedünnt und funktionslos. Auch Pupka et al. verglichen in einer Studie aus dem Jahr 2003 elektronenmikroskopisch die morphologischen Veränderungen der Gefäßwand der arteriellen Allografts mit (16 Patienten) und ohne Immunsuppression (13 Patienten) 32. Alle Patienten unterzogen sich einer Reoperation, bei der ein Stück des implantierten Allografts zur histologischen Evaluation entnommen wurde. Dabei zeigten sich elektronenmikroskopisch bei den Patienten mit Immunsuppression ein funktionsfähiges Endothel sowie eine Intima mit einer großen Anzahl von elastischen und kollagenen Fasern ohne Hinweis auf eine zelluläre Abstoßungsreaktion. In der Gruppe ohne Immunsuppression hingegen zeigte sich eine durchgehende Zerstörung der zellulären Matrix mit Ausdünnung der Tunica media und Verlust von Fibroblasten, kollagenen und elastischen Fasern. Nicht untersucht wurde in dieser Studie die Auswirkung der Aufbewahrung der arteriellen Allografts auf die Veränderung der zellulären Matrix. Allerdings wird die Bedeutung der hier angeführten Studien bezüglich des Verlustes der endothelialen Integrität des Allografts durch Kryokonservierung oder bei Implantation ohne 12 Immunsuppression in den internationalen Publikationen unterschiedlich gesehen. So berichteten bereits 1993 Gournier et al. über positive Beobachtungen bezüglich der Gefäßintegrität nach Kryokonservierung 33. Ziel dieser Studie war es, Aussagen über das biomechanische Verhalten von kryokonservierten Allografts im Vergleich zu frischen Arterien sowie über die histologischen Veränderungen nach Kryokonservierung machen zu können. Die Kryokonservierung wurde dabei nach einem computerkontrollierten Regime mit 15% DMSO als Kryoprotektivum durchgeführt. Bei direkt nach Auftauen sowie an den Tagen 1 und 7 nach Auftauen durchgeführten mechanischen Tests zeigten sich dann keine signifikanten Unterschiede zwischen den beiden Gruppen. Weiterhin wurden histologische Studien unter Standardmikroskopie und Elektronenmikroskopie vor und nach Kryokonservierung angewandt. Die Ergebnisse zeigten normale arterielle Strukturen ohne Veränderungen der kollagenen oder elastischen Fasern. Auch Endothelzellen konnten bei diesen Untersuchungen in unveränderter Position nachgewiesen werden. Ebenfalls mit dem Problem der Auswirkung der Kryokonservierung auf die histologische Stabilität und damit auf das biologische Überleben der Grafts, setzt sich eine Studie aus dem Jahr 2004 von Pascual et al. auseinander 34. Hierbei wurde in einem rattenexperimentellen Ansatz das Langzeitverhalten von kryokonservierten arteriellen Allografts mit dem von prothetischen Mikrografts verglichen. Drei Gruppen von Versuchsratten wurden entweder arterielle Autografts, kryokonservierte arterielle Allografts oder Mikrografts aus PTFE implantiert. Nach 180 Tagen wurden die Grafts morphologisch und immunhistochemisch evaluiert. Alle drei verwendeten Grafts zeigten eine gute Langzeittoleranz als arterielles Gefäßsubstitut. Autografts und Allografts zeigten eine 100%ige Durchgängigkeit sowie eine Hyperplasie der Intima im Sinne einer Neointima, die in den Autografts ausgeprägter erschien als in den Allografts. Die Kunststoffprothesen hingegen zeigten in 10% der Fälle eine komplette Thrombose des Gefäßlumens mit Verlegung der Blutstrombahn sowie ein nur diskontinuierlich ausgebildetes Neoendothel. Weiterhin wurde bei den arteriellen Substituten ein kompletter Verlust der muskulären Komponente der Tunica media einhergehend mit der Ausbildung einer stabilen Neointima, die die Funktion im Bereich der Tunica media übernahm, beobachtet. 1.2.2 Herkunft und Konservierung der Allografts Die heute mehrheitlich verwendeten Allografts werden im Rahmen von Multiorganentnahmen hirntoten Spendern explantiert und einer Gewebebank zur weiteren Präparation und Kryokonservierung zugeführt. Routinemäßig werden histologische, bakteriologische und virologische Tests an Specimen der Spenderallografts vorgenommen und das Spenderblut wird auf 13 Virusmarker, CMV, Herpes simplex, HIV und Hepatitiden untersucht. Auch werden die Blutgruppe des Spenders und die Major Histokompatibilitätskomplexe (MHC) untersucht, um später die Möglichkeit einer optimalen AB0-/ MHC- Kompatibilität mit dem Empfängerindividuum zu erreichen. Die Allografts selbst können angioskopisch in einem sterilen Medium unter Laminar- flow- Bedingungen untersucht werden, um eventuelle arterielle Läsionen auszuschließen. Beispielhaft sei die Prozessierung der Allografts kurz erläutert: Eine Dekontamination der Allografts wird erreicht durch eine 48h-Lagerung in einer Nährlösung, der Antibiotika und Fungizide zugesetzt werden. Im Anschluss daran wird die Gewebetemperatur der Arterien nach steriler Verpackung in einem Medium, das zu 10% die kryoprotektive Substanz Dimethylsulfoxid (DMSO) enthält, langsam computergestützt linear um 1 °C pro Minute gesenkt bis eine Gewebetemperatur von –40 ° C erreicht ist. Danach wird mit 5° C pro Minute bis auf -130° C gesenkt und anschließend der Allograft in der Dampfphase des flüssigen Stickstoffs bei etwa -190° C gelagert. DMSO wird zugegeben, um eine Ausbildung von intrazellulären Eiskristallen zu verhindern, die schädigend für die Struktur des Zytoplasmas sind. Die Methodik der Dekontamination und der Kryokonservierung ist weitgehend standardisiert. Dauer und Zusammensetzung der Antibiotikalösungen richten sich nach den lokalen Gegebenheiten sowie dem Stand des medizinischen Fortschritts. Die Einfrierprozedur ist einer Vielzahl von Parametern wie der Größe und Art des einzufrierenden Präparates, der Art der Einfrierkassette, der Verpackung u. v. a. anzupassen. 1.3 Entwicklung von synthetischen Gefäßprothesen Die Entwicklung synthetischer Gefäßprothesen schloss verschiedene Textilverbindungen wie Teflon, Orlon und Dacron ein und bediente sich unterschiedlicher Konstruktionstechniken wie Weben und Stricken35-38. Zurückzuführen sind diese Entwicklungen auf experimentelle Arbeiten von Voorhees et al. im Jahre 1952, welche beim Herzklappenersatz am Hundemodell eine Beschichtung von chirurgischen Seidennähten mit einem thrombusfreien Film beobachteten 22. Hieraus leitete sich ab, dass Prothesen biokompatibel sein müssen, d.h. aufgrund ihrer Beschaffenheit ohne nennenswerte Abstoßung oder Thrombosierung in die Blutbahn implantiert werden können. Der nächste Schritt in der Suche nach dem optimalen Gefäßsubstitut, stellte die Proteinbeschichtung der synthetischen Prothesen dar, die eine verminderte Porosität und Koagulabilität mit sich bringen sollte 39, 40. Doch trotz aller Weiterentwicklungen wie der Beschichtung durch antithrombolytische Moleküle oder Endothelzellbesiedlung, bleiben die 14 prinzipiellen Probleme dieser synthetischen Gefäßsubstitute die Neigung zur Thrombenbildung und die mangelnde Resistenz gegen Infektionen 41-46. 1.4 Nomenklatur und Klassifizierung der arteriellen Infektionen 1.4.1 Klassifikationen von Gefäßinfektionen Die historische Entwicklung der Nomenklatur der arteriellen Infektionen geht bis in das Jahr 1885 zurück, als Sir William Osler den ersten dokumentierten Fall von multiplen Aneurysmen der thorakalen Aorta bei bestehender Endokarditis beschrieb 50. Er führte dabei den heute gebräuchlichen Begriff des „mykotischen“ Aneurysmas ein. Patel und Johnston entwickelten 1977 unter der Berücksichtigung des bestehenden Gefäßstatus und der Infektionsquelle eine Klassifikation der mykotischen Aneurysmen 51. Wilson et al. schlugen 1978 eine Einteilung der Gefäßinfektionen in vier Kategorien vor: Mykotische Aneurysmen, infizierte Aneurysmen, bakterielle Arteritis und infizierte posttraumatische falsche Aneurysmen 52. Aufgrund der unzureichenden Berücksichtigung der Infektionsmechanismen entwickelten Moore et al. die Klassifikation weiter. Sie unterteilten dabei arterielle Infektionen nach ihrer Genese in mykotische Aneurysmen, bakterielle Arteritiden, Arteritiden durch eine benachbarte Infektion, infizierte Aneurysmen und Extensionen einer Protheseninfektion 53. 1.4.2 Klassifikationen von Prothesen- und Wundinfektionen in der Gefäßchirurgie Um die optimalen therapeutischen Möglichkeiten ausschöpfen und eine grundsätzliche systematisierte Einordnung von Infektionsrisiken vornehmen zu können, ist es essentiell, exakte Definitionen und Klassifikationen der Infektionsstadien von Protheseninfektionen festzusetzen. Auch um klinische Studien, Standards und Operationstechniken vergleichen zu können, sind derartige allgemeingültige Bezugsparameter unentbehrlich. Bereits 1972 führte Szyilagyi 1972 eine an morphologischen Gesichtspunkten orientierte Klassifikation postoperativer Infektionen ein. Die Klassifikation berücksichtigt die Eindringtiefe des Infektes in das Gewebe. Grad 1 stellt einen oberflächlichen kutanen Infekt dar, Grad 2 bezieht die Subcutis mit ein und Grad 3 ist definiert als tiefer, subfaszialer Infekt unter Einbeziehung des Transplantates 12. Im Gegensatz zu Szyilagyi orientierten sich Bandyk et al. 1991 bei der Zusammensetzung ihrer Klassifikation nicht an den morphologischen Gesichtspunkten sondern an den mikrobiologischen Befunden. Hierbei stellten sie einen Zusammenhang zwischen unterschiedlichen Infektionsarten, einer Früh- oder Spätinfektion nach Implantation und bestimmten Mikroorganismen her 47. Die umfangreiche Klassifikation der l`Association Universitaire de Recherche en Chirurgie, verbindet sowohl klinische, mikrobiologische als auch histologische Kriterien. Des Weiteren wird unterteilt in 15 Frühinfektionen innerhalb der ersten drei Monate und später auftretende Infektionen. In die Klassifikation gehen ebenso klinische Parameter wie eine Wundheilung per primam, ein makroskopisch sichtbarer Weichteildefekt und purulentes Sekret mit ein. Mikrobiologisch und histologisch orientiert sich die Einteilung an positiven Bakterienkulturen und histologischen Infektionsnachweisen 48. Diese Arbeit orientiert sich an der aktuellen CDC-Klassifikation (Centers for Disease Control and Prevention), die ein breites Spektrum postoperativer Wundinfektionen abdeckt und auch die klinisch relevanteste Klassifikation darstellt 49. Die Einteilung ist dabei wie folgt: A1 Oberflächliche postoperative Wundinfektion Infektion an der Inzisionsstelle innerhalb von 30 Tagen postoperativ, die nur Haut oder subkutanes Gewebe mit einbezieht und eines der folgenden Kriterien erfüllt: 1. eitrige Sekretion aus der oberflächlichen Inzision 2. kultureller Nachweis eines Mikroorganismus aus einem aseptisch entnommenen Wundsekret oder einer Gewebekultur von der oberflächlichen Inzision 3. Schmerz oder Empfindlichkeit; lokalisierte Schwellung; Rötung oder Überwärmung; 4. Diagnose des Chirurgen A2 Tiefe postoperative Wundinfektion Die Infektion tritt innerhalb der ersten 30 Tage postoperativ (innerhalb von einem Jahr, wenn Implantat in situ belassen wurde) auf. Die Infektion umfasst Faszien- und Muskelschicht. Zudem ist eines der folgenden Kriterien erfüllt: 1. eitrige Sekretion aus dem tiefen Einschnitt 2. Fieber (>38°C), lokalisierter Schmerz oder Empfindlichkeit 3. klinische Zeichen eines Abszess oder Verhaltes 4. Diagnose des Chirurgen A3 Infektion von Räumen und Organen im Operationsgebiet Die Infektion tritt innerhalb der ersten 30 Tage postoperativ (innerhalb von einem Jahr, wenn Implantat in situ belassen wurde) auf. Die Infektion erfasst Organe oder Körperhöhlen, die während der Operation geöffnet wurden oder an denen manipuliert wurde und erfüllt eines der folgenden Kriterien: 1. eitrige Sekretion aus einer Drainage, die Zugang zu dem Organ oder tiefen Raum hat 16 2. Isolierung eines Mikroorganismus aus steril entnommener Flüssigkeitskultur aus einem tiefen Organ oder Raum 3. klinische Zeichen eines Abszess oder Verhaltes 4. Diagnose des Chirurgen 1.5 Ursachen und Entstehungswege der Protheseninfektion Ursachen für die Entstehung einer Protheseninfektion sind neben dem Einbringen von Fremdmaterial in den Körper, die lokale Kontamination während der Implantation, die perkutane Besiedelung durch die Operationswunde und, durch Anbindung an die Blutstrombahn, die periund postoperative hämatogene Kontamination durch Bakteriämien 4, 54. Die höchste Prävalenz hat die lokale Kontamination 47. Hierbei verläuft die Protheseninfektion in vier Schritten ab. Zuerst kommt es zur bakteriellen Adhäsion an die Prothese, dann zur Bildung eines Biofilmes, unter dem sich Mikrokolonien bilden, was als dritten Schritt die Wirtsabwehr aktiviert. Zuletzt kommt es in einem vierten Schritt zur inflammatorischen Reaktion des die Prothese umgebenden Gewebes sowie der Gefäßanastomosen 1. Die klinischen Zeichen dieser Infektion sind die Autolyse des Gewebes, Gefäßwandrupturen, Anastomosenrupturen und Blutungen. Diese führen zu den klinischen Manifestationen als Sepsis, Abszess, Pseudoaneurysma und prothesio-digestive Fistel. Die Effektivität der angewandten Antibiotika sowie der immunologischen Abwehr wird beim Gebrauch von nicht-autologen, alloplastischen Grafts im Gegensatz zu autologen Grafts durch die fehlende Ausbildung von vaskulären Verbindungen zum Perigraftgewebe vermindert 25. Die Ausbildung derartiger Verbindungen ist auch bei arteriellen Allografts im tierexperimentellen Ansatz beschrieben worden 25, 31, 32. Weitere infektionsbegünstigende Faktoren sind das Persistenzverhalten des Mikroorganismus und die physikochemischen Eigenschaften des Prothesenmaterials. So hemmt und inaktiviert beispielsweise Staph. aureus durch die Fähigkeit, unterschiedliche Enzyme und Exotoxine zu bilden, die körpereigene Immunabwehr, während Staph. epidermidis seinerseits durch die Ausbildung einer Mucinkapsel der Immunabwehr entgeht. Aber auch die physikochemischen Eigenschaften des Prothesenmaterials spielen bei der Entstehung einer Infektion eine große Rolle. So vermutete Roon 1977, dass die Persistenz einer Prothese gegen eine hämatogene Kolonisation von der Integrität der Neointima der Protheseninnenseite abhängt. Im Zuge dieser Feststellung zeigte Roon, dass Dacron-Prothesen bei Implantation in ein infiziertes Gebiet eine 2,5fach höhere Infektionsinzidenz als PTFE-Prothesen besitzen. Dies führte er auf die unterschiedliche Pseudointimabildung dieser Prothesenmaterialien zurück 55. 17 Eine prognostisch ungünstige Situation stellt das Auftreten einer sogenannten prothesio-digestiven Fistel dar. Zahlreiche Studien belegen eine deutlich erhöhte Morbiditäts- und Mortalitätsrate einer untersuchten Patientenpopulation mit Gefäß- bzw. Protheseninfektionen im Bereich der infrarenalen Aorta beim gleichzeitigen Auftreten einer prothesio-digestiven Fistel 9, 56-61. 1.6 Zielsetzung und Fragestellung der Arbeit Ziel der vorliegenden Arbeit ist es, im Rahmen einer retrospektiven, klinischen Studie die Wertigkeit von kryokonservierten Allografts zur In-situ-Rekonstruktion der arteriellen Gefäßstrombahn bei Protheseninfektionen im Stadium A2-A3 der CDC-Klassifikation für postoperative Wundinfektionen im Bereich der abdominellen Aorta, der Iliacal- und Femoralgefäße zu ermitteln. Dabei sollen folgende Fragestellungen untersucht werden: 1. Welche Voroperationen wurden wann durchgeführt, wie wurde die Infektion diagnostiziert und in wieweit korrelieren prä- und intraoperative Befunde? Wie hoch war die Dauer der durchschnittlichen postoperativen Intensivüberwachung, wie lang der postoperative Krankenhausaufenthalt? 2. Wie sind die Ergebnisse (Mortalität, Offenheitsrate, Reoperationen) nach Gefäßersatz mit kryokonservierten Allografts bei Vorliegen einer Gefäß- resp. Protheseninfektion? 3. Unterscheiden sich kryokonservierte Allografts zur Behandlung von Protheseninfektionen bezüglich der kurz- und mittelfristigen Mortalität von traditionellen Behandlungskonzepten (Vergleich mit der Literatur)? 4. Welche Faktoren beeinflussen die perioperative und mittelfristige Mortalität? Als Beispiele seien genannt: aorto-enterische Fisteln, Infektionen mit ORSA, gleichzeitige Präsenz von unterschiedlichen kardiovaskulären Risikofaktoren sowie unterschiedliche Lokalisationen der operativen Eingriffe. 18 2. Patienten und Methoden 2.1 Vorstellung des Patientenkollektives Das hier beobachtete und statistisch ausgewertete Patientenkollektiv setzt sich aus 45 Patienten zusammen, die zwischen Februar 2000 und April 2004 mit Infektionen im Bereich der infrarenalen Aorta und weiter distal liegenden arteriellen Gefäßabschnitten unter Verwendung eines kryokonservierten arteriellen Allografts in der Klinik für Thorax-, Herz- und Gefäßchirurgie (heute Klinik für Herz-, Thorax-, Transplantations- und Gefäßchirurgie) mit den Standorten Klinikum Hannover Oststadt und Medizinische Hochschule Hannover operiert wurden. Es handelt sich um eine retrospektive, klinische Studie. Die Auswertung erfolgte anhand der Patientenakten, der klinischen Nachkontrollen im Rahmen der Gefäßsprechstunde der Medizinischen Hochschule Hannover sowie eines standardisierten Telefoninterviews. 2.1.1 Statistische Methoden Für die deskriptive statistische Ausarbeitung wurden die epidemiologischen Daten, die Art und Häufigkeit der Voroperationen, die Verteilung der präoperativen Risikofaktoren, die Zeitdauer zwischen Voroperation und Allograftimplantation sowie die Art des / der implantierten Allografts in ihren Verteilungshäufigkeiten aufgeschlüsselt. In einem nächsten Schritt wurden dann die erhobenen Ergebnisse auf eine signifikante Differenz getestet. Da es sich hier primär um eine Anwendungsbeobachtung handelt, wurde der statistischen Analyse keine explizite Fallzahlanalyse vorausgeschickt. Die Analyse der kardiopulmonalen Risikofaktoren pAVK, KHK, arterielle Hypertonie, Adipositas, Diabetes mellitus und chronische Niereninsuffizienz erfolgte in einem ersten Schritt deskriptiv mit Verteilung der Häufigkeiten. In einem zweiten Schritt wurde dann der Einfluss des Vorhandenseins eines Risikofaktors auf die postoperative Mortalität errechnet. Das Signifikanzniveau wurde hierbei auf α ≤ 0,05 festgelegt. Die Auswertung der operationsspezifischen Daten (Operationsindikation, Operationslokalisation, perioperativer Keimnachweis, Art der Voroperation, Art des implantierten Allografts, Reoperationen, postoperativer Aufenthalt auf der Intensivstation und Länge des postoperativen Krankenhausaufenthaltes) erfolgte ebenfalls in einem ersten Schritt deskriptiv mit Verteilungshäufigkeiten, Minimum, Median, Mittelwert und Maximum. In einem zweiten Schritt wurden auch hier die signifikanten Einflüsse auf die perioperative Morbidität und Mortalität errechnet. 19 Die erhobenen Daten wurden mit Hilfe eines Personalcomputers und dem statistischen Auswertungsprogramm SPSS Version 13.0 gesammelt, laufend aktualisiert und ausgewertet. Die deskriptiven Berechnungen wurden mittels Kreuztabellierung durchgeführt, die Einflüsse einzelner oder Gruppen von Risikofaktoren auf Mortalität und Morbidität wurden unter Verwendung der Kaplan-Meier-Funktion, des Log-Rang-Testes und der Cox-Regressionanalyse berechnet. Dabei wurden in einem ersten Schritt sämtliche erhobenen Variablen mit Hilfe der Kaplan-Meier-Funktion und des Log-Rang-Testes auf Signifikanzen getestet. In einem zweiten Schritt erfolgte dann der Quervergleich der erstellten signifikanten Unterschiede unter Verwendung der Cox-Regressionsanalyse. Dabei macht man sich zu Nutze, dass mit Hilfe der Kaplan-Meier-Funktion ein Überblick über die Erfüllung der Proportionalitätsannahme gewonnen wird, worauf dann in einem nächsten Schritt der nichtparametrische Log-Rang-Test als Standardverfahren in der Überlebenszeitanalyse für einfache Gruppenvergleiche Anwendung findet. Er erlaubt eine statistische Überprüfung, ob das (Mortalitäts-) Risiko in zwei Gruppen verschieden ist. Abschließend lässt sich dann mit der Cox-Regressionsanalyse der Einfluss von mehreren Variablen auf eine Überlebenszeit untersuchen. Aussagen zum relativen Risiko sind dabei prinzipiell zwar möglich, aber aufgrund der geringen Fallzahlen in einigen untersuchten Gruppen nicht sinnvoll und wurden daher nicht durchgeführt. 2.1.2 Studieneinschlusskriterien Folgende Einschlusskriterien für diese Studie wurden festgelegt: 1. prä- und intraoperative Diagnose eines mykotischen Aneurysmas, oder 2. Voroperation im aorto-iliaco-femoralen Bereich mit Kunststoffprothesenimplantation, 3. prä-, intra- oder postoperativ Beweis der Infektion mittels (eines der folgenden Kriterien): a) positivem Keimnachweis, b) Definition einer Wundinfektion im Stadium A2-A3 nach der CDC-Klassifikation, c) präoperativ sono- oder computertomographisch nachgewiesener periprothetischer Flüssigkeitssaum, d) erhöhten Serumentzündungszeichen bei Aufnahme (Leukozyten, CRP) 2.2 Präoperative Befunde Als kardiopulmonale Risikofaktoren werden in dieser Arbeit eine arterielle Hypertonie, Diabetes mellitus, pAVK, chronische Niereninsuffizienz, Adipositas und koronare Herzkrankheit gewertet 62-64 . 20 Eine arterielle Hypertonie besteht bei Ruhewerten von systolisch > 140 mmHg und diastolisch > 90 mmHg. Sämtliche hypertensive Patienten waren unter antihypertensiver Therapie normoton, wurden jedoch aufgrund des zugrunde liegenden Krankheitsbildes als hypertensiv eingestuft. Ein Diabetes mellitus lag vor, wenn Nüchtern-Plasmaglucose-Werte ≥ 126 mg/dl gemessen wurden sowie bei einem pathologisch ausfallenden oralen Glukose-Toleranz-Test mit einem 2hWert ≥ 200 mg/dl. Sämtliche diabetische Patienten waren perioperativ nach aktuellen Behandlungsstrategien, welche die phasengerechte Stufentherapie des Typ 2-Diabetes mit oralen Antidiabetika und ggf. eine Kombinationstherapie mit Insulinpräparaten umfasste, medikamentös eingestellt 64-66. Eine periphere arterielle Verschlusskrankheit wurde bei folgenden Befunden diagnostiziert: periphere Ischämiezeichen wie kühle Hauttemperatur, Blässe, Nekrosen, nicht palpable distale Pulse (A. poplitea, A. tibialis posterior, A. dorsalis pedis), Auskultation pulssynchroner Stenosegeräusche. Spezielle nicht-invasive und invasive apparative Untersuchungsmethoden wie Doppler- und Duplexsonographie, präoperative Angiographie und präoperative CT- Aufnahmen ergänzten die Diagnostik. Doppler-Verschlussdruckwerte unter 60 mmHg (Knöchel-Arm-Index < 0,4) belegen eine kritische Ischämie und damit eine Gefährdung der Extremität. Farbkodierte Duplexsonographie, Spiral-Computertomographie und digitale Substraktionsangiographie vervollständigten bei Bedarf die präoperative Diagnostik. Eine chronische Niereninsuffizienz wurde definiert als Einschränkung der Kreatinin-Clearance und der Konzentrationsfähigkeit bei noch normalen Retentionswerten im Serum 68. Ein Körpermassenindex (Body Mass Index, BMI) ≥ 25,0 wurde als Übergewicht definiert 69. Die koronare Herzkrankheit wurde definiert als koronarangiographisch oder myokardszintigraphisch nachgewiesene Manifestation der Atherosklerose in den Herzkranzgefäßen oder bei im EKG sichtbaren Zeichen eines abgelaufenen Myokardinfarktes 70. 2.3 Operationsindikationen Von 45 Patienten präsentierten sich 39 mit einer Primärgraftinfektion (PGI), bei sechs Patienten kompliziert durch eine aorto-enterischen Fistel, die übrigen sechs Patienten stellten sich mit der Komplikation eines mykotischen Aneurysmas (MA) vor. Die Indikation zur Implantation eines kryokonservierten arteriellen Allografts wurde streng nur bei eindeutigen präoperativen invasiven und nicht-invasiven Untersuchungsergebnissen sowie einer entsprechenden Klinik des Patienten gestellt. Bei stationärer Aufnahme der an den infrarenalen Gefäßabschnitten voroperierten Patienten erfolgte abhängig vom klinischen Erscheinungsbild - kreislaufstabil, instabil, septisch – 21 eine angepasste präoperative Diagnostik zur Wahl des geeigneten Operationsverfahrens. Bei kreislaufinstabilen, septischen Notfallpatienten, bei denen aufgrund der operativen Vorgeschichte in Kombination mit der entsprechenden Klinik, der Verdacht auf Ruptur auf dem Boden einer prothetischen Infektion bestand, beschränkte sich die Diagnostik auf Sonographie, Notfall-CT und ggf. bei offenen Ulcera und Wunden auf die Abstrichentnahme zur mikrobiologischen Diagnostik. Die intraoperativen Abstriche wurden sowohl von der eventuell bereits implantierten Kunststoffprothese als auch vom umliegenden Gewebe entnommen, die präoperativen Abstriche aus bereits existenten, zugänglichen Wundhöhlen. Zeigte die Notfall-CT typischerweise einen Flüssigkeitssaum mit einem für eine Abszessformation sprechenden Randenhancement um die Prothese und war die klinische Situation des Patienten mit einer schweren Infektion vereinbar, so wurde die Indikation zum Prothesenersatz durch biologisches Material gestellt. Bei kreislaufstabilen Patienten konnte die präoperative Diagnostik ausgedehnt werden. Sie umfasste eine klinische Basisdiagnostik bei Aufnahme, sowie umfassende invasive und nicht-invasive Untersuchungsmethoden. 2.4 Operationstechniken Die bei diesem Patientenkollektiv angewandten Operationstechniken entsprechen den allgemein üblichen, etablierten Vorgehensweisen bei Operationen an der infrarenalen Aorta, den Becken- und Beingefäßen 71. Sämtliche Eingriffe fanden in Intubationsnarkose (ITN) statt, postoperativ wurden die Patienten zur Überwachung in der Regel auf die Intensivstation verlegt. Typischerweise erfolgen in ITN und Rückenlage zunächst die Desinfektion und das sterile Abdecken des Operationsgebietes. Anschließend wird das Operationsfeld mit einer medianen Laparotomie eröffnet, etwaige intraperitoneale Verwachsungen werden gelöst, ein Retraktorsystem eingebracht und der Dünndarm in feuchten Bauchtüchern nach rechts herausgelagert oder abgedrängt. Jetzt erfolgen die Darstellung der Aortenbifurkation (Abb. 1) und der Iliacalarterien unter Schonung der Ureteren. Der nächste Schritt beinhaltet das Schaffen einer infrarenalen aortalen Klemmebene, ggf. auch einer suprarenalen Klemmebene, das Entfernen eventueller störender Verwachsungen und die Darstellung der großen intraperitonealen, arteriellen Gefäßabgänge der Aorta. Diese Schritte müssen den vorliegenden Befunden entsprechend angepasst werden. Wurde zuvor eine aortobiiliakale Prothese implantiert, so ist die Darstellung und die Schaffung einer Klemmebene auf die A. iliaca externa resp. interna auszudehnen. Im Anschluss daran werden sowohl die Aorta infrarenal als auch die Iliacalarterien abgeklemmt und die Aortenprothese eingeschnitten. Nun folgend wird das gesamte vorhandene Prothesenmaterial sorgfältig entfernt, Abstriche werden entnommen, es wird mit Braunol® (Braun, Melsungen, Deutschland) und Nebacetin® 22 (Yamanouchi Pharma, Heidelberg, Deutschland) gespült und anschließend der kryokonservierte, arterielle Allograft in das durch ausführliches Wunddebridement vorbereitete Gefäßbett gesetzt (Abb.2). Proximale und distale Anastomose werden mit Prolene (Polypropylen, Ethicon, Norderstedt, Deutschland) 3/0 oder 4/0 fortlaufend genäht, die notwendigen Aortenabgänge wie die A. mesenterica superior oder die Nierenarterien reimplantiert und die Anastomosensuffizienz durch anschließende Freigabe des Blutstromes geprüft. Die intraoperativ vorgenommene Heparinisierung mit 100 I.E. Heparin/ kg KG i.v. (Braun, Melsungen, Deutschland) wird abschließend durch Gabe von Protamin (ICN Pharmaceuticals Germany, Frankfurt/Main, Deutschland) in Dosierungen von 1000-5000 I.E./ml antagonisiert. Nun wird nach Sistieren der Blutung der Darm zurückverlagert. Die sonst übliche Graft-Inclusion oder der Verschluss des Retroperitoneums sind meist aufgrund des vorangegangenen Debridements und der Voroperationen nicht durchführbar. Zusätzliche Pathologien wie eine Unterbrechung der Darmwandkontinuität werden durch eine Keilresektion oder Segmentresektion versorgt. Diese Bereiche werden ebenso wie ein debridierter Wirbelkörperabszess anschließend mit einer Omentumplastik – sofern noch Omentum majus vorhanden – plombiert. Weiterhin wird hier und im Bereich des Allografts insbesondere der Anastomosen nebacetingetränkter Fibrinkleber appliziert. Eine Drainage wird in das kleine Becken und die Anastomosenregion eingelegt. Der Faszienverschluss wird mit einreihiger Polydioxanon-Naht der Stärke 1 (PDS, Ethicon, Norderstedt, Deutschland) vorgenommen. Als Operationsabschluss folgen die Einlage einer subkutanen Redondrainage, der schichtweise Wundverschluss über Einzelknopfsubkutannähte und abschließende Einzelknopfhautnähte sowie der sterile Verband. Im Gegensatz zu den Operationen an der infrarenalen Aorta sind bei Eingriffen an den Beckenund Beingefäßen andere Zugangswege notwendig. Bei Zugängen in der Beckenregion wird ein Hockeyschlägerschnitt zur retroperitonealen Eröffnung des Operationsfeldes bevorzugt, bei Eingriffen an den Beingefäßen unterhalb des Leistenbandes bevorzugt man die Inzision direkt über dem betroffenen Gefäß. Nach Darstellung wird das Zielgefäß mobilisiert und die entsprechende Anastomose aufgesucht. Vor der Inzision des Gefäßes / der Prothese wird eine Klemmung oder Blockung mit Hilfe eines Fogarty-Katheters vorgenommen. Bei verschlossenem oder hochgradig stenosiertem Gefäß werden eine intraoperative Angiographie und gegebenenfalls eine Thrombendarteriektomie durchgeführt. Präsentiert sich die Prothese infiziert, so wird sie wie bei den infrarenalen Eingriffen nach einem ausführlichen Wunddebridement komplett entfernt und durch einen arteriellen Allograft im Sinne eines iliaco-femoralen oder femoro-distalen Bypass ersetzt. Die Anastomosen bei diesen distalen Eingriffen werden in der Regel im Gegensatz zu den 23 Operationen an der infrarenalen Aorta mit 5/0 Prolene® (Polypropylen, Ethicon, Norderstedt) in fortlaufender Nahttechnik angelegt. Auch hier erfolgt der schichtweise Wundverschluss mit Polydioxanon -Einzelknopfsubkutannähten und nicht resorbierbaren Einzelknopfhautnähten oder Klammern. Abbildung 1 Abbildung 2 Abbildung 1 Intraoperativer Befund einer infizierten aortalen Primärprothese. Links befindet sich die Aortenklemme, die ehemalige, pusgefüllte Graft-Inclusion ist eröffnet. Man erkennt die Dacronprothese und die distale Anastomose in der Bildmitte. Abbildung 2 Situs wie in Abb. 1 nach Fertigstellung der proximalen termino-terminalen Anastomose zwischen Aorta infrarenal und dem kryokonservierten, arteriellen Allograft. Die Iliakalschenkel sind mit einer Klemme gefasst. Die A. renalis dextra ist distal der angeschlungenen V. renalis sinistra erkennbar. 2.5 Herkunft und präoperative Präparation der Aortenallografts Die in dieser Studie verwendeten Allografts wurden im Rahmen der postmortalen Organspende entsprechend dem Transplantationsgesetz explantiert und einer Gewebebank zur weiteren Präparation und Kryokonservierung zugeführt. Die Entnahme wird derzeit in Deutschland von der gemeinnützigen Deutschen Stiftung Organtransplantation koordiniert. Die humanen Allografts wurden bei Bedarf per Notfallanforderung von einer Gewebebank einer Tochter der Deutschen Stiftung Organtransplantation, seinerzeit der gemeinnützigen Gesellschaft für Gewebespende mit Sitz in Hannover (heute Deutsche Gesellschaft für Gewebespende) angefordert. Vor Implantation der kryokonservierten, arteriellen Allografts müssen diese nach einem festgelegten Schema präoperativ präpariert werden (Abb. 3 -6). Diese Präparation findet während der Operation im Operationssaal statt und umfasst das Auftauen, Waschen des Grafts (Abb. 4) sowie die Versorgung der Seitenäste mit Durchstechungsnähten (Abb. 5). Im Gegensatz zum Kryokonservierungsprozeß ist das Auftauen ein rascher Vorgang, bei dem der Graft, nachdem er bis auf 4° C aufgetaut ist, in ein 42° C warmes Wasserbad eingelegt wird. Anschließend wird der Graft in Lösungen (bis 2003 M-199, anschließend physiologische Kochsalzlösung) mit absteigender Dimethylsulfoxid- 24 (DMSO)-Konzentration gewaschen (Abb. 4-6). Ziel ist die vollständige Entfernung des cytotoxisch wirkenden DMSO. Abbildung 3 Abbildung 4 Abbildung 3 Herausnahme des inneren sterilen Beutels mit kryokonserviertem Allograft unter sterilen Bedingungen im Operationssaal. Abbildung 4 Auftauen und Auswaschen des kryokonservierten, arteriellen Allografts: Eine Iliakalbifurkation in M-199 während der Spülung des Lumens über eine großlumige Kanüle. Links in der Schale befindet sich ein noch nicht präparierter Graft mit Adventitia. Abbildung 5 Abbildung 6 Abbildung 5 Ligieren der nicht benötigten Seitenäste vor Implantation Abbildung 6 Allograft nach Präparation und vor Implantation. Um die benötigte Länge zu erreichen wurden vier Allograftsegmente termino-terminal anastomosiert. 25 3. Ergebnisse 3.1 Demographische Daten und Indikationen Insgesamt 45 Patienten wurden in diese klinische Studie aufgenommen. Es handelte sich dabei um 32 Männer (71,1%) und 13 Frauen (28,9%) im Alter zwischen 40 und 89 Jahren (durchschnittliches Alter 64,8 Jahre, medianes Alter 65 Jahre, Abb. 7). Abbildung 7 Altersverteilung nach Geschlecht Die Behandlung bestand in 29 intraabdominellen (64,4%) und 16 ausschließlich extraabdominellen (35,6%) Eingriffen. Dreiunddreißig Patienten präsentierten sich mit einer isolierten Primärgraftinfektion (PGI:73,3%), sechs Patienten mit einer Kombination aus einer Primärgraftinfektion und einer prothesio-digestiven Fistel (AEF: 13,3%), sechs weitere Patienten mit einem mykotischen Aneurysma (MA:13,3%). Der postoperative Beobachtungszeitraum betrug sieben Tage (diese Patientin verstarb eine Woche postoperativ) bis 1162 Tage (Mittelwert 309 Tage, Median 82 Tage). Eine arterielle Hypertonie wurde bei 34 von 45 Patienten (75,6%) diagnostiziert. Zehn Patienten (22,2%) hatten einen Diabetes mellitus (alle Typ 2), 35 Patienten (77,8%) litten an einer pAVK in den Stadien 2b bis 4 nach Fontaine. Weiterhin hatten 13 Patienten (28,9%) eine chronische Niereninsuffizienz, acht Patienten (17,8%) waren übergewichtig. An einer koronaren Herzkrankheit litten 20 Patienten (44,4%), zehn Patienten (22,2%) hatten anamnestisch einen 26 Myokardinfarkt erlitten. Weitere vier Patienten (8,9%) waren bereits mehrfach abdominell im späteren Operationsgebiet voroperiert (Tab. 1). Tabelle 1 Präoperative Befunde Kardiovaskuläre Risikofaktoren Anzahl der Patienten Prozent an der Gesamtzahl pAVK Grad 2b – 4 35 77,8 arterielle Hypertonie 34 75,6 KHK 20 44,4 chronische Niereninsuffizienz 13 28,9 Nikotinabusus 12 26,6 Myocardinfarkt in Vorgeschichte 10 22,2 Diabetes mellitus Typ 2 10 22,2 Adipositas 8 17,8 multiple Voroperationen 4 8,9 Sigmadivertikulitis 4 8,9 Wirbelkörperabszess 4 8,9 rezidivierende Septikämien 4 8,9 HCV- Infektion 3 6,7 HBV- Infektion 3 6,7 Bauchaortenaneurysma 3 6,7 Herzinsuffizienz NYHA 2b - 3 3 6,7 keine der genannten Erkrankungen 11 24,4 3.2 Voroperationen Bei stationärer Aufnahme präsentierten sich sechs Patienten (13,3%) ohne Voroperation an den aorto-iliacalen und aorto-femoralen Gefäßabschnitten (Tab. 2). Die übrigen 39 Patienten (86,7%) waren an den entsprechenden Gefäßen mit Kunststoffprothesen oder Venenstreifenplastiken behandelt worden. Die Implantation einer aorto-bifemoralen bzw. aorto-biprofundalen Gefäßprothese aus Dacron oder aus PTFE (Polytetrafluorethylen) stellte die Erstoperation bei 13 Patienten (28,9%) dar. Eine Rohrprothese erhielten drei Patienten (6,7%) zum infrarenalen Aortenersatz, sechs Patienten (13,3%) eine aorto-biiliacale Gefäßprothese. Weitere vier Patienten (8,9%) wurden mit einem einseitigen femoro-distalen Kunststoff-Bypass primär versorgt, neun Patienten (20%) mit einem aorto-iliaco-femoralen einseitigen Gefäßersatz und ein Patient (2,2%) mit einem iliaco-iliacalen Querbypass. Primär mit einer Venenpatchplastik wurden drei Patienten 27 (6,7%) behandelt, dabei führte eine spätere Infektion dieser Ersatzplastik zur Implantation eines arteriellen Allografts. Tabelle 2 Voroperationen bei 45 Patienten Patient Alter Geschlecht (Jahre) Voroperationen Zeitraum OP Allograft - Implantation Monate Infektionsort 1 89 W Fem.-pop. Bypass re. 3 A. femoralis. com. re. 2 63 M infrarenale Rohrprothese 33 proximale Anastomose 3 40 M Femoralpatchplastik re. 0,75 A. femoralis. com. re. 4 58 M Iliaco-pop. Bypass li. 2 A. femoralis. superf. li. 5 80 W Iliaco-prof. Bypass li. 180 A. iliaca com. re. 6 66 M Keine keine Voroperation A. iliaca com. li. 7 72 M Keine keine Voroperation Aa. iliacae com. 8 52 W Aorto-bifemorale Y-Prothese 24 A. femoralis. superf. li. 9 73 M Aorto-biiliacale Y-Prothese 144 Duodenum 10 75 M Aorto-biiliacale Y-Prothese 60 A. iliaca externa li. 11 72 M Aorto-biiliacale Y-Prothese 72 distale Anastomose re. 12 76 W Aorto-biiliacale Y-Prothese 1 proximale Anastomose 13 75 W Aorto-bifemorale Y-Prothese 36 A. femoralis. prof. li. 14 55 M Aorto-bifemorale Y-Prothese 0,75 distale Anastomose 15 42 M Femoralpatchplastik re. 0,25 A. femoralis. com. re. 16 61 W Aorto-biprof. Y-Prothese 36 Prothesenbifurkation 17 82 M Iliaco-femoraler Bypass li. 48 A. iliaca interna li. 18 58 M Aorto-bifemorale Y-Prothese 120 proximale Anastomose 19 42 W Iliaco-fem. Bypass re. 3 A. iliaca externa re. 20 74 W Aorto-bifemorale Y-Prothese 180 A. femoralis. prof. li. 21 63 M Keine keine Voroperation 22 75 M Keine keine Voroperation A. femoralis. prof. li. A. femoralis. com. / A. femoralis. prof. re. 23 75 W Iliaco-fem. Bypass li. 84 A. iliaca com. li. 24 65 M Aorto-biprof. Y-Prothese 120 A. femoralis. prof. re. 25 72 M Keine keine Voroperation A. iliaca externa re. 26 67 M Iliaco-fem. Bypass re. 3 A. femoralis. com. re. 27 67 M Keine keine Voroperation A. iliaca com. li. 28 67 M Iliaco-fem. Bypass li. 3 A. femoralis. com. li. 28 Tabelle 2 Voroperationen bei 45 Patienten 29 69 M Fem.-pop. Bypass re. 2 A. femoralis. com. re. 30 66 M Fem.-pop. Bypass re. 0,25 A. femoralis. com. re. 31 49 W 2x Iliaco-fem. Bypass re. 2 Aa. iliacae comm. 32 72 M Aorto-bifemorale Y-Prothese 192 distale Anastomose bd. 33 51 W Aorto-bifemorale Y-Prothese 1 A. iliaca com. li 34 62 M Aorto-bifemorale Y-Prothese 96 Aa. fem. prof. bd. 35 65 W Iliaco-iliacaler Querbypass 1 A. fem. prof. re. 36 60 M Aorto-biprof. Y-Prothese 120 Duodenum 37 63 M infrarenale Rohrprothese 1 Duodenum 38 70 M Fem.-pop. Bypass re. 1 A. fem. prof. re. 39 58 M perirenale Rohrprothese 108 proximale Anastomose 40 61 M Aorto-bifemorale Y-Prothese 204 Duodenum 41 56 M Aorto-biiliacale Y-Prothese 3 proximale Anastomose 42 56 M Aorto-biiliacale Y-Prothese 48 A. iliaca com. li. 43 64 W Aorto-biiliacale Y-Prothese 96 A. fem. prof. li. 44 64 M infrarenale Rohrprothese 38 Duodenum 45 74 M Aorto-bifemorale Y-Prothese 204 Aa. iliacae comm. 3.3 Präoperative Diagnostik Bei allen Patienten, mit Ausnahme der Patienten, die aufgrund einer akuten Ruptur (8 Patienten), eines starken Blutverlustes (5 Patienten) oder eines akuten Gefäßverschlusses (3 Patienten) eine Notoperation benötigten, wurden präoperativ Duplex-Ultraschalluntersuchungen durchgeführt ergänzt entweder durch eine Computertomographie (Abb. 8) oder eine digitale Subtraktionsangiographie (Abb. 9), um einen Infektionsherd lokalisieren bzw. ausschließen zu können. Alle Patienten erhielten gemäß der präoperativ angelegten Blutkulturen und der prä- und intraoperativ abgenommenen Abstriche und Gewebeproben (Abb. 10) eine Infektionsprophylaxe mit jeweils abgestimmten Antibiotika für mindestens zwei Wochen. Im Anschluss an diese Zeitspanne wurde die spezifische, resistogrammgerechte Antibiotikabehandlung für mindestens weitere vier Wochen fortgesetzt, abhängig von den klinischen und laborchemischen Parametern. Die verwendeten Antibiotika orientierten sich an der jeweiligen Keimbestimmung und der entsprechenden Resistenzlage. Zu den angewandten Antibiotika gehörten Metronidazol, Ciprofloxacin, Amoxicillin, Teicoplanin, Vancomycin und Linezolid. 29 Bei nicht nachweisbarem Erreger erhielten die Patienten vor einer resistogrammgerechten Therapie Clindamycin oder Vancomycin. Abbildung 8 Abbildung 9 Abbildung 8 Präoperative CT: Es zeigt sich eine aorto-enterische Fistel an der infrarenalen Aorta abdominalis. Dieser Patientin war initial eine aorto-biprofundale Y-Prothese implantiert worden. Bei protrahierter Infektsituation mit Ausbildung einer aorto-enterischen Duodenalfistel erfolgte dann der In-situ Ersatz mit kryokonservierter arterieller aorto-biprofundaler Allograft-Y-Prothese (Pat. 16, Tab. 11) Abbildung 9 DSA einer aorto-enterischen Fistel nach Primärimplantation einer infrarenalen Rohrprothese. Die digitale Subtraktionsangiographie zeigt einen Kontrastmittelaustritt oberhalb der Aortenbifurkation mit Anfüllen eines benachbarten Darmabschnittes (Pat. 44, Tab. 11). Abbildung 10 Abbildung 11 Abbildung 10 Intraoperativ für Histologie und zur Erregerdiagnostik entnommenes infiziertes Prothesensegment. Es ist deutlich ein schmierig belegtes Prothesenlumen mit frischen Thrombusanteilen zu erkennen. Abbildung 11 Die postoperative DSA zeigt beidseits deutliche Sklerosierungen und Stenosen im Bereich der Oberschenkelstrombahn sowie linksseitig einen intakten, gut perfundierten Allograft-Bypass auf das erste Poplitealsegment (Pat.30, Tab. 11). Die klinischen und apparativen Kontrolluntersuchungen der implantierten Grafts waren kurz vor Entlassung während des stationären Aufenthaltes sowie routinemäßig drei, sechs und zwölf Monate nach Entlassung geplant. Allerdings haben nicht alle Patienten ein lückenloses Follow-up erfahren können, da aus unterschiedlichsten Gründen Termine nicht wahrgenommen bzw. auch eine weitere Anbindung nicht gewollt wurden. Aufgetretene Probleme des implantierten Allografts 30 wurden weiterhin sowohl klinisch als auch durch DSA (Abb. 11 u. 13), CT oder MRT sowie teilweise mittels dreidimensionaler Rekonstruktion (Abb. 12) verifiziert. Abbildung 12 Abbildung 13 Abbildung 12 3D-Rekonstruktion zur klinischen Verlaufskontrolle. Der aorto-biiliakale Allograft zeigt eine gute Wandintegrität. Es ist weder Aneurysma noch Stenose zu erkennen (Pat. 10, Tab. 11). Abbildung 13 Die zur postoperativen Verlaufskontrolle durchgeführte DSA zeigt einen intakten aorto-biiliakalen arteriellen Allograft (Pat. 11, Tab. 11). 3.4 Bakteriologische Befunde Präoperativ gelang bei 33 Patienten (73,3%) ein Erregernachweis. Dieser wurde über eine Blutkultur (8 Patienten) oder über einen direkten Abstrich (25 Patienten) gewonnen. Dies führte zu einer an das Antibiogramm angepassten antibiotischen Therapie (Tab. 3). Bei 14 von 45 Patienten (31%) bestand bereits eine Mischbesiedelung aus unterschiedlichen bakteriellen und mykotischen Erregern, welche eine adäquate Therapie erschwerte. Bei zwölf von 45 Patienten (26,7% der Gesamtpatientenzahl) konnte trotz intensiver mikrobiologischer Aufarbeitung und des Versuches der kulturellen Anzüchtung und Bebrütung der sowohl wenn möglich präoperativ, als auch intraoperativ und postoperativ entnommenen Abstriche kein pathologisch infektionsträchtiger Erreger nachgewiesen werden. Diese negativen Befunde bestanden trotz stets auch im Blutbild nachweisbarer Infektionszeichen wie erhöhten Leukozytenzahlen und CRP. 3.5 Zeitspanne zwischen Voroperation und Allograftimplantation Bei drei Patienten (6,7%) betrug die Zeitspanne zwischen Voroperation und Allograftimplantation weniger als einen Monat, bei fünf weiteren Patienten (11%) lag die Zeitspanne zwischen einem und zwei Monaten (Tab. 4). Insgesamt zeigte sich eine Zeitspanne bis zum Auftreten einer Infektion von 0-204 Monate nach Erstoperation (Mittelwert 51 Monate, Median 24 Monate). 31 Tabelle 3 Perioperativ nachgewiesene Erreger Nachgewiesene Erreger Häufigkeit Prozent der n nachgewiesenen Keime Staph. aureus, davon 30 44,11 % ORSA 8 11,76 Enterococcus faecalis 7 10,29 E. coli 7 10,29 Candida albicans 5 7,35 Proteus mirabilis 2 2,94 Salmonella enteritis 2 2,94 Pseudomonas aeruginosa 3 4,41 Corynebact. spp. 3 4,41 Gramneg. Stäbchen 4 5,88 Bacteroides spp. 2 2,94 Citrobacter koseri 2 2,94 Moraxella spp. 1 1,47 Tabelle 4 Prozentuale Verteilung der Zeitspanne zwischen Voroperation und Allograftimplantation Monate Häufigkeit n Prozent % keine Voroperation 6 13,3 <1 3 6,7 1-3 10 22,2 4-48 6 13,3 49-120 9 20,0 121-204 11 24,5 3.6 Intraoperative Befunde 3.6.1 Infektlokalisationen Im Folgenden sind die intraoperativ erhobenen Befunde zur Infektlokalisation, dessen Ausbreitung und der daraufhin durchgeführten Operation aufgeführt. Der intraoperative Befund entsprach im Wesentlichen den bereits präoperativ mittels Ultraschall, Magnetresonanztomographie oder Computertomographie festgestellten Befunden. Verständlicherweise konnte die genaue Ausprägung und Ausbreitung des Infektes durch die 32 intraoperative Darstellung noch besser festgestellt werden. Von den 45 behandelten Patienten präsentierten sich 29 mit einer den abdominellen Bereich einschließenden Infektion (64,4%) und 16 mit einer ausschließlich extraabdominellen Infektion (35,6%), d.h. auf die Iliacal- und Femoropopliteal-Gefäßregion beschränkt. Das entspricht den präoperativ durch die Bildgebung ermittelten Befunden, wobei intraoperativ eine genauere Zuordnung vorgenommen werden konnte (Tab. 5). Tabelle 5 Intraoperativ ermittelte Infektlokalisation und daraus resultierende Operation Patient Präop. Lokalisation Intraoperative Lokalisation Operation 1 Femoralgefäße A. fem. prof. re. Patchplastik 2 Femoralgefäße A. poplitea re. Bypass 3 Femoralgefäße A. fem. com. re. Patchplastik 4 Femoralgefäße A. fem. superf. li. Bypass 5 Aorta abdominalis A. iliaca com. li. Bypass 6 Aorta abdominalis A. iliaca com. li. Y-Prothese 7 Aorta abdominalis Aa. iliacae comm. Y-Prothese 8 Aorta abdominalis A. iliaca com. li. Interponat 9 Aorta abdominalis Aa. iliacae comm. Y-Prothese 10 Aorta abdominalis distale A. abdominalis Y-Prothese 11 Aorta abdominalis distale A. abdominalis Y-Prothese 12 Aorta abdominalis Aa. iliacae comm. Y-Prothese 13 Aorta abdominalis Aa. iliacae comm. Y-Prothese 14 Aorta abdominalis A. iliaca com. li. Interponat 15 Femoralgefäße A. fem.com. / A. fem. prof. re. Patchplastik 16 Aorta abdominalis Aa. iliacae externae Y-Prothese 17 Iliacalgefäße A. iliaca externa / A. fem. prof. li. Bypass 18 Aorta abdominalis Aa. iliacae comm. Y-Prothese 19 Iliacalgefäße A. iliaca externa re. Interponat 20 Aorta abdominalis Aa. iliacae comm. Y-Prothese 21 Femoralgefäße A. fem. prof. li. Interponat 22 Femoralgefäße A. fem.com. / A. fem. prof. re. Femoralisersatz 23 Iliacalgefäße A. iliaca externa / A. fem. prof. li. Bypass 24 Aorta abdominalis Aa. iliacae comm. Y-Prothese 25 Femoralgefäße A. fem. com. / A. fem. superf. re. Femoralisersatz 33 Tabelle 5 Intraoperativ ermittelte Infektlokalisation und daraus resultierende Operation 26 Iliacal- + Femoralgefäße A fem. superf. li. Femoralisersatz 27 Aorta abdominalis A. iliaca com. li. Prothesenschenkelersatz 28 Iliacal- + Femoralgefäße A. iliaca externa / A. fem. prof. li. Bypass 29 Femoralgefäße A. fem.superf. / A. pop. re. Bypass 30 Femoralgefäße A. fem. superf. / A. pop. re. Bypass 31 Iliacal- + Femoralgefäße A. iliaca com. / A. fem. superf. re. Bypass 32 Aorta abdominalis Aa. iliacae comm Y-Prothese 33 Aorta abdominalis A. iliaca com. li. Prothesenschenkelersatz 34 Femoralgefäße A. fem. superf. bd. Interponat 35 Iliacalgefäße A. iliaca externa / A. fem. prof. re. Interponat 36 Aorta abdominalis Aa. iliacae comm. Y-Prothese 37 Aorta abdominalis A. abdominalis Aortenersatz 38 Iliacal- + Femoralgefäße A. iliaca externa re. Femoralisersatz 39 Aorta abdominalis A. abdominalis Aortenersatz 40 Aorta abdominalis Aa. iliacae comm. Y-Prothese 41 Aorta abdominalis distale A. abdominalis Y-Prothese 42 Iliacal- + Femoralgefäße A. iliaca com. li. Femoralisersatz 43 Femoralgefäße A. fem. prof. li. Bypass 44 Aorta abdominalis distale A. abdominalis Y-Prothese 45 Aorta abdominalis Aa. iliacae comm. Y-Prothese 3.7 Art des implantierten arteriellen Allografts Abhängig von Ort und Ausdehnung der zugrunde liegenden Infektion der Primärprothese bzw. des Nativgefäßes kamen zur Rekonstruktion der arteriellen Gefäßbahn unterschiedliche arterielle Allografts zur Anwendung (Tab. 6). So wurde bei 18 Patienten (40%) eine Allograft-Y-Prothese zum Ersatz der Aorta abdominalis mit Aufzweigung in die Arteriae iliacae communes oder Arteriae femorales communes implantiert. Einen einseitigen arteriellen Bypass mit Allograftimplantation erhielten 22 Patienten (49%). 3.8 Perioperative Begleitmaßnahmen Begleitend zu den operativen Eingriffen an den infrarenalen arteriellen Gefäßen mit Implantation eines arteriellen Allografts wurden bei 32 Patienten weitere Maßnahmen zum Gelingen der Implantation durchgeführt (Tab. 7). So wurde bei den sechs Patienten mit aorto-enterischer Fistel eine Darmsegmentresektion durchgeführt. Bei vier Weiteren war eine Dünndarmresektion mit 34 anschließender Duodenojejunostomie notwendig, bei acht Patienten wurde zum Schutz des implantierten Allografts im Bereich der Aorta abdominalis eine Omentumplastik durchgeführt. Eine intraoperative Thrombendarteriektomie wurde zur Verbesserung des arteriellen Blutflusses bei zwölf Patienten durchgeführt. Dabei bestanden die arteriellen Durchblutungsstörungen bei bekannter pAVK bereits präoperativ. Tabelle 6 Prozentuale Verteilung der implantierten arteriellen Allografts Art des implantierten Allografts Häufigkeit Prozent n % Allograft-Patchplastik 1 2,2 Allogener Bypass 22 49,0 Allograft-Y-Prothese 18 40,0 Allogener Prothesenschenkelersatz 2 4,4 Allogener Aortenersatz 2 4,4 Tabelle 7 Perioperative Prozeduren Perioperative Prozedur Häufigkeit n keine weiteren Maßnahmen 13 Darmsegmentresektion bei aorto-enterischer Fistel 6 Omentumplastik 8 Dünndarmresektion mit Duodenojejunostomie 4 Thrombendarterieektomie 12 M. rectus abdominis - Muskellappen 1 M. rectus femoris - Muskellappen 2 Hemicolektomie 1 Appendektomie 2 Nabelhernienrekonstruktion 1 D2 Amputation links 1 35 3.9 Mortalität 3.9.1 Dreißig-Tage-Mortalität Die 30-Tage-Mortalität betrug bei dem gesamten Patientenkollektiv 17,6% (8/45). Fünf Patienten starben aufgrund eines Multiorganversagens oder eines septischen Schocks an Tag 7 (Pat. 36), 13 (Pat. 11), 17 (Pat. 7), 21 (Pat. 9) bzw. 28 (Pat. 42) postoperativ. Die pathologisch-anatomische Untersuchung zeigte bei allen fünf Patienten intakte arterielle Allografts und eine intakte intestinale Rekonstruktion bei einem Patienten, der zusätzlich wegen einer aorto-enterischen Fistel operiert wurde (Pat. 36). Zwei weitere Patienten starben trotz sofortig durchgeführter operativer Notfallintervention aufgrund eines hypovolämischen Schocks bedingt durch Allograftruptur sieben bzw. zwölf Tage nach der Operation (Pat. 1, 12). Keiner dieser beiden Patienten zeigte intraoperativ das Bild einer aorto-enterischen Fistel. Ein weiterer Patient verstarb aufgrund einer Ruptur der nativen Aorta proximal des Allograftersatzes, der aufgrund von multiplen aortointestinalen Fisteln nach infrarenaler Rohrprothese durchgeführt worden war, 27 Tage postoperativ (Pat. 37). Insgesamt betrug damit die Allograft-assoziierte 30-Tage-Mortalität 6,7% (3/45). Nicht alle Patienten waren zum Zeitpunkt der Abschlussuntersuchung vor Entlassung über die 30 Tage hinaus. Mittels eines standardisierten Telefoninterviews konnte jedoch auch bei den Patienten, die aus unterschiedlichen Gründen keine weiteren Nachsorgetermine wahrnahmen, eine verwertbare Überlebenszeitanalyse durchgeführt werden. 3.9.2 Gesamtmortalität Der mittlere postoperative Beobachtungszeitraum betrug 20 Monate (Range 0,5-42 Monate, Median 3 Monate). Der Median des postoperativen Nachbeobachtungszeitraumes erscheint mit lediglich drei Monaten hier sehr klein. Dies findet seine Begründung darin, dass in die Berechnung des Medians die verstorbenen Patienten mit einbezogen wurden. Der mediane Beobachtungszeitraum für die Gruppe der Überlebenden beträgt ohne Einbeziehung der Verstorbenen zum Vergleich 14,5 Monate. 36 Abbildung 14 Kaplan-Meier-Funktion der Gesamtüberlebenswahrscheinlichkeit in Abhängigkeit der Zeit Während des Beobachtungszeitraumes verstarben weitere vier Patienten (8,8 %). Daraus resultiert eine Gesamtmortalität von 26,6% (12/45, Abb. 14). Ein Patient (Pat. 39) verstarb nach aortaler Allograftimplantation am postoperativen Tag 41 noch auf der Intensivstation unter dem klinischen Bild einer generalisierten Sepsis. Da seine Verwandten eine postmortale Obduktion ablehnten, konnte die Ursache für dieses septische Geschehen nicht geklärt werden. Ein weiterer Patient (Pat. 25) wurde 150 Tage nach Allograftimplantation mit einer Infektion im Leistenbereich, die jedoch den eingebrachten Graft nicht betraf, erneut stationär aufgenommen. Trotz großzügigen Debridements und einer Drainagetherapie mit einem Vacusealverband (KCI – Medizinprodukte, Wiesbaden, Deutschland), verschlechterten sich die Wundverhältnisse und mit ihnen der Gesamtzustand des Patienten einschließlich der Funktion innerer Organe. Der Patient verstarb im Multiorganversagen 153 Tage nach der Allograftimplantation. Laut Angaben ihres Hausarztes erlagen die übrigen zwei Patienten (Pat. 17 u. 21) manifesten Myokardinfarkten bzw. myokardialer Globalinsuffizienzen an den postoperativen Tagen 96 und 119, die keinen Bezug zu den vorgenommenen vaskulären Operationen hatten. Daraus ergibt sich eine Allograft-assoziierte Gesamtmortalität von 6,7% (3/45). In dem beobachteten Patientenkollektiv war die Spätmortalität nicht auf den implantierten Allograft zurückzuführen. Alle Patienten, die die ersten 30 Tage postoperativ überlebten, überlebten auch bis zum Abschluss des Beobachtungszeitraumes mit intakten Implantaten. 3.9.2.1 Mortalität bei Patienten mit Primärgraftinfektion Mit einer isolierten Primärgraftinfektion präsentierten sich 33 Patienten (73,7%) mit einem Altersmedian von 65 Jahren (Range 40-89), darunter 21 Männer (Range 40-82; Median 63) und 12 Frauen (Range 42-89; Median 65). Die 30-Tage-Mortalität in diesem Patientenkollektiv betrug 37 insgesamt 15,1% (5/33, Pat. 1, 9, 11, 12, 42). Auf das gesamte Kollektiv bezogen lag sie bei 11,1% (5/45). Die Gesamtmortalität bei Abschluss des Beobachtungszeitraumes betrug auf das selektive Patientenkollektiv der Primärgraftinfektionen bezogen 21,2% (7/33, Pat. 1, 9, 11, 12, 17, 39, 42), was einer auf das Gesamtkollektiv bezogenen Mortalität von 15,6 % (7/45) entspricht (Abb. 15). An perioperativen Komorbiditäten in dieser Gruppe waren arterielle Hypertonie bei 24 Patienten, periphere arterielle Verschlusskrankheit bei 25 Patienten (12 Patienten im Stadium 2b, sieben Patienten im Stadium 3 und sechs Patienten im Stadium 4) und Diabetes mellitus Typ 2 bei sechs Patienten vertreten. Vier Patienten mit Primärgraftinfektion, drei Männer und eine Frau (Pat. 3, 8, 15, 39), mussten im Rahmen ihres stationären Aufenthaltes graftbedingt reoperiert werden. Ursachen waren Nahtinsuffizienz im Bereich der A. femoralis communis bei ausgedehntem Abszess in der Femoralregion fünf Tage nach Allograftimplantation (Pat. 3), Versagen der Allograftpatchplastik sechs Tage nach Erstoperation wegen eines Spritzenabszesses (Pat. 15), Anastomoseninsuffizienz zwei Tage nach Implantation einer infrarenalen Allograft-Rohrprothese (Pat. 39) und umschriebener Infekt eines prothesio-femoralen Allograftinterponates im Bereich der linken Leiste 13 Tage nach Erstoperation (Pat. 8). Behandelt wurden diese Komplikationen mit einer erneuten Allograftpatchplastik in zwei Fällen (Pat. 13 u.15), in einem Fall mit einer Neuanlage eines prothesio-femoralen Interponates (Pat. 8) sowie mit Anastomosenrevision und Allograftpatchplastik in einem Fall (Pat. 39). Insgesamt waren zur Reoperation in der Untergruppe der Primärgraftinfektionen drei extraabdominelle und ein intraabdomineller Eingriff erforderlich. 3.9.2.2 Mortalität bei Primärgraftinfektion und aorto-enterischer Fistel Sechs Patienten (13,3%) mit einem Altersmedian von 61 Jahren (Range 60-67) präsentierten sich mit einer Primärgraftinfektion kompliziert durch eine aorto-enterische Fistel, darunter fünf Männer (Pat. 28, 36, 37, 40, 44: Median 63, Range 60-67) und eine Frau (Pat. 16: Alter 61 Jahre). Der präoperative Fistelnachweis mittels CT oder Endoskopie erbrachte dabei prothesio-duodenale Fisteln in drei Fällen (Pat. 36, 37, 40), aorto-duodenale und aorto-jejunale Fisteln in zwei Fällen (Pat. 16, 44) sowie eine prothesio-sigmoidale Fistel in einem Fall (Pat. 28). Die 30-Tage-Mortalität in dieser Untergruppe betrug 33,3% (2/6, Pat. 36 u. 37). Bei Abschluss des Beobachtungszeitraumes lag die Gesamtmortalität der Untergruppe der Patienten mit einer aorto-enterischen Fistel unverändert bei 33,3 % (2/6), bzw. 4,4 % (2/45) bezogen auf das Gesamtkollektiv (Abb. 15). Fünf Patienten aus dieser Untergruppe litten an arterieller Hypertonie, ebenfalls fünf Patienten präsentierten sich mit einer pAVK Grad 2b nach Fontaine. Drei Patienten aus dieser Untergruppe litten an Diabetes mellitus Typ 2. 38 Drei von sechs Patienten (50%, alles Männer) mit der Kombination einer Primärgraftinfektion mit einer aorto-enterischen Fistel mussten im Rahmen des stationären Aufenthaltes graftbedingt reoperiert werden (Pat. 36, 37, 40). Ursachen waren Nahtinsuffizienz des rechtsseitigen Allograftschenkels 28 Tage nach Implantation einer aorto-bifemoralen Allograft-Y-Prothese (Pat. 40), persistierende Infektion einer infrarenalen Allograft-Rohrprothese bei multiplen periprothetischen Abszessen 22 Tage nach Erstimplantation (Pat. 37) sowie Spontanperforation des rechtsseitigen Allograftschenkels im Durchtrittskanal zwischen Abdomen und Regio femoralis drei Tage nach Ersatz einer Y-Prothese mittels einer aorto-biprofundalen Allograftprothese (Pat. 36). Die operative Rekonstruktion dieser Komplikationen wurde in zwei Fällen mit einem Allograftschenkelersatz (Pat. 36, 40) und in einem Fall mit einem kompletten Graftersatz durchgeführt (Pat. 37). Hierbei wurde die initial implantierte infrarenale Allograft-Rohrprothese komplett explantiert, das Wundbett ausführlich debridiert und erneut eine infrarenale Allograft-Rohrprothese implantiert. Insgesamt waren im Rahmen der Reoperationen in der Untergruppe der Primärgraftinfektionen mit aorto-enterischer Fistel drei intra- und kein extraabdomineller Eingriff notwendig. Bei sämtlichen Patienten mit aorto-enterischer Fistel konnten perioperativ multiple Keimnachweise erbracht werden. So war bei jedem Patienten Staph. aureus nachweisbar, in einem Fall sogar ORSA (Pat. 37). Die weiteren nachgewiesenen Keime entsprachen zum Teil der fakultativ pathogenen Darmflora mit E. coli, Ent. faecalis, teilweise wurden jedoch auch ortsfremde Erreger wie Candida albicans (Pat. 37, 44), Proteus mirabilis (Pat. 44) sowie Moraxella spp. (Pat. 16) nachgewiesen. 3.9.2.3 Mortalität bei Patienten mit mykotischem Aneurysma (MA) Weitere sechs männliche Patienten (6/45, 13,3%: Altersmedian 67 Jahre, Range 63 - 75) stellten sich bei Aufnahme mit der Komplikation eines mykotischen Aneurysmas vor (Pat. 6, 7, 21, 22, 25, 27). Diese Patientengruppe war bei Aufnahme noch nicht voroperiert, d.h. die vorgenommene Allograftimplantation stellte den Ersteingriff dar. Die 30-Tage-Mortalität in dieser Untergruppe betrug 16,7 % (1/6). Auf das gesamte Kollektiv bezogen lag sie bei 2,2 % (1/45). Patient 7 verstarb 17 Tage postoperativ im Multiorganversagen. Bei Abschluss des Beobachtungszeitraumes lag die Gesamtmortalität der Untergruppe der mykotischen Aneurysmen bei 50 % (3/6 Pat. 7, 21, 25) bezogen auf das Gesamtkollektiv bei 6,7%, (3/45, Abb. 15). Ein Patient (Pat. 25) verstarb nach stationärer Wiederaufnahme 153 Tage nach Allograftimplantation im Multiorganversagen auf dem Boden einer unkontrollierbaren Sepsis, ein weiterer Patient (Pat. 21) verstarb an einer akuten, myokardialen Globalinsuffizienz 119 Tage postoperativ zu Hause. Fünf Patienten aus dieser Untergruppe hatten eine arterielle Hypertonie, 39 fünf eine pAVK, davon ein Patient im Stadium 2b und vier Patienten im Stadium 3. Ein Patient litt an Diabetes mellitus Typ 2. Ein Patient (Pat. 21) aus dieser Untergruppe musste im Rahmen des stationären Aufenthaltes graftbedingt reoperiert werden. Ursache war eine distale Nahtinsuffizienz einen Tag nach Implantation eines aorto-femoralen Allograftinterponates links, die mit Anastomosenrevision, Umstechung und Allograftpatchplastik versorgt wurde. Der weitere stationäre Verlauf dieses Patienten gestaltete sich danach insgesamt protrahiert. Er konnte dann 62 Tage postoperativ in einem zufriedenstellenden Allgemeinzustand entlassen werden, verstarb jedoch 119 Tage postoperativ an einer akuten, myokardialen Globalinsuffizienz. 3.9.2.4 Vergleich der Mortalität bezüglich der Operationsindikationen Die Analyse der Überlebenswahrscheinlichkeit 20 Monate postoperativ erbrachte für Patienten mit isolierter Primärgraftinfektion 74%, für Patienten mit mykotischem Aneurysma 50% sowie für Patienten mit der Kombination aus einer Primärgraftinfektion mit einer aorto-enterischen Fistel 62,5% (Abb. 15). ▬PGI ▬MA ▬AEF Abbildung 15 Kaplan-Meier Kurve für die Überlebenszeit der Patienten in den Untergruppen MA (Mykotisches Aneurysma), PGI (Primärgraftinfektion) und AEF (Aorto-enterische Fistel). Unterschiede nicht signifikant. Insgesamt zeigt sich in der Gruppe der aorto-enterischen Fisteln und in der Gruppe der mykotischen Aneurysmen eine höhere, jedoch statistisch nicht signifikante, Morbiditäts- und Mortalitätsrate im Vergleich zu isolierten Primärgraftinfektionen (p = 0,572). 40 3.9.2.5 Mortalität in Abhängigkeit von der Operationslokalisation Bei insgesamt 29 Patienten (64,4%) wurden intraabdominelle Gefäßersätze über eine mediane Laparotomie durchgeführt, 16 Patienten (35,6%) wurden extraabdominell bzw. extraperitoneal operiert (Kap. 3.7). Die 30-Tage-Mortalität in der Gruppe der intraabdominellen Gefäßeingriffe betrug 24,1% (7/29), in der Gruppe mit extraabdominellen Eingriffen starb keiner der Patienten innerhalb der ersten dreißig Tage postoperativ. Bei der 30-Tage-Mortalität zeigte sich ein gerade signifikanter Unterschied mit einem p-Wert von 0,038 im Log-Rang-Vergleich zwischen den beiden Untergruppen der Operationslokalisation. Die Gesamtmortalität betrug am Ende des Beobachtungszeitraumes in der Untergruppe der intraabdominellen Eingriffe 31,1% (9/29), in der Gruppe der extraabdominellen Operationen 18,7% (3/16). Auch hier zeigt sich ein Unterschied in der Mortalitätsrate, der jedoch statistisch nicht signifikant ist (p-Wert 0,32 im Log-Rang-Test). Von den ausschließlich extraabdominell operierten Patienten mussten 25% (4/16) im Verlauf des stationären Aufenthaltes reoperiert werden. Ursachen waren hier Reinfektionen, Nahtinsuffizienzen sowie Nahtaneurysmen. Bei den intraabdominell Operierten wurden 13,8% (4/29) graftbedingt reoperiert. Ursachen waren hier Nahtinsuffizienzen, Reinfektionen und Spontanperforation des eingebrachten Allografts. Statistisch zeigte sich hierbei kein signifikanter Unterschied. 3.10 Mortalität in Abhängigkeit von unterschiedlichen Komorbiditäten 3.10.1 Einflusses eines Staphylokokken-Nachweises auf Mortalität und Morbidität Insgesamt konnte bei 30 Patienten eine Besiedlung mit Staph. aureus festgestellt werden, bei acht von diesen Patienten ließ sich ORSA als Erreger identifizieren (Tab. 3). Die Mortalität in der ORSA-Gruppe betrug 25% (2/8, Pat. 11 u. 37), beide Patienten verstarben innerhalb der ersten 30 Tage postoperativ an septischem Multiorganversagen (Pat. 11) sowie an einer akuten Ruptur der nativen Aorta proximal der infrarenalen Anastomose bei multiplen aorto-intestinalen Fisteln. Bei den Patienten ohne ORSA-Nachweis lag die Mortalität bei 27% (10/37), hier verstarben sechs Patienten innerhalb der ersten 30 Tage (6/37; 16,2%; Pat.1, 7, 9, 12, 36, 42). Statistisch zeigt sich mit einem p-Wert von 0,987 kein signifikanter Einfluss einer Infektion mit ORSA auf die Langzeitüberlebenswahrscheinlichkeit (Log-Rang-Test). Dieser Wert bezeichnet ein nahezu identisches Ergebnis unabhängig von einem ORSA-Nachweis (Abb. 16). Bezogen auf die Tage-Mortalität dieser beiden Gruppen zeigt sich mit einem p-Wert von 0,606 ein ebenfalls statistisch nicht signifikanter Unterschied (Log-Rang-Test). 30- 41 ▬kein ORSA ▬ORSA Abbildung 16 Kaplan-Meier Kurve für die Überlebenszeit der Patienten mit/ohne ORSA-Nachweis (p=0,606). Die Mortalität in der Gruppe mit positivem Nachweis für Staph. aureus aber negativem ORSANachweis betrug 7/21 (33,3%; Pat. 1, 7, 12, 21, 25, 36, 42), die 30-Tage-Mortalität betrug 5/21 (23,8%; Pat. 1, 7, 12, 36, 42). Vergleicht man nun den Einfluss eines Staph. aureus-Nachweises auf die Langzeitüberlebenswahrscheinlichkeit, so zeigt sich eine Mortalität bezogen auf den Beobachtungszeitraum von 31% (9/29) in der Gruppe mit positivem Staphylokokken-Nachweis, sowie von 18,7% (3/16) in der Patientengruppe ohne Nachweis eines Staphylokokkenstamms. Mit einem p-Wert von 0,022 im Log-Rang-Test besteht hier ein statistisch signifikanter Unterschied im Vergleich dieser beiden Gruppen bezogen auf die Gesamtmortalität mit einer höheren Überlebenswahrscheinlichkeit für die nachweisnegative Gruppe. Der Vergleich des Einflusses eines positiven Staphylokokken-Nachweises auf die 30-Tage-Mortalität erbringt mit einem p-Wert von 0,137 jedoch keinen statistisch signifikanten Unterschied (Log-Rang-Test). 3.10.2 Einfluss eines bekannten Diabetes mellitus Typ 2 auf Mortalität und Morbidität Bei stationärer Aufnahme war bei zehn Patienten (10/45, 22,2%) ein behandlungsbedürftiger Diabetes mellitus Typ 2 bekannt, die übrigen 35 Patienten hatten eine normoglykämische Stoffwechsellage. Es zeigte sich bei der Berechnung des Einflusses der Diabeteserkrankung auf die Mortalität kein signifikanter Unterschied zur Gruppe der Nicht-Diabetiker. Die Mortalitätsrate in der Diabetesgruppe betrug 10% (1/10), in der Gruppe der Nicht-Diabetiker hingegen 31,4% (11/35). Im Vergleichstest errechnete sich ein p-Wert von 0,245, also keine Signifikanz (Log- 42 Rang- Test). Bezüglich der postoperativen Morbidität im Sinne einer Reoperationsrate zeigte sich in der Untergruppe der Diabetiker keine graftbedingte Reoperation, während sämtliche neun reoperierten Patienten aus der Gruppe der Nicht-Diabetiker stammten. 3.10.3 Einfluss einer pAVK-Erkrankung auf Mortalität und Morbidität Bei stationärer Aufnahme litten 77,8% der Patienten (35/45) an einer fortgeschrittenen pAVK in den Stadien 2b-4 nach Fontaine. Die Gesamtmortalität bei Abschluss des Beobachtungszeitraumes betrug in der Patientengruppe mit pAVK-Leiden 7/35 (20%), bei den Patienten ohne pAVK – Leiden 5/10 (50%). Die 30-Tage-Mortalität betrug 3/35 (8,6%) in der Gruppe mit pAVK, in der Gruppe ohne 4/10 (40%). Die Reoperationsrate war in der Gruppe der pAVK - Patienten mit 7/35 (20%) identisch mit dem Ergebnis in der Vergleichsgruppe 2/10 (20%). Insgesamt wurden 21 von 35 Patienten (60%) mit pAVK intraabdominell operiert, die übrigen 14 extraabdominell. In der Gruppe ohne pAVK-Erkrankung wurden acht Patienten (8/10: 80%) intraabdominell und zwei extraabdominell operiert. In der statistischen Auswertung zeigte sich mit einem p-Wert von 0,024 ein signifikant besseres Langzeitergebnis bezüglich der Mortalität in der Gruppe der pAVKErkrankten (Abb. 17). ▬pAVK ▬keine pAVK Abbildung 17 Kaplan-Meier Kurve für die Überlebenszeit der Patienten mit/ohne klinisch manifeste pAVK (p=0,024). Da sich auch im Bereich der Operationslokalisation ein signifikanter Unterschied gezeigt hat und sich als Kritikpunkt anbot, die Signifikanz auf die Kombination aus Operationslokalisation und pAVK-Leiden zu überprüfen, konnte mit Hilfe der Regressionsanalyse nach Cox eine derartige Auswertung durchgeführt werden. 43 Hierbei zeigte sich ein statistisch signifikanter Unterschied beim Vorliegen einer pAVK (p = 0,044), wohingegen die Lokalisation der Operation beim Hinzuziehen eines zweiten Faktors ihre Signifikanz einbüsst (p = 0,418). Bei einer bereits präoperativ bestehenden pAVK zeigt sich in Abhängigkeit von der Operationslokalisation ein marginal positiver Einfluss auf die Überlebenswahrscheinlichkeit. In Abhängigkeit von einer vorbestehenden, fortgeschrittenen pAVK zeigt sich eine signifikant höhere Überlebenswahrscheinlichkeit für Patienten mit pAVK nach intraabdominellen Eingriffen (Abb.18) Auf extraabdominelle Eingriffe bezogen, zeigt sich ein statistisch nicht signifikanter Unterschied für die Überlebenswahrscheinlichkeit eines Patienten mit oder ohne pAVK. ▬pAVK ▬keine pAVK Abbildung 18 Kaplan-Meier Kurve für die Überlebenszeit der Patienten nach intraabdominellen Eingriffen in Abhängigkeit einer fortgeschrittenen pAVK als Variable (p=0,044). 3.10.4 Einfluss einer arteriellen Hypertonie auf Mortalität und Morbidität Insgesamt 34 Patienten (75,6%) litten an einer medikamentös eingestellten arteriellen Hypertonie bei stationärer Aufnahme. Statistisch zeigte sich, dass in der Gruppe der Hypertoniker 12 von 34 Patienten (35,3%) im Laufe des Beobachtungszeitraumes verstarben, wohingegen kein Patient in der Gruppe der Normotoniker innerhalb des Beobachtungszeitraumes starb. Die 30-TageMortalität in der Hypertoniegruppe betrug 9/34 (26,5%). Anhand der Kaplan-Meier Methode (Abb.19) zeigte sich im Log-Rang-Vergleichstest eine signifikant höhere Mortalitätsrate in der Gruppe der Hypertoniker (p = 0,028). In der Gruppe der Hypertoniker mussten vier Patienten graftbedingt reoperiert werden (4/34, 11,8%), in der Gruppe der Normotoniker waren fünf Reoperationen notwendig (5/11, 45,5%). 44 ▬arterielle Hypertonie ▬keine arterielle Hypertonie Abbildung 19 Kaplan-Meier Kurve für die Überlebenszeit der Patienten bei bekannter arterieller Hypertonie (p=0,028). 3.10.5 Einfluss des Geschlechts auf Mortalität und Morbidität Die 30-Tage-Mortalität betrug in der Gruppe der Frauen 15,4% (2/13), in der Gruppe der Männer 18,7% (6/32). Die Gesamtmortalität lag bei Abschluss des Beobachtungszeitraumes bei 15,4% (2/13) in der weiblichen Untergruppe und bei 31,2% (10/32) in der männlichen Untergruppe. Damit war die Sterblichkeit innerhalb dieser Studie bei den männlichen Patienten trotz einer nahezu identischen Altersverteilung mehr als doppelt so hoch wie in der weiblichen Untergruppe. Die Anzahl der graftbedingten Reoperationen während des stationären Aufenthaltes betrug 7,7% (1/13) in der Frauengruppe und 25% (8/32) in der Männergruppe. Die geschlechtsspezifische Überlebenswahrscheinlichkeit unterscheidet sich nicht signifikant (p = 0,382). Um weiterführende Aussagen über das jeweilige Langzeitergebnis in Abhängigkeit vom Geschlecht machen zu können, ist es sinnvoll, weitere Variablen in die Berechnung mit einzubeziehen. So ist es möglich, die Überlebenswahrscheinlichkeit der Patienten beim gleichzeitigen Vorliegen mehrerer Variablen wie Operationslokalisation und Operationsindikation zu berechnen. Hierbei zeigte sich, dass 19 der 32 männlichen Patienten (59,4%) intraabdominell operiert worden sind. Hiervon verstarben im Laufe des Beobachtungszeitraumes acht Patienten, so dass die Mortalitätsrate 42,1% (8/19) betrug, bzw. die Überlebensrate 57,9%. Extraabdominell wurden 13 Männer operiert, hier betrug die Mortalität 15,4% (2/13). In der Frauengruppe wurden zehn Patientinnen (76,9%) intraabdominell operiert. Die Mortalitätsrate betrug dabei 10% (1/10). Drei Patientinnen wurden extraabdominell operiert, hier verstarb eine Patientin, so dass die 45 Mortalität 33,3% (1/3) betrug. Beim statistischen Vergleich der beiden Geschlechter in Abhängigkeit von der Operationslokalisation zeigte sich eine geringere Mortalitätsrate bei den Frauen, jedoch war dieser Unterschied mit einem p-Wert von 0,290 nicht signifikant (CoxRegression). In der Gruppe der extraabdominell Operierten erscheinen die Ergebnisse nahezu identisch, wobei hier die geringe Fallzahl in der weiblichen Untergruppe zu berücksichtigen ist. 3.10.6 Einfluss der Reoperationen auf Mortalität und Morbidität Insgesamt mussten neun Patienten, acht Männer (Altersdurchschnitt 56,4 Jahre, Median 60, Range 40-66) und eine Frau (Alter 52 Jahre), im Rahmen ihres stationären Aufenthaltes im Zusammenhang mit dem Homograft reoperiert werden. Im Vergleich der Auswirkung dieser Komplikationen auf das Langzeitüberleben zeigte sich in der Überlebensanalyse kein signifikanter Unterschied (p = 0,861, Log-Rang-Test) zwischen den beiden Gruppen. 3.10.7 Einfluss des Lebensalters auf die Mortalität Das mittlere Alter der Patienten betrug 64,8 Jahre, das mediane Alter 65 Jahre. Um den Einfluss des Lebensalters auf die Mortalität abschätzen zu können, wurde die Patientenpopulation in eine Gruppe unter 65 Jahre (21 Patienten) und eine Gruppe 65 Jahre oder älter (24 Patienten) eingeteilt. Hierbei zeigte im Log-Rang-Test mit einem p-Wert von 0,549 kein signifikanter Unterschied zwischen den beiden verglichenen Gruppen. 3.11 Verweildauer auf der Intensivstation Alle 45 Patienten wurden postoperativ intensivstationär überwacht (Tab. 8). Die durchschnittliche Verweildauer dort betrug im Mittel 6,3 Tage (Median 3 Tage, Spannbreite 1 bis 41 Tage). In die Berechnungen wurden zunächst die stationär Verstorbenen mit einbezogen. Eine selektiv nur für die Gruppe der Überlebenden erstellte Auswertung erbringt eine durchschnittliche postoperative Verweildauer auf der Intensivstation von fünf Tagen, bei einem Median von zwei Tagen (Range 1-41). 3.12 Dauer des postoperativen Krankenhausaufenthaltes Die Dauer des postoperativen Krankenhausaufenthaltes betrug im Mittel 25 Tage (Median 18 Tage, Range 7-132 Tage). Insgesamt 38 Patienten verblieben 30 Tage oder weniger postoperativ stationär, sieben Patienten 31 Tage oder mehr (Spannbreite 41-132 Tage). Die Patienten, die während des stationären Aufenthaltes verstarben, wurden in die statistische Auswertung miteinbezogen, wobei der jeweilige Todeszeitpunkt während des stationären Aufenthaltes mit dem Endpunkt des postoperativen Krankenhausaufenthaltes gleich gesetzt wurde. Ohne Einbeziehung 46 der während des stationären Aufenthaltes Verstorbenen, ergibt sich für die Gruppe der Überlebenden (n = 33) ein durchschnittlicher postoperativer Krankenhausaufenthalt von 26 Tagen (Median 18, Spannbreite 9-132). Tabelle 8 Postoperative Aufenthaltsdauer auf der Intensivstation Postoperative Aufenthaltsdauer Anzahl der Prozent der auf der Intensivstation in Tagen Patienten n Gesamtheit % 1 9 20,0 2 13 28,9 3 7 15,6 4 2 4,4 5 2 4,4 7 3 6,7 12 1 2,2 13 2 4,4 14 1 2,2 17 1 2,2 21 1 2,2 25 1 2,2 26 1 2,2 41 1 2,2 47 4. Diskussion 4.1 Ergebnisse nach Gefäßersatz mit kryokonservierten arteriellen Allografts Die in der Literatur beschriebene Inzidenz vaskulärer Protheseninfektionen variiert zwischen 0,2% und 5% und ist abhängig von der Operationslokalisation, der zugrunde liegenden Indikation und den patientenspezifischen Komorbiditäten. Auch treten Infektionen aortaler Prothesen Monate oder Jahre nach Implantation auf. Trotz verbesserter chirurgischer Techniken, adaptierter Antibiotikatherapie und optimierter Intensivbetreuung existiert keine allgemein gültige zufrieden stellende chirurgische Vorgehensweise. Unterschiedlichste Konzepte vom traditionellen Ex-situBypass mit Aortenblindverschluss über verschiedene Kunststoffprothesen zum In-situ Ersatz bis hin zu autologen Venengrafts werden mit unterschiedlichsten Ergebnissen propagiert. Die Schwierigkeit, klinische Protheseninfekte zu beherrschen, häufig bedingt durch die verspätete Diagnosestellung, die hohe Virulenz der Erreger, die oft multiplen Komorbiditäten, das Sepsis bedingte Multiorganversagen, Nahtinsuffizienzen und hämodynamisch relevante gastrointestinale Blutungen sowie der häufig schlechte Immunstatus der Patienten führen zu einer nach wie vor hohen Mortalitätsrate bei diesem Krankheitsbild 79. Autologe Grafts haben ihre überlegene Infektionsresistenz gegenüber Kunststoffprothesen bewiesen, stehen aber bei diesem speziellen Patientengut selten in suffizienter Zahl und geeignetem Zustand zur Verfügung. Ziel dieser Studie war es, angesichts des Fehlens eines guten Behandlungskonzeptes für vaskuläre Protheseninfektion sowie der in Zukunft zu erwartenden zunehmenden Inzidenz dieses Krankheitsbildes bedingt durch die steigende Zahl jährlicher Gefäßersätze, unsere Ergebnisse mit der Implantation kryokonservierter arterieller Allografts bei Prothesen- resp. Gefäßinfektionen differenziert auszuwerten und eine Grundlage für ein adaptiertes Behandlungskonzept zu erstellen; auch angesichts der sozioökonomischen Bedeutung eines Krankheitsbildes mit der Gefahr multipler Reoperationen, Extremitätenamputationen mit Berentungsfolgen und langen stationären Aufenthalten. Die präoperativen Bedingungen wie Komorbidität, Infektlokalisation und Art der Präsentation sind in unserer Studie vergleichbar mit den Angaben in der Literatur zum Krankheitsbild der Gefäßprotheseninfekte und mykotischen Aneurysmen. Einige Aspekte sollen im Folgenden besondere Erwähnung finden: Einfluss der Operationslokalisation auf Mortalität und Morbidität In Abschnitt 3.9.2.5 konnte gezeigt werden, dass die Operationslokalisation einen signifikanten Einfluss auf die perioperative Mortalität hat. So zeigte sich eine signifikant höhere Mortalitätsrate 48 bei intraabdominellen Rekonstruktionen. Erklärbar ist dieses mit dem höheren operativen Aufwand, der größeren Gefahr der Verletzung lebenswichtiger Organsysteme, der schwerer zu beherrschenden perioperativen Komplikationen, dem deutlich größeren Operationstrauma sowie der nicht lokal zu therapierenden postoperativen Komplikationen. Extraabdominelle bzw. –peritoneale Rekonstruktionen zeigen aufgrund ihres geringeren Operationsaufwandes eine niedrigere Mortalitätsrate, haben jedoch prozentual höhere Reoperationsraten. Dieses erklärt sich aus der häufig unzureichenden Weichteildeckung, welche eine rasche Progredienz oberflächlicher Wundinfektionen in die Tiefe erlauben sowie der unzureichenden Versorgung distaler Gewebeabschnitte mit konsekutiver Verminderung der lokalen Infektabwehr. Einfluss des Nachweises gram-positiver Kokken Neben den unterschiedlichsten perioperativen Risikofaktoren, die einen Einfluss auf die postoperativen Verläufe haben, erscheinen vor allen Dingen der sorgfältige Nachweis und die daran adaptierte Therapie der Infektionserreger ausschlaggebend für die Prognose. So bestätigt diese Untersuchung auch in diesem Krankengut die aus der Literatur bekannte hohe Mortalität bei Nachweis von ORSA und / oder OSSA 4-6, 9, 25, 46, 57-61, 79, 99, 102-104. Insofern gilt es hier das perioperative Management so weit zu optimieren, dass präoperativ positive Nachweise suffizient nach Antibiogramm behandelt werden, des Weiteren sollte bei Patienten, die nicht als Notfall eingeliefert werden („semielektiv“), der präoperative Krankenhausaufenthalt zeitlich minimiert werden, um der Entwicklung einer resistenten Hautflora vorzubeugen. Alle üblichen Infektionsherde sollten präoperativ sicher ausgeschlossen werden. Intraoperativ darf der zu implantierende Graft auf keinen Fall mit dem kontaminierten Operationsfeld oder der Haut des Patienten in Kontakt kommen. Auch sollten simultane gastrointestinale Prozeduren wenn irgend möglich vermieden werden. Des Weiteren erscheint eine perioperative Antibiotikaprophylaxe mit einem Cephalosporin (z.B. Cefazolin®) oder bei positivem ORSA-Nachweis mit Vancomycin (Vancomycin®) oder Linezolid (Zyvoxid®) sinnvoll 1. Einfluss aorto-enterischer Fisteln Mit einer Krankenhausmortalität von 2/6 Patienten (33,3%), zeigten Patienten mit aortoenterischer Fistel eine im Vergleich zum übrigen Patientenkollektiv höhere Mortalität. Diese war jedoch nicht statistisch signifikant. Die aus der Literatur bekannte erhöhte Mortalität bei aortoenterischer Fistel wurde also in dieser Studie bestätigt 9, 56-58, 60, 61, 99. 49 Die Ursache für die erhöhte Mortalität und Morbidität begründet sich in der Erkrankung an sich. Patienten mit aorto-enterischer Fistel weisen häufig eine multiple Komorbidität, speziell das HerzGefäß-System betreffend, auf. Des Weiteren handelt es sich hierbei um eine sehr seltene Erkrankung, deren Primärsymptome, gastrointestinale Blutabgänge, abdominelle Schmerzen, Hämatemesis, chronische Anämie, häufig zu initialen Fehldiagnosen führen, welche eine rasche operative Sanierung verzögern. Dazu kommt im fortgeschrittenen Stadium das Vollbild einer generalisierten Sepsis, welches in Kombination mit dem unphysiologischen perioperativen Stress zu einer höheren Morbidität und Mortalität führt. Ist die Diagnose einer aorto-enterischen Fistel gestellt, so bietet nur noch die chirurgische Sanierung einen Ausblick auf Erfolg. Hierbei sind die primären Ziele in absteigender Reihenfolge Erhalt des Lebens und der Extremitäten. Das chirurgische Konzept dafür beinhaltet die Kontrolle der Blutung, Rekonstruktion des Gastrointestinaltraktes, Infektionskontrolle und Erhalt resp. Wiederherstellung einer ausreichenden Extremitätenperfusion. Die allgemein üblichen operativen Optionen sind In-situ-Rekonstruktion, Graftexzision und Rekonstruktion mit autogener Vene sowie extraanatomische Rekonstruktion und Graftexzision. Allen gemein sind deutlich höhere Mortalitätsraten in der Behandlung von aorto-enterischen Fisteln im Vergleich zu isolierten Protheseninfektionen. Reilly et al. berichten von einer Mortalitätsrate von nur 18% in der Behandlung von aorto-enterischen Fisteln mit extraanatomischer Revaskularisierung und anschließender Graftexzision 100. Die Bedenken hinsichtlich einer Infektion der neu eingebrachten Kunststoffprothese in der Gegenwart eines infizierten Abdominalgrafts haben sich dort bisher nicht bestätigt. Im Gegensatz zu den extraanatomischen Rekonstruktionen bieten In-situ-Ersätze eine direkte aortale Revaskularisierung in einer Operation und verhindern auch die befürchtete Komplikation einer Aortenstumpfruptur. Allerdings bieten bei aorto-enterischen Fisteln die unterschiedlichen Konduits wenig zufriedenstellende Ergebnisse. So zeigen autogene Venen gute Ergebnisse bei isolierten Graftinfektionen, aber die Ergebnisse bei aorto-enterischen Fisteln waren weniger befriedigend 91, 101. Auch kryokonservierte arterielle Allografts zeigen trotz exzellenter Ergebnisse bei der Rekonstruktion isolierter Protheseninfekte schlechtere Resultate bei aorto-enterischen Fisteln, wie auch diese Arbeit unterstreicht 61, 76, 95. Die Gründe für diese Ergebnisse erscheinen noch unklar, mit dazu beitragen wird aber gewiss die unvermeidliche Kombination aus Graftimplantation und operativer Rekonstruktion des Gastrointestinaltraktes, welches immer eine Kontamination des Operationsfeldes zur Folge hat. 50 Einfluss der arteriellen Verschlusskrankheit auf die Mortalität Neben dem oben beschriebenen Einfluss unterschiedlich pathogener Keime auf Mortalität und Morbidität beeinflussen auch individuelle, kardiovaskuläre Risikofaktoren die Prognose. So zeigt sich in der hier vorliegenden Untersuchung ein signifikanter Einfluss einer vorbestehenden peripheren arteriellen Verschlusskrankheit auf die Überlebensrate. Interessanterweise weisen in dieser Untersuchung die Patienten, bei denen eine fortgeschrittene Gefäßerkrankung nachgewiesen wurde, eine signifikant höhere Überlebenswahrscheinlichkeit als die nicht an einer pAVKErkrankten auf. Selbst unter Hinzuziehen der Operationslokalisation zeigt sich nach wie vor eine Signifikanz für Patienten mit peripherer Verschlusskrankheit, insgesamt also ein unerwartetes Ergebnis, da man zunächst einen ungünstigen Einfluss der arteriellen Verschlusskrankheit vermuten würde. Vielleicht ist die Ursache darin begründet, dass die bereits langjährig an einer Verschlusskrankheit leidenden Patienten durch konsequente konservative Therapie über Jahre die Möglichkeit hatten, eine suffiziente Kollateralisierung zu entwickeln. Des Weiteren gilt es zu bedenken, dass diese Patienten häufig über Jahre hinweg mit oralen Antikoagulanzien und Rheologika behandelt wurden, welche die periphere Durchblutung optimieren. Auch eine höhere Ischämietoleranz im Sinne eines Preconditioning bei Patienten mit langjähriger Krankengeschichte kann diskutiert werden 105-107. Einfluss einer arteriellen Hypertonie auf die Mortalität Als weiterer Punkt wurde der Einfluss einer arteriellen Hypertonie auf die postoperative Prognose untersucht. Hierbei zeigte sich ein signifikant besseres Ergebnis bezüglich der Überlebensrate in der Gruppe der Nicht-Hypertoniker. Der ungünstige Einfluss einer lange bestehenden arteriellen Hypertonie auf die periphere Durchblutungssituation ist bekannt 62-64. Zur Einschätzung unserer Ergebnisse bezüglich des In-situ-Ersatzes infizierter Prothesen oder Gefäße mittels Implantation kryokonservierter arterieller Allografts hinsichtlich kurz- und mittelfristiger Mortalität bietet sich eine Einordnung in die Ergebnisse der internationalen Literatur an (Tab. 9). Langfristige Komplikationen sowie Langzeit – Überlebensanalysen waren nicht Untersuchungsziel dieser Arbeit. 51 Tabelle 9 Zusammenfassung des klinischen Ergebnisses selektiver Studien Krankenhaus - Gesamt- Mortalität (Graftassoziiert) Mortalität (Graftassoziiert) Reinfektionen Amputationen Sog. Majoramputationen Autor (Jahr) n n (%) n (%) n n Vogt et al. (1995)26 12 1(8) 3(25) 0 0 1 0 0 0 0 18 4(22) 6(33) 3 1 22 3(14) 3(14) 2 0 18 3(17) 4(22) 0 0 25 2(8) 2(8) 2 2 72 Alonso et al. (1997) Desgranges et al. (1998) 73 Eugene et al. (1998)74 Locati et al. (1998) 75 Nevelsteen et al. (1998) 76 Chiesa et al. (1998)24 44 6(14) 11(25) 0 3 77 90 15(17) 18(20) 4 0 78 28 5(18) 9(33) 4 0 Verhelst et al. (2000) Leseche et al. (2001) Noel et al. (2002) 79 56 7(13) 9(16) 6 3 60 45 6(13) 6(13) 0 0 80 17 0 0 0 0 Zhou et al. (2006) 42 7(17) 9(21) 0 6 Aktuelle Studie, Brand (2007) 45 3(7) 3(7) 4 0 Gabriel et al. (2004) Castier et al. (2005) 46 Die Tabelle 9 vergleicht Arbeiten aus den Jahren 1995-2006 bezüglich der graftassoziierten Krankenhaus- und Gesamtmortalität sowie bezüglich der Anzahl der im Rahmen des Beobachtungszeitraumes aufgetretenen Reinfektionen und Amputationen. Aufgenommen wurden Studien, die über eine Medline-Suche mit den Schlüsselwörtern „Arterielle Allografts bei infizierten Gefäßprothesen“ sowie „Kryokonservierung“ gefunden wurden. Hierbei war das Aufnahmekriterium eine Behandlung arterieller, infizierter Kunststoffgefäßprothesen mit Hilfe von kryokonservierten arteriellen Allografts. Die Überlebensraten bei den weniger Patienten (25 bzw. 12 vs. 45) umfassenden Studien von Nevelsteen et al. 76 und Vogt et al. 26aus den Jahren 1998 bzw. 1995 sind vergleichbar mit denen in der vorliegenden Studie. Allograftassoziierte Reinfektionen hingegen sind in der aktuellen Studie vergleichsweise häufig. Gründe dafür sind die im Vergleich wiederum hohe Anzahl an Patienten mit aorto-digestiver Fistel und mykotischem Aneurysma, die Multimorbidität des Kollektives sowie die Anzahl der extraabdominell operierten Patienten, was aufgrund der häufig desaströsen Weichteilverhältnisse, der Mikro- und Makroangiopathien der Patienten sowie der schlechten 52 Defektdeckungsmöglichkeiten mit einer erhöhten Reinfektionsrate einhergeht. Diese Ergebnisse entsprechen ebenfalls denen in der internationalen Literatur und unterstreichen die erhöhte Mortalität bei aorto-enterischen Fisteln und erhöhten Reinfektionsraten bei extraabdominellen Rekonstruktionen. Die Anzahl der graftbedingten Spätamputationen ist insgesamt im internationalen Vergleich relativ gering, das bestätigen auch unsere Ergebnisse. Hier zeigt lediglich die Studie von Zhou et al. aus dem Jahr 2006 mit sechs Spätamputationen bei 42 Patienten eine höhere Anzahl. Hierbei wurden lediglich intraabdominelle Rekonstruktionen bei infizierten infrarenalen Aortenprothesen vorgenommen. Insgesamt sind unsere Ergebnisse hinsichtlich Früh- und Krankenhausmortalität sowie Reinterventionsraten und Majoramputationen vergleichbar mit denen anderer Forschungsgruppen 36. Anzumerken ist bei dieser Art des Vergleichs von verschiedenen Studien, dass das Hauptaugenmerk auf die Mortalität, Reinfektionen und Amputationen gelegt wird, ohne dass auch in dieser Studie zu beachtende Störgrößen und Einflussfaktoren wie Komorbiditäten, Infektlokalisationen und Erregernachweis in die Auswertung mit einfließen. Diese Faktoren bestimmen wesentlich die Langzeitergebnisse. Die Komorbiditäten der Patienten unterscheiden sich in den entsprechenden Studien wie Eingangs erwähnt nicht wesentlich. Es handelt sich in der Regel um ältere Patienten mit üblichen, die postoperative Periode beeinflussenden Erkrankungen, die Patienten sind voroperiert und bei infektbedingter Rekonstruktion häufig in einem schlechten Allgemeinzustand. Die präoperativen Infektlokalisationen unterscheiden sich je nach Studiendesign, insgesamt handelt es sich jedoch um meist heterogene Gruppen mit sowohl intraals auch extraabdominellen Rekonstruktionen. Die höhere perioperative Mortalität bei gesichertem Nachweis pathogener, virulenter Bakterienstämme ist hinlänglich bekannt. 4.2 Vergleich der Therapiekonzepte Die Vor- und Nachteile der unterschiedlichen Techniken der Gefäßrekonstruktionen bei Protheseninfektionen der infrarenalen Aorta abdominalis werden in der Gefäßchirurgie seit jeher kontrovers diskutiert. Im Folgenden sollen nun die unterschiedlichen anerkannten Vorgehensweisen kurz vorgestellt und mit ihren Vor- und Nachteilen diskutiert werden. Ex-situ-Bypass mit Graftexcision Bei dieser Alternative zur In-situ-Rekonstruktion wird versucht, die chirurgische Intervention so minimal wie möglich zu gestalten. Im Falle eines intraabdominellen Protheseninfektes wird die gesamte in der Regel infrarenale Gefäßprothese entfernt, ein gründliches Wunddebridement 53 schließt sich an und der Aortenstumpf wird sorgfältig übernäht. Parallel dazu oder vorgeschaltet wird die Installation eines Ex-situ-Bypasses durchgeführt, der meistens in Form eines axillofemoralen / -profundalen Bypasses oder seltener als axillopoplitealer Bypass konstruiert wird 9, 81. Vorteile dieser Technik sind die Möglichkeit einer gegebenenfalls zweizeitigen Vorgehensweise, wobei zunächst der extraanatomische Bypass konstruiert wird, womit die physische Belastung des häufig multimorbiden Patienten verringert werden soll und damit auch die perioperative Mortalität, sowie der Versuch, die Gefahr einer Reinfektion durch Vermeidung der Implantation der Prothese in das infizierte Gebiet so gering wie möglich zu gestalten. Nachteile des Ex-situ-Bypasses sind die Gefahr einer Aortenstumpfruptur in 10%-20% der operierten Fälle, rekurrente Graftthrombosen und Graftinfektionen in 10%-40% der Fälle sowie Amputationsraten von 20%-29% 9, 59, 60, 81-87. Aufgrund der beschriebenen mit den Ex-situ-Grafts assoziierten Probleme, wird von einigen Autoren empfohlen, Patienten in sehr schlechtem Allgemeinzustand kombiniert mit einer Sepsis und einer kurzen Lebenserwartung mit dieser Art der Gefäßrekonstruktion zu behandeln. Bei diesem Patientenkollektiv beschreiben Bandyk et al. eine 30-Tage-Mortalität von 21% sowie eine Amputationsrate von 9% 36. Des Weiteren bevorzugen andere Autoren die extraanatomische Rekonstruktion bei Patienten mit präoperativ gesicherten ausgedehnten Abszessen im Perigraftgewebe, kombiniert mit einer kompletten Exzision des Primärgrafts und peniblem Aortenstumpfverschluss 81. Verglichen mit unseren Ergebnissen erscheinen die Komplikationsraten bei Ex-situ-Grafting höher. Graftthrombosen und Reinfektionen bei 10%-40%, Amputationsraten von bis zu 29% und 30-Tage-Mortalitäten von bis zu 21%. Demgegenüber stehen eine Reinfektionsrate von 8%, keine Amputationen und eine 30-Tage-Mortalität von 17,6% in unserer Studie. Aufgrund der verbesserten chirurgischen Technik, der wirkungsvollen perioperativen Antibiotikaprophylaxe und der nachweislich besseren Langzeitergebnisse sollte die Ex-situ-Rekonstruktion nur noch ausgewählten Patienten mit massivsten Abszessinfiltrationen und einer sehr kurzen Überlebenserwartung angeboten werden. Alle anderen Patienten mit infizierten Primärprothesen sollten einer In-situ-Rekonstruktion zugeführt werden. In-situ Bypass mit Rifampicin- oder silberbeschichteter Kunststoffprothese Dieses Verfahren wird von einigen Gefäßchirurgen bevorzugt, wenn sich der Patient mit einer Graftinfektion mit einem als niedrig – virulent eingeordneten Keim präsentiert 36, 81. So befürwortet Bandyk einen In-situ-Prothesenersatz mit einer Rifampicin-beschichteten PTFE - Prothese bei Patienten mit segmentellem Befall mit wenig virulenten grampositiven Erregern wie Staphylokokkus epidermidis 36. Größere Studien haben jedoch auch gezeigt, dass Rifampicin- 54 beschichtete Polyesterprothesen unzureichende Ergebnisse liefern, wenn mikrobiologisch eine Infektion mit ORSA, Pilzen oder Rifampicin-resistente Staph. epidermidis nachgewiesen wurden. Zusammengenommen sind diese Erreger verantwortlich für eine Mortalität von 16- 35 % in größeren Studien 36, 81, 82, 88, 89. So berichten Bandyk et al. von einer operationsbedingten Mortalitätsrate von 21% bei Ex-situ-Rekonstruktionen bei Patienten mit aorto-enterischer Fistel, sowie einer Amputationsrate von 9% bei diesem Patientengut. In unserer Studie zeigten die beiden verstorbenen Patienten mit aorto-enterischer Fistel intakte arterielle Allografts und Darmrekonstruktionen in der postmortalen Obduktion. Oderich et al. beschreiben in ihrer Studie eine Überlegenheit der In-situ-Rekonstruktion mit beschichteten Kunststoffgrafts gegenüber Exsitu-Rekonstruktionen bezogen auf die Graft-Offenheitsrate und die Komplikationsrate 81. Im Bereich der Reinfektionen und der operationsbedingten Mortalität gab es hingegen keine signifikanten Unterschiede. Auch in dieser Studie zeigt sich eine erhöhte Frühmortalität bei Patienten mit aorto-enterischer Fistel von 2/9 (22%), nicht beschrieben sind Komplikationen bei Patienten mit multiresistenter Keimbesiedlung oder Nachweis Rifampicin-resistenter Staph. epidermidis. Auch extraabdominelle Gefäß- oder Graftinfektionen werden hier nicht mit eingeschlossen. Alternative In-situ-Rekonstruktionsansätze benutzen silberbeschichtete Kunststoffprothesen. Bereits 1991 hatten Kinney et al. über den tierexperimentellen Einsatz von silberbeschichteten Polyesterprothesen im Hundemodell berichtet. Dabei konnte nach künstlich geschaffener Gefäßinfektion mit Low-Grade Erregern (Staph. epidermidis) nach In-situ-Rekonstruktion mit Silber-Ciprofloxacin beschichteten Prothesen nachgewiesen werden, dass auch 14 Tage nach Operation eine kontinuierliche, ausreichend supprimierende Antibiotikaabgabe stattfand 90. Sowohl Batt als auch Pupka beschrieben dann 2003 den klinischen Einsatz von silberbeschichteten Prothesen bei Primärgraftinfektionen. Während Pupka et al. über die Implantation bei neun Patienten berichten, die zwar eine Verbesserung der klinischen Situation aber keine Ausheilung der Infektion erbrachte 32, beschreiben Batt et al. den Einsatz bei 27 Patienten. Dabei kam es während des Beobachtungszeitraumes zu lediglich einer Reinfektion, es waren keine Amputationen notwendig und die perioperative Mortalität betrug 4/27 (15%) 38. Dennoch erscheinen auch hier angesichts dieser vielversprechenden Ergebnisse noch weiterführende, größere Langzeitstudien notwendig, um die Resultate valide mit anderen In-situ- Rekonstruktionsverfahren vergleichen zu können. 55 In-situ-Bypass mit autologer Vene (SFPV) Einige Autoren sehen autologe Venen, im Besonderen superfiziale femoro-popliteale Venen, als das momentan optimale Graftmaterial bei infektionsbedingten Rekonstruktionen im Bereich der infrarenalen Aorta an. Als autologes Gewebe sind diese Venen widerstandsfähiger gegen Reinfektionen und können daher in situ implantiert werden. Bereits 1997 beschreibt Clagett die regelmäßige Verwendung von autologen Femoralvenen zum In-situ-Ersatz bei Protheseninfektion. Dabei erhielten 41 Patienten insgesamt 63 Rekonstruktionen mittels Venenimplantation. Die perioperative Mortalitätsrate betrug 0%, die 30-Tage-Mortalität 3/41 (7,3%). Postoperativ traten bei 49% der Patienten größere Problem im Sinne von Amputationen bei zwei Patienten (5%), Pulmonalarterienembolie bei einem Patienten und Kompartmentsyndrom bei 12% (5/41) auf 91. Gibbons erweiterte in seiner 2003 publizierten Arbeit das Gebrauchsfeld der femoro-poplitealen Venen hin zu arteriellen Rekonstruktionen bei Graftinfektionen und mykotischen Aneurysmen der aorto-iliakalen und femoralen Gefäße sowie der Viszeralgefäße in stark kontaminierten Gebieten 92 . Sechsundzwanzig Patienten unterzogen sich in dieser Studie einer arteriellen Rekonstruktion mit femoro-poplitealen Venen bei gesicherter Infektion (fünf mykotische Aneurysmen und 21 Primärgraftinfektionen). Wann immer möglich wurde intraoperativ eine Omentumplastik oder eine Musculus Rectus femoris-Lappenplastik eingesetzt, um die neu geschaffene Anastomose zu bedecken, sowie eine neue Gefäßtunnelung angelegt. Die durchschnittliche postoperative Krankenhausaufenthaltsdauer betrug 23 Tage (Spannbreite 12 - 124 Tage), ein Patient verstarb postoperativ. Im weiteren Verlauf waren keine Amputationen notwendig. In allen Spenderbeinen kam es zu transienten Beinödemen, fünf Patienten mit signifikanten Anastomosenstenosen nach sechs Wochen wurden mit einer perkutanen Angioplastie versorgt, ein Patient erhielt eine Profundaplastik innerhalb der ersten drei Monate postoperativ. Angesichts dieser Ergebnisse muss man zu dem Schluss kommen, dass die Vena femoralis superficialis eine gute Alternative zur extraanatomischen Bypass-Rekonstruktion bietet. Allerdings fehlen auch hier noch Langzeitergebnisse 93. Die Ergebnisse dieser Forschungsgruppen erscheinen vergleichbar denen in der hier vorgestellten Studie. Anzumerken ist, dass bei Gibbons et al. keine Patienten mit aortoenterischen Fisteln, welche üblicherweise mit einer erhöhten Mortalität einhergehen, in die Studie aufgenommen wurden. Das größte Problem bei dieser autologen Form des In-situ-Graftings bleibt jedoch, dass selten adäquate Graftvenen vorhanden sind. Denn wie bereits mehrfach erwähnt handelt es sich bei diesen Patientenkollektiven häufig um multimorbide Menschen höheren Alters mit entsprechenden Begleitfaktoren wie multiplen Voroperationen, chronischer Veneninsuffizienz und arteriosklerotisch veränderten Gefäßen. Diese Patienten haben ein erhöhtes Risiko für das 56 Auftreten von postoperativen Ödemen und Kompartmentsyndromen 93, 94. Ein weiterer Punkt, der gegen eine solche Rekonstruktion spricht, ist die Tatsache, dass für eine derartige autologe Rekonstruktion zwei synchron arbeitende Teams (abdominell-aortal und peripher venös) notwendig sind. Das ist nicht nur teurer sondern gerade bei schwerkranken Patienten, die eine Notfallversorgung benötigen, häufig nicht realisierbar 79. In-situ-Bypass mit frischen, arteriellen Allografts Diese operative Alternative gleicht im Wesentlichen der in dieser Arbeit schwerpunktmäßig behandelten Allograftimplantation mit dem Unterschied, dass es sich hier um frische, nicht kryokonservierte Grafts handelt. Bereits 1993 präsentierten Kieffer et al. eine Studie mit 43 Patienten, die bei infizierter infrarenaler Aortenprothese mit Implantation eines frischen, nicht kryokonservierten arteriellen Allograft behandelt wurden. Hierbei wurde auf die AB0Kompatibilität zwischen Spender und Empfänger keine Rücksicht genommen. Kieffer et al. berichten von einer 30-Tage-Mortalität von 12 % und einer Spätmortalität von ebenfalls 12 % (Gesamtmortalität 24%). Neun überlebende Patienten hatten pathologische Veränderungen an den Allografts, die mit wiederholten Operationen sowie perkutanen Eingriffen innerhalb des Beobachtungszeitraumes von 1-42 Monaten behoben wurden. Es gab keine Spätamputationen. Weiterhin lobten Kieffer et al. die deutliche Verbesserung im operativen Vorgehen, da durch die erhöhte Infektionsresistenz der arteriellen Allografts ein In-situ-Ersatz erlaubt ist, sowie die höhere mechanische Belastbarkeit der arteriellen im Vergleich zu den venösen Grafts 95. Als Nachteile bei dieser Form der Operation sieht er den Umstand der Relaparotomie, die langen Operationszeiten und die potentielle Notwendigkeit der suprarenalen Klemmung. Ähnlich wie Kieffer berichteten auch Chiesa et al. 1998 in einer Studie mit 44 Patienten, von denen 13 mit frischen arteriellen Allografts und 31 mit kryokonservierten, arteriellen Allografts behandelt wurden. Auch hier bestand keine AB0- und HLA- Kompatibilität 24. Chiesa et al. beschreiben eine 30-Tage-Mortalität von 13,6 %, drei notwendige Spätamputationen, jedoch keine signifikanten Unterschiede zwischen den Gruppen der frischen und kryokonservierten arteriellen Allografts. Ebenfalls keine signifikanten Unterschiede zwischen frischen und kryokonservierten arteriellen Allografts bezüglich der Antigenität und Abstoßungsreaktion konnten Moriyama et al. 2001 in ihrer tierexperimentellen Arbeit erkennen 96. 57 Tabelle 10 Vergleich der unterschiedlichen Rekonstruktionskonzepte bei Gefäß- resp. Protheseninfektionen (SFPV, autologe saphenopopliteale Vene). Autor (Jahr) Krankenhaus - Gesamt- Mortalität (Graftassoziiert) Mortalität (Graftassoziiert) n n (%) 43 44 (13 frisch und 31 kryokonserviert) Reinfektionen Reoperationen n (%) n n 5(12) 9(21) 3 6 6(14) 11(25) 8 5 15 1 (7) 1(7) 0 2 41 3 (7) – 0 – 26 1(4) 1(4) 3 7 7 2(29) 2(29) 0 1 Frische arterielle Allografts Kieffer et al. (1993)95 Chiesa et al. (1998)24 SFPV Nevelsteen et al. (1995)8 Clagett et al. (1997) 91 92 Gibbons et al. (2003) Franke et al. (1996) 97 Extraanatomisch Taylor et al. (1994)98 164 9(5) – 17 – 9 84 24(28) 49(58) 23 23 59 Gabriel et al. (2004) 19 2(11) 2(11) 7 7 84 92 16(17) 25(27) 9 9 Seeger et al. (2000) 36 4(11) 7(19) – 22 Kuestner et al. (1995)85 33 6(18) 9(27) 5 6 27 4(15) 4(15) 1 0 27 2 (8) 2(8) 2 2 11 2 (18) 4(36) 2 2 Oderich et al. (2006) 52 4(7) 4(7) 6 6 Aktuelle Studie, Brand (2007) 45 3(7) 3(7) 4 8 O`Hara et al. (1986) Reilly et al. (1984) 87 Silber-beschichtete Prothesen Batt et al. (2003)38 Rifampicin imprägnierte Grafts Bandyk et al. (2001)36 88 Hayes et al. (1999) 81 In der Tabelle 10 werden die hier vorgestellten Ergebnisse in den Gesamtkontext der unterschiedlichen Konzepte zur Gefäßrekonstruktion bei Gefäß- resp. Protheseninfektionen 58 gesetzt. Die aufgelisteten Studien wurden über eine Medline-Suche mit den Schlüsselwörtern „Insitu-Rekonstruktionen bei arteriellen Gefäßprotheseninfektionen“ und „Ex-situ-Rekonstruktionen bei Gefäßinfektionen im Bereich der infrarenalen Aorta“ ausgewählt. Hierbei zeigen sich im Bereich der graftassoziierten Krankenhaus-Mortalität vergleichbar gute Ergebnisse bei Rekonstruktionen mit superfizialen Venengrafts oder Rifampicin-imprägnierten Kunststoffgrafts. Lediglich die Studienergebnisse von Hayes et al. 88 und Franke et al. 97 zeigen – bei vergleichsweise geringer Fallzahl – eine erhöhte Frühmortalität. Extraanatomische Rekonstruktionsversuche sowie Implantation silberbeschichteter Prothesen zeigen eine im Vergleich höhere Frühmortalitätsrate. Frische arterielle Allografts zeigen Frühmortalitätsraten die etwas höher als die Ergebnisse der kryokonservierten Grafts sind (Tab. 10). Spätmortalitäten, Reinfektionen und Reoperationen liegen prozentual im Vergleich mit den kryokonservierten Grafts auf einem Niveau. Diese Ergebnisse sprechen nicht für einen signifikant negativen Einfluss der Kryokonservierung auf die Infektionsresistenz und Langzeit-Offenheitsrate arterieller Grafts. Im Bereich der Reinfektionen und Reoperationen zeigen sämtliche In-situ Rekonstruktionsansätze deutlich bessere Ergebnisse als die extraanatomische Rekonstruktion. 4.3 Limitationen der Studie Limitierende Aspekte der frequenten Nutzung arterieller Allografts sind ein mit aktuell noch hohen Kosten verbundenes Spendermanagement sowie die eingeschränkte Zahl vorhandener suffizienter Grafts. Derartige Probleme gilt es mittels verbesserter Kooperation und Organisation des Entnahme- und Qualitätsmanagements anzugehen, um eine geforderte Versorgung gewährleisten zu können. Limitierende Faktoren dieser Studie waren ihre Retrospektivität, das heterogene Patientengut mit unterschiedlichen Infektions- und Operationslokalisationen und unterschiedlichen Operationsindikationen sowie der relativ kurze postoperative Nachbeobachtungszeitraum, der Langzeitkomplikationen unberücksichtigt lässt. 4.4 Konsequenzen für die Praxis Die Implantation von humanen Allografts zur Therapie von Gefäß- und Gefäßprotheseninfektionen stellt im Vergleich mit der prothesialen extraanatomischen Bypassversorgung, der In-situRekonstruktion mit silberbeschichteten Prothesen und der autologen Venenrekonstruktion eine gute Alternative dar. Die in dieser Arbeit erzielten Ergebnisse sind mit den bisher publizierten durchaus vergleichbar, wobei die Heterogenität des Patientengutes und der Erkrankungen solche Vergleiche allerdings erheblich erschweren. Der aufgezeigte Behandlungspfad mit präoperativer Sicherung der Diagnose Infektion durch qualitativ möglichst hochwertige Bildgebung, präoperative Abstriche, intraoperatives Debridement, Anlage von Netzplomben oder 59 Verschiebeplastiken sowie der In-situ Rekonstruktion der Gefäßstrombahn, der perioperativen zunächst ungerichteten – dann erregerspezifischen Antibiotikagabe unter Einbeziehung von Pilzen hat sich in unserer Klinik durchaus bewährt. Eine engmaschige poststationäre Anbindung mit regelmäßigen klinischen Nachuntersuchungen erscheint dennoch sinnvoll, um eventuell auftretende Komplikationen wie Stenosen oder Aneurysmen, die aus der Literatur bekannt sind, zeitnah und ggf. endovaskulär zu therapieren. 60 5. Zusammenfassung Problemstellung Das primäre Ziel dieser Arbeit war die Analyse der klinischen Ergebnisse bei Patienten, die aufgrund einer Gefäß- oder Primärprotheseninfektion im Bereich der infrarenalen Aorta mit kryokonservierten arteriellen Allografts zur In-situ-Rekonstruktion behandelt wurden. Ein weiteres Ziel war der auf der internationalen Literatur basierende Vergleich der unterschiedlichen Konzepte zur Behandlung einer Prothesen- resp. Gefäßinfektion mit den hier vorgestellten Ergebnissen. Darüber hinaus sollte ein beispielhaftes Behandlungsregime bei bestehender Protheseninfektion erstellt werden. Patienten und Methoden Im Zeitraum zwischen Februar 2000 und April 2004 wurden insgesamt 45 Patienten aufgrund von Primärprotheseninfektionen oder mykotischen Aneurysmen mit kryokonservierten arteriellen Allografts behandelt. Die Operationsindikation war bei 33 Patienten eine isolierte Primärgraftinfektion, bei sechs Patienten ein mykotisches Aneurysma ohne Voroperation und bei sechs Weiteren Primärgraftinfektionen verkompliziert durch eine aorto-enterische Fistel. Die Rekonstruktion bestand in 22 Bypässen, 18 infrarenalen Y-Prothesen und fünf anderen Verfahren. Die Ergebnisse wurden hinsichtlich allograftassoziierter Früh- und Spätmortalität, Amputationsrate, operationsbedingter Morbidität, Krankenhausaufenthaltsdauer, Patientenüberleben sowie Reoperations- und Reinfektionsrate analysiert. Ergebnisse In die von uns durchgeführte retrospektive klinische Studie wurden 45 Patienten (13 Frauen und 32 Männer, Altersmedian 65 Jahre, Range 40-89 Jahre) eingeschlossen, sämtliche Patienten waren aufgrund einer Gefäß- resp. Protheseninfektion mittels Implantation kryokonservierter arterieller Allografts behandelt worden. Bei der initialen Krankenhausaufnahme imponierten 33 Patienten mit einer isolierten Primärgraftinfektion, sechs mit einer Kombination einer Primärgraftinfektion mit einer prothesio-digestiven Fistel und sechs mit einem mykotischen Aneurysma. Es wurden insgesamt 29 intraabdominelle und 16 extraabdominelle Eingriffe durchgeführt. Die postoperative Aufenthaltsdauer auf der Intensivstation betrug 6,3 Tage (Range 1-41 Tage), die Gesamtaufenthaltsdauer postoperativ im Mittel 25 Tage. Während des stationären Aufenthaltes mussten neun Patienten graftbedingt reoperiert werden. Die 30-Tage Mortalität für das gesamte Kollektiv betrug 17,6% (8/45), wobei die allograftassoziierte Mortalität bei 6,7% (3/45) lag. Die 61 Gesamtmortalität betrug bei Abschluss der Beobachtung 26,6% (12/45), die allograftassoziierte Gesamtmortalität lag unverändert bei 6,7% (3/45). Die Reinfektionsrate lag bei Abschluss dieser Studie bei 8,9% (4/45) Es waren keine Majoramputationen notwendig. Schlussfolgerung Die In-situ-Rekonstruktion infizierter Gefäßprothesen oder Gefäße mittels Implantation kryokonservierter arterieller Allografts stellt ein sicheres und effizientes Verfahren für eine Hochrisikogruppe von Patienten dar. Die relative Infektionsresistenz der Allografts könnte mit der Wandstruktur und der Viabilität des Grafts zusammenhängen, welches einen verbesserten Transfer von Medikamenten und immunkompetenten Zellen in das graftumgebende Gewebe erlaubt. Des Weiteren kann möglicherweise bedingt durch die Lagerung in antibiotischer Lösung und die bei uns gängige Praxis der Imprägnierung des Grafts mit Nebacetin und Fibrinkleber eine gesteigerte antimikrobielle Aktivität im Vergleich zu konventionellen Grafts bedingt sein. Allerdings ist diese erhöhte Infektionsresistenz bisher noch nicht in einer Meta-Analyse randomisierter Studien im Sinne einer Level 1 – Studie nach den Richtlinien der Evidenzbasierten Medizin bewiesen worden. Dementsprechend gilt es in den nächsten Jahren die zunehmende Erfahrung der implantierenden Chirurgen immer neu zu evaluieren sowie eine kontinuierliche wissenschaftliche Erforschung der unterschiedlichen Präparationsmethoden, Veränderungen der Kryokonservierungsprotokolle und Langzeitergebnisse des Einflusses der Lagerung auf Qualität und Viabilität der arteriellen Grafts sowie klinische Langzeitüberlebensanalysen auszuwerten. Limitierende Aspekte der frequenten Nutzung arterieller Allografts sind ein mit aktuell noch hohen Kosten verbundenes Spendermanagement sowie die eingeschränkte Zahl vorhandener suffizienter Grafts. Derartige Probleme gilt es mittels verbesserter Kooperation und Organisation des Entnahme- und Qualitätsmanagements anzugehen, um eine geforderte Versorgung gewährleisten zu können. Limitierende Faktoren dieser Studie waren ihre Retrospektivität, das heterogene Patientengut mit unterschiedlichen Infektions- und Operationslokalisationen und unterschiedlichen Operationsindikationen sowie der relativ kurze postoperative Nachbeobachtungszeitraum, der Langzeitkomplikationen unberücksichtigt lässt. Eine engmaschige poststationäre Anbindung mit regelmäßigen klinischen Nachuntersuchungen erscheint sinnvoll, um eventuell auftretende Komplikationen zeitnah ggf. endovaskulär zu therapieren. 62 6. Literaturverzeichnis 1. Bandyk D, Esses G. Prosthetic graft infection. Surg Clin North Am 1994; 74(3):571-90. 2. Deiparine M, Ballard JL, Taylor FC, Chase D. Endovascular stent infection. J Vasc Surg 1996; 23 3. Fry W, Lindenauer SM. Infection complicating the use of plastic arterial implants. Arch Surg 1967; 94 4. Goldstone J, Moore W. Infection in vascular prostheses. Clinical manifestations and surgical management. Am J Surg 1974; 128(2):225-33. 5. Liekweg W, Greenfield LJ. Vascular prosthetic infections: Collected experience and results of treatment. Surgery 1977; 81 6. Lorentzen J, Nielsen O, Arendrup H, Kimose H, Bille S, Andersen J, Jensen Ch, Jacobsen F, Roder OC. Vascular graft infection: An analysis of sixty-two graft infections in 2411 consecutively implanted synthetic vascular grafts. Surgery 1985; 98(1):81-6 7. Naylor A, Payne D, London NJ, Thompson MM, Dennis MS, Sayers RD, Bell PR. Regarding "Limitations in the use of rifampicin-gelatin grafts against virulent organisms". Eur J Vasc Endovasc Surg 2002; 23, 11-6. 8. Nevelsteen A, Lacroix H, Suy R. Autogenous reconstruction with the lower extremity deep veins: An alternative treatment of prosthetic infection after reconstructive surgery for aortoiliac disease. J Vasc Surg 1995; 22: 129-34. 9. O'Hara P, Hertzer N, Beven E, Krajewski L. Surgical management of infected abdominal aortic grafts: review of a 25-year experience. J Vasc Surg 1986; 3: 725-31. 10. Ohki T, Veith F, Shaw P, Lipsitz E, Suggs W, Wain R, Bade M, Mehta M, Cayne N, Cynamon J, Valldares J, McKay. Increasing incidence of midterm and long-term complications after endovascular graft repair of abdominal aortic aneurysms: a note of caution based on a 9-year experience. Ann Surg 2001; 234: 323-34. 11. Rosenthal D, Archie JJ, Garcia-Rinaldi R, Seagraves MA, Baird D, McKinsey J, Lamis PA, Clark MD, Erdoes LS, Whitehead T. Carotid patch angioplasty: immediate and long-term results. J Vasc Surg 1990 12. Szilagyi D, Smith R, Elliott J, Vrandecic M. Infection in arterial reconstruction with synthetic grafts. Ann Surg 1972 13. Chiesa R, Astore D, Frigerio S, Garriboli L, Piccolo G, Castellano R, Scalamogna M, Odera A, Pirrelli S, Biasi G, Mingazzini P, Biglioli P, Polvani G, Guarino A, Agrifoglio G, Tori A, Spina G. Vascular prosthetic graft infection: epidemiology, bacteriology, pathogenesis and treatment. Acta Chir Belg 2002; 102(4):238-47. 63 14. Gross R, Hurwitt E, Bill A, Peirce E. Preliminary observations on the use of human arterial grafts in the treatment of certain cardiovascular defects. New Eng J Med 1948; 239:578-579. 15. Dubost C, Oeconomos N, Durand M, Metianu C. Greffe d'aorte humaine conservée. Semaine des Hopitaux de Paris 1950; 87:4497-4500. 16. Carrel A. Ultimate result of aortic transplantation. J Exp Med 1912; 15: 389-398. 17. Carrel A, Guthrie C. Uniterminal and biterminal venous transplantation. Surg Gynecol Obstet. 1906; 2:266-286. 18. Eastcott HHG, Hufnagel CA. The preservation of arterial grafts by freezing. Philadelphia: Saunders; 1950. 19. Marrangoni A, Cecchini L. Homotransplantation of arterial segments preserved by the freezedrying method. Ann.Surg. 1951; 134:977. 20. Barner H, De Weese JA. Aneurysmal degeneration of arterial homografts. Am Heart J 1967; 73(2):289-91. 21. Knox W, Miller R. Long-term appraisal of aortic and arterial homografts implanted in years 1954-1957. Ann Surg 1970; 172(6):1076-8. 22. Voorhees A, Jarctski A, Blakemore A. The use of tubes constructed from Vinyon "N" clot in bridging arterial defects. Ann.Surg. 1952;135:332. 23. Callow AD. Arterial homografts. Eur J Vasc Endovasc Surg 1996; 12(3):272-81. 24. Chiesa R, Astore D, Piccolo G, Melissano G, Jannello A, Frigerio D, Agrifoglio G; Bonalumi F; Corsi G; Constantini-Brancadoro S, Novali C, Locati P, Odero A, Pirrelli S, Cugnasca M, Biglioli P, Sala A, Polvani G, Guarino A, Biasi GM, Mingazzini P, Scalamogna M, Mantero S, Spina G, Prestipino F. Fresh and cryopreserved arterial homografts in the treatment of prosthetic graft infections: experience of the Italian Collaborative Vascular Homograft Group. Ann Vasc Surg 1998; 12(5):457-62. 25. Knosalla C, Goeau-Brissonniere O, Leflon V, Bruneval P, Eugene M, Pechere J, Koskas F, Nicolas MH, Leschi JP, Gerota J; Kieffer E. Treatment of vascular graft infection by in situ replacement with cryopreserved aortic allografts: an experimental study. J Vasc Surg 1998; 27(4):689-98. 26. Vogt PR, von Segesser LK, Goffin Y, Pasic M, Turina MI. Cryopreserved arterial homografts for in situ reconstruction of mycotic aneurysms and prosthetic graft infection. Eur J Cardiothorac Surg 1995; 9(9):502-6. 64 27. Vogt PR, Turina MI. Cryopreserved aortic homografts for mycotic aneurysms and infected arterial grafts. In: Yankah AC, Yakoub MH, Hetzer R, editors. Cardiac valve allografts. Darmstadt: Steinkopff; 1997. p. 227-241. 28. Vogt P, Pfammatter T, Schlumpf R, Genoni M, Kunzli A, Candinas D, Zund G, Turina MI. In situ repair of aortobronchial, aortoesophageal, and aortoenteric fistulae with cryopreserved aortic homografts. J Vasc Surg 1997; 26(1):11-7. 29. da Gama D, Sarmento C, Vieira T, do Carmo G. The use of arterial homografts for vascular reconstruction in patients receiving immunosuppression for organ transplantation. J Vasc Surg 1994; 20. 30. Schmitz-Rixen T, Megerman J, Colvin R, Williams A, Abbott W. Immunosuppressive treatment of aortic allografts. J Vasc Surg 1988; 7(1):82-92. 31. Vischjager M, Van GT, Van MJ, Pfaffendorf M, Jacobs M. Function of cryopreserved arterial allografts under immunosuppressive protection with cyclosporine A. J Vasc Surg 1996;24(5):876-82. 32. Pupka A, Skora J, Janczak D, Rucinski A, Korta K, Barc P, Stepinski P, Szyber P. The treatment of massive prosthetic grafts infections with the use of silver/collagen coated dacron vascular prosthesis. Polim Med 2003; 33(1-2):41-5. 33. Gournier JP, Adham M, Favre JP, Raba M, Bancel B, Lepetit JC, Barral X. Cryopreserved arterial homografts: preliminary study. Ann Vasc Surg 1993 34. Pascual G, Martinez S, Garcia-Honduvilla N, Corrales C, Bellon J, Bujan J. Long-term behaviour of cryopreserved arterial grafts versus prosthetic micrografts. Eur J Vasc Endovasc Surg 2004; 27(4):423-31. 35. Edwards W. Arterial grafts: past, present, and future. Arch Surg 1978; 113(11):1225-33. 36. Bandyk D, Novotney M, Back M, Johnson B, Schmacht D. Expanded application of in situ replacement for prosthetic graft infection. J Vasc Surg 2001; 34(3):411-9; discussion 419-20. 37. Earnshaw J. Conservative surgery for aortic graft infection. Cardiovasc Surg 1996; 4(5):570-2. 38. Batt M, Magne J, Alric P, Muzj A, Ruotolo C, Ljungstrom K, Garcia-Casas R, Simms M. In situ revascularization with silver-coated polyester grafts to treat aortic infection: early and midterm results. J Vasc Surg 2003; 38(5):983-9. 39. Lyman D, Metcalf L, Albo D, Richards K, Lamb J. The effect of chemical structure and surface properties of synthetic polymers on the coagulation of blood. III. In vivo adsorption of proteins on polymer surfaces. Trans Am Soc Artif Intern Organs 1974; 20 B:474-8. 65 40. Drury J, Ashton T, Cunningham J, Maini R, Pollock J. Experimental and clinical experience with a gelatin impregnated Dacron prosthesis. Ann Vasc Surg 1987; 1(5):542-7. 41. Schepens M. Dilation of knitted grafts in thoracic aorta. Eur J Cardiothorac Surg 2001; 20(2):430-1. 42. Nunn D. Structural failure of Dacron arterial grafts. Semin Vasc Surg 1999; 12: 83-91. 43. Eid A, Lyass S. Acute perigraft seroma simulating anastomotic bleeding of a PTFE graft applied as an arteriovenous shunt for hemodialysis. Ann Vasc Surg 1996; 10: 290-1. 44. Herring M, Smith J, Dalsing M, Glover J, Compton R, Etchberger K, Zollinger T. Endothelial seeding of polytetrafluoroethylene femoral popliteal bypasses: the failure of low-density seeding to improve patency. J Vasc Surg 1994; 20: 650-5. 45. Mirelli M, Buzzi M, Pasquinelli G, Tazzari P, Testi G, Ricchi E, Conte R, Stella A. Fresh and cryopreserved arterial homografts: immunological and clinical results. Transplant Proc 2005; 37(6):2688-91. 46. Zhou W, Lin P, Bush R, Terramani T, Matsuura J, Cox M, Peden E, Guerrero M, Silberfein EJ, Dardik A, Rosenthal D, Lumsden AB. In situ reconstruction with cryopreserved arterial allografts for management of mycotic aneurysms or aortic prosthetic graft infections: a multi-institutional experience. Tex Heart Inst J 2006; 33(1):14-8. 47. Bandyk D. Vascular graft infections: epidemiology, microbiology, pathogenesis and prevention. In: Bernhard VM, Towne JB (Eds.): Complications in vascular surgery. St.Louis, Quality Medical Publishing 1991: 223-234. 48. Association Universitaire de Recherche en Chirurgie G-BO. Etude prospective de 597 protheses aorto-femorales: resultats preliminaires. 1996; 4e Congres International sur la Prophylaxie des Infections. 49. Horan T, Gaynes R, Martone W, Jarvis W, Emori T. CDC definitions of nosocomial surgical site infections, 1992: a modification of CDC definitions of surgical wound infections. Am J Infect Control 1992;20(5):271-4. 50. Osler W. The Gulstonian lectures on malignant endocarditis. Br Med J 1885; 1:467-470. 51. Patel S, Johnston K. Classification and management of mycotic aneurysms. Surg Gynecol Obstet 1977; 144(5):691-4. 52. Wilson S, Van WP, Passaro E. Arterial infection. Curr Probl Surg 1978; 15(9):1-89. 53. Moore W. Physiopathology et classification des infectiones arterielles. In: Kieffer E, Goeau-Brissonniere O, Pechere JC (Eds.): Infections arterielles 1997:35-42. 66 54. Ernst C, Campbell H, Daugherty M, Sachatello C, Griffen W. Incidence and significance of intra-operative bacterial cultures during abdominal aortic aneurysmectomy. Ann Surg 1977; 185(6):626-33. 55. Roon A, Malone J, Moore W, Bean B, Campagna G. Bacteremic infectability: a function of vascular graft material and design. J Surg Res 1977;22(5):489-98. 56. Vollmar J, Kogel H. Aorto-enteric fistulas as postoperative complication. J Cardiovasc Surg (Torino) 1987; 28(5):479-84. 57. Bunt T. Synthetic vascular graft infections. II. Graft-enteric erosions and graft-enteric fistulas. Surgery 1983; 94(1):1-9. 58. Bunt T. Synthetic vascular graft infections. I. Graft infections. Surgery 1983; 93(6):733-46. 59. Gabriel M, Pukacki F, Checinski P, Oszkinis G, Stanisic M, Zielinski M, Pawlaczyk K. Current options in prosthetic vascular graft infection: comparative analysis of 63 consecutive cases. Langenbecks Arch Surg 2004; 389(4):272-7. 60. Gabriel M, Pukacki F, Dzieciuchowicz L, Oszkinis G, Checinski P. Cryopreserved arterial allografts in the treatment of prosthetic graft infections. Eur J Vasc Endovasc Surg 2004; 27(6):590-6. 61. Teebken O, Pichlmaier M, Brand S, Haverich A. Cryopreserved arterial allografts for in situ reconstruction of infected arterial vessels. Eur J Vasc Endovasc Surg 2004; 27(6):597-602. 62. Baena DJ, Alvarez PB, Pinol FP, Martin PR, Nicolau SM, Altes BA. Association between clustering of cardiovascular risk factors and the risk of cardiovascular disease. Rev Esp Salud Publica 2002; 76(1):7-15. 63. Diehm C, Kareem S, Lawall H. Epidemiology of peripheral arterial disease. Vasa 2004; 33(4):183-9. 64. Nasr C, Hoogwerf B, Faiman C, Reddy S. United Kingdom Prospective Diabetes Study (UKPDS). Effects of glucose and blood pressure control on complications of type 2 diabetes mellitus. Cleve Clin J Med 1999; 66(4):247-53. 65. Das S, Chakrabarti R. Non-insulin dependent diabetes mellitus: present therapies and new drug targets. Mini Rev Med Chem 2005; 5(11):1019-34. 66. Hosomi N, Noma T, Ohyama H, Takahashi T, Kohno M. Vascular proliferation and transforming growth factor-beta expression in pre- and early stage of diabetes mellitus in Otsuka Long-Evans Tokushima fatty rats. Atherosclerosis 2002;162(1):69-76. 67. Trübestein G. Arterielle Durchblutungsstörungen. In: Gerok, W., Huber, C., Meinertz, T., Zeidler, H.: Die Innere Medizin, Schattauer 2000;10:419-446. 67 68. Ritz E. Renal dysfunction: a novel indicator and potential promoter of cardiovascular risk. Clin Med 2003;3(4):357-60. 69. Wolfram G. Adipositas, Magersucht, Störungen des Eßverhaltens. In: Gerok, W., Huber, C., Meinertz, T., Zeidler, H.: Die Innere Medizin, Schattauer 2000;10:1211-22. 70. Meyer J. Erkrankungen des Koronarkreislaufes. In: Gerok, W., Huber, C., Meinertz, T., Zeidler, H.: Die Innere Medizin, Schattauer 2000;10:244-270. 71. Rutherford RB. In: Vascular Surgery. Section VIII Open Vascular Surgery: Basic Considerations 2005; 6th edition, Saunders. 72. Alonso M, Caeiro S, Cachaldora J, Segura R. Infected abdominal aortic aneurysm: in situ replacement with cryopreserved arterial homograft. J Cardiovasc Surg (Torino) 1997; 38(4):371-5. 73. Desgranges P, Beaujan F, Brunet S, Cavillon A, Qvarfordt P, Melliere D, Becquemin JP. Cryopreserved arterial allografts used for the treatment of infected vascular grafts. Ann Vasc Surg 1998; 12(6):583-8. 74. Eugene M, Gerota J. Cryopreserved aortic allograft replacement of infected prosthetic grafts in man: processing and clinical results. Transpl Int 1998; 11 Suppl 1:S452-4. 75. Locati P, Novali C, Socrate AM, Costantini E, Morlacchi E, Piazzalunga G, Costantini S. The use of arterial allografts in aortic graft infections. A three year experience on eighteen patients. J Cardiovasc Surg (Torino) 1998; 39(6):735-41. 76. Nevelsteen A, Feryn T, Lacroix H, Suy R, Goffin Y. Experience with cryopreserved arterial allografts in the treatment of prosthetic graft infections. Cardiovasc Surg 1998; 6(4):378-83. 77. Verhelst R, Lacroix V, Vraux H, Lavigne J, Vandamme H, Limet R, Nevelsteen A, Bellens B, Vasseur MA, Wozniak B, Goffin Y. Use of cryopreserved arterial homografts for management of infected prosthetic grafts: a multicentric study. Ann Vasc Surg 2000; 14(6):602-7. 78. Leseche G, Castier Y, Petit M, Bertrand P, Kitzis M, Mussot S, Besnard M, Cerceau O. Long-term results of cryopreserved arterial allograft reconstruction in infected prosthetic grafts and mycotic aneurysms of the abdominal aorta. J Vasc Surg 2001; 34(4):616-22. 79. Noel A, Gloviczki P, Cherry K, Safi H, Goldstone J, Morasch M, Johansen KH. Abdominal aortic reconstruction in infected fields: early results of the United States cryopreserved aortic allograft registry. J Vasc Surg 2002; 35(5):847-52. 80. Castier Y, Francis F, Cerceau P, Besnard M, Albertin J, Fouilhe L, Cerceau O, Albaladejo P, Leseche G. Cryopreserved arterial allograft reconstruction for peripheral graft infection. J Vasc Surg 2005; 41(1):30-7. 68 81. Oderich G, Bower T, Cherry K, Panneton J, Sullivan T, Noel A, Carmo M, Cha S, Kalra M, Gloviczki P. Evolution from axillofemoral to in situ prosthetic reconstruction for the treatment of aortic graft infections at a single center. J Vasc Surg 2006; 43(6):1166-74. 82. Ten RS, Van SM, Hagenaars T, Van UH. Management of aortic graft infection. J Cardiovasc Surg (Torino) 2002; 43(2):209-15. 83. Vogt PR, Brunner-La Rocca HP, Carrel T, von Segesser LK, Ruef C, Debatin J, Seifert B, Kiowski W, Turina MI. Cryopreserved arterial allografts in the treatment of major vascular infection: a comparison with conventional surgical techniques. J Thorac Cardiovasc Surg 1998; 116(6):965-72. 84. Reilly L, Altman H, Lusby R, Kersh R, Ehrenfeld W, Stoney R. Late results following surgical management of vascular graft infection. J Vasc Surg 1984; 1(1):36-44. 85. Kuestner L, Reilly L, Jicha D, Ehrenfeld W, Goldstone J, Stoney R. Secondary aortoenteric fistula: contemporary outcome with use of extraanatomic bypass and infected graft excision. J Vasc Surg 1995; 21(2):184-95; discussion 195-6. 86. Yeager R, Taylor L, Moneta G, Edwards J, Nicoloff A, McConnell D, Porter JM. Improved results with conventional management of infrarenal aortic infection. J Vasc Surg 1999; 30(1):76-83. 87. Seeger J, Pretus H, Welborn M, Ozaki C, Flynn T, Huber T. Long-term outcome after treatment of aortic graft infection with staged extra-anatomic bypass grafting and aortic graft removal. J Vasc Surg 2000; 32(3):451-9; discussion 460-1. 88. Hayes P, Nasim A, London N, Sayers R, Barrie W, Bell P, Naylor AR. In situ replacement of infected aortic grafts with rifampicin-bonded prostheses: the Leicester experience (1992 to 1998). J Vasc Surg 1999; 30(1):92-8. 89. Colburn MD, Moore WS, Chvapil M, Gelabert HA, Quinones-Baldrich WJ. Use of an antibiotic-bonded graft for in situ reconstruction after prosthetic graft infections. J Vasc Surg 1993 90. Kinney E, Bandyk D, Seabrook G, Kelly H, Towne J. Antibiotic-bonded PTFE vascular grafts: the effect of silver antibiotic on bioactivity following implantation. J Surg Res 1991; 50(5):430-5. 91. Clagett G, Valentine R, Hagino R. Autogenous aortoiliac/femoral reconstruction from superficial femoral-popliteal veins: feasibility and durability. J Vasc Surg 1997; 25(2):255-66; discussion 267-70. 69 92. Gibbons C, Ferguson C, Fligelstone L, Edwards K. Experience with femoro-popliteal vein as a conduit for vascular reconstruction in infected fields. Eur J Vasc Endovasc Surg 2003; 25(5):424-31. 93. Valentine R, Clagett G. Aortic graft infections: replacement with autogenous vein. Cardiovasc Surg 2001; 9(5):419-25. 94. Wells J, Hagino R, Bargmann K, Jackson M, Valentine R, Kakish H, Clagett GP. Venous morbidity after superficial femoral-popliteal vein harvest. J Vasc Surg 1999; 29(2):282-89; discussion 289-91. 95. Kieffer E, Bahnini A, Koskas F, Ruotolo C, Le Blevec D, Plissonnier D. In situ allograft replacement of infected infrarenal aortic prosthetic grafts: results in forty-three patients. J Vasc Surg 1993; 17(2):349-55; discussion 355-6. 96. Moriyama S, Utoh J, Sun L, Tagami H, Okamoto K, Kunitomo R, Kitamura N. Antigenicity of cryopreserved arterial allografts: comparison with fresh and glutaraldehyde treated grafts. ASAIO J 2001; 47(3):202-5. 97. Franke S, Voit R. The superficial femoral vein in aorto-iliac position--suitable as autogenous vascular replacement in deep prosthesis infection?. Chirurg 1996; 67(8):843-9. 98. Taylor L, Moneta G, McConnell D, Yeager R, Edwards J, Porter J. Axillofemoral grafting with externally supported polytetrafluoroethylene. Arch Surg 1994; 129(6):588-94; discussion 594-5. 99. Bahnini A, Plissonnier D, Koskas F, Kieffer E. Treatment of prostheto-digestive using arterial allograft. J Mal Vasc 1996; 21 Suppl A: 167-70. 100. Reilly L. Aortic graft infection: evolution in management. Cardiovasc Surg 2002; 10(4):372-7. 101. Clagett G, Bowers B, Lopez-Viego M, Rossi M, Valentine R, Myers S, Chervu A. Creation of a neo-aortoiliac system from lower extremity deep and superficial veins. Ann Surg 1993; 218(3):239-48; discussion 248-9. 102. Bandyk D, Bergamini T, Kinney E, Seabrook G, Towne J. In situ replacement of vascular prostheses infected by bacterial biofilms. J Vasc Surg 1991; 13(5):575-83. 103. Bandyk D. Diagnosis and treatment of biomaterial-associated vascular infections. Infect Dis Clin North Am 1992; 6(3):719-29. 104. Wagstaff S, Grigg M. Arterial homografts--a possible solution to an infective dilemma. Cardiovasc Surg 1996; 4(6):796-800. 105. Leschke M, Schoebel F, Strauer B. Low-dose intermittent urokinase therapy in chronic symptomatic end-stage arterial disease--clinical relevance for patients with coronary artery 70 disease or peripheral arterial occlusive disease. Clin Hemorheol Microcirc 1997; 17(1):59-66. 106. Schwartz J. Peripheral arterial disease: drug therapy. J Gend Specif Med 2002;5(4):16-20. 107. Schweizer J, Kaulen R, Altmann E, Nierade A, Nanning T. [Are beta-blockers generally contraindicated in patients with peripheral arterial occlusive disease?]. Z Kardiol 1996; 85(3):193-7 71 7. Anhang 7.1 Tabellenverzeichnis Tabelle 1: Präoperative Befunde...................................................................................................26 Tabelle 2: Voroperationen bei 45 Patienten.................................................................................27 Tabelle 3: Perioperativ nachgewiesene Erreger..........................................................................31 Tabelle 4: Zeitspanne zwischen Voroperation und Allograftimplantation...............................32 Tabelle 5: Infektlokalisation und Operation................................................................................32 Tabelle 6: Prozentuale Verteilung der implantierten arteriellen Allografts.............................34 Tabelle 7: Perioperative Prozeduren............................................................................................34 Tabelle 8: Postoperative Aufenthaltsdauer auf der Intensivstation..........................................47 Tabelle 9: Ergebnisses selektiver Studien.....................................................................................52 Tabelle 10: Unterschiedliche Rekonstruktionskonzepte bei Protheseninfektionen ................57 Tabelle 11: Charakteristika sämtlicher Patienten.......................................................................73 7.2 Abbildungsverzeichnis Abbildung 1: Intraoperativer Befund einer infizierten Prothese...............................................23 Abbildung 2: Intraoperativ Allograftimplantation.....................................................................23 Abbildung 3: Allograftpräparation 1. Schritt..............................................................................24 Abbildung 4: Allograftpräparation 2. Schritt..............................................................................24 Abbildung 5: Allograftpräparation 3. Schritt..............................................................................24 Abbildung 6: Allograft nach Präparation und vor Implantation..............................................24 Abbildung 7: Altersverteilung nach Geschlecht..........................................................................25 Abbildung 8: Präoperative CT......................................................................................................29 Abbildung 9: DSA einer aorto-enterischen Fistel .......................................................................29 Abbildung 10: Intraoperativ entnommenes infiziertes Prothesensegment...............................29 Abbildung 11: Postoperative DSA (1)...........................................................................................29 Abbildung 12: 3D-Rekonstruktion zur klinischen Verlaufskontrolle.......................................30 Abbildung 13: Postoperative DSA (2)...........................................................................................30 Abbildung 14: Gesamtüberlebenswahrscheinlichkeit in Abhängigkeit der Zeit......................36 Abbildung 15: Überlebenszeit der Patienten nach Operationsindikation.................................39 Abbildung 16: Überlebenszeit der Patienten mit / ohne ORSA-Nachweis................................41 Abbildung 17: Überlebenszeit der Patienten mit / ohne klinisch manifester pAVK................42 72 Abbildung 18: Überlebenszeit nach Operationslokalisation und Komorbidität......................43 Abbildung 19: Überlebenszeit der Patienten mit arterieller Hypertonie..................................44 73 Tabelle 11 Charakteristika sämtlicher Patienten Pat Gender Age Infektlokalisation Primärprothese Operationsindikation implantierter Allograft 1 w 89 A. prof. fem. re. Fem.-pop. Bypass re. isolierter Protheseninfekt Fem.-prothesialer Bypass re. 2 m 63 A. poplitea re. infrarenale Rohrprothese isolierter Protheseninfekt Aorto-biiliacale Y-Prothese 3 m 40 A.fem.com. re. Venenpatchplastik re. isolierter Protheseninfekt Allograft-Patchplastik re. 4 m 58 A. fem. superf. li. Iliaco-pop. Bypass li. isolierter Protheseninfekt Iliaco-pop. Bypass li. 5 w 80 A. iliaca com. li. Iliaco-prof. Bypass li. isolierter Protheseninfekt Aorto-prof. Bypass li. 6 m 66 A. iliaca com. li. keine mykotisches Aneurysma Iliaco-fem. Bypass li. 7 m 72 Aa. iliacae comm. keine mykotisches Aneurysma Aorto-biiliacale Y-Prothese 8 w 52 A. iliaca com. li. infrarenale Y-Prothese isolierter Protheseninfekt prothesio-fem. Allograft-Interponat li. 9 m 73 Aa. iliacae comm. infrarenale Y-Prothese isolierter Protheseninfekt Aorto-biiliacale Y-Prothese 10 m 75 distale A. abd. infrarenale Y-Prothese isolierter Protheseninfekt Aorto-biiliacale Y-Prothese 11 m 72 distale A. abd. infrarenale Y-Prothese isolierter Protheseninfekt Aorto-biiliacale Y-Prothese 12 w 76 Aa. iliacae comm. infrarenale Y-Prothese isolierter Protheseninfekt Aorto-biiliacale Y-Prothese 13 w 75 Aa. iliacae comm. infrarenale Y-Prothese isolierter Protheseninfekt Aorto-bifemorale Y-Prothese 14 m 55 A. iliaca com. li. infrarenale Y-Prothese isolierter Protheseninfekt Allograftersatz Prothesenschenkel re. 15 m 42 A. fem. com. /A. prof. fem. re. Venenpatchplastik re. isolierter Protheseninfekt Fem.-pop. Bypass re. 16 w 61 Aa .iliacae externae infrarenale Y-Prothese prothesio-enterische Fistel Aorto-biprofundale Y-Prothese 17 m 82 A. iliaca externa /A. prof. fem. li. Iliaco-fem. Bypass li. isolierter Protheseninfekt Iliaco-fem. Bypass li. 18 m 58 Aa. iliacae comm. infrarenale Y-Prothese isolierter Protheseninfekt Aorto-bifemorale Y-Prothese 19 w 42 A. iliaca externa re. Iliaco-fem. Bypass re. isolierter Protheseninfekt Aorto-iliacales Allograft-Interpomat re. 20 w 74 Aa iliacae comm. infrarenale Y-Prothese isolierter Protheseninfekt Aorto-biprofundale Y-Prothese 21 m 63 A. prof. fem. li. keine mykotisches Aneurysma Aorto-femorales Allograft-Interponat li. 22 m 75 A. fem. com. / A. prof. fem. re. keine mykotisches Aneurysma Iliaco-femorales Allograft-Interponat re. 74 Tabelle 11 Charakteristika sämtlicher Patienten 23 w 75 A. iliaca externa / A. prof. fem. li. Iliaco-fem. Bypass li. isolierter Protheseninfekt Iliaco-fem. Bypass li. 24 m 65 A. abd. / Aa. iliacae comm. infrarenale Y-Prothese isolierter Protheseninfekt Aorto-bifemorale Y-Prothese 25 m 72 A. fem. com. / A. fem. superf. re. keine mykotisches Aneurysma Iliaco-fem. Bypass re. 26 m 67 A. fem. superf. li. Iliaco-fem. Bypass li. isolierter Protheseninfekt Iliaco-fem. Bypass li. 27 m 67 A. iliaca com. li. keine mykotisches Aneurysma Aorto-fem. Bypass li. 28 m 67 A. iliaca externa / A. prof. fem. li. Iliaco-fem. Bypass li. prothesio-enterische Fistel Iliaco-pop. Bypass li. 29 m 69 A. fem. superf. /A. poplitea re. Fem.-pop. Bypass re. isolierter Protheseninfekt Fem.-pop. Bypass re. 30 m 66 A. fem. superf. / A. poplitea re. Fem.-pop. Bypass re. isolierter Protheseninfekt Fem.-pop. Bypass re. 31 w 49 A. iliaca com. / A. fem. superf. re. Iliaco-fem. Bypass re. isolierter Protheseninfekt Iliaco- / aorto-fem. Bypass re. 32 m 72 Aa. iliacae comm. infrarenale Y-Prothese isolierter Protheseninfekt Aorto-bifemorale Y-Prothese 33 w 51 A. iliaca com. li. infrarenale Y-Prothese isolierter Protheseninfekt Allograftersatz Prothesenschenkel li. 34 m 62 Aa. femorales .superf.. infrarenale Y-Prothese isolierter Protheseninfekt Prothesio-prof. Allograft-Interponat bd. 35 w 65 A. iliaca externa /A. prof. fem. re. Iliaco-iliacaler Bypass re. isolierter Protheseninfekt Iliaco-prof. Allograft-Interponat re. 36 m 60 Aa. iliacae comm. infrarenale Y-Prothese prothesio-enterische Fistel Aorto-biprofundale Y-Prothese 37 m 63 A. abd. infrarenale Rohrprothese prothesio-enterische Fistel infrarenale Rohrprothese 38 m 70 A. iliaca externa re. Fem.-pop. Bypass re. isolierter Protheseninfekt Iliaco-fem. Bypass re. 39 m 58 A. abd. infrarenale Rohrprothese isolierter Protheseninfekt infrarenale Rohrprothese 40 m 61 Aa. iliacae comm. infrarenale Y-Prothese prothesio-enterische Fistel Aorto-bifemorale Y-Prothese 41 m 56 distale A. abd. infrarenale Y-Prothese isolierter Protheseninfekt Aorto-biiliacale Y-Prothese 42 m 56 A. iliaca communis li. infrarenale Y-Prothese isolierter Protheseninfekt Prothesio-fem. Allograft-Interponat li. 43 w 64 A. prof. fem. li. infrarenale Y-Prothese isolierter Protheseninfekt Aorto-biiliacale Y-Prothese 44 m 64 distale A. abd. infrarenale Rohrprothese prothesio-enterische Fistel Aorto-biiliacale Y-Prothese 45 m 74 Aa. iliacae comm. infrarenale Y-Prothese isolierter Protheseninfekt Aorto-bifemorale Y-Prothese 75 Tabelle 11 Charakteristika sämtlicher Patienten Pat Begleitdiagnosen Begleitkomplikationen Mikrobiologie Verstorben 1 HT, pAVK 4, KHK, Multiple Voroperationen Wirbelkörperabszess Staph. aureus 7POD 2 HT, pAVK 2b, Typ A-Gastritis keine kein Keimnachweis 3 HCV, HBV, i.v.-Drogenabusus Wirbelkörperabszess Staph. aureus, Corynebact. spp. 4 DM, pAVK 4, KHK, Z.n. MI keine Staph. aureus 5 HT, DM, pAVK 4, KHK keine kein Keimnachweis 6 pAVK 3, Hyperurikämie kein Keimnachweis 7 HT, Adipositas, KHK, Z.n. MI keine BAA, Wirbelkörperabszess 8 pAVK 2b, Nikotinabusus kein Keimnachweis 9 HT, NI, Multiple Voroperationen keine BAA, Sigmadivertikulose 10 HT, pAVK 2b, NI, KHK keine E. coli, Bacteroides 11 HT, pAVK 3, NI, KHK, NYHA 2b keine ORSA 13POD 12 HT, Multiple Voroperationen Sigmadivertikulose Staph. aureus, Bacteroides 12POD 13 HT, DM, pAVK 2b, KHK keine kein Keimnachweis 14 HT, pAVK 2b, NI, Adipositas keine ORSA, Ent. faecalis 15 HIV, HCV, HBV, i.v.-Drogenabusus keine Staph. aureus, E. coli, Citrobacter koseri 16 HT, pAVK 2b, Adipositas, Nikotinabusus AEF Staph. aureus, Salmonella enteritis, Moraxella spp. 17 HT, pAVK 2b, NI, Typ A-Gastritis Sigmadivertikulose kein Keimnachweis 18 HT, Adipositas, KHK, Nikotinabusus keine Ent. faecalis 19 pAVK 3, NI, Adipositas, Z.n. Nierentransplantation keine kein Keimnachweis 20 NI, KHK, Z.n. MI keine kein Keimnachweis 21 HT, pAVK 2b, KHK Rektumkarzinom Staph. aureus, Ent. faecalis, Pseudomonas aeruginosa 22 HT, pAVK 3, Z.n. MI Bakteriämien ORSA 23 HT, pAVK 3 keine Staph. aureus Staph. aureus Candida albicans 17POD 21POD 96POD 119POD 76 Tabelle 11 Charakteristika sämtlicher Patienten 24 HT, DM, pAVK 2b keine Staph. aureus 25 HT, DM, pAVK 3, NI, KHK, Z.n. MI BAA Staph. aureus, Corynebact. spp., Candida albicans 26 HT, pAVK 2b, HBV, Nikotinabusus keine ORSA, Staph. aureus 27 HT, pAVK 3, Adipositas, KHK, Z.n. MI keine Staph. aureus 28 HT, DM, pAVK 2b, KHK, Z.n. MI AEF Staph. aureus 29 HT, DM, pAVK 4, Nikotinabusus keine 30 HT, DM, pAVK 4, Adipositas, NI keine Staph. aureus ORSA, E. coli, Ent. faecalis, Pseudomonas aeruginosa, Candida albicans 31 HT, pAVK 2b, KHK, Z.n. MI keine kein Keimnachweis 32 DM, pAVK 2b, NYHA 3 keine kein Keimnachweis 33 pAVK 3 keine Staph. aureus 34 Aneurysma spurium Staph. aureus, Corynebact .spp. 35 HT, pAVK 3, Nikotinabusus HT, pAVK 3, KHK, NI, Adipositas, Multiple Voroperationen Bakteriämien ORSA 36 HT, pAVK 2b, NI, KHK, NYHA 2b Staph. aureus, E. coli, Ent. faecalis 7POD 37 HT, pAVK 2b, KHK AEF AEF, Wirbelkörperabszess ORSA, E. coli, Ent. faecalis, Candida albicans, Salmonella enteritis 27POD 38 HT, pAVK 4, KHK, Nikotinabusus Ulcus Cruris ORSA, Pseudomonas aeruginosa 39 HT, NI keine E. coli, Proteus mirabilis 40 HT, pAVK 2b AEF Staph. aureus, Ent. faecalis, Citrobacter koseri 41 pAVK 3, Nikotin- / Alkoholabusus keine kein Keimnachweis 42 HT, HCV, Nikotinabusus keine Staph. aureus 43 HT, pAVK 2b, KHK, Z.n. MI Antrumresektion Staph. aureus 44 HT, rez. Septikämien AEF, Bakteriämien Staph. aureus, E. coli, Proteus mirabilis, Candida albicans 45 DM, pAVK 2b, NI, KHK, Z.n. MI keine kein Keimnachweis Legende: DM (Diabetes mellitus), HT (arterielle Hypertonie), NI (terminale Niereninsuffizienz); MI (Myokardinfarkt), KHK (koronare Herzkrankheit), AEF (aorto-enterische Fistel) 153POD 41POD 28POD 77 8. Lebenslauf Name: Stephan Brand Geburtsdatum: 11.09.1977 in Oldenburg Anschrift: Am Wandrahm 9, 28195 Bremen Schulausbildung: 08/1984 – 07/1988 Grundschule Hogenkamp, Oldenburg 08/1988 – 07/1990 Orientierungsstufe Marschweg, Oldenburg 08/1990 – 06/1997: Altes Gymnasium Oldenburg 06/1997: Allgemeine Hochschulreife, Altes Gymnasium Oldenburg Zivildienst: 1997 – 1998: Paritätischer Wohlfahrtsverband Oldenburg Hochschullaufbahn und beruflicher Werdegang: 1998 – 1999: Profifußball VfB Oldenburg (damals Regionalliga Nord) 10/1999 – 05/2006: Studium der Humanmedizin an der Medizinischen Hochschule Hannover 09/2001: Ärztliche Vorprüfung 08/2002: Erster Abschnitt der ärztlichen Prüfung 03/2005: Zweiter Abschnitt der ärztlichen Prüfung 05/2006: Dritter Abschnitt der ärztlichen Prüfung 05/2006: Ärztliche Approbation mit der Gesamtnote 1,6 Seit 07/2006: Assistenzarzt in der Klinik für Allgemein- und Unfallchirurgie Zentralkrankenhaus Links der Weser, PD Dr. med. A.S. Böhle, Bremen Praktisches Jahr: 05/2005 – 08/2005 Klinik für Orthopädische Chirurgie, Inselspital, Bern 08/2005 – 12/2005 Innere Medizin, Medizinische Hochschule Hannover 12/2005 – 03/2006 Klinik für Unfall- und Wiederherstellungschirurgie, Friederikenstift, Hannover Stephan Brand, Hannover und Bremen, den 08. Januar 2008 78 9. Publikationen: Originalarbeit: Teebken OE, Pichlmaier A, Brand S, Haverich A. Cryopreserved arterial allografts for in situ reconstruction of infected arterial vessels. Eur J Vasc Endovasc Surg 2004;27:597-602. Publiziertes Abstrakt: Brand S, Teebken O, Haverich A, Pichlmaier M. Cryopreserved human allografts for arterial repair in case of graft infection. Thorac Cardiovasc Surg 2007;54(Suppl1):S100. Poster: Brand S, Teebken O, Haverich A, Pichlmaier M. Cryopreserved human allografts for arterial repair in case of graft infection. Jahrestagung der Deutschen Gesellschaft für Thorax-, Herz- und Gefäßchirurgie, Hamburg 2006 10. Erklärung nach § 2 Abs. 2 Nrn. 5 und 6 PromO Ich erkläre, dass ich die der Medizinischen Hochschule Hannover zur Promotion eingereichte Dissertation mit dem Titel: „Kryokonservierte humane Allografts zur In-situ-Gefäßrekonstruktion nach Protheseninfektion“ in der Klinik für Herz-, Thorax- und Gefäßchirurgie unter Betreuung von Herrn PD Dr. med. O. E. Teebken ohne sonstige Hilfe durchgeführt und bei der Abfassung der Dissertation keine anderen als die dort aufgeführten Hilfsmittel benutzt habe. Ich habe die Dissertation bisher an keiner in- oder ausländischen Hochschule zur Promotion eingereicht. Weiterhin versichere ich, dass ich den beantragten Titel noch nicht erworben habe. Stephan Brand, Hannover und Bremen, den 08. Januar 2008 79 11. Danksagung Ich danke Herrn PD Dr. med. Omke E. Teebken für die Überlassung des Themas, die engagierte Betreuung sowie die vielen anregenden und hilfreichen fachlichen Diskussionen. Herrn Prof. Dr. med. Axel Haverich, dem Direktor der Klinik für Herz-, Thorax-, Transplantations- und Gefäßchirurgie, danke ich für die Bereitstellung des Arbeitsplatzes in den Räumen der Klinik. Mein besonderer Dank gilt Sarah und meinen Eltern für die Unterstützung und Liebe. Weiterhin danke ich Ingo, Georg, Oliver, Benjamin und Bianca für die langjährige Freundschaft und die Unterstützung in allen Lebenslagen. 80