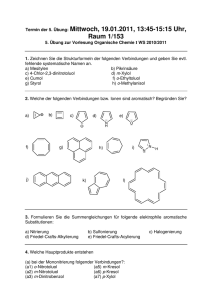
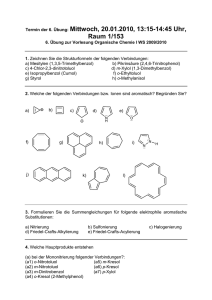
Intermetallische Verbindungen mit
Werbung

Intermetallische Verbindungen mit hochschmelzenden Übergangsmetallen und niedrigschmelzenden Metallen Inaugural-Dissertation zur Erlangung der Doktorwürde der Fakultät für Chemie und Pharmazie der Albert-Ludwigs-Universität Freiburg im Breisgau vorgelegt von Rainer Lux aus Solingen - 2004 - Dekan: Prof. Dr. K. Bucher Leiter der Arbeit: Prof. Dr. H. Hillebrecht Referent: Prof. Dr. H. Hillebrecht Korreferentin: Prof. Dr. C. Röhr Tag der Verkündung des Prüfungsergebnisses: 05.07.2004 meinen Eltern Die vorliegende Arbeit entstand in der Zeit von Januar 2000 bis Dezember 2003 zunächst am Lehrstuhl für Anorganische Chemie I der Universität Bayreuth, später am Institut für Anorganische und Analytische Chemie der Albert-Ludwigs-Universität in Freiburg im Breisgau unter der Leitung von Herrn Prof. Dr. Harald Hillebrecht Ihm gilt mein besonderer Dank für die interessante Themenstellung, das entgegengebrachte Vertrauen, die freundliche Betreuung sowie das immerwährende Interesse am Fortgang der Arbeit. Frau Prof. Dr. Caroline Röhr danke ich herzlich für die Übernahme des Korreferats. Bedanken möchte ich mich auch bei meinen zahlreichen Kolleginnen und Kollegen, mit denen ich in Bayreuth und Freiburg zusammenarbeiten durfte und die stets für ein äußerst angenehmes Arbeitklima sorgten. Dies sind Dr. Sabina Hartwig, Dr. Johannes Etzkorn und Dr. Knuth Gebhardt, die aus Bonn kommend zusammen mit Dr. Falko Meyer maßgeblich am Aufbau in Bayreuth beteiligt waren, sowie Dr. Marina Krekova, Barbara Hirsche, Volker Adasch und die technischen Angestellten Beate Bojer, Lisa Herrmann, Sonja Lutschinger, Bernd Putz und Dieter Will. Mein besonderer Dank gilt Dr. Wolfgang Milius für die gemeinsame Arbeit in Fragen der Pulverdiffraktometrie sowie für die anregenden Diskussionen zum Thema „Flugsicherheit“. Weiterhin gilt mein Dank den Freiburger Kollegen Dr. Simone Baumgärtner, Stefan Lösel, Dr. Thilo Ludwig, Herrn Dr. Heinz Rotter, sowie den technischen Angestellten Anita Becherer, Cordula Serr-Gehring, Klaus Bickel und Bernd Herold. Für die ausgezeichneten MikrosondeAnalysen bedanke ich mich herzlich bei Dr. Martin Ade. Weiter bedanken möchte ich mich bei den Mitarbeitern des Arbeitskreises Röhr, Dr. Constantin Hoch, Dr. Franziska Emmerling, Gero Frisch, Simone Schnabel und Marco Wendorf. Meinen herzlichen Dank möchte ich an dieser Stelle auch „meiner“ Laborantin Hasiba Richert aussprechen, deren immerwährende gute Laune für mich ebenso wertvoll war wie ihre Arbeit. Dr. Verena Kuntze danke ich für die quantitative Analyse an Mo7Ga26Zn26 und für die anregenden Diskussionen zur Strukturchemie intermetallischer Verbindungen. Ferner gilt mein Dank auch den Studenten, die im Rahmen eines Praktikums mit mir zusammengearbeitet haben, namentlich Imelda Oka, Stefan Lösel, Christian Piontek, Silke Taubmann, Uwe Kernchen und Ute Lippert in Bayreuth sowie Denis Petri in Freiburg. Zuletzt gilt mein Dank den Sekretärinnen Kristin Müller und Simone Zeuschel in Bayreuth sowie Sonja Bimmler in Freiburg, die ein Großteil an organisatorischen Aufgaben übernommen haben. Folgende Teile der Arbeit wurden bereits veröffentlicht: „Hierarchy in low melting intermetallic phases – ordering and defect variants in of close packings in components of zinc with niobium, tantalum and molybdenum“ V. Kuntze. R. Lux, H. Hillebrecht, 7th Europ. Conf. Solid State Chemistry, Madrid 1999 “Elementanaloge Polyederpackungen bei intermetallischen Phasen” R. Lux, V. Kuntze, H. Hillebrecht, 9. Jahrestagung der Deutschen Gesellschaft für Kristallographie, Bayreuth, 2001 Inhaltsübersicht 1. Einleitung .............................................................................................................1 2. Gallium in intermetallischen Verbindungen ............................................6 3. Zinkreiche Verbindungen .............................................................................14 3.1. Der MoZn6-Typ – Ordnungs- und Defektvarianten der dichtesten Kugelpackung .................................................................................................14 3.1.1. Der Strukturtyp MoZn6 – Gemeinsame Strukturmerkmale ....................17 3.1.2. Kristallstrukturen......................................................................................20 3.1.2.1. Das kubische MoZn6 ...............................................................20 3.1.2.2. Die kubischen Verbindungen V(Zn,Ga)6 , Nb(Zn,Ga)6 und Ta(Zn,Ga)6 ..............................................................................22 3.1.2.3. Das kubische Mo(Zn,Ga)6 ......................................................22 3.1.2.4. Das hexagonale Mo(Zn,Ga)6 ..................................................28 3.1.2.5. Das rhomboedrische Mo(Zn,Ga)6 ...........................................30 3.1.2.6. Die hexagonalen Verbindungen V(Zn,Ga)6 , Nb(Zn,Ga)6 und Ta(Zn,Ga)6 ..............................................................................36 3.1.3. Parallele zu den Elementstrukturen der Metalle .....................................42 3.1.4. Stapelregeln .............................................................................................45 3.1.5. Untersuchungen zur Abhängigkeit des Strukturwechsels von der VEK .49 3.1.6. Untersuchungen zum Zusammenhang zwischen Galliumgehalt und Gitterparameter im hexagonalen Mo(Zn,Ga)6 ...................................................59 3.2. V7Ga12Zn39 – Eine Variante des Strukturtyps Mo7Sn12Zn40 ......................68 3.2.1. Struktur des Typs Mo7Sn12Zn40 ..............................................................69 3.2.1.1. Beschreibung über mehrschalige Polyeder ..............................70 3.2.1.2. Selbstähnlichkeit im Mo7Sn12Zn40 ..........................................74 3.2.2. V7Ga12Zn39 – Synthese und Strukturdiskussion......................................83 3.2.3. Mo7Ga26Zn26 – partielle Substitution von Zink durch Gallium ..............93 4. Galliumreiche Verbindungen .........................................................................101 4.1. (MoGa5)nGa: Strukturwechsel durch minimale Substitution.....................104 4.1.1. Gemeinsame Strukturmerkmale in Mo8Ga41, Mo6Ga31 und „Mo4Ga21“108 4.1.2. Mo6Ga31 – triklin; eine neue Variante zum monoklinen Mo6Ga31 .........111 4.1.2.1. Strukturdiskussion ...............................................................114 4.1.3. Substitution durch Sauerstoff und Iod....................................................127 4.2. Das System V-Ga-Cu : Varianten der kubisch-innenzentrierten Struktur...........................................................................................................131 4.2.1. V2Cu3Ga8: Eine partiell aufgefüllte Variante des ReGa4 ......................134 4.2.2. V11Cu9Ga46: Eine komplexe kubische Struktur mit Variationen der kubisch- innenzentrierten Kugelpackung ..............................................153 4.2.2.1. Koordinationsverhältnisse ....................................................163 4.2.2.2. Strukturbeschreibung ............................................................168 4.2.2.3. Die Gallium-Teilstruktur ......................................................169 4.2.2.4. Motive der Elementstruktur des Vanadiums ........................173 4.2.2.5. Motive des Cr3Si-Typs ..........................................................177 4.2.2.6. Defekte in V11Cu9Ga46 ..........................................................184 4.2.2.7. Motive des γ-Messing ...........................................................188 5. Pt2Sn2Zn3 ...............................................................................................................194 5.1. Binäre Platin-Zinn- und Platin-Zink-Verbindungen..............................195 5.2. Synthesen.....................................................................................................200 5.3. Strukturbeschreibung ................................................................................204 5.4. Substitutionsversuche ...............................................................................210 6. Weitere Ergebnisse ............................................................................................213 6.1. Mo3Ga1.9Si4.1 ..............................................................................................213 6.2. Cu33Ga16 .....................................................................................................216 7. Experimenteller Teil .......................................................................................... 219 8. Anhang ................................................................................................................... 227 9. Zusammenfassung und Ausblick .................................................................. 280 10. Literaturangaben ........................................................................................ 285 Liste der verwendeten Abkürzungen Å Ångstrøm (10-10 m) b.c.c. body centered cubic (kubisch innenzentrierte Kugelpackung) c Jagodzinski-Symbol für kubische Stapelfolge c.c.p. cubic closed packing (kubisch dichteste Kugelpackung) cF24, hP14 Pearson-Symbolik; Bravais-Gitter und Anzahl der Atome pro Elementarzelle cm Zentimeter d Atomabstand E Element, Nichtmetall EDX Energiedispersive Röntgenspektroskopie FE Formeleinheiten h Jagodzinski-Symbol für hexagonale Stapelfolge h.c.p. hexagonal closed packing (hexagonal dichteste Kugelpackung) k[n] klassengleicher Übergang vom Index n KZ Koordinationszahl L Lücke M Metall RG Raumgruppe Symm. Symmetrie / Lagesymmetrie t[n] translationengleicher Übergang vom Index n ÜM Übergangsmetall(e) V Volumen VEK Valenzelektronenkonzentration Wyck. Wyckhoff Symbol X Element (allgemein) x Substitutionsgrad Z Anzahl der Formeleinheiten pro Elementarzelle (Schottky-) Leerstelle 3 6 -Netz Schläfli-Symbolik; Graphit-Netz a, b, c Gitterkonstanten x, y, z Atomkoordinaten R1(F), Zuverlässigkeitsfaktor wR2(I) gewichteter Zuverlässigkeitsfaktor 1. Einleitung ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ 1. Einleitung Die Entwicklung neuer Werkstoffe und Materialien, sowie deren Verbesserung und Optimierung spielen eine bedeutende Rolle in der Industrie und im täglichen Leben. Dabei haben Metalle und Legierungen die Entwicklungen der Menschheit entscheidend geprägt. Edelmetalle wie Kupfer, Silber und Gold sowie Legierungen wie Bronze oder Messing haben schon in den ersten Hochkulturen wichtige Schlüsselstellungen eingenommen. Obwohl lange Zeit keine Kenntnis über die chemische Bindung und die Struktur von Legierungen und intermetallischen Verbindungen vorlag, gelang es doch immer, deren Eigenschaften empirisch zu optimieren und nutzbringend anzuwenden. Heute sind die Strukturen einer großen Anzahl intermetallischer Phasen bekannt [1] . Im Gegensatz zu anderen Verbindungsklassen wie kovalenten oder ionischen Verbindungen fehlen bei intermetallischen Verbindungen bis heute einfache Prinzipien zum Verständnis der oft sehr komplexen Strukturen dieser Stoffe. Das mag daran liegen, dass sich die chemischen Bindungsverhältnisse intermetallischer Verbindungen nicht mit den sonst so überaus gut funktionierenden Valenzregeln beschreiben lassen. Bei der Beurteilung der Stabilität einer bestimmten Struktur werden im allgemeinen Argumente wie geometrische und elektronische Faktoren herangezogen. Immerhin sind diese Regeln bei einigen Klassen intermetallischer Verbindungen, wie Laves-Phasen, Hume-Rothery-Phasen oder ZintlPhasen, gut verstanden und werden in der Regel auch befolgt. Doch gerade in der oft faszinierenden Komplexität intermetallischer Verbindungen zeigt sich die Natur der chemischen Bindung in vielfältigen Schattierungen und Nuancen. In den letzten Jahren wurde immer mehr versucht, die Strukturchemie intermetallischer Phasen auch anhand theoretischer Methoden zu verstehen. Neben klassischen Ansätzen wie Bandstrukturrechnungen kommen dabei zunehmend neuere Modelle wie die periodischen Knotenflächen [2] und die Elektronenlokalisierungsfunktion[3] hinzu, die vor allem durch die graphische Darstellung der Elektronenverteilung eine Vorstellung von der Bindungsart und ihrer Bedeutung innerhalb der Strukturen vermitteln. 1 P. Villars, L. D. Calvert (Hrsg.), Pearson’s Handbook of Crystallographic Data for Intermetallic Phases; American Society for Metals, Metals Park, Ohio, 1995 2 H. G. von Schnering, R. Nesper, Angew. Chem. 1987, 99, 1097-1119 3 A. D. Becke, K. E. Edgecombe, J. Chem. Phys. 1990, 92, 5397-5403 1 1. Einleitung ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Zur Beurteilung der Möglichkeiten einer Optimierung bereits bekannter Werkstoffe, in denen intermetallische Phasen eine wesentliche Rolle spielen, sind genaue Kenntnisse über Bildung, Struktur und Eigenschaften der intermetallischen Phasen erforderlich. Ein Hauptweg zur Erlangung dieser Informationen ist derzeit noch die experimentelle Untersuchung der Phasen, die ihre Synthese als Voraussetzung hat. Ein Problem bei der Synthese ist dabei die Erreichung eines thermodynamischen Gleichgewichts sowie die Beseitigung kinetischer Hemmungen. Eine elegante Synthesemethode basiert auf Metallschmelzen, da in flüssigen Phasen die Diffusionskoeffizienten um Größenordnungen höher sind als in Festkörpern [4] [5] . Dieses Prinzip wurde schon 1898 von P. Lebeau als sogenannte Hilfsmetallbadtechnik eingeführt [6]. Reaktionen in flüssigen Medien haben den Vorteil, dass die Eigenschaften und Reaktivitäten der Metallschmelze durch Auswahl und Menge der Metalle gezielt beeinflusst werden können. Entscheidend für erfolgreiche Synthesen ist die Reaktivität der Schmelze. Unter den Voraussetzungen einer guten Solvatation der Reaktionspartner sowie einer temperaturabhängigen Löslichkeit bietet die Schmelze die Möglichkeit zur Züchtung von Einkristallen. Metallschmelzen eignen sich gleichermaßen als Reaktionsmedium zur Herstellung von Hartstoffen und Hartmetallen mit hohem Schmelzpunkt und zur Synthese intermetallischer Verbindungen zwischen Metallen mit sehr unterschiedlichen Schmelzpunkten wie etwa Molybdän, Wolfram und Rhenium mit Zinn, Zink und Gallium. Das komplexe Reaktionsgeschehen in Schmelzen ist unter zwei Gesichtspunkten zu betrachten. Einerseits kann die Metallschmelze als Lösungsmittel wirken, ohne in den Reaktionsprodukten enthalten zu sein. Bei Verwendung niedrigschmelzender Metalle ist dabei im Prinzip der gesamte Flüssigkeitsbereich der Schmelze für die Synthese nutzbar. Andererseits kann das Schmelzmetall selbst an der Reaktion teilnehmen und in den Produkten vorhanden sein. Eine Separation zwischen diesen Funktionen ist in der Regel nicht möglich. In einigen Fällen bewirkt die Zugabe geringer Mengen eines weiteren niedrigschmelzenden Metalls erst eine erfolgreiche Umsetzung zwischen Metallen, die im binären System nicht miteinander reagieren. Ein Mitreagieren des dritten Metalls ist dabei nicht prinzipiell von Nachteil. Gerade pseudobinäre Verbindungen liefern interessante 4 K. Wilke, Kristallzüchtung; Verlag Harri Deutsch, Thun, 1988 5 J. Hulliger, Angew. Chem. 1994, 106, 151-189 6 P. Lebeau, J. Eigueras, Compt. Rend. Acad. Sci. Paris, 1898, 127, 393 2 1. Einleitung ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Aussagen über Größenverhältnisse oder Strukturänderungen in Abhängigkeit von der Valenzelektronenkonzentration. So gelang im System Molybdän-Zink durch Verwendung von geringen Mengen an Gallium als weitere niedrigschmelzende Komponente problemlos die Synthese zinkreicher Verbindungen der Zusammensetzung Mo(Zn,Ga)6, die Ordnungs- und Defektvarianten der dichtesten Kugelpackungen bilden und die Strukturen der Metalle, die in dichtesten Kugelpackungen kristallisieren, in Form der Mo-zentrierten Koordinationspolyeder nachbilden. Mit den Übergangsmetallen Vanadium, Niob und Tantal konnten ebenfalls Verbindungen des Typs ÜM(Zn,Ga)6 synthetisiert werden, die nach dem gleichen Prinzip aufgebaut sind. Nachdem die ersten Vertreter charakterisiert waren, wurde vermutet, dass dieser Strukturtyp im wesentlichen von elektronischen Faktoren bestimmt wird. Ein Ziel dieser Arbeit war neben der Suche nach weiteren Vertretern vor allem die Frage, nach welchen Prinzipien Strukturwechsel erfolgen, und welche Funktion dem Gallium innerhalb dieser Strukturfamilie zukommt. In Schmelzen mit den Metallen Molybdän, Zinn und Zink, in denen auch das kubische MoZn6 als binäre Verbindung zugänglich ist, konnte 1995 von H. Hillebrecht und K. Gebhardt mit dem Mo7Sn12Zn40 die erste ternäre Verbindung in diesem System synthetisiert werden[7]. Die hochsymmetrische Kristallstruktur ist aus mehrschaligen Polyedern mit ikosaedrischer Symmetrie in CsCl-analoger Anordnung aufgebaut und stellt ein bemerkenswertes Beispiel für Hierarchie und Selbstähnlichkeit in intermetallischen Verbindungen dar. Spätere Arbeiten zeigten, dass sich sowohl Molybdän gegen andere hochschmelzende Übergangsmetalle wie Chrom, Niob oder Tantal, als auch Zinn gegen eine Reihe von Hauptgruppenelementen wie Indium, Wismut oder Antimon substituieren lassen, wobei das grundsätzliche Bauprinzip der Struktur nicht verändert wird [8]. In diesem Strukturtyp, der fast ausschließlich von geometrischen Faktoren bestimmt wird, war es bisher nicht gelungen das Zink durch andere Metalle zu ersetzen. Im Rahmen dieser Arbeit sollte nun untersucht werden, in wie weit dieser Strukturtyp auf zinkreiche Verbindungen beschränkt ist. 7 H. Hillebrecht, V. Kuntze, K. Gebhardt, Z. Krist. 1997, 212, 840-847 8 V. Kuntze, Dissertation, Bonn, 1999 3 1. Einleitung ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ In galliumreichen Verbindungen mit hochschmelzenden Übergangsmetallen findet man häufig Strukturmotive, die sich vom Ga8-Würfel ableiten. Verbindungen wie ReGa4 oder Mo2Cu3Ga8 bilden Ordnungs- und Defektvarianten der kubisch-innenzentrierten Kugelpackung, in denen die Übergangsmetalle in ein kubisch primitives Ga-Gitter nach unterschiedlichen Mustern eingebaut werden. Mit dem ÜMGa10-Polyeder, das eine Kombination aus Würfel und Ikosaeder darstellt, existiert ein weiteres Motiv, das bislang bevorzugt mit Molybdän als Übergangsmetall entsteht und eine Strukturreihe der Zusammensetzung (MoGa5)nGa (mit n = 4, 6, 8) bildet. In diesen Strukturen sind acht dieser sogenannten Zentaur-Polyeder über gemeinsame Spitzen zu einem Würfel angeordnet. Das außerhalb der Klammer stehende Gallium besitzt in diesen Verbindungen strukturchemisch eine besondere Rolle. Dazu gehört neben der Koordination die Eigenschaft, dass es sich durch andere Elemente relativ problemlos substituieren lässt, ohne das Motiv Würfel aus Zentaur-Polyeder zu beeinflussen. Untersuchungen ergaben, dass der Metallcharakter des Fremdelements entscheidend ist für eine unterschiedliche Anordnung dieser Cluster, und damit zu unterschiedlichen Strukturen führt. Aufgrund von häufig beobachteten Analogien bei den Strukturen hochschmelzender Übergangsmetalle in zinkreichen und galliumreichen Verbindungen wurde im Rahmen dieser Arbeit versucht, weitere Vertreter und neue Varianten dieser Verbindungen zu synthetisieren. In vielen intermetallischen Verbindungen zwischen hochschmelzenden Übergangsmetallen der 5. bis 8. Gruppe des Periodensystems und niedrigschmelzenden Metallen wie Aluminium, Zink, Zinn oder Gallium ist eine ausgesprochene Tendenz zur Ausbildung komplexer Strukturen und Anordnungen nach hierarchischen Prinzipien zu beobachten. Dabei handelt es sich stets um ausgesprochen übergangsmetallarme Verbindungen, in denen das Übergangsmetall als eine Art Ordnungsgeber fungiert, oder in einer recht gleichmäßigen Matrix der Mehrheitskomponente verteilt ist. Bemerkenswert ist neben einer großen Separierung und Ausordnung nach strukturchemischen Gesichtspunkten die oft sehr hohe Symmetrie oder Pseudosymmetrie in diesen Verbindungen. Charakteristische Merkmale sind häufig reguläre ÜM-Metalln-Polyeder, die entweder als diskrete Einheiten (MoAl12, VAl10), als eckenverknüpfte (V8Ga41, MoZn6) oder kantenverknüpfte (MoAl6, Ru4Sn3Zn29) Netzwerke vorliegen. Darüber hinaus sind in Strukturen wie Mo7Sn12Zn40, MoZn6, ReGa4 und Mo2Cu3Ga8 Motive der Selbstähnlichkeit vorhanden, in dem Sinne, dass gleiche Strukturelemente mit gleicher Symmetrie auf unterschiedlichem Niveau auftreten, die sich durch eine geeignete Skalierung direkt ineinander überführen lassen. 4 1. Einleitung ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Hochgeordnete Strukturen scheinen sich bevorzugt dann zu bilden, wenn zum Einen bestimmte Organisationsprinzipien mit langreichweitigen Wechselwirkungen vorliegen, die eine Bildung komplexer Baugruppen möglicherweise bereits in der flüssigen Phase ermöglicht. Zum Anderen werden hochsymmetrische Strukturen bei niedrigen Synthesetemperaturen generell begünstigt, da der Einfluss der Entropie geringer ist, und die Bildung fehlgeordneter Phasen unwahrscheinlicher wird. Bei der Gruppe der genannten Verbindungen scheinen bezüglich der Radienverhältnisse und/oder der Valenzelektronenkonzentration äußerst günstige Bedingungen vorzuliegen. Auch der Einsatz multinärer Metallschmelzen mit niedrigliegenden Eutektika und einer entsprechenden Reaktivität zeigt, dass erfolgreiche Synthesen von Verbindungen bei Temperaturen möglich sind, bei denen der Schmelzpunkt des Übergangsmetalls noch lange nicht erreicht ist. Im Rahmen dieser Arbeit wurden auch die Edelmetalle Platin und Palladium mit niedrigschmelzenden Metallen umgesetzt. Neben schon bekannten Verbindungen konnte mit dem Pt2Sn2Zn3 die erste ternäre Platin-Zinn-Zink-Verbindung synthetisiert werden. Die Verbindung kristallisiert in einem neuen Strukturtypen, der auffallende Strukturmerkmale von binären Randverbindungen der Systeme Pt-Zn und Pt-Sn in sich vereinigt. Zu Beginn der Arbeit erfolgt ein kurzer Überblick zum strukturchemischen Verhalten von Gallium in intermetallischen Phasen, da sich die Palette der vorgestellten Verbindungen von extrem galliumarm in den Verbindungen des Mo(Zn,Ga)6-Typs bis hin zu extrem galliumreich in (MoGa5)nGa erstreckt. In diesen Verbindungen besitzt das Metall eine enorme Flexibilität hinsichtlich seiner Größe bzw. seines Platzbedarfs innerhalb der Kristallstrukturen, die möglicherweise bei intermetallischen Verbindungen für kein anderes Element in dem hohen Ausmaße zu beobachten ist. 5 2. Gallium in intermetallischen Verbindungen ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ 2. Gallium in intermetallischen Verbindungen Da die im Rahmen dieser Arbeit synthetisierten Verbindungen nahezu alle aus galliumhaltigen Metallschmelzen gewonnen wurden, und in der Mehrheit auch Gallium enthalten, ist es sicher sinnvoll, vor der Diskussion der Ergebnisse einige allgemeine Betrachtungen zusammenzufassen, welche die Strukturchemie von galliumhaltigen intermetallischen Verbindungen betreffen. Ein Vergleich von Literaturdaten und eigenen Beobachtungen zeigt, dass sich Gallium in mancher Hinsicht etwas ungewöhnlich verhält, was vor allem das Atomvolumen bzw. den Raumbedarf in Verbindungen mit anderen Metallen – insbesondere Übergangsmetallen – im Vergleich zur Elementstruktur anbelangt. Im allgemeinen wird das Atomvolumen als Maß für die Größe bzw. den Raumbedarf von Metallen in intermetallischen Verbindungen herangezogen. Die verwendeten Atomvolumina werden dabei aus dem Quotienten der Molmasse und der Dichte der Elemente hergeleitet. Sinnvoll und miteinander vergleichbar sind diese Werte ohne Frage dann, wenn Metalle in ähnlichen Kristallstrukturen und in möglichst dichten Kugelpackungen kristallisieren, wie dies bei den meisten Übergangsmetallen der Fall ist. Bei Hauptgruppenmetallen und Halbmetallen ist diese Größe mit zunehmendem Nichtmetallcharakter des Elements kritisch zu betrachten, da in verstärktem Maße gerichtete und kovalente Wechselwirkungen auftreten, und aufgrund von Hybridisierungen geometrische Restriktionen wirksam werden, die bei Metallen in der Regel nicht beobachtet werden. Die Postübergangsmetalle sind bezüglich ihrer Strukturen und Eigenschaften ungewöhnlich und werden bisweilen nicht als „echte“ Metalle angesehen bezeichnet [9] [10] , bzw. als „Metametalle“ [11] . Während Metalle Strukturen mit möglichst hoher Packungsdichte bevor- zugen, gilt bei Hauptgruppenelementen ab der dritten Periode das Prinzip der maximalen Vernetzung, was mit einem mehr oder weniger starken Verlust an Raumerfüllung einhergeht. So beträgt die Raumerfüllung beispielsweise der Diamantstruktur nur 34% gegenüber 74% in dichtesten Kugelpackungen. Darüber hinaus schmelzen Elemente wie Gallium, Silizium, Germanium, Antimon und Bismut unter Volumenkontraktion. Die aus 9 C. Kittel, Introduction to Solid State Physics, 2. Aufl. Wiley, New York, 1956, S. 293, zitiert in [2] 10 J. D. Corbett, Angew. Chem. 2000, 112, 682-704 11 A. F. Holleman, N. Wiberg, Lehrbuch der anorganischen Chemie, W. de Gruyter, Berlin 1995 6 2. Gallium in intermetallischen Verbindungen ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ den Elementstrukturen abgeleiteten Atomvolumina der Hauptgruppenmetalle und Halbmetalle sind daher nicht unbedingt ein geeignetes Maß für ihren Raumbedarf in intermetallischen Verbindungen. Gallium als Element nimmt unter den Metallen eine gewisse Sonderstellung ein. Trotz seiner relativ hohen elektrischen Leitfähigkeit wird es aufgrund einiger Eigenschaften zu den Halbmetallen gezählt. Innerhalb der 3. Hauptgruppe treten zwischen Aluminium und Gallium Anomalien bzgl. Schmelzpunkt, Elektronegativität und Metallcharakter auf, die durch die Auffüllung der 3d-Schale von Scandium bis Zink bedingt sind. Anders als die meisten Metalle kristallisiert Gallium in einer recht merkwürdigen Struktur. Im thermodynamisch stabilen α-Gallium besitzt jedes Ga-Atom die Koordinationszahl 1+6, wobei ein Abstand mit 2.484 Å sehr kurz ist und als Ga-Ga-Paar mit einer ausgeprägten kovalenten Bindung gedeutet wird (in Abb. 2.1 rot gekennzeichnet). Die Kristallstruktur kann auf zwei Arten beschrieben werden. Eine geht von planaren Schichten aus, bei denen die Ga-Atome ein 63-Netz aus verzerrten Sechsecken parallel zu (100) bilden, die senkrecht dazu gemäß der Sequenz ...AB... gestapelt sind, wobei die Orientierung der verzerrten Sechsecke ebenfalls alternierend wechselt. Der Raum innerhalb der Sechsecke einer Schicht wird jeweils von Ga2-Paaren benachbarter Schichten umschlossen, und kann als Lücke aufgefasst werden. Tab. 2.1: Strukturdaten zu α-Gallium _____________________________________________________________ Kristallsystem Raumgruppe Gitterkonstanten Zellvolumen Z orthorhombisch C m c a (Nr. 64) a = 4.5230 Å b = 7.6610 Å c = 4.5240 Å 156.76 Å3 8 Dichte Pearson Symbol 5.908 g/cm3 oC8 Atomkoordinaten: Atom Wyck. Symm. x y z Ga 8f m.. 0 0.1549(8) 0.0810(6) _____________________________________________________________ 7 2. Gallium in intermetallischen Verbindungen ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Abstände in Å: 2.484 1x 2.691 2x 2.730 2x 2.788 2x Abb.2.1: Struktur von α-Gallium [12] [13]. Die Ga-Ga-Paare sind rot hervorgehoben. Abb. 2.2: Gewellte Schichten aus Ikosaederfragmenten im α-Gallium (Stereobild) Alternativ lässt sich die Struktur auf der Basis gewellter Schichten beschreiben, die als aufwärts und abwärts gerichtete Ikosaederhälften aufgefasst werden können, wobei der kürzeste Abstand zwischen diesen Schichten die Ga2-Paare darstellen (Abb. 2.2). Die Ursache für die ungewöhnliche Struktur von Gallium im Vergleich zum Aluminium lässt 12 B. D. Sharma, J. Donohue, Z. Krist., 1962, 117, 293-300 13 J. Donohue, The Structure of the Elements, Wiley, New York, 1972 8 2. Gallium in intermetallischen Verbindungen ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ sich aufgrund von Pseudopotentialrechnungen begründen [14] . Nach V. Heine treten Ver- zerrungen von Strukturen auf als Folge der Schwierigkeiten, Volumen- und Abstandsoptimierungen zugleich in einer hochsymmetrischen Struktur zu erlangen. Die Struktur des Galliums ist daher als Kompromiss zu verstehen, beide Parameter gleichzeitig zu optimieren. Der niedrige Schmelzpunkt von 29.78°C legt den Gedanken nahe, dass die Struktur eine „Notlösung“ darstellt, obwohl der hohe Siedepunkt von 2250°C zeigt, dass die chemischen Bindungen in Gallium alles andere als schwach sind. Im Grunde genommen verhält sich Gallium in den meisten intermetallischen Verbindungen nicht so ungewöhnlich, wie man aufgrund der Elementstruktur oder des daraus berechneten Atomvolumens erwarten würde. In vielen Fällen ist eine auffallende Parallele zu den aluminiumanalogen Verbindungen zu beobachten, wobei die galliumhaltigen Verbindungen tendenziell sogar ein etwas geringeres mittleres Atomvolumen aufweisen, als die aluminiumhaltigen Verbindungen. In Verbindungen – besonders mit frühen Übergangsmetallen – findet mit zunehmendem Anteil an Gallium bzw. Aluminium eine drastische Kontraktion der mittleren Atomvolumina statt, die bemerkenswerterweise auch noch in Verbindungen mit kleinen Übergangsmetallen wie Titan oder Vanadium zu beobachten ist (Abb. 2.3 und 2.4). Die Differenz des nach 100 % Gallium extrapolierten Atomvolumens der Aluminiumverbindungen liegt bei lediglich 4.2 %, während die Differenz bei den Galliumverbindungen 19.5 % beträgt. Ähnliche Atomvolumenkurven weisen die entsprechenden Silizide, Germanide und Stannide auf, deren Differenzen bei Si und Ge etwa 25 % und bei Sn 17 % betragen[15] [16]. Der Verlauf solcher Kurven ist im allgemeinen nicht strukturabhängig, sondern vielmehr eine Funktion der Elektronendichte bzw. der Valenzelektronenkonzentration [17]. In ihren Arbeiten verweisen K. Schubert et al. dabei auf die Tatsache, dass diese Hauptgruppenelemente im Gegensatz zu Aluminium nicht in dichtesten Kugelpackungen kristallisieren, und bringen die Differenz zwischen extrapoliertem und „tatsächlichem“ Atomvolumen mit der Abweichung von der dichtesten Kugelpackung in Zusammenhang. 14 V. Heine, D Weaire, Solid State Phys. 1970, 24, 247 15 M. Pötzschke, K. Schubert, Z. Metallkde. 1962, 53, 474-488 16 M. Pötzschke, K. Schubert, Z. Metallkde. 1962, 53, 548-561 17 R. Nesper, Angew. Chem. 1991, 103, 805-834 9 2. Gallium in intermetallischen Verbindungen ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Abb. 2.3: Mittlere Atomvolumina in intermetallischen Verbindungen zwischen Über gangsmetallen der 4. Gruppe mit Gallium und Aluminium. Nach [16] [18] PtGa2 Pt2Ga3 Mo6Ga31 Mo8Ga41 MoAl6 MoAl12 Abb. 2.4: Mittlere Atomvolumina in aluminium- und galliumhaltigen intermetallischen Verbindungen. Nach [16] [18] . Werte für Mo-Ga-Verbindungen im Diagramm links unten sind in Lit. [16] nicht angegeben. 16 M. Pötzschke, K. Schubert, Z. Metallkde. 1962, 53, 548-561 18 H. G. Meißner, K. Schubert, Z. Metallkde. 1965, 56, 475-484 10 2. Gallium in intermetallischen Verbindungen ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Ähnliche Kurven wurden auch für Galliumverbindungen mit den Übergangsmetallen Vanadium, Niob und Tantal gefunden (Abb. 2.4 rechts). In den Systemen Pt-Al und Pt-Ga, deren Verbindungen weitgehend isotyp sind, beobachtet man einen nahezu identischen Verlauf der Atomvolumenkurven beider Substanzklassen, die bei etwa 65 Atom-% Aluminium bzw. Gallium eine Unstetigkeit in den mittleren Atomvolumina aufweisen, die auch im System Mo-Al bei etwa 92Atom-% Aluminium auftritt (Abb. 2.4 links). Eine Interpretation für dieses Verhalten liefern K. Schubert et al. in ihren Arbeiten nicht, sondern weisen lediglich auf diese Parallele in den untersuchten Systemen hin. Neuere Arbeiten von H. Hillebrecht et al. bestätigen aber das etwas ungewöhnliche Verhalten bei den aluminiumreichen Molybdänverbindungen [19] [20]. In Abb. 2.4 links unten sind die mittleren Atomvolumina im System Mo-Ga mit eingetragen. Dabei handelt es sich neben dem Mo3Ga (isotyp zu Mo3Al; Cr3Si-Typ) um die Verbindungen Mo6Ga31 und Mo8Ga41 (Abschnitt 4.1.1), die zum Zeitpunkt der Arbeiten von Schubert noch unbekannt waren. Eine mögliche Erklärung für das Verhalten der Atomvolumina liegt offenbar in den Kristallstrukturen begründet, die mit zunehmenden Gehalt an Hauptgruppenmetall tendenziell in eher offenen Strukturen kristallisieren. Im MoAl12 liegen isolierte Ikosaeder vor, die ohne direkte Kontakte nach dem Muster einer kubisch-innenzentrierten Packung angeordnet sind, wobei der Gewinn an Raumfüllung der lokal dichtesten Ikosaederkoordination durch die weniger dichte Anordnung der Polyeder innerhalb der Struktur mehr als aufgehoben wird [21]. PtGa2 (CaF2-Typ [22] ) und Pt2Ga3 (Ni2Al3-Typ [23] ) bilden Ordnungs- und Defektvarianten der kubisch-innenzentrierten Kugelpackung, in denen Gallium in Form leicht verzerrter Würfel um das Platin koordiniert ist. Nach Angaben von Hellner und Laves sollen bereits in Verbindungen von Edel- und Münzmetallen mit Gallium und Indium heteropolare Bindungstendenzen vorhanden sein. Auch in den Verbindungen der Reihe (MoGa5)nGa mit n = 4, 6, 8, zu denen Mo6Ga31 und Mo8Ga41 gehören, liegen Strukturen mit hoher kubischinnenzentrierter Pseudosymmetrie vor. Der Würfel ist besonders in galliumreichen 19 H. Hillebrecht, Habilitationsschrift, Freiburg, 1997 20 M. Ade. Dissertation, Freiburg, 1997 21 J. Adam, J. B. Rich, Acta Cryst. 1954, 7, 813-816 22 E. Zintl, A. Harder, W. Haucke, Z. phys. Chem. 1937, 35B, 354-362 23 E. Hellner, F. Laves, Z. Naturforsch. 1947, 2A, 177-183 11 2. Gallium in intermetallischen Verbindungen ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Verbindungen mit Übergangsmetallen ein weit verbreitetes Strukturmotiv, der in vielen Varianten und Spielarten auftritt. Prinzipiell sollte das mittlere Atomvolumen in intermetallische Phasen von der Valenzeletronenkonzentration abhängen, wie dies ja auch bei den Elementstrukturen der Übergangsmetalle im allgemeinen gut befolgt wird. Man sollte daher beide Effekte, elektronische und geometrische Faktoren, für eine Interpretation des Raumbedarfs der Metalle in intermetallischen Phasen heranziehen. In galliumreichen Verbindungen zeigt Gallium die typische Koordinationschemie eines „großen“ Metalls mit niedriger Koordinationszahl für den Partner, während es – auch nach eigenen Beobachtungen – in galliumarmen Verbindungen bezüglich seines Raumbedarfs eher unauffällig ist bzw. zu einer Verminderung des Molvolumens beiträgt. In der Strukturfamilie des MoZn6 bzw. Mo(Zn,Ga)6, bei dem ein Teil des Zink statistisch gegen Gallium ersetzt ist (Abschnitt 3 ) ist ebenfalls stets eine leichte Volumenkontraktion in den galliumhaltigen Verbindungen zu beobachten. Dieses Verhalten von Gallium in zinkreichen Legierungen wurden schon 1964 von Davies und Owen beobachtet, die die Abhängigkeit der Gitterparameter und Volumenänderungen im zinkreichen Mischkristall der η-Phasen mit den Edelmetallen sowie Aluminium und Gallium in Abhängigkeit der Valenzelektronenkonzentration untersuchten (Abb. 2.5)[24]. Abb. 2.5: Verlauf der mittleren Atomvolumina in zinkreichen Mischkristallen mit Cu, Ag, Au, sowie Al und Ga. Nach [17] 24 D. A. Davies, E. A. Owen, Brit. J. Appl. Phys. 1964, 15, 1309-1314 12 2. Gallium in intermetallischen Verbindungen ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Dafür verwendeten sie korrigierte Atomvolumina, die nur den Einfluss der VEK auf die Volumenänderungen sichtbar macht und die unterschiedlichen Atomvolumina der Metalle in den Elementstrukturen unberücksichtigt lässt. Dabei stellten sie fest, dass das Molvolumen des Zn-Ga-Mischkristalls ein abweichendes Verhalten zeigt, und schlossen daraus, dass das Atomvolumen des elementaren Gallium kein guter Wert für die effektive Größe dieses Metalls in zinkreichen Verbindungen ist. Ähnliche Beobachtungen machten Jorda et al. bei Untersuchungen im System Nb-Ga. Sowohl für den Nb-reichen Mischkristall, als auch für das Nb3Ga (Cr3Si-Typ), das ebenfalls eine gewisse Phasenbreite besitzt, wurde mit steigendem Ga-Gehalt eine Verminderung der Gitterkonstanten festgestellt gefunden wurde [25] , wie bereits in früheren Arbeiten [26] [27] . Bei Untersuchungen pseudobinärer Zink-Gallium- und Zink- Aluminiumverbindungen mit Seltenerdmetallen der Zusammensetzung R(Zn,Ga)2 bzw. R(Zn,Al)2 (R = Ce, Sm, Gd, Er) konnte A. Iandelli ebenfalls eine Abnahme der Zellvolumina mit steigendem Ga-Gehalt beobachten, während sich die Volumina der aluminiumanalogen Verbindungen mit steigendem Al-Gehalt umgekehrt verhalten [28]. Diese Übersicht soll dazu beitragen, das strukturchemische Verhalten des Galliums in intermetallischen Phasen mit Übergangsmetallen einzuordnen, wobei sich zusammenfassend Folgendes feststellen lässt: das aus der Elementstruktur berechnete Atomvolumen von Gallium ist nicht unbedingt ein geeigneter Wert für seine effektive Größe in intermetallischen Verbindungen. Das gilt besonders für galliumarme Verbindungen mit Übergangsmetallen, in denen Gallium einen ähnlichen Raumanspruch hat wie etwa Aluminium und Zink. In galliumreichen Verbindungen ist dagegen eine zunehmend eigenständige Strukturchemie zu beobachten, in der das Gallium offenbar einen größeren Raumbedarf hat. In diesen teilweise komplexen Strukturen existiert auch eine wesentlich größere Bandbreite an direkten Ga-Ga-Kontakten, die von etwa 2.4 bis 3.3 Å reichen. Das Gallium zeigt einen der großen Vorzüge von Metallen, ihre enorme Flexibilität, die bereits in der Elementstruktur des Galliums in Erscheinung tritt, und sich in intermetallischen Verbindungen in vielfältiger Weise zeigt. 25 J. L. Jorda, R. Flückiger, J. Muller, J. Less Common Met. 1977, 55, 249-264 26 G. W. Webb, J. J. Engelhrdt, IEEE Trans. Magn. 1975, 11, 208 27 D. A. Ashby, R. D. Rawlings, J. Less Common Met. 1976, 50, 111 28 A. Iandelli, J. Less Common Met. 1991, 169, 187-196 13 3.1 Der MoZn6-Typ ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ 3. Zinkreiche Verbindungen 3.1. Der MoZn6-Typ – Ordnungs- und Defektvarianten der dichtesten Kugelpackung In diesem Abschnitt werden die Ergebnisse intensiver Untersuchungen zur Synthese binärer und ternärer zinkreicher Verbindungen mit hochschmelzenden Übergangsmetallen vorgestellt und zu einem vorläufigen Abschluss gebracht. Dabei wurden insbesondere die Übergangsmetalle der 5. und 6. Gruppe mit Hilfsmetallen wie Gallium, Zinn oder Blei in Zinkschmelzen umgesetzt. Die Kristallstrukturen der dabei gewonnenen Verbindungen zeigen eine interessante Parallele zu den Elementstrukturen der Metalle, die sich darin äußert, dass diese Elementstrukturen in Form von Polyederpackungen imitiert werden. Ausgangspunkt der Arbeiten waren Versuche zur Synthese binärer, aluminiumanaloger Zinkverbindungen des Molybdän [19] . Die extremen Unterschiede der Schmelz- und Siedepunkte der Metalle (Mo: 2620 / 5000°C; Zn: 419 / 908°C) erschweren jedoch die Untersuchung. Der niedrige Siedepunkt des Zink beschränkt zudem die Reaktionstemperaturen in nicht druckfesten Gefäßen auf Temperaturen von maximal 900°C, bei der die beiden Metalle noch nicht miteinander reagieren. Die Zugabe eines weiteren Metalls mit niedrigem Schmelzpunkt und hohem Siedepunkt sollte diese Einschränkungen überwinden. Die ersten erfolgreichen Umsetzungen gelangen in ternären und quarternären Schmelzen mit den Metallen Mo-Sn-Zn und Mo-Pb-Sn-Zn. Das Mo7Sn12Zn40 war die erste ternäre Verbindung in dem System Mo-Sn-Zn, ein neuer Strukturtyp, bei dem Ikosaeder aus Ikosaedern die charakteristischen Strukturmerkmale sind [7]. Die Verbindung kristallisiert kubisch in der Raumgruppe Fm-3c (a = 25.44 Å), und hat fast 1000 Atome pro Elementarzelle. Die Kristallstruktur ist nach einem hierarchischen Prinzip aufgebaut, in dem Sinne, dass die Zentren großer hochsymmetrischer Cluster einfache Positionen im Gitter besetzen. Weitere Untersuchungen ergaben, dass sich in dieser Verbindung sowohl das Molybdän gegen andere Übergangsmetalle (V, Nb, Ta, Cr), als auch das Zinn gegen einige Hauptgruppenmetalle (Ga, In, Sb, Bi) ersetzten lässt 19 H. Hillebrecht, Habilitationsschrift, Freiburg, 1997 H. Hillebrecht, V. Kuntze, K. Gebhardt, Z. Krist. 1997, 212, 840-847 8 V. Kuntze. Dissertation, Bonn 1999 7 14 [8] . 3. Zinkreiche Verbindungen ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Damit konnte gezeigt werden, dass dieses strukturchemisch anspruchsvolle Baumotiv kein Einzelfall darstellt, sondern ein primär auf geometrischen Faktoren beruhendes, und auf unterschiedliche Systeme anwendbares Prinzip, das seine Stabilität offenbar aus der ihm innewohnenden Selbstähnlichkeit bezieht. Eine alternative Beschreibung des Mo7Sn12Zn40 erfolgt über mehrschalige Cluster, sogenannter Mackay-Polyeder. In diesen Polyedern mit ikosaedrischer Symmetrie (Punktgruppe Ih) kann die naturgemäß auftretende Frustration bezüglich der Forderung einer möglichst dichten Anordnung der Atome dadurch ausgeglichen werden, dass die großen Atome – wie z.B. Zinn – die äußere Schale besetzen. Versuche in quarternären Schmelzen mit den Metallen Mo-Pb-Sn-Zn, die Polyeder durch Zugabe eines noch größeren Metalls wie Blei um eine weitere Schale zu vergrößern, gelangen bisher nicht. Statt dessen entstand die binäre Verbindung MoZn6 (Fm-3m, a = 7.751 Å), die weder Zinn noch Blei enthält. Dabei handelt es sich vermutlich um die von Th. Heumann et al. beschriebene Verbindung mit der Summenformel MoZn7 [29] . Die Kristallstruktur lässt sich als Ordnungs- und Defektvariante der kubisch-dichtesten Kugelpackung beschreiben, wobei die Ordnung der Metallatome innerhalb dichtgepackter Schichten der des AuCu3-Typs entspricht (Abb. 3.1, Seite 17). In jeder zweiten Schicht fehlen jedoch die Mo-Atome, so dass alternierende Schichten der Zusammensetzung MoZn3 und Zn3 ( = Leerstelle) gestapelt sind. Das MoZn6 stellt einen grundsätzlich neuen Strukturtypen dar, da reine Defektvarianten von dichtesten Kugelpackungen bislang unbekannt waren. Aus quarternären Schmelzen mit Gallium statt Blei entstand die pseudobinäre Verbindung MoZn6-xGax (x ≈ 1.5), bei der etwa ein Viertel der Zinkatome statistisch gegen Gallium ersetzt ist. Diese Verbindung kristallisiert hexagonal in der Raumgruppe P63/mmc (a = 5.403 Å; c = 8.93 Å) und ist ähnlich aufgebaut wie das kubische MoZn6. Beide Verbindungen sind aus MoZn12-Polyedern aufgebaut, die über gemeinsame Ecken zu einem dreidimensionalen Gerüst verknüpft sind. Im kubischen MoZn6 sind Kuboktaeder in der Art einer kubisch-dichtesten Kugelpackung, im hexagonalen Mo(Zn,Ga)6 sind „Antikuboktaeder“ in der Art einer hexagonal-dichtesten Packung angeordnet. Wie im Fall des Mo7Sn12Zn40 sind auch hier die Strukturen nach einem hierarchischen Prinzip aufgebaut. Aufgrund der Ordnung der Metallatome und der Lücken lassen sich die Strukturen 29 Th. Heumann, H.-W. Schleicher, H. Venker, Z. Metallkde. 1969, 60, 438-441 15 3.1 Der MoZn6-Typ ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ übersichtlich als Polyederpackung beschreiben, bei der die Polyeder analog den Atomen die Positionen einer dichtesten Packung besetzen. Dabei werden die Elementstrukturen des Cu-Typs und des Mg-Typs imitiert. Weitere Untersuchungen zeigten, dass diese beiden Verbindungen lediglich die ersten Vertreter einer ganzen Strukturfamilie sind, deren Zusammensetzung ÜM(Zn,Ga)6 lautet, und die in Abhängigkeit von der Art des Übergangsmetalls und des Galliumgehalts weitere Stapelvarianten bilden. Bisher konnten für alle Stapelvarianten der dichtesten Kugelpackung, die bei Metallen unter Normalbedingungen beobachtet werden (Cu-, Mg-, La-, Sm-Struktur), Vertreter des Typs ÜM(Zn,Ga)6 (ÜM = Mo, V, Nb, Ta) gefunden werden, die diese Stapelfolgen in Form von Polyederpackungen nachbilden [30]. Neben den obengenannten Verbindungen konnten einige – allerdings galliumreiche – Verbindungen wie ReGa4, CrGa4 und MnGa4 synthetisiert werden, die im selten auftretenden PtHg4-Typ kristallisieren, und eine Ordnungs- und Defektvariante der kubisch innenzentrierten Kugelpackung bilden. Die über gemeinsame Ecken verknüpften ÜMGa8Würfel sind nach dem Muster der kubisch-innenzentrierten Packung angeordnet und bilden ein Pendant zur kubisch-innenzentrierten Kugelpackung des α-Fe-Typs. Die gesamte Strukturchemie der oben aufgeführten Verbindungen zeigt deutliche Parallelen zu den Elementstrukturen der Metalle. Bei den Verbindungen des Typs ÜM(Zn,Ga)6 und ÜMGa4 werden Atom- und Polyederpackung direkt um den Faktor zwei ineinander überführt. In allen Fällen ist auch die Raumgruppe die Gleiche, wie die der entsprechenden Elementstruktur. Eine Ausnahme diesbezüglich bildet das aus Ikosaedern aufgebaute Mo7Sn12Zn40, das an die Elementstruktur des α-Mangan mit u.a. ikosaedrisch koordinierten Mn-Atomen erinnert. Die im Rahmen dieser Arbeit durchgeführten Untersuchungen beschränkten sich nicht nur auf die Synthese neuer Vertreter dieser Strukturfamilie, sondern sollten auch der Frage nachgehen, welche Bedeutung dem Gallium innerhalb dieser Verbindungen zukommt. Der Übersicht wegen werden diese Ergebnisse im Anschluss an die Beschreibung der Kristallstrukturen vorgestellt. 30 R. Lux, Diplomarbeit, Bonn, 1999 16 3. Zinkreiche Verbindungen ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ 3.1.1. Der Strukturtyp MoZn6 – Gemeinsame Strukturmerkmale Wie oben erwähnt, bilden die Verbindungen des Typs MoZn6 Ordnungs- und Defektvarianten der dichtesten Kugelpackung. Der Übersichtlichkeit halber soll im folgenden Abschnitt, wenn nicht ausdrücklich vermerkt, das Molybdän stellvertretend für die hochschmelzenden Übergangsmetalle stehen. Auch das Zink soll stellvertretend für die beiden niedrigschmelzenden Metalle Zink und Gallium stehen, da die beiden Elemente wegen ähnlicher Elektronenzahlen röntgenographisch nicht zu unterscheiden sind, und auch keine Ausordnung oder Differenzierung nach kristallographischen Lagen beobachtet wurde. Für die Verbindungen mit Vanadium, Niob und Tantal gelten bezüglich Zink und Gallium analoge Betrachtungen. Im MoZn6 entspricht die Ordnung der Metallatome innerhalb einer Schicht dichtgepackter Atome der des AuCu3-Typs, bei dem – nach der Schläfli-Symbolik – sowohl die gesamte Anordnung der Atome, als auch das Untergitter der Minderkomponente – also das der Übergangsmetalle – ein 36-Netz bilden. Die Mehrheitskomponente bildet dann ein 3636-Kagomé-Netz. Im MoZn6 fehlen in jeder zweiten Schicht die Mo-Atome, wie in Abb. 3.1 dargestellt. Demzufolge sind alternierende Schichten der Zusammensetzung MoZn3 und Zn3 derart gestapelt, dass die Mo-Atome der folgenden Schichten ausschließlich über den Dreiecksflächen liegen, die von Zn-Atomen in den Defektschichten gebildet werden. Damit haben die Mo-Atome nur Zn-Atome als nächste Nachbarn. Es werden keine direkten Mo-Mo-Kontakte gebildet, weder innerhalb einer Schicht, noch zwischen benachbarten Schichten. Abb. 3.1: Verteilung der Metalle im MoZn6 innerhalb einer Schicht: MoZn3 (links) und Zn3 (rechts) 17 3.1 Der MoZn6-Typ ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Das Molybdän ist 12-fach von Zink in Form eines Kuboktaeders oder „Antikuboktaeders“ umgeben, je nachdem, ob sich die Mo-haltige Schicht in kubischer oder hexagonaler Stapelsequenz befindet (Abb. 3.2). Das Zink ist wegen der vorhandenen Defekte nur 10-fach von zwei Molybdän- und acht Zinkatomen koordiniert. Allerdings leiten sich auch diese Polyeder vom Kuboktaeder bzw. „Antikuboktaeder“ der dichtesten Kugelpackung ab. Dabei sind – außer für das kubische MoZn6 – verschiedene Kombinationen möglich, je nach dem, ob sich das Zink in kubischer bzw. hexagonaler Stapelsequenz, oder in Mo-haltigen bzw. in Defektschichten befindet. Die entsprechenden Polyeder sind weiter unten wiedergegeben. Zn Zn Zn Zn Zn Zn Zn Zn Zn Zn Zn Mo Zn Zn Zn Zn Zn Zn Mo Zn Zn Zn Zn Zn Zn Zn Abb. 3.2: Koordinationspolyeder des Mo in den Verbindungen des Typs MoZn6. Kuboktaeder (links) und „Antikuboktaeder“ (rechts). Durch die Art der Stapelung der Schichten und aufgrund der Ordnung der Mo-Atome innerhalb einer Schicht bilden die Strukturen ein dreidimensionales Netzwerk aus eckenverknüpften MoZn12-Polyedern, wobei jedes Zn-Atom gemäß der Formulierung MoZn12/2 jeweils zwei Polyedern gemeinsam angehört. Durch die Symmetrie der Polyeder (Kuboktaeder bzw. „Antikuboktaeder“) sind aufgrund dieser Verknüpfung alle Polyeder ihrerseits von zwölf weiteren Polyedern umgeben. Da die Packung der Atome und die Ordnung der Mo-Atome innerhalb einer Schicht derjenigen einer dichtesten Packung entspricht, sind auch die Koordinationspolyeder in Form einer dichtesten Packung angeordnet. Die Polyeder verhalten sich strukturchemisch ähnlich wie Atome einer 18 3. Zinkreiche Verbindungen ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ dichtesten Packung. Abb. 3.3 zeigt die Analogie zwischen Kugelpackung und Polyederpackung. Für das mittlere Polyeder ist eine Art Kugelsphäre eingezeichnet, deren Radius sich aus der Summe zweier Atomradien – denen des Molybdäns und des Zinks – ergibt. Kugelpackung und Polyederpackung werden durch eine Skalierung um den Faktor zwei direkt ineinander überführt. Abb. 3.3: Vergleich einer dicht gepackten Anordnung von Atomen mit einer dicht gepackten Anordnung von MoZn12-Polyedern 19 3.1 Der MoZn6-Typ ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ 3.1.2. Kristallstrukturen 3.1.2.1. Das kubische MoZn6 MoZn6 kristallisiert kubisch in der Raumgruppe Fm-3m (a = 7.7516(1) Å) in Form metallisch glänzender Oktaeder. Häufig werden auch hexagonale oder trigonale Plättchen beobachtet, die bei der Röntgenstrukturanalyse eine hexagonale Zelle mit einem c/a-Verhältnis von √6 zeigen (a = 5.43Å und c = 13.31 Å), wobei es sich um eine ReversObvers-Verzwillingung der kubisch-dichtesten Kugelpackung handelt. In der Kristallstruktur sind alternierende Schichten der Zusammensetzung MoZn3 und Zn3 in kubischer Stapelsequenz ...ABC... (Jagodzinski-Symbolik: c) gestapelt und bilden ein kubisch flächenzentriertes Gitter. Bedingt durch die Ordnung und Defekte liegt im Vergleich zur kubisch-dichtesten Kugelpackung eine achtfache Überstruktur bei Verdopplung der Gitterkonstanten (a’ = 2a) vor, wobei die Raumgruppe Fm-3m beibehalten wird. Formal stellt die Struktur auch eine Defektvariante des AuCu3-Typs (RG: Pm-3m) dar, dessen Zelle als Subzelle in Abb. 3.4 gestrichelt dargestellt ist. Das MoZn6 lässt sich durch eine einfache Gruppe-Untergruppe-Beziehung aus dem AuCu3-Typ herleiten (klassengleich, Ordnung 2): der erste Schritt ist eine Verdopplung der Gitterkonstante, der zweite Schritt stellt den Übergang vom P-Gitter zum F-Gitter dar. Mo Zn Lücke Abb. 3.4: Elementarzelle des MoZn6 (links) und die Verteilung der Metallatome innerhalb der Schichten MoZn3 und Zn3. 20 3. Zinkreiche Verbindungen ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Durch die Defekte im MoZn6 wird das Koordinationspolyeder des Molybdäns nicht beeinflusst. Es ist das reguläre Kuboktaeder der kubisch-dichtesten Kugelpackung mit der Koordinationszahl zwölf. Das Zink ist wegen der Defekte dagegen nur zehnfach koordiniert, wobei sich das Koordinationspolyeder vom Kuboktaeder ableiten lässt. Die Defekte sind in Abb. 3.5 durch weiße Kreise dargestellt. Zn Zn Zn Zn Zn Zn Zn Zn Zn Mo Zn Zn Mo Zn Zn Zn Zn Mo Zn Zn Zn Zn Zn Zn Abb. 3.5: Koordinationspolyeder des Molybdäns (links) und des Zinks (rechts) in MoZn6 Tab. 3.1: Strukturdaten zu MoZn6 ____________________________________________________________ Strukturdaten Summenformel MoZn6 Kristallsystem Raumgruppe Gitterkonstanten Zellvolumen kubisch F m -3 m (no. 225) a = 7.7516(1) Å 465.77(1) Å3 röntgenographische Dichte Pearson code Formeleinheiten / Zelle 6.964 g/cm3 cF28 4 Atomkoordinaten Atom Wyck. Symm. x y z Mo Zn 4a 24d m-3m m.mm 0 0 0 0.25 0 0.25 4b m-3m 0.5 0.5 0.5 ____________________________________________________________ 21 3.1 Der MoZn6-Typ ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ 3.1.2.2. Die kubischen Verbindungen V(Zn,Ga)6 , Nb(Zn,Ga)6 und Ta(Zn,Ga)6 Neben dem binären MoZn6 existieren mit den Übergangsmetallen der 5. Gruppe isotype Verbindungen, bei denen ein Teil des Zinks gegen Gallium ersetzt ist. Wegen sehr ähnlicher Elektronenzahlen sind Zink und Gallium röntgenographisch kaum unterscheidbar. Da kein Hinweis für eine geordnete Verteilung der Galliumatome oder für eine Überstruktur vorliegt, wird eine statistische Verteilung von Zink und Gallium angenommen. Die Untersuchung mehrerer Einkristalle mit energiedispersiver Röntgenspektroskopie (EDX) lieferte für alle drei Verbindungen eine beträchtliche Menge an Gallium. Im V(Zn,Ga)6 beträgt das Zn-Ga-Verhältnis etwa 1.5 : 1 und bei den höheren Homologen Niob und Tantal etwa 1 : 1. Angaben zur Synthese, der Zusammensetzung und den Gitterkonstanten sind in Tabelle 3.3, Seite 27 enthalten. 3.1.2.3. Das kubische Mo(Zn,Ga)6 Aufgrund früherer Beobachtungen wurde immer vermutet, dass das kubische MoZn6 nur als rein binäre Verbindung existiert. Dafür sprach, dass bisher die kubische Verbindung nie in galliumhaltigen Ansätzen beobachtet wurde, sowie die Tatsache, dass die kubischen Vertreter mit den Metallen der 5. Gruppe – Vanadium, Niob und Tantal – stets beträchtliche Mengen an Gallium enthalten. Das MoZn6 lässt sich bei geeigneten Molverhältnissen problemlos und reproduzierbar aus ternären Mo-Zn-Sn-Schmelzen oder quarternären Mo-Sn-Zn-Pb-Schmelzen herstellen, wobei die zusätzlichen Metalle in der Kristallstruktur nicht vorhanden sind. Weiterhin wurde die hexagonale und rhomboedrische Stapelvariante des Mo(Zn,Ga)6, deren Strukturbeschreibung in den nächsten Abschnitten erfolgt, nur als ternäre Verbindungen, und auch nur in galliumhaltigen Schmelzen beobachtet. Schließlich wird eine weitere hexagonale Stapelvariante ÜM(Zn,Ga)6 mit acht Schichten einer dichtesten Packung nur mit den Übergangsmetallen der 5. Gruppe beobachtet. Diese Ergebnisse sprechen deutlich für elektronische Einflüsse als strukturbestimmende Faktoren bei der Bildung der entsprechenden Kristallstruktur, bei der die Valenzelektronenkonzentration (VEK) einen maßgeblichen Einfluss ausübt. Am Beispiel der Synthesen des kubischen MoZn6 und des hexagonalen Mo(Zn,Ga)6 wird deutlich, dass offensichtlich nicht nur das Gallium in der Kristallstruktur für den Strukturwechsel verantwortlich ist, sondern dass auch die Anwesenheit geringer Mengen eines zusätzlichen 22 3. Zinkreiche Verbindungen ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Metalls wie Gallium, Zinn und/oder Blei in der Schmelze die Bildung einer Struktur begünstigt oder verhindert. Dass die Synthese von MoZn6 nun doch aus galliumhaltigen Mo-Zn-Schmelzen gelang, und dass sehr geringe Mengen an Gallium auch im Reaktionsprodukt enthalten ist, mag auf den ersten Blick überraschen. Hier zeigt sich die auffallende Parallele zu den HumeRothery-Phasen in der Form, dass die Bildung einer Struktur nicht nur von der VEK der beteiligten Partner abhängt, sondern dass die Produkte auch eine gewisse Phasenbreite bzw. einen Homogenitätsbereich besitzen. Offensichtlich kann das binäre MoZn6 einen geringen Anteil an Gallium in die Kristallstruktur einbauen, bevor die Struktur instabil wird, und in die hexagonale Form wechselt. Ähnliche Verhältnisse werden auch bei den Messing-Phasen beobachtet. Für diese These spricht die Tatsache, dass die kubische Verbindung nur in sehr galliumarmen Schmelzen entsteht, und das Gallium auch nur zu einem bedeutend niedrigerem Anteil – im Vergleich zur hexagonalen Verbindung – in der Kristallstruktur vorhanden ist. Die Synthese des kubischen Mo(Zn,Ga)6 gelang nahezu phasenrein in Mo-Ga-ZnSchmelzen im molaren Verhältnis 1 : 1 : 20 bei einer Temperatur von 850°C und einer Abkühlrate von 6°/h. Die Verbindung entsteht zwar auch noch bei niedrigerem Ga-Gehalt, allerdings nimmt dabei die Qualität der Einkristalle ab, und auch in den Pulverdiagrammen sind bei abnehmendem Galliumgehalt verstärkt Reflexe von nicht umgesetztem Molybdän zu beobachten. Bei steigendem Galliumgehalt erfolgt dann sehr schnell der Strukturwechsel zur hexagonalen Variante. Das gemessene Pulverdiagram zeigt gute Übereinstimmung mit dem aus den Strukturdaten berechnetem Diagramm. Zusätzliche Reflexe im gemessenen Diagramm stammen von Mo3Ga (Cr3Si-Typ). Diese Verbindung entsteht im System Mo-Ga-Zn nur dann, wenn der Anteil an Gallium in der Schmelze äußerst gering ist, und ihre Existenz bietet möglicherweise einen Ansatzpunkt für die Frage, in wie weit das Gallium am Lösungsvorgang des Molybdäns beteiligt ist. Die Ergebnisse zum Einfluss des Galliums in der Schmelze und in den einzelnen Verbindungen werden in Abschnitt 3.1.5 ausführlich diskutiert. 23 3.1 Der MoZn6-Typ Intensität ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Intensität berechnet 10 gemessen 20 30 40 50 60 70 80 2-Theta Abb. 3.6: Pulverdiagram des kubischen Mo(Zn,Ga)6. Zusätzliche Reflexe im gemessenen Diagramm stammen von geringen Mengen Mo3Ga (Cr3Si-Typ) Nach Entfernen des überschüssigen Metalls mit sehr verdünnter Salzsäure bleibt das Mo(Zn,Ga)6 in Form metallisch glänzender gut ausgebildeter Oktaeder und trigonaler Antiprismen zurück. Die röntgenographische Untersuchung mehrerer Einkristalle ergab eine kubisch-flächenzentrierte Elementarzelle mit einer Gitterkonstanten von 7.678(2) Å. Mit den Koordinaten des binärenMoZn6 als Startmodell konvergierte die Verfeinerung mit SHELX97 des aus 115 unabhängigen Reflexen bestehenden Datensatzes mit 6 Parametern in der Raumgruppe Fm-3m problemlos bei Zuverlässigkeitswerten von R1(F) = 0.0398 und wR2(I) = 0.0884. Anhand der Röntgendaten waren Aussagen über den Galliumgehalt nicht möglich. Die ersten EDX-Analysen erfolgten an einem Oktaeder (Abb. 3.15, Seite 35) und ergaben ein Zink-Gallium-Verhältnis von etwa 3:1. Dieser recht hohe Anteil an Gallium entspricht der Summenformel MoZn4.5Ga1.5 und ist vergleichbar mit der Zusammensetzung des hexagonalen Mo(Zn,Ga)6. Da nicht auszuschließen war, dass es sich dabei um einen Oberflächeneffekt handelt, wurden weitere EDX-Analysen mit in Kunstharz gegossenen und angeschliffenen Kristallen durchgeführt. Diese Messungen an mehreren Kristallen ergaben alle einen deutlich geringeren Galliumgehalt von etwa 10 Atom % Gallium. Das entspricht einer Summenformel von etwa MoZn5,4Ga0.6. Weitere Elemente, etwa Sauerstoff oder Silizium, dass aus Reaktion des Metalls mit dem Quarzglas des Reaktionsgefäßes stammen könnte, wurden nicht gefunden. 24 90 3. Zinkreiche Verbindungen ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Tab. 3.2: Angaben zur Strukturbestimmung des kubischen Mo(Zn,Ga)6 Rel. Molmasse Kristallsystem Raumgruppe Zellabmessungen Zellvolumen Anzahl der Formeleinheiten Röntgendichte Messtemperatur Röntgenstrahlung F ( 0 0 0) Messbereich h, k, l max. 2θ Scantyp Scanbreite Max. Messzeit pro Reflex Messwerte davon unbeobachtet unabhängige Reflexe davon mit I > 0 davon mit I > 2σ(I) Kristallform Kristallabmessungen Absorptionskorrektur Interner Standard Schwächungskoeffizient Extinktionskoeffizient (SHELX97) Restelektronendichte Wichtungsfunktion 494.58 g/mol kubisch F m –3 m (Nr. 225) a = 7.678(2) Å V = 452.74 Å3 4 7.162 g/cm3 20°C Mo Kα1 888 14; 14; 14 85° Ω/ 2θ 0.37° + 0.41 * tanθ 30s 625 0 115 115 89 Oktaeder 0.1 * 0.1 * 0.1 mm3 empirisch; Ψ - scan 0.0817 (0.0302) 33.71 mm-1 0,01144 + 1.45; -1.07 (0.50) e/ Å3 1 / [σ2 * F02 + (0,0447 * P) 2] mit P = (F02 + 2 * Fc2) / 3 6 R1(F) = 0.0398; wR2(I) = 0.0884 Zahl der Parameter R- Werte Ortskoordinaten und Auslenkungsparameter Atom Wyck. Symm. x y z Ueq Mo Zn 4a 24d m-3m m.mm 0 0 0 0.25 0 0.25 0.0076(4) 0.0107(4) Atom U11 U22 U33 U12 U13 U23 Mo Zn 0.0076(4) 0.0081(5) 0.0076(4) 0.0120(5) 0.0076(4) 0.0120(5) 0 0 0 0 0 -0.0034(4) 25 3.1 Der MoZn6-Typ ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Auffallend ist die etwas kleinere Gitterkonstante von nur 7.6786(9) Å im pseudobinären Mo(Zn,Ga)6 gegenüber dem binären MoZn6 (a = 7.7516(1) Å). Aufgrund des aus der Elementstruktur des Galliums berechneten höheren Atomvolumens von 19.6 Å3 gegenüber Zink (15.2 Å3) und Molybdän (15.5 Å3) wäre für die galliumhaltige Verbindungen auf den ersten Blick eine etwas größere Gitterkonstante zu erwarten. Allerdings stimmen die Beobachtungen sehr gut mit den in Abschnitt 2 beschriebenen Verhältnissen überein, wonach der Raumbedarf von Galliums in intermetallischen Verbindungen in der Regel kleiner ist als in der Elementstruktur. Auch das Verhalten von Gallium als Minderkomponente in zinkreichen Verbindungen, das stets mit einer geringen Kontraktion der mittleren Atomvolumina verbunden ist, wird hier bestätigt. Ein geringer Zinngehalt in dem aus zinnhaltigen Schmelzen erhaltene MoZn6 ist nach EDX-Analysen auszuschließen. Auszuschließen sind auch Zufälle bei der Auswahl von Einkristallen oder Messfehler der Diffraktometer, was die Vermessung zahlreicher Einkristalle auf verschiedenen Diffraktometern bestätigt (STOE IPDS, STOE IPDS II, Siemens P4, Enraf Nonius CAD4). Man erkennt die unterschiedlichen Gitterkonstanten deutlich in den Pulverdiagrammen der aus verschiedenartigen Metallschmelzen synthetisierten Verbindungen (Abb. 3.7) Beide Diffraktogramme zeigen scharfe Peaks mit geringer Halbwertsbreite, was die definierte Gitterkonstante bestätigt. In Tabelle 8.1 und 8.2 (Seite 227) sind die Ergebnisse der Indizierung und Verfeinerung der Gitterkonstanten beider Pulverdiagramme zusammengefasst. rot: schwarz: MoZn6 Mo(Zn,Ga)6 Mo : Sn : Zn Mo : Ga : Zn 1 : 1 : 15 5 10 20 30 40 50 60 1 : 1 : 20 70 80 90 2 -T h e ta - S c a le Abb. 3.7: Vergleich der Pulverdiagramme des binären MoZn6 (rot) mit dem pseudobinären Mo(Zn,Ga)6 (schwarz). 26 3. Zinkreiche Verbindungen ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Tabelle 3.3: Angaben zur Synthese sowie die Ergebnisse der EDX-Analyse und die Gitterkonstanten der kubischen Verbindungen des Typs MoZn6. Verbindung molarer Ansatz Zusammensetzung Gitterkonstante nach EDX-Analyse Mo : Sn : Zn MoZn6 1 : 1 : 15 MoZn6 7.7516(1) Å ÜM : Ga : Zn Mo(Zn,Ga)6 1 : 1 : 20 MoZn5,4Ga0,6 7.678(2) Å V(Zn,Ga)6 1 : 2 : 10 VZn3,5Ga2,5 7.6485(8) Å Nb(Zn,Ga)6 1 : 4 : 14 NbZn3,0Ga3,0 7.8037(4) Å Ta(Zn,Ga)6 1 : 4 : 4 TaZn3,0Ga3,0 7.7940(1) Å Abstände [in Å] der kubischen Verbindungen ÜM(Zn,Ga)6 MoZn6 Mo(Zn,Ga)6 Mo - Zn 2.741(2) 12x Mo - Zn 2.717(1) 12x Zn - Mo 2.741(2) 2x Zn - Mo 2.717(1) 2x Zn - Zn 2.741(2) 8x Zn - Zn 2.717(1) 8x V(Zn,Ga)6 Nb(Zn,Ga)6 Ta(Zn,Ga)6 V - Zn 2.704(1) 12x Nb - Zn 2.759(1) 12x Ta - Zn 2.756(1) 12x Zn - V 2.704(1) 2x Zn - Nb 2.759(1) 2x Zn - Ta 2.756(1) 2x Zn - Zn 2.704(1) 8x Zn - Zn 2.759(1) 8x Zn - Zn 2.756(1) 8x 27 3.1 Der MoZn6-Typ ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ 3.1.2.4. Das hexagonale Mo(Zn,Ga)6 Ähnlich aufgebaut wie das kubische MoZn6 ist das pseudobinäre hexagonale Mo(Zn,Ga)6, bei dem nach EDX-Untersuchungen etwa ein Viertel der Zinkatome statistisch gegen Gallium ersetzt ist, was einer Summenformel von MoZn4,5Ga1,5 entspricht. Die Verbindung kristallisiert hexagonal in der Raumgruppe P63/mmc (a = 5.4059(6) Å, c = 8.9321(12) Å) in Form metallisch glänzender hexagonaler Säulen und unregelmäßiger Polyeder mit vielen Flächen. Die Verteilung der Metallatome und das Auftreten von Lücken in jeder zweiten Schicht entsprechen dem des kubischen MoZn6. Die Elementarzelle enthält vier Schichten in der Stapelfolge ...ABAC... (Jagodzinski-Symbol: hc), wobei sich die MoAtome in den Schichten B und C befinden, also Schichten in hexagonaler Stapelsequenz. Die Defektschichten dagegen liegen in kubischer Stapelfolge (Abb. 3.8). Auch für diese Stapelvariante der dichtesten Kugelpackung ist eine 1:3-Ordnungsvariante bekannt: es ist der TiNi3-Typ (P63/mmc; a = 5.096 Å, c = 8.304 Å[31]), bei dem kubische und hexagonale Stapelfolgen in abwechselnder Sequenz vorliegen. A C A B A c a b Mo Zn, Ga Lücke Abb. 3.8: Struktur des hexagonalen Mo(Zn,Ga)6 mit Kennzeichnung der Schichten. Dargestellt sind vier Elementarzellen. 31 J. G. White, Acta Cryst. 1965, 18, 217 28 3. Zinkreiche Verbindungen ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Die Mo-Atome in den Schichten B und C liegen in hexagonaler Stapelsequenz. Daraus ergibt sich als Koordinationspolyeder das „Antikuboktaeder“ der hexagonal-dichtesten Kugelpackung. Auch die Zn-Atome sind in diesen Schichten „antikuboktaedrisch“ –allerdings wegen der zwei Lücken in den Nachbarschichten nur zehnfach – koordiniert, während die Zn-Atome in den Defektschichten mit Einbeziehung der Lücken kuboktaedrisch koordiniert sind. Zn1 Zn2 Zn2 Zn2 Zn1 Mo Zn1 Zn1 Zn1 Zn1 Zn2 Zn2 Zn2 Zn2 Mo Zn2 Zn1 Zn1 Zn2 Zn1 Zn2 Zn2 Mo Zn2 Zn1 Zn1 Mo Zn1 Mo Zn2 Zn1 Zn1 Zn2 Zn1 Zn2 Abb. 3.9: Koordinationspolyeder im hexagonalen Mo(Zn,Ga)6: „Antikuboktaeder“ um Molybdän, sowie unvollständige Kuboktaeder und „Antikuboktaeder“ um Zn1 und Zn2. Tab. 3.4: Strukturdaten zum hexagonalen Mo(Zn,Ga)6 _____________________________________________________ Strukturdaten Summenformel MoZn4,5Ga1,5 Kristallsystem Raumgruppe Gitterkonstanten Zellvolumen hexagonal P 63/m m c (no. 194) a = 5.4059(6) Å c = 8.9321(12) Å 226.06 Å3 röntgenographische Dichte Pearson code Formeleinheiten / Zelle Wyckoff-Sequenz 7.173 g/cm3 hP14 2 hgd Atomkoordinaten Atom Wyck. Symm. x y z Mo Zn1 Zn2 2d 6g 6h -6m2 .2/m. mm2 0.33333 0.5 0.16152(5) 0.66667 0 0.32303(9) 0.75 0 0.25 2a -3m. 0 0 0 _____________________________________________________ 29 3.1 Der MoZn6-Typ ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Das hexagonale Mo(Zn,Ga)6 entsteht in Mo-Ga-Zn-Schmelzen mit unterschiedlichem Ga-Gehalt und auch die Verbindung selbst besitzt eine gewisse Phasenbreite, wobei je nach Galliumgehalt die Gitterkonstanten geringfügig variieren. Mit steigendem Ga-Gehalt in der Schmelze erhöht sich auch der Ga-Gehalt in der Verbindung in gewissem Maße. Die Ergebnisse dazu werden in Abschnitt 3.1.5, Seite 49 diskutiert. Das c/a-Verhältnis ist mit etwa 1.652 etwas größer als das ideale Verhältnis von 1.633 für diese Struktur. Deshalb sind auch die Werte der Atomkoordinaten der Zn2-Lage gegenüber den idealen Werten von x = 1/6 und y = 1/3 ein wenig kleiner, (Tab. 3.4; Seite 29) , so dass die Koordinationspolyeder in Richtung der c-Achse leicht verzerrt sind. Möglicherweise ist das auf den Einfluss des Galliums in der Struktur zurückzuführen. Ähnliches findet man auch bei den Hume-Rothery-Phasen, wo sich in den Messing-Phasen ein Anstieg der VEK ebenfalls geringfügig auf die Gitterkonstanten auswirkt [32]. 3.1.2.5. Das rhomboedrische Mo(Zn,Ga)6 Auch hier liegt eine Ordnungs- und Defektvariante der dichtesten Packung vor. Die Verteilung der Mo-Atome innerhalb der Schichten und das Auftreten von unbesetzten MoPositionen in jeder zweiten Schicht, die auch hier ausschließlich in kubischer Stapelfolge auftreten, entspricht dem Prinzip der oben beschriebenen Verbindungen. Die Elementarzelle enthält achtzehn Schichten in der rhomboedrischen Stapelfolge ...ABACAB CACBCA BCBABC... (Jagodzinski-Symbol (hchccc)3). Dabei wird ein Permutationszyklus durchlaufen, dessen Identitätsperiode aus drei mal sechs Schichten besteht. Die Stapelsequenz hchc entspricht der des hexagonalen Mo(Zn,Ga)6.. Mo-Atome in diesen Sequenzen sind “antikuboktaedrisch” von Zn umgeben. Durch das Auftreten von zwei weiteren c-Sequenzen (MoZn3, Zn3) erscheinen in der Struktur zusätzlich Schichten kuboktaedrisch koordinierter Mo-Atome. Daher lässt sich die Stapelfolge auch beschreiben als Sequenz dreier aufeinanderfolgender Blöcke des hexagonalen Mo(Zn,Ga)6, die durch eine Schicht Kuboktaeder in ihrer Stapelposition gegeneinander verschoben sind. Im Rahmen dieser Arbeit ist es nun auch gelungen, die Verbindung nahezu phasenrein und in hoher Ausbeute zu erhalten. Abb.3.10 zeigt die gute Übereinstimmung des gemessenen mit dem aus Einkristalldaten berechneten Diagramms. 32 W. B. Pearson, The Crystal Chemistry and Physics of Metals and Alloys, Wiley, New York, 1972 30 3. Zinkreiche Verbindungen ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Die zusätzlichen, mit einem Stern gekennzeichneten Linien sind die stärksten Reflexe von ZnGa2O4, das im Strukturtyp des Spinell kristallisiert (cF56, Fd-3m, a = 8.389(1)Å, und des Öfteren in Form großer transparenter, farbloser Oktaeder oder als Drusen mit sehr kleinen Kristallen in Mo-Ga-Zn-Schmelzen beobachtet wurde. In einigen Ansätzen ist die Bildung dieser Verbindung zurückzuführen auf geringste Verunreinigungen an ZnO, die im verwendeten Zink enthalten war, wie Pulveraufnahmen zeigten. In diesen Ansätzen sind denn auch sehr große Einkristalle vorhanden. Röntgenographische Untersuchungen mit dem Einkristalldiffraktometer und EDX-Analysen an einigen Kristallen ergaben ein Zn : Ga-Verhältnis von 1 : 2. Kristalle des ZnGa2O4 dienten daher als Eichkristalle für die Bestimmung des Zn-Ga-Verhältnisses in Kristallen des hexagonalen Mo(Zn,Ga)6. Bemerkenswert ist die Tatsache, dass die Synthese von Spinellen in Metallschmelzen bei 850°C in einkristalliner Form gelingt, obwohl die Verbindung einen Schmelzpunkt von 2140°C hat. berechnet 5 10 20 30 40 50 60 70 80 * * 10 20 30 100 gemessen * 5 90 40 * * 50 60 70 80 90 100 2-Theta - Scale Abb. 3.10: Pulverdiagram des rhomboedrischen Mo(Zn,Ga)6. Die mit einem Stern gekennzeichneten Reflexe stammen von ZnGa2O4 (Spinell-Typ) 31 3.1 Der MoZn6-Typ ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ C B A B C B A C B C A C B A C A B c a A b Mo kubisch Mo hexagonal Zn, Ga Lücke Abb. 3.11: Struktur des rhomboedrischen Mo(Zn,Ga)6 mit Kennzeichnung der Schichten. Mo-Atome in kubischer und hexagonaler Stapelsequenz sind rot bzw. blau gekennzeichnet. Dargestellt sind vier Elementarzellen. 32 3. Zinkreiche Verbindungen ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Die Elementarzelle enthält zwei Molybdän- und vier Zinkpositionen, die je nach Lage ihrer Nachbarschichten kuboktaedrisch bzw. „antikuboktaedrisch“ koordiniert sind. Für die Zinkatome ergibt sich wegen der Lücken wieder eine 10-fache Koordination, bestehend aus zwei Mo- und acht Zn-Atomen. Zn4 Zn1 Zn1 Zn1 Mo1 Zn4 Zn1 Zn1 Zn4 Zn4 Abb. 3.12: Zn4 Zn4 Zn1 Zn3 Zn3 Zn3 Zn2 Zn4 Zn4 Zn4 Mo2 Zn3 Zn3 Zn3 Zn2 Zn2 Koordinationspolyeder des Molybdäns im rhomboedrischen Mo(Zn,Ga)6 Die Symmetrie der Zn-Polyeder von Zn1 und Zn3 in den molybdänhaltigen Schichten folgt naturgemäß derjenigen der entsprechenden Mo-Polyeder; d.h. unvollständiges Kuboktaeder bzw. „Antikuboktaeder“ (Abb. 3.12). Da sich die Zn-Atome in molybdänfreien Schichten (Zn2 und Zn4) immer in kubischer Stapelfolge befinden sind diese jeweils unvollständig kuboktaedrisch koordiniert (Abb. 3.13). Zn4 Zn1 Mo1 Zn1 Zn4 Abb. 3.13: Zn1 Zn4 Zn4 Zn1 Mo1 Zn1 Zn3 Mo2 Zn3 Zn2 Zn4 Zn4 Zn3 Zn3 Mo2 Zn3 Zn2 Koordinationspolyeder der Zinkatome der molybdänhaltigen Schichten im rhomboedrischen Mo(Zn,Ga)6 33 3.1 Der MoZn6-Typ ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Zn3 Mo2 Zn2 Zn2 Zn2 Zn2 Zn3 Zn3 Zn1 Mo1 Zn3 Zn1 Zn4 Zn2 Zn4 Zn4 Zn3 Mo2 Zn3 Zn4 Zn4 Mo2 Abb. 3.14: Koordinationspolyeder der Zinkatome der molybdänfreien Schichten im rhomboedrischen Mo(Zn,Ga)6 Tab. 3.5: Strukturdaten zum rhomboedrischen Mo(Zn,Ga)6 _____________________________________________________ Strukturdaten Summenformel Mo(Zn,Ga)6 Kristallsystem Raumgruppe Gitterkonstanten Zellvolumen trigonal R -3 m (no. 166) a = 5.4030(7) Å c = 40.1399(8) Å 1014.79(3) Å3 röntgenographische Dichte Pearson code Formeleinheiten / Zelle 7.081 g/cm3 hR21 / hP63 3 / 9 Atomkoordinaten Atom Wyck. Symm. x y z Mo1 Mo2 Zn1 Zn2 Zn3 Zn4 3a 6c 9d 9e 18h 18h -3m 3m .2/m .2/m .m .m 0 0 0.5 0.5 0.49481(8) 0.50053(7) 0 0 0 0 -0.49481(8) -0.50053(7) 0 0.22241(3) 0.5 0 0.22216(3) 0.38890(3) 1 2 3b 6c -3m 3m 0 1/3 0 2/3 0.5 0.27767 _____________________________________________________ 34 3. Zinkreiche Verbindungen ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Kristalle des kubischen, hexagonalen und rhomboedrischen Mo(Zn,Ga)6 lassen sich gut anhand ihres unterschiedlichen Habitus unterscheiden. Die kubische Verbindung kristallisiert fast ausschließlich in Form mehr oder weniger perfekter Oktaeder, während die hexagonale Verbindung in unregelmäßigen Polyedern kristallisiert. Die wenigen Einkristalle des rhomboedrischen Mo(Zn,Ga)6, die bisher gefunden wurden, bilden stets plättchenförmige Kristalle in Form von trigonalen, hexagonalen oder stark verzerrten hexagonalen Polyedern. Der überwiegende Teil des rhomboedrischen Mo(Zn,Ga)6 bildet ein dunkelgraues Pulver. 10µm 10µm Abb. 3.15: links: REM-Bild eines Kristalls des kubischen Mo(Zn,Ga)6 rechts: REM-Bild eines Kristalls des hexagonalen Mo(Zn,Ga)6 10µm 10µm Abb. 3.16: links: REM-Bild eines Kristalls des rhomboedrischen Mo(Zn,Ga)6 (an der rechten Seite abgebrochen) rechts: REM-Bild eines Kristalls des kubischen Mo7Ga26Zn26 35 3.1 Der MoZn6-Typ ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ 3.1.2.6. Die hexagonalen Verbindungen V(Zn,Ga)6 , Nb(Zn,Ga)6 und Ta(Zn,Ga)6 Eine weitere hexagonale Stapelvariante existiert mit den Übergangsmetallen der 5. Gruppe. Die Verbindungen kristallisieren in der Raumgruppe P63/mmc. Für die Tantalverbindung wurden Gitterkonstanten von a = 5.501(3) Å und c = 18.069(11) Å gemessen. Die Elementarzelle enthält acht Schichten einer dichtesten Kugelpackung nach dem oben beschriebenen Prinzip. Dies entspricht einer Verdopplung der c-Achse im Vergleich zum hexagonalen Mo(Zn,Ga)6. Die Stapelsequenz erfolgt nach dem Muster ...ACBC ABCB... (Jagodzinski-Symbol (hccc)2) mit den Übergangsmetallen in den Schichten A B A C. Damit enthält die Struktur alternierende Schichten kuboktaedrisch und „antikuboktaedrisch“ koordinierte Übergangsmetalle, wobei die Defektschichten sich auch hier ausschließlich in kubischer Stapelfolge befinden. Bisher waren nur die Niob- und Tantalverbindung bekannt [5] . Im Rahmen dieser Arbeit konnte nun auch die entsprechende Vanadiumverbindung synthetisiert und charakterisiert werden, so dass diese „Lücke“ nun geschlossen ist. Einkristalle des hexagonalen V(Zn,Ga)6 konnten aus einer zinkreichen ternären Metallschmelze V:Ga:Zn im molaren Verhältnis 1:2:9 bei einer Reaktionstemperatur von 850°C in sehr geringer Ausbeute gezüchtet werden. Nach Entfernen des überschüssigen Metalls mit sehr verdünnter Salzsäure blieben neben metallisch glänzenden tetragonalen Säulen und Quadern, bei denen es sich um V2Ga5 handelt (P4/mbm, a = 8.965 Å, c = 2.70 Å, Mn2Hg5-Typ[33]), sehr wenige kleine hexagonale Plättchen zurück. Die Vermessung eines Kristalls mit dem IPDS ergab eine hexagonale Zelle mit den Gitterkonstanten a = 5.4140(8) Å und c = 17.847(4) Å. Die Zellabmessungen und die Symmetrie ließen auf ein Isotypie zu den oben erwähnten Verbindungen schließen. Mit den Koordinaten des Nb(Zn,Ga)6 bzw. Ta(Zn,Ga)6 als Startmodell konvergierte die Verfeinerung mit SHELX97 des aus 204 unabhängigen Reflexen bestehenden Datensatzes mit 20 Parametern in der Raumgruppe P63/mmc problemlos bei Zuverlässigkeitswerten von R1(F) = 0.0249 und wR2(I) = 0.0845. Anhand der Röntgendaten konnte keine Aussage über einen möglichen Galliumgehalt gemacht werden. EDX-Analysen ergaben ein ZinkGallium-Verhältnis von etwa 2:1, wie es auch für die Tantal- und Niob-Verbindungen 5 R. Lux, Diplomarbeit, Bonn, 1999 33 K. Schubert, H.G. Meissner, M. Pötzsche, W. Roßteutscher, E. Stolz, Naturwissenschaften, 1962, 49,57 36 3. Zinkreiche Verbindungen ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ gemessen wurde. Dies entspricht einer Zusammensetzung von VZn4Ga2. In Abb. 3.17 ist die Struktur dargestellt. Die Übergangsmetallatome befinden sich in Schichten mit der Stapelfolge . . . ABAC . . ., die auch von der Elementstruktur des Lanthan gebildet wird. Mit den Defektschichten, die ausschließlich in kubischer Stapelfolge liegen, sind Schichten mit Übergangsmetall alternierend in kubischer und hexagonaler Sequenz angeordnet. A B C B A C B C A c a b ÜM, kubisch ÜM, hexagonal Zn, Ga Lücke Abb. 3.17: Struktur des hexagonalen V(Zn,Ga)6 , Nb(Zn,Ga)6 und Ta(Zn,Ga)6 mit Kennzeichnung der Schichten. Die Übergangsmetalle in kubischer und hexagonaler Stapelsequenz sind rot bzw. blau gekennzeichnet. Dargestellt sind vier Elementarzellen. 37 3.1 Der MoZn6-Typ ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Ähnlich wie im rhomboedrischen Mo(Zn,Ga)6 verteilen sich die Übergangsmetalle auf zwei kristallographische Lagen, eine mit kuboktaedrischer und eine „antikuboktaedrischer“ Koordination durch Zink Zn3 Zn1 Zn1 Zn1 Zn1 Zn1 Zn3 Zn2 Zn2 M2 Zn2 Zn3 Zn3 Abb. 3.18: Zn1 M1 Zn3 Zn3 Zn3 Zn3 Zn2 Zn2 Zn3 Zn3 Zn3 Zn2 Zn3 Koordinationspolyeder der Übergangsmetallatome im hexagonalen ÜM(Zn,Ga)6 Von den drei Zinklagen befinden sich zwei Lagen (Zn1 und Zn2) in den gleichen Schichten wie das Übergangsmetall und sind dementsprechend unvollständig kuboktaedrisch bzw. „antikuboktaedrisch“ von je acht Zink- und zwei Übergangsmetallatomen koordiniert. Da übergangsmetallfreie Schichten (Zn3) immer in kubischer Sequenz liegen sind diese Zinkatome ebenfalls unvollständig kuboktaedrisch umgeben. Zn3 Zn1 Zn3 Zn3 M1 Zn1 Zn1 Zn1 M1 Zn3 Abb. 3.19: 38 Zn1 Zn2 M2 Zn2 Zn3 Zn3 Zn1 Zn3 Zn2 Zn3 M1 Zn1 Zn2 M2 Zn2 Zn3 Zn3 M2 Zn3 Zn3 Zn3 Zn2 Zn2 Koordinationspolyeder der Zinkatome im hexagonalen ÜM(Zn,Ga)6 3. Zinkreiche Verbindungen ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Tab. 3.6: Angaben zur Strukturbestimmung von V(Zn,Ga)6 Rel. Molmasse Kristallsystem Raumgruppe Zellabmessungen Zellvolumen Anzahl der Formeleinheiten Röntgendichte Messtemperatur Diffraktometer Röntgenstrahlung F ( 0 0 0) Meßbereich h, k, l max. 2θ Mess- / Scanmodus I / σ(I)-Verhältnis Messwerte davon unbeobachtet unabhängige Reflexe davon mit I > 0 davon mit I > 2σ(I) Kristallform Kristallabmessungen Absorptionskorrektur Interner Standard Schwächungskoeffizient Extinktionskoeffizient (SHELX98) Restelektronendichte Wichtungsfunktion Zahl der Parameter R- Werte 443.26 g/mol hexagonal P 63/m m c (Nr. 194) a = 5.4140(8) Å c = 17.847(4) V = 453.03 Å3 4 6.498 g/cm3 20°C STOE IPDS I Mo Kα1 Graphit-Monochromator 812 ±6; ±6; ±21 52° 100 Platten à 2 min bei 2° ϕ-Inkrement 6.0 3199 15 205 205 131 hexagonales Prisma 0.1 * 0.1 * 0.02 mm3 numerisch; Equivalent-Methode 0.1043 (0.0304) 32.99 mm-1 0,00045 + 0.92; -0.64 (0.31) e/ Å3 1 / [σ2 * F02 + (0,0296 * P) 2] mit P = (F02 + 2 * Fc2) / 3 20 R1(F) = 0.0252; wR2(I) = 0.0587 39 3.1 Der MoZn6-Typ ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Erwartungsgemäß sind die Gitterkonstanten des hexagonalen V(Zn,Ga)6 im Vergleich zur Niob- bzw. Tantalverbindung wegen des geringeren Atomradius des Vanadiums etwas kleiner (Metallradien für Koordinationszahl 12 nach L. Pauling: Vanadium: 1.34 Å; Niob und Tantal: 1.46 Å [34] ). Das c/a-Verhältnis der Gitterkonstanten ist bei allen drei Verbindungen ähnlich und entspricht mit dem für diese Zellabmessungen zu erwartenden Wert für diese Stapelvariante, der etwa das Doppelte des idealen c/a-Verhältnisses von 1.63 für eine hexagonal-dichteste Kugelpackung ist. Tab. 3.7: Angaben über Zusammensetzung der Schmelzen, Ergebnisse der EDX-Analyse sowie Gitterkonstanten und c/a-Verhältnisse des hexagonalen V(Zn,Ga)6, Nb(Zn,Ga)6 und Ta(Zn,Ga)6 Verbindung molarer Ansatz ÜM : Ga : Zn V(Zn,Ga)6 1 : 2 : 9 Zusammensetzung Gitterkonstanten c/a-Verhältnis nach EDX-Analyse VZn4.0Ga2.0 a = 5.4140(8) 3.296 c = 17.847(4) Nb(Zn,Ga)6 1 : 6 : 9 NbZn3.5Ga2.5 a = 5.505(3) 3.282 c = 18.069(11) Ta(Zn,Ga)6 1 : 4 : 4 TaZn3.5Ga2.5 a = 5.501(3) 3.282 c = 18.069(11) Bezüglich der Abstandsverhältnisse zwischen den Atomen verhalten sich alle drei Verbindungen sehr ähnlich. Nennenswerte Verzerrungen sind nur für die Zn2-Polyeder zu beobachten. Dabei handelt es sich um Zinkatome in den ÜMZn3-Schichten in hexagonaler Stapelsequenz, die unvollständig „antikuboktaedrisch“ koordiniert sind. Dort befinden sich die Lücken auf der „gleichen Seite“ des Koordinationspolyeders (Abb. 3.19, Seite 38), so dass die Zinkatome etwas in Richtung dieser Lücken ausweichen können. Dadurch werden die Abstände der Zn2-Atome im Bereich der Lücken alle etwas kürzer (2.611(3) Å) und auf der gegenüber liegenden Seite etwas länger (2.803(1) Å; Werte für das V(Zn,Ga)6) Der Unterschied zwischen dem kürzesten und längsten Zn2-Zn2-Abstand beträgt etwa 7%. Die 34 L. Pauling, Die Natur der chemischen Bindung, 3. Auflage, Verlag Chemie Weinheim, 1976 40 3. Zinkreiche Verbindungen ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ gleiche Tendenz bezüglich der Abstände ist auch beim rhomboedrischen Mo(Zn,Ga)6 zu beobachten. Alle anderen Unterschiede im Vergleich zu den idealen Abständen sind vernachlässigbar gering und liegen bei maximal 1%. Diese nur sehr geringen Verzerrungen bestätigen die Vorstellung, wonach die Strukturen dieser Verbindungen als Packung von ÜM(Zn,Ga)12-Polyeder aufgefasst werden können. Tabelle 3.8: Ortskoordinaten und Auslenkungsparameter des hexagonalen V(Zn,Ga)6 Atom V1 V2 ZN1 ZN2 ZN3 Atom V1 V2 ZN1 ZN2 ZN3 Wyck. 2a 2d 6g 6h 12k Symm. -3m. -6m2 .2/m. mm2 .m. x 0 0.33333 0.5 0.3451(3) 0.1661(1) y 0 0.66667 0 0.1725(2) 0.3322(2) z 0 0.75 0 0.75 0.6252(1) 4f 3m. 1/3 2/3 0.12520 U11 0.019(1) 0.019(1) 0.019(1) 0.018(1) 0.023(1) U22 0.019(1) 0.019(1) 0.019(1) 0.018(1) 0.017(1) U33 0.029(2) 0.030(2) 0.034(1) 0.032(1) 0.030(1) U12 0.0099(6) 0.0099(6) 0.0096(4) 0.0091(4) 0.0088(3) U13 0.00000 0.00000 -0.0025(3) 0.00000 0.0005(3) Ueq 0.0230(9) 0.0233(9) 0.0246(5) 0.0232(5) 0.0243(4) U23 0.00000 0.00000 -0.005(1) 0.00000 0.0011(5) Tabelle 3.9: Ausgewählte Abstände (in Å) des hexagonalen V(Zn,Ga)6 , Nb(Zn,Ga)6 und Ta(Zn,Ga)6 V(Zn,Ga)6 Nb(Zn,Ga)6 Ta(Zn,Ga)6 V1 Zn1 Zn3 2.707(1) 6x 2.725(2) 6x Nb1 Zn1 Zn3 2.752(1) 6x 2.765(1) 6x Ta1 Zn1 Zn3 2.750(1) 6x 2.765(1) 6x V2 Zn2 Zn3 2.708(1) 6x 2.723(2) 6x Nb2 Zn2 Zn3 2.753(2) 6x 2.758(1) 6x Ta2 Zn2 Zn3 2.751(2) 6x 2.757(1) 6x Zn1 V1 Zn1 Zn3 2.707(1) 2x 2.707(1) 4x 2.730(1) 4x Zn1 Nb1 Zn1 Zn3 2.753(2) 2x 2.752(2) 4x 2.772(1) 4x Zn1 Ta1 Zn1 Zn3 2.750(2) 2x 2.750(2) 4x 2.772(1) 4x Zn2 Zn2 V2 Zn3 Zn2 2.611(3) 2.708(1) 2.735(1) 2.803(1) 2x 2x 4x 2x Zn2 Zn2 Nb2 Zn3 Zn2 2.646(1) 2.753(2) 2.769(1) 2.859(1) 2x 2x 4x 2x Zn2 Zn2 Ta2 Zn3 Zn2 2.644(1) 2.751(2) 2.769(1) 2.857(1) 2x 2x 4x 2x Zn3 Zn3 Zn3 V2 V1 Zn1 Zn2 2.698(2) 2.716(2) 2.723(2) 2.725(2) 2.730(1) 2.735(1) 2x 2x 1x 1x 2x 2x Zn3 Zn3 Zn3 Nb2 Nb1 Zn2 Zn1 2.738(1) 2.767(1) 2.758(1) 2.765(1) 2.769(1) 2.772(1) 2x 2x 1x 1x 2x 2x Zn3 Zn3 Zn3 Ta2 Ta1 Zn2 Zn1 2.736(1) 2.765(2) 2.757(1) 2.765(1) 2.769(1) 2.772(1) 2x 2x 1x 1x 2x 2x 41 3.1 Der MoZn6-Typ ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ 3.1.3. Parallele zu den Elementstrukturen der Metalle Auch wenn die Kristallstrukturen des Typs MoZn6 bzw. ÜM(Zn,Ga)6 zunächst nur als mehr oder weniger komplexe Varianten von dichtesten Kugelpackungen erscheinen, so sind sie doch durch eine bemerkenswerte Gemeinsamkeit verbunden. Betrachtet man nur die Koordinationspolyeder der Übergangsmetallatome, lassen sich alle Strukturen auf Elementstrukturen der Metalle zurückführen, die in dichtesten Kugelpackungen kristallisieren. Dabei werden die Kristallstrukturen des Cu-, Mg-, La- und Sm-Typs in Form von Polyederpackungen nachgebildet. Trotz Vergrößerung der Elementarzellen bleibt in allen Fällen die Raumgruppe der entsprechenden Elementstruktur erhalten. Zudem besetzen in den Verbindungen des ÜM(Zn,Ga)6 die Übergangsmetalle kristallographisch die gleichen Positionen, wie die Metalle in den Elementstrukturen. Auf diese Weise werden Atom- und Polyederpackung direkt durch eine Skalierung um den Faktor zwei ineinander überführt. Tabelle 3.10: Einige Angaben zu Struktur und Zusammensetzung der bisher bekannten Verbindungen vom Typ ÜM(Zn,Ga)6 Verbindung Stapelfolge der Polyeder verwandte Elementstruktur (JagodzinskiSymbol) Raumgruppe Zusammensetzung nach EDX-Analyse MoZn6 Mo(Zn,Ga)6 V(Zn,Ga)6 Nb(Zn,Ga)6 Ta(Zn,Ga)6 MoZn6 ...ABC... Cu (c)3 Fm-3m VZn4,5Ga1,5 NbZn4,5Ga1,5 TaZn3,0Ga3,0 Mo(Zn,Ga)6 ...AB... Mg (h)2 P63/mmc MoZn4,5Ga1,5 Sm (hhc)3 R-3m MoZn4,5Ga1,5 La (hc)2 P63/mmc VZn4,0Ga2.0 NbZn3,0Ga3,0 TaZn3,5Ga2,5 Mo(Zn,Ga)6 ...ABA BCB CAC.... V(Zn,Ga)6 Nb(Zn,Ga)6 Ta(Zn,Ga)6 42 ...ABAC... 3. Zinkreiche Verbindungen ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Mg-Typ Cu-Typ Abb. 3.20: Gegenüberstellung von Polyederpackungen im ÜM(Zn,Ga)6 und Kugelpackungen der entsprechenden Elementstrukturen der Metalle. Die über gemeinsame Ecken ÜM(Zn,Ga)12-Polyeder verknüpften verhalten sich strukturchemisch wie die Atome einer dichtesten Kugelpackung. Kuboktaeder sind rot, „Antikuboktaeder“ sind blau dargestellt. La-Typ Sm-Typ 43 3.1 Der MoZn6-Typ ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Darüber hinaus zeigen die Kristallstrukturen Motive der Selbstähnlichkeit, die sich darin äußert, dass die ÜM(Zn,Ga)12-Polyeder ihrerseits von zwölf Polyedern umgeben sind, deren Symmetrie durch das zentrale Polyeder vorgegeben wird: es werden Kuboktaeder aus Kuboktaedern im kubischen MoZn6 und „Antikuboktaeder“ aus „Antikuboktaedern“ im hexagonalen Mo(Zn,Ga)6 gebildet. Selbst in den Kristallstrukturen der La- und SmStapelvarianten, in denen beide Sorten Polyeder gleichzeitig (in benachbarten Schichten) auftreten, bleibt diese Eigenschaft erhalten, d.h. Polyeder in der zweiten Koordinationssphäre repräsentieren immer die Symmetrie der ersten Koordinationssphäre. Dies ist auch völlig verständlich, da die Übergangsmetalle topologisch die Positionen einer dichtesten Packung besetzen, und diese Atome ihrerseits von zwölf Zinkatomen in Form der dichtesten Kugelpackung umgeben sind, entsteht bei einer Verknüpfung der Polyeder über gemeinsame Ecken automatisch diese Form von Selbstähnlichkeit. Das Prinzip an sich lässt sich durch relativ einfache geometrische Vorgaben realisieren, da die Polyeder problemlos mit der dichtesten Packung kompatibel sind, bzw. einen Teil dieser Packung darstellen. Abb. 3.21: Polyeder aus Polyedern in ÜM(Zn,Ga)6 . Die Symmetrie des zentralen Polyeders setzt sich in der zweiten Koordinationssphäre fort. 44 3. Zinkreiche Verbindungen ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ 3.1.4. Stapelregeln In der auffallenden Parallele der Strukturen des ÜM(Zn,Ga)6 zu den Elementstrukturen der Metalle, die in dichtesten Kugelpackungen kristallisieren, kommt in anschaulicher Weise das schon häufig formulierte Symmetrieprinzip zum Ausdruck, nach dem in kristallinen Festkörpern die Tendenz zu beobachten ist, Anordnungen mit möglichst hoher Symmetrie zu bilden [35] [36] . Am Beispiel der dichtesten Kugelpackung wird deutlich, dass die Mehrzahl der Metalle die kubisch- und die hexagonal-dichteste Kugelpackung als die einfachsten und hochsymmetrischsten Vertreter bevorzugen. Komplexere Stapelvarianten des La- und Sm-Typs sind dagegen eher selten. Für die Stapelvarianten des Typs ÜM(Zn,Ga)6 wären prinzipiell – wie bei den dichtesten Kugelpackungen – unendlich viele Varianten denkbar, da Polyeder- und Kugelpackung den gleichen geometrischen Vorgaben folgen. Mit wenigen Gesetzmäßigkeiten lassen sich die Bedingungen formulieren, nach denen dichteste Packungen aus Kuboktaedern und „Antikuboktaedern“ möglich sind. Die wichtigste Voraussetzung ist dabei die Verknüpfung der Polyeder über gemeinsame Spitzen, aus der sich dann folgende Regeln ableiten: 1. Das Ordnungsmuster der Minderkomponente muss innerhalb der dichtgepackten Schichten ein 36-Netz nach dem Typ des AuCu3 bilden. Damit besitzt die Anordnung der Minderkomponente die Geometrie der Atome einer dichtesten Kugelpackung. 2. Die Atome der Minderkomponente müssen in jeder zweiten Schicht fehlen. Damit erhält man alternierende Schichten der Zusammensetzung MoZn3 und Zn3. 3. Die Defektschichten Zn3 dürfen ausschließlich in kubischer Stapelfolge liegen. Auf diese Weise sind aufeinanderfolgende Übergangsmetallschichten niemals deckungsgleich gestapelt. 4. Es dürfen nie zwei aufeinanderfolgende Schichten in hexagonaler Stapelfolge auftreten. Aufeinanderfolgende Schichten in kubischer Stapelfolge sind dagegen erlaubt. Diese Forderung ergibt sich aus Punkt 2. und 3. 35 F. Laves, Phase Stability in Metals and Alloys, McGraw-Hill, New York, 1967 36 H. Bärnighausen, MATCH Communications in Mathematical Chemistry, 1980, 9, 139 45 3.1 Der MoZn6-Typ ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Als Folge dieser Bedingungen liegen Übergangsmetallatome in kubischer Stapelsequenz auch bezüglich der übernächsten Schicht in kubischer Stapelsequenz und Übergangsmetalle in hexagonaler Stapelfolge sind bezüglich der übernächsten Stapelfolge ebenfalls hexagonal angeordnet. Das Resultat dieser Regeln ist nicht nur eine dichteste Packungen aus Polyedern, sondern auch die schon oben erwähnte Selbstähnlichkeit der Anordnung der Polyeder um ein willkürlich betrachtetes Koordinationspolyeder, ungeachtet der Tatsache, ob Polyeder in benachbarten Schichten von gleicher Art sind oder nicht (Abb. 3.21). Formal stellen die Verbindungen ÜM(Zn,Ga)6 auch Überstrukturen von Polytypen des AuCu3 dar, in denen ja das Ordnungsmuster der Minderkomponente innerhalb der dichtgepackten Schichten bereits die geforderte Symmetrie aufweist. Von allen vier Stapelvarianten, die von den Metallen gebildet werden, sind entsprechende Ordnungsvarianten MX3 mit analoger Stapelsequenz bekannt. Für das kubische MoZn6 bzw. den Cu-Typ ist dies der AuCu3-Typ mit der Abfolge ...ABC..., und für das hexagonale Mo(Zn,Ga)6 bzw. den Mg-Typ die Struktur des SnNi3, dessen Abfolge ...AB... lautet. Der TiNi3-Typ mit der Stapelsequenz ...ABAC... sowie der BaPb3-Typ mit der rhomboedrischen Stapelsequenz ...ABA BCB CAC... entspricht den Strukturen des ÜM(Zn,Ga)6 mit der Stapelvariante des Lanthan und dem rhomboedrischen Mo(Zn,Ga)6 in der Stapelfolge des Samarium. Der Übergang von einer Stapelvariante des MX3 zum entsprechenden Typ des ÜM(Zn,Ga)6 erfolgt dann so, dass formal die Abstände der dichtgepackten Schichten in Stapelrichtung vergrößert bzw. aufgeweitet werden, und zwischen diese Schichten eine Schicht der Zusammensetzung X3 eingefügt wird, die bezüglich ihrer beiden Nachbarschichten in kubischer Stapelsequenz liegen muss. Mit diesen einfachen Regeln lassen sich eine Vielzahl von Stapelvarianten konstruieren und Kristallstrukturen solcher Polyederpackungen prinzipiell im Voraus berechnen, was bei der Suche nach möglichen weiteren Stapelvarianten äußerst nützlich ist. Im Folgenden sind die Zusammenhänge zwischen Kugelpackung, Polyederpackung und Ordnungsvarianten anhand sogenannter Stapeldiagramme graphisch zusammengefasst. 46 3. Zinkreiche Verbindungen ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Abb. 3.22: Zeichenerklärung für Stapeldiagramme der Strukturen ÜM(Zn,Ga)6 Koordinationspolyeder: Verknüpfung der Koordinationspolyeder: ÜM(Zn,Ga)3 = Kuboktaeder (Zn,Ga)3 = „Antikuboktaeder“ Stapelfolgen: Beispiel für die Elementstruktur des Samariums: ...ABABCBCAC... ABC-Notation . . . c h h c h h c h h . . . = (hhc)3 Jagodzinski-Notation Die Bezeichnung sich wiederholender Stapelfolgen – wie (hhc)3 – beginnt stets mit einer Schicht in hexagonaler Stapelfolge “h”, Schichten in kubischer Stapelfolge „c“ erfolgen erst danach. Tiefgestellte Indizes geben die Anzahl von Schichten oder Schichtpaketen an, die zu einer Identitätsperiode führen. Strukturtyp Stapeldiagramme: (h)2 Stapelfolge der Polyeder in Jagodzinski-Notation h BMo C AMo C BMo C AMo C h h h Mg-Typ (hc)2 Mo(Zn,Ga)6 - hex. P63/mmc a = 5.406 Å c = 8.932 Å h c h c h c h hP14 Stapelfolge der Schichten in Jagodzinski-Notation Translationsperiode Pearson-Symbol analoge Elementstruktur Raumgruppe; Gitterkonstanten 47 3.1 Der MoZn6-Typ ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Abb. 3.23: Stapeldiagramme der Strukturen des ÜM(Zn,Ga)6 48 3. Zinkreiche Verbindungen ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ 3.1.5. Untersuchungen zur Abhängigkeit des Strukturwechsels von der VEK Schon bei den ersten Vertretern des Typs MoZn6 bzw. ÜM(Zn,Ga)6 fielen einige Besonderheiten hinsichtlich der Art des Übergangsmetalls, des Ga-Gehalts in den Verbindungen und der Art der Stapelvarianten auf, die darauf hindeuteten, dass dieser Strukturtyp nicht durch geometrische, sondern offenbar hauptsächlich durch elektronische Faktoren gesteuert wird. Dafür spricht auch, dass nie eine Differenzierung zwischen Zink und Gallium bezüglich der kristallographischen Lagen beobachtet wurde, obwohl im Vergleich zum Zink dem Gallium allgemein ein größeres Atomvolumen zugeordnet wird. Als die ersten Vertreter dieser Strukturfamilie charakterisiert worden waren, konnte Folgendes beobachtet werden: • Das kubisch MoZn6 war nur als binäre Verbindung bekannt, die auch nie in galliumhaltigen Schmelzen gefunden wurde. Darüber hinaus wurde die binäre Verbindung nie mit hexagonaler oder rhomboedrischer Symmetrie beobachtet. • Das hexagonale Mo(Zn,Ga)6 entsteht erst bei der Zugabe von Gallium zur Metallschmelze, und enthält als teilsubstituierte, pseudobinäre Verbindung auch stets ein gewissen Anteil an Gallium. • Die rhomboedrische Stapelvariante des Mo(Zn,Ga)6 wurde bisher nur in Schmelzen mit Gallium und auch nur mit Molybdän als Übergangsmetall gefunden. • Auch die kubischen Verbindungen mit den Elementen der 5. Gruppe enthalten immer beträchtliche Mengen an Gallium. Des Weiteren existiert eine hexagonale Stapelvariante, die mit Molybdän nicht beobachtet wurde. • Mit den Elementen der 5. Gruppe wurde die Struktur des hexagonalen Mo(Zn,Ga)6 nicht beobachtet. Diese Beobachtungen sprechen deutlich für einen strukturbestimmenden Einfluss der Valenzelektronenkonzentration (VEK), der sich in einem fein abgestuften Wechselspiel zwischen der Art des Übergangsmetalls und des Anteils an Gallium in den Kristallstrukturen und den Stapelvarianten zeigt. Daraus ergibt sich eine gewisse Parallele zu den Elementstrukturen der Metalle, die sich nicht nur in der auffälligen Ähnlichkeit der Kristallstrukturen (Kugelpackung ↔ Polyederpackung) äußert, sondern offenbar auch der Strukturwechsel nach den ähnlichen Gesichtspunkten erfolgt, wie bei den Metallen. 49 3.1. Der MoZn6-Typ ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Als Begründung für die unterschiedlichen Elementstrukturen der Metalle (c.c.p., h.c.p. b.c.c., Stapelvarianten der Lanthanoide, Sonderstellung des Mangan) wird üblicherweise die Valenzelektronenkonzentration (VEK) herangezogen, die entsprechende Auswirkung auf die Bandstruktur hat. Die Stapelvarianten bei den Lanthanoiden lassen sich einigermaßen befriedigend mit der Zahl der 4f-Elektronen und ihren Einfluss auf die 5d- und 6s-Schale erklären, wobei offenbar die Elektronenkonfiguration die Art der Stapelvariante steuert. Mit steigender Zahl der 4f-Elektronen steigt auch der Anteil an Schichten in hexagonaler Stapelsequenz. Eine Erklärung liefert die Vorstellung, dass die steigende Kernladung sich stärker auf die 4f-Schale auswirkt, als auf die 5d- und 6s-Schale, womit sich deren Beiträge zur Bandstruktur ändern. Aufgrund der Lanthanoidenkontraktion nimmt der Einfluss der 4f-Elektronen trotz steigender Anzahl kontinuierlich ab, so dass weniger Elektronen im effektiven Bindungsfeld vorhanden sind. In diesem Sinne äußert sich auch das Verhalten der Lanthanoiden unter Druck; aufgrund der Kompression vornehmlich der s- und d-Orbitale gewinnen die inneren f-Elektronen an Einfluss und der Anteil der Schichten in kubischer Sequenz in den Strukturen steigt. Die späten Lanthanoiden, von Gadolinium bis Thulium sowie Lutetium, kristallisieren alle in hexagonal-dichtester Kugelpackung. Der Einfluss der Elektronenkonfiguration auf die Struktur zeigt sich auch bei den beiden Elementen Europium und Ytterbium, die mit ihrer „vorzeitig“ halb- bzw. ganz gefüllten f-Schale aus der Reihe der Lanthanoiden fallen (Europium: kubisch innenzentriert; Ytterbium: kubisch dichteste Kugelpackung). Diese beiden Elemente haben auch jeweils einen größeren Atomradius als ihre Nachbarmetalle im Periodensystem. Einen ähnlichen „Gang“ findet man bei den Übergangsmetallen der 3. bis 12. Gruppe des Periodensystems nicht. Allerdings lassen sich immerhin gewisse Tendenzen erkennen: bei den frühen Übergangsmetallen der 3. bis 8. Gruppe dominiert die hexagonal dichteste Kugelpackung, unterbrochen durch einen Block mit kubisch innenzentrierter Kugelpackung (5. und 6. Gruppe), wogegen die späten Übergangsmetalle die kubisch dichteste Kugelpackung bilden. Ausnahmen bilden die Elemente Mangan, Eisen und Kobalt, sowie die Elemente der 12. Gruppe Zink, Cadmium und Quecksilber. In Tabelle 3.11 sind die Elementstrukturen der Metalle bei Normalbedingungen dargestellt. 50 3. Zinkreiche Verbindungen ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Tab. 3.11: Kristallstrukturen der Metalle unter Normalbedingungen nach [37] Li i Na i K i Rb i Cs i Fr Be h Mg h Ca h Sr h Ba i Ra i Sc h Y h La hc Ac c Ti h Zr h Hf h Co h Rh c Ir c Ni c Pd c Pt c Cu c Ag c Au c Ce c Th c Pr hc Pa ⊗ Nd hc U ⊗ Pm Sm Eu Gd Tb Dy hc hhc i h h h Np Pu Am Cm Bk Cf hc hc c,hc ⊗ ⊗ Ho h Es V i Nb i Ta i Cr Mn i ⊗ Mo Tc i h W Re i h c kubisch dichteste Kugelpackung h hexagonal dichteste Kugelpackung Fe i Ru h Os h Zn h* Cd h* Hg c* Al c Ga ⊗ In c* Tl h Sn ⊗ Pb c Er Tm h h Fm Md Yb c No Lu h Lr hc, hhc Stapelvarianten dichtester Kugelpackungen i kubisch innenzentrierte Kugelpackung ⊗ eigener Strukturtyp * etwas verzerrt Ein weiteres klassisches Beispiel für den strukturbestimmenden Einfluss der Valenzelektronenkonzentration bei Metallen sind die Hume-Rothery-Phasen oder Messing-Phasen, bei denen sich ein Strukturwechsel von der kubisch-dichtesten Kugelpackung über die kubisch-innenzentrierte Kugelpackung und dem γ-Messing bis zur hexagonal-dichtesten Kugelpackung bei einer Zunahme der VEK von eins auf zwei vollzieht. Auch diese Verbindungen besitzen eine gewisse Phasenbreite bzgl. ihrer Zusammensetzung (Abb. 3.24). 37 U. Müller, Anorganische Strukturchemie, Teubner Verlag Stuttgart, 3. Auflage, 1996, S. 186 51 3.1. Der MoZn6-Typ ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ kubisch-innenzentrierte Kugelpackung Valenzelektronenkonzentration kubisch-dichteste Kugelpackung hexagonal-dichteste Kugelpackung kubisch (”kompliziert”) hexagonal-dichteste Kugelpackung (verzerrt) 2,0 1,8 1,6 α + β α 1,4 β + γ β γ γ + ε ε ε + η 80 90 η 1,2 1,0 0 10 20 30 40 Cu 50 CuZn 60 Cu5Zn8 70 CuZn3 100 Zn Stoffmengenanteil Zn (%) Abb. 3.24: Phasenfolge im System Kupfer-Zink in Abhängigkeit von der Valenz elektronenkonzentration bei Raumtemperatur. Nach [38]. Schließlich wirkt sich die Zahl der Valenzelektronen auch bei einer Reihe geordneter binärer und pseudobinärer Phasen der Zusammensetzung MX3, die Ordnungsvarianten der dichtesten Kugelpackung bilden, auf die Art der Stapelvariante und die Ordnung der Metallatome innerhalb der dicht-gepackten Schichten aus. Beispiele dafür sind Systeme wie V(Fe,Co)3, V(Co,Ni)3, (Ti,Ta)Ni3 oder Ta(Ru,Pd)3, bei denen mit steigender Anzahl der Valenzelektronen eine Variation an Schichten in kubischer Stapelsequenz beobachtet wird [39] . Durch Hinzulegieren des elektronenreicheren Metalls werden verschiedene Polytypen des AuCu3-Typs mit jeweils abnehmender Anzahl von Schichten in kubischer Stapelsequenz beobachtet, was schließlich zur Bildung des SnNi3-Typs führt, dessen Schichtfolge ausschließlich hexagonal ist. Bei einem weiteren Anstieg der Elektronenzahl wechselt die Ordnung der Komponente M vom 36-Netz (T-Netz) in ein 44-Netz (R-Netz) 38 Riedel, Anorganische Chemie, 5. Auflage, de Gruyter, Berlin-NewYork, 2002 39 W. B. Pearson, The Crystal Chemistry and Physics of Metals and Alloys, Wiley, New York, 1972, S. 87 52 3. Zinkreiche Verbindungen ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ und es erfolgt wieder eine Zunahme an Schichten in kubischer Stapelfolge, bis die Struktur des TiAl3 erreicht wird. In Abb. 3.25 ist dieser Verlauf mit der Angabe einiger Strukturtypen schematisch dargestellt. Zunahme der VEK: Struktur: AuCu3 TiNi3 SnNi3 TiCu3 TiAl3 Anteil kubischer Sequenzen: 100 % 50 % 0% 0% 100 % Muster: 36-Netz von M 44-Netz von M Abb.3.25: Schematischer Verlauf des Strukturwechsels in Abhängigkeit der VEK bei einigen binären und pseudobinären Phasen der Zusammensetzung MX3. Momentan sieht es so aus, dass auch in den Verbindungen des ÜM(Zn,Ga)6 qualitativ mit steigendem Galliumgehalt die hexagonalen Stapelsequenzen steigen. Dass nun auch das kubische Mo(Zn,Ga)6 als pseudobinäre Verbindung existiert, mag auf den ersten Blick überraschen und den oben aufgeführten Beobachtungen widersprechen, zeigt aber, dass die Verbindungen eine gewisse Phasenbreite bezüglich Zusammensetzung und „Elektronenakzeptanz“ aufweisen. Im Einklang damit steht auch die Tatsache, dass das kubische Mo(Zn,Ga)6 einen nur sehr geringen Anteil an Gallium enthält, und auch nur in sehr galliumarmen Schmelzen entsteht. 53 3.1. Der MoZn6-Typ ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Die Überprüfung eines möglichen Zusammenhangs zwischen Galliumgehalt und Strukturwechsel machten zahlreiche Versuche – besonders im galliumarmen Bereich des Systems Mo-Ga-Zn – notwendig, da hier die entsprechenden Strukturen beobachtet wurden. Eine Beschränkung auf das Molybdän als Übergangsmetall erscheint schon deshalb sinnvoll, da in diesem System bereits vier Verbindungen in drei verschiedenen Stapelvarianten existieren. Darüber hinaus sind mit Molybdän kaum binäre Verbindungen als Nebenprodukte zu erwarten, da mit diesem Übergangsmetall – außer den hier vorgestellten Strukturen – bisher überhaupt erst fünf Verbindungen mit Zink und/oder Gallium bekannt sind, namentlich: Mo3Ga (Cr3Si-Typ)[40], Mo6Ga31 (eigener Strukturtyp)[41], Mo8Ga41 (V8Ga41-Typ)[42], MoZn22 (eigener Strukturtyp)[43] als binäre, und Mo7Ga26Zn26 (isotyp zu Mo7Sn12Zn40)[7] als ternäre Phase. Mit den Metallen Vanadium, Niob und Tantal dagegen sind zahlreiche binäre Gallium- und Zinkverbindungen unterschiedlichster Zusammensetzung bekannt, von denen einige sehr leicht zugänglich und stabil sind, und damit eine einigermaßen systematische Analyse erschweren. Bei den Untersuchungen im System Mo-Ga-Zn sollten folgende Punkte geklärt werden: • Gibt es einen erkennbaren Zusammenhang zwischen der Zusammensetzung der Metallschmelze und einem Strukturwechsel? • Welches Zink-Gallium-Verhältnis liegt in der jeweiligen Kristallstruktur vor? • Wie groß sind die Phasenbreiten? Treten Strukturwechsel sprunghaft oder allmählich auf? • Wie groß ist der Existenzbereich des rhomboedrischen Mo(Zn,Ga)6? Bisher ist die Kristallstruktur nur anhand weniger Einkristalle charakterisiert worden. • Lässt sich bei geeignetem Zn-Ga-Verhältnis die hexagonale Stapelvariante des LaTyps auch mit Molybdän realisieren? • Wie lassen sich die galliumreicheren Verbindungen Mo7Ga26Zn26 und Mo8Ga41 in diese Reihe einordnen. 40 B.T. Matthias, E.A. Wood, E. Corenzwit, V.B. Bala, J. Phys. Chem. Solids, 1956, I, 188 41 K. Yvon, Acta Cryst. 1974, B30, 853-861 42 K. Yvon, Acta Cryst. 1975, B31, 117-120 43 C.J. Toussaint, H. Venker, Acta Cryst. 1968, B24, 743 7 H. Hillebrecht, V, Kuntze, K, Gebhardt, Z. Krist. 1997, 212, 840-847 54 3. Zinkreiche Verbindungen ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Um diese Fragen zu beantworten, wurden über 60 Ansätze mit unterschiedlichem Mo-GaZn-Gehalt zur Reaktion gebracht. Das molare Verhältnis Mo : Zn lag, bis auf wenige Ausnahmen, immer bei 1 : 20, lediglich die Menge an Gallium wurde variiert. Dabei reichten die Zusammensetzungen der Ansätze von extrem galliumarm (Mo:Ga:Zn 1 : 0.01 : 20) bis hin zu galliumreich (Mo:Ga:Zn 1 : 10 : 20). Auch einige sehr galliumreiche Ansätze der Zusammensetzung Mo:Ga:Zn 1 : 10 : 10 bis 1 : 20 : 10 wurden untersucht. Einige Ansätze in dem Bereich, bei dem das rhomboedrische Mo(Zn,Ga)6 auftritt, wurden wiederholt, um die Ergebnisse auf eine Reproduzierbarkeit zu überprüfen. Der Vollständigkeit halber wurden auch binäre Ansätze Mo:Zn im molaren Verhältnis 1 : 20 und 1 : 40 umgesetzt. Die Synthesen erfolgten aus den Elementen in evakuierten Quarzglasampullen. Die Reaktionstemperatur betrug in allen Fällen 850°C bei einer Dauer von etwa drei Tagen und einer Abkühlrate von 5°/h auf 500°C. Die weitere Abkühlrate auf Raumtemperatur betrug danach 18°/h. Das überschüssige Zink wurde mit sehr verdünnter wässriger Salzsäure entfernt und der Rückstand röntgenographisch charakterisiert. Neben der Aufnahme von Pulverdiagrammen von allen Proben wurden auch zahlreiche Einkristalle vermessen. Die dabei gewonnenen Ergebnisse bestätigen die aufgestellten Vermutungen und zeigen, dass die erwarteten Strukturwechsel vom Verhältnis der Metalle in der Schmelze abhängt. Im binären System Mo-Zn wurde in Übereinstimmung mit den Arbeiten von W. Jeitschko et al. keine Bildung von MoZn6 bis zu einem Mo:Zn-Verhältnis von 1 : 40 beobachtet[44]. Das Pulverdiagramm zeigt dabei lediglich die Reflexe von nicht umgesetztem Molybdän. Doch schon bei geringsten Mengen an Gallium erfolgt eine Reaktion zwischen den Metallen, wobei – bei einem Ga-Gehalt von 0.01 bis 0.1 - zunächst Mo3Ga gebildet wird und die Reflexe des Molybdäns in den Pulverdiagrammen rasch verschwinden. Mit zunehmendem Ga-Anteil in der Schmelze bildet sich dann vermehrt das kubische Mo(Zn,Ga)6, das sich in Ansätzen Mo-Ga-Zn im Verhältnis 1 : 0.8 : 20 bis 1 : 1 : 20 nahezu phasenrein darstellen lässt, wobei das Mo3Ga in diesen Ansätzen nur noch in Spuren vorhanden ist. Anhand dieses Ganges wird auch deutlich, wie das Molybdän in die Schmelze eingebracht wird: offenbar bildet das Gallium, welches im Mo3Ga verzerrt ikosaedrisch von zwölf Mo-Atomen umgeben ist, „Nukleationszentren“ für das Über44 T. Nasch, W. Jeitschko, J. Solid State Chem. 1999, 143, 95-103 55 3.1. Der MoZn6-Typ ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ gangsmetall. Auf diese Weise „löst“ sich das Molybdän bei entsprechender Menge an Gallium zunehmend in der Zinkschmelze. Diese Vorstellung bestätigt einmal mehr die Vorteile multinärer Metallschmelzen und ihr präparatives Potential zur Synthese von Verbindungen aus Metallen mit sehr unterschiedlichen Schmelzpunkten und zeigt die Funktion des Hilfsmetalls Gallium und seiner „lösungsvermittelnden“ Eigenschaften in seiner schönsten Art. Interessanterweise beginnt die Bildung des kubischen Mo(Zn,Ga)6 ab einem Mo-GaVerhältnis von etwa 3 : 1 – der Stöchiometrie des Mo3Ga – und steigt dann rasch an, während der Anteil an Mo3Ga in entsprechender Weise zurückgeht. Möglicherweise ist das „Überangebot“ an Gallium daran beteiligt, und das System weicht beim Kristallisationsprozess in die geeignete Richtung aus, was dann aufgrund elektronischer Effekte eben die Ordnungs- und Defektvariante der dichtesten Kugelpackung ist. Immerhin bilden Zink und Gallium selbst keine Verbindungen miteinander, so dass die Beteiligung des Galliums an der Bildung des Mo(Zn,Ga)6 auf alle Fälle attraktiver ist. Ab einem Ga-Gehalt von Mo-Ga-Zn im Verhältnis 1 : 1.2 : 20 beginnt dann die Bildung des hexagonalen Mo(Zn,Ga)6 mit rascher Abnahme der kubischen Verbindung. Das hexagonale Mo(Zn,Ga)6 weist bzgl. des Ga-Gehalts der Schmelze einen recht großen Existenzbereich auf. Die phasenreine Darstellung gelingt in Schmelzen mit einem Metallanteil von Mo-Ga-Zn 1 : 1.4 : 20 bis 1 : 3 : 20. Selbst in einem Ansatz 1 : 4 : 20 sind noch nennenswerte Mengen der Verbindung nachweisbar. Etwa in der Mitte dieses Bereichs, bei einem Ga-Anteil von 1.8 bis 2.0 existiert eine „Lücke“ für das hexagonale Mo(Zn,Ga)6, in der die rhomboedrische Stapelvariante stabil ist und auch nahezu phasenrein entsteht. Der Strukturwechsel erfolgt an diesen Stellen sehr rasch, und bei wiederholten Versuchen mit Metallschmelzen der Zusammensetzung Mo-Ga-Zn im molaren Verhältnis zwischen 1 : 1.8 : 20 und 1 : 2 : 20 bildete sich einmal die hexagonale und ein anderes Mal die rhomboedrische Stapelvariante. In allen Fällen waren auch geringe Mengen an ZnGa2O4 (Spinell) im Pulverdiagramm zu erkennen. Dieses aus der Reaktion mit der Quarzampulle entstandene Oxid spielt möglicherweise bei der Entstehung der hexagonalen oder rhomboedrischen Struktur eine gewisse Rolle, wenn man annimmt, dass der Spinell zuerst auskristallisiert, und damit der Schmelze einen Teil des Galliums entzieht, die dadurch an diesem Metall geringfügig verarmt und den Strukturwechsel in die entsprechende Richtung lenkt. Auf jeden Fall konnte die frühere Annahme bestätigt 56 3. Zinkreiche Verbindungen ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ werden, dass die Existenz des rhomboedrischen Mo(Zn,Ga)6 auf einen äußerst kleinen Bereich beschränkt ist, wobei die Bildung der Struktur offenbar sehr sensibel auf äußere Einflüsse reagiert. Ab einem Ga-Gehalt in der Schmelze von Mo-Ga-Zn 1 : 3 : 20 erfolgt ein weiterer Strukturwechsel vom hexagonalen Mo(Zn,Ga)6 zum kubischen Mo7Ga26Zn26, welches isotyp zum Mo7Sn12Zn40 (Fm-3c, a = 25.45Å) ist. Diese Verbindung bildet nun nicht mehr eine Variante der dichtesten Kugelpackung, sondern eine komplexe Struktur aus mehrschaligen Polyedern mit ikosaedrischer Symmetrie. Ab einem gewissen Anteil an Gallium werden neben elektronischen hier zunehmend auch geometrische Faktoren strukturbestimmend. Dieser Strukturtyp wird offenbar primär durch elektronische Einflüsse ermöglicht, und dann durch geometrische Faktoren „gestaltet“. Diese Vorstellung wird dadurch bestätigt, dass der Mo7Sn12Zn40-Typ bevorzugt dann gebildet wird, wenn neben der Kombination Übergangsmetall-Zink ein großes Hauptgruppenmetall als weitere Komponente in der Verbindung vorhanden ist. In den mehrschaligen Polyedern mit ikosaedrischer Symmetrie befinden sich die Hauptgruppenelemente in der äußeren Schale, und können eben durch ihre Größe die zwangsläufig auftretende Frustration in ikosaedrischen Packungen einigermaßen ausgleichen. Im Mo7Ga26Zn26 zeigt sich die Flexibilität des Galliums in der Weise, dass es nicht nur das Zinn, sondern auch einen beträchtlichen Anteil an Zink ersetzen kann, zwei Metalle mit deutlich unterschiedlichem Atomvolumen, ohne dass sich die Struktur des Mo7Sn12Zn40-Typs ändert. Das Mo7Ga26Zn26 lässt sich aus Schmelzen der Zusammensetzung Mo-Ga-Zn von 1 : 5 : 20 bis 1 : 7 : 20 annähernd phasenrein darstellen; mit weiter ansteigendem GaGehalt entsteht zunehmend das Mo8Ga41, wobei der Anteil an Mo7Ga26Zn26 langsam abnimmt und ab einem Verhältnis Mo-Ga-Zn 1 : 15 : 20 im Pulverdiagramm nicht mehr zu beobachten ist. Dementsprechend zeigen auch die Pulverdiagramme galliumreicher Ansätze, etwa Mo-Ga-Zn im molaren Verhältnis 1 : 20 : 10, nur noch Reflexe des Mo8Ga41. Zusammenfassend kann man feststellen, dass bei den Strukturwechseln der Stapelvarianten des Mo(Zn,Ga)6 ähnliche Verhältnisse vorherrschen, wie bei den Elementstrukturen der Metalle oder den Hume-Rothery-Phasen. Dabei sind wohl hauptsächlich elektronische Faktoren für diesen Strukturwechsel verantwortlich. Der strukturbestimmende Einfluss des Galliums zeigt sich nicht nur in der Metallschmelze, sondern auch in der Kristallstruktur. 57 3.1. Der MoZn6-Typ ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Umfangreiche EDX-Analysen haben den geringeren Ga-Gehalt in der kubischen Verbindung im Vergleich zur hexagonalen Verbindung bestätigt. Darüber hinaus ist bis jetzt die hexagonale Variante des La-Typs, die mit den Übergangsmetallen der 5. Gruppe entsteht, in Mo-haltigen Schmelzen nicht beobachtet worden. Darin zeigt sich auch, dass die Art des Übergangsmetalls eine gewisse Rolle bei der Bildung der Struktur bildet. In der folgenden Abbildung sind die Ergebnisse der Untersuchungen im System Mo-Ga-Zn graphisch dargestellt. Auf der Abszisse ist der molare Anteil an Gallium bzgl. der Zusammensetzung Mo-Ga-Zn 1 : x : 20 dargestellt ( x = 0 bis 20); zu beachten ist, dass ab einem Verhältnis Mo-Ga-Zn 1 : 5 : 20 die Skala gestaucht dargestellt ist). Ein geeignetes Maß für die Ordinate zu finden, ist etwas schwieriger; wenn man aber annimmt, dass die Verbindungen des Typs Mo(Zn,Ga)6 alle eine ähnliche Streukraft besitzen, lässt sich auf Grund der Intensitäten in den Pulverdiagrammen der quantitative Anteil der entsprechenden Kristallstruktur abschätzen. Aufgrund dieser Vorstellung wurde dieses halbquantitative Diagramm erstellt. Abb. 3.26: Darstellung der Existenzbereiche der Kristallstrukturen im System Mo-Ga-Zn von der Abhängigkeit des Ga-Anteils in der Mo-Ga-Zn-Schmelze. 58 3. Zinkreiche Verbindungen ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ 3.1.6. Untersuchungen zum Zusammenhang zwischen Galliumgehalt und Gitterparameter im hexagonalen Mo(Zn,Ga)6 Bei Legierungen und intermetallischen Verbindungen mit einer gewissen Phasenbreite wird im allgemeinen eine charakteristische Änderung der Gitterparameter in Abhängigkeit von der Zusammensetzung und damit der VEK beobachtet. Bei den zinkreichen η-Phasen der messingartigen Systeme Cu-Zn, Ag-Zn, Au-Zn ebenso wie in den zinkreichen Randphasen der Systeme Al-Zn und Ga-Zn beispielsweise erfolgt bei einer Zunahme der VEK von 1.94 auf 2.02 auch eine Vergrößerung des c/a-Verhältnisses von etwa 1.75 auf 1.85 als Resultat der Zunahme der c-Gitterkonstanten bei gleichzeitiger Abnahme der aGitterkonstanten [24] [45]. Ähnliche Verhältnisse sind in den Systemen der Übergangsmetalle Titan, Zirkonium und Hafnium mit Metallen der 8. bis 10. Gruppe des Periodensystems wie Palladium, Kupfer, Silber, Gold, Zink und Cadmium gefunden worden[46], die alle im Zr2Cu-Typ kristallisieren [47] . Ursache für dieses Verhalten sind primär nicht unter- schiedliche Atomvolumina der Metalle, sondern nach der Theorie von Jones eine zunehmende Überlappung der Brillouin-Zonen in der hexagonal-dichtesten Kugelpackung durch eine Zunahme der Valenzelektronen, die zu einer Verzerrung der Kristallstruktur führt. Mit diesem Model, können auch die großen c/a-Verhältnisse von Zink und Cadmium (1.856 bzw. 1.886) gegenüber den nahezu idealen c/a-Verhältnissen in den Strukturen von Magnesium (1.624) oder Beryllium (1.568) erklärt werden. Da das hexagonale Mo(Zn,Ga)6 eine gewisse Phasenbreite besitzt, war es interessant zu untersuchen, ob mit steigendem Ga-Gehalt in der Schmelze auch eine Änderung der Zusammensetzung zu beobachten ist, und wie sich diese Änderung auf die Gitterparameter auswirkt. Dazu wurden zahlreiche Einkristalle des hexagonalen Mo(Zn,Ga)6 anhand von EDX-Analysen untersucht und Pulverdiagramme indiziert, in denen die Verbindung nahezu phasenrein auftritt. 24 D.A. Davies, E. A. Owen, Brit. J. Appl. Phys. 1964, 15, 1309-1314 45 K. Lohberg, Z. Metallkde. 1940, 32, 38 46 W. Roßteutscher, K. Schubert, Z. Metallkde, 1965, 56, 730-734 47 K. Schubert, Kristallstrukturen zweikomponentiger Phasen, Springer-Verlag, Berlin, 1964 59 3.1. Der MoZn6-Typ ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Für EDX-Analysen wurden Einkristalle des hexagonalen Mo(Zn,Ga)6 in Kunstharz gegossen und angeschliffen, um Fehler bei der Messung durch Effekte wie Oberflächenveredelungen oder schräg liegende Flächen zu beseitigen. Um die Proben elektrisch leitend zu machen, wurde dem Kunstharz Kupferpulver beigemischt (Abb.3.27, links). Kristall Kunstharz Kupferpartikel 0.5 mm Abb. 3.27: Schliffbilder von in Kunstharz eingegossenen Einkristallen. Das weiße Quadrat in der rechten Abbildung zeigt die Fläche eines Messbereichs (10 x 10 µm) im Vergleich zur Größe des Kristalls, der bei Bedarf auch verkleinert werden kann. Bei einem Blick in das „Innere“ eines Einkristalls ergeben sich bisweilen etwas überraschende Befunde. Einige der von außen scheinbar tadellos wirkenden Polyeder sind dabei alles andere als perfekt und weisen Hohlräume sowie Fremdeinschlüsse auf. a b Abb. 3.28: a: Hohlräume im Inneren eines Kristalls, erkennbar an hellen und dunklen Schatten b: Fremdphasen im Inneren eines Kristalls, erkennbar an unterschiedlichen Graustufen 60 3. Zinkreiche Verbindungen ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Aus den Proben, in denen das hexagonale Mo(Zn,Ga)6 auch in Form von Einkristallen vorlag – einige Proben enthielten nur Pulver – wurden jeweils mehrere Kristalle ausgewählt, und jeder Kristall wurde an mehreren Stellen analysiert. Zur Kalibrierung für die Quantifizierung des Zn-Ga-Gehaltes diente ein ZnGa2O4 Einkristall. Außer den drei Metallen Molybdän, Zink und Gallium konnten keine weiteren Elemente nachgewiesen werden. Tabelle 2. und Abb. 6 fassen die Ergebnisse zusammen. Tab. 3.12: Zusammensetzung der Einkristalle des hexagonalen Mo(Zn,Ga)6 in Abhängigkeit von der Zusammensetzung der Metallschmelze. molare Zusammensetzung der Schmelze Stöchiometrie nach EDX-Analyse Mo Ga Zn Mo Ga Zn 1 1,0 20 1,17(1) 1,06(1) 4,94(1) 1 1,4 20 1,17(2) 1,12(1) 4,88(1) 1 1,8 20 1,17(2) 1,16(2) 4,84(2) 1 2,0 20 1,12(2) 1,61(2) 4,39(1) 1 2,4 20 1,18(1) 1,37(2) 4,63(2) 1 2,6 20 1,21(3) 1,40(2) 4,60(3) 1 3,0 20 1,21(1) 1,50(1) 4,50(1) Insgesamt sind die Ergebnisse erfreulich eindeutig und zufriedenstellend. Innerhalb der Kristalle aus Ansätzen einer bestimmten Zusammensetzung wurden keine nennenswerten Streuungen festgestellt. Die Werte für Molybdän sind zwar etwas zu groß, liegen aber alle im gleichen Bereich und sind nahezu konstant. Die Erfahrung zeigte, dass die Werte sehr schwerer Elemente in Vergleich zu leichten Elementen stets etwas höher liegen, als die aus den röntgenographischen Daten ermittelten Zahlen, und wurde auch auf verschiedenen Geräten beobachtet. Mögliche Verbesserungen der Werte könnten durch eine Kalibrierung mit geeigneten Eichkristallen, wie etwa Mo3Ga erzielt werden. 61 3.1. Der MoZn6-Typ ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Abb. 3.29: Änderung des Ga- und Zn-Gehaltes des hexagonalen Mo(Zn,Ga)6 in Ab hängigkeit von der Zusammensetzung der Metallschmelze. Wie Abb. 3.29 zeigt, erfolgt mit zunehmendem Ga-Gehalt in der Metallschmelze auch ein nahezu linearer Anstieg des Ga-Gehaltes in den Kristallen des Mo(Zn,Ga)6. Dabei ändert sich die Zusammensetzung von etwa MoGaZn5 auf MoGa1,5 Zn4,5 in den Schmelzen mit Metallgehalten von Mo:Ga:Zn zwischen 1 : 1 : 20 und 1 : 3 : 20. Eine signifikante Abweichung ist bei der Zusammensetzung Mo : Ga : Zn von 1 : 2 : 20 zu beobachten. Dort liegt, wie aus Abb. 3.26, Seite 58 hervorgeht, der sehr schmale Stabilitätsbereich des rhomboedrischen Mo(Zn,Ga)6. Wie schon erläutert, wurden Ansätze in diesem Bereich der Zusammensetzung mehrfach wiederholt, um die Entstehung der beiden Verbindungen auf Reproduzierbarkeit zu überprüfen und es entstand dabei einmal die hexagonale, das andere Mal die rhomboedrische Verbindung. In den Fällen, bei denen das hexagonale Mo(Zn,Ga)6 entsteht, ist auch eine drastische Änderung der Zusammensetzung der Kristalle zu verzeichnen, die wie eine Unstetigkeitsstelle im Kurvenverlauf wirkt. Das rhomboedrische Mo(Zn,Ga)6 enthält ebenfalls einen vergleichsweise hohen Ga-Anteil von etwa 23 Atom-%, was einer Summenformel von MoGa1,6Zn4,4 entspricht. Mit einer Änderung der Zusammensetzung ändert sich auch die Valenzelektronenkonzentration in der Verbindung. Berechnet man die VEK nach der Beziehung. VEK = (Anzahl der Valenzelektronen) / (Anzahl der Atome) ergeben sich zwei Möglichkeiten der graphischen Darstellung; entweder in Abhängigkeit der Zusammensetzung der Metallschmelze oder in Anhängigkeit der Zusammensetzung 62 3. Zinkreiche Verbindungen ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ der Einkristalle. Bei der Berechnung der VEK erhält hier Molybdän keine, Zink zwei und Gallium drei Valenzelektronen [34] . Die Festlegung der Zahl der Valenzelektronen für Übergangsmetalle ist dabei unproblematisch, solange nur ein System, wie Mo-Ga-Zn, für sich alleine betrachtet wird. Die Tatsache, dass die kubischen Verbindungen ÜM(Zn,Ga)6 mit V, Nb und Ta einen deutlich höheren Ga-Gehalt aufweisen als das kubische Mo(Zn,Ga)6 zeigt, dass auch der unterschiedlichen Valenzelektronenzahl der Übergangsmetalle eine grundsätzliche Bedeutung zukommt. Die allgemein vorgenommene Festlegung, dass Elemente mit nicht abgeschlossener d-Schale in der Regel Null Valenzelektronen erhalten, ist demnach nur als grobe Näherung zu betrachten. L. Pauling beispielsweise unterteilt die Elemente in drei Klassen, in elektronenunterschüssige Atome (Elemente mit Elektronenmangel), eletronenüberschüssige Atome und sogenannte „Pufferatome“, deren metallische Wertigkeiten je nach ihrer Stellung im Periodensystem durch „Aufnahme“ bzw. „Abgabe“ von Elektronen an einen Partner erhöht oder – bei Pufferatomen – konstant bleibt. Diese grobe Einteilung ist in dem Sinne nachvollziebar, dass elektronenunterschüssige Elemente im wesentlichen diejenigen Metalle sind, bei denen ausschließlich bindende Zustände besetzt werden, was sich auch am Gang der Schmelzpunkte dieser Elemente innerhalb einer Periode bemerkbar macht. Die aus Tabelle 3.13 entnommenen metallischen Wertigkeiten geben an, wieviel Elektronen ein Metall zur VEK beiträgt. Die daraus abgeleiteten einfachen „Elektronenabzählregeln“ haben sich für die binären messingartigen Systeme bzw. die klassischen Hume-RotheryPhasen der späten Übergangsmetalle als sehr gut geeignet erwiesen. Tab. 3.13: Einteilung der Atome entsprechend der Änderung ihrer metallischen Wertigkeit bei Änderung der Elektronenzahl nach [34]. elektronenunterschüssige Atome Li Atome mit konstanter Wertigkeit Be B C Na Mg Al Si elektronenüberschüssige Atome Pufferatome K Ca Sc Ti V Cr Mn Fe Co Ni Cu Zn Ga Ge As Se Br Rb Sr Y Zr Nb Mo Tc Ru Rh Pd Ag Cd In Sn Sb Te I Cs Ba La Ce Lu Hf Ta W Re Os Ir Pt Au Hg Tl Pb Bi Po At 0 0 0 0 0 1 2 3 4 34 L. Pauling, Die Natur der chemischen Bindung, 3. Auflage, Verlag Chemie, Weinheim, 1968 63 3.1. Der MoZn6-Typ ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Die Tatsache, dass gerade die frühen Übergangsmetalle wie beispielsweise Molybdän, Wolfram, Rhenium, Mangan, aber auch Titan und Zirkonium als Minderkomponente in Verbindungen mit „elektronenreichen“ Metallen wie Aluminium, Zink, Gallium und Zinn bevorzugt komplexe Strukturen mit sehr differenzierten Baumotiven bilden, liefert möglicherweise einen Hinweis darauf, dass neben geometrischen Faktoren nicht nur elektronische Faktoren allgemein, sondern insbesondere Beiträge der Valenzelektronen der Übergangsmetalle eine entscheidende Rolle bei der Ausbildung dieser Strukturen spielen. Da der Beitrag des Molybdäns bezüglich der Anzahl der Valenzelektronen in den Verbindungen Mo(Zn,Ga)6 als konstant zu betrachten ist, bleibt dieses Metall bei der Berechnung der VEK unberücksichtigt und erhält den Wert Null. Die Anzahl der Atome ist sieben, da die Summenformel in allen Verbindungen gleich ist. Unter Berücksichtigung der stöchiometrischen Faktoren ergeben sich mit der Gleichung die in Tabelle 3.13 angegebenen Werte. VEK Tab. 3.14: 64 = [x ⋅ 3] + [(6 − x ) ⋅ 2] 7 aus der Summenformel MoGaxZn6-x Valenzelektronenkonzentration in den Verbindungen Mo(Zn,Ga)6 Ga-Anteil in der Schmelze Ga-Anteil im Kristall VEK 0,0 0,0 1,714 0,8 0,6 1,800 1,0 1,06 1,866 1,4 1,12 1,874 1,8 1,16 1,880 2,0 1,61 1,944 2,4 1,37 1,910 2,6 1,40 1,914 3,0 1,50 1,929 Struktur kubisch hexagonal rhomboedrisch hexagonal 3. Zinkreiche Verbindungen ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Trägt man den Verlauf der VEK gegen die Zusammensetzung in der Schmelze auf, ergibt sich die Kurve in Abb. 3.30 links, die zwar tendenziell ansteigt, aber an besagter Stelle vom idealen Verlauf abweicht und den Phasenverlauf aus Abb. 3.26, Seite 58 wiedergibt. Das rhomboedrische Mo(Zn,Ga)6 ist in dieser Reihe die Verbindung mit der höchsten Valenzelektronenkonzentration. Der Strukturwechsel vom kubischen zum hexagonalen Mo(Zn,Ga)6 erfolgt ebenfalls durch einen sprunghaften Anstieg des Ga-Gehalts in der Kristallstruktur, und damit der VEK im Vergleich zur Zunahme des Ga-Anteils in der Schmelze. 2,00 2,00 1,95 1,95 1,90 1,85 VEK VEK 1,90 1,80 1,85 1,80 1,75 1,75 1,70 0,0 1,0 2,0 3,0 m olarer Anteil Gallium bezogen auf Mo : Ga : Zn 1 : X : 20 Abb. 3.30: kubisch 1,70 0,00 0,50 hex. 1,00 rhomb. 1,50 Ga-Gehalt im Kristall Verlauf der VEK und Strukturwechsel im Mo(Zn,Ga)6 Die Auswertung von Pulverdiagrammen des hexagonalen Mo(Zn,Ga)6 zeigt im Stabilitätsbereich des rhomboedrischen Mo(Zn,Ga)6 ebenfalls Abweichungen bezüglich der Gitterparameter. In Abb. 3.31 sind die Änderungen in Abhängigkeit des Ga-Gehaltes in der Metallschmelze dargestellt. Mit zunehmendem Ga-Gehalt in der Schmelze und auch in den Kristallen ist eine Abnahme der a-Achse bei gleichzeitiger Zunahme der c-Achse zu beobachten. Die sprunghaften Änderungen bei einem molaren Ga-Gehalt von 1.8 bis 2.0 zeigen, dass die Struktur des hexagonalen Mo(Zn,Ga)6 in diesem Bereich offenbar nicht besonders stabil ist, was sich durch starke Änderungen der Gitterparameter bemerkbar macht. 65 3.1. Der MoZn6-Typ ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ c-Achse 5,415 9,00 5,410 8,99 Gitterkonstante [Å] Gitterkonstante [Å] a-Achse 5,405 5,400 5,395 5,390 5,385 8,98 8,97 8,96 8,95 8,94 0,8 1,0 1,2 1,4 1,6 1,8 2,0 2,2 2,4 2,6 2,8 3,0 3,2 3,4 0,8 1,0 1,2 1,4 1,6 1,8 2,0 2,2 2,4 2,6 2,8 3,0 3,2 3,4 molarer Anteil Ga bezogen auf Mo : Ga : Zn 1 : X : 20 molarer Anteil Ga bezogen auf Mo : Ga : Zn 1 : X : 20 Zellvolum en 1,668 227,2 1,666 227,0 1,664 Zellvolumen [Å 3] c/a-Verhältnis c/a-Verhältnis 1,662 1,660 1,658 1,656 1,654 226,8 226,6 226,4 226,2 226,0 225,8 225,6 1,652 225,4 0,8 1,0 1,2 1,4 1,6 1,8 2,0 2,2 2,4 2,6 2,8 3,0 3,2 3,4 molarer Anteil Ga bezogen auf Mo : Ga : Zn 1 : X : 20 Abb. 3.31: 0,8 1,0 1,2 1,4 1,6 1,8 2,0 2,2 2,4 2,6 2,8 3,0 3,2 3,4 molarer Anteil Ga bezogen auf Mo : Ga : Zn 1 : X : 20 Änderung der Gitterparameter im hexagonalen Mo(Zn,Ga)6 in Abhängigkeit vom Ga-Gehalt in der Schmelze Zusammenfassend lässt sich feststellen, dass die auf Seite 54 formulierten Fragen zufriedenstellend beantwortet werden konnten. Hervorzuheben ist die Rolle des Galliums als Hilfsmetall, das die Schwierigkeiten bei der Synthese von Metallen mit sehr unterschiedlichen Schmelz- und Siedepunkten beseitigt und im Falle des Systems Mo-Zn offenbar erst ermöglicht, während im binären Mo-Zn-Schmelzen keine Reaktion stattfindet. Das Auftreten der Verbindung Mo3Ga bei sehr geringem Anteil Gallium in der Schmelze bietet möglicherweise einen Ansatzpunkt zur Beantwortung der Frage, nach 66 3. Zinkreiche Verbindungen ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ welchem Mechanismus oder Prinzip eine Mobilisierung des Molybdäns erfolgt, die schließlich zu Verbindungen zwischen Molybdän und Zink führt. Dass in den Kristallstrukturen auch geringe Mengen des „Hilfsmetalls“ Gallium vorhanden sind, konnte hier zur Synthese neuer Verbindungen vorteilhaft ausgenutzt werden. Die Strukturwechsel vollziehen sich in Abhängigkeit vom Galliumgehalt der Schmelze und in den Kristallstrukturen, und zeigen eine auffallende Parallele zu den Elementstrukturen der Metalle und den Hume-Rothery-Phasen. Bestätigt wurde auch die Vermutung, dass die rhomboedrische Verbindung eine nur sehr geringe Phasenbreite besitzt. Sie enthält auch den größten Anteil an Gallium in der Kristallstruktur und damit die höchste VEK der drei Stapelvarianten. Ungewöhnlich ist die Lage des Stabilitätsbereiches der Verbindung verbunden mit der Tatsache, dass der Galliumgehalt nicht dem allgemeinen Verlauf folgt. Die Struktur des hexagonalen ÜM(Zn,Ga)6 mit der La-Stapelfolge der Polyeder wurde auch im Rahmen dieser Arbeit nicht im System Mo-Ga-Zn gefunden und existiert bisher nur mit den Elementen der 5. Gruppe als Übergangsmetallkomponente. Dies zeigt, dass auch dem Übergangsmetall eine gewisse Bedeutung bei der Bildung bestimmter Stapelvarianten zukommt. Mit weiter zunehmendem Galliumanteil in der Schmelze ändern sich schließlich auch die grundlegenden Strukturmotive der Verbindungen, wobei zunächst der Mo7Sn12Zn40-Typ gebildet wird, der als charakteristisches Strukturmotiv mehrschalige Polyeder mit Ikosaedersymmetrie enthält. In sehr galliumreichen Schmelzen entsteht Mo8Ga41 mit zehnfach von Gallium koordinierten Mo-Atomen, dessen Struktur eine hohe kubisch-innenzentrierte Pseudosymmetrie besitzt. 67 3.2. Der Mo7Sn12Zn40-Typ ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ 3.2. V7Ga12Zn39 – Eine Variante des Strukturtyps Mo7Sn12Zn40 Mit dem Mo7Sn12Zn40 (Fm-3c; a = 25.447 Å) gelang 1995 H. Hillebrecht und K. Gebhardt zum ersten Mal die Synthese einer ternären Verbindung im System Mo-Sn-Zn [7] . Charakteristische Baugruppen in der Struktur sind mehrschalige Polyeder mit Ikosaedersymmetrie sowie Motive der kubisch-innenzentrierten Kugelpackung. Weitere Untersuchungen in zinkreichen Schmelzen haben gezeigt, dass sich sowohl das Molybdän gegen andere Übergangsmetalle, als auch das Zinn gegen ähnliche Hauptgruppenmetalle substituieren lässt [8]. Bisher wurden neben Molybdän die Metalle Chrom, Vanadium, Niob und Tantal mit den Hauptgruppenmetallen Gallium, Indium, Zinn Blei, Antimon und Wismut in Zinkschmelzen umgesetzt, allerdings nicht in allen Kombinationen, und auch waren bisher nicht alle Synthesen erfolgreich. Im Rahmen dieser Arbeit konnten zwei weitere Vertreter dieses Strukturtyps synthetisiert und charakterisiert werden. Das V7Ga12Zn39 ist weitgehend isotyp zum Mo7Sn12Zn40, bildet jedoch eine neue Variante bezüglich der Koordination eines der Übergangsmetallatome, was sich in der Summenformel niederschlägt. Während im Mo7Sn12Zn40 eine ÜM-Position 14-fach durch Zink koordiniert ist, ist die entsprechende Lage im V7Ga12Zn39 nur 12-fach von Zink umgeben. Der Rest der Struktur bleibt von dieser Abweichung unberührt. Darüber hinaus gelang mit der Synthese des Mo7Ga26Zn26 zum ersten Mal – zumindest partiell – die Substitution des Zinks in diesem Strukturtypen durch ein anderes Metall. Die bisher erfolglosen Versuche, das Zink durch ähnliche Metalle wie z. B. Aluminium oder Kupfer zu ersetzen, deuten darauf hin, dass der Mo7Sn1Zn40-Typ offenbar auf zinkreiche Verbindungen beschränkt ist. Dass eine Substitution des Zinks nun mit Gallium ansatzweise gelang, zeigt einmal mehr die strukturchemische Flexibilität dieses Metalls. Ein völliger Austausch von Zinks durch Gallium ist unwahrscheinlich, da in sehr galliumreichen Schmelzen die Struktur des Mo8Ga41 gebildet wird. 7 H. Hillebrecht, V. Kuntze, K. Gebhardt, Z. Krist. 1997, 212, 840-847 8 V. Kuntze, Dissertation, Bonn, 1999 68 3. Zinkreiche Verbindungen ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Der Ersatz von Molybdän und Zinn im Mo7Sn12Zn40-Typ erfolgt recht einheitlich. Dabei findet stets eine 1:1-Substitution des Übergangsmetalls statt, und – bis auf wenige Ausnahmen, welche die Besetzungsfaktoren und die geringe Substitution einer Zn-Lage betreffen – auch ein entsprechender Ersatz von Zinn durch das Hauptgruppenmetall. Bisher existieren mit den oben genannten zwei neuen Verbindungen insgesamt zwölf Vertreter dieses Strukturtyps, dessen Kristallstruktur ein besonders charakteristisches Beispiel für Hierarchie und Selbstähnlichkeit in intermetallischen Phasen repräsentiert. Obschon die Elementarzelle beinahe tausend Atome enthält, lässt sich die Struktur in nur zwei Schritten als CsCl-analoge Anordnung großer, mehrschaliger Cluster beschreiben, wobei sich die Zentren dieser Cluster auf hochsymmetrischen Lagen befinden. Darüber hinaus enthält die Struktur Merkmale von drei wichtigen Packungsprinzipien, namentlich Motive der ikosaedrischen Packung, der dichtesten Kugelpackung und der kubisch innenzentrierten Kugelpackung. Schließlich ist das Mo7Sn12Zn40 eines der seltenen Beispiele für die Besetzung von 192-zähligen Lagen in einer kubischen Raumgruppe. 3.2.1. Struktur des Typs Mo7Sn12Zn40 Vor der Diskussion der Ergebnisse sollen die wichtigsten Strukturmerkmale dieses außergewöhnlichen Strukturtyps zusammengefasst werden. Da die Abweichung im V7Ga12Zn39 den grundsätzlichen Aufbau der Struktur nicht beeinflussen, gelten für diese Verbindung analoge Betrachtungen; die Unterschiede werden bei der Strukturbeschreibung diskutiert. Die Struktur des Mo7Sn12Zn40 lässt sich auf zwei verschiedene Arten beschreiben, wobei die Eine von mehrschaligen Polyedern und die Andere von Motiven der Selbstähnlichkeit ausgeht. Beide Darstellungen gehen von Punkten mit maximaler Symmetrie aus, die als Zentren von komplexen Polyedern aufgefasst werden können. 69 3.2. Der Mo7Sn12Zn40-Typ ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ 3.2.1.1. Beschreibung über mehrschalige Polyeder Die Raumgruppe Fm-3c weist zwei 8-zählige Lagen auf, die beide von Molybdänatomen besetzt werden. Mo2 auf der Lage 8a (1/4, 1/4, 1/4,) ist in erster Koordinationssphäre von einem Zn8-Würfel umgeben (Zn6 auf 64g), dessen Flächen von weiteren Zn-Atomen überkappt sind (Zn7 auf 48f), die mit den Atomen des Würfels einen Rhombendodekaeder bilden. Die zweite Schale wird von einem chiralen Sn24-Polyeder gebildet, dessen 6 Vierecksflächen und 24 Dreiecksflächen an einen Würfel erinnert, dessen Ecken und Kanten schräg abgeschnitten sind, und einen der archimedischen Körper repräsentiert. Die Symmetrie dieses Polyeders ist 432 und entspricht damit der Lagesymmetrie der Mo2-Position. Jedes Zinnatom gehört gleichzeitig zu einem Viereck und vier Dreiecken. Da das Polyeder aus einer einzigen kristallographischen Lage gebildet wird, ist jedes Zinnatom zwangsläufig symmetrieäquivalent. Die Polyeder sind so orientiert, dass die Vierecke parallel zu den Flächen der Elementarzelle liegen, dadurch zeigen die Spitzen der MoZn14-Einheit innerhalb dieses Sn24-Polyeders in Richtung der Zentren dieser Vierecke. Die acht Flächen in Richtung der 3-zähligen Achsen sind naturgemäß gleichseitige Dreiecke, wogegen die restlichen Dreiecke leicht verzerrt sind. In der Kristallstruktur sind aufgrund der Zentrosymmetrie beide enantiomere Formen dieses Polyeders enthalten. Die zweite Sorte mehrschaliger Polyeder ist ein Mackay-Polyeder um Mo1 auf der Lage 8b (0, 0, 0). Diese Mo-Atome sind in erster Koordinationssphäre 12-fach von Zn-Atomen (Zn2 auf 96i) in Form eines Ikosaeders umgeben. In der zweiten Schale befinden sich in der Verlängerung der fünfzähligen Achse im Abstand von 5.294Å zwölf weitere MoAtome (Mo3 auf 96i), die ihrerseits ein großes Ikosaeder um das kleinere mit identischer Orientierung bilden. Auf dessen Kantenmitten liegen insgesamt 30 Zn-Atome (Zn1 auf 48e und Zn3 auf 192j), die für sich allein betrachtet ein Ikosidodekaeder mit 12 Fünfecken und 20 Dreiecken bilden. Insgesamt enthält dieser Mackay-Polyeder gemäß der Formulierung [Mo(Zn12) (Mo12Zn30)] 54 Atome und eine nahezu ideale Ih-Symmetrie. Die Zahl der Atome in den einzelnen Schalen folgt dabei der Formel zur Berechnung der Anzahl von Kugeln, die bei dichtesten Kugelpackungen in der n-ten Schale enthalten sind (10n2+2). Ein ähnlicher Zusammenhang wurde von A. L. Mackay auch für ikosaedrische Packungen hergeleitet[48]. Die dreidimensionale Verknüpfung und damit der Bruch der fünfzähligen Symmetrie erfolgt durch Zn6-Oktaeder zweier weiterer Zinklagen (Zn4 auf 96i und Zn5 auf 96h). 48 A. L. Mackay. Acta Cryst. 1962, 15, 916-918 70 3. Zinkreiche Verbindungen ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Abb. 3.32: Zweischalige Polyeder in Mo7Sn12Zn40; oben: Mo(Zn8Zn6)(Sn24)-Polyeder; unten: Mackay-Polyeder aus Mo(Zn12)(Mo12Zn30) 71 3.2. Der Mo7Sn12Zn40-Typ ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Abb. 3.33: Struktur des Mo7Sn12Zn40 als CsCl-analoge Anordnung mehrschaliger Polyeder. Die MoZn14Sn24-Einheit ist blau und der Mackay-Polyeder (Mo13Zn42) ist rot und gelb dargestellt. Eine weitere Zinklage, die die MackayPolyeder verknüpft, ist der Übersicht wegen nicht dargestellt. 72 3. Zinkreiche Verbindungen ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Die F-Zentrierung der Elementarzelle und die Verdopplung der Gitterkonstanten bezogen auf eine kubisch primitive Anordnung im Sinne des CsCl-Typs beruhen auf der alternierenden Verkippung benachbarter Mackay-Polyeder um jeweils 90° und der Tatsache, dass beide enantiomeren Formen des Sn24-Polyeders – ebenfalls alternierend – auftreten. Im Vergleich zu anderen intermetallischen Verbindungen mit Ikosaedern, wie MoAl12 (RG: Im-3; a = 7.573Å) a = 12.642Å) [49] [21] und Mackay-Polyedern, wie α-AlMnSi (RG: Pm-3, tritt dadurch im Mo7Sn12Zn40 eine Verdopplung der Translationsperiode auf. _______________________________________________________________________________________ Tab. 3.14: Strukturdaten zum Mo7Sn12Zn40 Summenformel Kristallsystem Raumgruppe Gitterkonstante Zellvolumen röntgenographische Dichte Pearson Code Formeleinheiten / Zelle Mo7 Sn12 Zn40 kubisch F m -3 c (Nr. 226) a = 25.4468(7) Å 16477.8 Å3 7.595 g/cm3 cF944 16 Atomkoordinaten Atom Wyck. Symm. x y z Mo1 Mo2 Mo3 Sn Zn1 Zn2 Zn3 Zn4 Zn5 Zn6 Zn7 8b 8a 96i 192j 48e 96i 192j 96i 96h 64g 48f m-3. 432 m.. 1 mm2.. m.. 1 m.. ..2 .3. 4.. 0 1/4 0.8240 0.7930 0.8222 0.9126 0.9096 0.8517 1/4 0.1899 0.1398 0 1/4 0.1108 0.1630 0 0.0550 0.1462 0.2182 0.0562 0.1899 1/4 0 1/4 0 0.9124 0 0 0.9427 0 0.0562 0.1899 1/4 Abstände um Mo1 und Mo2 bis 8.0Å Mo1 (0, 0, 0) Mo2 (1/4, 1/4, 1/4) Atom Abstand Anzahl 1. Schale Zn2 2.642 12 2. Schale Zn1 Zn3 Mo3 4.522 4.612 5.290 6 24 12 Zn5 Zn4 Sn 6.673 6.718 7.060 24 12 24 3.Schale Atom Abstand Anzahl 1. Schale Zn7 Zn6 2.649 2.802 8 6 2.Schale Sn 4.807 24 3. Schale Zn3 Zn4 Zn5 Mo3 6.894 6.912 6.974 7.520 24 24 12 24 21 J. Adam, J. B. Rich, Acta Cryst. 1954, 7, 813-816 49 M. Cooper, K. Robinson, Acta Cryst. 1966, 20, 614-617 73 3.2. Der Mo7Sn12Zn40-Typ ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ 3.2.1.2. Selbstähnlichkeit im Mo7Sn12Zn40 Die Struktur des Mo7Sn12Zn40 ist durch eine bemerkenswerte Selbstähnlichkeit gekennzeichnet, die sich in zweierlei Hinsicht äußert. Dabei bedeutet Selbstähnlichkeit, dass entweder Anordnung der Atome und Symmetrie der Polyeder über mehrere Schalen beibehalten werden, oder dass eine Kondensation von Polyedern aus Polyedern stattfindet, wobei die äußeren Polyeder in der Art des zentralen Polyeders angeordnet sind. Beide Arten sind in der Struktur des Mo7Sn12Zn40 vertreten. Fügt man um die oben beschriebenen Polyeder eine weitere Schale hinzu, erhält man um das Sn24-Polyeder ein neues Mo24-Polyeder mit gleicher Orientierung, wie das Sn24Polyeder, das aus den Dreiecksflächen von Mo-Atomen der acht Mackay-Polyedern gebildet wird, die das Sn24-Polyeder würfelförmig umgeben. Diese Mo-Atome auf der Lage 96i enthalten somit die Symmetrie-Information beider mehrschaliger Cluster, und je nach „Standpunkt“ (Mo = 0, 0, 0 oder Mo = 1/4, 1/4, 1/4) führen die Mo-Atome in den äußeren Schalen die Symmetrie und Orientierung der nächst inneren Schale weiter. Für das Mackay-Polyeder ist diese Ineinanderstellung von Baugruppen gleicher Geometrie und Symmetrie – inneres und äußeres Ikosaeder – bereits in den beiden ersten Schalen vorhanden. Die dritte Schale um das Mackay-Polyeder besteht dagegen aus einem Rhombenikosidodekaeder mit 60 Ecken, 120 Kanten und 62 Flächen (20 Dreiecke, 30 Vierecke, 12 Fünfecke), das aus 36 Zink- und 24 Zinnatomen aufgebaut wird. und ebenfalls Ih-Symmetrie besitzt, wenn man zwischen Zinn und Zink nicht unterscheidet. Dieses Polyeder findet sich auch im α-AlMnSi-Typ wieder, wobei diese Polyeder, wie im Mo7Sn12Zn40 über gemeinsame Vierecksflächen, die von Zinkatomen gebildet werden, miteinander verknüpft sind. Auf diese Weise lässt sich das Mo7Sn12Zn40 alternativ auch über dreischalige und einschalige Polyeder beschreiben, die sich direkt berühren, oder als ein System zweier selbstähnlicher Cluster, die einander durchdringen, wobei die Kontaktstellen die Symmetrie-Information beider Teilsysteme in sich trägt. 74 3. Zinkreiche Verbindungen ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Zn Sn Abb. 3.34: Selbstähnlichkeit im Mo7Sn12Zn40. Dargestellt sind jeweils drei Schalen um die Mo1 (unten) und Mo2 (oben) Position. oben: Mo24-Polyeder außerhalb des Sn24-Polyeders. Auf den Kantenmitten des Mo-Polyeder befinden sich noch Zn-Atome, die nicht gezeichnet wurden. unten: Rhombenikosidodekaeder aus 36 Zn- und 24 Sn-Atomen als nächste Schale außerhalb des Mackay-Polyeders. 75 3.2. Der Mo7Sn12Zn40-Typ ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Die zweite von Art Selbstähnlichkeit findet man in der Anordnung der Polyeder untereinander wieder, und betrifft die Mo-Atome des Mackay-Polyeders. Sowohl das Mo-Atom im Zentrum, als auch die Mo-Atome in der zweiten Schale in Verlängerung der fünfzähligen Achse des zentralen Ikosaeders, sind ikosaedrisch umgeben, hier von jeweils zehn Zn- und zwei Sn-Atomen, und bilden mit dem zentralen Polyeder ein Ikosaeder aus Ikosaedern, ein sogenanntes „Superikosaeder“. Abb. 3.35: „Superikosaeder“ im Mo7Sn12Zn40. Zwölf Mo(Zn10Sn2)-Ikosaeder sind über gemeinsame Ecken um das zentrale MoZn12-Ikosaeder (rot) zu einem Ikosaeder aus Ikosaedern kondensiert. Die Entstehung hochsymmetrischer komplexer Kristallstrukturen in intermetallischen Phasen scheint immer dann begünstigt zu sein, wenn bestimmte Organisationsprinzipien auftreten, die über die erste Koordinationssphäre hinausgehen, und möglicherweise bereits in der Schmelze vorliegen. In dieser Vorstellung bilden sich schon in der flüssigen Phase kurz vor dem Erstarrungspunkt große „molekulare“ Aggregate wie Mackay-Polyeder oder „Superikosaeder“ im Mo7Sn12Zn40-Typ oder auch kleinere Polyeder wie Kuboktaeder oder „Antikuboktaeder“ in den Strukturen des Mo(Zn,Ga)6, in denen Selbstähnlichkeit ein wesentliches Merkmal zu sein scheint. Die Kristallisation solcher Cluster muss als kooperativer Prozess mit langreichweitigen Wechselwirkungen erfolgen, bei dem entsprechende 76 3. Zinkreiche Verbindungen ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Baugruppen schon im flüssigen Zustand vorhanden sind, und die Schmelze in der Nähe des Erstarrungspunktes bereits einen hohen Grad an Ordnung aufweist. Zudem müssen die Cluster einigermaßen miteinander kompatibel sein, damit die Kristallisation in einer periodischen Struktur mit Translationsfernordnung erfolgen kann. Im Falle des MoZn6Typs ist diese Bedingung bei relativ kleinen Translationsperioden erfüllt, da Kugelpackung und Polyederpackung Bestandteil des selben Bauprinzips sind; aber auch im Mo7Sn12Zn40Typ scheinen mit dem Mackay-Polyeder und dem überkappten Würfel des MoZn14Polyeders äußerst günstige Bedingungen vorzuliegen, die eine Kristallisation in einer hochsymmetrischen Struktur mit einfachen Prinzipen ermöglicht. Wegen der Ih-Symmetrie der mehrschaligen Polyeder sind im Vergleich zu den Strukturen des MoZn6 zum Einen große Translationsperioden und zum Anderen zwei verschiedene Motive notwendig. Es ist schon lange bekannt, dass die Struktur einer Schmelze besonders in der Nähe des Erstarrungspunktes nicht völlig regellos ist, sondern aus mehr oder weniger zusammenhängenden kleinen Bereichen besteht, welche eine verzerrte Kristallsymmetrie erkennen lässt, die durch ein Versetzungsnetzwerk und Fehlstellenkonglomerate voneinander getrennt sind [50] . Vorhandene Kristallisationskeime oder kleine kristalline Bereiche üben auf die vor ihnen liegende Schmelzzone einen orientierenden Einfluss auf. Dieser Bereich der Schmelze bildet zwar kein reguläres Gitter, aber auch kein statistisches Ensemble, sondern eine weitgehend geordnete Zone, die zwar die in der Schmelze entsprechende Eigenfehlordnung besitzt, in der aber bereits eine gewisse Fernordnung beobachtet werden kann, und als Orientierungsschicht bezeichnet wird (Abb. 3.36). Abb. 3.36: Schematische Darstellung des Übergangs zwischen Kristall und Schmelze [50] . 50 H. Peipst, Z. Phys. Chem. 1961, 216, 304-333 77 3.2. Der Mo7Sn12Zn40-Typ ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Der Strukturtyp des Mo7Sn12Zn40 ist ein eindrucksvolles Beispiele für Verbindungen, die nach „hierarchischem Prinzip“ aufgebaut sind. Hierarchie bedeutet einerseits die sinnvolle Zusammenfassung komplexer Baugruppen zu einer Art „Pseudoteilchen“ und eine eher topologische Betrachtung der Kristallstruktur unter Rückführung auf einfach Bauprinzipien, und andererseits der Vergleich dieser Muster mit verwandten Strukturen, die sich gegebenenfalls durch eine geeignete Skalierung ineinander überführen lassen [51]. Bei dieser Betrachtungsweise findet man eine bemerkenswerte Analogie zur NaZn13Struktur [52] , die nach einem ähnlichen Muster aufgebaut ist, wie das Mo7Sn12Zn40. Im NaZn13 sind ZnZn12-Ikosaeder in der gleichen Art kubisch angeordnet, wie die „Superikosaeder“ im Mo7Sn12Zn40, und an die Stelle der MoZn14-Einheiten in den Lücken der Polyeder befinden sich im NaZn13 die Natriumatome, die ihrerseits 24-fach – wie die 14er-Polyeder im Mo7Sn12Zn40 – von den Dreiecksflächen acht benachbarter Ikosaeder umgeben sind. In beiden Fällen ist nicht nur die Raumgruppe identisch; auch die kristallographischen Punktlagen und die Koordinaten der Atome im NaZn13 entsprechen denen der Mo-Atome im Mo7Sn12Zn40 (8a, 8b und 96i). Atom- und Polyederpackung werden einfach durch eine Skalierung um den Faktor zwei ineinander überführt. Mo7Sn12Zn40 Na Zn Zn NaZn13 Abb. 3.37: Atomanordnung im NaZn13 und Polyederanordung im Mo7Sn12Zn40. Rechts oben sind der Übersicht wegen nicht alle gelben Ikosaeder dargestellt 51 W. Carrillo-Cabrena, N. Caroca-Canales, H. G. Schnering, Z. anorg. allg. Chem. 1994, 620, 247-257 52 D. P. Shoemaker, R. E. Marsh, F. J. Ewing, L. J. Pauling, Acta Cryst. 1952, 5, 637-644 78 3. Zinkreiche Verbindungen ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Im Prinzip steht das NaZn13 in gleicher Beziehung zum Mo7Sn12Zn40 wie die Elementstrukturen der dichtesten Kugelpackungen zu den Strukturen des MoZn6. Das NaZn13 selbst steht ebenfalls in einer hierarchischen Beziehung zum Strukturtyp des CsCl, wenn man acht Elementarzellen des CsCl betrachtet, und die Chloridionen gegen die ZnZn13-Ikosaeder austauscht. Auf diese Weise lässt sich die komplexe Struktur des Mo7Sn12Zn40 in nur zwei Schritten auf den CsCl-Typ zurückführen, wenn man nur die Anordnung der Polyeder betrachtet. In allen drei Strukturen ist das zentrale Baumotiv nach der Notation von Hellner [53] der kubische Bauverband P des Cäsiumchlorids. Bei einer sukzessiven Vereinfachung der Polyederstruktur und entsprechender Verkleinerung der Elementarzellen gelangt man zu folgendem Schema: Mo7Sn12Zn40 NaZn13 CsCl Abb. 3.38: Strukturvergleich nach dem hierarchischen Prinzip. Die Ikosaeder aus Ikosaedern im Mo7Sn12Zn40 = Mo7Sn12Zn40 NaZn13 CsCl 53 sind als große Ikosaeder widergegeben. cF944 MoZn14 8a ¼ ¼ ¼ P2’ a = 25.45Å MoZn12(Mo12Zn30)[Sn24Zn44] 8b 0 0 P2 cF112 Na 8a ¼ ¼ ¼ P2’ a = 12.28Å ZnZn13 8b 0 0 P2 cP2 Cs 1b ½ ½ ½ P’ a = 4.1Å Cl 1a 0 P 0 0 0 0 E. Hellner, Struct. Bond. 1979, 37, 61-120 79 3.2. Der Mo7Sn12Zn40-Typ ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Im Zentrum der mehrschaligen Polyeder finden sich Strukturmerkmale von dichten Kugelpackungen wieder. Innerhalb der Sn24-Einheit befindet sich ein MoZn14-Polyeder mit der Koordinationszahl 8 + 6, das Motiv der kubisch innenzentrierten Kugelpackung. Innerhalb der Mackay-Polyeder bildet das MoZn12-Ikosaeder einen Ausschnitt der ikosaedrischen Packung, der lokal dichtesten Kugelpackung für Kugeln mit etwas unterschiedlicher Größe. Schließlich kann man die Zinkatome des Mackay-Polyeders auffassen als einen Komplex aus 20 Zn6-Oktaedern, die über gemeinsame Ecken und Flächen miteinander verknüpft sind, und im Prinzip Ausschnitte der hexagonal dichtesten Kugelpackung darstellen, und an die Elementstruktur des Zinks erinnern. Die Zentren dieser Oktaeder sind identisch mit den Zentren der leicht verzerrten Tetraeder, die von den 13 Mo-Atomen des Mackay-Polyeders aufgespannt werden [48] , und bilden einen Rhombendodekaeder, das, wie sein duales Gegenstück, das Ikosaeder, ebenfalls Ih-Symmetrie besitzt. Die Oktaeder der Zinkatome des Mackay-Polyeders können als „sphärisch“ gekrümmte dichteste Packung aufgefasst werden, wobei die für diese Anordnung notwendige Verzerrung der Oktaedergeometrie nur sehr gering ist. 1.05 60° B 1.05 B 1.05 B 1.0 1.0 1.0 63.43° A Abb. 3.39: links: Zn3 Mo3 Zn2 Mo3 Zn1 Mo3 Zn2 leicht verzerrtes Tetraeder, von denen 20 ein Ikosaeder aufbauen (mit rechts: entsprechender Ausschnitt aus dem Mackay-Polyeder. A. L. Mackay. Acta Cryst. 1962, 15, 916-918 80 Zn2 Mo1 Angabe der Winkel und der relativen Kantenlängen). 48 Zn3 3. Zinkreiche Verbindungen ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Abb. 3.40: Komplex aus 20 Zn6-Oktaeder innerhalb des Mackay-Polyeders. Jeweils zwei Oktaeder sind über gemeinsame Flächen verknüpft (Stereobild). Weitere Zn6-Oktaeder befinden sich außerhalb des Mackay-Polyeders und umschließen dieses oktaedrisch entlang der kristallographischen Achsen. Diese bilden jeweils ein Tetraeder aus vier eckenverknüpften Oktaedern, wobei die sechs verknüpfenden Zinkatome – für sich betrachtet – ebenfalls ein Zn6-Oktaeder bilden. Schließlich enthält die Struktur auch Oktaeder auf der „Außenseite“ der Sn24-Polyeders, an denen jeweils drei Zink- und drei Zinn-Atome beteiligt sind. Diese bilden Paare von kantenverknüpften Oktaedern, die, über gemeinsame Spitzen verbunden, die Form des Sn24-Polyeders in verzerrter Form nachbilden. Dabei erfolgt die Verknüpfung über Spitzen nur durch Sn-Atome und die Verknüpfung über Kanten durch jeweils ein Zn- und SnAtom. Damit enthält die Struktur des Mo7Sn12Zn40 direkt – in Form der Koordinationspolyeder – oder indirekt – über die (leeren) Zentren von Polyedern – sämtliche platonischen Körper, sowie zwei archimedische Körper. Die Struktur ist damit ein imposantes Beispiel dafür, dass selbst komplexe intermetallische Verbindungen aus einfachen – wenn auch oft vielfältig modifizierten – Strukturmotiven aufgebaut sind, die keineswegs ein „typisch intermetallisches Gewirr“ darstellen, sondern auf simplen Bauprinzipien und hochsymmetrischen Motiven beruhen. 81 3.2. Der Mo7Sn12Zn40-Typ ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Abb. 3.41: Tetraeder aus eckenverknüpften Zn6-Oktaedern, dessen Zentrum man ebenfalls als einen Oktaeder auffassen kann. Sechs dieser Komplexe sind um das Mackay-Polyeder entlang der kristallographischen Achsen angeordnet (Stereobild). Mo2 Mo2 Abb. 3.42: Komplex aus 24 Zn3Sn3-Oktaeder um das MoZn14-Polyeder (der Übersicht wegen ist nur das Molybdän im Zentrum dargestellt.). Die Eckenverknüpfung der Oktaeder erfolgt über die Zinnatome des Sn24-Polyeders¸ die Kantenverknüpfung über die außen liegenden Zinkatome. 82 3. Zinkreiche Verbindungen ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ 3.2.2. V7Ga12Zn39 – Synthese und Strukturdiskussion Die Synthese des V7Ga12Zn39 erfolgte durch direkte Umsetzung der Elemente in evakuierten Quarzampullen. Dazu wurden V, Ga und Zn im molaren Verhältnis 1:2:9 gemischt, auf 850°C erhitzt und nach vier Tagen mit 3°/h auf 400°C abgekühlt. Die weitere Abkühlung auf Raumtemperatur erfolgte mit 20°/h. Nach Entfernen des überschüssigen Metalls mit sehr verdünnter wässriger Salzsäure konnten wenige Einkristalle des V7Ga12Zn39 in Form von spröden grauen Würfeln isoliert werden. Die Oberflächen einiger Kristalle waren bereits stark angegriffen, wie auf Abb. 3.43 zu sehen ist. Diese Empfindlichkeit gegenüber Säuren wurde schon bei anderen zinkreichen Vanadiumverbindungen, wie beispielsweise dem V7Sn12Zn40 oder dem kubischen V(Zn,Ga)6 beobachtet. 50 µm Abb. 3.43: REM-Bild eines V7Ga12Zn39-Einkristalls Als weiteres Reaktionsprodukt entsteht immer ein beträchtlicher Anteil an V2Ga5, das anhand der Kristallform (tetragonale Plättchen, sowie Säulen und Nadeln) optisch gut vom V7Ga12Zn39 zu unterscheiden ist. Das V2Ga5 stellt eine äußerst leicht zugängliche und gut kristallisierende Verbindung dar, die bei nahezu beliebigem V-Ga-Verhältnissen entsteht, und somit eine phasenreine Darstellung der erwünschten ternären Verbindungen naturgemäß erschwert. Daher ist es bis jetzt auch noch nicht gelungen, das V7Ga12Zn39 in reiner Form so synthetisieren. 83 3.2. Der Mo7Sn12Zn40-Typ ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Die röntgenographische Vermessungen von Einkristallen des V7Ga12Zn39 mit dem IPDS ergab eine kubisch flächenzentrierte Elementarzelle mit einer Gitterkonstanten von 24.857(3)Å. Aufgrund der Symmetrie und der Zellabmessungen konnte auf eine Isotypie zum Strukturtyp des Mo7Sn12Zn40 (Fm-3c; a = 25.4467(7)Å) geschlossen werden. Nach Mittelung in der Lauegruppe m-3m konnte mit einem Datensatz aus 693 unabhängigen Reflexen mit 54 Parametern in der Raumgruppe Fm-3c ein Strukturmodell erhalten werden, das mit dem des Mo7Sn12Zn40 weitgehend identisch ist. Die Verfeinerung mit SHELX 97 konvergierte problemlos bei Zuverlässigkeitswerten von R1(F) = 0.0615 und wR2(I) = 0.1621. Die wechselseitige Freigabe der Besetzungsfaktoren bestätige die geordnete Verteilung der Metallatome. Wegen der sehr ähnlichen Elektronenzahlen sind Zink und Gallium röntgenographisch nicht zu unterscheiden. Ein Vergleich der Abstände Ga-Zn und V-Zn legt allerdings eine Substitution von Zinn durch Gallium nahe. EDXAnalysen ergaben, dass es sich um eine ternäre Verbindung handelt. Die Bestimmung des Zn-Ga-Verhältnisses gelang nicht eindeutig. Die Ursache liegt möglicherweise an der angegriffenen Oberfläche der Kristalle. Bereits im Anfangsstadium der Verfeinerung zeigte sich, dass die Struktur nur zehn statt der elf Punktlagen des Mo7Sn12Zn40 aufweist. Anstelle der Zinkpositionen auf 64g und 48f, die das Mo2 in einer 8+6-Koordination in Form eines Rhombendodekaeders umgeben, enthält das V7Ga12Zn40 nun eine 96-zählige Lage,. Dadurch verringert sich die Koordinationszahl des V2 auf zwölf und die Zinkatome bilden ein regelmäßiges Kuboktaeder. Beide Polyeder besitzen die Punktsymmetrie m –3 m, die mit der Lagesymmetrie 432 der Übergangsmetallposition kompatibel ist, und sind dual zueinander; die Ecken des einen Polyeders weisen jeweils in Richtung der Flächenmitten des anderen und umgekehrt. Zn7 Zn6 Zn6 Zn6 Zn6 Zn6 Zn6 V2 Zn6 Zn6 Zn6 Zn6 Zn6 Zn6 Zn6 Zn6 Zn6 Zn7 Zn7 Zn6 Zn6 Zn7 Zn7 Mo2 Zn6 Zn6 Zn6 Zn7 V7Ga12Zn39 Mo7Sn12Zn40 Abb. 3.44: Vergleich der Koordination der ÜM2-Position in V7Ga12Zn39 und Mo7Sn12Zn40 84 3. Zinkreiche Verbindungen ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Zn2 Zn4 Zn6 Zn2 Zn2 Zn2 Zn2 Zn2 Zn6 Ga Zn2 Zn6 Zn6 V2 Zn6 Zn6 Zn2 Zn2 Zn2 Zn6 Zn6 Zn3 Zn6 V3 Zn2 Zn5 Zn3 Zn3 Zn2 Zn3 Zn5 Zn2 Zn3 Zn5 Zn3 Zn2 Zn2 Zn3 Ga V3 V3 Ga Ga Zn3 Zn3 Zn3 Zn4 V2 Zn5 Zn1 Zn4 Zn6 Zn6 Zn6 Zn6 Zn5 Zn5 Zn5 Ga Ga V3 Zn4 Zn2 Zn3 Zn4 V1 V3 Zn2 Zn1 Zn3 Zn2 Zn2 V3 Ga Ga Zn1 Zn2 Zn5 Ga V3 Zn3 Zn3 Zn1 Zn3 Zn3 Zn2 V3 Zn5 Zn3 Zn1 Zn2 Zn3 Zn5 V3 Zn3 Zn6 Ga Zn4 Zn5 V1 Zn2 Zn6 Zn6 Zn6 Zn1 Zn5 Zn3 V3 Ga Ga Ga Ga V3 Zn4 Zn5 Zn4 Zn3 Zn3 Ga Ga Ga Ga Ga Ga Zn6 Zn6 Abb. 3.45: Koordinationspolyeder in V7Ga12Zn39 85 3.2. Der Mo7Sn12Zn40-Typ ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Die beiden anderen Vanadiumpositionen V1 und V3 sind wie im Mo7Sn12Zn40 ikosaedrisch koordiniert. V1 ist nahezu unverzerrt ikosaedrisch von Zn2 umgeben; die Verzerrung betrifft lediglich die Winkel, deren Abweichung vom Idealwert nur bis zu 3% beträgt. Größer sind die Verzerrungen beim Ikosaeder um Mo3, das aus zehn Zink- und zwei Galliumatomen besteht. Die Koordinationspolyeder der Zinkatome lassen sich – bis auf Zn4, das nur eine 8+2 Koordination aus vier Ga-, vier Zn- und zwei Mo-Atomen aufweist, aus pentagonalen Prismen herleiten, die über den Basisflächen von Vanadium überkappt sind, und entsprechen den Polyedern des Mo7Sn12Zn40. Eine Ausnahme bildet natürlich das Koordinationspolyeder des Zn6, welches die V-Atome kuboktaedrisch umgibt. Diese Position im inneren des chiralen 24er-Polyeders wird ja im Mo7Sn12Zn40 von zwei verschiedenen kristallographischen Lagen besetzt, und bildet ein anderes Polyeder um das Übergangsmetall. Beim Zn6 in V7Ga12Zn40 scheint es sich lediglich um eine verzerrte Variante des Zn7 in Mo7Sn12Zn40 zu handeln. Eine genaue Betrachtung zeigt jedoch, dass Zn7 im Mo7Sn12Zn40 bzgl. der Linie Mo-Zn7 in Richtung der vierzähligen Achse, also über dem Zinnquadrat des Sn24-Polyeders liegt, während Zn6 in V7Ga12Zn39 in Richtung der zweizähligen Achse liegt, und damit auf die gemeinsame Kante beiden leicht verzerrten Dreiecksflächen des Ga24-Polyeders zeigt. Das Koordinationspolyeder des Galliums wird davon allerdings nicht beeinflusst und entspricht dem des Zinns in Mo7Ga12Zn40. Mo2 Zn6 Zn6 Zn7 V2 Mo2 Zn6 Zn7 Zn7 Zn6 Zn6 Zn6 Zn6 Zn6 Zn6 Zn6 Zn6 Zn6 Zn6 Zn7 Ga Sn Sn Sn Sn Sn Mo7Sn12Zn40 Sn Sn Ga Ga Ga V7Ga12Zn39 Abb. 3.46: Vergleich der Zn-Polyeder innerhalb der Sn24-Polyeder im Mo7Sn12Zn40 mit dem Zn-Polyeder in V7Ga12Zn39 86 3. Zinkreiche Verbindungen ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Die Frage nach dem Grund für die unterschiedlichen Koordinationen um die ÜM3Positionen lässt sich sicherlich einigermaßen befriedigend anhand geometrischer Betrachtungen beantworten. Vanadium ist mit einem Atomvolumen von 13.9Å3 kleiner als Molybdän mit einem Atomvolumen von 15.5Å3, und auch Gallium ist kleiner als Zinn. Ob beide Effekte in die gleiche Richtung wirken, lässt sich nur vermuten, auf jeden Fall beeinflussen sie die Gitterkonstante der Verbindung, die im V7Ga12Zn39 mit 24.857(3) Å deutlich kleiner ist als die des Mo7Sn12Zn40 (a = 25.447(1)Å). Das Kuboktaeder in der Vanadiumverbindung stellt einen Ausschnitt der kubisch dichtesten Kugelpackung dar. Neben der kleineren Koordinationszahl von zwölf stellt dies die dichtere Packung im Vergleich zur 8 + 6-Koordination der entsprechenden Mo-Position im Mo7Sn12Zn40 dar, die als Motiv der kubisch innenzentrierten Kugelpackung angesehen werden kann (Packungsdichte c.c.p.: π / (3√2) = 74.05% ; b.c.c: 1/8 π √3 = 68.02%) [37]. Für das kleinere Vanadium scheint die kuboktaedrische Umgebung eine günstige Alternative zu der des Molybdäns zu sein, obwohl Molybdän und Zink etwa gleich groß sind, und in Verbindungen wie den Strukturen des MoZn6 problemlos dichteste Kugelpackungen bilden. Der eigentliche Grund liegt wahrscheinlich im Kristallisationsprozess der Verbindung begründet. Wenn man annimmt, dass sich bereits in der Schmelze kurz vor dem Erstarrungspunkt große Aggregate wie etwa die Superikosaeder vorbilden, die sich während der Kristallisation zu dem kubischen Bauverband zusammenschließen, ist es durchaus möglich, dass in den Lücken Teile der Schmelze eingeschlossen werden, wobei die Art der Koordination in diesen Lücken zwischen den Superikosaedern eine Frage des vorhandenen Raumes ist, und dass das vorhandene Übergangsmetall in diesen Lücken ebenfalls als Ordnungsgeber wirkt. Diese Positionen in der Kristallstruktur sind auch die Einzigen, die nennenswerte Defizite aufweist. Aufgrund der geringeren Größe sowohl des Vanadiums als auch des Galliums im Vergleich zu Molybdän und Zinn sind auch die Superikosaeder im V7Ga12Zn39 kleiner als im Mo7Sn12Zn40. Sie umschließen ihrerseits eine kleinere Lücke, so dass die etwas dichtere Packungsvariante des Kuboktaeders und den Lücken gegenüber dem Rhombendodekaeder verwirklicht werden kann. Eine Tendenz diesbezüglich konnte schon bei der zum Mo7Sn12Zn40 isotypen Verbindung V7Sn12Zn40 beobachtet werden [8] . Dort zeigte sich bereits eine deutliche Unterbesetzung der Zinkpositionen und eine partielle Besetzung einer zusätzlichen allgemeinen Lage um die 37 8 U. Müller, Anorganische Strukturchemie, Teubner Taschenbücher, Stuttgart, 1996 V. Kuntze, Dissertation, Bonn, 1999 87 3.2. Der Mo7Sn12Zn40-Typ ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ V2-Position in den Lücken der Superikosaeder. Vanadium hat dort nur eine mittlere Koordinationszahl von etwa 13.2 statt 14 in der entsprechenden Mo-Verbindung. V7Sn12Zn40 befindet sich bezüglich der Besetzung der Lücken innerhalb der Superikosaeder offenbar auf einer Schwelle, die aus der Größe des Zinns und damit der Größe der Superikosaeder resultiert, und kann sich nicht eindeutig für eine bestimmte Koordinationsgeometrie in diesen Lücken entscheiden. Mit Vanadium und dem etwas kleineren Gallium im V7Ga12Zn39 scheinen die geometrischen Verhältnisse bezüglich der Raumbeanspruchung zwischen Superikosaeder und den von ihnen umschlossenen Lücken wieder in einem günstigen Verhältnis zu liegen, was sich dann in der dichteren Packungsvariante und der niedrigeren Koordinationszahl dieser Lücken niederschlägt. Betrachtet man Abstände innerhalb der chiralen Sn24- bzw. Ga24-Polyeder, findet man für das Ga-Polyeder eine etwas stärkere Verzerrung im Vergleich zum Sn-Polyeder, die sich in einer größeren Bandbreite der Abstände äußert (Tab. 3.15). Die Durchmesser der Polyeder entlang der vierzähligen Achse betragen 8.193Å für das Sn24-Polyeder und 8.281Å für das Ga24-Polyeder. In Richtung der dreizähligen Achse kehren sich die Längenverhältnisse um: 8.602Å im Sn24-Polyeder und 8.412Å im Ga24-Polyeder. Dadurch werden im V7Ga12Zn39 die Abstände im Ga4-Quadrat senkrecht zur vierzähligen Achse kleiner, und die Ga-GaAbstände senkrecht zur zweizähligen Achse größer als im Sn24-Polyeder des Mo7Sn12Zn40. Insgesamt findet beim Ga24-Polyeder eine leichte Verzerrung in Richtung einer oktaedrischen Geometrie statt, wobei das Volumen des Ga24-Polyeders – selbst bei gleich großer Gitterkonstante der beiden Verbindungen – schrumpft, was anhand der „Grenzpolyeder“ mit 432-Symmetrie, dem Würfel und dem Oktaeder deutlich wird. Die Volumina dieser Polyeder ergeben (a = Kantenlänge der Polyeder): VWürfel VOktaeder = a3 = a3 ⋅ 2 3 Damit beträgt das Volumen eines Oktaeders im Vergleich zu einem Würfel gleicher Kantenlänge nur etwa 47.14%, was fast einer Halbierung gleicht. 88 3. Zinkreiche Verbindungen ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Anhand dieser Betrachtungen wird plausibel, warum sich die Zinkatome in den Lücken der Superikosaeder für eine etwas niedrigere Koordinationszahl aber dafür etwas höhere Packungsdichte „entscheiden“. Ein Vergleich mit anderen Verbindungen des Typs Mo7Sn12Zn40 zeigt darüber hinaus, dass hauptsächlich geometrische Faktoren strukturbestimmend für diesen Typen verantwortlich sind. Obwohl Niob und Tantal die gleicher Elektronenzahl wie Vanadium haben, wird in den entsprechenden Verbindungen eine unterschiedliche Koordination der ÜM2-Position bevorzugt. Die Synthesen der analogen Verbindungen mit Nb-Ga-Zn und Ta-Ga-Zn kann weitere Ergebnisse liefern, doch leider waren entsprechende Versuche in dieser Richtung bisher noch nicht erfolgreich. _________________________________________________________________________ Tab. 3.15: Vergleich der Sn-Metall- und Ga-Metall-Abstände in Mo7Sn12Zn40 und V7Ga12Zn39 Sn Sn Sn Sn Sn Sn Sn Sn Sn Sn Sn Sn Mo3 Zn6 Zn7 Zn4 Zn4 Zn5 Zn3 Zn3 Zn6 Sn Sn Sn 2.712(0) 2.727(0) 2.804(0) 2.955(0) 3.029(0) 3.037(0) 3.095(0) 3.104(0) 3.759(0) 3.486(0) 3.492(0) 2x 3.764(0) 2x Ga Ga V3 Zn6 2.602(3) 2.481(3) Ga Ga Ga Ga Ga Ga Ga Ga Ga Zn4 Zn4 Zn3 Zn5 Zn3 Zn6 Ga Ga Ga 2.740(3) 2.764(3) 2.817(3) 2.960(3) 3.010(3) 3.114(3) 3.276(3) 2x 3.721(3) 3.803(3) 2x _________________________________________________________________________ 89 3.2. Der Mo7Sn12Zn40-Typ ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Tab. 3.16: Angaben zur Strukturbestimmung von V7Ga12Zn40 Rel. Molmasse Kristallsystem Raumgruppe Zellabmessungen 3743.04 g/mol kubisch F m –3 c (Nr. 226) a = 24.857(3) Å Zellvolumen Anzahl der Formeleinheiten Röntgendichte Messtemperatur Diffraktometer Röntgenstrahlung V = 15357.85 Å3 16 6.475 g/cm3 20°C STOE IPDS Mo Kα1 Graphit-Monochromator 27248 ±28; ±30; ±30 52° 100 Platten à 6 min bei 2° ϕ-Inkrement 6.0 29393 2973 693 693 430 Würfel 0.15 * 0.15 * 0.15 mm3 numerisch; Equivalent-Methode 0.3155 (0.0770) 33.67 mm-1 0,00001 + 2.69; -2.11 (0.41) e/ Å3 1 / [σ2 * F02 + (0,1058 * P) 2] mit P = (F02 + 2 * Fc2) / 3 54 R1(F) = 0.0615; wR2(I) = 0.1621 F ( 0 0 0) Messbereich h, k, l max. 2θ Mess- / Scanmodus I / σ(I)-Verhältnis Messwerte davon unbeobachtet unabhängige Reflexe davon mit I > 0 davon mit I > 2σ(I) Kristallform Kristallabmessungen Absorptionskorrektur Interner Standard Schwächungskoeffizient Extinktionskoeffizient (SHELX97) Restelektronendichte Wichtungsfunktion Zahl der Parameter R- Werte 90 3. Zinkreiche Verbindungen ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Tab. 3.17: Ortskoordinaten und Auslenkungsparameter (in [Å2]) in V7Ga12Zn39 Atom Wyck. Symm. x y z Ueq V1 V2 V3 Ga1 Zn1 Zn2 Zn3 Zn4 Zn5 Zn6 8b 8a 96i 192j 48e 96i 192j 96i 96h 96h * m-3. 432 m.. 1 mm2.. m.. 1 m.. ..2 ..2 0 1/4 0.1779(2) 0.2948(1) 0.3202(2) 0.0895(1) 0.1502(1) 0.2220(1) 1/4 1/4 0 1/4 0.1112(2) 0.0832(1) 0 0.0576(1) 0.0611(1) 0 0.0604(1) 0.1725(1) 0 1/4 0 0.1683(1) 0 0 0.0956(1) 0.1573(1) 0.0604(1) 0.1725(1) 0.026(3) 0.024(3) 0.026(1) 0.0329(7) 0.028(1) 0.0241(7) 0.0269(6) 0.0344(8) 0.0237(7) 0.038(1) * Defizit: 9,68(1) % Atom U11 U22 U33 U12 U13 U23 V1 V2 V3 Ga1 Zn1 Zn2 Zn3 Zn4 Zn5 Zn6 0.026(3) 0.024(3) 0.023(2) 0.034(1) 0.027(2) 0.024(2) 0.024(1) 0.028(2) 0.019(1) 0.045(2) 0.026(3) 0.024(3) 0.027(2) 0.028(1) 0.032(2) 0.025(2) 0.031(1) 0.038(2) 0.026(1) 0.035(1) 0.026(3) 0.024(3) 0.028(2) 0.036(1) 0.023(2) 0.023(2) 0.025(1) 0.037(2) 0.026(1) 0.035(1) 0 0 -0.0003(2) 0.005(1) 0 -0.001(1) -0.0001(9) 0 0.0016(9) 0.0129(1) 0 0 0 -0.002(1) 0 0 0.0019(9) 0.002(1) -0.0016(9) -0.013(1) 0 0 0 -0.0071(9) 0 0 0.0051(9) 0 0.003(1) -0.019(2) Tab. 3.18: Ausgewählte Abstände (in [Å]) in V7Ga12Zn39 V1 - Zn2 12x 2.646(3) V2 - Zn6 12x 2.724(2) V3 - Zn2 2.569(5) V3 - Ga 2.602(3) 2x V3 - Zn5 2.658(4) 2x V3 - Zn3 2.725(4) 2x V3 - Zn4 2.738(6) V3 - Zn1 2.766(4) V3 - Zn3 2.771(3) 2x V3 - Zn4 2.801(5) Ga - Zn6 2.481(3) Ga - V3 2.602(3) Ga - Zn4 2.740(3) Ga - Zn4 2.764(3) Ga - Zn3 2.817(3) Ga - Zn5 2.960(3) Ga - Zn3 3.010(3) Ga - Zn6 3.114(3) Ga - Ga 3.276(3) 2x Ga - Ga 3.721(3) Ga - Ga 3.803(3) 2x Zn1 - Zn2 Zn1 - Zn5 Zn1 - V3 Zn1 - Zn3 2.662(5) 2.747(3) 2.766(4) 2.916(3) 2x 4x 2x 4x Zn2 - V3 Zn2 - V1 Zn2 - Zn1 Zn2 - Zn3 Zn2 - Zn2 Zn2 - Zn3 Zn2 - Zn2 2.569(5) 2.646(3) 2.662(5) 2.761(3) 2x 2.763(3) 4x 2.816(3) 2x 2.863(4) Zn3 - Zn5 Zn3 - V3 Zn3 - Zn3 Zn3 - Zn2 Zn3 - V3 Zn3 - Zn4 Zn3 - Zn2 Zn3 - Ga Zn3 - Zn1 Zn3 - Ga Zn3 - Zn3 2.632(2) 2.725(4) 2.733(3) 2x 2.761(3) 2.771(3) 2.801(4) 2.816(3) 2.817(3) 2.916(3) 3.010(3) 3.039(3) Zn4 - V3 Zn4 - Ga Zn4 - Ga Zn4 - V3 Zn4 - Zn3 Zn4 - Zn5 2.738(6) 2.740(3) 2x 2.764(3) 2x 2.801(5) 2.801(4) 2x 2.922(4) 2x Zn5 - Zn3 Zn5 - V3 Zn5 - Zn1 Zn5 - Zn4 Zn5 - Ga Zn5 - Zn5 2.632(2) 2x 2.658(4) 2x 2.747(3) 2x 2.922(4) 2x 2.960(3) 2x 3.000(3) 2x Zn6 - Ga Zn6 - V2 Zn6 - Zn6 Zn6 - Ga 2.481(3) 2x 2.724(2) 2.724(2) 4x 3.114(3) 2x 91 3.2. Der Mo7Sn12Zn40-Typ ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Tab. 3.19: Ausgewählte Abstände in Mo7Sn12Zn40 Mo1 Zn2 2.628(2) 12x Mo2 Zn6 Zn7 2.649(2) 8x 2.804(4) 6x Mo3 Zn2 Sn Zn5 Zn3 Zn3 Zn1 Zn4 Zn4 2.664(2) 2.712(1) 2x 2.743(2) 2x 2.772(2) 2x 2.779(2) 2x 2.821(2) 2.822(1) 2.856(2) Mo3 Zn6 Zn7 Zn4 Zn4 Zn5 Zn3 Zn3 Sn Sn Zn6 Sn 2.712(1) 2.727(2) 2.804(3) 2.955(2) 3.029(2) 3.037(2) 3.095(2) 3.104(2) 3.486(2) 3.492(2) 2x 3.759(2) 3.764(2) 2x Sn 92 Zn1 Zn2 Zn5 Mo3 Zn3 2.693(3) 2x 2.732(3) 4x 2.821(2) 2x 2.842(2) 4x Zn2 Mo1 Mo3 Zn1 Zn3 Zn3 Zn2 Zn2 2.628(3) 2.664(2) 2.693(2) 2.742(2) 2x 2.745(3) 2x 2.754(2) 4x 2.799(2) Zn2 Zn2 Zn4 Mo3 Mo3 Zn5 Zn3 Zn1 Zn3 2.742(2) 2.745(2) 2.767(2) 2.772(1) 2.779(3) 2.781(2) 2.801(2) 2x 2.841(1) 2.916(2) Zn3 Zn4 Zn3 Mo3 Mo3 Zn5 Sn 2.767(3) 2x 2.822(2) 2.856(3) 2.862(3) 2x 2.955(2) 2x Zn5 Zn1 Mo3 Zn3 Zn5 Zn4 2.732(3) 2x 2.743(1) 2x 2.781(3) 2x 2.8621) 2x 2.862(3) 2x Zn6 Zn7 Mo2 Sn 2.511(3) 3x 2.649(4) 2.727(3) 3x Zn7 Zn6 Sn Mo2 2.511(2) 4x 2.804(4) 4x 2.804(3) 3. Zinkreiche Verbindungen ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ 3.2.3. Mo7Ga26Zn26 – partielle Substitution des Zinks durch Gallium Wie eingangs des Abschnitts bereits erwähnt, waren die Versuche, in den Strukturen des ÜM7Sn12Zn40-Typs Zink gegen andere Metalle zu substituieren, bislang nur mit Gallium erfolgreich. Bei der Überlegung, welche Metalle für einen Ersatz von Zink in Frage kommen, spielen neben physikalischen und chemischen Eigenschaften ebenso strukturchemische Aspekte der entsprechenden Elemente sicher eine entscheidende Rolle. Dabei sollten die Metalle neben einer guten gegenseitigen Löslichkeit niedrige Schmelzpunkte aber einen möglichst großen Flüssigkeitsbereich aufweisen – immerhin gelingen die Synthesen dieser Verbindungen durch einfaches Zusammenschmelzen der Elemente bei moderaten Temperaturen von maximal 850°C und einer Aufarbeitung der erstarrten Schmelzen in verdünnten wässrigen Säuren. Ein Blick auf das Periodensystem zeigt, dass eigentlich nur wenige Metalle diese Bedingungen erfüllen, wie etwa Aluminium oder die Münzmetalle. Diese haben eine ähnlich Größe wie Zink und die meisten Übergangsmetalle, besitzen entsprechend gute Lösungseigenschaften und unterscheiden sich in ihrer Strukturchemie nicht allzu sehr von der des Zinks. Auf die Verwendung von Cadmium als Schmelzmetall wurde bisher verzichtet, da das Metall einen niedrigen Siedepunkt (767.3°C) und einen hohen Dampfdruck besitzt. Bei Verwendung von Tantal-Ampullen ließen sich Probleme bei der Umsetzung in Cadmiumschmelzen umgehen. Der naheliegende Austausch von Zink gegen Aluminium war bisher aber ebenso erfolglos wie der Ersatz durch Kupfer. Reaktionen in silber- oder goldreichen Schmelzen wurden bisher aus naheliegenden Gründen nicht durchgeführt: die Metalle sind nicht nur sehr teuer, sondern besitzen auch einen hohen Schmelzpunkt (Ag: 960.8°C; Au: 1036°C), so dass auf Korundtiegel oder Tantalampullen zurückgegriffen werden muss, da Quarzglas bei Temperaturen über 1000°C bereits weich wird. Synthesen mit Aluminium müssen ebenfalls in Korundtiegeln oder Ähnlichem durchgeführt werden, da dieses Metall schon in geringsten Mengen das Quarzglas der Ampullen angreift, so dass Oxide und Silizide entstehen, die ein vernünftiges Aufschmelzen verhindern. Versuche mit den Metallen TaGa-Cu und Nb-Ga-Cu führten bisher nur zu den binären Randphasen wie Ta5Ga3 (Cr5B3Typ), NbGa3 (TiAl3-Typ) und CuGa2 (FeSi2-Typ), in kupferreichen Schmelzen häufig auch das Cu9Ga4 (Zn5Cu8-Typ). 93 3.2. Der Mo7Sn12Zn40-Typ ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Mit Molybdän und Vanadium als Übergangsmetall entstehen in Kupfer-GalliumSchmelzen zwar ternäre Verbindungen (Mo2Cu3Ga8, V2Cu3Ga8). Diese jedoch bilden einen eigenen Strukturtypen, der eine Ordnungs- und Defektvariante der kubischinnenzentrierten Kugelpackung darstellt, in der die Metalle Mo und Cu (bzw. V und Cu) partiell die Lücken des kubisch-primitiven Galliumgerüstes besetzen. Dass die Substitution von Zink ausgerechnet mit Gallium zumindest teilweise gelang, mag auf den ersten Blick überraschen. Obwohl sich Zink und Gallium in mancher Hinsicht ähnlich sind, unterscheidet sich die Strukturchemie zinkreicher und galliumreicher Verbindungen doch erheblich voneinander. Während zinkreiche Verbindungen mit Übergangsmetallen häufig Motive der dichtesten Kugelpackung oder Ikosaeder ausbilden, findet man in entsprechenden galliumreichen Verbindungen eine auffällige Vorliebe des Galliums zur Ausbildung von Würfeln und dessen Variationen, sowie einer linearen Anordnung der Art -ÜM-Ga-ÜM-. Gallium hat in diesen Verbindungen eher den Charakter eines großen Metalls, und bevorzugt oft niedrige Koordinationen von acht bis elf um das Übergangsmetall. Als Hauptgruppenmetall neigt es bereits zur Ausbildung von Galliumnetzwerken mit gerichteter, lokalisierter Bindung und partiell kovalentem Bindungscharakter. In vielen galliumreichen Verbindungen wie CuGa2, Mo2Cu3Ga8, oder den sehr galliumreichen Verbindungen des Typs (MoGa5)nGa) [41] [42] fungiert Gallium als eine Art Gerüstgeber, in dessen Lücken die Partner eingebaut werden, wobei die Palette der Strukturen von einfachen Ordnungsvarianten bis hin zu komplexen Überstrukturen mit über 800 Atomen pro Elementarzelle reicht. Einige dieser galliumreichen Verbindungen wurden im Rahmen dieser Arbeit synthetisiert und werden in den nächsten Kapiteln ausführlich beschrieben. Bei näherer Betrachtung scheint es aber dennoch plausibel, dass gerade Gallium als Kandidat für eine Substitution des Zinks in Frage kommt. Gallium ist nicht nur für Zink, mit dem es in jedem Verhältnis mischbar ist, sondern auch für die meisten Übergangsmetalle ein guter Reaktionspartner. Ein Vergleich mit den im vorhergehenden Kapitel beschriebenen zinkreichen Verbindungen des Typs MoZn6, die Variationen der dichtesten Kugelpackung bilden, zeigt, dass sich das Gallium zu einem erheblichen Teil problemlos in das Wirtsgitter des Zinks einbauen lässt, ohne seinen ausgeprägten eigen41 K. Yvon, Acta Cryst. 1974, B30, 863-861 42 K. Yvon, Acta Cryst. 1975, B31, 117-120 94 3. Zinkreiche Verbindungen ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ ständigen strukturchemischen Charakter zu zeigen, den es in den galliumreichen Verbindungen entfaltet. Immerhin beträgt der Anteil an Gallium in den kubischen Verbindungen Ta(Zn,Ga)6 und Nb(Zn,Ga)6 fast 50 %. Dabei findet bei allen Verbindungen keine Differenzierung der niedrigschmelzenden Metalle auf verschiedene kristallographische Lagen statt, die zugegebenermaßen für Zink und Gallium röntgenographisch schwer zu ermitteln ist. Auch Auffälligkeiten bezüglich der interatomaren Abstände sind nicht zu beobachten. Gallium ist hinsichtlich seiner Raumbeanspruchung hinreichend flexibel, und kann sich bis zu einem gewissen Grad, zumindest mit Zink als Reaktionspartner, in das Wirtsgitter der Mehrheitskomponente einfügen, ohne strukturchemisch besonders auffällig in Erscheinung zu treten. Erst bei einem genügend hohem Anteil in der Metallschmelze macht sich der „strukturgebende“ Einfluss des Galliums bemerkbar, und tritt in Konkurrenz zum Zink. Damit lässt sich auch die Frage beantworten, warum sich Zink nicht vollständig durch Gallium ersetzen lässt. Umfangreiche Untersuchungen im System Mo-Ga-Zn, die von sehr zinkreichen bis zu sehr galliumreichen Ansätzen reichten, und die Auswertung anhand von Pulverdaten kommen dabei zu folgendem Ergebnis: In den zinkreichen Schmelzen bis zu einem Ga-Zn-Verhältnis bis etwa 1:7 entstehen die Stapelvarianten der dichtesten Kugelpackung vom Typ MoZn6. Bei größer werdendem Galliumanteil wird dann Mo7Ga26Zn26 gebildet, das sich bei einem Ga-Zn-Anteil in der Schmelze von 1:4 bis 1:2 nahezu phasenrein synthetisieren lässt. Ab einem Ga-Zn-Verhältnis von etwa 1:1 beginnt dann merklich die Bildung des rhomboedrischen Mo8Ga41, das als galliumreichste binäre bekannte Verbindung am Ende der Reihe binärer und ternärer Verbindungen des Molybdäns mit Zink und Gallium steht. In Abb. 3.47 sind die Pulverdiagramme abgebildet, die nach Aufarbeitung verschiedener Metallschmelzen mit unterschiedlichem Ga-Zn-Verhältnis aus jeweils einer Probe angefertigt wurden. Zum Vergleich sind die aus Einkristalldaten berechneten Pulverdiagramme des Mo7Ga26Zn26 und des Mo8Ga41 mit abgebildet. Während im Pulverdiagram a (Mo:Ga:Zn 1:5:20) noch ausschließlich die Linien des Mo7Ga26Zn26 zu finden sind, erkennt man in Diagramm b (Mo:Ga:Zn 1:10:20) bereits die zusätzlichen Reflexe des Mo8Ga41, die dann in Diagramm c (Mo:Ga:Zn 1:20:10) ausschließlich auftreten. 95 3.2. Der Mo7Sn12Zn40-Typ ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Mo8Ga41 berechnet c Mo:Ga:Zn 1:20:10 b Mo:Ga:Zn 1:10:20 a Mo:Ga:Zn 1:5:20 Mo7Ga26Zn26 berechnet 5 10 20 30 40 50 60 2-Theta - Scale Abb. 3.47: Pulverdiagramme von drei Mo-Ga-Zn-Schmelzen mit verschiedenem Zn-GaVerhältnis. Zum Vergleich sind die aus Einkristalldaten berechneten Pulver diagramme des Mo7Ga26Zn26 und des Mo8Ga41 mit abgebildet. 96 3. Zinkreiche Verbindungen ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ EDX-Untersuchungen an mehreren Einkristallen des Mo7Ga26Zn26 ergaben ein Ga-ZnVerhältnis von etwa 1:1. Die Messungen erfolgten an geschliffenen Kristallen, die in Kunstharz eingebettet waren, um Oberflächeneffekte bei der Analyse zu unterdrücken. Diese Effekte sind bei vielen Einkristallen zu beobachten, und oft mit bloßem Auge erkennbar. CuGa2 beispielsweise, das oft in ÜM-Ga-Cu-Schmelzen entsteht, ist oft ganz oder teilweise von einer Kupferschicht überzogen, während die Kristalle selbst silberfarben sind. Die Erfahrung zeigte, dass eigentlich alle Kristalle intermetallischer Verbindung einen silbernen, typisch metallischen Glanz aufweisen, während die Oberflächen häufig schwarz sind oder eine bronze-, messing- oder kupferfarbene Oberfläche besitzen. Zudem haben vergleichende Messungen an röntgenographisch gut charakterisierten einfachen binären Verbindungen wie beispielsweise V2Ga5, Mo3Ga, CuGa2 oder PtSn2 gezeigt, dass die EDX-Analysen an geschliffenen Präparaten Ergebnisse liefern, die eindeutig besser der Summenformel entsprechen. Solche Kristalle können zudem als „Eichkristalle“ bei der Abschätzung der Metallgehalte neuer Kristallstrukturen herangezogen werden. Dennoch gab der sehr hohe Galliumgehalt Anlass zu der Frage, ob es sich dabei um ein „Artefakt“ handelt, das nur bei einzelnen Kristallen auftritt oder ob die Verbindung tatsächlich so große Mengen an Gallium enthält. Da die Synthese phasenrein gelang – aus einem 1.0g Ansatz Mo-Ga-Zn im molaren Verhältnis 1 : 7: 20 entstehen bei einer angenommenen quantitativen Umsetzung des Molybdäns etwa 0.31g Mo7Ga26Zn26 – lag genug Substanz für eine nasschemisch-analytische Untersuchungsmethode vor. Die Analysen wurden zusammen mit Dr. Verena Kuntze und der Firma Kuntze in Meerbusch bei Neuss durchgeführt. Bei der Nachweismethode handelt es sich um einen Küvettentest der Firma Merck©, fotometrischer Nachweis mit PAR (Pyridylazoresorcin), Messbereich 0.2 – 5.0 mg/l. Insgesamt wurden drei Proben mehrmals jeweils zwischen 12 und 20 Minuten vermessen, die alle aus einem Aufschluss stammen. Dabei wurde für die Analyse 0.01g Substanz benötigt. Bei der Wahl eines geeigneten Lösungsmittels zum Aufschluss der Kristalle stellte sich heraus, dass die Verbindung bemerkenswert stabil gegenüber Säuren ist. Möglicherweise ist der hohe Anteil des im Vergleich zum Zink edleren Gallium in der Verbindung der Grund für diese Resistenz. Selbst Lösungsversuche in heißer konzentrierter Schwefelsäure waren unbefriedigend. Der vollständige Aufschluss gelang in 97 3.2. Der Mo7Sn12Zn40-Typ ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ heißer konzentrierter Salpetersäure, wobei sehr wenig feines schwarzes Pulver zurückblieb, bei dem es sich vermutlich um Molybdän handelt. Bei den nicht erfolgreichen Lösungsversuchen mit verschiedenen Säuren wurde zunächst eine Gasentwicklung beobachtet, die dann aber – bei Salzsäure schnell, bei Schwefelsäure langsamer – abebbte. Das könnte darauf hindeuten, dass, wie oben beschrieben, zunächst eine Oberflächenschicht aufgelöst wurde, die sehr viel korrosionsanfälliger ist, als die eigentliche Verbindung. Inwieweit diese Oberflächenschicht allerdings Teil der Struktur ist, bleibt offen. Für die Analyse wurden insgesamt 0.0066g eingewogen, mit Schwefelsäure und Salpetersäure in der Hitze behandelt und mit VE-Wasser auf 1 Liter aufgefüllt. Die Messmethode verlangt einen pH-Wert von 4-10. Nach dem Neutralisieren enthielt die Probe zusätzlich zu den obengenannten Stoffen noch etwas NaOH und K2CO3, wobei der pH-Wert bei 5 lag. Es wurden drei Proben – alle aus einem Aufschluss – mehrmals im Abstand zwischen 12 und 20 Minuten vermessen. Die Ergebnisse sind in Tab. 3.20 aufgeführt. In Übereinstimmung mit den EDX-Analysen enthält die Verbindung etwa gleiche Mengen Zink und Gallium, was einer Summenformel von Mo7Ga26Zn26 entspricht Tab. 3.20: 98 Ergebnisse der Bestimmung des Zn-Gehaltes im Mo7Ga52-xZnx Ergebnis aus den Messungen (Zn-Gehalt) Mittelwerte Abweichung 2.70 – 2.74 mg 2.72 +/- 0.02 mg 2.48 – 2.52 mg 2.50 +/- 0.02 mg 2.56 – 2.58 mg 2.57 +/- 0.01 mg Mittelwert: 2.60 +/- 0.12 mg Zink Ergebnisse in mmol: 0.0382 bis 0.0416 mmol Zink Mittelwert: 0.0400(18) mmol Zink 3. Zinkreiche Verbindungen ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Fehler und Grenzen: Bei der Analyse wurden keinerlei Variationen im Molybdängehalt berücksichtigt, was sich auf die Molmasse auswirken würde. Weiter wurden keine Unterbesetzungen kristallographischer Lagen in der Kristallstruktur berücksichtigt. Diese Daten müssen aus der Röntgenstrukturanalyse entnommen werden. Schließlich kann nicht ausgeschlossen werden, ob die oben beschriebenen Oberflächeneffekte beim Auflösen der Substanz das Ergebnis beeinflussen. Abschließend ist aber zu sagen, dass die Analyse insgesamt zufriedenstellend ist, was Fehler und Verteilungsbreite der Messergebnisse angeht. Eine zusätzliche Überprüfung der anderen Bestandteile ist bisher nicht möglich, da weder für Gallium noch für Molybdän geeignete Testsätze zur Verfügung stehen, und ein Vergleich mit klassischen Nachweismethoden mehr Fehler als Nutzen mit sich bringen würden, was besonders bezüglich des sehr geringen Mo-Gehalts in der Verbindung plausibel erscheint. Eine weitere Möglichkeit, den Zinkgehalt zu bestimmen, besteht in der komplexometrischen Titration in alkalischer, gepufferter Lösung bei pH = 7 - 10 mit Ethylendiamintetraessigsäure (EDTA) und Erio T als Indikator, die sich laut Literatur durch einen extrem scharfen Umschlagspunkt auszeichnet[54], und sich daher für eine Mikroanalyse anbietet. Sehr reines Zink oder Zinkoxid eignet sich deshalb als Urtitersubstanz für die Einstellung von EDTA-Lösungen. Allerdings stören bei dieser Methode zahlreiche Metallionen die Titration (u. a. Al3+), die entweder entfernt oder maskiert werden müssen. Da Ga3+ in wässriger Lösung ähnliche Eigenschaften wie Aluminium besitzt, und vor der Titration quantitativ zu entfernen ist, wären die Ergebnisse sicherlich mit großen Fehlern behaftet, da ein Verschleppen erheblicher Mengen an Zink in dem gallertartigen Niederschlag des Ga(OH)3 nicht auszuschließen ist. Außerdem ist Zink, wie Aluminium und Gallium, ebenfalls amphoter, was äußerst sorgfältige Einstellungen entsprechender pH-Werte notwendig macht, und eine quantitative Trennung von Gallium zusätzlich erschwert. Des weiteren blockieren bereits Spuren von Co2+, Ni2+ und Cu2+ den Indikator. Diese Metalle könnten immerhin durch geringste Verunreinigungen der Chemikalien bei Synthese, Aufarbeitung und Aufschluss der Kristalle in die Analysenlösung eingeschleppt werden und das Ergebnis nachteilig beeinflussen. Bei einer kritischen Abschätzung 54 Jander, Jahr, Maßanalyse, 14. Auflage, Walter de Gruyter, Berlin-New York, 1986 99 3.2. Der Mo7Sn12Zn40-Typ ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ zwischen Aufwand und Nutzen scheinen in diesem besonderen Fall die Nachteile zu überwiegen. Deshalb wurde auf die Anwendung dieser Methode zur quantitativen Bestimmung des Zinkgehaltes verzichtet. Anhand des Pulverdiagramms von Mo7Ga26Zn26 wurde eine Gitterkonstante von 24.8612(8) Å errechnet (Tabelle 8.3). Die schmalen Reflexprofile im gemessenen Diagramm weisen auf eine definierte Zusammensetzung der Struktur mit engem Homogenitätsbereich ohne Mischkristallbildung hin. Röntgenographische Untersuchungen von Einkristallen ergab die Struktur des Mo7Sn12Zn40-Typs, wobei eine statistische Verteilung von Zink und Gallium angenommen wurde. Die Verfeinerung konvergierte bei Zuverlässigkeitswerten von R1(F) = 0.0145 und wR2(I) = 0.0177. Eine Zinklage weist ein Defizit von etwa 10% auf. Dabei handelt es sich um Zn-Atome der 14er-Polyeder, die in den Lücken zwischen den „Superikosaedern“ angeordnet sind. Weitere Angaben zur Strukturlösung sind in Tabelle 8.12 zusammengefasst. Mo7Sn12Zn40 – berechnet Mo7Ga26Zn26 – berechnet Intensität Mo7Ga26Zn26 – gemessen * 5 10 * 20 30 * * 40 50 60 2 Theta Abb. 3.48: gemessenes und aus Einkristalldaten berechnete Pulverdiagramme von Mo7Ga26Zn26 und Mo7Sn12Zn40. Die mit einem Stern gekennzeichneten Reflexe im unteren Diagramm stammen von ZnGa2O4. 100 4. Galliumreiche Verbindungen ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ 4. Galliumreiche Verbindungen Gallium stellt für die meisten Übergangsmetalle einen guten Reaktionspartner dar. Von allen Metallen mit nichtabgeschlossener d-Schale gibt es mindestens eine, häufig jedoch mehrere binäre Verbindungen mit Gallium, wobei die Zusammensetzung in einigen binären Systemen von galliumarm bis sehr galliumreich variiert. Mit Molybdän beispielsweise gibt es als galliumarme Verbindung das Mo3Ga mit Cr3Si-Struktur (cP8, P m –3 n), und im galliumreichen Teil des Phasendiagramms existieren eine Reihe von Verbindungen der Zusammensetzung (MoGa5)nGa (n = 4, 6, 8), deren Strukturen im nächsten Kapitel ausführlich beschrieben werden. Das benachbarte Niob bildet sieben binäre Galliumverbindungen mit Zusammensetzungen zwischen Nb3Ga und NbGa3, und mit Vanadium sind neun Verbindungen bekannt, deren V-Ga-Verhältnis von V5Ga bis V8Ga41 variiert. Mit seiner guten Reaktivität gegenüber Übergangsmetallen ist Gallium mit Aluminium vergleichbar, und nimmt mit diesem eine gewisse Sonderstellung unter den niedrigschmelzenden Metallen ein. Die Anzahl verschiedener Übergangsmetallverbindungen mit Zink oder Zinn ist schon wesentlich geringer und lückenhafter, und bei Metallen wie Cadmium und Quecksilber, sowie den schweren Hauptgruppenmetallen Indium, Blei und Wismut sind lediglich einzelne Vertreter bekannt. Galliumreiche und aluminiumreiche Verbindungen mit Übergangsmetallen unterscheiden sich in ihren Strukturen deutlich voneinander. Gallium ist in diesen Strukturen größer als Aluminium und neigt zur Ausbildung gerichteter Bindungen mit kovalenten Bindungsanteilen. Aluminium als „klassisches“ Metall hat einen ähnlichen Platzbedarf, wie die meisten Übergangsmetalle, und bildet mit diesen häufig Ordnungsvarianten dichtester Kugelpackungen oder Strukturen mit Ikosaedern. Darin haben die Übergangsmetalle meist die erwartete hohe Koordinationszahl von zwölf. Verbindungen wie WAl12 [21], α-AlMnSi oder MoAl6 [19] [49] haben eine besondere Bedeutung bei der Diskussion ikosaedrischer Quasikristalle, in denen Aluminium ebenfalls einen Hauptbestandteil bildet [55] [56] . 21 J. Adam, J. B. Rich, Acta Cryst. 1954, 7, 813-816 49 M. Cooper, K. Robinson, Acta Cryst. 1966, 20, 614-617 19 H. Hillebrecht, Habilitationsschrift, Freiburg, 1997 55 D. Shechtman, I. Blech, D. Gratias, J. W. Cahn, Phys. Rev. Lett. 1984, 53, 183 56 W. Steurer, Z. Krist. 1990, 190, 179-234 101 4.1. (MoGa5)nGa – Strukturwechsel durch minimale Substitution ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Gallium hingegen liegt aufgrund einiger Eigenschaften schon auf der Grenze zu den Halbmetallen, und unterscheidet sich bereits in seiner Elementstruktur deutlich von seinen metallischen Nachbarn Aluminium und Zink. Während diese in dichtesten Kugelpackungen kristallisieren, in denen bindende Wechselwirkungen zwischen den Atomen weitgehend ungerichtet sind, besitzt das Gallium bereits in seiner Elementmodifikation partiell kovalente Bindungsanteile mit gerichteten Wechselwirkungen, was sich in einem andersartigen Platzbedarf äußert. So ist denn auch in den meisten galliumreichen Verbindungen ein Trend zu niedrigen Koordinationszahlen von 8, 8 + 2 oder 10 für das Übergangsmetall zu beobachten. Das am häufigsten auftretende Strukturmotiv in galliumreichen Verbindungen ist der Würfel, der in vielfältigen Varianten auftritt. Dies betrifft sowohl die Geometrie (regulär oder verzerrt), die nächste Koordinationssphäre (isoliert oder überkappt), als auch die Verknüpfungsmöglichkeiten der vom Übergangsmetall oder bisweilen auch von Gallium zentrierten Würfel. Flächenverknüpft findet er sich beispielsweise in FeGa3 (eigener Typ)[32] oder im CuGa2 (FeSi2Typ)[57], kantenverknüpft im PtGa2 (CaF2-Typ)[22], eckenverknüpft im ReGa4 (PtHg4-Typ)[58]. Zweifach überkappte Würfel enthält das PdGa5 (eigener Typ)[59], dreifach überkappte Würfel das Mo2Cu3Ga8[8], das eine Auffüllungsvariante des ReGa4 darstellt, und vierfach überkappte verzerrte Würfel sind im CuGa2 enthalten. Auch Strukturelemente mit fünfzähliger Symmetrie sind in vielen galliumreichen Verbindungen enthalten, beispielsweise im V2Ga5 (Mn2Hg5-Typ)[60], das aus Netzen aufgebaut ist, die Fünfecke enthalten und – übereinandergestapelt – pentagonale Prismen bilden. Durch Kombination von Würfel und Ikosaeder entsteht ein sogenanntes Zentaur-Polyeder, das sich durch entsprechende Verzerrung auch aus einem zweifach überkappten Würfel herleiten lässt. Dieses Polyeder ist in allen Verbindungen des Typs (MoGa5)nGa enthalten. 32 W. B. Pearson, The Crystal Chemistry and Physics of Metals and Alloys, Wiley, New York, 1972 57 M. El-Boragy, K. Schubert, Z. Metallkde. 1972, 63, 53-53 22 E. Zintl, A. Harder, W. Haucke, Z. phys. Chem. 1937, 35B, 354-362 58 H. Hillebrecht, V. Kuntze, 12th Int. Conf. Solid Comp. Trans. Met., St. Malo, 1997 59 Yu. Grin, K. Peters, H. G. von Schnering, Z. Krist. 1997, 212, 6 8 V. Kuntze, Dissertation, Bonn, 1990 60 Lu Hsueh-shan, Liang Ching-kwei, Chinese Physics, Peking, transl. W. Xuebao, 1965, 21, 1281-1293 102 4. Galliumreiche Verbindungen ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Abb. 4.1: Beispiele von Variationen und Spielarten des Würfels und deren Verknüpfungen grau; ÜM: in galliumreichen Verbindungen mit Übergangsmetallen. Gallium: schwarz. Ergänzende Erläuterungen im vorhergehenden Textabschnitt. 103 4.1. (MoGa5)nGa – Strukturwechsel durch minimale Substitution ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Die Auswahl der in Abb. 4.1 dargestellten Verbindungen, in denen Ga-Würfel als Strukturmotiv auftreten, ist keineswegs vollständig, sondern soll einige charakteristische Beispiele wiedergeben und wurden auch im Hinblick auf die noch zu besprechenden Verbindungen zusammengestellt. Besonders die auf der rechten Seite der Übersicht dargestellten Verbindungen Mo2Cu3Ga8, V2Ga5, CuGa2 und Mo8Ga41 enthalten Strukturmotive, die direkt, oder in abgewandelter Form in der neuen kubischen Verbindung V11Cu9Ga46 auftreten, deren ausführliche Beschreibung in Kapitel 4.2.2 erfolgt. Die Beschriftung entlang der Pfeile beschreibt die „Gestalt“ des Würfels und Art der Verknüpfung untereinander. 4.1. (MoGa5)nGa: Strukturwechsel durch minimale Substitution Intermetallische Verbindungen zwischen Molybdän und Gallium sind seit 1958 bekannt. Allerdings herrschte einige Zeit Unklarheit bezüglich Zusammensetzung und Struktur der beiden Verbindungen Mo6Ga31 und Mo8Ga41, die man ursprünglich für eine einzige Verbindung der Zusammensetzung ~MoGa5 hielt. Immerhin unterscheiden sich die beiden Verbindungen in ihrer Zusammensetzung nur um zehntel Prozent, und eine eindeutige Charakterisierung gelang erst anhand von Einkristallen. Später konnte eine dritte, allerdings bisher nur pseudobinäre Verbindung, das Mo4Ga20X, und im Rahmen dieser Arbeit eine weitere Modifikation des Mo6Ga31 gefunden werden, das eine Variante der oben genannten Verbindung und strukturchemisch eine Art Bindeglied zwischen dem „Mo4Ga21“ und dem Mo8Ga41 darstellt. Um die etwas verwirrenden Zusammenhänge zu entschlüsseln, soll an dieser Stelle zunächst ein Literaturüberblick über das System Mo-Ga gegeben werden. Vor der Besprechung der eigenen Ergebnisse werden die wichtigsten Strukturmerkmale dieser bemerkenswerten Familie an binären und pseudobinären galliumreichen Verbindungen des Molybdäns erläutert, die im Grunde genommen komplexe Überstrukturen der kubisch innenzentrierten Kugelpackung darstellen und wieder nach hierarchischem Prinzip strukturiert sind. 104 4. Galliumreiche Verbindungen ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ B. T. Matthias et al. fanden 1958 bei Untersuchungen im System Molybdän-Gallium neben dem Mo3Ga (Cr3Si-Typ) eine Verbindung der Zusammensetzung MoGa4, die aber nicht näher charakterisiert wurde[61]. J. D. Bornand et al. konnten die Verbindung einige Jahre später ebenfalls synthetisieren, indem sie die Metalle im Lichtbogen aufschmolzen und mehrere Wochen lang temperten. Sie gaben die Zusammensetzung MoGa4,5-5,5 an, konnten allerdings das komplizierte Pulverdiagramm nicht indizieren[62]. K. Yvon gelang Mitte der siebziger Jahre des vorigen Jahrhunderts die Züchtung von Einkristallen und deren strukturelle Charakterisierung. Dabei stellte sich heraus, dass es sich bei dem „MoGa5“ um mindestens zwei Verbindungen handelt, die sich mit der gemeinsamen Summenformel (MoGa5)nGa mit n = 6 und 8 formulieren lassen. Mo6Ga31 kristallisiert monoklin in der Raumgruppe P 21 /c[41], das Mo8Ga41 rhomboedrisch in der Raumgruppe R -3 [42] und ist isotyp zu V8Ga41 [63]. 1983 erschienen erstmals Berichte einer polnischen Arbeitsgruppe über substituierte Verbindungen der Zusammensetzung Mo6Ga30M mit M = Cu, Ag, Au, die jedoch die rhomboedrische Struktur des Mo8Ga41 haben sollten[64]. Des weiteren wurde eine tetragonale Variante Mo8Ga40E mit E = S, Se Te, deren Charakterisierung anhand von Einkristalldaten für die Schwefelverbindung gelang[65]. 1996 erhielt V. Kuntze eine ternäre Verbindung MoSnGa4, welche die gleiche Metrik wie die von M. Wolcyrz et al. beschriebene Verbindung aufweist. Dieses MoSnGa4 bildet eine Substitutionsreihe mit der Zusammensetzung Mo4Ga21-5xSn4x (0.45 < x < 1), deren hypothetische Grenzformel Mo4Ga21 lautet[66]. Diese Verbindung mit tetragonaler Symmetrie (RG: I 4/m) ist damit der dritte Vertreter der Reihe mit der Summenformel (MoGa5)nGa mit n = 4. Die binäre Grenzverbindung Mo4Ga21 konnte bisher allerdings noch nicht synthetisiert werden, dafür aber Verbindungen wie Mo4Ga20Sb und W4Ga20Sb. 61 A. Wood, V. B. Compton, B. T. Matthias, E. Corenzwit, Acta Cryst. 1958, 11, 604 62 J. D. Bornand, R. E. Siemens, L. L. Oden, J. Less-Common Met. 1973, 30, 205 41 K. Yvon, Acta Cryst. 1974, B30, 853-861 42 K. Yvon, Acta Cryst. 1975, B31, 117-120 63 K. Girgis, W. Petter, G. Pupp, Acta Cryst. 1975, B31, 113-116 64 R. Horyn, R. Andruszkiewicz, J. Less-Common Met. 1983, 91, L5-L7 65 M. Wolcyrz, R. Andruszkiewicz, K. Lukaszewicz, Acta Cryst. 1989, C45, 991-993 66 V. Kuntze, Diplomarbeit, Freiburg, 1996 105 4.1. (MoGa5)nGa – Strukturwechsel durch minimale Substitution ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Bei den oben beschriebenen substituierten Mo6Ga30E und Mo8Ga40M wird formal dasjenige Gallium durch Metall bzw. Chalkogen ersetzt, welches in der Formel (MoGa5)nGa außerhalb der Klammer steht. Die etwas ungewöhnliche Summenformel des tetragonalen Mo4Ga21-5xSn4x ergibt sich daraus, dass hier keine 1:1-Substitution, sondern der Ersatz von vier Sn- gegen fünf Ga-Atome innerhalb komplexer Baueinheiten stattfindet. Dadurch wird das Grundgerüst der Kristallstruktur aber nicht grundsätzlich beeinflusst. Die Unstimmigkeiten zwischen Summenformel und Struktur in den substituierten Verbindungen Mo6Ga30M von R. Horyn und Mo8Ga40E von M. Wolcyrz ist möglicherweise darauf zurückzuführen, dass die molaren Zusammensetzungen der drei Verbindungen fast identisch sind, und sich nur um einige zehntel Prozent voneinander unterscheiden. Ein Blick in das Phasendiagramm Mo-Ga zeigt, wie eng die Existenzbereiche der drei Verbindungen sind. Der Vollständigkeit halber sei hier vermerkt, dass die Beschriftung der Phasen Mo6Ga31 und Mo8Ga41 falsch ist und vertauscht werden muss, da das Mo8Ga41 die galliumärmste der drei Verbindungen ist, wie auch aus Tab. 4.1 zu entnehmen ist. „Mo4Ga21“ Abb. 4.2: binäres Phasendiagramm Mo-Ga nach Massalski[67]. Die Kennzeichnung der Phasen Mo6Ga31 und Mo8Ga41 ist falsch und muss vertauscht werden, da das Mo8Ga41 die galliumärmste der drei Verbindungen (MoGa5)nGa ist. Der Übersicht halber ist auch das binäre „Mo4Ga21“ mit eingezeichnet. 67 T. B. Massalski (Hrsg.), Binary Alloy Phase Diagramms, ASM, Metals Park, Ohio, 1986 106 4. Galliumreiche Verbindungen ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Die Frage, welche Faktoren für die Bildung einer der drei Strukturen verantwortlich ist, ob es ein binäres Mo4Ga21 gibt, und in wie weit sich der Charakter des Fremdelements in den Verbindungen auf die Struktur auswirkt – immerhin beträgt die Substitution des „zusätzlichen“ Galliums nur 2 - 4% der Gesamtzusammensetzung – wurde in den umfangreichen Arbeiten von V. Kuntze erstmals untersucht[8]. Summenformel % Mo % Ga % zusätzliches Ga “Mo4Ga21” 16.00 84.00 4.00 Mo6Ga31 16.22 83.78 2.70 Mo8Ga41 16.33 83.67 2.04 Tab. 4.1: Zusammensetzung der drei Verbindungen (MoGa5)nGa Als Ergebnis der Substitutionsversuche ergab sich dabei ein recht übersichtliches Bild: Der Einbau von Metallen führt zur Bildung des rhomboedrischen Mo8Ga40X, wogegen der Einbau von Nichtmetallen das tetragonale Mo4Ga20X ergibt. Erste Hinweise zu diese Tendenz sind bereits in den Arbeiten von R. Horyn und M. Wolcyrz zu finden, und konnten hier vollauf bestätigt werden. An der Grenze Metall-Nichtmetall entsteht als neue Variante das monokline Mo6Ga31 für Gallium und abweichende Substitutionsmuster für das tetragonale „Mo4Ga21“ bei Zinn und Indium. Im Rahmen dieser Arbeit sollten die Ergebnisse vervollständigt und gegebenenfalls erweitert werden, da auf der einen Seite einige Mo-Ga-Element-Kombinationen noch zu untersuchen waren, und auf der anderen Seite nicht auszuschließen war, dass diese strukturell variablen Verbindungen noch weitere Varianten bilden. Vor der Diskussion der eigenen Ergebnisse ist es sicher sinnvoll, die wichtigsten Strukturelemente der Verbindungen (MoGa5)nGa zu erläutern. 8 V. Kuntze, Dissertation, Bonn, 1999 107 4.1. (MoGa5)nGa – Strukturwechsel durch minimale Substitution ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ 4.1.1. Gemeinsame Strukturmerkmale in Mo8Ga41, Mo6Ga31 und „Mo4Ga21“ Bei hochgeordneten intermetallischen Verbindungen mit stark unterschiedlichem stöchiometrischem Verhältnis der Metalle untereinander werden die Kristallstrukturen meist überwiegend von den Koordinationsverhältnissen der Minderkomponente bestimmt. Trotz unterschiedlicher Zusammensetzung und Symmetrie enthalten die Kristallstrukturen der drei Verbindungen alle die gleichen Strukturelemente, die durch die Koordinationspolyeder der Mo-Atome gebildet werden. Die Molybdänatome sind in Form eines sogenannten Zentaur-Polyeders von zehn Galliumatomen umgeben, die ihrerseits durch eine Verknüpfung über gemeinsame Spitzen zu je zwei Polyedern gehören, woraus sich die Zusammensetzung MoGa10/2 = MoGa5 ergibt. Das zusätzliche Gallium in der Summenformel (MoGa5)nGa nimmt also nicht an diesen Polyedern teil. Das Zentaur-Polyeder besteht aus einer Würfel- und einer Ikosaederhälfte, und erhielt seinen Namen wegen seiner „zwitterartigen“ Gestalt in Anlehnung an das aus der griechischen Mythologie bekannte Fabelwesen gleichen Namens. In idealer Form besitzt es drei Vierecks- und zehn Dreiecksflächen und hat die Punktsymmetrie 3m (C3v nach Schönflies). Der Name für dieses Polyeders wurde von D. J. M. Bevan aus der Arbeitsgruppe von H. Bärnighausen vorgeschlagen[68]. Ga Mo Ga Mo Abb. 4.3: Koordinationspolyeder von Molybdän in Mo8Ga41 und Mo6Ga31 aus einem halben Würfel und einem halben Ikosaeder. (Stereobild) 68 H. Bärnighausen, persönliche Mitteilung 108 4. Galliumreiche Verbindungen ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Jeweils acht dieser Koordinationspolyeder sind über gemeinsame Ecken zu einem leicht verzerrten Würfel verknüpft, in dessen Zentrum sich das zusätzliche Gallium befindet. Dieses Gallium ist kuboktaedrisch von zwölf Galliumatomen umgeben, da die Verknüpfung zum Würfel über die Ikosaederhälfte der Zentauren erfolgt, und ist die einzige Ga-Position ohne direkte Kontakte zu Molybdän. Abb. 4.5: Koordinationspolyeder des „zusätzlichen“ Galliums im Zentrum der Würfel aus Zentauren. Abb. 4.6: Je acht MoGa10-Polyeder bilden einen leicht verzerrten Würfel um das zusätzliche Gallium. Der Kuboktaeder um dieses Gallium ist rot hervorgehoben. (Stereobild). 109 4.1. (MoGa5)nGa – Strukturwechsel durch minimale Substitution ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Die verschiedenen Summenformeln Mo8Ga41, Mo6Ga31 und „Mo4Ga21“, ergeben sich aus dem unterschiedlichen Kondensationsgrad dieser Würfel und korrespondieren direkt mit dem Verhältnis „zusätzliches Gallium zu n“. Im rhomboedrischen Mo8Ga41 mit n = 8 bezüglich der Summenformel (MoGa5)nGa sind dies isolierte Würfel, im monoklinen Mo6Ga31 sind es Paare von Würfeln bzw. Doppelwürfel und im tetragonalen „Mo4Ga21“ sind es schließlich Stränge von solchen Würfeln (Abb. 4.7) Tab. 4.2: Zusammenhang zwischen Summenformel und Strukturmotiv in (MoGa5)nGa Summenformel Mo8Ga41 Verhältnis (MoGa5) : Ga 8:1 isolierte Würfel Mo6Ga31 12 : 2 = 6 : 1 Paare von Würfeln Mo4Ga21 4n : n = 4 : 1 Ketten von Würfeln Abb. 4.7: isolierte Würfel im rhomboedrischen Mo8Ga41, Doppelwürfel im monoklinen Mo6Ga31 und Stränge von Würfeln im tetragonalen „Mo4Ga21“ 110 Strukturmotiv 4. Galliumreiche Verbindungen ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ 4.1.2. Mo6Ga31 – triklin; eine neue Variante zum monoklinen Mo6Ga31 Da ein Strukturwechsel vom rhomboedrischen Mo8Ga41 bzw. von den substituierten Verbindungen Mo8Ga40X zum tetragonalen Mo4Ga20X nach bisherigen Erkenntnissen offensichtlich durch den Charakter des Fremdelements – Metall oder Nichtmetall – bestimmt wird, ist es sicher interessant, den Einfluss von Elementen noch einmal eingehend zu untersuchen, die an der Grenze zwischen diesen beiden Polen stehen, den Halbmetallen. Bei Elementen wie Germanium, Arsen, Antimon und Tellur bildete sich bisher immer die tetragonale Struktur des Mo4Ga20X, die je nach Fremdelement eine gewisse tetragonale Verzerrung (Verlängerung in c-Richtung) der Umgebung der substituierten Position ergab[8]. Dadurch erniedrigt sich die Koordination des Fremdelements von 12 auf 4 + 8, was auch im Einklang mit einem mehr kovalenten Bindungscharakter Ga-X und den eher niedrigeren Koordinationszahlen der entsprechenden binären Verbindungen wie z.B. GaAs oder GaSe steht. Im Folgenden soll über sie Untersuchungen der Systeme Molybdän-Gallium mit den Elementen Silizium, Sauerstoff und Iod berichtet werden, die bisher noch nicht untersucht wurden. Interessant bezüglich der Frage, in wie weit sich der Metall- bzw. der Nichtmetallcharakter auf die Struktur auswirkt, sind dabei vor allem die Elemente Silizium und Iod, die auf der Grenzlinie der Halbmetalle im Periodensystem stehen. Aus einer Schmelze Mo-Ga-Si der molaren Zusammensetzung 1 : 10 : 1 konnten bei einer Reaktionstemperatur von 1000°C und Abkühlung auf Raumtemperatur mit 2°/h nach Entfernung des überschüssigen Metalls mit verdünnter wässriger HCl wenige metallisch glänzende, unregelmäßig geformte Plättchen isoliert werden, von denen einige eine Kantenlänge von bis zu 0.5 mm hatten. Röntgenographische Untersuchungen dieser Kristalle mit dem IPDS und dem Vierkreisdiffraktometer ergaben stets eine Zelle mit trikliner Symmetrie und den Gitterkonstanten: a = 9.5579(19) Å α = 87.26(3) ° b = 9.5619(19) Å β = 80.87(3) ° c = 14.6256(29) Å γ = 85.43(3) ° 3 V = 1314.7 Å 8 V. Kuntze, Dissertation, Bonn, 1999 111 4.1. (MoGa5)nGa – Strukturwechsel durch minimale Substitution ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Dieser Befund war zunächst etwas überraschend, da die Kristallstrukturen mit hochorganisierten Baugruppen, wie sie in den bisher untersuchten Systemen stets auftraten, eher in höher symmetrischen Raumgruppen kristallisieren. Zudem sind auch noch zwei Gitterkonstanten ( a und b) vergleichbar mit der a-Achse des monoklinen Mo6Ga31, und das Zellvolumen der triklinen Verbindung ist etwa halb so groß, wie das der monoklinen Verbindung, dessen Gitterparameter hier zum Vergleich angegeben sind, so dass nicht auszuschließen war, dass es sich dabei um ein monoklines Mo6Ga31 handelt. Gitterparameter des monoklinen Mo6Ga31: a = 9.496 Å β = 95.13 ° b = 16.043 Å c = 16.978 Å V = 2675.2 Å3 Von einem Kristall konnte mit einem Datensatz aus 8669 unabhängigen Reflexen ein Strukturmodell in der Raumgruppe P-1 entwickelt werden, das bei Zuverlässigkeitswerten von R1(F) = 0.0907 und wR2(I) = 0.239 sehr schnell konvergierte. Obwohl kein konkretes Strukturmodell vorlag, konnte aufgrund des Zellvolumens und der Atomvolumina der Metalle zumindest die Anzahl der Atome pro Elementarzelle abgeschätzt werden. Mit einem mittleren Atomvolumen von 17.3 Å3 für Metalle und einem Zellvolumen von 1314.69(1) Å3 sollten in der Raumgruppe P-1 mit partieller Besetzung der einzähligen Lagen etwa 36 bis 40 kristallographische Lagen vorhanden sein. Die Modellsuche mit SHELX 97 (direkte Methoden) ergab nach den üblichen Korrekturen dann auch vier Mo-Positionen und 35 Ga-Positionen (= 39 Lagen) neben einigen unbestimmten Positionen mit geringer Restelektronendichte. Bei der weiteren Verfeinerung konnten zwei der Galliumpositionen mit sehr niedrigen Temperaturfaktoren als Molybdän identifiziert werden. Mit diesen Werten – sechs Mo-Positionen, jeweils auf 2i – und 33 GaPositionen (vier Gallium auf den Lagen 1a, 1e 1f, und 1g, sowie 29 Gallium auf der allgemeinen Lage 2i) war die Verfeinerung damit im Prinzip abgeschlossen. Angaben zur Struktur sind in Tabelle 4.3 und 4.4 ab Seite 121 aufgeführt. 112 4. Galliumreiche Verbindungen ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Die relativ hohen R-Werte deuten dabei lediglich auf eine nicht sehr gute Kristallqualität hin, das Modell an sich wird dadurch allerdings nicht in Frage gestellt, wie die Vermessung von mehr als einem Dutzend Kristallen ergab. Nach den Ergebnissen der röntgenographischen Strukturanalyse handelt es sich um eine binäre Molybdän-Gallium-Verbindung mit der Zusammensetzung Mo6Ga31 und zwei Formeleinheiten pro Elementarzelle. Die Verbindung enthält demnach kein Silizium, was auch durch EDX-Analysen an mehreren Kristallen bestätigt werden konnte. 100µm Abb. 4.4: REM-Bild eines Einkristalls des triklinen Mo6Ga31. 113 4.1. (MoGa5)nGa – Strukturwechsel durch minimale Substitution ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ 4.1.2.1. Strukturdiskussion Das trikline Mo6Ga31 ist wie die monokline Struktur aus den gleichen Strukturelementen aufgebaut. In beiden Verbindungen sind jeweils zwölf Zentaur-Polyeder derart angeordnet, dass die Molybdänatome in den Zentren der Koordinationspolyeder einen leicht verzerrten Doppelwürfel bilden. Im Vergleich zur Elementarzelle des monoklinen Mo6Ga31 handelt es sich hier tatsächlich um eine Halbierung des Zellvolumens und damit natürlich auch der Zahl der Formeleinheiten pro Zelle. Die Parallele zeigt sich sehr schön in der Verteilung der Mo-Lagen beider Verbindungen. Im monoklinen Mo6Ga31 werden sechs MoPositionen auf der allgemeinen Lage 4e der Raumgruppe P 21 / c besetzt (24 Mo-Atome = 4 Formeleinheiten / Zelle), im triklinen Mo6Ga31 sind es sechs Mo-Positionen auf der allgemeinen Lage 2i der Raumgruppe P-1 (12 Mo-Atome = 2 Formeleinheiten / Zelle). c a b Mo Ga Abb. 4.8: Elementarzelle und Doppelwürfel aus Zentauren im triklinen Mo6Ga31. Beide Darstellungen zeigen den gleichen Ausschnitt. 114 4. Galliumreiche Verbindungen ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Ga1 Ga1 c c a b a b Mo6Ga31 – monoklin “Mo4Ga21” – tetragonal Mo6Ga31 – triklin Mo8Ga41 - rhomboedrisch Abb. 4.9: Anordnung der durch die Mo-Atome beschriebenen Würfel in den Verbindungen (MoGa5)nGa 115 4.1. (MoGa5)nGa – Strukturwechsel durch minimale Substitution ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Der Unterschied zwischen beiden Kristallstrukturen liegt in der verschiedenen Anordnung dieser Doppelwürfel untereinander. Betrachtet man nur die Würfel, die von den MoAtomen gebildet werden (Abb. 4.9), sind im monoklinen Mo6Ga31 benachbarte Doppelwürfel in Richtung der a-c-Ebene jeweils um 90° gegeneinander verdreht, während in der triklinen Struktur alle Doppelwürfel die gleiche Orientierung aufweisen. In Abb. 4.9 sind die analogen Darstellungen bezüglich der Verknüpfung von Mo-Würfeln für Mo8Ga41 und „Mo4Ga21“ ebenfalls gezeichnet. Man erkennt im „Mo4Ga21“ die Ketten der flächenverknüpften Mo8-Würfel in Richtung der c-Achse, und die isolierten Mo8-Würfel im rhomboedrischen Mo8Ga41. Ein genauer Vergleich ergibt, dass die Mo12-Doppelwürfel im triklinen Mo6Ga31 in der gleichen Art und Weise zueinander angeordnet sind, wie die isolierten Mo8-Würfel im rhomboedrischen Mo8Ga41. Die Verknüpfung der aus Molybdän gebildeten Würfel, Doppelwürfel oder Würfelketten innerhalb eines der vier Strukturtypen erfolgt immer nach dem gleichen Prinzip. Betrachtet man einen bestimmten Würfel, so weist eine Kante dieses Würfels jeweils in Richtung der Flächenmitte eines benachbarten Würfels, und damit auch in die Richtung des zentralen Galliums. In den Kristallstrukturen von Mo8Ga41, Mo6Ga31 und „Mo4Ga21“ dominieren also Motive der kubisch-innenzentrierten Kugelpackung nicht nur bzgl. der nächsten Umgebung Mo-Ga, sondern reichen auch noch bis in die nächste und übernächste Koordinationssphäre hinein. Ein Vergleich mit der Struktur des CsCl als einfachste Möglichkeit, Atome von zwei verschiedenen Elementen im Sinne einer kubischinnenzentrierten Kugelpackung anzuordnen, zeigt dabei einige Parallelen aber auch Unterschiede. Bei den folgenden Betrachtungen sollen der Übersicht wegen nur die Strukturmotive der Ga-zentrierten Mo-Würfel betrachtet werden; die umgebende Matrix der übrigen Ga-Atome ist dabei ohne Bedeutung. In der oben beschriebenen Betrachtungsweise wird in der CsCl-Struktur das eine Teilgitter in das Andere überführt, während im Mo8Ga41 (als Beispiel) an dieser Stelle wiederum ein Ga-zentrierter Mo8-Würfel erscheint (Abb. 4.10, folgende Seite). Im Prinzip wird aber das gleiche Strukturmotiv wie im CsCl-Typ realisiert, nur die Dekoration der Positionen im Gitter ist in beiden Strukturen unterschiedlich. In beiden Fällen haben aber die Zentralatome eines Würfels die für die kubisch-innenzentrierte Kugelpackung typische Koordinationszahl 8 + 6. 116 4. Galliumreiche Verbindungen ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ CsCl-Typ Mo8Ga41 Abb. 4.10: Vergleich der CsCl-Struktur (links) mit analogen Baugruppen im (MoGa5)nGa (rechts), hier am Beispiel des Mo8Ga41. Dort sind nur die Ga-zentrierten Mo8Würfel gezeichnet Die Ähnlichkeiten zum CsCl-Typ sind damit aber noch nicht erschöpft. Zur ersten Koordinationssphäre der CsCl-Struktur zählt man üblicherweise die Zentren der Nachbarwürfel mit, da diese nur etwa 15% weiter vom Zentralatom entfernt sind, als die acht Atome des Würfels selbst. Diese weiter entfernten Atome bilden für sich betrachtet einen Oktaeder. Sucht man im Mo8Ga41 die Lage der Ga-Atome in den Zentren der voneinander isolierten GaMo8-Nachbarwürfel, erkennt man, dass diese ebenfalls einen Oktaeder bilden, der aber bzgl. der Orientierung nicht senkrecht auf den Würfelflächen liegt, sondern um den Winkel von 22.55° gegenüber dem zentralen GaMo8-Würfel verkippt ist. Das Strukturmotiv des CsCl-Typs ist also im Prinzip auch diesbezüglich noch vorhanden, wenn auch verbunden mit einer Verzerrung und einer Skalierung, die durch das Vorhandensein der Würfel aus Zentauren zustande kommt. In Abb. 4.11 sind die vergleichbaren Koordinationsverhältnisse für die CsCl-Struktur und das Mo8Ga41 dargestellt. Das Mo6Ga31 hat diesbezüglich ineinander gestellte Doppeloktaedern und das „Mo4Ga21“ Stränge von ineinander gestellten Oktaedern. Im Rahmen der Strukturanalyse des monoklinen Mo6Ga31 berichtete K. Yvon über die Probleme bei der Modellsuche durch die hohe Pseudosymmetrie, die auf die kubisch innenzentrierte Anordnung der Polyeder zurückzuführen ist. 117 4.1. (MoGa5)nGa – Strukturwechsel durch minimale Substitution ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Abb. 4.11: Lage der Zentren (blaue Kugeln) benachbarter Würfel im CsCl (links) und im Mo8Ga41 (rechts) Das Verknüpfungsprinzip der Würfel untereinander gilt analog auch für die beiden Kristallstrukturen des Mo6Ga31 und für das „Mo4Ga21“: jede Kante eines Würfels, sei es nun die eines Doppelwürfels (Mo6Ga31) oder die eines Würfelstranges („Mo4Ga21“), zeigen in ihrer Verlängerung auf die Flächenmitte eines benachbarten Würfels. Das trifft im übrigen für jede einzelne Würfelkante zu und ist unabhängig vom Kondensationsgrad der Würfel in den einzelnen Strukturen. Damit beinhalten die Strukturen Baublöcke mit Motiven der kubisch-innenzentrierten Kugelpackung, die jeweils um eine halbe Würfeldiagonale gegeneinander versetzt sind. Wie eingangs des Kapitels bereits erwähnt, stellt das trikline Mo6Ga31 strukturchemisch gesehen eine Art Bindeglied (oder eine „Brücke“) zwischen dem Mo8Ga41 und der Struktur des „Mo4Ga21“ dar. Die von den Mo-Atomen gebildeten Doppelwürfel haben in der triklinen Verbindung alle die gleiche Orientierung, während sie in der monoklinen Verbindung in einer Raumrichtung jeweils alternierend um 90° verkippt sind. Die Versetzung benachbarter Doppelwürfel erfolgt im triklinen Mo6Ga31 dabei wie im rhomboedrischen Mo8Ga41 jeweils um eine halbe Würfeldiagonale. Damit sind die Verknüpfungsmuster beider Verbindungen gleich, wenn man gedanklich einen isolierten Würfel im Mo8Ga41 durch einen Doppelwürfel des triklinen Mo6Ga31 ersetzt. In Abb. 4.12 sind die Verknüpfungsmuster beider Verbindungen schematisch dargestellt. Die zweite rechts dargestellte Verknüpfung, die immerhin möglich wäre, wird dabei nicht realisiert. Mit 118 4. Galliumreiche Verbindungen ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ diesem Verknüpfungsmuster haben das trikline und das monokline Mo6Ga31 dahingehend gemeinsame Strukturmerkmale, dass im monoklinen Mo6Ga31 die Verknüpfung der Doppelwürfel in gleicher Weise erfolgt. Weitere Kondensationen von Doppelwürfeln zu beispielsweise einer kurzen Kette aus Viererwürfeln würden zu einer Verbindung der Zusammensetzung Mo5Ga26 führen, und das Ende solcher Kondensation ist die Struktur des „Mo4Ga21“ mit seinen „unendlichen“ Strängen aus Würfeln. Für das „Mo4Ga21“ als Endglied einer derartigen hypothetischen Kondensationsreihe wäre es natürlich egal, ob die Verknüpfung der Doppelwürfel bei der in der triklinen Verbindung realisierten Weise oder in der in Abb. 4.12 rechts in grau dargestellten Weise beginnt, da am Ende sowieso die „unendliche“ Kette steht. Die im (MoGa5)nGa realisierten Verknüpfungsmuster der unterschiedlich dimensionierten Würfeleinheiten zeigen einmal mehr die Tendenz von hoch organisierten Strukturen, sich nach möglichst einheitlichen Anordnungen von Strukturmotiven nach ähnlichen Motiven zu gruppieren, wobei das trikline Mo6Ga31 bezüglich dieser Vorgabe sowohl Merkmale des Mo8Ga41, als auch seines Pendants, des monoklinen Mo6Ga31 zeigt, und schließlich, aufgrund der gleichen Orientierung der Baueinheiten, gewisse Ähnlichkeiten mit der Struktur des „Mo4Ga21“ hat. Abb. 4.12: Verknüpfung der GaMo8-Würfel im Mo8Ga41, im triklinen Mo6Ga31 und „Mo4Ga21“. Die grau dargestellte Möglichkeit wird nicht realisiert. Mo8Ga41 triklines Mo6Ga31 “Mo4Ga21” 119 4.1. (MoGa5)nGa – Strukturwechsel durch minimale Substitution ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Abb. 4.13: Analoge Anordnung der isolierten Würfel im Mo8Ga41 (links) und der Doppelwürfel im triklinen Mo6Ga31 (rechts) Abb. 4.14: Verknüpfung der GaMo8Würfel im „Mo4Ga21“ (links) und im monoklinen Mo6Ga31 (rechts) 120 4. Galliumreiche Verbindungen ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Tab. 4.3: Angaben zur Strukturbestimmung des triklinen Mo6Ga31 Rel. Molmasse Kristallsystem Raumgruppe Zellabmessungen 2736.96 g/mol triklin P –1 (Nr. 2) a = 9.5579(19) Å b = 9.5619(19) Å c = 14.6256(29) Å α = 87.26(3) ° β = 80.87(3) ° γ = 85.43(3) ° Zellvolumen Anzahl der Formeleinheiten Röntgendichte Messtemperatur Diffraktometer Röntgenstrahlung F ( 0 0 0) Messbereich h, k, l max. 2θ Mess- / Scanmodus I / σ(I)-Verhältnis Messwerte davon unbeobachtet unabhängige Reflexe davon mit I > 0 davon mit I > 2σ(I) Kristallform Kristallabmessungen Absorptionskorrektur Interner Standard Schwächungskoeffizient Extinktionskoeffizient (SHELX98) Restelektronendichte Wichtungsfunktion Zahl der Parameter R- Werte V = 1314.69 Å3 2 6.914 g/cm3 20°C STOE IPDS Mo Kα1 Graphit-Monochromator 2426.0 ±14; ±14; ±21 66° 100 Platten à 15 min bei 2° ϕ-Inkrement 6.0 18351 12 8669 8669 3814 triklines Plättchen 0.1 * 0.15 * 0.02 mm3 numerisch; Equivalent-Methode 0.1173 (0.1563) 32.99 mm-1 0,1164 + 5.75; -3.82 (0.88) e/ Å3 1 / [σ2 * F02 + (0,1143 * P) 2] mit P = (F02 + 2 * Fc2) / 3 341 R1(F) = 0.0907; wR2(I) = 0.2394 121 4.1. (MoGa5)nGa – Strukturwechsel durch minimale Substitution ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Tab. 4.4: Strukturdaten zum triklinen Mo6Ga31 Summenformel Kristallsystem Raumgruppe Gitterkonstanten Mo6 Ga31 triklin P -1 (Nr. 2) a = 9.5579(19) Å b = 9.5619(19) Å c = 14.6256(29) Å α = 87.26(3) ° β = 80.87(3) ° γ = 85.43(3) ° Zellvolumen röntgenographische Dichte Pearson Code Formeleinheiten / Zelle 1314.69(7) Å3 6.914 g/cm3 aP74 2 Atomkoordinaten: Atom Mo1 Mo2 Mo3 Mo4 Mo5 Mo6 Ga1 Ga2 Ga3 Ga4 Ga5 Ga6 Ga7 Ga8 Ga9 Ga10 Ga11 Ga12 Ga13 Ga14 Ga15 Ga16 Ga17 Ga18 Ga19 Ga20 Ga21 Ga22 Ga23 Ga24 Ga25 Ga26 Ga27 Ga28 Ga29 Ga30 Ga31 Ga32 Ga33 Wyck. 2i 2i 2i 2i 2i 2i 2i 1a 1g 1f 1e 2i 2i 2i 2i 2i 2i 2i 2i 2i 2i 2i 2i 2i 2i 2i 2i 2i 2i 2i 2i 2i 2i 2i 2i 2i 2i 2i 2i Symm. 1 1 1 1 1 1 1 -1 -1 -1 -1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 x 0.8427(2) 0.3283(2) 0.3932(2) 0.2689(2) 0.9083(2) 0.2071(2) 0.4719(3) 0 0 1/2 1/2 0.8175(3) 0.3133(3) 0.5305(3) 0.1076(3) 0.5980(3) 0.2700(3) 0.2373(3) 0.8794(3) 0.1399(3) 0.9582(3) 0.0398(3) 0.3317(3) 0.5648(3) 0.0472(3) 0.1528(3) 0.7908(3) 0.2161(3) 0.3953(3) 0.0382(3) 0.2380(3) 0.7319(3) 0.0788(3) 0.7813(3) 0.6278(3) 0.5206(3) 0.3404(3) 0.6964(3) 0.5648(3) y 0.3025(2) 0.1850(2) 0.3053(2) 0.0626(2) 0.4256(2) -0.1713(2) 0.4359(3) 0 1/2 0 1/2 0.1111(3) 0.1603(3) 0.0700(3) 0.2795(3) 0.2098(3) 0.0742(3) 0.0175(3) 0.2696(3) 0.3448(3) 0.4354(3) 0.1501(3) 0.2016(3) 0.1057(3) 0.6292(3) -0.1671(3) 0.4031(3) 0.4396(3) 0.3264(3) 0.0909(3) 0.3417(3) 0.2767(3) 0.2151(3) 0.0488(3) 0.3986(3) 0.1785(3) 0.5679(3) 0.5462(3) 0.3021(3) z 0.4718(1) 0.5921(1) 0.9278(1) 0.2544(1) 0.8088(1) 0.8728(1) 0.3320(2) 0 1/2 1/2 0 0.6081(2) 0.0828(2) 0.6722(2) 0.7068(2) 0.0211(2) 0.9162(2) 0.7381(2) 0.9623(2) 0.8821(2) 0.3263(2) 0.3631(2) 0.4034(2) 0.8532(2) 0.8586(2) 0.2127(2) 0.6464(2) 0.0497(2) 0.7349(2) 0.1749(2) 0.2427(2) 0.3098(2) 0.5356(2) 0.4369(2) 0.8251(2) 0.2157(2) 0.8524(2) 0.4561(3) 0.5195(3) _________________________________________________________________________ 122 4. Galliumreiche Verbindungen ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Tabelle 4.5: Ausgewählte Abstände im triklinen Mo6Ga31. Angegeben sind nur die Abstände Mo-Ga, sowie die des Ga1-Ga (das kuboktaedrisch koordinierte Gallium) Mo1 Ga15 Ga3 Ga28 Ga6 Ga33 Ga27 Ga32 Ga16 Ga21 Ga26 2.566(4) 2.593(3) 2.632(2) 2.636(4) 2.637(2) 2.637(3) 2.640(3) 2.651(5) 2.730(3) 2.773(2) Mo5 Ga15 Ga22 Ga9 Ga13 Ga20 Ga19 Ga14 Ga25 Ga29 Ga21 2.552(4) 2.567(4) 2.585(5) 2.625(3) 2.629(1) 2.634(3) 2.655(3) 2.674(4) 2.685(1) 2.807(2) Mo2 Ga8 Ga4 Ga9 Ga28 Ga32 Ga27 Ga33 Ga12 Ga23 Ga17 2.564(3) 2.588(5) 2.608(4) 2.623(2) 2.635(2) 2.635(2) 2.649(4) 2.681(4) 2.727(3) 2.752(6) Mo6 Ga19 Ga13 Ga24 Ga11 Ga10 Ga12 Ga30 Ga31 Ga26 Ga2 2.573(3) 2.581(3) 2.599(2) 2.601(2) 2.602(3) 2.605(4) 2.714(3) 2.716(3) 2.856(3) 2.944(5) Mo3 Ga5 Ga22 Ga18 Ga14 Ga11 Ga7 Ga10 Ga29 Ga31 Ga23 2.541(3) 2.570(5) 2.580(4) 2.606(2) 2.609(3) 2.638(4) 2.640(3) 2.684(4) 2.736(3) 2.816(7) Ga1 Ga8 Ga18 Ga16 Ga7 Ga6 Ga24 Ga25 Ga20 Ga30 Ga17 2.564(4) 2.575(5) 2.599(4) 2.618(3) 2.619(4) 2.641(3) 2.662(1) 2.675(3) 2.696(3) 2.775(3) Ga23 Ga17 Ga26 Ga21 Ga29 Ga25 Ga31 Ga30 Ga33 Ga32 Ga32 Ga33 2.755(4) 2.778(4) 2.790(4) 2.820(4) 2.966(4) 2.979(3) 2.993(4) 3.022(4) 3.194(4) 3.263(4) 3.285(4) 3.355(5) Mo4 _______________________________________________________________________________________ 123 4.1. (MoGa5)nGa – Strukturwechsel durch minimale Substitution ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Ga21 Ga3 Ga32 Ga6Ga27 Ga27 Ga15 Ga32 Ga33 Ga9 Ga18 Ga17 Ga33 Ga26 Mo6 Ga13 Ga14 Ga19 Ga15 Ga20 Ga26 Mo5 Ga9 Ga24 Ga11 Ga12 Ga2 Ga24 Ga19 Koordinationspolyeder der Mo-Atome im triklinen Mo6Ga31 Ga25 Mo6 Ga32 Ga13 Ga24 Ga11 Ga33 Ga29 Ga32 Ga31 Ga15 Ga24 Ga13 Ga23 Ga27 Ga21 Ga32 Ga28 Ga8 Mo4 Mo2 Mo3 Ga17 Ga33 Ga11 Ga16 Ga17 Ga33 Mo2 Mo1 Ga20 Ga22 Ga8 Ga28 Ga4 Ga3 Ga11 Ga10 Ga33 Ga17 Ga15 Mo6 Ga29 Ga31 Ga32 Ga21 Ga27 Ga2 Mo3 Mo2 Mo1 Ga21 Ga1 Ga30 Ga10 Ga13 Ga22 Ga31 Ga25 Ga7 Ga30 Ga21 Mo4 Ga10 Ga18 Ga11 Ga20 Ga7 Ga8 Abb. 4.15: Ga12 Ga8 Ga29 Ga25 Ga16 Ga6 Ga22 Mo3 Ga23 Ga30 Ga5 Ga29 Ga23 Mo2 Ga16 Ga28 Ga26 Ga17 Ga28 Ga4 Ga14 Mo1 Ga33 Ga31 Ga17 Ga22 Ga8 Ga12 Ga4 Ga23 Ga10 Ga5 Ga22 Ga31 Ga29 Ga10 Mo3 Abb. 4.16: 124 Ga28 Ga21 Ga33 Ga27 Mo1 Ga8 Ga7 Ga6 Ga24 Ga25 Ga30 Ga18 Ga17 Ga30 Ga6 Ga18 Mo4 Mo4 Koordinationspolyeder der Ga-Atome im triklinen Mo6Ga31 4. Galliumreiche Verbindungen ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Mo2 Mo3 Ga23 Ga32 Ga5 Ga27 Ga13 Ga21 Ga28 Ga10 Ga11 Ga30 Ga14 Ga13 Ga22 Ga24 Mo6 Mo1 Mo1 Ga26 Ga32 Ga19 Ga16 Ga10 Ga19 Ga23 Ga32 Ga17 Ga6 Ga25 Ga24 Mo5 Mo4 Mo5 Mo3 Mo5 Ga25 Ga10 Ga29 Ga23 Ga11 Ga27 Ga25 Ga21 Mo3 Mo2 Ga33 Ga16 Ga9 Ga11 Mo6 Ga27 Ga15 Ga19 Ga31 Ga22 Ga31 Ga26 Ga15 Ga14 Ga2 Ga28 Ga3 Ga9 Ga13 Ga11 Ga30 Ga26 Ga2 Mo6 Mo5 Ga29 Ga12 Ga12 Mo6 Mo5 Ga8 Ga11 Ga30 Mo5 Ga14 Ga18 Ga31 Ga20 Ga23 Ga9 Ga7 Ga10 Ga14 Ga15 Ga20 Ga18 Ga7 Ga9 Mo2 Mo3 Ga29 Ga12 Ga15 Ga22 Ga14 Ga9 Ga13 Ga29 Ga21 Ga4 Ga1 Ga18 Ga17 Ga20 Ga16 Ga25 Ga7 Ga8 Ga30 Ga33 Ga32 Ga24 Mo6 Ga13 Ga29 Ga31 Ga7 Ga22 Ga21 Mo4 Mo4 Ga18 Ga14 Ga5 Ga3 Ga6 Ga18 Ga24 Mo3 Mo3 Ga14 Ga31 Ga1 Ga26 Ga31 Mo4 Mo1 Ga6 Ga8 Ga30 Mo4 Ga20 Ga19 Ga25 Ga20 Ga16 Ga23 Ga1 Ga7 Ga24 Ga8 Ga20 Ga29 Ga25 Mo5 Ga15 Ga19 Ga9 Ga25 Ga29 Ga13 Mo5 Ga12 Ga33 Ga32 Ga19 Ga2 Mo2 Mo6 Abb. 4.16: Koordinationspolyeder der Ga-Atome im triklinen Mo6Ga31 (Fortsetzung) 125 4.1. (MoGa5)nGa – Strukturwechsel durch minimale Substitution ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Mo4 Ga30 Ga31 Ga7 Ga17 Mo6 Ga30 Ga28 Ga27 Ga28 Ga3 Ga21 Ga6 Ga15 Ga15 Ga16 Ga33 Mo5 Mo1 Ga32 Mo3 Ga31 Ga23 Ga5 Ga1 Ga23 Ga8 Ga1 Ga10 Ga30 Ga26 Ga10 Ga31 Ga1 Ga23 Ga17 Mo1 Ga33 Ga27 Ga9 Ga32 Ga26 Ga32 Ga1 Ga21 Ga1 Ga26 Ga21 Ga6 Ga28 Ga33 Ga3 Ga15 Ga23 Ga32 Mo1 Ga19 Mo6 Mo6 Mo2 Ga1 Ga31 Ga12 Ga26 Mo5 Ga33 Ga5 Ga14 Ga30 Ga22 Ga20 Ga25 Ga21 Mo3 Ga29 Ga7 Ga29 Ga33 Mo1 Mo4 Ga17 Ga25 Ga26 Ga16 Ga6 Mo1 Ga18 126 Ga12 Ga4 Ga26 Ga22 Abb. 4.16: Ga27 Ga17 Ga17 Ga1 Ga1 Ga9 Ga28 Ga19 Ga25 Ga29 Ga21 Ga32 Ga12 Ga16 Ga1 Mo2 Mo2 Ga8 Ga4 Ga17 Mo2 Koordinationspolyeder der Ga-Atome im triklinen Mo6Ga31 (Fortsetzung) 4. Galliumreiche Verbindungen ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Wie bereits erwähnt, enthält das trikline Mo6Ga31 kein Silizium. In wie weit dieses Element an der Bildung der neuen Variante des Mo6Ga31 beteiligt ist, lässt sich nur schwer abschätzen. Bestätigt wird allerdings die Annahme, dass an der Grenze Metall / Nichtmetall alternative Strukturen zum Mo8Ga41 und „Mo4Ga21“ gebildet werden, und dass der Charakter des Fremdelements den Strukturwechsel durch seine Anwesenheit in der Metallschmelze offenbar bewirkt oder zumindest ermöglicht, auch wenn das Element selbst nicht in der Kristallstruktur vorhanden ist. Die Frage nach dem Verbleib des Siliziums ließ sich auch eindeutig klären. In der Metallschmelze bildete sich eine weitere Verbindung, deren Kristalle sich optisch sehr gut von denen des Mo6Ga31 unterscheiden. Dabei handelt es sich, wie röntgenographische Untersuchungen zeigten, um eine Verbindung der ungefähren Zusammensetzung Mo3Ga2Si4, die in Form sehr schön ausgebildeter, metallisch glänzender hexagonaler Säulen, und Bipyramiden kristallisiert. Die Kristallstruktur bildet eine Splitvariante des CrSi-Typs (P 62 2 2 (a = 4.706(1)Å, c = 6.543(2)Å) und ist wahrscheinlich mit der anhand von Pulverdaten charakterisierten Verbindung identisch, die 1986 von R. Andruszkiewicz und R. Horyn veröffentlicht wurde[69]. Nähere Einzelheiten zu dieser Struktur in Abschnitt 6. Da diese Verbindung bei der Umsetzung der Elemente Mo-Ga-Si in größerer Menge als das Mo6Ga31 entsteht, und zudem röntgenographisch sehr gut streut, sind in den Pulverdiagrammen der untersuchten Ansätze die Linien des Mo6Ga31 nicht eindeutig zu erkennen. 4.1.3. Substitution durch Sauerstoff und Iod Die Systeme Mo-Ga-O sowie Mo-Ga-I sind bisher noch nicht untersucht worden. Dabei sind gerade die beiden Elemente Sauerstoff und Iod interessante Kandidaten hinsichtlich der Frage, in wie weit sich sehr kleine oder sehr große Elemente noch problemlos in die Strukturen integrieren lassen. Zudem liegt das Iod auf der Grenze zwischen Metallen und Nichtmetallen, und wenn der Metallcharakter des Fremdelements ausschlaggebend für die Bildung der unterschiedlichen Strukturen ist, sollte sich das beim Iod bemerkbar machen. 69 R. Andruszkiewicz, R. Horyn, J. Less-Common Met. 1986, 119, 91-97 127 4.1. (MoGa5)nGa – Strukturwechsel durch minimale Substitution ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Für den Versuch, den Sauerstoff mit Molybdän und Gallium umzusetzen, wurde MoO3 eingesetzt, das sich wegen seines niedrigen Schmelzpunktes auch als Flussmittel bei Schmelzreaktionen eignet. Die Reaktion mehrerer Ansätze Mo-Ga-MoO3 in molaren Verhältnissen zwischen 1 : 8 : 1 bis 2 : 12 : 1 erfolgte in evakuierten Quarzampullen bei 1000°C und einer Abkühlrate von 2°/h auf Raumtemperatur. Nach Entfernen des überschüssigen Metalls mit verdünnter wässriger HCl blieben große Mengen an dunkelgrauem feinkristallinem Pulver zurück. Es fand zwar eine Umsetzung statt, wobei sich allerdings phasenrein die molybdänreiche Verbindung Mo3Ga gebildet hatte, wie im Pulverdiagram in Abb. 4.17 zu erkennen ist. Ob der Sauerstoff die Bildung dieser Verbindung beeinflusst, bleibt offen, auch der Verbleib des Sauerstoffs ist unklar. Möglicherweise reagiert er zusammen mit geringen Metallanteilen mit der Gefäßwand, oder es findet eine Redox-Reaktion statt, wobei molekulares O2 entsteht. Ein Blick ins binäre Phasendiagram Mo-Ga zeigt, dass der Anteil an Molybdän in den bisher gewählten Menge zu hoch ist, sofern der Sauerstoff entweicht, und das System tatsächlich binär wird. Anzumerken ist allerdings, dass bei Zusatz anderer Elemente die gewünschte Umsetzung stets bei einem Mo-Ga-Verhältnis von etwa 1 : 8 bis 1 : 10 gelang, ohne dass dabei Mo3Ga entstand. Intensität berechnet gemessen 5 10 20 30 40 50 60 70 2 Theta Abb. 4.17: 128 Gemessenes und berechnetes Pulverdiagramm von Mo3Ga 80 90 4. Galliumreiche Verbindungen ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Die Umsetzungen mit Iod waren hinsichtlich der gewünschten Ergebnisse zwar erfolgreicher, aber auch hier konnten die Verbindungen bislang nur in Pulverform oder in Form stark miteinander verwachsener kleiner Kristalle erhalten werden, so dass röntgenographische Untersuchungen mit dem Einkristalldiffraktometer bisher unmöglich waren. Zudem sind die Linien in einigen Pulverdiagrammen stark verbreitert, was auf schlechte Kristallqualität hinweist. Die Umsetzung mehrerer Ansätze Mo-Ga-I erfolgte in evakuierten Quarzampullen bei einer Reaktionstemperatur von 800°C und einer Abkühlrate von 2°/h auf Raumtemperatur. Von dem Reaktionsprodukt wurde nach Entfernen des überschüssigen Metalls mit verdünnter wässriger HCl jeweils Pulverdiagramme angefertigt, die immerhin eine qualitative und halbquantitative Phasenanalyse ermöglichen. Anhand der Pulverdaten ist zu erkennen, dass sich in wechselnden Anteilen sowohl die Struktur des rhomboedrische Mo8Ga41, als auch die des monoklinen Mo6Ga31 bilden. Eine Interpretation bzgl. der molaren Zusammensetzungen Mo-Ga-I und die Auswirkung auf die Bildung der Struktur ist noch etwas unklar. Es scheint so, dass ein sinkender Anteil an Iod und Gallium in der Schmelze die Struktur des Mo8Ga41 begünstigt. Weitere Untersuchungen in noch galliumreicheren Schmelzen würden sicherlich die Kristallqualität verbessern und die Bildung guter Einkristalle ermöglichen. Wenn sich allerdings auch der Anteil an Gallium entscheidend auf die Bildung der Struktur auswirkt, ist das – möglicherweise Iod enthaltende – Mo6Ga31 offenbar eine nur schwer zugängliche Verbindung, deren Synthese eventuell auf Umwegen über eine quarternäre Schmelze möglich ist. Aufgrund der Pulverdaten ist eine Aussage bezüglich der Substitution des zusätzlichen Gallium durch Iod nur schwer zu treffen. Während die Intensitäten des Pulverdiagramms in Abb. 4.18 oben, das ausschließlich die Linien des binären Mo8Ga41 enthält, gut mit den Literaturdaten übereinstimmt, kann man in Abb. 4.18 im unteren Diagramm Abweichungen in den Intensitäten einiger Reflexe des Mo6Ga31 erkennen, was möglicherweise auf einen Iodgehalt in der Verbindung hindeutet. 129 4.1. (MoGa5)nGa – Strukturwechsel durch minimale Substitution ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Mo8Ga41 Intensität Mo6Ga31 monoklin Mo-Ga-I 15 20 30 40 50 1 : 16 : 1 60 Intensität 2 Theta Mo-Ga-I 15 20 30 40 50 2 : 16 : 1 60 Intensität 2 Theta Mo-Ga-I 15 20 30 40 2 Theta Abb. 4.18: 130 Pulverdiagramme aus drei Ansätzen Mo-Ga-I 50 1 : 10 : 1 60 4. Galliumreiche Verbindungen ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ 4.2. Das System V-Ga-Cu – Varianten der kubisch-innenzentrierten Struktur Vergleicht man die Kristallstrukturen der in den vorhergehenden Kapiteln vorgestellten Verbindungen miteinander, so fallen sofort die verschiedenen Strukturmotive zinkreicher und galliumreicher Verbindungen auf. Während die zinkreichen Verbindungen überwiegend Ordnungsvarianten der dichtesten Kugelpackungen oder Strukturen mit Ikosaedern (als lokal dichteste Packung) bilden, findet man in den entsprechenden galliumreichen Verbindung eher Motive der kubisch-innenzentrierten Kugelpackung. Geringe Zusätze einer weiteren, dritten Komponente stören dieses Konzept nicht grundsätzlich, sondern führen lediglich zu Variationen des einmal realisierten Musters. Der Übergang von zinkreichen zu galliumreichen Verbindungen gestaltet sich – zumindest bei den Molybdänverbindungen – in einer interessanten Weise. Von der zinkreichen Seite kommend, akzeptiert der Strukturtyp Mo7Sn12Zn40 immerhin noch bis zu 50% Gallium, was zum Mo7Ga26Zn26 führt, in dem neben den Zinn- auch Zinkatome durch Gallium ersetzt werden, während man in Strukturen wie Mo6Ga31 oder Mo8Ga41 diese Akzeptanz für Fremdelemente im Galliumgitter nicht, und für „Mo4Ga21“ nur in geringem Maße findet. In dieser Strukturfamilie werden Fremdelemente nur zu einem sehr geringen Anteil und auch nur auf bestimmte Plätze in die Kristallstruktur integriert. Ersetzt man das Zink durch Kupfer, seinen linken Nachbarn im Periodensystem, wird in den galliumreichen Verbindungen wieder ein neues Strukturkonzept verwirklicht, bei dem erstens die Vorliebe des Galliums für die Bildung von Würfeln noch stärker in den Vordergrund rückt, und zweitens das Kupfer als weitere Minderkomponente problemlos in größeren Mengen die Kristallstruktur eingebaut werden kann, wobei der Kupferanteil bisweilen sogar den des Übergangsmetalls übertrifft. Erste Untersuchungen in Systemen ÜM-Ga-Cu mit Übergangsmetallen wie Rhenium, Molybdän oder Wolfram ergaben stets binäre oder ternäre Verbindungen, deren Kristallstrukturen regelrechte Überstrukturen der kubisch-innenzentrierten Kugelpackung bzw. des CsCl-Typs bilden[*]. Diese Verbindungen sind ebenfalls nach einem hierarchischen Prinzip aufgebaut und besitzen Motive der Selbstähnlichkeit in dem Sinne, dass Atom- und Polyederanordnung einander entsprechen. * Die CsCl-Struktur soll dabei als einfachste Möglichkeit verstanden werden, verschiedene Elemente im Sinne einer kubisch-innenzentrierten Kugelpackung anzuordnen. 131 4.2. Das System V-Ga-Cu – Varianten der kubisch-innenzentrierten Kugelpackung ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Beispiele solcher Verbindungen sind ReGa4 (I m –3 m, a = 5.7642(1) Å), das im PtHg4Typ kristallisiert und die erste anhand von Einkristalldaten charakterisierte Verbindung dieses Strukturtyps ist [70] . In dieser einfachen hochsymmetrischen Kristallstruktur bildet Gallium ein reguläres kubisch-primitives Gitter. Gemäß der Formulierung (Re 3)Ga4 sind im Vergleich zum CsCl-Typ ¾ der Gitterplätze frei, und Rhenium ordnet in einem kubisch innenzentrierten Teilgitter aus, so dass Re-zentrierte Ga8-Würfel über gemeinsame Ecken eine kubisch-innenzentrierten Anordnung aus innenzentrierten Würfeln bilden (Abb. 4.19). Aufgrund dieser Anordnung bildet die Kristallstruktur eine kubisch-innenzentrierte Kugelpackung aus innenzentrierten Würfeln, und stellt damit eine elementanaloge Polyederpackung der Kristallstruktur des Wolfram-Typs dar. Kugelpackung und Polyederpackung werden um den Faktor zwei ineinander überführt. Eine diesbezügliche Parallele findet man auch in den Strukturtypen des MoZn6, die Ordnungs- und Defektvarianten der dichtesten Kugelpackungen sind. Im Falle des ReGa4 stellt die Struktur eine Ordnungs- und Defektvariante der kubisch-innenzentrierten Kugelpackung dar. Sie ist damit ein weiteres Beispiel für das bereits beschriebene hierarchische Prinzip, bei dem Übergangsmetallpolyeder als strukturbestimmendes Motiv nach unterschiedlichen Mustern verknüpft sind. Wie beim MoZn6 und Mo7Sn12Zn40 kann man Motive der Selbstähnlichkeit finden, in dem Sinne, dass innenzentrierte ReGa8-Würfel nach dem Muster der kubischinnenzentrierten Packung angeordnet sind. Abb. 4.19: Struktur des ReGa4 als kubisch innenzentrierte Anordnung der ReGa8-Würfel, rechts als Polyederdarstellung. 70 V. Kuntze, H. Hillebrecht, Z. Krist. 1998, Suppl. 15, 34 132 4. Galliumreiche Verbindungen ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Das Mo2Cu3Ga8 (I –4 3 d, a = 11.917(1) Å) als weiteres Beispiel bildet einen eigenen Strukturtyp und stellt formal eine aufgefüllte Variante des ReGa4 dar, bei der die Hälfte der im ReGa4 freien Plätze durch Kupfer besetzt werden. Die Besetzung der Lücken erfolgt dabei in der Weise, dass drei benachbarte Flächen des Mo-zentrierten Ga8-Würfels durch Kupfer überkappt werden. Im Rahmen dieser Arbeit konnte das isotype V2Cu3Ga8 und eine neue komplexe kubische Verbindung der Zusammensetzung V11Cu9Ga46 synthetisiert. werden. Bei näherer Betrachtung stehen diese Strukturen auch in verwandtschaftlichem Verhältnis zu den Hume-Rothery-Phasen, insbesondere zum Strukturtyp des γ-Messing, der ja selbst oft als 27-fache Überstruktur des CsCl-Typs bzw. als (verzerrte) Ordnungs- und Defektvariante der kubisch-innenzentrierten Struktur aufgefasst wird[34] [32] [37]. Allerdings ist die Tendenz zur Ausordnung in zwei separate Teilgitter bei den Verbindungen ÜM-Ga bzw. ÜM-Ga-Cu weitaus stärker ausgeprägt, als beim γ-Messing, bei dem oft auch Mischbesetzungen einzelner Lagen auftreten. Neben strukturchemischen Parallelen treten auch ähnliche Bildungsmechanismen in Erscheinung, bei denen die Valenzelektronenkonzentration eine entscheidende Rolle spielt. Nach den bisherigen Ergebnissen scheint neben dem Charakter des Übergangsmetalls vor allem auch der Anteil an Kupfer in den Kristallstrukturen maßgeblich für die Gestaltung, Größe oder Dimension der Überstruktur verantwortlich zu sein. 34 L. Pauling, Die Natur der chemischen Bindung, Verlag Chemie Weinheim, 3. Auflage, 1968 32 W. B. Pearson, The Crystal Chemistry and Physics of Metals and Alloys, Wiley, New York 1972 37 U. Müller, Anorganische Strukturchemie, Teubner Taschenbücher Stuttgart, 3. Auflage, 1996 133 4.2. Das System V-Ga-Cu – Varianten der kubisch-innenzentrierten Kugelpackung ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ 4.2.1. V2Cu3Ga8: Eine partiell aufgefüllte Variante des ReGa4 Im Rahmen dieser Arbeit war auch das System V-Ga-Cu Gegenstand intensiver Untersuchungen, wobei sich die Synthesen aus thematischen Gründen auf galliumreiche Ansätze beschränkten. Das System V-Ga-Cu erscheint schon deshalb interessant, weil einige isotype Verbindungen von beiden Metallen mit Gallium oder auch Zink existieren, wie z.B. zwei Varianten des Mo(Zn,Ga)6 sowie Parallelen bei den Verbindungen des Mo7Sn12Zn40 und des Mo8Ga41, die auch mit Vanadium als Übergangsmetall bekannt sind. Aufgrund der Erfahrungen erschien es daher naheliegend, dass beispielsweise auch eine zu Mo2Cu3Ga8 isotype Verbindung mit Vanadium existieren sollte. Die Vielzahl der binären Randphasen im System V-Ga-Cu bereiten allerdings auch einige Probleme bei der Synthese entsprechender ternärer Verbindungen. Wegen der großen Stabilität bzw. der leichten Zugänglichkeit der binären Phasen wird der Schmelze das Vanadium und/oder das Kupfer „vorzeitig“ entzogen, so dass diese Metalle nicht mehr in ausreichender Menge miteinander reagieren können. In den folgenden Abschnitten soll ein kurzer Überblick über die binären Cu-Ga- und V-Ga-Verbindungen gegeben werden, wobei die galliumreichen Verbindungen, die auch stets bei den eigenen Arbeiten entstanden, etwas näher beschrieben werden. Im binären System Cu-Ga gewinnt mit steigendem Kupfergehalt die komplexe Strukturchemie der Cu-Ga-Messingphasen zunehmend an Gewicht, so dass vermehrt mit deren Bildung zu rechnen ist, und möglicherweise keine Umsetzung des Übergangsmetalls mehr erfolgt, oder zumindest in den Hintergrund rückt. Selbst in galliumreichen Schmelzen entstehen diese Verbindungen nach eigenen Ergebnissen noch bevorzugt und erschweren die Synthese von ÜM-Ga-Cu-Verbindungen. In Pulverdiagrammen und auch anhand von Einkristallen konnte oft das Cu9Ga4 (P-43m, a = 8.67 Å) nachgewiesen werden [71], das in der Struktur des γ-Messing kristallisiert und isotyp zum Cu9Al4 ist [72]. 71 R. Stokhuizen, J. K. Brandon, P. C. Chieh, W. B. Pearson, Acta Cryst. 1974, B30, 2910-2911 72 L. Arnberg, S. Westman, Acta Cryst., 1978, A34, 399-404 134 4. Galliumreiche Verbindungen ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Abb. 4.20: binäres Phasendiagramm Cu-Ga; nach Massalski [67] Darüber hinaus existiert im galliumreichen Teil des Phasendiagramms Cu-Ga die Verbindung CuGa2 (P 4 / m m m, a = 2.8265(3) Å, c = 5.823(1) Å) [57] , die ebenfalls sehr leicht zugänglich ist, und in nahezu allen Ansätzen zumindest in Spuren entstand. Die Struktur ist isotyp zum FeSi2 [73] . Da die Kristallstruktur dieser Verbindung einige Parallelen zu den noch zu besprechenden Verbindungen aufweist, soll sie an dieser Stelle kurz vorgestellt werden. Die Struktur von CuGa2 lässt sich als kubisch-primitives Gitter aus Ga-Atomen beschreiben, wobei die Hälfte der Ga8-Würfel von Kupfer zentriert ist. Die Verteilung der Kupferatome erfolgt in der Weise, dass alternierende Würfelschichten in der a-b-Ebene abwechselnd ganz gefüllt oder völlig leer sind. Die Cu-zentrierten Ga8-Würfel sind in Richtung der c-Achse elongiert, die leeren Würfel dagegen gestaucht, woraus eine 67 T. B. Massalski (ed.), Binary Phase Diagrams, American Society for Metals, Metals Park, Ohio, 1986 57 M. El-Boragy, K. Schubert, Z. Metallkde. 1972, 63, 53-53 73 F. A. Siderquko et al. Fizika Metallov I Metallovedeninie, 1959, 8, 465 135 4.2. Das System V-Ga-Cu – Varianten der kubisch-innenzentrierten Kugelpackung ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ tetragonale Symmetrie resultiert. Abgesehen von der Verzerrung ist auch hier die Vorliebe des Galliums für die Bildung von Würfeln erkennbar. In Anbetracht des relativ kleinen Atomvolumens des Kupfers (11.8 Å3) ist die niedrige Koordination der Ga-Atome um das Kupfer plausibel. Während die Ga-Atome verzerrt oktaedrisch von sechs weiteren Ga-Atomen, sowie von vier Cu-Atomen auf der Seite des längsten Ga-Ga-Abstandes umgeben ist, sind die Cu-Atome innerhalb des verzerrten Ga8-Würfels aufgrund der Flächen- und Kantenverknüpfung dieser Würfel innerhalb einer Schicht von vier weiteren Cu-Atomen koordiniert. Der kurze Ga-Ga-Abstand von nur 2.387 Å lässt sich als Ga2-Hantel deuten, wie er auch in der Elementstruktur des Galliums auftritt. 3.436 Å Ga Cu 2.635 Å 2.826 Å c Cu 2.387 Å Cu Ga b a Ga Abb. 4.21: Elementarzelle und Koordinationen im CuGa2 mit einigen Bindungslängen. Abb. 4.22: Struktur des CuGa2: Schichten von Cu-zentrierten, verzerrten Ga8-Würfeln und leere Würfelschichten sind alternierend in Richtung der c-Achse gestapelt. c a 136 b Cu Ga 4. Galliumreiche Verbindungen ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Im binären System V-Ga sind insgesamt neun Verbindungen bekannt, deren Zusammensetzungen von V5Ga bis „VGa5“ bzw. V8Ga41 variieren, von denen allerdings nur fünf eindeutig charakterisiert worden sind. Das Phasendiagramm ist von H. G. Meissner et al. und R. G. Maier et al. eingehend untersucht worden [18] [74] . R. G. Maier et al. stellten fest, dass nur der galliumreiche Teil des Phasendiagramms wirklich binär ist. Mit zunehmendem Vanadiumgehalt ab etwa 50% wird der Einfluss von Sauerstoff so groß, dass dieser Teil des Phasendiagramms als ternär zu betrachten ist, da sich dort sauerstoffstabilisierte Verbindungen bilden. Selbst durch Umschmelzen des pulverförmigen Vanadiums im Lichtbogen konnte der Sauerstoff nicht entfernt werden. Nach Angaben der Autoren soll auch im supraleitenden V3Ga eine gewisse Löslichkeit des Sauerstoffs vorhanden sein. Einige Angaben zu den bekannten V-Ga-Verbindungen sind in Tabelle 4.6 enthalten. Die galliumreichste bisher bekannte Verbindung V8Ga41 ist isotyp zum Mo8Ga41, das im vorhergehenden Kapitel angesprochen wurde, und vermutlich identisch mit der Verbindung „VGa~5“, die bereits 1966 veröffentlicht wurde [75] . Wie im Mo8Ga41 ist auch hier das Übergangsmetall zehnfach von Gallium in Form eines ZentaurPolyeders koordiniert, von denen acht den schon beschriebenen „Würfel“ bilden. Abb. 4.23: binäres Phasendiagramm V-Ga; nach Massalski [67] 18 H. G. Meissner, K. Schubert, Z. Metallkde. 1965, 56, 475-484 74 R. G. Maier, Y. Uzel, H. Kandler, Z. Naturforsch. 1966, 21, 531-540 75 K. Girgis, F. Laves, R. Reinmann, Naturwissenschaften, 1966, 53, 610 67 T. B. Massalski (ed.), Binary Phase Diagrams, American Society for Metals, Metals Park, Ohio, 1986 137 4.2. Das System V-Ga-Cu – Varianten der kubisch-innenzentrierten Kugelpackung ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Tab. 4.6: Einige Daten binärer Vanadium-Gallium-Verbindungen mit Literaturangaben. Verbindung Strukturtyp Pearson- Raumgruppe Gitter- Code Daten Bemerkungen Lit. konstanten [Å] EK / Pulver V5Ga CsCl cP2 Pm-3m a = 3.048 Pulver ** [76] V3Ga Cr3Si cP8 Pm-3n a = 4.819 Pulver * [76] [40] V2Ga Mg hP2 P63/mmc Pulver β-Mn cP20 P4132 Pulver ** HT-Phase ** [18] V3Ga2 a = 2.75 c = 4.45 a = 6.62 V5Ga3 Mn5Si3 hP16 P63/mcm Pulver ** [24] V6Ga5 Sn5Ti6 hP22 P63/mmc V6Ga7 Cu5Zn8 cI52 I-43m V2Ga5 Mn2Hg5 tP14 P4/mbm V8Ga41 V8Ga41 hR49 R-3 a = 7.28 c = 4.69 a = 8.46 c = 5.16 a = 9.18 a = 8.9540 c = 2.6892 a = 13.938(6) c = 14.892(1) [24] Pulver Pulver HT-Phase [24] EK [77] EK [63] EK = Strukturaufklärung an Einkristallen HT = Hochtemperatur * = Sauerstofflöslichkeit vermutet [74] ** = Sauerstoffstabilisierte Phase nach Angabe der Autoren 76 E. M. Savitskii, P. J. Kripyakevisch, W. W. Baron, Yu. V. Efimov, Inorg. Mat. 1967, 3(1), 35-42 40 B. T. Matthias, E. A. Wood, E. Corenzwit, V. B. Bala, J. Phys. Chem. Solids, 1956, 1, 188 18 H.-G. Meissner, Schubert, Z. Metallkde. 1965, 56, 475-484 77 L. Hsueh-Shan, L. Ching-Kwei, Chinese Physics, Peking, transl. from W. Xuebao, 1965, 21, 1281-1293 63 K. Girgis, W. Petter, G. Pupp, Acta Cryst. 1975, B31, 113-116 74 R. G. Maier, Y. Uzel, H. Kandler, Z. Naturforsch. 1966, 21, 531-540 138 [24] 4. Galliumreiche Verbindungen ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Das V2Ga5 (Mn2Hg5-Typ; P4/mbm, a = 8.954 Å, c = 2.6892 Å) als weitere galliumreiche Verbindung entsteht aus nahezu allen galliumreichen Schmelzen. Selbst aus ternären Ansätzen mit beträchtlichen Mengen an Kupfer ist diese Verbindung äußerst leicht zugänglich, und bildet oft das Hauptprodukt. Die tetragonale Struktur ist recht einfach aufgebaut und lässt sich über das Ga-Netzwerk bzw. über die V-zentrierten Koordinationspolyeder leicht beschreiben. Nach der Schläfli-Symbolik bilden die beiden symmetrieunabhängigen Galliumatome auf den Lagen 2d und 8i ein 5353- und ein 5453-Netz im Verhältnis 1:4. Diese ebenen Netze sind senkrecht übereinander in Richtung der c-Achse gestapelt. Die aus diesem Netzwerk resultierenden pentagonalen Prismen – mit dem größten Volumen – sind von Vanadium zentriert; die verbleibenden tetragonalen und trigonalen Prismen sind unbesetzt. Die V-Atome sind von zehn Ga- und zwei V-Atomen aus benachbarten Prismen koordiniert, woraus sich eine Koordinationszahl von 10 + 2 = 12 ergibt. Da jedes Ga-Atom acht Prismen gleichzeitig angehört, ergibt sich eine Summenformel von V2Ga(10*4) / 8 = V2Ga5. In der a-b-Ebene sind die vanadiumzentrierten Prismen kanten-, und in Richtung der c-Achse über gemeinsame Flächen verknüpft. b b a Abb. 4.24: c a V Ga Struktur des V2Ga5. links: Ga-Netzwerk; rechts: perspektivische Darstellung der Struktur in Richtung der c-Achse. 139 4.2. Das System V-Ga-Cu – Varianten der kubisch-innenzentrierten Kugelpackung ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Ga1 Ga2 V Ga2 Ga1 Ga2 Ga2 Ga2 Ga2 Ga2 Ga2 Ga1 Ga2 Ga Ga2 Ga1 Tab. 4.7: ausgewählte Abstände in V2Ga5 V V Ga1 Ga2 Ga2 2.689 2.646 2.625 2.791 2x 2x 4x 4x Ga1 Ga1 Ga2 2.689 2.671 2x 4x Ga2 Ga1 Ga2 Ga2 Ga2 2.671 2.689 2.786 2.803 Ga V Abb. 4.25: 2x 2x Koordinationspolyeder in V2Ga5 Das Strukturmotiv des Würfels ist auch in dieser Verbindung noch vorhanden, wenn auch in Form eines leeren Ga8-Würfels, der aber immerhin von vier V-Atomen überkappt ist. Bemerkenswert sind auch die kurzen Ga-Ga-Abstände, die alle im Bereich von 2.671 Å bis 2.803 Å liegen, und damit deutlich unterhalb der Werte von etwa 3 Å, die man im allgemeinen für große Metalle erwartet. Durch den recht hohen Schmelzpunkt von ca. 1050°C kristallisiert das V2Ga5 auch in ternären V-Ga-Cu-Schmelzen schon früh aus. Dadurch wird der Schmelze das Vanadium weitgehend entzogen, wodurch das Übergangsmetall für Reaktionen mit Gallium/Kupfer nicht mehr zur Verfügung steht. Falls die Bildung einer Verbindung V2Cu3Ga8 möglich ist, setzt die Kristallisation erst bei niedriger Temperatur ein, da schon der Schmelzpunkt des Mo2Cu3Ga8 bei 800°C liegt, wie DTA-Analysen an phasenreinen Präparaten dieser Verbindung gezeigt haben. In sehr galliumreichen Schmelzen ist wiederum mit der Bildung des V8Ga41 und – in Konkurrenz dazu – des CuGa2 zu rechnen. Selbst die 140 4. Galliumreiche Verbindungen ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ kupferreichen Messing-Phasen des Cu9Ga4 konnten in den Pulverdiagrammen einiger Ansätze mit etwas höherem Cu-Gehalt nachgewiesen werden. Auch die Tatsache, dass die thermodynamischen und kinetischen Verhältnisse in einer ternären V-Ga-Cu-Schmelze gegenüber den binären Systemen durchaus verschieden sein können, und wahrscheinlich auch sind, erleichtert die Umsetzung der drei Metalle zu einer ternären Verbindung nicht notwendigerweise. Immerhin befindet man sich im ternären Phasendiagramm V-Ga-Cu in einem relativ begrenzten Bereich, wo die Bildung von vier binären Verbindungen – CuGa2, V2Ga5, V8Ga41 und Cu9Ga4 – überdurchschnittlich begünstigt ist. Ga 100 10 90 V8Ga41 80 V2Ga5 70 20 z 30 z z 60 V11Cu9Ga46 z z CuGa 2 40 50 50 60 V2Cu3Ga8 40 70 z 30 Cu9Ga4 80 20 90 10 100 V Abb. 4.26: 100 90 80 70 60 50 40 30 20 10 Cu ternäres Diagramm V-Ga-Cu; Trotz der offensichtlichen Stabilität bzw. der leichten Bildungstendenz der binären galliumreichen Verbindungen konnten zwei neue ternäre Verbindungen synthetisiert werden. Dabei handelt es sich um das V2Cu3Ga8, (I –4 3 d; a = 11.786(1) Å), das isotyp zum Mo2Cu3Ga8 ist, sowie das V11Cu9Ga46 (P m –3 n; a = 23.362(3) Å), das einen neuen Strukturtyp bildet (Abschnitt 4.2.2), und mit fast 800 Atomen pro Zelle eine komplexe Überstruktur der kubisch-innenzentrierten Kugelpackung darstellt. Im Falle der zugletztgenannten Verbindung gelang die Synthese nach einigen Versuchen sogar nahezu phasenrein. Dabei lagen die Schwierigkeiten zur Herstellung der Verbindungen nicht darin, 141 4.2. Das System V-Ga-Cu – Varianten der kubisch-innenzentrierten Kugelpackung ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ die Metalle zur Reaktion zu bringen, sondern durch entsprechende Mengenverhältnisse der Metalle untereinander den „Ort“ im Phasendiagramm zu finden, der einen Reaktionsweg in die gewünschte Richtung ermöglicht, und die sensiblen Gleichgewichtslagen entsprechend ausnutzt. Ein Indiz für diese Sensibilität ist die Tatsache, dass in den Pulverdiagrammen von fast allen Reaktionsgemischen mindestens zwei, in den meisten Fällen jedoch vier Verbindungen gleichzeitig in unterschiedlichen Mengen gebildet wurden. Die Synthese des V2Cu3Ga8 gelang aus Ansätzen mit unterschiedlichem Anteil der Metalle im Verhältnis V-Ga-Cu von 1 : 15 : 6 bis 1 : 20 : 8 allerdings bisher nicht phasenrein, sondern immer mit variierenden Anteilen an CuGa2, V2Ga5 und der weiteren neuen Verbindung V11Cu9Ga46. In einigen Pulverdiagrammen konnten auch die Linien des Cu9Ga4 nachgewiesen werden. Die Metallgemische wurden in evakuierten Quarzampullen für zwei Wochen auf 1000°C erhitzt, und mit einer Abkühlrate von 4°/h auf 400°C abgekühlt. Nach zwei Tagen wurde mit 16°/h auf Raumtemperatur abgekühlt. Nach Entfernen des überschüssigen Metalls mit verdünnter wässriger HCl blieben in den meisten Ansätzen eine große Anzahl von Kristallen zurück. Anhand der Kristallform lassen sich die verschiedenen Verbindungen optisch einigermaßen voneinander unterscheiden. CuGa2 bildet meist größere Aggregate miteinander verwachsener tetragonaler Platten und Quader, die mit Kupfer überzogen sind oder metallisch glänzen. V2Ga5 bildet in der Regel recht große Einkristalle in Form dunkelgrauer tetragonaler Quader oder Säulen und V11Cu9Ga46, kristallisiert teilweise in sehr großen kupferfarbenen Kristallen, die oft an Rhombendodekaeder erinnern. Daneben fanden sich wenige hellgraue würfelförmige Kristalle, die nach röntgenographischer Vermessung mit dem Einkristalldiffraktometer die für V2Cu3Ga8 erwartete kubisch-innenzentrierter Symmetrie mit einer Gitterkonstanten von 11.786(1) Å ergaben. Von einem Kristall konnte ein Datensatz mit 382 unabhängigen Reflexen erhalten werden. Die Strukturverfeinerung mit SHELX 97 konvergierte in der azentrischen Raumgruppe I -4 3 d mit den Startkoordinaten des Mo2Cu3Ga8 rasch bei Zuverlässigkeitswerten von R1(F) = 0.0468 und wR2(I) = 0.1171. Die Freigabe der Besetzungsfaktoren bestätigte die geordnete Verteilung der Metallatome. Weitere Angaben zur Strukturlösung sind in Tab. 4.8 angegeben. 142 4. Galliumreiche Verbindungen ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Tab. 4.8: Angaben zur Strukturbestimmung von V2Cu3Ga8 Rel. Molmasse Kristallsystem Raumgruppe Zellabmessungen 850.28 g/mol kubisch I –4 3 d (Nr. 220) a = 11.786(1) Å Zellvolumen Anzahl der Formeleinheiten Röntgendichte Messtemperatur Diffraktometer Röntgenstrahlung V = 1637.23 Å3 8 6.899 g/cm3 20°C STOE IPDS II Mo Kα1 Graphit-Monochromator 3048.0 ±16; ±16; ±16 59° 90 Platten à 4 min bei 2° ϕ-Inkrement ω = 0° / 90° 6.0 16122 1782 382 382 310 Polyeder 0.2 * 0.2 * 0.2 mm3 numerisch; Equivalent-Methode 0.1228 (0.0268) 35.54 mm-1 0,000196 + 1.48; -2.20 (0.39) e/ Å3 1 / [σ2 * F02 + (0,0366 * P) 2 + 100.70 * P] mit P = (F02 + 2 * Fc2) / 3 25 R1(F) = 0.0468; wR2(I) = 0.1171 F ( 0 0 0) Meßbereich h, k, l max. 2θ Mess- / Scanmodus I / σ(I)-Verhältnis Messwerte davon unbeobachtet unabhängige Reflexe davon mit I > 0 davon mit I > 2σ(I) Kristallform Kristallabmessungen Absorptionskorrektur Interner Standard Schwächungskoeffizient Extinktionskoeffizient (SHELX98) Restelektronendichte Wichtungsfunktion Zahl der Parameter R- Werte 143 4.2. Das System V-Ga-Cu – Varianten der kubisch-innenzentrierten Kugelpackung ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Tab. 4.9: Ortskoordinaten und Auslenkungsparameter in V2Cu3Ga8 Atom Wyck. Symm. x y z Ueq V Cu Ga1 Ga2 16c 24d 48e 16c .3. 2.. 1 .3. 0.4865(2) 1/2 0.3818(2) 0.6138(2) 0.5135(1) 1/4 0.3788(2) 0.3862(2) 0.0135(1) -0.2503(2) -0.1295(1) 0.8862(2) 0.0027(7) 0.0051(6) 0.0099(5) 0.0099(8) Atom V Cu Ga1 Ga2 U11 0.0027(7) 0.0051(9) 0.0055(8) 0.0099(9) U22 0.0027(7) 0.0075(10) 0.0123(8) 0.0099(9) U33 0.0027(7) 0.0027(10) 0.0118(11) 0.0099(9) U12 0.0049(5) 0.0029(8) 0.0010(5) 0.0016(5) U13 0.0049(5) 0.00000 0.0038(6) 0.0016(5) U23 -0.0049(5) 0.00000 -0.0032(5) -0.0016(5) Tabelle 4.10: Ausgewählte Abstände in V2Cu3Ga8 im Vergleich zu Mo2Cu3Ga8 V2Cu3Ga8 Mo2Cu3Ga8 V Ga2 Ga2 Ga1 Ga1 Cu 2.504(3) 2.600(3) 2.519(3) 3x 2.624(3) 3x 2.796(2) 3x Mo Ga2 Ga2 Ga1 Ga1 Cu 2.564(1) 2.596(1) 2.599(1) 3x 2.603(1) 3x 2.773(0) 3x Cu Ga1 Ga1 Ga2 Ga1 V Cu 2.505(2) 2.602(2) 2.639(3) 2.652(2) 2.796(2) 2.939(3) Cu Ga1 Ga1 Ga2 Ga1 Mo Cu 2.567(1) 2.599(1) 2.632(1) 2.660(1) 2.773(0) 3.270(2) Ga1 Cu V Cu V Cu Ga2 Ga1 Ga1 Ga2 2.505(2) 2.519(3) 2.602(2) 2.624(3) 2.652(2) 2.742(3) 2.853(3) 2x 3.081(2) 2x 3.129(3) Ga1 Cu Mo Cu Mo Cu Ga2 Ga1 Ga1 Ga2 2.567(1) 2.599(1) 2.599(1) 2.603(1) 2.660(1) 2.733(1) 2.914(1) 3.053(1) 3.240(1) V V Cu Ga1 Ga1 2.504(3) 2.600(3) 2.639(3) 3x 2.742(3) 3x 3.129(3) 3x Ga2 Mo Mo Cu Ga1 Ga1 2.564(1) 2.596(1) 2.632(1) 3x 2.733(1) 3x 3.240(1) 3x Ga2 144 2x 2x 2x 2x 2x 2x 2x 2x 2x 2x 2x 2x 4. Galliumreiche Verbindungen ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Die Synthese von V2Cu3Ga8 gelang bisher nicht phasenrein, da die Ausscheidung der binären Randverbindungen im ternären System V-Ga-Cu offensichtlich sehr begünstigt ist. Immerhin gelang es, die Bildung des V2Ga5 soweit zu unterdrücken, dass diese Verbindung im Pulverdiagramm nicht mehr nachzuweisen ist. Dies ist insofern als Erfolg zu werten, als dass V2Ga5 in den meisten Ansätzen stets zu einem beträchtlichen Anteil vorhanden war. Im Pulverdiagram aus dem Rückstand einer Schmelze V-Ga-Cu im molaren Verhältnis 1:20:8 sind außer dem V2Cu3Ga8 nur die Reflexe von CuGa2 und dem V11Cu9Ga46 zu erkennen. Abb. 4.27: 20µm REM-Bild eines V2Cu3Ga8-Kristalls CuGa2 relative Intensitäten V11Cu9Ga46 berechnet gemessen 15 20 30 40 50 60 70 80 90 2 -T heta - S ca le Abb. 4.28: Pulverdiagramm von V2 Cu3Ga8 . Die zusätzlichen Reflexe stammen von CuGa2 und V11Cu9Ga46 145 4.2. Das System V-Ga-Cu – Varianten der kubisch-innenzentrierten Kugelpackung ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Die Struktur des V2Cu3Ga8 stellt eine partiell aufgefüllte Variante des zu Beginn des Abschnittes angesprochenen ReGa4 dar. Im ReGa4 sind ¾ der Würfelzentren unbesetzt, was im Vergleich zum CsCl-Typ eine Verdopplung der Gitterkonstante notwendig macht. Im V2Cu3Ga8 sind nun die Hälfte dieser leeren Gitterplätze von Kupfer besetzt. Dies führt zu einer erneuten Verdopplung der Gitterkonstanten bezüglich der ReGa4-Struktur. Die Teilstruktur der unbesetzten Würfelzentren im ReGa4 wird dabei im Verhältnis 1 : 1 aufgespalten und zur Hälfte von Kupfer besetzt, was durch die Summenformel V2Cu3 3Ga8 im Vergleich zu Re2 3 3Ga8 = Re 3Ga4 ausgedrückt werden kann. V Cu Ga Abb. 4.29: 146 Struktur des V2Cu3Ga8. Die Subzelle des ReGa4 ist rot dargestellt. 4. Galliumreiche Verbindungen ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Damit erhöht sich die Koordinationszahl der Vanadiumatome im Vergleich zum ReGa4 von 8 auf 8+3, und das Polyeder ist ein leicht verzerrter dreifach überkappter Würfel. Die überkappenden Kupferatome befinden sich auf drei benachbarten Flächen des Ga8-Würfels. Die Kupferatome sind ebenfalls würfelförmig von Gallium koordiniert, wobei zwei gegenüberliegende Flächen des Ga8-Würfels von Vanadium überkappt sind, wodurch sich die Koordinationszahl von 8+2 ergibt. Gemäß dem Verhältnis V:Cu = 2:3 gehören zur Koordinationssphäre der V-Atome drei Cu-Atome, und umgekehrt zur Koordinationssphäre der Cu-Atome zwei V-Atome. Die Koordinationspolyeder der beiden Galliumpositionen entsprechen dem des Galliums in ReGa4, wobei weitere Flächen des Ga6-Oktaeders durch die hinzugekommenen Cu-Atome überkappt werden. Damit erhöht sich auch die Koordinationszahl beider Galliumpositionen von 6+2 auf 6+2+3. Ausgewählte Abstände sind in Tabelle 4.10, Seite 144 aufgelistet, wobei zum Vergleich die Abstände des Mo2Cu3Ga8 mit aufgeführt sind. V Cu Ga1 Ga1 Ga2 Ga1 Ga1 Ga2 Ga1 Cu V Cu Ga1 Cu Ga1 Ga2 Ga1 Ga2 Ga1 Ga1 Ga1 V Ga2 Ga1 V V Cu Ga1 Ga1 Cu Ga1 Ga2 Ga1 Ga2 V Cu Ga1 Ga1 Ga1 Cu Ga1 Abb. 4.30: Ga1 Ga1 Cu V Cu Ga1 Koordinationspolyeder in V2Cu3Ga8 147 4.2. Das System V-Ga-Cu – Varianten der kubisch-innenzentrierten Kugelpackung ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Interessant ist auch die Koordination der unbesetzten Würfel, deren Polyeder in der Anzahl und Verteilung der Atome nebenbei direkt die Summenformel der Verbindung wiedergibt. Die leeren Ga8-Würfel sind fünffach überkappt von je zwei Vanadiumatomen in facialer Anordnung und von drei Kupferatomen in meridialer Anordnung um den Ga8-Würfel. Cu Ga Ga Ga Ga Cu V Ga Ga V Ga Ga Cu Abb. 4.31: Koordination um die unbesetzten Würfel in V2Cu3Ga8 Aufgrund der zusätzlichen partiellen Besetzung der Würfel mit Kupfer treten in der Struktur des V2Cu3Ga8 ebenso wie in den bisher bekannten isotypen Verbindungen Mo2Cu3Ga8 und W2Cu3Ga8 geringfügige Verzerrungen auf. Diese betreffen sowohl das kubisch-primitive Teilgitter der Ga-Atome, wie auch die Positionen der Übergangsmetalle und des Kupfers. Topologisch besetzen die V-Atome im V2Cu3Ga8 die Positionen der ReAtome im ReGa4 und die Teilstruktur des Vanadium bildet für sich betrachtet ebenfalls ein – allerdings leicht verzerrtes – kubisch-innenzentriertes Gitter. Bemerkenswert ist allerdings die Art der Verzerrung und die daraus sich ergebende Koordinationsgeometrie. Ausgehend von einem V-Atom innerhalb eines Würfels rücken sowohl die Cu-Atome, als auch die nächsten V-Atome, die sich in Verlängerung dieser Achse V-Cu befinden, aufeinander zu, statt sich abzustoßen. Daraus ergibt sich nicht nur ein recht kurzer V-CuAbstand von 2.796 Å; auch der V-V-Abstand in dieser Achse ist mit 5.583 Å um 0.637 Å kürzer als die V-V-Abstände, die über einen leeren Würfel gebildet werden (6.220 Å). Daraus resultiert nicht nur für die nächste Umgebung der V-Atome eine (8+3)-Koordination in Form des dreifach überkappten Würfels, sondern auch für die Koordination der V-Atome untereinander. 148 4. Galliumreiche Verbindungen ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Abb. 4.32: Anordnung der V-Atome um ein VGa8Cu3-Polyeder Abstände V-V in Å: Zentralatom zu Würfelecken: 5.104(2) 5.123(2) 2x 6x V-V über Kupfer: 5.583(2) 3x V-V über leere Würfel: 6.220(2) 3x Die auf den ersten Blick willkürlich erscheinende Auffüllung der leeren Plätze mit Kupfer erfolgt letztendlich nach einem Prinzip, bei dem wieder Hierarchie und Motive der Selbstähnlichkeit im Vordergrund stehen. Bezüglich der Koordinationspolyeder des Vanadium bildet das V2Cu3Ga8 dreifach überkappte Würfel aus dreifach überkappten Würfeln als neues Strukturmotiv, und stellt damit neben den Strukturen des MoZn6, ReGa4 und Mo7Sn12Zn40 ein weiteres Beispiel für Hierarchie und Selbstähnlichkeit in intermetallischen Verbindungen dar. Dabei gelingt die selbstähnliche Anordnung nicht nur mit hochsymmetrischen Polyedern wie Würfel, Kuboktaeder, „Antikuboktaeder“ und Ikosaeder, sondern auch mit einem eher unsymmetrischen Polyeder, der lediglich die Punktsymmetrie 3 m besitzt. Bemerkenswert ist, dass diese recht anspruchsvolle Anordnung in einer Kristallstruktur realisiert werden kann, bei deren Beschreibung nur vier kristallographische Lagen notwendig sind. 149 4.2. Das System V-Ga-Cu – Varianten der kubisch-innenzentrierten Kugelpackung ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Abb. 4.33: Dreifach überkappter Würfel aus dreifach überkappten Würfeln in V2Cu3Ga8 Um von der Struktur des ReGa4 zu der des V2Cu3Ga8 zu gelangen, sind gruppentheoretisch drei Schritte notwendig [78]. Schließlich muss im Vergleich zum ReGa4 die Gitterkonstante verdoppelt, und gleichzeitig das Galliumgitter gemäß der Zähligkeit der kristallographischen Lagen im Verhältnis 1 : 3 aufgespalten werden; ebenso muss das Gitter der im ReGa4 leeren Plätze im Verhältnis 1 : 1 geteilt und zur Hälfte mit Kupfer aufgefüllt werden. Zunächst wird lediglich die Besetzung leerer und besetzter Gitterplätze im ReGa4 vertauscht, was zur Struktur des Pt3O4 führt [79] . Der erste Schritt nach dieser Besetzungs- inversion ist ein klassengleicher Übergang vom Index 2 in die Raumgruppe P m –3 n. In dieser Raumgruppe ist bisher kein Vertreter bekannt, bei dem die entsprechenden kristallographischen Lagen besetzt sind. 78 Th. Hahn (cd.), Int. Tables for Crystallography, 1983 79 E. E. Galloni, A. E. Roffo, J. Chem. Phys. 1941, 9, 875-877 150 4. Galliumreiche Verbindungen ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Abb. 4.34: Gruppentheoretischer Zusammenhang zwischen CsCl, ReGa4 und V2Cu3Ga8. Die Atomlagen für V2Cu3Ga8 stellen ideale Plätze dar. 151 4.2. Das System V-Ga-Cu – Varianten der kubisch-innenzentrierten Kugelpackung ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Die Verdopplung der Elementarzelle und eine Aufspaltung des Ga-Gitter in ReGa4 erfolgt in einem weiteren klassengleichen Übergang vom Index 4 in die Raumgruppe I a –3 d. Ein Vertreter in dieser Raumgruppe mit entsprechender Struktur ist der Ni3Ga4-Typ (a =11.41 Å). Dabei wird die Lage 8e (1/8, 1/8, 1/8) in P m –3 n im Verhältnis 1 : 3 aufgespalten in die Lagen 16b (1/8, 1/8, 1/8) und 48g (1/8, 1/8, 3/8) in I a –3 d, die in Ni3Ga4 von Nickel besetzt werden (48g) bzw. leer bleiben (16b). Die zweite Teilstruktur, die in ReGa4 von Rhenium besetzt ist, bzw. leer bleibt, wird in Ni3Ga4 von Gallium besetzt und es findet nur eine Verachtfachung der Zähligkeit der kristallographischen Lagen statt. Der letzte Schritt erfolgt in einem translationengleichen Übergang vom Index 2 mit Symmetrieabbau in die Raumgruppe I –4 3 d zur Struktur des V2Cu3Ga8. Bei diesem Schritt wird nun das Teilgitter der im ReGa4 leeren Plätze, die im Ni3Ga4 von Gallium besetzt werden, im Verhältnis 1 : 1 aufgespalten und zur Hälfte mit Kupfer besetzt. Die Aufspaltung erfolgt aus der Lage 48f (0, 0, ¼) in I a –3 d in zwei Lagen 24d (¼, ¼, ¼,) und (½,0, ¼) in I –4 3 d. 152 4. Galliumreiche Verbindungen ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ 4.2.2. V11Cu9Ga46: Eine komplexe kubische Struktur mit Variationen der kubischinnenzentrierten Kugelpackung Wie bereits im vorhergehenden Abschnitt erläutert, erschwert die hohe Bildungstendenz der binären Randphasen in den Systemen V-Cu und Cu-Ga die Umsetzung der Metalle zu ternären Verbindungen. Trotz der komplexen Gleichgewichtslagen im galliumreichen Teil des ternären Systems V-Ga-Cu gelang die Synthese einer weiteren neuen Verbindung. Neben dem V2Cu3Ga8 wurden in einigen Ansätzen gelegentlich Kristalle gefunden, die bei der röntgenographischen Untersuchung mit dem Einkristalldiffraktometer eine kubischprimitive Zelle und eine Gitterkonstante von 23.4 Å zeigten. Da dies im Vergleich zum V2Cu3Ga8 (a = 11.786(1)Å) ziemlich genau eine Verdopplung darstellt, lag die Vermutung nahe, dass es sich dabei um eine weitere, noch komplexere Überstruktur des ReGa4 bzw. V2Cu3Ga8 handelt. Bei einem kubisch primitiven Grundgerüst aus Ga-Atomen, wie in ReGa4 und V2Cu3Ga8 läge damit eine 8x8x8 = 512-fache Überstruktur des CsCl-Typs vor. Dass diese große Translationsperiode problemlos und wiederholt gefunden wurde, ist angesichts der ähnlichen Elektronenzahlen und der damit verbundenen vergleichbaren Streukraft der Metalle Vanadium, Kupfer und Gallium erstaunlich, und lässt auf eine hochgeordnete Struktur schließen. Bei der Synthese dieser Verbindung ergaben sich ähnliche Schwierigkeiten, wie bei der des V2Cu3Ga8. Vor allem bei der Züchtung geeigneter Einkristalle zur Strukturanalyse traten Probleme auf, da in vielen Ansätzen ein erheblicher Anteil des Produktes nach der Aufarbeitung aus größeren Aggregaten miteinander verwachsener Kristalle und aus Pulver bestand. Weniger problematisch dagegen war die optische Unterscheidbarkeit von nicht erwünschten Produkten wie etwa V2Ga5 oder CuGa2, die beide in Form von Säulen und Quadern kristallisieren (Abb. 4.35; folgende Seite). Obwohl die Summenformel der neuen Verbindung zu diesem Zeitpunkt noch unbekannt war, sollte sie zumindest eine ähnliche Zusammensetzung aufweisen, wie das V2Cu3Ga8, unter der Voraussetzung, dass beide Verbindungen aus ähnlichen Strukturmotiven aufgebaut sind. Die Phasenanalyse aus Pulverdiagrammen ergab einheitlich, dass die Bildung des V2Ga5 zunehmend begünstigt wird, je ausgeglichener das Verhältnis Vanadium – Kupfer in der Schmelze ist. Dementsprechend gelang die Synthese des V2Cu3Ga8 nahezu phasenrein dann auch aus Schmelzen der Zusammensetzung V:Ga:Cu im molaren Verhältnis 1:20:8, 153 4.2.2 V11Cu9Ga46 ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ CuGa2 CuGa2 200 µm V2Ga5 200 µm V2Ga5 200 µm V11Cu9Ga46 200 µm V11Cu9Ga46 200 µm Abb. 4.35: 154 Kristalle von CuGa2, V2Ga5 und V11Cu9Ga4 200 µm 4. Galliumreiche Verbindungen ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ deren Zusammensetzung bzgl. des V-Cu-Verhältnisses einen deutlichen Kupferüberschuss aufweist. In Abb. 4.36 der folgenden Seite ist die Zusammensetzung der Schmelze durch das Symbol f dargestellt. In dieser Schmelze ist der Kupfergehalt gut fünfmal höher, als in der Kristallstruktur selbst. Die Idee dabei war, aus dem extrem galliumreichen Bereich des Phasendiagramms mit einem entsprechend hohem Anteil an Kupfer einen „Weg“ zu der gewünschten Verbindung zu ermöglichen. Einerseits sollte bei entsprechenden Mengen an Kupfer die Bildung des V2Ga5 unwahrscheinlicher werden, andererseits besitzt die Schmelze mit etwa 30% Kupfer einen recht großen Flüssigkeitsbereich, so dass möglicherweise günstige Bedingungen für die Ausscheidung des V2Cu3Ga8 vorliegen. Im binären System Kupfer – Gallium ist die Schmelze mit der Zusammensetzung Cu : Ga von etwa 30 : 70 Prozent noch bis etwas unterhalb 500°C flüssig. Das V2Cu3Ga8 sollte bei dieser Temperatur jedoch bereits auskristallisiert sein (das isotype Mo2Cu3Ga8 zersetzt sich bei 800°C). Unter gleichen Gesichtspunkten durchgeführte Synthesen für die neue Verbindung waren ebenfalls erfolgreich. In Abb. 4.36 sind die tatsächlich existierenden Verhältnisse dargestellt. Das Bild stellt den galliumreichen Teil des ternären Systems V-Ga-Cu dar und enthält zum Vergleich die entsprechenden Bereiche der binären Phasendiagramme. Neben den binären Randphasen und den beiden ternären Verbindungen sind Beispiele für die Zusammensetzung von Schmelzen mit angegeben, bei denen die Synthesen besonders erfolgreich waren. Die qualitativ besten Einkristalle fanden sich in einer Schmelze der molaren Zusammensetzung V:Ga:Cu 1:15:4 (c in Abb. 4.36), deren Strukturanalyse die Summenformel V11Cu9Ga46 ergab. EDX-Untersuchungen an geschliffenen Kristallen ergaben einen Metallgehalt von 17.1% Vanadium, 12.8% Kupfer und 70.1% Gallium, was sehr gut mit den Werten der Röntgenstrukturanalyse übereinstimmt. Die meisten – teilweise sehr großen – Einkristalle konnten aus einem Ansatz der Zusammensetzung V:Ga:Cu 1:20:4 (d in Abb. 4.36) isoliert werden. Nahezu phasenrein gelang die Synthese aus einer Schmelze der Zusammensetzung V:Ga:Cu 1:20:4 (e in Abb. 4.36). In weiteren Ansätzen mit unterschiedlichem Anteil der Metalle entstanden neben CuGa2 und V2Ga5 auch beide Verbindungen – V2Cu3Ga8 und V11Cu9Ga46 – gleichzeitig in unterschiedlichem Mengenverhältnis, was angesichts der komplexen Gleichgewichtslagen in diesem Bereich des Phasendiagramms verständlich ist. Die Umsetzungen der Metalle 155 4.2.2 V11Cu9Ga46 ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ war aber in sofern erfolgreich, als dass es gelang, beide Verbindungen, das V2Cu3Ga8 und das V11Cu9Ga46, durch Variation vor allem des Cu-Gehaltes in den Schmelzen fast phasenrein und auch getrennt voneinander zu synthetisieren. Dies zeigt einmal mehr in sehr schöner Weise, dass der Rolle des „Hilfsmetalls“ – in diesem Fall Kupfer – in der 00 0 10 0 0 10 20 0 20 0 40 0 60 0 80 70 0 50 0 60 30 Ga 400 ] [°C ur rat e mp Te [°C ] 800 Te mp er a tur 0 90 12 00 Methode der Hilfsmetallbadtechnik eine bedeutende Rolle zukommt. 0 50 99 5°C 6 Ga 7 °C V 113 5 6 Ga 5 V °C 10 20 Ga 2 z 5°C 48 8°C 46 60 V2Cu3Ga8 z Ga 4 Cu 9 Cu Abb. 4.36: galliumreicher Teil des ternären Phasendiagramms V-Ga-Cu mit den binären Phasendiagrammen V-Ga und Cu-Ga. Die mit Zahlen V11Cu9Ga46 e 1 : 7.5 : 1.5 dargestellten Punkte bezeichnen die Lage der Schmelzen, aus denen die Synthesen der Verbindungen V2Cu3Ga8 und V11Cu9Ga46 V2Cu3Ga8 besonders erfolgreich waren. Die Zahlen am Rand des ternären Diagramms geben den prozentualen Anteil an Gallium an. 156 5°C 64 4.7 ~3 7.6 ~3 8.1 2.6 50 ~3 ~4 V c 1 : 15 : 4 z Cu 30 30 f 1 : 20 : 8 f 40 40 V : Ga : Cu (molarer Anteil) 3. 6 ~7 50 d 1 : 20 : 4 70 z V11Cu9Ga46 60 4°C z 6 2 Ga 5 80 d d e c 25 V z 80 90 ~7 8 Ga 41 90 C ,6° 29 29 .77 °C 0°C 6 10 80 °C 10 50 °C ~9 V 4. Galliumreiche Verbindungen ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Das V11Cu9Ga46 kristallisiert in Form regelmäßiger, teilweise recht großer Polyeder, die oft Ähnlichkeiten mit Rhombendodekaedern aufweisen und größtenteils mit einer Kupferschicht überzogen sind. Die röntgenographische Vermessung einiger dieser Kristalle ergaben eine kubische Zelle mit einer Gitterkonstanten von 23.362(1) Å. Die Vermessung eines kleinen Kristalls mit dem IPDS ergab nach Mittelung in der Laue-Klasse m –3 m einen Datensatz mit 1797 unabhängigen Reflexen. Über direkte Methoden konnte in der Raumgruppe P m -3 n ein Strukturmodell entwickelt werden, das schließlich bei Zuverlässigkeitswerten von R1(F) = 0.0291 und wR2(I) = 0.0586 konvergierte. Da kein konkretes Strukturmodell vorlag, aber immerhin eine galliumreiche Verbindung mit ähnlicher Zusammensetzung wie V2Cu3Ga8 zu erwarten war, erfolgte die Verfeinerung wegen ähnlicher Elektronenzahlen der Metalle Vanadium, Kupfer und Gallium zunächst auf der Basis einer reinen Galliumverbindung. Im Endstadium der Verfeinerung, die nach dieser Methode bei R1(F) = 0.120 konvergierte, erfolgte durch wechselseitige Freigabe der Besetzungsfaktoren die endgültige Ermittlung vor allem der Vanadium- und Kupferlagen. Die Positionen der Vanadiumatome konnten sehr schnell gefunden werden, was sich jedes Mal in einer signifikanten Erniedrigung des R1(F)-Wertes äußerte. Etwas problematischer war dagegen die Differenzierung zwischen Kupfer und Gallium, die aber – in Anbetracht des ähnlichen Streuvermögens der beiden Metalle – erstaunlich eindeutig konvergierte und nach kritischer Abschätzung der Besetzungs- und Temperaturfaktoren zum endgültigen Strukturmodell führten. In V11Cu9Ga46 bildet Gallium ein annähernd kubisch primitives Gitter, wobei an einigen Stellen zusätzliche Galliumatome eingelagert sind, was sich auf die Umgebung zweier Vanadiumpositionen auswirkt. Im Ganzen ist die Kristallstruktur gekennzeichnet von einer erstaunlichen Separierung vor allem der Metalle Vanadium und Kupfer. Diese beiden Metalle bilden untereinander – bis auf eine Ausnahme – keine direkten Kontakte in dem Sinne, dass benachbarte Würfelzentren von derselben Metallsorte besetzt werden. Dies erkennt man auch sehr schön in der grafischen Darstellung der Abstände der Metalle untereinander in Abb. 4.37, in der die Abstände [in Å] gegen deren Häufigkeit dargestellt ist. 157 4.2.2 V11Cu9Ga46 ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Anzahl V-V 1 2 3 4 5 6 [Å] 1 2 3 4 5 6 [Å] 1 2 3 4 5 6 [Å] 1 2 3 4 5 6 [Å] 1 2 3 4 5 6 [Å] 1 2 3 4 5 6 [Å] V - Cu V - Ga Cu - Cu Cu - Ga Ga - Ga Abb. 4.37: Verteilung der Metall-Metall-Abstände in V11Cu9Ga46 bis 6.0 Å. 158 4. Galliumreiche Verbindungen ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Die Verteilung der Abstände in Abb. 4.37 zeigt die in hochsymmetrischen Strukturen sehr häufig beobachte „Lücke“ zwischen der ersten und der zweiten Koordinationssphäre. Abstände unter 3.0 Å können als direkte Kontakte gewertet werden, in dem Sinne, dass V-Ga- und Cu-Ga-Abstände bzgl. einer innenzentrierten Struktur diejenigen sind, die vom Zentrum eines Würfels (V oder Cu) zu den Ecken (Ga) reichen, und die etwas Längeren (Abstände V-V und V-Cu) diejenigen zu benachbarten Würfelzentren sind. Die Ga-GaAbstände variieren von 2.673(2) Å bis 3.454(2) Å und erstrecken sich über einen größeren Bereich, als die übrigen Metall-Metall-Abstände. Diese größere Dispersion in den Abständen ist charakteristisch für Gallium und ein weiteres Beispiel für die Flexibilität des Metalls. Bis auf einige kurze V-V-Abstände existieren sonst keine direkten V-V- und insbesondere keine direkten Cu-Cu-Kontakte, was eindrucksvoll die Beobachtungen bestätigt, dass auch in intermetallischen Verbindungen eine Tendenz zu möglichst hoher Ordnung und großer Separation vorherrscht, trotz geringer Differenzen der Elektronegativitäten und der Atomvolumina der Metalle. Ein Vergleich des aus Einkristalldaten berechnetem und gemessenem Pulverdiagramm zeigt eine sehr gute Übereinstimmung der Lage und Intensitäten der Reflexe. Zusätzliche Linien geringer Intensität in Abb. 4.38 stammen von CuGa2. Intensität berechnet gemessen * 10 * 20 30 * ** 40 ** 50 60 * 70 80 90 2 -The ta Abb. 4.38: Pulverdiagramm von V11Cu9Ga46. Die mit einem Stern gekennzeichneten Reflexe gehören zu CuGa2. 159 4.2.2 V11Cu9Ga46 ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Tab. 4.11: Angaben zur Strukturbestimmung von V11Cu9Ga46 Rel. Molmasse Kristallsystem Raumgruppe Zellabmessungen 4339.32 g/mol kubisch P m –3 n (Nr. 223) a = 23.362(3) Å Zellvolumen Anzahl der Formeleinheiten Röntgendichte Messtemperatur Diffraktometer Röntgenstrahlung V = 12750.75 Å3 12 6.781 g/cm3 20°C STOE IPDS Mo Kα1 Graphit-Monochromator 23280.0 ±26; ±26; ±26 48° 400 Platten à 4 min bei 0.25° ϕ-Inkrement 6.0 77338 97 1797 1797 969 Polyeder 0.1 * 0.1 * 0.1 mm3 numerisch; Equivalent-Methode 0.1720 (0.0437) 35.54 mm-1 0,000001 + 0.97; -1.84 (0.25) e/ Å3 1 / [σ2 * F02 + (0,02840 * P) 2 + 0.0 * P] mit P = (F02 + 2 * Fc2) / 3 170 R1(F) = 0.0291; wR2(I) = 0.0586 F (0 0 0) Meßbereich h, k, l max. 2θ Mess- / Scanmodus I / σ(I)-Verhältnis Messwerte davon unbeobachtet unabhängige Reflexe davon mit I > 0 davon mit I > 2σ(I) Kristallform Kristallabmessungen Absorptionskorrektur Interner Standard Schwächungskoeffizient Extinktionskoeffizient (SHELX98) Restelektronendichte Wichtungsfunktion Zahl der Parameter R- Werte 160 4. Galliumreiche Verbindungen ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Tab. 4.12: Strukturdaten zum V11Cu9Ga46 Summenformel Kristallsystem Raumgruppe Gitterkonstante Zellvolumen Formeleinheiten / Zelle röntgenographische Dichte Pearson Code Cu9 Ga46 V11 kubisch P m -3 n (no. 223) a = 23.362(3) Å 12750.58(300) Å3 12 6.781 g/cm3 cP792 Ortskoordinaten in V11Cu9Ga46 Atom Wyck. Symm. x y z Ueq V1 V2 V3 V4 V5 V6 V7 V8 Cu1 Cu2 Cu3 Cu4 Ga1 Ga2 Ga3 Ga4 Ga5 Ga6 Ga7 Ga8 Ga9 Ga10 Ga11 Ga12 Ga13 Ga14 Ga15 Ga16 6b 6d 8e 12f 12h 16i 24k 48l 12f 24k 24k 48l 2a 6c 16i 24j 24k 24k 24k 48l 48l 48l 48l 48l 48l 48l 48l 48l mmm.. -4m.2 .32 mm2.. mm2.. .3. m.. 1 mm2.. m.. m.. 1 m-3. -4m.2 .3. ..2 m.. m.. m.. 1 1 1 1 1 1 1 1 1 0 1/4 1/4 0.2620(1) 0.6274(1) 0.6117(1) 0.7333(1) 0.6112(1) 0.3781(1) 0.6184(1) 0.7390(1) 0.7415(1) 0 1/4 0.6798(1) 0.9064() 0.5900() 1/2 0.5867(1) 0.5572(1) 0.6756(1) 0.5595(1) 0.6825(1) 0.6777(1) 0.8043(1) 0.5616(1) 0.8018(1) 0.6821(1) 1/2 1/2 1/4 0 1/2 0.6117(1) 1/2 0.6413(1) 0 1/2 1/2 0.6253(1) 0 0 0.6798(1) 0.5935(1) 0.6675(1) 0.6655(1) 1/2 0.5646(1) 0.5721(1) 0.5722(1) 0.5698(1) 0.5613(1) 0.5612(1) 0.5642(1) 0.5578(1) 0.6889(1) 1/2 0 1/4 0 0 0.3882(1) 0.2436(1) 0.1131(1) 0 0.2397(1) 0.1215(1) 0.2492(1) 0 1/2 0.3202(1) 1/4 0 0.0916(1) 0.4077(1) 0.3058(1) 0.1776(1) 0.1801(1) 0.0612(1) 0.3161(1) 0.1866(1) -0.0593(1) 0.3101(1) 0.1835(1) 0.0078(8) 0.0106(8) 0.0104(7) 0.0099(8) 0.0182(8) 0.0088(6) 0.0097(4) 0.0096(3) 0.0222(6) 0.0124(4) 0.0140(4) 0.0152(3) 0.0203(1) 0.0170(6) 0.0136(4) 0.0199(3) 0.0185(4) 0.0194(4) 0.0196(3) 0.0145(3) 0.0131(2) 0.0142(3) 0.0134(2) 0.0134(3) 0.0133(3) 0.0143(2) 0.0147(2) 0.0128(2) 161 4.2.2 V11Cu9Ga46 ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Tab. 4.13: ausgewählte Abstände in V11Cu9Ga46. Ga1 Ga7 2.957(2) 12x Ga2 Ga5 Ga6 Ga4 2.852(2) 4x 2.912(2) 4x 3.090(1) 4x V1 Ga14 Cu1 V5 2.496(1) 8x 2.847(3) 2x 2.976(3) 2x V2 Ga11 Cu3 V5 2.682(1) 8x 2.851(2) 4x 2.864(3) 2x Ga16 Ga3 Cu4 2.637(1) 6x 2.841(1) 2x 2.919(1) 6x V4 Ga8 Ga10 Cu1 Cu2 2.564(2) 4x 2.570(2) 4x 2.713(4) 2.767(2) 2x V5 Ga11 Ga14 V2 V1 2.523(2) 4x 2.553(2) 4x 2.864(3) 2.976(3) V6 Ga8 Ga12 Ga7 Ga3 2.558(2) 3x 2.568(2) 3x 2.714(2) 3x 2.753(2) Ga3 Ga13 Ga12 Ga15 Ga9 Cu2 Cu3 Cu4 2.753(2) 2.563(2) 2.572(2) 2.608(2) 2.653(2) 2.687(3) 2.856(3) 2.937(1) V3 V7 162 2x 2x 2x 2x 2x V8 Ga14 Ga13 Ga10 Ga16 Ga15 Ga4 Ga11 Ga9 Ga6 Ga5 2.487(2) 2.545(2) 2.554(2) 2.586(2) 2.604(2) 2.612(1) 2.652(2) 2.674(2) 2.707(2) 2.758(2) Cu1 Ga14 Ga10 V4 V1 2.546(2) 4x 2.577(2) 4x 2.713(4) 2.847(3) Cu2 Ga10 Ga8 Ga9 Ga12 V7 V4 2.584(2) 2.590(2) 2.595(2) 2.676(2) 2.687(3) 2.767(2) 2x 2x 2x 2x Cu3 Ga11 Ga13 Ga9 Ga11 V2 V7 2.527(2) 2.585(2) 2.598(2) 2.620(2) 2.851(2) 2.856(3) 2x 2x 2x 2x Cu4 Ga3 Ga16 Ga15 Ga13 Ga9 Ga12 Ga16 Ga16 V3 V7 2.540(2) 2.548(2) 2.550(2) 2.556(2) 2.591(2) 2.627(2) 2.628(2) 2.647(2) 2.919(1) 2.937(1) 4. Galliumreiche Verbindungen ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ 4.2.2.1. Koordinationsverhältnisse Die Kristallstruktur von V11Cu9Ga46 wird von 28 symmetrieunabhängigen Atomen aufgebaut (acht V-Lagen, vier Cu-Lagen und 16 Ga-Lagen), deren Koordinationspolyeder in Abb. 4.39 bis Abb. 4.42 zusammengestellt sind. Zwei der Vanadiumlagen – V6 auf 16i und V8 auf 48l – sind, wie in Abb. 4.39 dargestellt, zehnfach in Form eines ZentaurPolyeders koordiniert, dem kennzeichnenden Strukturmotiv der in Kapitel 4.1. beschriebenen Strukturfamilie des (MoGa5)nGa und des zu Mo8Ga41 isotypen V8Ga41. Dieser Befund war zunächst überraschend, da diese etwas ungewöhnlich Art von Koordination im Typ des V2Cu3Ga8 nicht auftritt. Ga Ga Ga Ga Ga Ga Ga Ga Ga Ga V6/8 Ga Ga Ga Ga Ga V6/8 Ga Ga Ga Ga Ga Abb. 4.39: Koordinationspolyeder der Vanadiumatome auf den Lagen V6 und V8. Das Zentaur-Polyeder ist so dargestellt, dass die Ikosaederhälfte nach oben zeigt (Stereobild). Das Zentaur-Polyeder lässt sich zwar aus einem zweifach überkapptem Würfel herleiten, der ebenfalls die Koordinationszahl 10, bzw. 8+2 hat, jedoch ist die daraus resultierende Verzerrung derart groß, dass man nicht mehr von einer würfelförmigen Umgebung sprechen kann, und somit ein eigenes Koordinationspolyeder entsteht. Die grau 163 4.2.2 V11Cu9Ga46 ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ dargestellten Atome in Abb.4.40 stellen die Eckpunkte des Würfels dar, der an zwei benachbarten Flächen von den weiß dargestellten Atomen überkappt wird. Um von dort zum Zentaur-Polyeder zu gelangen, werden die weißen und schraffierten Kreise entlang der Pfeilrichtung etwas verschoben, so dass die weißen Kreise aufeinander zurücken, und die schraffierten Kreise sich voneinander entfernen. Im Idealfall, wie z. B. im rhomboedrischen V8Ga41 hat das Zentaur-Polyeder die Punktsymmetrie 3 m ( C3v ), der zweifach überkappte Würfel dagegen besitzt nur die Punktsymmetrie m m 2 ( C2v ). 1 1 2 2 2 1 1 1 1 2 2 1 Abb. 4.40: 2 2 2 1 Gegenüberstellung von zweifach überkapptem Würfel (oben) und ZentaurPolyeder (unten). Im Zentaur-Polyeder ist die Lage der dreizähligen Achse mit dargestellt. (Stereobilder) 164 4. Galliumreiche Verbindungen ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Wie im V8Ga41 sind auch im V11Cu9Ga46 acht solcher Zentaur-Polyeder über gemeinsame Spitzen zu einem Würfel kondensiert, wobei diese Kondensation auch hier über die Ikosaederhälfte erfolgt, so dass zwei Galliumpositionen – Ga1 auf 2a und Ga2 auf 6c – kuboktaedrisch von jeweils zwölf Ga-Atomen koordiniert sind. Die Lagesymmetrie der beiden Ga-Atome (Ga1: -3 m ; Ga2: -4 2 m ) erlaubt eine gewisse Verzerrung der Kuboktaeder (Punktsymmetrie m -3 m), die auch in beiden Fällen in geringem Maße zu beobachten ist. Wie im V8Ga41 und den Verbindungen des Typs (MoGa5)nGa sind diese beiden Ga-Atome die einzigen, die ausschließlich von Gallium umgeben sind. Alle anderen GaPositionen weisen mindestens zwei weitere Kontakte zu Vanadium bzw. Kupfer auf. Ga7 Ga7 Ga7 Ga7 Ga7 Ga7 Ga1 Ga7 Ga7 Ga7 Ga7 Ga7 Ga7 Ga5 Ga4 Ga4 Ga6 Ga6 Ga6 Ga2 Ga5 Ga5 Ga5 Ga4 Ga4 Ga6 Abb. 4.41: Polyeder der beiden kuboktaedrisch koordinierten Ga-Positionen im Zentrum der Würfel aus Zentauren. Die Koordinationspolyeder der restlichen Vanadiumatome stellen verzerrte Ga8-Würfel dar, die in unterschiedlichem Maße von Vanadium bzw. Kupfer überkappt sind (Abb.4.42). Ähnliches gilt für die Kupferatome, wobei dieses Metall bemerkenswerterweise nur eine einzige Art der Koordination bevorzugt, die sich auf vier Lagen verteilt. Dies ist ein Ga8-Würfel, der auf zwei gegenüberliegenden Flächen von Vanadium überkappt ist. Die Koordinationspolyeder der Galliumatome bilden weitgehend mehr oder weniger verzerrte Oktaeder oder diesem verwandte Polyeder, die über einigen Dreiecksflächen von Vanadium bzw. Kupfer überkappt sind, also die typischen Polyeder für Ordnungs- und Defektvarianten der kubisch-innenzentrierten Struktur. Stärkere Abweichungen von dieser Geometrie betreffen diejenigen Atome, die sich in unmittelbarer Nachbarschaft zu den Zentaur-Polyedern befinden. 165 4.2.2 V11Cu9Ga46 ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ V5 Ga14 Ga14 Cu4 V5 Ga14 Ga14 Ga11 Ga11 Ga11 Ga16 Ga3 Ga11 Cu3 Cu1 V1 Ga14 Ga14 Cu1 Ga14 Ga14 Ga11 Ga11 Ga10 Ga8 Ga10 Ga10 Ga10 Cu2 Ga14 Ga14 Ga12 Ga10 Ga10 Ga8 Ga14 Ga14 Ga9 V1 Ga11 Ga11 Ga3 Ga2 Cu4 Ga13 Ga13 Ga16 Ga16 V3 Ga9 Ga16 Ga3 Ga13 V8 Abb. 4.42: Koordinationspolyeder in V11Cu9Ga46 Ga16 Ga16 Ga9 Ga12 Ga15 Ga13 V7 V8 Ga13 Ga16 Ga14 Ga2 Ga15 Ga6 Ga5 Ga11 Ga4 Ga6 Ga4 Cu4 16 Ga13 Ga9 Cu4 V8 Ga15 Cu4 Ga15 V7 Ga5 Ga6 Ga12 Cu3 V3 Ga11 Ga9 Ga13 Ga12 Ga9 V6 Ga12 V7 Cu3 V7 Ga12 Ga9 Ga13 V2 Ga8 Ga10 Ga12 Ga16 Cu4 Cu2 Ga14 Ga3 Ga15 V1 Cu1 166 Ga12 V4 Ga10 Cu4 Cu4 Ga11 Ga11 Ga14 Ga14 V4 Ga14 Ga16 Ga16 V5 Cu1 V3 Cu4 Cu4 Ga11 Ga11 Ga10 Cu2 Ga10 Ga11 V2 V4 Ga8 Cu4 V5 Cu2 Ga8 Cu3 Ga11 V5 Ga8 Cu4 Cu3 V2 Cu3 Ga16 Ga16 Ga11 Ga5 Ga13 Ga16 Ga4 Ga6 Ga14 V8 Ga11 4. Galliumreiche Verbindungen ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ V8 Ga4 Ga5 Ga15 Ga14 Ga8 Ga10 Ga8 Ga1 Ga6 Ga2 Ga10 V6 Ga7 Ga7 Ga12 V4 Cu2 Ga7 Ga8 Ga8 Ga8 Ga15 Ga14 Ga4 Ga5 Ga10 Ga9 Ga9 Ga12 Cu3 Ga14 Cu1 Ga10 Ga8 Ga13 V4 Cu2 Cu3 Ga12 Ga8 Ga11 Cu4 Ga16 Ga11 V2 Cu3 Ga11 Ga14 Cu4 Cu3 Ga15 Ga11 Ga11 Ga9 Ga9 V6 V1 V7 Ga13 Ga13 Ga15 V5 Cu1 Ga14 Ga14 Ga11 Ga14 Ga10 V7 Cu2 V8 Ga5 Ga9 V8 Ga4 Ga6 Ga5 Ga16 Ga12 Ga15 Ga15 Cu4 V3 V7 Cu4 Ga10 V5 Ga10 Ga8 Ga16 Ga14 Ga10 Ga9 Ga13 Ga12 Ga7 V8 V7 Cu4 Ga3 Ga7 V8 Cu2 Ga16 V6 Ga15 V8 Ga12 Ga12 V6 V8 Ga10 Ga11 Ga8 Ga8 Ga7 Ga7 Ga12 Cu4 Ga3 Ga16 Ga13 Ga16 Ga9 Ga13 Cu4 V8 Ga4 Ga4 Ga6 V8 Ga15 Abb. 4.42: Koordinationspolyeder in V11Cu9Ga46 (Fortsetzung) 167 4.2.2 V11Cu9Ga46 ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ 4.2.2.2. Strukturbeschreibung Die charakteristischen Bauelemente im V11Cu9Ga46 sind Würfel aus Zentaur-Polyeder wie im V8Ga41, sowie metallzentrierte Ga8-Würfel, deren Flächen in unterschiedlichem Maße von weiteren Vanadium- und Kupferatomen überkappt sind, und die an die Struktur des CuGa2 erinnern. Die Strukturmotive dieser dem V11Cu9Ga46 benachbarten binären Randphasen werden in der Kristallstruktur derart miteinander verknüpft, dass auch auf hierarchischer Ebene einfache hochsymmetrischer Strukturen in Form von Polyedern imitiert werden. So sind etwa die Würfel aus Zentaur-Polyedern analog den Atomen im Cr3Si-Typ angeordnet, und eine Teilstruktur aus diesen Würfeln aus Zentauren bildet mit weiteren Polyedern eine Anordnung nach der Art des γ-Messing. Schließlich sind die Koordinationspolyeder der Vanadiumatome innerhalb der gesamten Struktur so geschickt verteilt, dass Vanadium für sich betrachtet das Muster einer kubisch-innenzentrierten Kugelpackung bildet, was der Struktur des elementaren Vanadiums entspricht, die hier bezüglich der Abstände um den Faktor zwei skaliert ist. Dies entspricht der Verteilung der Übergangsmetalle im ReGa4 und V2Cu3Ga8, die ja auch innerhalb dieser Strukturen – für sich betrachtet – ein kubisch-innenzentriertes Teilgitter bilden. Eine weitere Parallele zum V2Cu3Ga8 besteht in der Koordination der Kupferatome in Form zweifach von Vanadium überkappter Ga8-Würfel. Die Ga-zentrierten Ga12-Kuboktaeder in der Kristallstruktur wirken sich auf das Galliumteilgitter dahingehend aus, dass die weitgehend kubisch-primitive Galliumstruktur an eben diesen Stellen gestört wird. Dies hat Konsequenzen bezüglich der Art und Anzahl von Würfellücken in deren nächster Umgebung, Neu hingegen ist im V11Cu9Ga46 das Auftreten völlig voneinander separierter Würfel aus Zentauren, wie sie in dieser Weise in den Strukturen des (MoGa5)nGa und natürlich auch im V8Ga41 nicht realisiert werden. Dort erfolgte die Verknüpfung der entsprechenden Baugruppen untereinander immer so, dass die Ga-Atome an der Peripherie der Würfel aus Zentaur-Polyeder jeweils zwei Clustern gleichzeitig angehörten. 168 4. Galliumreiche Verbindungen ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ 4.2.2.3. Die Gallium-Teilstruktur Wegen der Komplexität erscheint es sinnvoll, die Struktur zunächst in Untergitter aufzuteilen und separat zu betrachten, was sich bei einer Ordnungs- und Defektvariante der kubisch-innenzentrierten Struktur geradezu anbietet. In Abb. 4.43 ist die Teilstruktur der Galliumatome dargestellt, die ein annähernd kubisch-primitives Gerüst bildet. Die 8x8x8Matrix stellt damit eine 512-fache Überstruktur bzgl. des CsCl-Typs dar. Nicht dargestellt sind die kuboktaedrisch koordinierten Ga-Atome der Lagen 2a und 6c, da sie topologisch zum anderen Teilgitter gehören. Abb. 4.43: Ga-Teilstruktur in V11Cu9Ga46, bestehend aus einer annähernd regulär kubischen Matrix aus 8x8x8-Ga-Würfeln. Blick in (100)-Richtung der Elementarzelle. Der Ausschnitt beträgt in z = – 1/8 bis + 1/8. 169 4.2.2 V11Cu9Ga46 ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Signifikante Störungen des Gitters erkennt man in dem hier gewählten Ausschnitt um den Ursprung und entlang der Flächenmitten der Elementarzelle. Diese werden durch die Würfel der Zentaur-Polyeder (rote Bindungen in Abb. 4.43) bzw. durch die kuboktaedrische Umgebung im Zentrum dieser Polyeder hervorgerufen (dunkelblau dargestellt in Abb. 4.44). Insgesamt ist diese Störung aber nicht sehr groß, wie der Vergleich mit einem entsprechenden regulären Cluster aus dem ReGa4 zeigt (Abb. 4.44 rechts). Der Unterschied zwischen beiden Clustern besteht im wesentlichen eben in der kuboktaedrischen Umgebung des Zentralatoms, die sich aus der Verknüpfung der Zentaur-Polyeder ergibt, statt der kubischen Koordination in einem regulären Würfelkomplex aus dem ReGa4. Dieser reguläre, aus 27 Würfeln bestehende Cluster enthält insgesamt 64 Galliumatome, wohingegen der Würfel aus Zentauren 68 Galliumatome aufweist, also vier Zusätzliche. Dies korreliert direkt mit der Erhöhung der Koordinationszahl des Zentralatoms von acht in ReGa4 auf zwölf in V11Cu9Ga46, sowie der Verknüpfung der Zentauren untereinander über zwölf gemeinsame Galliumatome statt der acht Atome über den zentralen Würfel in ReGa4. Abb. 4.44: Würfel aus Zentauren (links) als Strukturmotiv im V11Cu9Ga46 im Vergleich zum Würfel aus Würfeln im ReGa4 (rechts) 170 4. Galliumreiche Verbindungen ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Dass im V11Cu9Ga46 ausgerechnet das Strukturmotiv der Würfel aus Zentauren auftritt, zeigt, dass dieser Baugruppe beim Aufbau von galliumreichen Verbindungen offenbar eine prinzipielle Bedeutung zukommt. Immerhin existiert ja als binäre Randphase das V8Ga41, in der dieses Strukturmotiv ausschließlich auftritt. Die hohe kubisch innenzentrierte Pseudosymmetrie der in Abschnitt 4.1 beschriebenen Verbindungen des (MoGa5)nGa-Typs tritt hier ebenfalls in Erscheinung. Alle Verbindungen lassen sich alternativ beschreiben als Strukturen mit Motiven des CsCl-Typs, in die ÜMGa12-Kuboktaeder nach unterschiedlichen Mustern eingebaut sind. Das V11Cu9Ga46 stellt in dieser Hinsicht eine neue Variante des (MoGa5)nGa-Typs dar. Ein wesentlicher Unterschied zum V8Ga41 und generell zu den Strukturen des (MoGa5)nGa besteht darin, dass diese Würfel aus Zentauren in der Struktur des V11Cu9Ga46 nun völlig voneinander separiert vorliegen, während sie in der erstgenannten Gruppe von Verbindungen immer über gemeinsame Galliumatome miteinander verknüpft sind. Abb. 4.45 zeigt die Lage der Würfel aus Zentaur-Polyeder im V11Cu9Ga46 (links) im Vergleich zur Verknüpfung dieser Baugruppen am Beispiel von V8Ga41 (rechts). Zwar liegen auch im V8Ga41 isolierte Würfel aus Übergangsmetall vor, die Würfel aus Zentaur-Polyeder selbst sind aber dahingehend noch miteinander verknüpft, als dass Galliumatome an der „Peripherie“ dieser Würfel gleichermaßen als Kontaktstelle zu benachbarten Baugruppen fungieren. Im V11Cu9Ga46 dagegen sind diese Cluster in der Weise ausgedünnt, dass der direkte Kontakt über gemeinsame Galliumatome verloren geht. Auf diese Weise entstehen neue Ga8-Würfel, die partiell mit Vanadium und Kupfer gefüllt sind. z=0 z=¼ z=0 z=0 Abb. 4.45: Links: Lage der Würfel aus Zentaur-Polyeder im V11Cu9Ga46 Rechts: Verknüpfung der Würfel aus Zentaur-Polyedern im V8G41 171 4.2.2 V11Cu9Ga46 ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Die Beschreibung als separierte oder isolierte Würfel aus Zentaur-Polyeder in V11Cu9Ga46 lässt sich anhand der Summenformel bzw. der Anzahl der Galliumatome pro Elementarzelle verifizieren. Ein Würfel aus Zentaur-Polyeder hat die Zusammensetzung (V8Ga68)Ga, wobei das außerhalb der Klammer stehende Gallium das kuboktaedrisch koordinierte Atom im Zentrum des Clusters symbolisiert. Die Elementarzelle enthält acht dieser Baugruppen, was einer Zusammensetzung (V64Ga544)Ga8 = V64Ga552 entspricht, also genau der Anzahl an Galliumatomen pro Elementarzelle. Die restlichen Vanadiumatome und die Kupferatome verteilen sich auf Gitterplätze zwischen den Zentaur-Clustern. Nach dieser Darstellung besteht theoretisch die Möglichkeit, dass sich das V11Cu9Ga46 formal aus den Strukturen des V8Ga41 und dem im letzten Abschnitt vorgestellten V2Cu3Ga8 herleiten lässt. Dieser Zusammenhang sollte möglich sein, auch wenn das Strukturmotiv des V2Cu3Ga8 – der dreifach überkappte Würfel – nicht direkt in der Kristallstruktur vorhanden ist. Dass dies nicht der Fall ist, lässt sich rechnerisch auf einfache Weise zeigen, indem man die Summenformel nach strukturchemischen Gesichtspunkten Folgendermaßen aufteilt: das Motiv des V8Ga41 – der (V8Ga68)Ga-Cluster – enthält ein Ga-Atom im Zentrum, acht V-Atome als Würfel, zwölf Ga-Atome, die den Kuboktaeder bilden sowie 56 weitere Ga-Atome an der Peripherie des Clusters, die jedoch nur zur Hälfte gezählt werden dürfen, da sie gleichzeitig zum zweiten, hypothetischen V2Cu3Ga8-Motiv angehören. Die Summenformel dieser V8Ga41-Teilstruktur ergibt 8 x Ga V8 Ga12 Ga56/2 = Ga8 V64 Ga96 Ga224 = V64 Ga328 Subtrahiert man diese Anzahl Atome von den 132 Vanadium, 108 Kupfer und 552 Galliumatomen pro Elementarzelle, verbleibt ein Rest der Zusammensetzung V68Cu108Ga224, der im Vergleich zum V2Cu3Ga8 zu wenig Gallium bzw. zuviel Vanadium und Kupfer enthält. Normiert auf die stöchiometrischen Faktoren von Vanadium bzw. Gallium lautet die Summenformel dieser Teilstruktur V2Cu3,2Ga6,6 bzw. V2,4Cu3,9Ga8. Bezüglich einer Zusammensetzung nach dem Muster aus V8Ga41 und V2Cu3Ga8 müsste die Elementarzelle 120 Vanadium-, 84 Kupfer- und 552 Galliumatome haben, was einer Zusammensetzung von V10Cu7Ga46 entspräche. Dass die Struktur des V11Cu9Ga46 nicht eine Teilstruktur des V2Cu3Ga8 enthält, kann man schon an den Koordinationspolyedern der Vanadiumatome und deren Zähligkeit abschätzen, deren Koordinationszahlen in der Regel höher sind als im V2Cu3Ga8. 172 4. Galliumreiche Verbindungen ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ 4.2.2.4. Motive der Elementstruktur des Vanadiums V1 6b (0, ½, ½) V4 12f (0.262, 0, 0) V2 6d ( ¼, ½, 0) V3 8e ( ¼, ¼, ¼) V5 12h (0.627, ½, 0) V6 16i (0.611, 0.611, 0.388) = V7 24k (0.733, ½, 0.243) Abb. 4.46: V8 48l (0.611, 0.641, 0.113) Anordnung der Vanadiumatome in V11Cu9Ga46 gegliedert nach kristallographischen Lagen 173 4.2.2 V11Cu9Ga46 ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Die Würfelzentren bzw. die Leerstellen in der Galliummatrix bilden das zweite Teilgitter, das von Vanadium und Kupfer teilweise besetzt wird. Topologisch gesehen gehören auch zwei Ga-Lagen dazu; dabei handelt es sich um die beiden kuboktaedrisch koordinierten Ga-Atome im Zentrum der Würfel aus Zentauren auf den Lagen Ga1 auf 2a (0, 0, 0) und Ga2 auf 6c (¼ , 0, ½). Darüber hinaus sind auch tatsächliche Lücken, also leere Ga-Würfel vorhanden. Eine ausführliche Analyse der Kristallstruktur bzgl. Füllungsgrad und Anzahl der Lücken erfolgt in Abschnitt 4.2.2.6. ab Seite 183. An dieser Stelle sei nur vermerkt, dass im V11Cu9Ga46 aufgrund des Auftretens der Cluster aus Zentauren und der damit verbundenen Verzerrungen einige der regulären Würfel eines unverzerrten kubischen Gitters in andere Polyeder umgewandelt oder derart verzerrt werden, dass man nicht mehr von Lücken im eigentlichen Sinne sprechen kann. In Abb. 4.46 sind die Positionen der Vanadiumatome im V11Cu9Ga46 entsprechend ihrer Lagesymmetrie einzeln aufgeführt. Die Darstellung von Atomen auch außerhalb der Elementarzelle einiger Atomlagen erfolgte dabei nach strukturchemischen Gesichtspunkten, und soll zum Verständnis der Symmetrie der Struktur beitragen. Lässt man die Position des V5 auf 12h einmal außer Betracht, bilden die Vanadiumatome mit den beiden oben angesprochenen Galliumlagen 2a und 6c für sich betrachtet eine leicht verzerrte kubisch-innenzentrierte Struktur, wobei bemerkenswerterweise die würfelförmig angeordneten Vanadiumatome V6 auf 16i und V8 auf 48l, also die 10-fach in Form eines Zentaur-Polyeders koordinierten V-Atome, das eine Teilgitter bilden, und die restlichen Vanadiumpositionen mit den beiden Galliumlagen das andere Teilgitter dieser innenzentrierten Anordnung aufbauen. Dabei findet innerhalb der Vanadiumlagen nicht nur eine strukturchemische Separation bezüglich der ersten Koordinationssphäre statt (Vanadium im Zentaur-Polyeder – Vanadium im Würfel) sondern auch innerhalb der Teilstruktur des Vanadiums für sich betrachtet, die sich darin äußert, dass gleichartig koordinierte Vanadiumatome zum gleichen Untergitter gehören. In Abb. 4.47 auf der folgenden Seite ist diese innenzentrierte Anordnung wiedergegeben, wobei die Lagen V6 und V8 schwarz dargestellt sind. Sieht man von den Galliumatomen in dieser Teilstruktur einmal ab, deren Anteil lediglich 6,67% beträgt, ist im V11Cu9Ga46 implizit die kubischinnenzentrierte Struktur des elementaren Vanadiums enthalten, skaliert um den Faktor zwei, was sich auch an den Abständen äußert. Im elementaren Vanadium betragen diese 3.026 Å im V11Cu9Ga46 aufgrund von Verzerrungen im Durchschnitt etwa 6.0 Å. 174 4. Galliumreiche Verbindungen ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Ga V V6 + V8 Abb. 4.47: kubisch-innenzentrierte Anordnung der Vanadiumatome im V11Cu9Ga46 mit den beiden Galliumlagen Ga1 und Ga2. Die einzige Vanadiumposition, die nicht direkt dieser kubisch-innenzentrierten Teilstruktur angehört, ist V5 auf der Lage 12h. Nach strukturchemischen Aspekten erfüllt diese Lage eher die Funktion der Kupferatome, die einen weiteren Teil der Lücken im Galliumgitter auffüllen. Bei Röntgenstrukturanalysen an einigen Einkristallen konnte auf dieser Lage wiederholt eine leichte Überbesetzung festgestellt werden, die entweder auf eine V-CuMischbesetzung oder auf eine Cu-Lage mit leichtem Defizit hindeutet. Ein Vergleich der Koordinationspolyeder in Abb. 4.42 zeigt, dass diese Lage die gleiche Art der Koordination aufweist, wie die Cu-Atome, nämlich einen Ga8-Würfel, der an zwei gegenüberliegenden Flächen von Vanadium überkappt ist. Andererseits ist gerade diese Position innerhalb der Struktur des V11Cu9Ga46 im Zusammenhang mit den Lagen V1 und V2 derart charakteristisch, dass es sinnvoll erscheint, diese Position doch als Vanadium zu betrachten, wie im nächsten Abschnitt erläutert wird. 175 4.2.2 V11Cu9Ga46 ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Die hohe kubisch-innenzentrierte Pseudosymmetrie ist auch in den Pulverdiagrammen zu erkennen (Abb.4.48). Die Dimension der Überstruktur lässt sich nicht nur aus den Gitterkonstanten der entsprechenden Verbindungen abschätzen, sondern auch anhand der indizierten Pulverdiagramme regelrecht ablesen. Dabei sind in einer kubisch-innenzentrierten Anordnung im allgemeinen die h,0,0-, h,h,0- und h,k,k-Reflexe diejenigen mit der höchsten Intensität, da diese Netzebenen besonders dicht mit Atomen besetzt sind, und dementsprechend die höchste Elektronendichte aufweisen. Die große Ähnlichkeit der Pulverdiagramme von V11Cu9Ga46 und V2Cu3Ga8 mit dem von Cu5Zn8 zeigen die Analogie der Strukturen zum γ-Messing. 8,0,0 8,8,0 16,0,0 16,8,8 4,0,0 4,4,0 8,0,0 8,4,4 3,0,0 3,3,0 6,0,0 6,3,3 2,0,0 2,2,0 4,0,0 4,2,2 1,0,0 1,1,0 2,0,0 2,1,1 V11Cu9Ga46 Intensität V2Cu3Ga8 Cu9Ga4 ReGa4 CsCl 10 20 30 40 50 60 70 80 2 Theta Abb. 4.48: Pulverdiagramme von Verbindungen, die als Überstrukturen der kubisch-innenzentrierten Kugelpackung aufgefasst werden können. 176 90 4. Galliumreiche Verbindungen ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ 4.2.2.5. Motive des Cr3Si-Typs Ähnlich wie die Strukturen des MoZn6 oder Mo7Sn12Zn40 lässt sich auch das V11Cu9Ga46 nach einem hierarchischen Prinzip beschreiben, dahingehend, dass die Zentren großer Baugruppen einfache und hochsymmetrische Plätze in der Kristallstruktur besetzen. Die Zentren der würfelförmigen Einheiten aus jeweils acht Zentaur-Polyedern – Ga1 auf 2a und Ga2 auf 6c – besetzen die gleichen Positionen, wie die Atome in der Struktur des Cr3Si (a = 4.56 Å), das ebenfalls in der Raumgruppe P m –3 n kristallisiert[80]. Auf diese Weise bilden die Würfel im V11Cu9Ga46 ein Polyeder-analoges Pendant zur Struktur des Cr3Si-Typs. Abb. 4.48 zeigt die Parallele zwischen Atom- und Polyederanordnung beider Strukturen. Der Übersicht wegen sind im V11Cu9Ga46 nur die Würfel gezeichnet. Unterschiedlichen Grautöne symbolisieren die verschiedenen kristallographischen Lagen. Im Cr3Si-Typ, sind die Si-Atome, die ein kubisch-innenzentriertes Gitter bilden, verzerrt ikosaedrisch von zwölf Übergangsmetallen umgeben. Die primitive Symmetrie beruht auf der Tatsache, dass die verzerrten Ikosaeder um Ursprung und Zentrum der Elementarzelle um 90° verdreht angeordnet sind. = Abb. 4.49: Vergleich zwischen Atom- und Polyederanordnung im Cr3Si (links) und V11Cu9Ga46 (rechts). 80 J. E. Joergensen, S. E. Rasmussen, Acta Cryst. 1982, B38, 346-347 177 4.2.2 V11Cu9Ga46 ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Häufig wird betont, dass die Übergangsmetalle im Cr3Si-Typ entlang der Flächen der Elementarzelle Ketten bilden, die senkrecht zueinander entsprechend der drei Raumrichtungen verlaufen (Abb. 4.50). Dies sind auch mit dM-M = a/2 die kürzesten Abstände in der Struktur. Einige Verbindungen dieses Strukturtyps, der überwiegend von Metallen gebildet wird und von dem etwa 70 Vertreter bekannt sind, sind Supraleiter mit teilweise recht hohen kritischen Temperaturen. In vielen Untersuchungen wird der strukturelle Aspekt der Supraleitfähigkeit gerade mit diesen Ketten in Verbindung gebracht. Im V11Cu9Ga46 bilden die hellgrauen Würfel auf den Flächen der Elementarzelle in Abb. 4.49 ebenfalls Ketten entlang der drei Raumrichtungen mit einem Abstand dGa2-Ga2 = a/2 (Ga2 befindet sich im Zentrum der Würfel), die allerdings aufgrund der großen Gitterkonstanten einen Abstand von 11.681(2) Å haben. Abb. 4.50: Darstellung der Cr3Si-Struktur mit Hervorhebung der Cr-Ketten entlang der drei Raumrichtungen. Jeweils senkrecht zu diesen großen Würfel aus Zentaur-Polyedern verlaufen im V11Cu9Ga46 ebenfalls auf den Flächen der Elementarzelle und entlang der drei Raumrichtungen Ketten aus Vanadium-zentrierten Ga8-Würfeln, von denen jeder zweite noch auf gegenüber liegenden Seiten von Kupfer überkappt ist. Die Vanadiumatome haben in sofern direkten Kontakt zueinander, als dass sie sich in benachbarten Würfeln befinden, und auf diese Weise zur 8 + 6 – Koordination bezüglich einer kubisch-innenzentrierten Kugelpackung zu zählen sind. Die Ketten werden von den Lagen V1, V2 und V5 gebildet und die Abstände der V-Atome untereinander betragen etwa 2.8 bis 2.9 Å. 178 4. Galliumreiche Verbindungen ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Cu Ga V5 V1 V5 V2 V5 V1 V5 V2 V5 V1 V5 Cu Ga Cu4 V7 Cu4 V3 Cu4 V7 Cu4 V3 Cu4 V7 Cu4 Abb. 4.51: Stränge Metallzentrierter Ga8-Würfel und deren schematische Anordnung innerhalb der Struktur des V11Cu9Ga46 (Die Elementarzellen stellen Stereobilder dar. V-zentrierte Würfel: orange; Cu-zentrierte Würfel: gelb). 179 4.2.2 V11Cu9Ga46 ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Betrachtet man die Ga-Matrix in Abb. 4.43 auf Seite 169, fallen weitere „Kanäle“ auf, die ungestört von den Würfeln aus Zentaur-Polyeder entlang der Achsen verlaufen. Ein System dieser Kanäle aus Würfellücken ist ebenfalls vollständig besetzt, diesmal abwechselnd von Vanadium und Kupfer, wobei die Vanadium-zentrierten Würfel wieder von Kupferatomen überkappt (Abb.4.50, unten). Diese Stränge von Würfeln durchdringen sich jeweils in den Zentren der Oktanden der Elementarzelle auf den Koordinaten der V3-Atome (8e; ¼,¼,¼), während die Stränge auf den Flächen der Elementarzelle keinen Kontakt miteinander haben. Abb. 4.51zeigt jeweils eine Kette metallzentrierter Ga-Würfel in der Länge einer Elementarzelle, sowie deren Lage innerhalb der Struktur des V11Cu9Ga46 als Stereobild. Der Übersicht halber sind in den Stereobildern nur Würfel ohne überkappende Atome dargestellt. Alle weiteren Würfellücken, die innerhalb der Ga-Matrix noch als durchgehende Kanäle erkennbar sind, sind nicht mehr vollständig gefüllt und weisen echte Lücken auf. Ein Beispiel ist in Abb. 4.52 dargestellt, die eine Würfelschicht in Höhe x = 2/8 der Elementarzelle zeigt. Neben gefüllten und leeren Lücken erkennt man auch die Bereiche, an denen sich die Zentaur-Polyeder befinden. Durchgehende Stränge gefüllter Lücken sind durch Pfeile markiert. V Cu Ga Abb. 4.52: Blick in (100)-Richtung auf eine Würfelschicht in Höhe x = ¼ der Elementar zelle des V11Cu9 Ga46 180 4. Galliumreiche Verbindungen ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ x=0 x = 1/8 x = 2/8 x = 3/8 Abb. 4.53: Darstellung der V11Cu9Ga46Struktur auf der Basis von Schichten in Form von Ga8-Würfeln in Blickrichtung (100). Die Angabe der Höhe in x-Richtung bezieht sich auf die Ebene der V- und CuAtome. Ga im Kuboktaeder V Cu Ga x = 4/8 181 4.2.2 V11Cu9Ga46 ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Auch die Lage der Kupferatome innerhalb der Struktur erfolgt nicht wahllos oder zufällig, sondern nach einem bestimmten Prinzip. In Abb. 4.54 oben ist noch einmal die kubisch-primitive Teilstruktur der V-Atome mit Ga1 und Ga2 sowie V5 dargestellt, ohne die Lagen V6 und V8 in den Zentaur-Polyedern, die dieses Gitter zentrieren. In der Abbildung darunter sind zusätzlich die Kupferatome dargestellt, die alle ausschließlich Anordnung in zwischen einer linearen jeweils zwei Vanadiumatomen angeordnet sind. Diese bevorzugte Art der Koordination erkennt man bereits bei der Betrachtung der Koordinationspolyeder des Kupfers in Abb. 4.42 auf Seite 166, die alle diese eine Art der Koordinationssphäre bevorzugen, bei dem ein Ga8-Würfel auf zwei gegenüberliegenden Flächen von Vanadium überkappt ist. Die untere Abbildung zeigt zusätzlich noch die unbesetzten Ga8-Würfel als weiße Kreise, die das V- und Cu-Teilgitter innerhalb der Ga-Matrix „vervollständigen“, soweit es sich um kubisch koordinierte Plätze handelt, sowie die V-Atome auf den Lagen V6 und V8 in den Zentaur-Polyedern. V V6 + V8 Cu Ga Lücke Abb. 4.54: 182 Teilstruktur der V- und Cu-Atome sowie der leeren Würfel im V11Cu9Ga46 4. Galliumreiche Verbindungen ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Insgesamt bildet Vanadium und Kupfer zusammen mir den beiden Galliumatomen auf den Lagen 2a und 6c ein defektes kubisch-primitives Gitter, bei dem die Metalle in der Gestalt ausordnen, das sich strukturchemisch ein bemerkenswert differenzierte Struktur bildet. Darin bevorzugen alle Kupferatome die gleiche Umgebung, und die Vanadiumatome separieren nach Art ihrer ersten Koordinationssphäre – Zentaur oder Würfel – in zwei Teilgitter, die für sich betrachtet eine kubisch-innenzentrierte Anordnung bilden. Dieses Strukturmodell wurde ausnahmslos an allen Einkristallen bestätigt, unabhängig von der Zusammensetzung der Schmelze. An keinem der vermessenen Kristalle konnte auf den Positionen der Lücken Restelektronendichte festgestellt werden, die darauf hindeuten würde, dass diese Lagen – wenn auch nur partiell – besetzt wären. Umgekehrt wurden auch keine nennenswerte Unterbesetzung festgestellt, sodass auch deutliche Defizite ausgeschlossen werden können. Selbst die V5-Lage auf 12h, welche die gleiche Koordination aufweist, wie die Kupferatome, zeigte nie eine Überbesetzung, obwohl vom strukturchemischen Standpunkt aus diese Position eher für Kupfer als für Vanadium spricht. Diese Vanadiumposition ist auch die einzige, die nicht zu der kubisch-innenzentrierten Teilstruktur der restlichen Vanadiumatome gehört. Auf der anderen Seite ist das Strukturmotiv der linearen Ketten aus Vanadium in den Ga-Würfeln entlang der Flächen der Elementarzelle derart charakteristisch und auffällig, dass es durchaus sinnvoll erscheint, das diese Lage auch von Vanadium besetzt ist. Wäre diese Position mit Kupfer besetzt, betrüge das Defizit aus röntgenographischen Daten immerhin 33.3%. Erfahrungsgemäß sind derartige Unter- oder Mischbesetzungen auch von der Zusammensetzung der Schmelze abhängig, in der sich die Kristalle bilden und machen sich bei entsprechendem Atomvolumen der unterschiedlichen Metalle auch in einer Änderung der Gitterkonstanten bemerkbar. Diesbezüglich konnten allerdings bei allen vermessenen Kristallen so gut wie keine Änderungen beobachtet werden. Zwar schwanken die Gitterkonstanten zwischen 23. 287(2) Å und 23.394(3) Å, der Unterschied beträgt in Anbetracht der Größe der Elementarzelle aber nur 0.42%. Darüber hinaus zeigten Einkristalle mit kleiner Gitterkonstante eher ein sehr geringes Vanadiumdefizit gerade auf der Lage V5, was mit der Änderung der Gitterkonstanten korreliert, da Vanadium ein etwas größeres Atomvolumen im Vergleich zum Kupfer hat. Schließlich sprechen auch die EDXAnalysen für Vanadium, deren Messungen ein V:Cu-Verhältnis von 1.4 : 1.0 ergaben. Bei einer vollständigen Besetzung mit Kupfer würde das Verhältnis 1 : 1 betragen. 183 4.2.2 V11Cu9Ga46 ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ 4.2.2.6. Defekte in V11Cu9Ga46 Der Vollständigkeit halber sei hier auch die Umgebung der Lücken in Form von Koordinationspolyedern dargestellt, die erwartungsgemäß leicht verzerrte Ga8-Würfel darstellen, die in unterschiedlichem Maße von Vanadium und Kupfer überkappt sind. Soweit es sich um leere Ga8-Würfel handelt, hat das V11Cu9Ga46 insgesamt 120 solcher Lücken, die sich auf vier kristallographische Lagen verteilen: Lücke Wyck. Symm. x y z L1 L2 L3 L4 24j 24k 24k 48l ..2 m.. m.. 1 0.12515 0.61984 0.12764 0.37340 3/4 1/2 0 0.25049 0.37485 0.11953 0.24840 0.38109 V8 Ga11 Ga9 Cu3 V4 V8 Ga13 Ga16 Cu4 Cu3 Ga13 Ga11 Ga9 Ga16 Ga10 Cu4 Ga9 Ga11 Ga14 Cu3 Cu2 Cu1 Ga10 Ga14Ga11 Ga9 Ga10 Ga8 V8 Ga10 Ga8 Ga15 Ga10 Ga9 Ga16 Cu4 V5 Cu2 Ga15 Ga12 Ga15 V8 V8 V7 L1 L2 L3 Ga12 Ga12 Ga8 Cu4 Ga3 Ga12 V6 L4 Abb. 4.55: Koordinationspolyeder der würfelförmigen Leerstellen in V11Cu9Ga46, Im Vergleich zu einer 8x8x8 = 512-fachen Überstruktur des CsCl-Typs hat die Elementarzelle des V11Cu9Ga46 bezüglich einer 1:1-Aufspaltung in ein kubisch-primitives Ga-Gitter und eine entsprechende Teilstruktur bestehend aus Vanadium, Kupfer und Defekten zu viele Galliumatome ( 552 Gallium pro Zelle statt 512) , und zu wenig Vanadium- und Kupferatome bzw. Defekte (132 Vanadium + 108 Kupfer + 120 Defekte = 360 Positionen statt 512). Diese scheinbare Diskrepanz ist mit dem Strukturmotiv der Würfel aus ZentaurPolyeder zu erklären, da diese zum Einen mehr Galliumatome besitzen, als ein entsprechend großes Motiv der unverzerrten Struktur, und zum Anderen eben durch die daraus resultierende Verzerrung der kubischen Matrix einige der ursprünglichen Würfel zu 184 4. Galliumreiche Verbindungen ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ andersartigen Lücken umgewandelt bzw. derart deformiert werden, dass man nicht mehr von Lücken im eigentlichen Sinne sprechen kann. Zunächst müssen acht kuboktaedrisch koordinierte Galliumatome – die Lagen Ga1 auf 2a und Ga2 auf 6c – von den 552 Ga-Atomen subtrahiert und dem zweiten Verband zugerechnet werden, dadurch verbleibt für die Ga-Teilstruktur ein „Überschuss“ von 32 Atomen, der sich mit je vier Atomen auf die insgesamt acht Würfel aus Zentaur-Polyeder der Elementarzelle verteilt. Diese Baugruppe hat, wie in Abb. 4.56 zu erkennen ist, vier „Gerüstatome“ mehr, als ein entsprechender Ausschnitt eines regulären Clusters aus 27 Würfeln, da sich die Koordinationszahl im Zentrum des Würfels aus Zentaur-Polyedern von acht auf zwölf, also um vier Atome erhöht. Ausgehend von der Erhöhung der Koordinationszahl der acht Vanadiumatome auf den Ecken dieser Baugruppe um zwei von acht im Würfel (Abb. 4.56 rechts) zu Koordinationszahl zehn im Zentaur (Abb. 4.56 links) kommt man zum gleichen Ergebnis: formal kommen 8x2 = 16 Ga-Atome hinzu, von denen man acht subtrahieren muss, die zum ursprünglichen zentralen Würfel in Abb. 4.56 rechts gehören (schwarz dargestellt). Die acht restlichen Atome gehören jeweils zwei Polyedern gemeinsam an, so dass sich ihre effektive Zahl noch einmal halbiert, und somit vier zusätzliche Atome pro Cluster ausmachen. Schließlich kann man auch die ursprünglichen acht Atome des Zentralwürfels zu den neu hinzukommenden 16 Atomen im Würfel aus Zentaur hinzuaddieren, wobei von den formal 24 Atomen nur zwölf übrigbleiben, da die einzelnen Zentaur-Polyeder eben an diesen Stellen über gemeinsame Ecken miteinander verknüpft sind. Diese zwölf Atome sind gerade die in Abb. 4.56 links schwarz dargestellten Atome des zentralen Kuboktaeders. Abb. 4.56: Vergleich von Würfel aus Zentauren (links) mit Würfel aus Würfel (rechts) 185 4.2.2 V11Cu9Ga46 ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Zur Beantwortung der Frage, wie viele der Lücken im zweiten Teilgitter, die partiell von Vanadium und Kupfer besetzt werden, noch als Würfel zu betrachten sind, kann man folgendermaßen vorgehen: leitet man das Motiv der Würfel aus Zentaur-Polyedern aus einem Komplex aus 3x3x3 = 27 Würfeln ab, so erfolgt formal eine Umwandlung dieser Würfel zu folgenden Polyedern: 1 Würfel zu 1 Kuboktaeder Abb. 60 a 8 Würfel zu 8 Zentaur-Polyeder Abb. 60 b 6 Würfel zu 6 tetragonalen Antiprismen Abb. 60 c 12 Würfel zu 2x12 = 24 tetragonalen Pyramiden Abb. 60 d Σ = 27 Würfel Abb. 4.57: a b c d Änderung der Koordinationsgeometrie vom Übergang Würfel nach ZentaurPolyeder. Von diesen Polyedern sind nur die Zentaur-Polyeder (Abb. 4.57 b) und das Kuboktaeder (Abb. 4.57 a) mit Vanadium bzw. Gallium besetzt, die tetragonalen Prismen, die sich über den Vierecksflächen des zentralen Kuboktaeders befinden (Abb. 4.57 c), sind nicht besetzt. Die in Abb. 4.57 d gezeigten Polyeder lassen sich annähernd als tetragonale Pyramiden bezeichnen, von denen je zwei über eine gemeinsame Dreiecksfläche miteinander 186 4. Galliumreiche Verbindungen ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ verknüpft sind. Deren Volumen ist allerdings derart gering, dass sie keine Lücken im eigentlichen Sinne mehr darstellen. Pro Elementarzelle sind acht dieser Cluster im V11Cu9Ga46 enthalten, damit gehen formal 8 x 27 = 216 Würfel in neuartige Polyeder über, von denen aber nur 8 x 9 = 72 Polyeder mit Atomen besetzt werden, namentlich acht Zentauren mit Vanadium und ein Kuboktaeder mit Gallium pro Cluster. Damit verbleiben für die restliche Struktur bzgl. eines 8x8x8 = 512 Atome umfassenden Gitters: 512 – 216 = 296 „echte“ Würfel Die Auffüllung der gesamten Ga-Matrix durch Vanadium und Kupfer und Gallium erfolgt dann nach folgendem Schema: 8 64 Σ = 72 V-Atome in Zentaur-Polyedern Atome in Würfel aus Zentaur-Polyedern 68 V-Atome in Würfeln 108 Cu-Atome in Würfeln Σ = 176 Es verbleibt ein Rest von: Ga-Atome in Kuboktaedern Atome in Ga8-Würfeln 296 – 176 = 120 leeren Ga8-Würfeln, die sich auf vier kristallographischen Lagen verteilen, wie auf Seite 27 bereits geschildert. Wenn man von den 512 theoretischen Würfeln 132 Vanadium, 108 Kupfer, 8 Gallium und 120 Defekte subtrahiert, entsteht eine Differenz von 144 „fehlenden“ Lücken. Diese Zahl entspricht genau den 8 x 18 = 144 formalen Lücken, die innerhalb der Würfel aus Zentauren in tetragonale Prismen bzw. Paare flächenverknüpfter Pyramiden umgewandelt werden. 187 4.2.2 V11Cu9Ga46 ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ 4.2.2.7. Motive des γ-Messing Eine Parallele besteht zu den Messing-Phasen dahingehend, dass dort einerseits die Art der Kristallstruktur von der Valenzelektronenkonzentration gesteuert wird, und dass andererseits die Struktur des γ-Messing bzw. des Cu5Zn8 (I-43m; a = 8.878(4) Å) [81] bei einer bestimmten VEK eine Alternative zu den Kristallstrukturen der reinen Metalle aufgefasst werden kann, die sich aus der kubisch-innenzentrierten Kugelpackung herleiten lässt, während die Metalle selbst in einer kubisch-dichtesten (Kupfer) bzw. einer hexagonaldichtesten Kugelpackung (Zink) kristallisieren. Diese Parallele zum γ-Messing beschränkt sich aber nicht nur auf diesen Formalismus. Im V11Cu9Ga46 sind auch strukturchemisch Motive des γ-Messing enthalten, die in der kubisch-innenzentrierten Anordnung der Vanadiumatome innerhalb der Kristallstruktur zum Ausdruck kommt, wobei die Koordinationspolyeder dieser Vanadiumatome nach ähnlichen Prinzipien angeordnet sind, wie die Atome im γ-Messing. Betrachtet man die Lagen V6, V4 und V7 für sich allein (Abb. 4.58), die in dieser Reihenfolge jeweils Würfel, Oktaeder und Kuboktaeder bilden, erinnert die Anordnung dieser Atome an die Struktur des γ-Messing, die sich in entsprechender Weise herleiten lässt. Ein nennenswerter Unterschied ist die Anordnung der Würfel um Ursprung und Zentrum der Elementarzelle die im γ-Messing aufgrund der dort formal vorhandenen Lücke aus zwei unterschiedlich großen Tetraedern besteht, die durch entsprechende Verschiebung der Atome diese Lücke kompensieren. Topologisch betrachtet lassen sich diese beiden Tetraeder im γ-Messing aber immerhin aus einem Würfel herleiten, bei dem vier Atome näher zusammenrücken, und auf diese Weise ein kleines und ein großes Tetraeder bilden. Der reguläre Würfel im V11Cu9Ga46 resultiert aus der Tatsache, das die Vanadiumatome keine direkten Kontakte aufweisen, sondern in den Zentaur-Polyedern sitzen, und durch das Galliumgitter voneinander separiert sind. Beide Strukturtypen weisen allerdings eine gleiche Zähligkeit der kristallographischen Lagen dieser Atome auf: im γ-Messing werden zwei 8-zählige, eine 12-zählige und eine 24-zählige Lage besetzt; dies entspricht in der Struktur des V11Cu9Ga46 einer 16-zähligen (= 2 x 8-zähligen) und ebenfalls einer 12-zähligen und einer 24-zähligen Lage. 81 J. K. Brandon, R. Y. Brizard, P. C. Chieh, R. K. McMillan, W. B. Pearson, Acta Cryst. 1974, B30, 1412-1417 188 4. Galliumreiche Verbindungen ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Zn1 und Cu1 jeweils auf 8c V6 auf 16i Cu2 auf 12e V4 auf 12f Zn2 Zn2 auf 24g V7 auf 24k Abb. 4.58: Vergleich der Struktur des γ-Messing (links) mit den vergleichbaren Vanadium-Lagen im V11Cu9Ga46 (rechts). Die unterschiedlichen Größen der Elementarzellen sind nicht maßstabsgetreu wiedergegeben. 189 4.2.2 V11Cu9Ga46 ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Die Struktur des γ-Messing wird anschaulich beschrieben als eine kubisch-innenzentrierte Anordnung dieser 27-atomigen Cluster, bestehend aus zwei Tetraedern, Oktaeder und Kuboktaeder. In ähnlicher Weise sind die Würfel aus Zentaur-Polyeder sowie weitere durch Vanadium zentrierte Polyeder um den Ursprung und das Zentrum der Elementarzelle im V11Cu9Ga46 angeordnet. Im Gegensatz zum γ-Messing, der bzgl. der kubischinnenzentrierten Kugelpackung ein 3x3x3-Gitter darstellt (Abb. 4.59), bildet das Vanadium ein 4x4x4-Teilgitter innerhalb der Struktur des V11Cu9Ga46. Abb. 4.59: Teilstruktur der Vanadiumatome in V11Cu9Ga46 (links) und Struktur von γ-Messing (rechts), dargestellt als verzerrte kubisch-innenzentrierte Kugelpackung Dadurch kommt eine weitere Vanadiumposition hinzu, die für sich allein betrachtet einen Würfel bilden, zwei Clustern gleichzeitig angehört, und so eine gemeinsame Kontaktstelle der Einheiten um Ursprung und Zentrum der Zelle bildet (V3 auf [¼, ¼, ¼]; in Abb. 4.60 blau dargestellt). Durch diese Aufweitung entstehen auf den Flächen der Elementarzelle große Zwischenräume, welche von je zwei weiteren Würfel aus Zentaur-Polyeder besetzt werden, die aufgrund ihrer Abmessungen problemlos in diese Zwischenräume passen. 190 4. Galliumreiche Verbindungen ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ V3 V4 V6 V7 Abb. 4.60: γ-Messing-analoges Strukturmotiv der Vanadiumatome in V11Cu9Ga46. Betrachtet man alle Atome der Struktur, bilden die vanadiumzentrierten Polyeder jeweils einen kubischen Cluster, dessen Zentrum von einem Würfel aus Zentaur-Polyeder gebildet wird, der auf seiner Oberfläche von insgesamt 26 in unterschiedlichem Maße überkappten, ebenfalls vanadiumzentrierten Ga8-Würfeln umgeben ist, die alle ausschließlich über gemeinsame Spitzen miteinander verknüpft sind. Bemerkenswert ist, dass alle Ga8-Würfel, die direkt an die Vierecksflächen der Zentaur-Polyeder angrenzen, unbesetzt bleiben. Daraus ergibt sich nicht nur bezüglich der Atomanordnung, sondern auch hinsichtlich der Polyederpackung die außerordentlich hohe innenzentrierte Pseudosymmetrie der Struktur. Abb. 4.61: kubischer Cluster aus insgesamt 34 vanadiumzentrierten Polyedern (Stereobild) 191 4.2.2 V11Cu9Ga46 ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Die letztendlich kubisch primitive Symmetrie der Kristallstruktur des V11Cu9Ga46 beruht einerseits auf der Tatsache, dass die würfelförmigen Cluster um Ursprung und Zentrum der Elementarzelle jeweils um 90° gegeneinander rotiert sind, wie man in Abb. 4.62 anhand der gelben und roten Polyeder erkennen kann, und andererseits an den kettenartigen Strukturmotiven auf den Flächen der Elementarzelle, die entlang der drei Raumrichtungen verlaufen. Abb. 4.62: γ-Messing-analoge Anordnung von vanadium-zentrierten Polyedern in V11Cu9Ga46 (Stereobild) Insgesamt ist im V11Cu9Ga46 eine bemerkenswerte Tendenz zu Anordnungen mit einem Bestreben nach hoher Symmetrie der unterschiedlichen Atomsorten zu beobachten, die sich auch darin äußert, dass Atome der gleichen Sorte strukturchemisch möglichst äquivalente Lagen einnehmen. Dies zeigt sich nicht zuletzt an der für alle Kupferatome gleichen Umgebung und der Tatsache, dass die Vanadiumatome für sich betrachtet eine kubisch-innenzentrierte Anordnung zu bilden, wie es auch im ReGa4 und V2Cu3Ga8 zu beobachten ist. 192 4. Galliumreiche Verbindungen ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Hinsichtlich der Kombinations- und Kondensationsmöglichkeiten der Würfel aus ZentaurPolyeder scheint es für diese Baugruppe kaum Grenzen zu geben. Nachdem im System Mo-Ga mit dem Typ (MoGa5)nGa (n = 4, 6, 8) Strukturen existieren, in denen dieses Motiv in vier Varianten verwirklicht wird, erscheint es im V11Cu9Ga46 in einer neuartigen Version mit kubischer Symmetrie, diesmal zusammen mit weiteren Strukturmotiven, in denen die Metalle Vanadium und Kupfer als Ordnungsgeber wirken, oder zumindest nach Prinzipien eingelagert werden, bei denen eine möglichst hohe Symmetrie auch über große Translationsperioden realisiert werden kann. In Abb. 4.63 sind schematisch noch einmal die wesentlichen und höchstsymmetrischen Baugruppen des V11Cu9Ga46 in Form von Polyedern dargestellt. Gelbe und orange Würfel stellen die Cluster aus Zentaur-Polyeder dar, die beiden allseits überkappten vanadiumzentrierten Würfel (rot und blau) stellen auf ihren ausgezeichneten, da hochsymmetrischen Plätzen sozusagen die Ankerpunkte der weiteren Strukturmotive dar. Abb. 4.63: Anordnung hochsymmetrischer Baugruppen bzw. Polyeder in V11Cu9Ga46 193 5. Pt2Sn2Zn3 ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ 5. Pt2Sn2Zn3 Zinn bildet besonders mit den späten Übergangsmetallen relativ problemlos binäre Verbindungen. Mit einem Atomvolumen von 27 Å3 ist es jedoch fast doppelt so groß wie die meisten Übergangsmetalle, so dass Ordnungsvarianten von dichtesten Kugelpackungen eher selten, und dann von den übergangsmetallreichen Verbindungen, gebildet werden, wobei häufig der AuCu3- und Ni3Sn-Typ vertreten sind. Die Strukturchemie zinnreicher Verbindungen der Übergangsmetalle ist eher geprägt von Motiven, bei denen das Übergangsmetall als Minderkomponente in ein Netzwerk des größeren Zinn eingelagert ist. In diesen Verbindungen hat das Übergangsmetall auffallend häufig die Koordinationszahl acht und die Zinnatome bilden Würfel oder tetragonale Antiprismen, die meist über gemeinsame Kanten miteinander verknüpft sind. In der Reihe binärer PlatinZinn-Verbindungen beispielsweise lässt sich dieser „Gang“ hinsichtlich Koordination des Zinngerüsts gut erkennen, wobei das Motiv des Würfels geometrisch zunehmend an Bedeutung gewinnt, je zinnreicher die Verbindung ist. Auch Zink bildet zumindest mit den Edelmetallen Nickel, Palladium und Platin mehrere binäre Verbindungen, die man aufgrund der Stellung der Metalle im Periodensystem häufig noch zu den Hume-Rothery-Phasen zählt. Zink und Platin sind mit etwa 15.2 Å3 bzw. 15.1 Å3 annähernd gleich groß, und die Strukturchemie binärer Platin-Zink-Verbindungen wird fast ausschließlich von elektronischen Faktoren dominiert, wogegen bei Platin-Zinn-Verbindungen eher geometrische Faktoren eine vorrangige Rolle spielen. Aus diesem Blickwinkel betrachtet scheint es interessant, inwieweit sich diese beiden strukturbestimmenden Faktoren in entsprechenden ternären Pt-Sn-Zn-Verbindungen gegenseitig beeinflussen, stören oder gar ergänzen. Angesichts der guten Reaktivität des Platins gegenüber Zinn und Zink ist es daher verwunderlich, dass bisher noch keine ternären Pt-Sn-Zn-Verbindungen beschrieben wurden. Durch Umsetzung der Elemente konnte nun mit dem Pt2Sn2Zn3 eine neue Verbindung synthetisiert werden, deren Kristallstruktur einerseits eine Alternative zu den großen hierarchischen Strukturen z. B. des Typs Mo7Sn12Zn40 darstellt, und andererseits noch Strukturmotive der jeweiligen binären Randverbindungen in sich trägt. 194 6. Weitere Ergebnisse ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ 5.1. Binäre Platin-Zinn- und Platin-Zink-Verbindungen Im binären System Platin-Zinn sind bisher fünf Verbindungen bekannt, deren Kristallstrukturen von klassischen Motiven geprägt sind. Neben der platinreichen Verbindung Pt3Sn, die im weitverbreiteten AuCu3-Typ kristallisiert und eine Ordnungsvariante der kubisch-dichtesten Kugelpackung darstellt, existieren vier weitere Verbindungen, in denen das Platin stets die Koordinationszahl 8 bzw. 6 + 2 hat (Abb. 5.1). Im PtSn (NiAs-Typ) bilden die Zinnatome eine in c-Richtung leicht gestauchte hexagonal-dichteste Kugelpackung, bei der Platin alle Oktaederlücken besetzt. Durch das recht niedrige c/a-Verhältniss von nur 1.325 sind die Pt-Pt-Abstände zu benachbarten Oktaederlücken um 0.52% kürzer (2.718 (1)Å), als die Pt-Sn-Abstände (2.732(1) Å), wogegen bei idealem c/a-Verhältnis von 1.63 die Abstände der Atome in den Oktaederlücken um etwa 15% länger sind, als die Abstände von Oktaederlücken zu Packungsteilchen. Durch unterschiedliche c/a-Verhältnisse treten die Atome in den Oktaederlücken mehr oder weniger in Wechselwirkung miteinander, was sich auf die elektrische Eigenschaften auswirkt: NiAsStrukturen mit niedrigem c/a-Verhältnis sind metallische Leiter, wogegen bei c/a-Verhältnissen von etwa 1.77 eher ionischer Charakter vorliegt [32] [82]. Geometrisch wird die Koordinationssphäre des Platins durch diese Stauchung der c-Achse etwas in Richtung Würfel verschoben, was sich auch in der Aufweitung der Sn-Sn-SnWinkel auf etwa 70° äußert. Diese Tendenz ist bei der etwas zinnreicheren Verbindung Pt2Sn3, die einen eigenen Strukturtyp bildet, noch deutlicher zu erkennen. In der Koordinationssphäre des Platins wird formal ein Pt- durch ein Sn-Atom ersetzt, und die Winkel der Sn-Atome untereinander sind mit einer Abweichung von rund ± 10° dem Wert von 90° schon recht nahe. K. Schubert beschreibt diese Verbindung auf der Basis alternierender Schichten mit NiAs- und CaF2-Motiven, die nach dem Muster . . . A B . . . in c-Richtung gestapelt sind [83]. Die ideale Würfelsymmetrie für das Platin wird im PtSn2 realisiert, das im CaF2-Typ kristallisiert. Eine Alternative zum Würfel bildet das quadratische Antiprisma im PtSn4, 32 W. B. Pearson, The Crystal Chemistry and Physics of Metals and Alloys, Wiley-Interscience, New York, 1972 82 J. Zemann, Acta Cryst. 1958, 11, 55 83 K. Schubert, H. Pfisterer, Z. Metallkde. 1949, 40, 405-411 195 5. Pt2Sn2Zn3 ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ dessen Struktur als eine Defekt- und Stapelvariante zum CuAl2-Typ aufgefasst werden kann. In den beiden zuletzt genannten Verbindungen ist das Platin achtfach nur noch von Zinn umgeben. Diese strukturchemischen Verwandtschaften bei benachbarten binären Phasen stellen keinen Einzelfall dar und sind auch in anderen Systemen zu finden. Die zinnreichen Verbindungen im System Palladium-Zinn, PdSn2, PdSn3 und PdSn4 beispielsweise enthalten alle dasselbe Strukturmotiv und stellen Varianten des CuAl2-Typs dar. = PtSn Pt2Sn3 (NiAs-Typ) PtSn2 (eigener Typ) (CaF2-Typ) Abb. 5.1: Strukturmotive in binären Pt-Sn-Verbindungen; dargestellt sind die Koordinationspolyeder der Pt-Atome. In Pfeilrichtung nimmt der Zinngehalt der Verbindung zu. Pt3Sn Pt Sn (AuCu3-Typ) PtSn4 (eigener Typ) Die Änderung der Koordinationssphäre des Übergangsmetalls mit zunehmendem Zinngehalt steht im Einklang sowohl mit dem Atomvolumen als auch mit dem Metallcharakter des Zinns. Als großes Metall zeigt es in Verbindungen mit kleineren Partnern zu eher niedrigen Koordinationszahlen, und als Hauptgruppenmetall neigt es bereits zur Ausbildung gerichteter Wechselwirkungen mit partiell kovalentem Bindungscharakter, und die Teilstruktur des Zinns in zinnreichen Verbindungen lässt sich als dreidimensionales Netzwerk interpretieren, in das die kleineren Elemente als Minderkomponente eingelagert sind. Diesbezüglich besteht eine gewisse Verwandtschaft zu galliumreichen Verbindungen, bei denen ähnliche Tendenzen zu beobachten sind. 196 6. Weitere Ergebnisse ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Abb. 5.2: Verbindung binäres Phasendiagramm Platin-Zinn nach Massalski [67] Struktur- Pearson- Raum- Typ Code gruppe Gitterkonstanten Lit. Charakterisierung Pt90Sn10 Cu cF4 Fm-3m a = 3.9495 [84] Pulver Pt3Sn AuCu3 cP4 Pm-3m a = 4.018 [85] Pulver PtSn NiAs hP4 P63/mmc [85] Pulver Pt2Sn3 Eigener hP10 P63/mmc PtSn2 CaF2 cF12 Fm-3m a = 4.104(2) c = 5.436(2) a = 4.325(5) [86] c = 12.34(1) [88] a = 6.4331 [86] Pulver [87] Pulver Pulver a = 6.418(3) PtSn4 Eigener oC20 Ccca b = 11.366(6) c = 6.384(2) Tab. 5.1: Einige Daten binärer Platin-Zinn-Verbindungen mit Literaturangeben. [84] H.-J. Schaller, Z. Metallkde. 1979, 70, 318-321 [85] K. L. Shelton, P. A. Merewether, B. J. Skinner, Canadian Mineralogist, 1981, 19, 599-605 [86] J. S. Charlton, M. Cordey-Hayes, I. R. Harris, J. Less- Common Met. 1970, 20, 105-112 [87] B. Künnen, D. Niepmann, W. Jeitschko, J. Alloys Comp. 2000, 309,1-9 [88] K. Schubert, H. Pfisterer, Z. Metallkde. 1949, 40, 405-411 67 T. B. Massalski (Hrsg.), Binary Alloy Phase Diagrams, ASM, Metals Park, Ohio, 1986 197 5. Pt2Sn2Zn3 ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Im System Platin-Zink ist die Situation weniger übersichtlich und es herrschen in der Literatur einige Wiedersprüche bzgl. Zusammensetzung und Phasenbreite der einzelnen Verbindungen, wie ein Vergleich mit dem Phasendiagram in Abb. 5.4 und der Tabelle 5.2 zeigt. Die Pt-Zn-Verbindungen werden im allgemeinen noch den Hume-Rothery-Phasen zugeordnet, bei denen die Valenzelektronenkonzentration (VEK) für die Bildung der Strukturen verantwortlich ist[34] [89] . Allerdings folgt die Strukturchemie der einzelnen Phasen nicht streng den für die klassischen Messing-Phasen Cu/Zn oder Cu/Sn aufgestellten Regeln. Die ideale Zusammensetzung für die γ-Messing-Phase wäre nach Pauling Pt5Zn21 mit einer VEK von [42/26 ≡ 2x(21/13) = 1.615]. Die von A. Johannson und S. Westmann anhand von Einkristalldaten publizierte Verbindung Pt3Zn10 hat mit einer VEK von 1.538 immerhin näherungsweise den idealen Wert von 1.615. Das Phasendiagram in Abb. 5.4 bezeichnet diese Verbindung als „γ1-Phase“, und bei etwas höherem Zinkgehalt erstreckt sich der Bereich des „idealen γ-Messing“ mit der Zusammensetzung Pt5Zn21, der im Phasendiagram immerhin mit der Bezeichnung „ γ “ gekennzeichnet ist. Als typische Koordinationszahlen der Atome in diesen Verbindungen, auf die hier nicht im Einzelnen eingegangen werden soll, sind mit mindestens zehn recht hoch und in der Regel werden Koordinationszahlen von elf oder mehr bevorzugt. Die Koordinationspolyeder sind auch eher komplex (Abb. 5.3) und bestehen beispielsweise aus überkappten pentagonalen oder hexagonalen Prismen, Frank-Kasper-Polyeder oder Edshammer-Polyeder, also typische Polyeder von intermetallischen Verbindungen, deren Partner annähernd gleiches Atomvolumen besitzen. Pt Zn Pt7Zn12 Abb. 5.3: Pt4Zn7 Beispiele von Koordinationspolyedern in Pt-Zn-Verbindungen. 34 L. Pauling, Die Natur der chemischen Bindung, Verlag Chemie, Weinheim, 3. Auflage, 1976 89 H. R. Christen, Grundlagen der allgemeinen und anorganischen Chemie, Salle + Sauerländer, Frankfurt/Main, 7. Auflage, 1982 198 6. Weitere Ergebnisse ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Abb. 5.4: binäres Phasendiagram Platin-Zink nach Massalski [67] Zn-Gehalt Verbindung nach Summenformel Pt3Zn 25.0 % Pt7Zn12 63.1 % StrukturTyp [*] AuCu3 Eigener Pt4Zn7 63.6 % Eigener Pt3Zn10 (γ1) 76.9 % Eigener Tab. 5.2: VEK Raumgruppe Pm-3m 24/19 = 1.263 14/11 = 1.273 20/13 = 1.538 Gitter a = 3.893 Lit. Pulver [91] Einkristall [90] Pulver [92] Einkristall a = 28.79 Pbam b = 6.94 c = 2.76 P321 F-43m a = 4.111 c = 2.745 a = 18.1128(6) Einige Daten binärer Platin-Zink-Verbindungen mit Literaturangaben H. Nowotny, E. Bauer, A. Stempfl, H. Bittner, Monatsh. Chem. 1952, 83, 221-236 [91] W. Carl, K. Schubert, J. Less- Common Met. 1969, 19, 279-283 [92] A. Johannson, S. Westman, Acta Chem. Scand. 1970, 24, 3471-3479 * sierung [90] [90] 67 Charakteri- T. B. Massalski (Hrsg.), Binary Alloy Phase Diagrams, ASM, Metals Park, Ohio, 1986 nach L. Pauling hat Platin Null und Zink Zwei Valenzelektronen pro Atom 199 5. Pt2Sn2Zn3 ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ 5.2. Synthesen Die erste Synthese des Pt2Sn2Zn3 erfolgten durch Umsetzung der Metalle im molaren Verhältnis Pt:Sn:Zn 1:4:2. Dazu wurden die Metalle in evakuierten Quarzampullen auf 1000°C erhitzt und nach drei Tagen mit 5°/h auf 600°C abgekühlt. Die weitere Abkühlung auf Raumtemperatur erfolgte mit 12°/h. Nach Entfernung des überschüssigen Metalls mit verdünnter wässriger HCl blieben viele bronzefarbene sehr gut ausgebildete Kristalle in Form hexagonaler Prismen zurück, von denen einige eine Kantenlänge von bis zu 1mm aufwiesen. Die röntgenographische Untersuchung von kleinen Kristallen mit dem Vierkreisdiffraktometer ergaben eine hexagonale Elementarzelle mit den Gitterkonstanten a = 4.3367(5) Å und c = 15.532(3) Å. Nach Mittelung in der Laue-Klasse 6/mmm konnte in der Raumgruppe P63/mmc mit direkten Methoden ein Strukturmodell entwickelt werden, das bei der anschließenden Verfeinerung problemlos konvergierte. Unter Verwendung von 402 unabhängigen Reflexen und 14 freien Parametern wurden Zuverlässigkeitswerte von R1(F) = 0.0250 und wR2(I) = 0.0591 erreicht. Die wechselseitige Freigabe der Besetzungsparameter bestätigte die geordnete Verteilung der Metalle und zeigte keine Abweichungen. 100 µm Abb.5.5: 200 REM Bild von Pt2Sn2Zn3 Kristallen 6. Weitere Ergebnisse ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Tab. 5.3: Angaben zur Strukturbestimmung von Pt2Sn2Zn3 Rel. Molmasse Kristallsystem Raumgruppe Zellabmessungen Zellvolumen Anzahl der Formeleinheiten Röntgendichte Messtemperatur Röntgenstrahlung F ( 0 0 0) Meßbereich h, k, l max. 2θ Scantyp Scanbreite Max. Messzeit pro Reflex Messwerte davon unbeobachtet unabhängige Reflexe davon mit I > 0 davon mit I > 2σ(I) Kristallform Kristallabmessungen Absorptionskorrektur Interner Standard Schwächungskoeffizient Extinktionskoeffizient (SHELX97) Restelektronendichte Wichtungsfunktion Zahl der Parameter R- Werte 832.70 g/mol hexagonal P 63 / m m c (Nr. 194) a = 4.3367(5) Å c = 15.532(3) Å V = 252.97 Å3 2 10.813 g/cm3 20°C Mo Kα1 692.0 ±8; ±8; ±29 85° Ω/ 2θ 0.70° + 0.35 * tan θ 45s 7255 547 402 402 324 hexagonales Prisma 0.1 * 0.1 * 0.05 mm3 empirisch; Ψ - scan 0.0994 (0.0302) 78.59 mm-1 0,020185 + 3.29; -1.49 (0.49) e/ Å3 1 / [σ2 * F02 + (0,0260 * P) 2 + 1.00*P] mit P = (F02 + 2 * Fc2) / 3 14 R1(F) = 0.0250; wR2(I) = 0.0591 201 5. Pt2Sn2Zn3 ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Tab. 5.4: Strukturdaten zu Pt2Sn2Zn3 Summenformel Kristallsystem Raumgruppe Gitterkonstanten Pt2Sn2Zn3 hexagonal P 63/m m c (Nr. 194) a = 4.3367(5) Å c = 15.532(3) Å 252.97(7) Å3 10.814 g/cm3 hP14 N2O2P3 2 Zellvolumen röntgenographische Dichte Pearson Code Formula type Z Ortskoordinaten und Auslenkungsparameter in Pt2Sn2Zn3: Atom Wyck. Symm. x y z Ueq Pt1 Pt2 Zn1 Zn2 Sn 2a 2c 2d 4e 4f -3m. -6m2 -6m2 3m. 3m. 0 1/3 2/3 0 1/3 0 2/3 1/3 0 2/3 0 1/4 1/4 0.33197(7) 0.42802(4) 0.0134(1) 0.0146(1) 0.0204(3) 0.0168(2) 0.0139(1) Atom Pt1 Pt2 Zn1 Zn2 Sn U11 0.0135(1) 0.0142(1) 0.0139(4) 0.0182(3) 0.0134(1) U22 0.0135(1) 0.0142(1) 0.0139(4) 0.0182(3) 0.0134(2) U33 0.0133(2) 0.0155(2) 0.0333(9) 0.0142(4) 0.0150(2) U12 0.0067(1) 0.0071(1) 0.0069(2) 0.0090(2) 0.0067(1) U13 0 0 0 0 0 U23 0 0 0 0 0 Tab. 5.5: Ausgewählte Abstände in Pt2Sn2Zn3: Pt1 Zn2 Sn Sn 2.610(1) 2x 2.742(0) 2x 2.742(0) 4x Pt2 Zn1 Zn1 Sn Zn2 Zn2 2.504(0) 2.504(0) 2.765(1) 2.809(1) 2.809(1) Pt2 Pt2 Zn2 Zn2 2.504(0) 2x 2.504(0) 2.809(1) 2x 2.809(1) 4x Zn1 202 Zn2 Zn2 Pt1 Pt2 Zn1 Pt2 Zn1 Sn Sn 2.546(2) 2.610(1) 2.809(1) 2.809(1) 2.809(1) 2x 2.809(1) 2x 2.914(1) 2.915(1) 2x Sn Pt1 Pt1 Pt2 Zn2 Zn2 Sn Sn 2.742(0) 2.742(0) 2x 2.765(1) 2.914(1) 2.915(1) 2x 3.357(1) 3.357(1) 2x 2x 2x 2x 4x 5. Pt2Sn2Zn3 ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Die Reflexe des gemessenen Pulverdiagramms zeigen bezüglich Lage und Intensität eine sehr gute Übereinstimmung mit dem aus der Strukturanalyse berechnetem Diagramm (Abb. 5.6). Im gemessenen Diagramm sind keine zusätzlichen Reflexe zu erkennen, die Umsetzung erfolgte demnach phasenrein. EDX-Untersuchungen, die zusammen mit Einkristallen des PtSn2 als Eichkristalle durchgeführt wurden, ergaben eine Zusammensetzung von 28.9% Platin, 28.6% Zinn und 42.5% Zink, was sehr gut mit der relative Intensitäten röntgenographisch ermittelten Zusammensetzung von Pt2Sn2Zn3 übereinstimmt. berechnet gemessen 10 20 30 40 50 60 70 80 2-Theta - Scale Abb. 5.6: Berechnetes und gemessenes Pulverdiagramm von Pt2Sn2Zn3 203 5. Pt2Sn2Zn3 ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ 5.3. Strukturbeschreibung Pt2Sn2Zn3 kristallisiert in einem neuen, bemerkenswert einfachen Strukturtyp, der anschaulich auf der Basis Pt-zentrierter Koordinationspolyeder beschrieben werden kann. Charakteristisches Merkmal sind leicht verzerrte Pt(Sn6Zn2)-Würfel, die über gemeinsame Kanten zu Schichten verknüpft sind. Die Verknüpfung der Würfel untereinander erfolgt dabei ausschließlich über gemeinsame Zinnatome, die jeweils drei Würfeln gleichzeitig angehören; die Zinkatome befinden sich an den Spitzen der Würfel entlang der 63-Achse. Diese Schichten sind in c-Richtung bzgl. des Koordinatensystems alternierend revers und obvers orientiert, und weisen untereinander keine direkten Kontakte auf. Auf der Spiegelebene in z = ¼ und ¾ der Raumgruppe P63/mmc befinden sich weitere Pt- und Zn-Atome, die gewissermaßen die Kontaktstellen zwischen den Würfelschichten bilden und mit jeweils vier Atomen der Würfel oberhalb und unterhalb der Spiegelebene (drei Zn und ein Sn) einen Edshammer-Polyeder bilden. Würfel – revers Edshammer-Polyeder Würfel – obvers Edshammer-Polyeder Würfel - revers Abb. 5.7: 204 Kristallstruktur von Pt2Sn2Zn3 5. Pt2Sn2Zn3 ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Die Platinatome spannen für sich betrachtet innerhalb der Schichten ein 36-Netz mit einem Pt-Pt-Abstand von 4.3367(5) Å auf, also das geometrische Muster einer Schicht der dichtesten Kugelpackung und sind wie die Atome in der Elementstruktur des Lanthan in der Reihenfolge . . .ABAC . . . gestapelt, wobei Pt-Atome innerhalb der Würfel stets in Position A liegen. Die Anordnung der Würfel und deren Verknüpfung untereinander ist nur dann mit dieser Symmetrie kompatibel, wenn sie bezüglich der Basisfläche der Elementarzelle wie ein Rhomboeder auf der „Spitze stehen“. Diese Spitzen werden von Zinkatomen gebildet, während die Zinnatome jeweils drei Würfeln gleichzeitig angehören, und diese über Kanten verknüpfen. Diese trigonale Anordnung isolierter Würfelschichten enthält sogenannte Mulden und Sattelpunkte, an denen sich drei Würfel in einem gemeinsamen Punkt berühren. Die Sattelpunkte auf der Oberseite einer Schicht sind gleichzeitig die Mulden auf der Unterseite und umgekehrt. Die Platin- und Zinkatome auf den Spiegelebenen sind so angeordnet, dass Platin jeweils in einer Linie senkrecht ober- und unterhalb der Sattelpunkte der benachbarten Würfelschichten, und die Zinkatome in entsprechender Weise ober- und unterhalb der Mulden benachbarter Würfelschichten liegen. Der Abstand Zn-Sn zu den Zinnatomen in diesen Mulden ist mit 4.998(1) Å ungewöhnlich groß, so dass die Kristallstruktur zwischen diesen Zn- und Sn-Atomen formal Lücken enthält, die in Abb. 5.8 durch weiße Kugeln dargestellt sind (Lagesymmetrie: 4f; Koordinaten: 1/3, 2/3, 0.572). Diese Lücken werden allerdings durch die Zinnatome teilweise kompensiert, was sich unter anderem in einer Verzerrung der Pt(Sn6Zn2)-Würfel äußert. Abb. 5.8: Lage der Pt- und Zn-Atome auf der Spiegelebene über bzw. unter einer Würfelschicht in Pt2Sn2Zn3 205 5. Pt2Sn2Zn3 ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Topologisch besetzen die Pt-Atome in den Edshammer-Polyedern und die „Lücken“ in den Mulden zwischen drei Würfeln die Positionen von Würfelzentren in einer kubischinnenzentrierten Kugelpackung, und nach diesem Formalismus entsteht die Struktur des PtSn2 bzw. des CaF2-Typs, in denen die Atome nach genau diesem Muster angeordnet sind. Eine Würfelschicht im Pt2Sn2Zn3 stellt demnach einen Ausschnitt der PtSn2-Struktur dar. Der wesentliche Unterschied besteht in der alternierenden revers-obvers-Stapelfolge der einzelnen Würfelschichten, die so voneinander separiert sind, dass zwischen ihnen planare Schichten von Pt- und Zn-Atomen gewissermaßen als „Abstandhalter“ so in die Struktur eingebaut werden, dass für jede Atomsorte entsprechend ihres Atomvolumens und ihrer direkten Umgebung die günstigste Koordinationssphäre entsteht. Dies wird besonders deutlich, wenn man die Koordinationspolyeder der Pt-Atome betrachtet, die in Abb. 5.9 dargestellt sind. Pt1 ist würfelförmig von sechs Zinn- und zwei Zinkatomen umgeben, und folgt damit nicht nur der schon Eingangs erwähnten Vorliebe für binärer Pt-Sn-Verbindungen zur Ausbildung des Würfelmotivs, sondern auch dem Trend, dass bei Atomen unterschiedlicher Größe für das kleinere Atom im allgemeinen auch nur kleine Koordinationszahlen beobachtet werden. Das Koordinationspolyeder des Pt1, das fast mehrheitlich vom großen Zinn umgeben ist, erinnert an das Motiv des PtSn2 bzw. des CaF2-Typs. Pt2 dagegen ist von neun Zink- und zwei Zinnatomen in Form eines Edshammer-Polyeders umgeben. Dieses regelmäßige Polyeder, das häufig in intermetallischen Verbindungen auftritt, enthält zwei Würfelhälften, die in Abb. 5.9 durch gelbe und rote Verbindungslinien hervorgehoben sind. Alternativ lässt sich die Umgebung von Pt2 beschreiben als ein trigonales Prisma – gebildet von Zn2 – das auf den Basisflächen von Zinn, und auf den Seitenflächen von Zn1 überkappt ist. Von der eher hohen Koordinationszahl und der Geometrie des Polyeders erinnert dieses Motiv an die komplexen Strukturen der binären Pt-Zn-Verbindungen, die mit den Messingphasen verwandt sind. 206 5. Pt2Sn2Zn3 ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Sn Sn Sn Sn Zn2 Zn2 Zn1Zn1 Pt2 Pt1 Sn Sn Zn2 Zn2Zn2 Zn2 Zn1 Zn2Zn2 Sn Sn Abb. 5.9: Koordinationspolyeder der beiden Platinatome in Pt2Sn2Zn3. Die Koordinationspolyeder der Zinkatome sind auf den ersten Blick etwas unregelmäßig. Unter Einbeziehung der formalen „Lücken“ auf der Lage 4f lassen sie sich jedoch auf einfache, hochsymmetrische Polyeder zurückführen (Abb. 5.10). Zn1 ist von sechs Zinkund drei Platinatomen in Form eines trigonalen Prismas aus Zink umgeben, dessen Seitenflächen von Platin überkappt sind. Mit den Lücken ergibt dies wie bei Pt2 ein Edshammer-Polyeder. Das unregelmäßige Polyeder um Zn2 lässt sich aus einem hexagonalen Prisma ableiten, dessen Basisflächen von Zink und Platin überkappt sind. Wie Platin bevorzugt auch das ähnlich große Zink eher hohe Koordinationszahlen und ist überwiegend von Platin und Zink umgeben. Folgerichtig sind auch die „Lücken“ an den Stellen der Koordinationspolyeder zu finden, in deren Nähe die Zinnatome sitzen, was besonders gut in der Koordinationssphäre des Zn2 zu erkennen ist. Auch hier erinnern die Polyeder von Koordinationszahl und Geometrie her an die binären Pt-Zn-Verbindungen, in denen ähnliche Polyeder auftreten. 207 5. Pt2Sn2Zn3 ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Zn2 Zn2 Zn2 Zn2 Pt2 Pt2 Zn1 Zn2 Zn1 Pt2 Zn1 Pt2 Zn2 Zn2 Pt2 Zn1 Pt2 Zn2 Sn Sn Sn Pt1 Pt2 Pt Zn2 Sn Zn2 Zn2 Sn Sn Pt1 Pt1 Sn Sn Sn Pt Pt1 Sn Pt Sn Pt Sn Sn Sn Abb. 5.10: Koordinationspolyeder der Zink- und Zinnatome in Pt2Sn2Zn3. Zum Vergleich der Sn-Lage ist ein entsprechender Ausschnitt des PtSn2 (CaF2-Struktur, unten rechts) dargestellt. Das Koordinationspolyeder des Zinns zeigt wiederum eine auffallende Ähnlichkeit zur Struktur des PtSn2. Nicht nur die Geometrie des Polyeders, sondern auch die Anordnung der Minderkomponente beider Strukturen sind in der gleichen Art um das Zentralatom in Form eines Tetraeders angeordnet. Platin bildet in PtSn2 formal eine kubisch-dichteste Kugelpackung mit Zinn in allen Tetraederlücken, was in dieser Geometrie zum Ausdruck kommt, die man auch als „gefülltes Diamantgitter“ auffassen kann. Auf der anderen Seite kann man die PtSn2-Struktur auch als kubisch-primitive Kugelpackung auffassen, in der die Hälfte aller Würfellücken von Platin besetzt werden, was den strukturchemisch tatsächlich vorhandenen Verhältnissen im PtSn2 eher entspricht, wenn man die Kugelpackung als ein Gerüst sich Idealerweise berührender Teilchen auffasst, in dessen Lücken sich die andere Sorte Teilchen befindet. 208 5. Pt2Sn2Zn3 ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Für die einzelnen Atome ist die Art der Koordination völlig schlüssig: Pt1, das fast ausschließlich vom großen Zinn umgeben ist, bildet das Motiv des Würfels mit vergleichsweise kleiner Koordinationszahl, und Pt2, das fast ausschließlich vom gleichgroßen Zink umgeben ist, bevorzugt die höhere Koordinationszahl elf in Form des eher kompliziert aufgebauten Edshammer-Polyeder. Für die restlichen Atome gilt Ähnliches; Zink ist überwiegend von Zink und Platin umgeben, in der Koordination des Zinns findet sich das Muster des PtSn2 fast identisch wieder. Damit sind wesentliche Strukturmotive der binären Pt-Sn- sowie Pt-Zn-Verbindungen nebeneinander in der Struktur des Pt2Sn2Zn3 enthalten, und die Verknüpfung beider Baugruppen erfolgt aufgrund der problemlosen Kompatibilität des Edshammer-Polyeders mit dem Würfel nach einem bemerkenswert einfachen Prinzip, das in einer hochsymmetrischen Kristallstruktur resultiert. Die Kristallstruktur von Pt2Sn2Zn3 lässt sich auch auf der Basis planarer Schichten beschreiben, die in Richtung der c-Achse gestapelt sind (Abb. 5.11). Die Platinatome (Pt2) im Zentrum der Edshammer-Polyeder bilden zusammen mit den Zinkatomen der Lage Zn1 ein 36-Netz (Graphit-Netz). Die restlichen Atome sind jeweils im 63-Netz nach dem Muster einer dichtesten Kugelpackung angeordnet. Diese Beschreibung hat jedoch eher topologischen Charakter, da die Abstände der Atome innerhalb der Schichten mit 36-Netz 4.3367(5) Å so groß sind, dass wohl keine direkten Kontakte zwischen den Atomen innerhalb dieser Schichten vorhanden sind. Die kürzesten Abstände zwischen Pt1, Zn2 und Sn sind vielmehr diejenigen zwischen benachbarten Schichten. Abb. 5.11: Schichten in Pt2Sn2Zn3 209 5. Pt2Sn2Zn3 ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ 5.4. Substitutionsversuche Pt2Sn2Zn3 ist bislang die einzige Verbindung, die in diesem Strukturtyp kristallisiert. Alle Substitutionsversuche, die Platin und Zinn betreffen, führten nicht zu der gewünschten isotypen Verbindung. Der naheliegende Austausch von Platin gegen Palladium oder Nickel gelang ebenso wenig wie der Ersatz von Zinn gegen andere Hauptgruppenmetalle wie Germanium, Indium oder Gallium. Bei der Wahl der Metalle und der Kombination entsprechender ternärer Mischungen spielten sowohl Betrachtungen über Existenzbedingungen und mögliche Bildungsmechanismen des Pt2Sn2Zn3, als auch die Strukturchemie der einzelnen binären Systeme eine Rolle. Dabei sollten die Metalle zumindest eine ähnliche Zahl von Valenzelektronen und entsprechend unterschiedliche Atomvolumina haben. Versuche im System Pd-Sn-Zn führten stets zu den binären Verbindungen PdSn2 und PdSn4, die sich bei entsprechendem Pd-Sn-Verhältnis phasenrein oder auch gemeinsam synthetisieren lassen. Ersetzt man das Zinn gegen Indium, entsteht bei nahezu allen Mischungsverhältnissen Pd3In7, das isotyp zum Ir3Ge7 ist, und nach U. Häussermann auch aus binären Pd-In-Schmelzen zugänglich ist [93] . In diesen Verbindungen ist das Über- gangsmetall zwar auch achtfach von Zinn bzw. Indium koordiniert, jedoch in Form von tetragonalen Antiprismen, die im PdSn2 und Pd3In7 paarweise über gemeinsame Vierecksflächen miteinander verknüpft sind, wodurch sich die Koordinationszahl des Übergangsmetalls wegen der geringen Pd-Pd-Abstände von 8 auf 8 + 1 erhöht. In diesen Strukturen, die sich formal vom CuAl2-Typ ableiten, ist das Gerüst des Hauptgruppenmetalls sehr flexibel, so dass sich durch verschiedene Orientierungen und unterschiedlichem Füllungsgrad der Leerstellen eine Vielzahl von Strukturen konstruieren lassen, die auf die elektronischen und geometrischen Ansprüche jedes Elementpaars optimal angepasst sind. Dieses Strukturmotiv ist offensichtlich sehr günstig, und wird ja ebenfalls im PtSn4 realisiert. 93 U. Häussermann, M. Elding-Pontén, Ch. Svenson, : Lidin, Chem. Eur. J. 1998, 4, No.6, 1007-1015 210 5. Pt2Sn2Zn3 ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Wenn als Randbedingung für die Existenz der Struktur des Pt2Sn2Zn3 entsprechende Strukturmotive der binären Phasen sind, sollten im System Pt-Ga-Zn günstige Voraussetzungen vorliegen, da dort mit dem PtGa2 ebenfalls eine Verbindung existiert, die im Fluorit-Typ kristallisiert. Wie in den vorhergehenden Kapiteln beschrieben, ist der Ga8-Würfel ein bevorzugtes Strukturmotiv bei galliumreichen Verbindungen, und auch das Pt2Ga3 kann als Defektvariante des CsCl-Typs aufgefasst werden[23]. Die Umsetzung dieser Metalle in verschiedenen molaren Verhältnissen führte jedoch auch hier nicht zum gewünschten Ergebnis. Allerdings wurden einige Kristalle gefunden, die bei der röntgenographischen Untersuchung eine hexagonale Zelle mit Gitterkonstanten von a = 12.41 Å. und c = 27.83 Å zeigten. Bisher ist es allerdings nicht gelungen, ein befriedigendes Strukturmodell zu finden. Möglicherweise liegen beim Pt2Sn2Zn3 äußerst günstige Bedingungen bezüglich der Radienverhältnisse der Atome untereinander und der Valenzelektronenkonzentration vor, die auf Platin, Zinn und Zink optimal zugeschnitten sind, und diesen Strukturtyp ermöglichen. Mit dieser Annahme scheinen die Existenzbedingungen des Pt2Sn2Zn3 in einem ziemlich engen Bereich zu liegen. Dies ist zugleich erstaunlich, da Pt2Sn2Zn3 eine sehr leicht zugängliche Verbindung ist, deren Synthese aus Schmelzen mit sehr unterschiedlichen molaren Verhältnissen der Metalle gelingt. Versuche haben gezeigt, das die Verbindung phasenrein entsteht, solange das Pt-Zn-Verhältnis zwischen 1 : 2 und 1 : 4, und das Pt-Sn-Verhältnis zwischen 1 : 4 und 1 : 20 liegt. Ähnliche Radienverhältnisse liegen vor, wenn Platin gegen Rhodium oder Iridium, Zinn gegen Indium und Zink gegen Kupfer ersetzt wird, wobei allerdings die VEK von 2.0 in Pt2Sn2Zn3 auf einen sehr niedrigen Wert von 1.29 in einer hypothetischen Verbindung „Rh2In2Cu3“ verringert würde [*] . Ersetzt man gedanklich Zink durch das etwas größere Aluminium, ergäbe sich bei einem „Rh2In2Al3“ eine VEK = 2.14, der zwar dem Wert des Pt2Sn2Zn3 einigermaßen entspricht, aber bezüglich der Radienverhältnisse der Metalle untereinander wiederum ungünstig ist. Dabei ist zu beachten, dass die Atomvolumina aus den Elementstrukturen berechnet wurden, deren Werte in Verbindungen untereinander durchaus variieren können. 23 * E. Hellner, F. Laves, Z. Naturforsch. 1947, 2A, 177 - 183 Valenzelektronen pro Atom nach L. Pauling: Edelmetalle = 0; Cu = 1; Zn = 2; Al, In = 3; Sn = 4 211 5. Pt2Sn2Zn3 ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Denkbar wäre auch eine Kombination zweier Edelmetalle, die im Periodensystem in unmittelbarer Nachbarschaft zum Platin liegen, die dann quartärnere Splitvarianten des Pt2Sn2Zn3 ergeben könnten. Eine Ausordnung ungleich großer Edelmetalle auf die beiden Lagen mit verschiedener Koordination wäre dabei ein interessanter Sensor nicht nur für den unterschiedlichen Raumbedarf der Metalle, sondern könnte gleichzeitig Auskunft darüber geben, in wie weit geometrische und elektronische Faktoren diesen Strukturtyp beeinflussen oder gestalten. Ein Vergleich des Pt2Sn2Zn3 mit V11Cu9Ga46 (Abschnitt 4.2.2) zeigt, dass beide Verbindungen jeweils Strukturmotive der benachbarten binären Randphasen nebeneinander beinhalten, die einerseits sehr gut untereinander kompatibel sind, und andererseits geschickt miteinander verknüpft sind. Auf diese Weise können sich Strukturen mit hoher Symmetrie und relativ einfachen Baumotiven bilden, auch wenn dafür große Translationsperioden wie im V11Cu9Ga46 notwendig sind. 212 6. Weitere Ergebnisse ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ 6. Weitere Ergebnisse 6.1. Mo3Ga1.9Si4.1 Bei der Synthese des triklinen Mo6Ga31 aus Molybdän-Gallium-Silizium-Schmelzen entstanden viele sehr gut ausgebildete metallisch glänzende hexagonale Nadeln und Bipyramiden. Die röntgenographische Vermessung einiger Kristalle mit dem Einkristalldiffraktometer ergab eine hexagonale Zelle mit a = 4.7110(1) Å und c = 6.5371(1) Å. Ein Vergleich mit den in diesem System bekannten Verbindungen zeigte, dass es sich offenbar um die von R. Andruszkiewicz und R. Horyn 1986 publizierte Verbindung Mo3Ga2Si4 handelt [94], die lediglich anhand von Pulverdaten charakterisiert wurde. Die Autoren gaben für die beiden kristallographischen Lagen eine Mischbesetzung von M1 auf 3d mit 95% Mo und 5% Ga, sowie M2 auf 6j mit 31% Ga und 69% Si an. Die Verfeinerung des aus 310 unabhängigen Reflexen bestehenden Datensatzes mit SHELX97 konvergierte in der Raumgruppe P6222 bei Zuverlässigkeitswerten von R1(F) = 0.0266 und wR2(I) = 0.0569. Nach Freigabe der Besetzungsparameter ergab sich für die Lage 6j eine Fehlbesetzung, die als Splitlage verfeinert wurde, und ein Ga:Si-Verhältnis von etwa 31:69 ergab, was mit den von R. Andruszkiewicz angegebenen Daten sehr gut übereinstimmt. Auf der Mo-Lage wurde kein Unterbesetzung festgestellt. EDX-Analysen bestätigten die Zusammensetzung. _______________________________________________________________________________ Tab. 6.1: Strukturdaten zum Mo3Ga1.9Si4.1 Summenformel Mo3Ga1.9Si4.1 Kristallsystem Raumgruppe Gitterkonstanten hexagonal P 62 2 2 (Nr. 180) a = 4.7110(1) Å c = 6.5371(6) Å 125.64(1) Å3 Zellvolumen Formeleinheiten pro Zelle 1 Pearson code hP9 _______________________________________________________________________________ 94 R. Andruszkiewicz, R. Horyn, J. Less Common Met. 1986, 119, 91-97 213 6.Weitere Ergebnisse ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Tab. 6.2: Ortskoordinaten und Auslenkungsparameter Atom Wyck. Symm. Occ. x y z Ueq Mo Ga* Si* 3c 6i 6i 222 ..2 ..2 0.31(1) 0.69(1) 1/2 0.1659(8) 0.1613(9) 0 0.332(2) 0.323(2) 0 0 0 0.0043(1) 0.0035(3) 0.0035(3) Atom U11 U22 U33 U12 U13 U23 Mo Ga* Si* 0.0029(2) 0.0026(3) 0.0026(3) 0.0032(2) 0.0068(2) 0.0016(1) 0.0040(4) 0.0044(3) 0.0020(2) 0.0040(4) 0.0044(3) 0.0020(2) 0 -0.0002(1) -0.0002(1) 0 0 0 * Mischbesetzung: 31% Gallium, 69% Silizium _______________________________________________________________________________ Die Struktur bildet eine Ordnungsvariante der dichtesten Kugelpackung, wobei jede Schicht die Zusammensetzung Mo(Ga,Si)2 mit dem in Abb. 6.1 links dargestellten Ordnungsmuster aufweist. Gallium und Silizium bilden für sich betrachtet ein 36-GraphitNetz, während Molybdän in einem 63-Netz mit einer Maschenweite von 4.7110(1) Å ausordnet. Benachbarte Schichten sind im Mo3Ga1.9Si4.1 nicht in der sonst für dichteste Kugelpackungen üblichen Art gestapelt, das Atome der folgenden Schicht über den Mulden liegen, die von drei Atomen der vorhergehenden Schicht gebildet werden. Vielmehr sind die Atome folgender Schichten bezüglich der Stapelrichtung senkrecht unter- bzw. oberhalb der kürzesten Abstände benachbarter Schichten angeordnet (Abb. 6.1 rechts) a a b b Si/Ga Mo Abb. 6.1: links: Ordnung der Atome in Mo3Ga1.9Si4.1 innerhalb einer Schicht rechts: Stapelfolge zweier Schichten in Mo3Ga1.9Si4.1 214 6. Weitere Ergebnisse ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ A C Si/Ga Mo B A C B A Abb. 6.2: Koordinationspolyeder und Stapelfolge der Schichten in Mo3Ga1.9Si4.1 Die Elementarzelle enthält drei Schichten in der Abfolge ...ABC...; die Atome sind jedoch aufgrund der ungewöhnlichen Art der Stapelung statt 12-fach nun 14-fach koordiniert. Daraus resultiert ein eigenartiges Versetzungsnetzwerk mit Motiven der dichtesten Kugelpackung. Abb. 6.3: Perspektivische Darstellung der Mo3Ga1.9Si4.1-Struktur (Stereobild) 215 6.Weitere Ergebnisse ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ 6.2. In Cu33Ga16 Wolfram-Gallium-Kupfer-Schmelzen entstanden häufig sehr kleine graue würfelförmige Kristalle, deren röntgenographische Vermessung mit dem Einkristalldiffraktometer eine kubisch primitive Zelle mit einer Gitterkonstanten von 8.667 Å ergaben. Symmetrie und Zellabmessungen ließen auf Cu9Ga4 schließen, das isotyp zum Cu9Al4 ist und im Typ des γ-Messings kristallisiert. Die Verfeinerung von Datensätzen in der Raumgruppe P-43m mit den Startkoordinaten des Al9Ga4 konvergierten jedoch nicht. Es konnte schließlich ein neues Strukturmodell entwickelt werden, das statt der 52 Atome pro Elementarzelle des γ-Messing-Typs nur 49 Atome enthält. Die Verfeinerung des aus 509 unabhängigen Reflexen bestehenden Datensatzes mit SHELX97 konvergierte in der Raumgruppe P-43m bei Zuverlässigkeitswerten von R1(F) = 0.0856 und wR2(I) = 0.2150. _________________________________________________________________________ Tab. 6.3: Strukturdaten zum Cu33Ga16 Summenformel Cu33Ga16 Kristallsystem Raumgruppe Gitterkonstanten Zellvolumen Formeleinheiten pro Zelle Pearson code kubisch P -4 3 m (Nr. 215) a = 8.6679(10) Å 651.24(13) Å3 1 cP49 Tab. 6.4:Ortskoordinaten und Auslenkungsparameter Atom Cu1 Cu2 Cu3 Cu4 Cu5 Ga1 Ga2 Ga3 Wyck. 1a 4e 12i 4e 12i 6f 4e 6g Symm. -43m .3m ..m .3m ..m 2.mm .3m 2.mm Occ. 0.97 0.98 1.02 0.96 0.86 1.05 1.01 0.99 x 0 0.8281(4) 0.0388(4) 0.3316(4) 0.5277(4) 0.6580(4) 0.6280(4) 0.1425(4) y 0 0.8281(4) 0.3089(3) 0.3316(4) 0.8205(3) 0 0.6280(4) 1/2 z 0 0.8281(4) 0.3089(3) 0.3316(4) 0.8205(3) 0 0.6280(4) 1/2 Atom Cu1 Cu2 Cu3 Cu4 Cu5 Ga1 Ga2 Ga3 U11 0.038(3) 0.030(1) 0.027(1) 0.029(1) 0.026(2) 0.034(2) 0.030(1) 0.015(1) U22 0.038(3) 0.030(1) 0.034(1) 0.029(1) 0.026(1) 0.024(2) 0.030(1) 0.034(1) U33 0.038(3) 0.030(1) 0.034(1) 0.029(1) 0.026(1) 0.024(1) 0.030(1) 0.034(1) U12 0 0.009(1) -0.002(1) 0.006(1) 0.002(1) 0 0.011(1) 0 U13 0 0.009(1) -0.002(1) 0.006(1) 0.002(1) 0 0.011(1) 0 U23 0 0.009(1) -0.003(1) 0.006(1) -0.002(1) -0.004(1) 0.011(1) -0.007(2) _________________________________________________________________________ 216 6. Weitere Ergebnisse ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Die Zusammensetzung aus der Strukturanalyse ergibt eine Summenformel von C33Ga16 mit einem Cu-Ga-Verhältnis von etwa 2 : 1, während Cu9Ga4 die etwas kupferreichere Verbindung ist. Eine EDX-Analyse war bisher nicht möglich, da die Einkristalle zu klein für eine Präparation in Kunstharz und anschließendem Anschliff sind. Es ist daher nicht möglich, eine genaue Zusammensetzung zu ermitteln. Wesentliche Unterschiede in Cu33Ga16 im Vergleich zur Struktur des γ-Messing bestehen in der verschiedenartigen Koordination um Ursprung und Zentrum der Elementarzelle. Im Typ des γ-Messing sind dort formal Defekte enthalten, die von acht benachbarten Atomen insofern geschlossen werden, als dass diese Atome etwas aufeinander zurücken, die sich als kleines und großes Tetraeder beschreiben lassen (Abb. 6.4. links). Abgesehen von der Dekoration mit Atomen unterschiedlicher Art, ist dieses Baumotiv in allen Messingstrukturen vorhanden. Im Cu33Ga16 befinden sich kleines und großes Tetraeder ebenfalls im Zentrum der Elementarzelle, im Ursprung der Zelle weicht das Motiv im Vergleich zur γ-Messing Struktur jedoch ab. Dort befindet sich nun ein Kupferatom, wodurch sich die nächste Koordinationssphäre verändert (Abb. 6.4. rechts) Al Cu Cu Ga Cu9Al4 Cu33Ga16 Abb. 6.4: Gegenüberstellung der Strukturmotive um Zentrum und Ursprung der Elementarzelle in Cu9Al4 (links) und Cu33Ga16 (rechts). 217 6.Weitere Ergebnisse ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Darüber hinaus enthält die Struktur des Cu33Ga16 auf der Lage 4e (x,x,x = 0.1765) nun echte Defekte, die verzerrt würfelförmig von fünf Kupfer- und drei Galliumatomen koordiniert sind. Die neue Struktur ist auch in Pulverdiagrammen nachzuweisen, es handelt sich also nicht um einzelne Einkristalle. In Abb. 6.5 ist ein vergrößerter Ausschnitt des Pulverdiagramms aus einem Ansatz der molaren Zusammensetzung W:Ga:Cu 1:20:6 dargestellt. Neben den Strichdiagrammen von elementarem Wolfram und CuGa2 enthält die Abbildung zum Vergleich die aus Einkristalldaten berechneten Diagramme des Cu9Ga4 sowie des Cu33Ga16. Deutlich erkennbar sind einige Reflexe im gemessenen Diagramm, die im theoretischen Diagramm von Cu9Ga4 nicht vorhanden sind, jedoch mit Reflexen des Cu33Ga16 übereinstimmen. gemessen relative Intensitäten Cu33Ga16-berechnet Cu9Ga4-berechnet CuGa2 Wolfram 9 10 20 30 40 2-Theta - Scale Abb. 6.5: Pulverdiagramm und Phasenanalyse eines Ansatzes W-Ga-Cu der molaren Zusammensetzung 1:20:6 nach Aufarbeitung mit verdünnter wssrg. HCl 218 7. Experimenteller Teil ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ 7. Experimenteller Teil 7.1. Geräte Die röntgenographischen Untersuchungen an Pulverproben erfolgten an Pulverdiffraktometern von Siemens (D 5000) und STOE (STADI P2) – beide mit Cu-Kα-Strahlung und Ge-Einkristallmonochromator – in Debye-Scherrer-Geometrie (Transmission) mit ortsempfindlichen Detektoren und wurden mit Hilfe des Programmpaketes DIFFRAC-PLUS von Bruker AS ausgewertet. Anhand von Einkristalldaten berechnete Pulverdiagramme wurden mit den Programmen DIFFRAC97 [95] , sowie WINXPOW von STOE angefertigt, die sich durch Konvertierung in die BRUKER-Software einbinden lassen, und als eigenständige Datenbank für eine Phasenanalyse zur Verfügung stehen. Indizierungen von Pulverdiagrammen erfolgten mit den Programmen WINXPOW und WERNER [96] . Die Messung von Reflexintensitäten zur Einkristallstrukturanalyse wurden an folgenden Diffraktometern durchgeführt: SIEMENS P4; Enraf Nonius CAD 4, STOE IPDS und STOE IPDS II; alle Diffraktometer sind mit Mo-Kα-Strahlung und Graphit-Monochromator ausgestattet. Für die Modellsuche und für die Absorptionskorrektur fanden die Programmpakete SHELXTL-97 [97] , X-RED, X-SHAPE [98] Verwendung. Die graphische Darstellung der Kristallstrukturen erfolgte mit dem Programm DIAMOND [99]. Zur Elementanalyse wurde eine mit einem Rasterelektronenmikroskop (Zeiss DSM 940) integrierte Mikrosonde (Link Analytical Microprobe QX 2000) verwendet. Die Intensität der emittierten Röntgenstrahlung wurde mit einem Halbleiterdetektor energiedispersiv gemessen. 95 Th. Degen, Programm DIFFRAC97, Institut für Anorganische Chemie, Universität Bonn, 1997 96 P.-E. Werner, L. Eriksson, M. Westdahl, J. Appl. Cryst. 1985, 18, 367 97 G. M. Sheldrick, Institut für Anorganische Chemie, Universität Göttingen, 1997 98 X-SHAPE basiert auf dem Programm HABITUS, W. Herrendorf, Institut für Anorganische Chemie, Universität Gießen 99 DIAMOND 2.1c, Informationssystem für Kristallstrukturen, K. Brandenburg, Institut für Anorganische Chemie, Universität Bonn, 1998 219 7. Experimenteller Teil ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ 7.2. Synthesen Die Synthesen erfolgten, falls nicht anders angegeben, aus den Elementen in üblicher Handelsqualität ohne weitere Vorbehandlung. Von allen Substanzen außer Gallium wurden Pulverdiagramme angefertigt, um den Reinheitsgehalt zu überprüfen. Dabei zeigten sich, außer bei einer Charge Zinkpulver, die Spuren von Zinkoxid enthielt und nicht weiter verwendet wurde, keine Nebenprodukte. Die Elemente lagen in Form feiner Pulver vor. Gallium, das nur in Form von Splattern bzw. Schrot mit einer Korngröße von etwa 1-2 mm zu erhalten ist, wurde teilweise vorbehandelt: um das Metall auch in kleinsten Mengen dosieren zu können, wurde es bei 80°C aufgeschmolzen und auf einer Kunststoffunterlage mit einer – ebenfalls erhitzen – Pasteur-Pipette zu dünnen Drähten ausgezogen, die nach dem Erstarren des Metalls in kleine Stücke gebrochen werden können. Die Umsetzung der Elemente erfolgte in evakuierten Quarzampullen in Kastenöfen der Firmen Lenton, Heraeus, Nabertherm und Linn. 7.2.1. Mo(Zn,Ga)6 - kubisch Eine nahezu phasenreine Synthese des kubischen Mo(Zn,Ga)6, die auch zu gut ausgebildeten Einkristallen führte, erfolgte in einer Mo-Ga-Zn-Schmelze mit der molaren Zusammensetzung 1 : 0.8 : 20. 0.0379g (0.40 mmol) Molybdän, 0.0215g (0.31 mmol) Gallium und 0.5100g (7.80 mmol) Zink wurden in einer evakuierten Quarzampulle mit 60°/h auf 850 °C erhitzt und nach vier Tagen mit 6°/h auf 500°C abgekühlt. Nach weiteren vier Tagen wurde mit 18°/h auf Raumtemperatur abgekühlt. Der entstandene Regulus wurde mit stark verdünnter Salzsäure behandelt. Mo(Zn,Ga)6 bildet Kristalle in Form von metallisch glänzenden und teilweise verwachsenen Oktaedern, trigonalen Antiprismen und unregelmäßigen Polyeder. Viele Einkristalle ergaben bei der Vermessung mit dem Einkristalldiffraktometer eine hexagonale Zelle mit einem c/a-Verhältnis von √6, bei der es sich um eine Revers/Obvers-Verzwillingung der kubisch- dichtesten Kugelpackung handelt. EDX-Analysen an Einkristallen ergaben ein Verhältnis Zink : Gallium von 9 : 1, dies entspricht einer Zusammensetzung MoZn5,4Ga0,6. Eine nahezu phasenreine Synthese gelingt auch mit einer Zusammensetzung Mo:Ga:Zn von 1 : 0.4 : 20, allerdings nur in Pulverform. Als weitere nachgewiesen werden. 220 Reaktionsprodukt konnte im Pulverdiagramm Mo3Ga 7. Experimenteller Teil ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ 7.2.2. Mo(Zn,Ga)6 - rhomboedrisch Die Synthese des rhomboedrischen Mo(Zn,Ga)6 erfolgte mit den Metallen Mo : Ga : Zn im molaren Verhältnis 1 : 2 : 20 nahezu phasenrein. 0.0624g (0.65 mmol) Molybdän, 0.0911g ( 1.31 mmol) Gallium und 0.854g (13,06 mmol) Zink wurden in einer evakuierten Quarzampulle mit 60°/h auf 850 °C erhitzt und nach vier Tagen mit 6°/h auf 500°C abgekühlt. Nach weiteren vier Tagen wurde mit 18°/h auf Raumtemperatur abgekühlt. Der entstandene Regulus wurde mit stark verdünnter Salzsäure behandelt. Das rhomboedrische Mo(Zn,Ga)6 bleibt dabei als schwarzes Pulver und einigen Einkristallen in Form trigonaler Plättchen zurück. Das Pulverdiagramm entspricht dem aus Einkristalldaten berechnetem Diagramm, zusätzliche Reflexe stammen von geringen Mengen ZnGa2O4, das im SpinellTyp kristallisiert. EDX-Analysen ergaben ein Verhältnis Zink : Gallium von 3 : 1, was einer Zusammensetzung MoZn4,5Ga1,5 entspricht. 7.2.3. V(Zn,Ga)6 - hexagonal 0.0460g (0.90 mmol) Vanadium, 0.1100g (1.58 mmol) Gallium und 0.5300g ( 8.11 mmol) Zink (V-Ga-Zn 1 : 2 : 9) wurden in einer evakuierten Quarzampulle mit 60°/h auf 850 °C erhitzt und nach vier Tagen mit 6°/h auf 500°C abgekühlt. Nach weiteren vier Tagen wurde mit 18°/h auf Raumtemperatur abgekühlt. Nach Behandlung mit verdünnter Salzsäure blieben Säulen und tetragonale Plättchen (V2Ga5), wenige Würfel (V7Ga12Zn39) und einige sehr kleine hexagonale Plättchen zurück. Die röntgenographische Untersuchung mit dem Einkristalldiffraktometer ergaben eine hexagonale Zelle mit a = 5.4140(8) Å und c = 17.847(4) Å. Die Strukturanalyse bestätigte die Isotypie zu den Strukturen Nb(Zn,Ga)6 und Ta(Zn,Ga)6. EDX-Analysen ergaben ein Zink-Gallium-Verhältnis von 2 : 1, was einer Summenformel VZn4Ga2 entspricht. 221 7. Experimenteller Teil ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ 7.2.4. V7Ga12Zn39 0.0460g (0.90 mmol) Vanadium, 0.1100g (1.58 mmol) Gallium und 0.5300g ( 8.11 mmol) Zink (V-Ga-Zn 1 : 2 : 9) wurden in einer evakuierten Quarzampulle mit 60°/h auf 850 °C erhitzt und nach vier Tagen mit 6°/h auf 500°C abgekühlt. Nach weiteren vier Tagen wurde mit 18°/h auf Raumtemperatur abgekühlt. Nach Behandlung mit verdünnter Salzsäure blieben Säulen und tetragonale Plättchen (V2Ga5), einige sehr kleine hexagonale Plättchen (hexagonales V(Zn,Ga)6) sowie einige Würfel zurück, deren röntgenographische Untersuchung mit dem Einkristalldiffraktometer eine kubische Zelle mit einer Gitterkonstanten von 24.857(3) Å ergab. Die Strukturanalyse zeigte eine weitgehende Isotypie zum Mo7Sn12Zn40-Typ mit einer etwas abweichenden Koordination einer Vanadiumposition. EDX-Analysen ergaben lediglich, dass es sich um eine ternäre V-GaZn-Verbindung handelt. Die Messungen waren bezüglich der Zusammensetzung nicht einheitlich. Die Oberflächen der Kristalle zeigten viele Risse, ob diese durch einen Angriff von Salzsäure hervorgerufen wurden, bleibt offen. 7.2.5. Mo7Ga26Zn26 0.0548g (0.57 mmol) Molybdän, 0.1995g (2.86 mmol) Gallium und 0.7479g (11.44 mmol) Zink (Mo-Ga-Zn 1 : 5 : 20) wurden in einer evakuierten Quarzampulle mit 60°/h auf 850 °C erhitzt und nach vier Tagen mit 6°/h auf 500°C abgekühlt. Nach weiteren vier Tagen wurde mit 18°/h auf Raumtemperatur abgekühlt. Nach Behandlung mit verdünnter Salzsäure blieben viele metallisch glänzende, teilweise verwachsene Würfel zurück. EDXAnalysen an einigen Kristallen ergaben ein Gallium-Zink-Verhältnis von 1 : 1. Eine nasschemische Analyse – Küvettentest der Firma Merck©, fotometrischer Nachweis mit PAR (Pyridylazoresorcin), Messbereich 0.2 – 5.0 mg/l – bestätigte die Zusammensetzung. Die Verbindung hat demnach die Zusammensetzung Mo7Ga26Zn26.. Röntgenographische Untersuchungen mit dem Einkristalldiffraktometer ergaben eine kubische Zelle mit a = 24.816(3) Å und eine Isotypie zum Mo7Sn12Zn40-Typ. Da Zink und Gallium röntgenographisch nicht zu unterscheiden sind, wird eine statistische Substitution angenommen. Berechnete Pulverdiagramme mit einer 1:1-Mischbesetung der Zn- und GaPositionen im Mo7Sn12Zn40-Typ ergeben eine sehr gute Übereinstimmung mit den gemessenen Pulverdiagrammen. 222 7. Experimenteller Teil ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ 7.2.6. Mo6Ga31 - triklin 0.0585g ( 0.61 mmol) Molybdän, 0.4233g (6.07 mmol) Gallium und 0.0177g (0.63 mmol) Silizium (Mo-Ga-Si 1 : 10 : 1) wurden in einer evakuierten Quarzampulle mit 60°/h auf 1000 °C erhitzt und nach vier Tagen mit 6°/h auf 500°C abgekühlt. Nach weiteren vier Tagen wurde mit 18°/h auf Raumtemperatur abgekühlt. Nach Behandlung mit verdünnter Salzsäure blieben neben hellgrauem Pulver zahlreiche sehr gut ausgebildete dünne, lange Nadeln und hexagonaler Bipyramiden, bei denen es sich nach röntgenographischen Untersuchungen um die Verbindung Mo3Ga1.9Si4.1 handelt. Einige wenige unregelmäßige und teilweise sehr große flache Polyeder ergaben bei Untersuchungen mit dem Einkristalldiffraktometer eine trikline Kristallstruktur der Zusammensetzung Mo6Ga31. Bei der Verfeinerung konnte kein Silizium gefunden werden, was durch EDX-Analysen mehrerer Einkristalle bestätigt werden konnte. In Pulverdiagrammen konnte die Linien des Mo6Ga31 bisher nicht nachgewiesen werden, da die gleichzeitig gebildete Verbindung Mo3Ga2Si4 in deutlich größeren Mengen als das Mo6Ga31 entsteht, und zudem eine hohe Streukraft besitzt. 7.2.7. Mo6Ga31, Mo8Ga41 (mit Iod) Die Synthese von Verbindungen mit den Strukturen des Mo8Ga41- und Mo6Ga31-Typs (monoklin) gelingt auch in Mo-Ga-Schmelzen mit geringen Zusätzen an Iod. Ob die Kristalle auch Iod enthalten ist noch unklar, da die Verbindungen bisher nur in Pulverform vorliegen und keine geeigneten Einkristalle für eine Strukturanalyse und EDX-Untersuchungen vorhanden sind. Ein Vergleich von gemessenen und aus Einkristalldaten berechneten Pulverdiagrammen lassen darauf schließen, dass das monokline Mo6Ga31 Iod enthalten könnte, was sich an unterschiedlichen Intensitäten einiger Reflexe bemerkbar macht. 223 7. Experimenteller Teil ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Die Synthese des Mo8Ga41 erfolgte aus einer Mo-Ga-I-Schmelze der molaren Zusammensetzung 1 : 16 : 1. Dazu wurden 0.0617g (0.64 mmol) Molybdän, 0.3568g (5.14 mmol) Gallium und 0.0814g ( 0.32 mmol) Iod in einer evakuierten Quarzampulle mit 60°/h auf 1000 °C erhitzt und nach vier Tagen mit 6°/h auf 500°C abgekühlt. Nach weiteren vier Tagen wurde mit 18°/h auf Raumtemperatur abgekühlt. Nach Behandlung mit verdünnter Salzsäure blieb viel hellgraues Pulver und einige stark verwachsene schwarz glänzende Konglomerate aus Kristallen zurück. Die Synthese des Mo6Ga31-monoklin erfolgte aus einer Mo-Ga-I-Schmelze der molaren Zusammensetzung 1 : 10 : 1. Dazu wurden 0.0457g (0.48 mmol) Molybdän, 0.3324g (4.77 mmol) Gallium und 0.0606g (0.24 mmol) Iod in einer evakuierten Quarzampulle mit 60°/h auf 1000 °C erhitzt und nach vier Tagen mit 6°/h auf 500°C abgekühlt. Nach weiteren vier Tagen wurde mit 18°/h auf Raumtemperatur abgekühlt. Nach Behandlung mit verdünnter Salzsäure blieb viel hellgraues Pulver und grober Krümel zurück. Die röntgenographische Analyse anhand von Pulverdiagrammen bestätigten die Bildung von Mo6Ga31 neben geringen Mengen Mo8Ga41. 7.2.8. V2Cu3Ga8 0.0280g (0.55 mmol) Vanadium, 0.7687g (11.01 mmol) Gallium und 0.2799g (4.40 mmol) Kupfer (V-Ga-Cu 1 : 20 : 8) wurden in einer evakuierten Quarzampulle mit 60°/h auf 1000 °C erhitzt und nach zwei Wochen mit 4°/h auf 400°C abgekühlt. Nach weiteren vier Tagen wurde mit 16°/h auf Raumtemperatur abgekühlt. Nach Behandlung mit verdünnter Salzsäure blieben neben dunkelgrauem Pulver, tetragonalen Quadern von CuGa2 einige hellgraue unregelmäßige Polyeder zurück, deren röntgenographische Vermessung mit dem Einkristalldiffraktometer die zum Mo2Cu3Ga8 isotype Struktur ergab. 224 7. Experimenteller Teil ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ 7.2.9. V11Cu9Ga46 0.0269g (0.53 mmol) Vanadium, 0.7358 (10.55 mmol) Gallium und 0.1341g (2.11 mmol) Kupfer (V-Ga-Cu 1 : 20 : 4) wurden in einer evakuierten Quarzampulle mit 60°/h auf 1000 °C erhitzt und nach zwei Wochen mit 4°/h auf 400°C abgekühlt. Nach weiteren vier Tagen wurde mit 16°/h auf Raumtemperatur abgekühlt. Nach Behandlung mit verdünnter Salzsäure blieben neben dunkelgrauem Pulver, tetragonalen Quadern von CuGa2 einige kupferfarbene, teilweise große Polyeder zurück, deren röntgenographische Vermessung mit dem Einkristalldiffraktometer eine kubische Elementarzelle mit einer Gitterkonstanten von 23.362(3) Å ergab. Nach der Strukturlösung hat die Verbindung die Zusammensetzung V11Cu9Ga46, was durch EDX-Analysen an geschliffenen Einkristallen bestätigt werden konnte. 7.2.10. Pt2Sn2Zn3 0.1217g (0.62 mmol) Platin, 0.2964g (2.50 mmol) Zinn und 0.0818g (1.25 mmol) Zink (Pt-Sn-Zn 1 : 4 : 2) wurden in einer evakuierten Quarzampulle mit 60°/h auf 1000 °C erhitzt und nach vier Tagen mit 4°/h auf 400°C abgekühlt. Nach weiteren zwei Tagen wurde mit 16°/h auf Raumtemperatur abgekühlt. Nach Behandlung mit verdünnter Salzsäure blieben zahlreiche bronzefarbene Kristalle in Form hexagonaler Prismen und sechseckiger Polyeder zurück. Die röntgenographische Vermessung mit dem Einkristalldiffraktometer ergab eine Zelle mit hexagonaler Metrik und den Gitterkonstanten a = 4.3367(5) Å und c = 15.532(3) Å. Die Strukturlösung ergab eine Zusammensetzung Pt2Sn2Zn3, was durch EDX-Analysen bestätigt werden konnte. 225 7. Experimenteller Teil ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ 7.2.11. Mo3Ga1.9Si4.1 Mo3Ga1.9Si4.1 entsteht als weitere Verbindung bei der Synthese des triklinen Mo6Ga31.Die Mengenangaben der Elemente entsprechen denjenigen für die Synthese des Mo6Ga31 angegebenen Werte. 0.0585g ( 0.61 mmol) Molybdän, 0.4233g (6.07 mmol) Gallium und 0.0177g (0.63 mmol) Silizium (Mo-Ga-Si 1 : 10 : 1) wurden in einer evakuierten Quarzampulle mit 60°/h auf 1000 °C erhitzt und nach vier Tagen mit 6°/h auf 500°C abgekühlt. Nach weiteren vier Tagen wurde mit 18°/h auf Raumtemperatur abgekühlt. Nach Behandlung mit verdünnter Salzsäure blieben neben hellgrauem Pulver und eunigen unregelmäßigen flachen Polyedern (Mo6Ga31) zahlreiche sehr gut ausgebildete dünne, lange Nadeln und hexagonaler Bipyramiden, bei denen es sich nach röntgenographischen Untersuchungen um die Verbindung Mo3Ga1.9Si4.1 handelt. Die Zusammensetzung konnte duch EDX-Analysen bestätigt werden. 7.2.12. Cu33Ga16 Die Verbindung entsteht bei der Umsetzung der Metalle Wolfram, Gallium und Kupfer in unterschiedlichen Mengenverhältnissen in Form sehr kleiner grauer Polyeder. Die Strukturlösung erfolgte an Einkristallen aus einer Schmelze der molaren Zusammensetzung W-Ga-Cu 1 : 20 : 6. Dazu wurden 0.0933 g (0.51 mmol Wolfram, 0.7130 g (10.23 mmol) Gallium und 0.1936 g (3.05 mmol) Kupfer in einer evakuierten Quarzampulle auf 1000°C erhitzt und nach drei Tagen mit 4°/h auf 500°C, und danach wurde mit 18°/h auf Raumtemperatur abgekühlt. Nach Behandlung mit verdünnter Salzsäure bleiben neben dunkelgrauem Pulver (nicht umgesetztes Wolfram) und verwachsener Quader (CuGa2) wenige kleine Polyeder zurück. Die röntgenographische Vermessung einiger Kristalle ergab eine binäre Verbindung der Zusammensetzung Cu33Ga16. Angaben zur Strukturlösung sind in Tabelle 8.32 zusammengefasst. 226 8. Anhang ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ 8. Anhang 8.1. Angaben zur Strukturbestimmung Tab. 8.1: Ergebnis der Indizierng des kubischen Mo(Zn,Ga)6 anhand von Pulverdaten Mo(Zn,Ga)6 aus einem Ansatz der Zusammensetzung Mo:Ga:Zn Refined cell parameters : 1:0.8:20 Cell A : 7.690(4) Cell Volume: 454.7(4) Number of indexed lines : 16 2Theta zeropoint Final 2Theta window : 0.03(4) : 0.2300 N 2Th[obs] H K L 2Th[calc] obs-calc Int. d[obs] d[calc] 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 19.966 23.095 32.914 38.809 40.603 47.243 51.782 53.237 58.780 62.745 69.057 72.706 82.167 83.323 87.943 100.662 1 2 2 3 2 4 3 4 4 5 4 5 5 6 4 7 1 0 2 1 2 0 3 2 2 1 4 3 3 2 4 3 1 0 0 1 2 0 1 0 2 1 0 1 3 2 4 1 19.983 23.114 32.917 38.808 40.608 47.241 51.778 53.227 58.777 62.731 69.033 72.685 82.121 83.281 87.895 100.604 -0.0171 -0.0187 -0.0030 0.0010 -0.0042 0.0015 0.0041 0.0100 0.0033 0.0133 0.0237 0.0208 0.0457 0.0423 0.0486 0.0586 31.2 1.9 1.9 14.0 100.0 34.0 5.4 0.5 0.3 2.7 18.6 3.1 1.1 16.0 4.4 1.3 4.4435 3.8480 2.7190 2.3185 2.2201 1.9224 1.7641 1.7192 1.5696 1.4796 1.3590 1.2995 1.1722 1.1588 1.1095 1.0007 4.4398 3.8450 2.7188 2.3186 2.2199 1.9225 1.7642 1.7195 1.5697 1.4799 1.3594 1.2998 1.1727 1.1593 1.1099 1.0011 Average delta(2Theta) = 0.004 Maximum delta(2Theta) = 0.010 ( peak 16 ) = 7.2 * average Figure of Merit F(16) = 180.2.9 ( 0.004, 22 ) Durbin-Watson serial correlation = 1.933 ( not significant ) Sqrt[ sum( w * delta(q)^2 ) / ( Nobs - Nvar ) ] = 3.7009e-005 227 8. Anhang ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Tab. 8.2: Ergebnis der Indizierng des kubischen MoZn6 anhand von Pulverdaten MoZn6 aus einem Ansatz der Zusammensetzung Refined cell parameters : Mo:Sn:Zn 1:1:15 Cell A : 7.756(6) Cell Volume: 466.6(6) Number of indexed lines : 16 2Theta zeropoint Final 2Theta window : 0.01(6) : 0.3600 N 2Th[obs] H K L 2Th[calc] obs-calc Int. d[obs] d[calc] 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 19.780 22.893 32.598 38.435 40.214 46.790 51.290 52.743 62.104 68.340 71.938 81.251 82.392 86.936 90.331 99.430 1 2 2 3 2 4 3 4 5 4 5 5 6 4 7 7 1 0 2 1 2 0 3 2 1 4 3 3 2 4 1 3 1 0 0 1 2 0 1 0 1 0 1 3 2 4 1 1 19.811 22.914 32.629 38.464 40.247 46.815 51.305 52.739 62.137 68.363 71.969 81.273 82.415 86.957 90.349 99.434 -0.0309 -0.0209 -0.0309 -0.0287 -0.0328 -0.0245 -0.0150 0.0048 -0.0332 -0.0235 -0.0300 -0.0219 -0.0233 -0.0213 -0.0182 -0.0044 31.3 2.3 2.7 16.6 100.0 40.2 6.1 0.8 3.0 23.4 4.0 1.4 20.1 6.1 1.5 1.6 4.4849 3.8815 2.7447 2.3402 2.2407 1.9400 1.7798 1.7342 1.4934 1.3715 1.3115 1.1830 1.1695 1.1197 1.0862 1.0098 4.4779 3.8780 2.7422 2.3385 2.2390 1.9390 1.7794 1.7343 1.4926 1.3711 1.3110 1.1828 1.1693 1.1195 1.0861 1.0097 Average delta(2Theta) = 0.042 Maximum delta(2Theta) = 0.156 ( peak 9 ) = 8.4 * average Figure of Merit F(17) = 75.9 ( 0.004, 22 ) Durbin-Watson serial correlation = 2.059 ( not significant ) Sqrt[ sum( w * delta(q)^2 ) / ( Nobs - Nvar ) ] = 0.00072361 228 8. Anhang ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Tab. 8.3: Ergebnis der Indizierng des kubischen Mo7Ga26Zn26 anhand von Pulverdaten Mo7Ga26Zn26 aus einem Ansatz : Mo:Ga:Zn 1:7:20 Nicht indizierte Rflexe gehören zu ZnGa2O4 Refined cell parameters : Cell_A : 24.8612(8) Cell_Volume: 15366.1(8) Number of single indexed lines : 63 Number of unindexed lines : 5 Final 2Theta window : 0.0700 N 2Th[obs] H K L 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 41 42 7.095 10.069 12.309 15.924 17.454 18.402 20.181 21.117 21.417 28.705 30.314 31.121 32.190 32.806 32.995 34.393 35.705 36.120 36.848 37.398 37.552 38.817 41.609 41.696 42.364 42.856 43.656 44.129 44.912 45.378 46.756 48.526 49.708 51.369 51.992 52.432 53.647 55.259 55.791 57.408 57.778 58.800 2 2 2 4 4 0 2 2 2 2 --4 3 0 0 --5 4 5 4 3 --0 2 5 2 5 3 8 6 7 0 5 2 5 8 4 6 0 2 9 4 8 4 --7 5 0 0 2 0 2 not 0 1 0 0 not 1 0 3 2 1 not 0 0 1 2 3 1 2 0 3 0 1 2 3 0 4 2 0 0 1 0 4 4 not 5 1 4 5 6 8 7 8 7 8 9 10 10 9 10 9 11 8 10 9 12 11 12 11 10 12 12 14 14 11 14 12 14 13 15 2Th[calc] 7.106 10.055 12.323 15.930 17.461 indexed 20.189 21.125 21.428 28.703 indexed 31.130 32.178 32.792 32.995 34.383 indexed 36.099 36.840 37.386 37.567 38.813 41.541 41.707 42.364 42.852 43.654 44.130 44.915 45.380 46.755 48.542 49.706 51.415 51.976 52.393 53.633 55.256 55.789 indexed 57.762 58.797 obs-calc -0.0110 0.0135 -0.0142 -0.0058 -0.0075 ---0.0081 -0.0075 -0.0108 0.0014 ---0.0084 0.0121 0.0139 -0.0001 0.0094 --0.0213 0.0083 0.0115 -0.0152 0.0040 0.0676 -0.0106 0.0003 0.0041 0.0013 -0.0017 -0.0025 -0.0026 0.0009 -0.0154 0.0029 -0.0456 0.0167 0.0384 0.0143 0.0031 0.0010 --0.0155 0.0032 Int. d[obs] d[calc] 22.3 2.4 6.8 3.3 8.1 2.1 4.3 16.8 12.6 3.5 3.9 4.1 3.0 9.7 11.1 4.6 12.5 5.6 2.5 8.9 5.7 97.3 52.3 76.1 100.0 45.4 29.5 9.6 16.3 11.3 16.1 2.0 3.4 3.5 2.2 3.5 3.0 3.5 4.1 4.1 5.4 5.7 12.4498 8.7780 7.1850 5.5611 5.0769 4.8174 4.3966 4.2038 4.1456 3.1075 2.9461 2.8715 2.7785 2.7277 2.7126 2.6055 2.5126 2.4847 2.4373 2.4027 2.3932 2.3181 2.1688 2.1644 2.1318 2.1085 2.0717 2.0506 2.0166 1.9970 1.9413 1.8745 1.8327 1.7773 1.7574 1.7437 1.7070 1.6610 1.6464 1.6038 1.5945 1.5691 12.4306 8.7897 7.1768 5.5591 5.0748 4.3949 4.2023 4.1435 3.1076 2.8707 2.7796 2.7289 2.7126 2.6062 2.4861 2.4378 2.4034 2.3923 2.3183 2.1721 2.1639 2.1318 2.1087 2.0718 2.0505 2.0165 1.9969 1.9413 1.8740 1.8328 1.7758 1.7579 1.7449 1.7075 1.6611 1.6465 1.5948 1.5692 229 8. Anhang ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ 43 44 45 46 47 48 49 50 51 52 53 54 55 56 57 58 59 60 61 62 63 64 65 66 67 68 59.462 63.053 64.423 64.800 66.721 67.800 68.711 71.453 73.279 74.197 75.673 76.117 76.581 77.029 77.824 78.721 79.278 82.394 82.836 83.729 84.144 85.848 86.741 89.039 89.904 91.998 16 14 17 17 18 18 15 19 17 14 14 20 20 19 19 18 16 16 20 18 19 21 16 22 23 0 --10 3 5 0 2 11 3 9 14 14 0 2 7 7 10 14 14 8 12 11 7 16 6 3 0 59.438 0.0243 not indexed --0 64.426 -0.0029 1 64.791 0.0085 1 66.722 -0.0005 0 67.796 0.0047 2 68.743 -0.0322 3 71.434 0.0185 1 73.281 -0.0021 3 74.198 -0.0007 0 75.679 -0.0063 2 76.133 -0.0160 0 76.586 -0.0043 0 77.038 -0.0083 1 77.827 -0.0026 3 78.725 -0.0039 0 79.286 -0.0081 0 82.406 -0.0120 2 82.850 -0.0135 0 83.736 -0.0070 0 84.178 -0.0340 1 85.835 0.0135 1 86.717 0.0237 0 89.029 0.0103 0 89.909 -0.0047 1 92.000 -0.0016 2.6 5.3 4.3 6.3 4.4 9.7 9.6 3.2 7.3 4.9 14.5 6.5 4.3 3.0 4.9 3.4 6.0 8.9 2.8 2.6 4.7 2.8 5.9 2.2 2.8 3.6 1.5532 1.4731 1.4451 1.4376 1.4008 1.3811 1.3650 1.3192 1.2908 1.2770 1.2558 1.2495 1.2431 1.2370 1.2263 1.2146 1.2075 1.1695 1.1644 1.1542 1.1496 1.1311 1.1217 1.0986 1.0903 1.0709 Average delta(2Theta) = 0.011 Maximum delta(2Theta) = 0.068 ( peak 23 ) = 6.1 * average Figure of Merit F(30) = 56.8 ( 0.010, 54 ) Durbin-Watson serial correlation = 1.928 ( not significant ) Sqrt[ sum( w * delta(q)^2 ) / ( Nobs - Nvar ) ] = 0.00012072 230 1.5538 1.4450 1.4378 1.4008 1.3812 1.3644 1.3195 1.2907 1.2770 1.2557 1.2493 1.2431 1.2369 1.2263 1.2145 1.2074 1.1694 1.1642 1.1542 1.1492 1.1312 1.1220 1.0987 1.0902 1.0708 8. Anhang ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Tab. 8.4: Angaben zur Strukturbestimmung zum kubischen Mo(Zn,Ga)6 Rel. Molmasse Kristallsystem Raumgruppe Zellabmessungen 494.58 g/mol kubisch F m –3 m (Nr. 225) a = 7.678(2) Å Zellvolumen Anzahl der Formeleinheiten Röntgendichte Meßtemperatur Röntgenstrahlung V = 452.74 Å3 4 7.162 g/cm3 20°C Mo Kα1 F ( 0 0 0) Meßbereich max. 2θ Scantyp Scanbreite Max. Meßzeit pro Reflex Meßwerte davon unbeobachtet unabhängige Reflexe davon mit I > 0 davon mit I > 2σ(I) Kristallform Kristallabmessungen Absorptionskorrektur Interner Standard Schwächungskoeffizient Extinktionskoeffizient (SHELX97) Restelektronendichte Wichtungsfunktion Zahl der Parameter R- Werte 888 h, k, l 14; 14; 14 85° Ω/ 2θ 0.37° + 0.41 * tanθ 30s 625 8 114 114 88 Oktaeder 0.1 * 0.1 * 0.1 mm3 empirisch; Ψ - scan 0.0801 (0.0375) 33.71 mm-1 0,00553 + 0.92; -0.64 (0.31) e/ Å3 1 / [σ2 * F02 + (0,0296 * P) 2] mit P = (F02 + 2 * Fc2) / 3 6 R1(F) = 0.0398; wR2(I) = 0.0884 231 8. Anhang ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Tab. 8.5: Angaben zur Strukturbestimmung hexagonalen V(Zn,Ga)6 Rel. Molmasse Kristallsystem Raumgruppe Zellabmessungen Zellvolumen Anzahl der Formeleinheiten Röntgendichte Meßtemperatur Diffraktometer Röntgenstrahlung F ( 0 0 0) Meßbereich max. 2θ Mess- / Scanmodus Meßwerte davon unbeobachtet unabhängige Reflexe davon mit I > 0 davon mit I > 2σ(I) Kristallform Kristallabmessungen Absorptionskorrektur Interner Standard Schwächungskoeffizient Extinktionskoeffizient (SHELX98) Restelektronendichte Wichtungsfunktion Zahl der Parameter R- Werte 232 443.26 g/mol hexagonal P 63/m m c (Nr. 194) a = 5.4140(8) Å c = 17.847(4) V = 453.03 Å3 4 6.498 g/cm3 20°C STOE IPDS Mo Kα1 Graphit-Monochromator 812 h, k, l ±6; ±6; ±21 52° 100 Platten à 2 min bei 2° ϕ-Inkrement I / σ(I)-Verhältnis 6.0 3199 15 205 205 131 hexagonales Prisma 0.1 * 0.1 * 0.02 mm3 numerisch; Equivalent-Methode 0.1043 (0.0304) 32.99 mm-1 0,00045 + 0.92; -0.64 (0.31) e/ Å3 1 / [σ2 * F02 + (0,0296 * P) 2] mit P = (F02 + 2 * Fc2) / 3 20 R1(F) = 0.0252; wR2(I) = 0.0845 8. Anhang ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Tab. 8.6: Ortskoordinaten und Auslenkungsparameter zum kubischen Mo(Zn,Ga)6 Atom Wyck. Symm. x y z Ueq Mo Zn 4a 24d m-3m m.mm 0 0 0 0.25 0 0.25 0.0076(4) 0.0107(4) U22 Atom U11 Mo Zn 0.0076(4) 0.0076(4) 0.0081(5) 0.0120(5) U33 U12 U13 U23 0.0076(4) 0.0120(5) 0 0 0 0 0 -0.0034(4) Abstände in [Å]: Mo – Zn 2.7148(7) 12x Zn – Mo 2.7148(7) 2x Zn – Zn 2.7148(7) 8x Tab. 8.7: Ortskoordinaten und Auslenkungsparameter des hexagonalen V(Zn,Ga)6 Atom Wyck. Symm. x y z Ueq V1 V2 ZN1 ZN2 ZN3 2a 2d 6g 6h 12k -3m. -6m2 .2/m. mm2 .m. 0 0.33333 0.5 0.3451(3) 0.1661(1) 0 0.66667 0 0.1725(2) 0.3322(2) 0 0.75 0 0.75 0.6252(1) 0.0230(9) 0.0233(9) 0.0246(5) 0.0232(5) 0.0243(4) Atom U11 U22 U33 U12 U13 U23 V1 V2 ZN1 ZN2 ZN3 0.019(1) 0.019(1) 0.019(1) 0.018(1) 0.023(1) 0.019(1) 0.019(1) 0.019(1) 0.018(1) 0.017(1) 0.029(2) 0.030(2) 0.034(1) 0.032(1) 0.030(1) 0.009(6) 0.0099(6) 0.0096(4) 0.0091(4) 0.0088(3) 0 0 -0.0025(3) 0 0.0005(3) 0 0 -0.005(1) 0 0.0011(5) 233 8. Anhang ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Tab. 8.8: Abstände (in Å) und Winkel (in°) in V(Zn,Ga)6 V1 - Zn1 Zn1 Zn1 Zn1 Zn1 Zn1 Zn3 Zn3 Zn3 Zn3 Zn3 Zn3 2.707(4) 2.707(4) 2.707(4) 2.707(4) 2.707(4) 2.707(4) 2.723(2) 2.723(2) 2.723(2) 2.723(2) 2.723(2) 2.723(2) 180.00 60.00 120.00 60.00 120.00 119.69(2) 60.31(2) 90.00 90.00 60.31(2) 119.69(2) 120.00 60.00 120.00 60.00 60.31(2) 119.69(2) 90.00 90.00 119.69(2) 60.31(2) 60.00 120.00 180.00 119.69(2) 60.31(2) 60.31(2) 119.69(2) 90.00 90.00 180.00 120.00 90.00 90.00 60.31(2) 119.69(2) 119.69(2) 60.31(2) 60.00 90.00 90.00 119.69(2) 60.31(2) 60.31(2) 119.69(2) 60.31(2) 119.69(2) 119.69(2) 60.31(2) 90.00 90.00 180.00(6) 59.38(5) 120.62(5) 59.38(5) 120.62(5) V2 - Zn2 Zn2 Zn2 Zn2 Zn2 Zn2 Zn3 Zn3 Zn3 Zn3 Zn3 Zn3 2.7076(4) 2.7076(4) 2.7076(4) 2.7076(4) 2.7076(4) 2.7076(4) 2.7239(2) 2.7239(2) 2.7239(2) 2.7239(2) 2.7239(2) 2.7238(2) 120.00 120.00(0) 62.41(8) 57.59(8) 177.59(8) 89.31(2) 60.50(3) 60.50(3) 120.30(3) 120.30(3) 89.31(2) 120.00 57.59(8) 177.59(8) 62.41(8) 120.30(3) 89.31(2) 89.31(2) 60.50(3) 60.50(3) 120.30(3) 177.59(8) 62.41(8) 57.59(8) 60.50(3) 120.30(3) 120.30(3) 89.31(2) 89.31(2) 60.50(3) 120.00 120.00 120.30(3) 60.50(3) 60.50(3) 89.31(2) 89.31(2) 120.30(3) 120.00(0) 60.50(3) 89.31(2) 89.31(2) 120.30(3) 120.30(3) 60.50(3) 89.31(2) 120.30(3) 120.30(3) 60.50(3) 60.50(3) 89.31(2) 146.54(2) 59.81(5) 146.54(2) 59.81(5) 109.71(6) Zn1 - Zn1 Zn1 Zn1 V1 V1 Zn1 Zn3 Zn3 Zn3 Zn3 2.7070(4) 2.7070(4) 2.7070(4) 2.7070(4) 2.7070(4) 2.7070(4) 2.7282(3) 2.7282(3) 2.7282(3) 2.7282(3) 180.00 60.00 60.00 120.00 120.00 60.26(2) 119.74(2) 90.09(2) 89.91(2) 120.00 120.00 60.00 60.00 119.74(2) 60.26(2) 89.91(2) 90.09(2) 120.00 60.00 180.00 90.09(2) 89.91(2) 60.26(2) 119.74(2) 180.00 60.00 60.15(3) 119.85(3) 119.85(3) 60.15(3) 120.00 119.85(3) 60.15(3) 60.15(3) 119.85(3) 89.91(2) 90.09(2) 119.74(2) 60.26(2) 180.00(4) 59.70(5) 120.30(5) Zn2 - Zn2 Zn2 V2 V2 Zn3 Zn3 Zn3 Zn3 Zn2 Zn2 2.6085(3) 2.6085(3) 2.7076(4) 2.7076(4) 2.7363(4) 2.7363(4) 2.7363(4) 2.7363(4) 2.8055(3) 2.8055(3) 60.00 61.20(4) 121.20(4) 120.84(3) 91.13(4) 91.12(4) 120.84(3) 180.00(8) 120.00 121.20(4) 61.20(4) 91.13(4) 120.84(3) 120.84(3) 91.12(4) 120.00 180.00 177.59(8) 119.11(3) 60.04(3) 60.04(3) 119.11(3) 118.80(4) 58.80(4) 60.04(3) 119.11(4) 119.11(4) 60.04(3) 58.80(4) 118.80(4) 59.08(6) 144.21(8) 108.97(5) 59.16(4) 88.88(4) 108.97(5) 144.21(8) 88.88(4) 59.16(3) 59.08(6) 88.88(4) 59.16(3) 234 8. Anhang ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Zn3 - Zn3 Zn3 Zn3 Zn3 V2 V1 Zn1 Zn1 Zn2 Zn2 2.6981(3) 2.6981(2) 2.7159(3) 2.7159(2) 2.7239(4) 2.7238(4) 2.7282(3) 2.7282(3) 2.7363(4) 2.7363(4) 60.00 180.00(3) 120.00 119.90(2) 60.31(2) 90.09(2) 119.85(3) 91.13(4) 60.46(3) 120.00 180.00(5) 119.90(2) 60.31(2) 119.85(3) 90.09(2) 60.46(3) 91.13(4) 60.00 60.10(2) 119.69(2) 89.91(2) 60.15(3) 88.88(4) 119.54(3) 60.10(2) 119.69(2) 60.15(3) 89.91(2) 119.54(3) 88.88(4) 179.74(6) 120.24(4) 120.24(4) 59.45(3) 59.45(3) 59.54(3) 59.54(3) 120.76(4) 120.76(4) 59.49(3) 178.69(5) 119.41(3) 235 8. Anhang ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Tab. 8.9: Angaben zur Strukturbestimmung von V7Ga12Zn39 Rel. Molmasse Kristallsystem Raumgruppe Zellabmessungen 3743.04 g/mol kubisch F m –3 c (Nr. 226) a = 24.857(3) Å Zellvolumen Anzahl der Formeleinheiten Röntgendichte Messtemperatur Diffraktometer Röntgenstrahlung V = 15357.85 Å3 16 6.475 g/cm3 20°C STOE IPDS Mo Kα1 Graphit-Monochromator 27248 h, k, l ±28; ±30; ±30 52° 100 Platten à 6 min bei 2° ϕ-Inkrement I / σ(I)-Verhältnis 6.0 29393 2973 693 693 430 Würfel 0.15 * 0.15 * 0.15 mm3 numerisch; Equivalent-Methode 0.3155 (0.0770) 33.67 mm-1 0,00001 + 2.69; -2.11 (0.41) e/ Å3 1 / [σ2 * F02 + (0,1058 * P) 2] mit P = (F02 + 2 * Fc2) / 3 54 R1(F) = 0.0615; wR2(I) = 0.1621 F ( 0 0 0) Messbereich max. 2θ Mess- / Scanmodus Messwerte davon unbeobachtet unabhängige Reflexe davon mit I > 0 davon mit I > 2σ(I) Kristallform Kristallabmessungen Absorptionskorrektur Interner Standard Schwächungskoeffizient Extinktionskoeffizient (SHELX97) Restelektronendichte Wichtungsfunktion Zahl der Parameter R- Werte 236 8. Anhang ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Tab. 8.10: Ortskoordinaten und Auslenkungsparameter in V7Ga12Zn39 Atom Wyck. Symm. Occ. x y z Ueq V1 V2 V3 Ga1 Zn1 Zn2 Zn3 Zn4 Zn5 Zn6 1.01 0.97 1.01 0.94 0.95 0.99 0.96 1.01 0.97 0.90 0 1/4 0.1779(2) 0.2948(1) 0.3202(2) 0.0895(1) 0.1502(1) 0.2220(1) 1/4 1/4 0 1/4 0.1112(2) 0.0832(1) 0 0.0576(1) 0.0611(1) 0 0.0604(1) 0.1725(1) 0 1/4 0 0.1683(1) 0 0 0.0956(1) 0.1573(1) 0.0604(1) 0.1725(1) 0.026(3) 0.024(3) 0.026(1) 0.0329(7) 0.028(1) 0.0241(7) 0.0269(6) 0.0344(8) 0.0237(7) 0.038(1) 8b 8a 96i 192j 48e 96i 192j 96i 96h 96h m-3. 432 m.. 1 mm2.. m.. 1 m.. ..2 ..2 Atom U11 U22 U33 U12 U13 U23 V1 V2 V3 Ga1 Zn1 Zn2 Zn3 Zn4 Zn5 Zn6 0.026(3) 0.024(3) 0.023(2) 0.034(1) 0.027(2) 0.024(2) 0.024(1) 0.028(2) 0.019(1) 0.045(2) 0.026(3) 0.024(3) 0.027(2) 0.028(1) 0.032(2) 0.025(2) 0.031(1) 0.038(2) 0.026(1) 0.035(1) 0.026(3) 0.024(3) 0.028(2) 0.036(1) 0.023(2) 0.023(2) 0.025(1) 0.037(2) 0.026(1) 0.035(1) 0 0 -0.0003(2) 0.005(1) 0 -0.001(1) -0.0001(9) 0 0.0016(9) 0.0129(1) 0 0 0 -0.002(1) 0 0 0.0019(9) 0.002(1) -0.0016(9) -0.013(1) 0 0 0 -0.0071(9) 0 0 0.0051(9) 0 0.003(1) -0.019(2) 237 8. Anhang ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Tab. 8.11: Abstände (in Å) und Winkel (in°) in V7Ga12Zn39 V1 - Zn2 Zn2 Zn2 Zn2 Zn2 Zn2 Zn2 Zn2 Zn2 Zn2 Zn2 Zn2 2.646(3) 2.646(3) 2.646(3) 2.646(3) 2.646(3) 2.646(3) 2.646(3) 2.646(3) 2.646(3) 2.646(3) 2.646(3) 2.646(3) 180.00(13) 62.94(3) 62.94(3) 117.06(3) 117.06(3) 114.50(13) 117.06(3) 62.94(3) 62.94(3) 117.06(3) 65.50(13) 117.06(3) 117.06(3) 62.94(3) 62.94(3) 65.50(13) 62.94(3) 117.06(3) 117.06(3) 62.94(3) 114.50(13) 62.94(3) 117.06(3) 180.00(13) 62.94(3) 62.94(3) 117.06(3) 65.50(13) 114.50(13) 117.06(3) 180.00(13) 117.06(3) 117.06(3) 65.50(13) 114.50(13) 117.06(3) 62.94(3) 62.94(3) 62.94(3) 62.94(3) 114.50(13) 65.50(13) 62.94(3) 117.06(3) 117.06(3) 117.06(3) 117.06(3) 62.94(3) 114.50(13) 65.50(13) 62.94(3) 62.94(3) 117.06(3) 62.94(3) 117.06(3) 180.00(13) V2 - Zn6 2.723(4) Zn6 2.723(4) Zn6 2.723(4) Zn6 2.723(4) Zn6 2.723(4) Zn6 2.723(4) Zn6 2.723(4) Zn6 2.723(4) Zn6 2.723(4) Zn6 2.723(4) Zn6 2.723(4) Zn6 2.723(4) 180.00 60.00 120.00 60.00 120.00 120.00 60.00 120.00 60.00 90.00 90.00 120.00 60.00 120.00 60.00 60.00 120.00 60.00 120.00 90.00 90.00 180.00 60.00 120.00 90.00 90.00 60.00 120.00 60.00 120.00 120.00 60.00 90.00 90.00 120.00 60.00 120.00 60.00 180.00 60.00 120.00 90.00 90.00 120.00 60.00 120.00 60.00 90.00 90.00 60.00 120.00 180.00 60.00 120.00 120.00 60.00 V3 - Zn2 Ga Ga Zn5 Zn5 Zn3 Zn3 Zn4 Zn1 Zn3 Zn3 Zn4 2.568(5) 2.602(4) 2.602(4) 2.657(4) 2.657(4) 2.724(4) 2.724(4) 2.738(6) 2.765(4) 2.770(3) 2.770(3) 2.801(5) 120.41(12) 120.41(12) 109.24(14) 109.24(14) 62.81(12) 62.81(12) 173.43(21) 59.73(15) 63.52(10) 63.52(10) 110.73(19) 105.66(19) 68.48(10) 122.18(17) 116.55(17) 63.80(9) 62.28(11) 122.69(11) 68.06(7) 173.48(17) 60.81(10) 122.18(17) 68.48(10) 63.80(9) 116.55(17) 62.28(11) 122.69(11) 173.48(17) 68.06(7) 60.81(10) 68.72(14) 171.81(19) 111.13(7) 65.55(11) 60.82(12) 57.96(7) 115.97(17) 126.24(15) 111.13(7) 171.81(19) 65.55(11) 60.82(12) 115.97(17) 57.96(7) 126.24(15) 67.78(15) 122.23(15) 111.60(16) 116.84(17) 59.65(11) 60.90(11) 122.23(15) 111.60(16) 59.65(11) 116.84(17) 60.90(11) Ga - Zn6 V3 Zn4 Zn4 Zn3 Zn5 Zn3 Zn6 Ga Ga Ga Ga 2.480(3) 2.602(3) 2.740(3) 2.764(3) 2.816(3) 2.959(3) 3.009(3) 3.113(3) 3.275(3) 3.275(3) 3.720(5) 3.803(4) 148.42(14) 148.21(12) 112.38(10) 128.05(11) 92.47(10) 98.73(9) 56.93(12) 94.87(7) 63.75(6) 41.41(8) 81.47(6) 63.18(11) 61.28(12) 60.21(11) 56.65(11) 58.63(10) 148.63(14) 116.70(11) 113.82(12) 107.41(10) 111.43(11) 76.42(12) 60.52(9) 117.32(10) 108.05(11) 96.09(10) 53.82(8) 106.31(8) 164.93(11) 87.43(10) 117.98(10) 61.27(8) 106.60(11) 140.25(11) 106.16(8) 53.14(8) 88.75(10) 163.84(12) 100.41(9) 55.84(10) 89.51(9) 83.21(10) 166.73(8) 126.83(12) 51.50(7) 52.31(6) 145.83(10) 167.23(6) 83.90(9) 51.06(6) 128.74(7) 112.76(9) 136.18(11) 133.24(11) 73.35(8) 78.22(6) 238 8. Anhang ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Zn1 - Zn2 Zn2 Zn5 Zn5 Zn5 Zn5 V3 V3 Zn3 Zn3 Zn3 Zn3 2.661(5) 2.661(5) 2.746(4) 2.746(4) 2.746(4) 2.746(4) 2.765(4) 2.765(4) 2.915(3) 2.915(3) 2.915(3) 2.915(3) 65.08(17) 146.02(7) 103.99(7) 103.99(7) 146.02(7) 56.47(12) 121.54(19) 93.85(12) 60.44(7) 60.44(7) 93.85(12) 103.99(7) 146.02(7) 146.02(7) 103.99(7) 121.54(19) 56.47(12) 60.44(7) 93.85(12) 93.85(12) 60.44(7) 101.13(17) 66.20(9) 66.20(9) 123.85(13) 57.66(8) 55.30(6) 152.92(16) 89.99(6) 108.74(6) 66.20(9) 66.20(9) 57.66(8) 123.85(13) 152.92(16) 55.30(6) 108.74(6) 89.99(6) 101.13(17) 57.66(8) 123.85(13) 89.99(6) 108.74(6) 55.30(6) 152.92(16) 123.85(13) 57.66(8) 108.74(6) 89.99(6) 152.92(16) 55.30(6) 178.01(26) 121.10(6) 58.31(5) 58.31(5) 121.10(6) Zn2 - V3 V1 Zn1 Zn3 Zn3 Zn2 Zn2 Zn2 Zn2 Zn3 Zn3 Zn2 2.568(5) 2.646(3) 2.661(5) 2.761(3) 2.761(3) 2.762(3) 2.762(3) 2.762(3) 2.762(3) 2.815(3) 2.815(3) 2.863(6) 178.52(16) 63.81(13) 61.36(11) 61.36(11) 120.97(7) 122.64(12) 122.64(12) 120.97(7) 61.73(7) 61.73(7) 121.27(12) 114.71(12) 119.79(10) 119.79(10) 58.53(01) 58.53(1) 58.53(1) 58.53(1) 117.84(7) 117.84(7) 57.25(6) 113.70(11) 113.70(11) 87.92(13) 146.48(11) 146.48(11) 87.92(13) 64.25(7) 64.25(7) 57.46(8) 66.76(12) 152.96(14) 95.14(15) 61.29(9) 90.25(7) 58.69(10) 114.15(11) 146.44(6) 90.25(7) 61.29(9) 95.14(15) 152.96(14) 114.15(11) 58.69(10) 146.44(6) 60.00 109.56(9) 107.33(5) 148.21(16) 59.33(8) 58.79(8) 62.41(15) 109.56(9) 149.26(16) 89.13(6) 106.70(8) Zn3 - Zn5 V3 Zn3 Zn3 Zn2 V3 Zn4 Zn2 Ga Zn1 Ga Zn3 2.632(2) 2.724(4) 2.733(4) 2.733(4) 2.761(3) 2.770(3) 2.801(4) 2.815(3) 2.816(3) 2.915(3) 3.009(3) 3.038(5) 125.50(12) 158.58(8) 111.65(11) 139.76(12) 58.87(10) 64.98(9) 102.89(10) 99.97(10) 59.09(11) 62.87(8) 89.58(6) 61.01(11) 120.72(12) 55.84(11) 169.33(18) 60.90(11) 115.21(13) 55.99(9) 114.26(10) 136.93(12) 56.11(7) 60.00 61.65(8) 119.06(12) 114.54(12) 89.72(7) 65.66(8) 140.57(10) 98.09(7) 108.29(6) 90.86(6) 59.34(12) 157.97(6) 59.66(8) 102.91(7) 106.94(10) 58.51(7) 144.07(1) 114.05(13) 105.25(9) 59.38(12) 107.12(11) 83.07(11) 149.36(10) 56.62(6) 123.68(14) 54.75(11) 134.57(12) 58.13(9) 53.32(9) 116.72(9) 141.83(12) 58.38(8) 90.12(11) 104.17(9) 57.16(6) Zn4 - V3 Ga Ga Ga Ga V3 Zn3 Zn3 Zn5 Zn5 2.738(6) 2.740(3) 2.740(3) 2.764(3) 2.764(3) 2.801(5) 2.801(4) 2.801(4) 2.921(3) 2.921(3) 128.68(8) 128.68(8) 56.44(9) 56.44(9) 165.84(18) 110.54(13) 110.54(13) 55.90(9) 55.90(9) 98.35(14) 147.52(16) 73.04(9) 56.00(8) 109.72(13) 61.09(8) 149.70(14) 94.96(8) 73.04(9) 147.52(16) 56.00(8) 61.09(8) 109.72(13) 94.96(8) 149.70(14) 97.20(14) 128.67(8) 93.68(8) 151.38(14) 62.66(8) 108.12(12) 128.67(8) 151.38(14) 93.68(8) 108.12(12) 62.66(8) 58.20(10) 58.20(10) 65.69(12) 112.62(12) 54.71(7) 112.62(12) 88.81(12) 239 8. Anhang ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Zn5 - Zn3 Zn3 V3 V3 Zn1 Zn1 Zn4 Zn4 Ga Ga Zn5 Zn5 2.632(2) 2.632(2) 2.657(4) 2.657(4) 2.746(4) 2.746(4) 2.921(3) 2.921(3) 2.959(3) 2.959(3) 3.000(4) 3.000(4) 152.14(16) 118.79(10) 63.17(8) 141.70(13) 65.61(9) 112.92(9) 60.31(8) 64.82(8) 92.92(10) 109.46(6) 90.42(6) 63.17(8) 118.79(10) 65.61(9) 141.70(13) 60.31(8) 112.92(9) 92.92(9) 64.82(8) 90.42(6) 109.46(6) 172.82(18) 61.52(10) 112.34(10) 123.31(10) 58.56(11) 132.28(12) 54.87(9) 118.42(10) 55.64(7) 112.34(10) 61.52(10) 58.56(11) 123.31(10) 54.87(9) 132.28(12) 55.64(7) 118.42(10) 78.87(17) 91.08(7) 108.73(6) 147.08(6) 111.23(8) 56.90(4) 56.90(4) 108.73(6) 91.08(7) 111.23(8) 147.08(6) 56.90(4) 56.90(4) 154.58(13) 56.06(8) 102.48(9) 59.11(6) 145.54(7) Zn6 - Ga Ga Zn6 Zn6 V2 Zn6 Zn6 Ga Ga 2.480(3) 2.480(3) 2.724(4) 2.724(3) 2.724(4) 2.724(3) 2.724(3) 3.114(3) 3.114(3) 97.18(16) 161.51(6) 110.32(6) 131.41(8) 108.31(6) 73.33(8) 84.86(12) 70.66(10) 73.33(8) 108.31(6) 131.41(8) 110.32(6) 161.51(6) 70.66(10) 84.86(12) 60.00 60.00 90.00 120.00 106.06(5) 92.38(5) 60.00 120.00 90.00 164.66(6) 49.74(7) 60.00 60.00 108.55(7) 108.55(7) 60.00 49.74(7) 164.66(6) 92.38(5) 106.06(5) 240 8. Anhang ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Tab. 8.12: Angaben zur Strukturbestimmung von Mo7Ga26Zn26 Rel. Molmasse Kristallsystem Raumgruppe Zellabmessungen 3743.04 g/mol kubisch F m –3 c (Nr. 226) a = 24.816(2) Å Zellvolumen Anzahl der Formeleinheiten Röntgendichte Messtemperatur Diffraktometer Röntgenstrahlung V = 15282.72 Å3 16 8.108 g/cm3 20°C STOE IPDS II Mo Kα1 Graphit-Monochromator 33440 h, k, l ±28; ±30; ±30 52° 100 Platten à 6 min bei 2° ϕ-Inkrement I / σ(I)-Verhältnis 6.0 2141 529 612 612 430 Würfel 0.15 * 0.15 * 0.15 mm3 numerisch; Equivalent-Methode 0.0010 (0.1090) 37.69 mm-1 0,00001 + 0.61; -0.90 (0.11) e/ Å3 1 / [σ2 * F02 + (0,0001 * P) 2] mit P = (F02 + 2 * Fc2) / 3 55 R1(F) = 0.0145; wR2(I) = 0.0177 F ( 0 0 0) Messbereich max. 2θ Mess- / Scanmodus Messwerte davon unbeobachtet unabhängige Reflexe davon mit I > 0 davon mit I > 2σ(I) Kristallform Kristallabmessungen Absorptionskorrektur Interner Standard Schwächungskoeffizient Extinktionskoeffizient (SHELX97) Restelektronendichte Wichtungsfunktion Zahl der Parameter R- Werte 241 8. Anhang ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Tab. 8.13: Ortskoordinaten und Auslenkungsparameter in Mo7Ga26Zn26 Atom Wyck. Symm. x y z Ueq Mo1 Mo2 Mo3 Zn1 Zn2 Zn3 Zn4 Zn5 Zn6 Zn7 * Zn8 8a 96i 8b 96i 192j 48e 96h 96i 192j 48f 64g 432 m.. m-3. m.. 1 mm2.. ..2 m.. 1 4.. .3. 1/4 0.17781(3) 0 0.15720(5) 0.20623(3) 0.18022(6) 1/4 0.08928(4) 0.14967(3) 1/4 0.18675(3) 1/4 0.38781(3) 1/2 0.27919(4) 0.33566(3) 1/2 0.43988(3) 0.44296(4) 0.43960(3) 1/4 0.31325(3) 1/4 0 0 0 0.08636(3) 0 -0.06012(3) 0 -0.09450(3) 0.12877(7) 0.18675(3) 0.0069(6) 0.0081(2 0.0076(5) 0.0170(3) 0.0181(2) 0.0140(3) 0.0124(2) 0.0104(2) 0.0141(2) 0.0150(7) 0.0181(3) * 10 % Unterbesetzung für alle Zn-Lagen wird eine Mischbesetzung Zn : Ga im Verhältnis 1 : 1 angenommen 242 Atom U11 U22 U33 U12 U13 U23 Mo1 Mo2 Mo3 Zn1 Zn2 Zn3 Zn4 Zn5 Zn6 Zn7 Zn8 0.0069(6) 0.0071(4) 0.0076(5) 0.0195(6) 0.0206(5) 0.0120(8) 0.0083(5) 0.0075(5) 0.0115(4) 0.0147(8) 0.0182(3) 0.0069(6) 0.0079(3) 0.0076(5) 0.0087(6) 0.0217(4) 0.0107(9) 0.0145(3) 0.0110(5) 0.0184(4) 0.0147(8) 0.0182(3) 0.0069(6) 0.0094(4) 0.0076(5) 0.0230(6) 0.0123(4) 0.0194(1) 0.0145(3) 0.0129(5) 0.0124(4) 0.0157(1) 0.0182(3) 0 -0.0004(3) 0 -0.0010(5) 0.0044(3) 0 -0.0013(4) 0.0019(5) -0.0005(3) 0.00000 0.0043(3) 0 0 0 0.00000 -0.0017(4) 0 0.0013(4) 0.00000 -0.0013(3) 0.00000 -0.0043(3) 0 0 0 0.00000 0.0073(4) 0 0.0019(4) 0.00000 0.0038(3) 0.00000 0.0043(3) 8. Anhang ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Tab. 8.14: Abstände (in Å) und Winkel (in°) in Mo7Ga26Zn26 Mo1 - Zn8 Zn8 Zn8 Zn8 Zn8 Zn8 Zn8 Zn8 Zn7 Zn7 Zn7 Zn7 2.719(1) 2.719(1) 2.719(1) 2.719(1) 2.719(1) 2.719(1) 2.719(1) 2.719(1) 3.008(2) 3.008(2) 3.008(2) 3.008(2) 180.00 109.47 70.53 109.47 109.47 70.53 70.53 125.26 54.74 125.26 54.74 70.53 109.47 70.53 70.53 109.47 109.47 54.74 125.26 54.74 125.26 70.53 109.47 109.47 180.00 70.53 54.74 125.26 54.74 125.26 180.00 70.53 109.47 109.47 54.74 125.26 125.26 54.74 109.47 70.53 70.53 125.26 54.74 54.74 125.26 70.53 180.00 109.47 54.74 125.26 125.26 54.74 125.26 125.26 54.74 54.74 Mo2 - Zn5 Zn2 Zn2 Zn4 Zn4 Zn6 Zn6 Zn1 Zn1 Zn6 Zn6 Zn3 2.588(1) 2.601(1) 2.601(1) 2.666(1) 2.666(1) 2.718(1) 2.718(1) 2.744(1) 2.753(1) 2.764(1) 2.764(1) 2.785(1) 119.55(3) 119.55(3) 108.30(3) 108.30(3) 62.31(3) 62.31(3) 111.18(4) 172.01(5) 62.59(2) 62.59(2) 59.31(5) 110.97(5) 121.34(4) 66.28(3) 65.27(3) 119.37(4) 64.01(3) 63.28(3) 66.47(3) 177.44(4) 119.44(3) 66.28(3) 121.34(4) 119.37(4) 65.27(3) 64.01(3) 63.28(3) 177.44(4) 66.47(3) 119.44(3) 68.07(4) 170.36(4) 111.63(2) 126.98(3) 65.32(3) 114.78(4) 57.95(2) 60.05(3) 111.63(2) 170.36(4) 126.98(3) 65.32(3) 57.96(2) 114.78(4) 60.05(3) 66.94(4) 61.44(3) 123.81(3) 59.94(3) 115.78(4) 111.01(4) 61.44(3) 123.81(3) 115.78(4) 59.94(3) 111.01(4) Mo3 - Zn5 Zn5 Zn5 Zn5 Zn5 Zn5 Zn5 Zn5 Zn5 Zn5 Zn5 Zn5 2.629(1) 2.629(1) 2.629(1) 2.629(1) 2.629(1) 2.629(1) 2.629(1) 2.629(1) 2.629(1) 2.629(1) 2.629(1) 2.629(1) 63.02(1) 65.15(5) 63.02(1) 180.00(3) 116.98(1) 63.02(1) 116.98(1) 63.02(1) 114.85(5) 116.98(1) 116.98(1) 116.98(1) 65.15(5) 116.98(1) 180.00(4) 63.02(1) 114.85(5) 116.98(1) 63.02(1) 116.98(1) 63.02(1) 116.98(1) 114.85(5) 63.02(1) 63.02(1) 63.02(1) 63.02(1) 180.00 116.98(1) 116.98(1) 116.98(1) 114.85(5) 116.98(1) 180.00 63.02(1) 63.02(1) 63.02(1) 116.98(1) 63.02(1) 116.98(1) 63.02(1) 116.98(1) 65.15(5) 63.02(1) 63.02(1) 116.98(1) 65.15(5) 63.02(1) 116.98(1) 63.02(1) 116.98(1) 63.02(1) 114.85(5) 116.98(1) 180.00(5) 65.15(5) Zn3 - Zn5 Zn5 Zn4 Zn4 Zn4 Zn4 Mo2 Mo2 Zn6 Zn6 Zn6 Zn6 2.664(1) 2.664(1) 2.730(1) 2.730(1) 2.730(1) 2.730(1) 2.785(1) 2.785(1) 2.885(1) 2.885(1) 2.885(1) 2.885(1) 64.19(6) 145.88(2) 104.30(2) 145.88(2) 104.30(2) 56.67(3) 120.86(6) 93.06(4) 60.08(3) 93.06(4) 60.08(3) 104.30(2) 145.88(2) 104.30(2) 145.88(2) 120.86(6) 56.67(3) 60.08(3) 93.06(4) 60.08(3) 93.06(4) 101.24(5) 66.27(3) 66.27(3) 124.06(4) 57.80(2) 109.09(2) 153.52(5) 55.83(2) 90.36(2) 66.27(3) 66.27(3) 57.80(2) 124.06(4) 90.36(2) 55.83(2) 153.52(5) 109.09(2) 101.25(5) 124.06(4) 57.80(2) 55.83(2) 90.36(2) 109.09(2) 153.52(5) 57.80(2) 124.06(4) 153.52(5) 109.09(2) 90.36(2) 55.83(2) 177.53(8) 120.92(2) 58.32(2) 120.92(2) 58.32(2) 243 8. Anhang ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Zn4 - Zn6 Zn6 Mo2 Mo2 Zn3 Zn3 Zn2 Zn2 Zn1 Zn1 Zn4 Zn4 2.632(1) 2.632(1) 2.666(1) 2.666(1) 2.730(1) 2.730(1) 2.880(1) 2.880(1) 2.925(1) 2.925(1) 2.984(1) 2.984(1) 153.28(5) 118.69(3) 62.89(2) 141.15(4) 65.07(3) 93.73(3) 64.37(3) 60.00(3) 113.42(3) 90.15(2) 108.92(2) 62.89(2) 118.69(3) 65.07(3) 141.15(4) 64.37(3) 93.73(3) 113.42(3) 60.00(3) 108.92(2) 90.15(2) 173.93(5) 62.14(2) 112.67(3) 55.78(2) 130.28(4) 58.78(3) 122.81(3) 55.97(2) 119.00(2) 112.67(3) 62.14(2) 130.28(4) 55.78(2) 122.81(3) 58.78(3) 119.00(2) 55.97(2) 78.75(5) 112.04(3) 148.63(2) 109.18(2) 90.82(2) 56.87(1) 56.87(1) 148.63(2) 112.04(3) 90.82(2) 109.18(2) 56.87(1) 56.87(1) 74.70(4) 57.93(3) 100.28(3) 103.07(2) 153.91(2) Zn5 - Mo2 Mo3 Zn3 Zn6 Zn6 Zn5 Zn5 Zn5 Zn5 Zn6 Zn6 Zn5 2.588(1) 2.629(1) 2.664(2) 2.747(1) 2.747(1) 2.748(1) 2.748(1) 2.748(1) 2.748(1) 2.784(1) 2.784(1) 2.831(2) 179.35(5) 64.02(4) 61.15(3) 61.15(3) 122.03(4) 121.30(2) 121.30(2) 122.03(4) 61.79(3) 61.79(3) 121.92(3) 115.33(4) 119.36(4) 119.36(4) 58.49(1) 58.49(1) 58.49(1) 58.49(1) 118.02(3) 118.02(3) 57.43(2) 113.87(4) 113.87(4) 146.89(4) 88.45(5) 88.45(5) 146.89(4) 63.89(3) 63.89(3) 57.90(3) 66.12(4) 60.88(4) 90.28(3) 152.19(5) 94.32(6) 59.34(4) 114.15(4) 146.80(2) 94.32(6) 152.19(5) 90.28(3) 60.88(4) 114.15(4) 59.34(4) 146.80(2) 60.00 109.30(4) 62.00(6) 89.51(2) 149.21(6) 106.93(3) 107.45(2) 109.30(4) 59.54(3) 148.33(6) 59.00(3) Zn6 - Zn4 Mo2 Zn6 Zn6 Zn5 Mo2 Zn5 Zn1 Zn2 Zn3 Zn2 Zn6 2.632(1) 2.718(1) 2.739(1) 2.739(1) 2.747(1) 2.764(1) 2.784(1) 2.790(1) 2.870(1) 2.885(1) 2.943(1) 2.998(1) 124.67(3) 158.16(3) 112.02(4) 140.79(4) 59.15(2) 103.66(3) 65.22(3) 101.18(3) 59.10(4) 61.90(3) 89.85(2) 60.87(4) 120.67(4) 56.54(3) 171.26(4) 116.10(4) 59.74(3) 55.41(2) 114.95(3) 134.32(4) 56.53(2) 60.00 61.00(3) 119.00(4) 89.71(3) 113.52(5) 63.26(3) 141.23(3) 98.58(2) 108.00(2) 90.48(2) 59.19(4) 59.66(4) 157.42(2) 100.39(2) 107.49(4) 60.54(3) 144.00(1) 115.16(4) 59.57(4) 105.23(3) 105.91(4) 84.15(4) 150.90(3) 56.94(2) 55.62(3) 124.28(4) 133.10(4) 59.04(2) 54.11(3) 117.72(2) 142.58(5) 152.71(4) 56.03(4) 103.01(4) 88.29(3) Zn7 - Zn2 Zn2 Zn2 Zn2 Zn8 Zn8 Zn8 Zn8 Mo1 2.609(1) 2.609(1) 2.609(1) 2.609(1) 2.645(1) 2.645(1) 2.645(1) 2.645(1) 3.008(2) 132.42(8) 80.63(3) 80.63(3) 161.79(4) 59.26(3) 117.12(2) 89.03(2) 113.79(4) 80.63(3) 80.63(3) 59.26(3) 161.79(4) 89.03(2) 117.12(2) 113.79(4) 132.42(8) 117.12(2) 89.03(2) 59.26(3) 161.79(4) 113.79(4) 89.03(2) 117.12(2) 161.79(4) 59.26(3) 113.79(4) 114.10(8) 72.79(4) 72.79(4) 57.05(4) 72.79(4) 72.79(4) 57.05(4) 114.10(8) 57.05(4) 244 8. Anhang ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Zn8 - Zn2 Zn2 Zn2 Zn7 Zn7 Zn7 Mo1 Zn8 Zn8 Zn8 2.598(1) 2.598(1) 2.598(1) 2.645(1) 2.645(1) 2.645(1) 2.719(1) 3.139(1) 3.139(1) 3.139(1) 90.74(4) 90.74(4) 142.86(3) 110.01(2) 59.67(3) 124.74(3) 79.28(2) 163.52(2) 102.36(2) 90.74(4) 110.01(2) 59.67(3) 142.86(3) 124.74(3) 102.36(2) 79.28(2) 163.52(2) 59.67(3) 142.86(3) 110.01(2) 124.74(3) 163.52(2) 102.36(2) 79.28(2) 107.06(4) 107.06(4) 68.22(4) 122.95(4) 53.60(2) 53.60(2) 107.06(4) 68.22(4) 53.60(2) 53.60(2) 122.95(4) 68.22(4) 53.60(2) 122.95(4) 53.60(2) 54.74 54.74 54.74 Zn2 - Zn8 Mo2 Zn7 Zn1 Zn1 Zn6 Zn4 Zn6 2.598(1) 2.601(1) 2.609(1) 2.811(1) 2.835(1) 2.870(1) 2.880(1) 2.943(1) 147.80(4) 61.06(4) 149.81(4) 122.63(3) 93.60(3) 118.64(3) 91.90(3) 148.29(5) 60.99(3) 60.44(3) 59.33(3) 57.94(2) 59.42(3) 95.21(4) 94.64(4) 126.60(3) 131.76(3) 152.24(5) 74.41(4) 116.30(3) 61.84(3) 107.71(4) 58.55(3) 115.78(3) 106.29(4) 101.52(3) 56.19(3) 53.72(2) Zn1 - Mo2 Mo2 Zn6 Zn6 Zn2 Zn2 Zn2 Zn2 Zn4 Zn4 2.744(1) 2.753(1) 2.790(1) 2.790(1) 2.811(1) 2.811(1) 2.835(1) 2.835(1) 2.925(1) 2.925(1) 166.80(6) 58.82(3) 58.82(3) 128.39(3) 128.39(3) 55.55(3) 55.55(3) 113.38(4) 113.38(4) 110.61(5) 110.61(5) 55.73(3) 55.73(3) 128.75(3) 128.75(3) 55.91(3) 55.91(3) 64.99(4) 91.90(3) 148.45(5) 109.43(4) 61.34(3) 54.78(2) 88.36(4) 148.45(5) 91.90(3) 61.34(3) 109.43(4) 88.36(4) 54.78(2) 99.35(5) 150.19(6) 73.44(3) 60.23(3) 106.34(4) 73.44(3) 150.19(6) 106.34(4) 60.23(3) 98.22(5) 149.48(5) 95.18(2) 245 8. Anhang ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Tab. 8.15: Angaben zur Strukturbestimmung des triklinen Mo6Ga31 Rel. Molmasse Kristallsystem Raumgruppe Zellabmessungen Meßwerte davon unbeobachtet unabhängige Reflexe davon mit I > 0 davon mit I > 2σ(I) Kristallform Kristallabmessungen 443.26 g/mol hexagonal P 63/m m c (Nr. 194) a = 5.4140(8) Å c = 17.847(4) V = 453.03 Å3 4 6.498 g/cm3 20°C STOE IPDS Mo Kα1 Graphit-Monochromator 812 h, k, l ±6; ±6; ±21 52° 100 Platten à 2 min bei 2° ϕ-Inkrement I / σ(I)-Verhältnis 6.0 3199 15 205 205 131 hexagonales Prisma 0.1 * 0.1 * 0.02 mm3 Absorptionskorrektur numerisch; Equivalent-Methode Interner Standard Schwächungskoeffizient Extinktionskoeffizient (SHELX98) Restelektronendichte Wichtungsfunktion 0.1043 (0.0304) 32.99 mm-1 0,00045 + 0.92; -0.64 (0.31) e/ Å3 1 / [σ2 * F02 + (0,0296 * P) 2] mit P = (F02 + 2 * Fc2) / 3 20 R1(F) = 0.0252; wR2(I) = 0.0845 Zellvolumen Anzahl der Formeleinheiten Röntgendichte Meßtemperatur Diffraktometer Röntgenstrahlung F ( 0 0 0) Meßbereich max. 2θ Mess- / Scanmodus Zahl der Parameter R- Werte 246 8. Anhang ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Tab. 8.16: Ortskoordinaten und Auslenkungsparameter im triklinen Mo6Ga31 Atom Wyck. Symm. x y z Ueq Mo1 Mo2 Mo3 Mo4 Mo5 Mo6 Ga1 Ga2 Ga3 Ga4 Ga5 Ga6 Ga7 Ga8 Ga9 Ga10 Ga11 Ga12 Ga13 Ga14 Ga15 Ga16 Ga17 Ga18 Ga19 Ga20 Ga21 Ga22 Ga23 Ga24 Ga25 Ga26 Ga27 Ga28 Ga29 Ga30 Ga31 Ga32 Ga33 2i 2i 2i 2i 2i 2i 2i 1a 1g 1f 1e 2i 2i 2i 2i 2i 2i 2i 2i 2i 2i 2i 2i 2i 2i 2i 2i 2i 2i 2i 2i 2i 2i 2i 2i 2i 2i 2i 2i 1 1 1 1 1 1 1 -1 -1 -1 -1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 0.8427(2) 0.3283(2) 0.3932(2) 0.2689(2) 0.9083(2) 0.2071(2) 0.4719(3) 0 0 1/2 1/2 0.8175(3) 0.3133(3) 0.5305(3) 0.1076(3) 0.5980(3) 0.2700(3) 0.2373(3) 0.8794(3) 0.1399(3) 0.9582(3) 0.0398(3) 0.3317(3) 0.5648(3) 0.0472(3) 0.1528(3) 0.7908(3) 0.2161(3) 0.3953(3) 0.0382(3) 0.2380(3) 0.7319(3) 0.0788(3) 0.7813(3) 0.6278(3) 0.5206(3) 0.3404(3) 0.6964(3) 0.5648(3) 0.3025(2) 0.1849(2) 0.3053(2) 0.0626(2) 0.4256(2) -0.1713(2) 0.4359(3) 0 1/2 0 1/2 0.1111(3) 0.1603(3) 0.0700(3) 0.2795(3) 0.2098(3) 0.0742(3) 0.0175(3) 0.2696(3) 0.3448(3) 0.4354(3) 0.1501(3) 0.2016(3) 0.1057(3) 0.6292(3) -0.1671(3) 0.4031(3) 0.4396(3) 0.3264(3) 0.0909(3) 0.3417(3) 0.2767(3) 0.2151(3) 0.0488(3) 0.3986(3) 0.1785(3) 0.5679(3) 0.5462(3) 0.3021(3) 0.4718(1) 0.5921(1) 0.9278(1) 0.2544(1) 0.8088(1) 0.8728(1) 0.3320(2) 0 1/2 1/2 0 0.6081(2) 0.0828(2) 0.6722(2) 0.7068(2) 0.0211(2) 0.9162(2) 0.7381(2) 0.9623(2) 0.8821(2) 0.3263(2) 0.3631(2) 0.4034(2) 0.8532(2) 0.8586(2) 0.2127(2) 0.6464(2) 0.0497(2) 0.7349(2) 0.1749(2) 0.2427(2) 0.3098(2) 0.5356(2) 0.4369(2) 0.8251(2) 0.2157(2) 0.8524(2) 0.4561(3) 0.5195(3) 0.0163(3) 0.0163(3) 0.0170(3) 0.0178(4) 0.0176(4) 0.0205(4) 0.0285(7) 0.0350(9) 0.0281(8) 0.0268(8) 0.0252(7) 0.0256(5) 0.0243(5) 0.0261(5) 0.0261(6) 0.0249(5) 0.0278(6) 0.0255(5) 0.0271(6) 0.0274(6) 0.0261(5) 0.0267(6) 0.0314(6) 0.0256(6) 0.0256(5) 0.0261(6) 0.0323(6) 0.0255(6) 0.0321(6) 0.0269(6) 0.0276(6) 0.0345(7) 0.0263(6) 0.0260(5) 0.0284(6) 0.0314(6) 0.0315(6) 0.0466(9) 0.0492(4) 247 8. Anhang ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Tab. 8.17: Auslenkungsparameter im triklinen Mo5Ga31 Atom U11 U22 U33 U12 U13 U23 Mo1 Mo2 Mo3 Mo4 Mo5 Mo6 Ga1 Ga2 Ga3 Ga4 Ga5 Ga6 Ga7 Ga8 Ga9 Ga10 Ga11 Ga12 Ga13 Ga14 Ga15 Ga16 Ga17 Ga18 Ga19 Ga20 Ga21 Ga22 Ga23 Ga24 Ga25 Ga26 Ga27 Ga28 Ga29 Ga30 Ga31 Ga32 Ga33 0.012(7) 0.013(7) 0.012(7) 0.014(7) 0.016(7) 0.018(8) 0.023(1) 0.035(2) 0.032(2) 0.021(2) 0.021(2) 0.030(1) 0.024(1) 0.020(1) 0.022(1) 0.018(1) 0.029(1) 0.029(1) 0.023(1) 0.018(1) 0.026(1) 0.020(1) 0.029(1) 0.019(1) 0.020(1) 0.023(1) 0.039(2) 0.021(1) 0.029(1) 0.017(1) 0.028(1) 0.039(2) 0.019(1) 0.031(1) 0.017(1) 0.020(1) 0.034(1) 0.028(1) 0.016(1) 0.012(1) 0.014(1) 0.013(1) 0.014(1) 0.012(1) 0.017(1) 0.026(1) 0.025(2) 0.018(2) 0.025(2) 0.019(2) 0.020(1) 0.023(1) 0.026(1) 0.024(1) 0.027(1) 0.019(1) 0.019(1) 0.026(1) 0.026(1) 0.022(1) 0.026(1) 0.036(1) 0.024(1) 0.019(1) 0.016(1) 0.030(1) 0.021(1) 0.033(1) 0.021(1) 0.017(1) 0.030(1) 0.025(1) 0.015(1) 0.027(1) 0.035(1) 0.018(1) 0.019(1) 0.031(2) 0.023(8) 0.021(7) 0.025(8) 0.025(8) 0.024(8) 0.028(9) 0.036(1) 0.043(2) 0.041(2) 0.034(2) 0.036(2) 0.027(1) 0.025(1) 0.033(1) 0.030(1) 0.030(1) 0.037(1) 0.028(1) 0.030(1) 0.039(1) 0.028(1) 0.032(1) 0.028(1) 0.032(1) 0.038(1) 0.038(1) 0.028(1) 0.032(1) 0.034(1) 0.043(2) 0.034(1) 0.036(2) 0.037(1) 0.032(1) 0.039(1) 0.039(2) 0.043(2) 0.085(3) 0.094(3) -0.0005(1) 0.0012(1) 0.0000(1) -0.0008(1) -0.0019(1) -0.0042(1) -0.002(1) -0.001(2) -0.010(2) 0.008(2) -0.003(1) -0.009(1) -0.004(1) 0.004(1) 0.004(1) -0.001(1) -0.009(1) -0.003(1) -0.002(1) 0.002(1) -0.008(1) 0.002(1) 0.003(1) 0.002(1) -0.004(1) -0.004(1) -0.009(1) 0.004(10) 0.001(1) 0.001(1) 0.005(1) -0.008(1) 0.003(1) -0.008(1) -0.005(1) -0.007(1) 0.004(1) 0.005(1) -0.005(1) 0.004(6) -0.016(6) -0.020(6) -0.009(6) -0.004(6) -0.006(7) -0.004(1) -0.001(2) -0.017(2) -0.006(1) -0.006(1) -0.004(1) -0.001(1) -0.010(1) 0.002(1) -0.007(1) -0.008(1) -0.004(1) 0.0002(1) -0.0105(1) 0.0012(1) 0.0009(1) -0.0049(1) -0.0003(1) -0.0048(1) -0.0032(1) -0.0001(1) 0.0036(1) -0.0071(1) -0.0118(1) -0.0004(1) -0.0117(1) -0.0129(1) -0.0047(1) 0.0044(1) -0.0041(1) -0.0133(1) 0.0050(1) 0.0042(1) 0.002(1) 0.001(1) -0.0003(6) 0.001(1) 0.001(1) 0.005(1) 0.0013(1) -0.0002(2) 0.002(1) -0.009(1) -0.003(1) 0.006(1) 0.005(1) 0.003(1) -0.003(1) 0.003(1) 0.001(1) 0.003(1) 0.007(1) -0.001(1) 0.005(1) -0.007(1) -0.003(1) -0.007(1) -0.001(1) -0.002(1) -0.005(1) -0.005(1) -0.007(1) 0.003(1) 0.002(1) 0.001(1) -0.002(1) -0.003(1) -0.004(1) 0.006(1) 0.001(1) 0.016(1) 0.021(2) 248 8. Anhang ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Tab. 8.18: Abstände (in Å) und Winkel (in°) im triklinen Mo6Ga31 Mo1 - Ga15 Ga3 Ga28 Ga6 Ga33 Ga27 Ga32 Ga16 Ga21 Ga26 2.565(3) 2.592(2) 2.632(3) 2.636(3) 2.637(3) 2.637(3) 2.639(3) 2.651(3) 2.729(3) 2.772(4) 64.18(8) 112.60(11) 158.23(10) 122.44(12) 97.29(11) 71.50(11) 65.62(10) 125.36(12) 62.80(11) 157.55(8) 112.78(10) 126.40(11) 65.11(8) 71.67(10) 97.48(9) 64.98(9) 124.58(10) 61.19(10) 75.00(11) 94.36(10) 129.82(13) 63.10(10) 122.04(11) 63.72(10) 77.58(11) 63.97(10) 129.39(12) 94.46(10) 64.34(10) 122.40(12) 140.09(13) 63.82(11) 135.28(14) 75.58(14) 73.40(14) 135.67(14) 61.77(9) 135.96(13) 78.40(10) 74.89(13) 136.35(11) 77.52(13) Mo2 - Ga8 Ga4 Ga9 Ga28 Ga32 Ga27 Ga33 Ga12 Ga23 Ga17 2.563(3) 2.588(2) 2.607(3) 2.622(3) 2.635(3) 2.635(3) 2.649(4) 2.680(3) 2.726(4) 2.751(3) 63.27(7) 113.78(11) 96.36(11) 123.92(14) 158.29(12) 72.16(11) 66.86(10) 63.89(10) 124.63(10) 157.09(10) 64.20(7) 124.42(11) 112.32(9) 70.89(9) 97.40(8) 123.78(9) 65.06(7) 94.66(11) 77.06(11) 61.17(10) 131.34(13) 62.80(9) 66.24(10) 121.54(10) 139.01(13) 64.41(10) 133.71(12) 61.25(10) 139.62(12) 77.92(11) 76.86(11) 63.15(10) 137.76(12) 73.67(13) 73.14(13) 128.06(13) 93.79(11) 138.09(13) 123.87(10) 76.16(14) 63.70(10) 73.56(14) Mo3 - Ga5 Ga22 Ga18 Ga14 Ga11 Ga7 Ga10 Ga29 Ga31 Ga23 2.540(2) 2.569(3) 2.580(3) 2.606(3) 2.609(4) 2.638(3) 2.639(3) 2.683(3) 2.735(3) 2.817(4) 66.29(8) 117.59(9) 120.46(8) 159.27(10) 97.07(9) 67.39(8) 65.62(8) 65.44(8) 117.08(10) 159.71(11) 67.38(10) 102.56(11) 65.10(9) 103.12(11) 127.47(11) 73.29(10) 125.69(10) 118.99(12) 66.80(10) 94.68(10) 63.96(9) 67.03(9) 126.93(11) 71.88(9) 65.91(10) 95.46(11) 159.36(12) 123.95(11) 67.00(10) 66.72(10) 62.22(10) 100.22(10) 129.56(11) 130.07(11) 83.65(11) 64.02(9) 140.58(11) 76.56(10) 138.39(10) 129.53(12) 145.81(12) 129.18(10) Mo4 - Ga8 Ga18 Ga16 Ga7 Ga6 Ga24 Ga25 Ga20 Ga30 Ga17 2.563(3) 2.575(3) 2.599(3) 2.617(3) 2.618(3) 2.640(3) 2.661(3) 2.675(4) 2.696(4) 2.774(4) 64.96(10) 118.15(11) 121.00(10) 65.58(10) 156.31(12) 122.33(12) 95.61(10) 65.61(10) 68.11(10) 157.42(13) 67.59(9) 100.50(10) 102.45(11) 128.59(11) 64.83(10) 73.45(10) 127.92(11) 119.26(10) 64.77(9) 65.63(10) 70.55(10) 92.72(11) 128.96(12) 68.40(10) 157.10(12) 66.16(10) 67.72(10) 94.20(11) 68.92(10) 123.78(12) 99.37(11) 129.87(11) 62.91(10) 128.17(11) 79.09(11) 81.33(10) 60.74(9) 142.06(11) 132.43(11) 67.80(10) 129.27(10) 63.94(10) Mo5 - Ga15 Ga22 Ga9 Ga13 Ga20 Ga19 Ga14 Ga25 Ga29 Ga21 2.552(3) 2.567(3) 2.584(3) 2.624(3) 2.628(3) 2.633(4) 2.655(3) 2.674(3) 2.685(3) 2.807(4) 118.09(11) 65.66(10) 156.10(11) 120.35(11) 65.61(11) 94.21(11) 66.10(9) 121.87(11) 68.97(11) 157.93(12) 66.92(9) 119.90(11) 64.35(10) 94.99(11) 68.88(9) 71.73(10) 124.12(10) 100.93(10) 66.23(10) 101.96(11) 62.98(10) 127.01(11) 126.56(12) 77.92(10) 65.78(10) 100.33(12) 61.90(10) 131.80(10) 82.03(11) 129.75(12) 157.94(10) 93.67(10) 125.46(12) 67.02(9) 68.34(10) 64.30(9) 76.60(10) 140.82(12) 130.32(10) 143.81(12) 129.41(11) 140.89(10) 249 8. Anhang ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Mo6 - Ga19 Ga13 Ga24 Ga11 Ga10 Ga12 Ga30 Ga31 Ga26 Ga2 2.572(4) 2.580(3) 2.598(3) 2.601(3) 2.602(3) 2.605(3) 2.714(3) 2.715(3) 2.855(4) 2.944(2) 72.25(11) 65.00(9) 157.04(11) 119.36(11) 117.65(12) 121.20(11) 63.99(9) 70.11(11) 97.27(8) 98.84(11) 98.42(12) 65.03(10) 156.44(10) 126.65(11) 82.68(10) 136.87(12) 60.61(7) 96.86(10) 157.89(12) 69.84(10) 134.37(12) 125.62(12) 83.76(11) 60.96(7) 72.17(10) 63.92(10) 81.37(11) 137.02(11) 124.18(12) 60.42(8) 118.81(12) 64.36(10) 69.57(10) 118.34(10) 97.11(9) 68.67(10) 120.82(11) 64.95(11) 64.26(10) 61.64(11) 96.11(8) 141.51(11) Ga1 - Ga23 Ga17 Ga26 Ga21 Ga29 Ga25 Ga31 Ga30 Ga33 Ga32 Ga32 Ga33 2.754(5) 2.777(5) 2.790(4) 2.819(4) 2.966(4) 2.978(5) 2.993(4) 3.022(4) 3.193(5) 3.262(5) 3.285(6) 3.355(5) 178.14(14) 90.80(13) 89.12(12) 60.82(11) 120.14(13) 60.64(11) 118.62(13) 114.58(14) 114.69(13) 63.61(11) 64.86(11) 90.72(12) 89.36(12) 119.14(14) 59.92(10) 121.12(13) 63.14(10) 65.18(11) 63.63(11) 116.08(13) 113.46(13) 179.75(16) 121.41(13) 118.41(13) 59.76(10) 58.71(10) 65.05(10) 115.78(13) 67.27(11) 116.49(13) 58.35(10) 61.44(10) 120.00(13) 121.14(14) 115.19(13) 64.46(10) 112.90(12) 63.68(10) 59.36(10) 61.66(9) 89.70(11) 170.85(13) 122.50(10) 123.59(13) 97.15(11) 89.19(12) 59.73(9) 124.90(13) 98.47(12) 172.06(13) 124.63(11) 57.98(10) 124.24(11) 172.33(15) 98.65(12) 125.11(13) Ga2 - Ga13 Ga13 Ga11 Ga11 Ga24 Ga24 Mo6 Mo6 Ga7 Ga7 2.805(3) 2.805(3) 2.805(3) 2.805(3) 2.827(3) 2.827(3) 2.944(2) 2.944(2) 3.852(3) 3.852(3) 180.00(15) 91.28(8) 88.72(8) 91.41(8) 88.59(8) 126.73(7) 53.27(7) 90.38(7) 89.62(7) 88.72(8) 91.28(8) 88.59(8) 91.41(8) 53.27(7) 126.73(7) 89.62(7) 90.38(7) 180.00(12) 87.35(9) 92.65(9) 53.73(7) 126.27(7) 44.72(7) 135.28(7) 92.65(9) 87.35(9) 126.27(7) 53.73(7) 135.28(7) 44.72(7) 180.00(4) 53.47(6) 126.53(6) 132.07(7) 47.93(7) 126.53(6) 53.47(6) 47.93(7) 132.07(7) 180.00(6) 88.59(6) 91.41(6) Ga3 - Mo1 Mo1 Ga15 Ga15 Ga27 Ga27 Ga21 Ga21 Ga32 Ga32 Ga9 Ga9 2.592(2) 2.592(2) 2.740(3) 2.740(3) 2.814(3) 2.814(3) 2.861(3) 2.861(3) 3.063(4) 3.063(4) 3.831(3) 3.831(3) 180.00 122.57(7) 57.43(7) 58.22(7) 121.78(7) 59.82(8) 120.18(8) 54.88(7) 125.12(7) 91.53(6) 88.47(6) 57.43(7) 122.57(7) 121.78(7) 58.22(7) 120.18(8) 59.82(8) 125.12(7) 54.88(7) 88.47(6) 91.53(6) 180.00 90.65(8) 89.35(8) 65.74(9) 114.26(9) 117.08(10) 62.92(10) 133.42(7) 46.58(7) 89.35(8) 90.65(8) 114.26(9) 65.74(9) 62.92(10) 117.08(10) 46.58(7) 133.42(7) 180.00 73.42(8) 106.58(8) 112.42(8) 67.58(8) 135.89(7) 44.11(7) 106.58(8) 73.42(8) 67.58(8) 112.42(8) 44.11(7) 135.89(7) 180.00 66.79(10) 113.21(10) 121.15(8) 58.85(8) 250 8. Anhang ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Ga4 - Mo2 Mo2 Ga8 Ga8 Ga28 Ga28 Ga17 Ga17 Ga33 Ga33 2.588(2) 2.588(2) 2.702(3) 2.702(3) 2.769(3) 2.769(3) 2.874(3) 2.874(3) 3.037(4) 3.037(4) 180.00(7) 122.07(6) 57.93(6) 121.50(7) 58.50(7) 119.78(7) 60.22(7) 124.51(7) 55.49(7) 57.93(6) 122.07(6) 58.50(7) 121.50(7) 60.22(7) 119.78(7) 55.49(7) 124.51(7) 180.00 89.89(9) 90.11(9) 115.14(8) 64.86(8) 64.38(11) 115.62(11) 90.11(9) 89.89(9) 64.86(8) 115.14(8) 115.62(11) 64.38(11) 180.00(12) 73.57(9) 106.43(9) 113.11(8) 66.89(8) 106.43(9) 73.57(9) 66.89(8) 113.11(8) 180.00 66.28(10) 113.72(10) Mo3 Mo3 Ga22 Ga22 Ga29 Ga29 Ga31 Ga31 Ga10 Ga10 2.540(2) 2.540(2) 2.794(3) 2.794(3) 2.833(3) 2.833(3) 2.857(3) 2.857(3) 2.875(3) 2.875(3) 180.00(7) 57.35(7) 122.65(7) 59.62(8) 120.38(8) 60.57(7) 119.43(7) 57.94(7) 122.06(7) 122.65(7) 57.35(7) 120.38(8) 59.62(8) 119.43(7) 60.57(7) 122.06(7) 57.94(7) 180.00 113.67(8) 66.33(8) 68.22(9) 111.78(9) 92.05(8) 87.95(8) 66.33(8) 113.67(8) 111.78(9) 68.22(9) 87.95(8) 92.05(8) 180.00 64.93(8) 115.07(8) 70.58(8) 109.42(8) 115.07(8) 64.93(8) 109.42(8) 70.58(8) 180.00 116.05(8) 63.95(8) Mo4 Mo1 Ga28 Ga20 Ga27 Ga16 Ga8 Ga21 Ga33 Ga17 2.618(3) 2.636(3) 2.681(4) 2.762(4) 2.793(4) 2.794(3) 2.807(4) 2.858(4) 3.303(4) 3.435(5) 167.02(12) 118.19(13) 59.55(9) 134.49(12) 57.27(8) 56.26(9) 116.84(12) 115.81(11) 52.46(8) 59.32(9) 122.71(12) 58.03(9) 133.49(12) 110.84(11) 59.41(9) 51.22(8) 123.74(12) 177.65(15) 89.79(12) 92.40(11) 89.73(13) 115.67(12) 63.83(11) 65.76(10) 92.38(12) 86.76(11) 88.36(11) 65.87(10) 116.21(12) 111.99(11) 88.75(11) 166.76(12) 73.77(11) 108.52(11) 134.69(11) 104.49(12) 146.22(14) 94.57(11) 149.69(14) 59.68(9) 56.95(9) 56.25(9) Mo4 Mo3 Ga11 Ga10 Ga22 Ga24 Ga18 Ga25 Ga30 2.617(3) 2.638(3) 2.711(4) 2.797(4) 2.802(3) 2.870(4) 2.888(3) 2.941(4) 3.007(4) 165.50(14) 135.97(13) 112.82(12) 117.00(11) 57.31(9) 55.50(8) 56.85(8) 56.77(9) 58.38(9) 58.02(9) 56.27(8) 131.73(11) 128.59(11) 112.01(11) 110.58(12) 93.95(12) 94.24(11) 93.70(12) 96.71(11) 151.49(11) 146.86(12) 93.55(11) 170.11(13) 83.04(10) 102.69(13) 58.29(10) 92.13(10) 168.72(14) 89.85(10) 62.11(9) 72.95(10) 108.06(11) 104.43(13) 112.36(12) 64.64(10) Ga8 - Mo4 Mo2 Ga4 Ga18 Ga23 Ga6 Ga30 Ga12 Ga17 Ga33 2.563(3) 2.563(3) 2.702(3) 2.759(4) 2.802(4) 2.807(4) 2.851(4) 2.891(4) 2.994(4) 3.070(5) 175.49(14) 117.38(10) 57.73(8) 123.52(13) 58.16(8) 59.43(9) 120.53(13) 59.28(9) 126.23(13) 58.80(7) 125.80(11) 60.87(9) 122.67(13) 118.23(13) 58.51(9) 116.34(13) 55.20(9) 172.78(12) 116.77(11) 89.45(10) 104.74(12) 90.05(10) 60.36(8) 63.11(11) 69.58(10) 91.68(12) 68.37(11) 88.59(12) 113.27(11) 123.83(15) 108.14(14) 118.90(13) 73.76(10) 177.12(13) 68.56(12) Ga5 - Ga6 - Ga7 - 115.30(11) 178.05(12) 72.55(10) 68.23(10) 63.03(10) 62.69(10) 167.74(16) 251 8. Anhang ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Ga9 - Mo5 Mo2 Ga27 Ga14 Ga12 Ga15 Ga20 Ga23 Ga32 Ga21 2.584(3) 2.607(3) 2.667(4) 2.737(4) 2.756(3) 2.785(4) 2.848(4) 2.916(4) 3.266(5) 3.394(4) 167.60(14) 120.78(12) 59.77(9) 130.78(13) 56.61(8) 57.64(8) 114.92(12) 116.12(11) 53.98(8) 59.92(9) 119.50(12) 59.89(8) 111.55(12) 134.06(12) 58.82(9) 51.85(8) 125.20(12) 179.42(12) 91.37(11) 92.83(12) 93.21(13) 115.75(12) 66.13(12) 66.82(9) 88.29(11) 87.40(11) 87.23(12) 63.70(11) 113.57(14) 113.74(10) 166.28(15) 86.92(11) 74.04(10) 110.58(10) 135.38(13) 105.86(10) 92.39(12) 145.10(13) 59.73(9) 152.41(13) 57.98(9) 57.85(9) Ga10 - Mo6 Mo3 Ga18 Ga13 Ga7 Ga30 Ga5 Ga31 Ga11 Ga29 2.602(3) 2.639(3) 2.765(4) 2.786(4) 2.797(4) 2.833(4) 2.875(3) 3.035(4) 3.064(4) 3.298(4) 167.29(13) 134.10(11) 57.10(9) 122.76(12) 59.73(9) 112.92(11) 56.97(8) 53.89(8) 124.94(12) 56.97(8) 121.60(12) 57.96(8) 116.13(11) 54.66(6) 110.33(10) 138.16(13) 52.32(8) 94.23(12) 87.24(12) 144.09(14) 101.88(10) 154.98(13) 91.66(11) 56.49(9) 177.77(13) 114.71(13) 91.73(10) 73.77(11) 84.07(10) 69.31(10) 64.56(10) 86.33(8) 104.23(12) 97.57(11) 110.27(11) 98.18(10) 59.46(11) 57.73(7) 71.87(10) 166.11(12) 152.24(12) 54.12(7) Ga11 - Mo6 Mo3 Ga7 Ga12 Ga2 Ga14 Ga18 Ga10 Ga30 2.601(3) 2.609(3) 2.711(4) 2.755(4) 2.805(3) 2.837(4) 2.857(4) 3.064(4) 3.466(4) 164.83(13) 128.77(13) 58.11(9) 65.86(8) 130.08(13) 109.35(11) 53.94(8) 50.73(8) 59.40(10) 113.70(13) 129.26(11) 56.98(9) 56.10(9) 120.92(12) 114.27(11) 173.05(14) 88.56(10) 88.72(11) 87.08(12) 84.56(11) 125.95(11) 96.01(11) 86.31(11) 89.35(12) 100.60(11) 56.31(9) 86.90(10) 168.72(12) 103.39(12) 90.24(10) 172.77(14) 78.99(10) 116.43(10) 136.11(13) 58.90(9) Ga12 - Mo6 Mo2 Ga28 Ga11 Ga9 Ga8 Ga26 Ga24 Ga30 Ga23 2.605(3) 2.680(3) 2.702(4) 2.755(4) 2.756(3) 2.891(4) 2.912(4) 2.978(4) 3.001(4) 3.417(5) 167.05(11) 120.59(13) 57.97(9) 134.55(12) 113.30(11) 62.05(9) 54.98(8) 57.38(8) 127.26(12) 58.31(9) 122.29(13) 57.31(8) 54.64(9) 111.58(12) 136.64(12) 109.70(11) 51.39(8) 176.64(12) 89.59(11) 87.37(12) 61.00(10) 96.16(13) 102.76(11) 109.68(12) 93.39(11) 90.57(12) 116.61(12) 85.33(11) 73.89(11) 70.93(11) 100.17(12) 146.08(14) 91.56(10) 153.53(15) 55.13(9) 95.25(11) 167.80(11) 76.47(11) 57.85(9) 57.74(10) 51.93(9) 147.14(12) Ga13 - Mo6 Mo5 Ga14 Ga10 Ga2 Ga20 Ga22 Ga19 Ga29 Ga31 2.580(3) 2.624(3) 2.715(4) 2.786(4) 2.805(3) 2.853(4) 2.862(3) 3.038(4) 3.485(4) 3.500(4) 163.40(11) 130.52(13) 57.86(9) 66.12(7) 129.59(14) 108.90(11) 53.75(9) 118.84(11) 50.32(7) 59.60(9) 112.01(12) 130.23(10) 57.17(9) 55.58(8) 121.71(13) 49.74(8) 113.53(10) 171.53(13) 89.31(9) 87.56(11) 87.25(11) 86.21(12) 109.28(11) 126.36(13) 96.26(10) 86.46(12) 88.36(10) 100.08(11) 62.29(9) 56.38(9) 86.24(9) 169.24(14) 90.34(9) 133.65(12) 116.22(10) 103.78(11) 172.93(12) 79.27(11) 54.04(8) 57.02(9) 136.83(12) 58.74(9) 252 8. Anhang ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Ga14 - Mo3 Mo5 Ga13 Ga9 Ga19 Ga11 Ga22 Ga31 Ga23 2.606(3) 2.655(3) 2.715(4) 2.737(4) 2.814(4) 2.837(4) 2.871(4) 2.950(5) 2.987(4) 167.48(14) 133.73(13) 117.83(12) 114.02(13) 57.11(9) 55.71(8) 58.60(9) 60.02(9) 58.50(9) 57.25(9) 57.49(9) 131.46(14) 127.08(11) 110.06(11) 110.52(12) 94.91(13) 93.79(11) 92.49(12) 94.99(12) 146.56(12) 152.76(15) 93.81(12) 92.00(11) 169.77(15) 104.09(13) 61.06(10) 171.04(14) 82.97(11) 90.13(11) 58.17(9) 113.71(11) 65.96(11) 100.07(13) 76.85(10) 109.83(12) Ga15 - Mo5 Mo1 Ga3 Ga9 Ga26 Ga19 Ga16 Ga25 Ga32 Ga21 2.552(3) 2.565(3) 2.740(3) 2.785(5) 2.786(5) 2.810(4) 2.827(4) 2.852(4) 3.041(4) 3.042(5) 174.20(15) 116.22(12) 57.72(9) 123.54(14) 58.59(9) 121.15(11) 59.01(9) 125.47(11) 59.49(10) 58.39(7) 122.09(12) 62.24(10) 126.53(14) 58.65(9) 118.62(11) 55.38(8) 114.72(13) 87.80(10) 118.52(12) 172.71(12) 90.13(10) 102.04(11) 63.74(10) 59.04(9) 111.64(12) 92.86(11) 176.65(15) 113.21(13) 68.02(10) 71.11(11) 67.91(12) 71.67(11) 119.25(13) 70.98(12) 176.59(14) 88.86(11) 71.04(10) 64.68(9) 123.16(14) 113.32(12) 114.38(12) 105.56(12) Ga16 - Mo4 Mo1 Ga27 Ga28 Ga6 Ga15 Ga24 Ga17 Ga25 Ga26 2.599(3) 2.651(3) 2.715(4) 2.764(4) 2.794(3) 2.827(4) 2.839(4) 3.023(4) 3.038(4) 3.287(4) 164.44(14) 115.15(12) 137.42(13) 57.96(8) 112.23(13) 57.90(8) 58.55(9) 55.69(8) 129.18(12) 58.86(8) 58.11(8) 131.89(13) 55.73(8) 126.72(11) 110.05(12) 109.83(11) 54.39(8) 89.72(12) 87.78(11) 89.59(11) 172.15(14) 59.13(10) 101.37(13) 113.25(10) 91.41(12) 101.29(10) 98.03(13) 144.48(14) 155.96(12) 55.49(9) 167.02(14) 90.76(10) 72.26(10) 110.10(11) 138.62(14) 90.12(11) 95.52(12) 58.05(9) 53.58(9) 113.10(12) 71.91 (11) 72.62 (10) Ga17 - Mo2 Mo4 Ga1 Ga27 Ga4 Ga25 Ga8 Ga16 Ga30 Ga32 Ga33 Ga28 2.751(3) 2.774(4) 2.777(5) 2.844(4) 2.874(3) 2.879(4) 2.994(4) 3.023(4) 3.043(4) 3.210(5) 3.234(5) 3.380(4) 144.09(14) 108.35(14) 56.16(9) 54.72(6) 149.74(11) 107.25(11) 108.92(12) 144.58(12) 51.76(9) 51.76(9) 49.34(8) 107.27(13) 105.95(13) 105.58(10) 56.13(8) 52.60(8) 53.06(8) 54.98(9) 155.33(12) 149.56(12) 94.77(11) 123.60(13) 114.22(12) 63.51(11) 114.02(13) 122.22(12) 62.36(11) 65.55(11) 63.63(11) 157.12(14) 98.68(11) 102.24(11) 122.38(14) 55.02(9) 158.77(14) 65.18(10) 102.61(12) 52.65(9) 155.39(11) 54.78(7) 123.20(13) 96.00(9) 98.66(11) 59.28(8) 51.78(7) 102.37(11) 61.90(10) 60.52(9) 101.78(12) 126.94(14) 137.54(14) 94.77(12) 56.37(9) 151.98(13) 102.51(11) 74.54(10) Ga18 - Mo4 Mo3 Ga8 Ga10 Ga20 Ga11 Ga7 Ga29 Ga30 Ga23 2.575(3) 2.580(3) 2.759(4) 2.765(4) 2.815(4) 2.857(4) 2.888(3) 2.907(4) 3.153(4) 3.173(4) 167.45(13) 57.31(8) 130.24(12) 59.30(9) 125.10(13) 56.91(8) 114.11(12) 55.03(8) 110.24(11) 111.71(11) 59.07(8) 117.59(12) 57.09(8) 135.57(13) 58.19(8) 126.40(12) 57.52(8) 166.01(13) 88.25(12) 91.20(12) 105.94(11) 95.24(12) 57.20(10) 55.84(9) 87.59(12) 91.51(11) 87.06(11) 71.05(11) 136.33(13) 112.03(10) 173.88(12) 85.63(10) 61.66(9) 114.34(10) 101.13(12) 100.37(12) 112.35(10) 140.48(13) 70.23(10) 59.50(9) 73.61(10) 159.81(13) 253 8. Anhang ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Ga19 - Mo6 Mo5 Ga22 Ga24 Ga31 Ga15 Ga14 Ga13 Ga26 Ga25 2.572(4) 2.633(4) 2.770(4) 2.778(3) 2.804(4) 2.810(4) 2.814(4) 3.038(4) 3.126(5) 3.290(4) 168.41(14) 133.71(12) 57.95(9) 60.49(9) 112.89(13) 122.03(12) 54.00(9) 59.20(10) 125.40(11) 56.66(9) 121.07(12) 115.33(11) 55.79(9) 58.22(9) 136.94(13) 109.23(12) 52.26(8) 94.83(10) 143.16(13) 103.75(13) 87.18(11) 90.24(11) 156.36(13) 57.84(9) 115.70(13) 91.74(12) 176.85(15) 84.97(11) 76.00(11) 68.82(9) 95.80(12) 63.34(10) 73.47(11) 57.94(10) 150.84(13) Ga20 - Mo5 Mo4 Ga24 Ga6 Ga18 Ga9 Ga13 Ga29 Ga21 2.628(3) 2.675(4) 2.688(3) 2.762(4) 2.815(4) 2.848(4) 2.853(4) 2.934(3) 3.056(4) 165.39(12) 135.61(13) 114.13(12) 115.82(10) 56.14(9) 57.04(9) 57.42(8) 58.61(9) 59.00(9) 57.55(9) 55.87(9) 129.77(11) 130.63(13) 110.26(11) 108.85(12) 94.73(11) 95.26(12) 95.92(11) 93.32(12) 151.65(14) 149.74(13) 91.42(12) 85.71(12) 171.06(13) 100.29(12) 58.56(9) 168.66(12) 91.70(11) 89.61(12) 60.71(9) 108.99(11) 74.04(10) 99.08(11) 70.08(10) 112.64(11) Ga21 - Mo1 Mo5 Ga1 Ga29 Ga6 Ga3 Ga25 Ga15 Ga20 Ga32 Ga33 Ga27 2.729(3) 2.807(4) 2.819(4) 2.823(4) 2.858(4) 2.861(3) 2.965(4) 3.042(5) 3.056(4) 3.265(5) 3.289(6) 3.392(4) 143.96(12) 108.49(13) 148.46(15) 56.26(9) 55.20(7) 145.17(13) 108.17(12) 109.83(11) 51.30(8) 50.94(9) 49.60(7) 107.30(12) 56.97(9) 106.03(12) 104.91(11) 55.12(8) 51.54(9) 53.06(9) 149.88(13) 156.03(14) 94.39(10) 63.43(10) 122.88(15) 114.94(12) 61.92(10) 114.23(12) 120.18(13) 64.35(11) 66.11(11) 157.79(14) 100.71(13) 156.27(14) 61.07(10) 102.57(13) 59.71(9) 127.44(12) 101.63(13) 136.18(12) 99.19(10) 158.31(14) 122.85(13) 55.57(9) 102.13(12) 64.57(10) 52.24(9) 96.53(11) 55.22(8) 124.48(11) 59.58(8) 98.51(11) 52.66(7) 56.68(10) 103.02(12) 98.68(11) 127.51(12) 132.13(13) Ga22 - Mo5 Mo3 Ga19 Ga5 Ga7 Ga13 Ga14 Ga25 Ga29 Ga31 Ga19 Ga14 2.567(3) 2.569(3) 2.770(4) 2.794(3) 2.802(3) 2.862(3) 2.871(4) 2.965(4) 3.078(4) 3.169(4) 3.766(4) 3.850(3) 166.16(14) 59.00(9) 112.28(12) 116.57(12) 57.51(8) 136.92(11) 57.27(8) 55.93(8) 127.20(11) 101.11(8) 43.39(7) 130.16(13) 56.36(7) 58.62(8) 126.25(13) 56.92(8) 113.31(10) 111.05(11) 55.76(8) 89.68(9) 149.95(12) 166.08(13) 87.25(11) 91.58(10) 88.55(12) 69.91(10) 111.15(11) 136.81(13) 91.01(10) 46.89(7) 87.80(9) 91.82(10) 104.10(10) 96.33(10) 57.45(8) 56.83(8) 101.74(9) 135.70(10) 173.30(14) 86.30(11) 61.25(9) 102.56(11) 114.38(10) 134.16(12) 134.05(12) 100.27(11) 112.18(11) 71.72(10) 70.72(9) 52.42(9) 44.79(8) 140.88(13) 158.52(13) 58.22(10) 47.87(8) 94.09(9) 254 85.42(11) 165.87(13) 97.46(11) 55.68(10) 101.22(11) 55.07(9) 110.43(12) 8. Anhang ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Ga23 - Mo2 Ga1 Ga8 Mo3 Ga29 Ga31 Ga9 Ga14 Ga18 Ga32 Ga33 Ga12 2.726(4) 2.754(5) 2.802(4) 2.817(4) 2.901(4) 2.909(4) 2.916(4) 2.987(4) 3.173(4) 3.214(5) 3.315(5) 3.417(5) 110.11(14) 55.24(9) 141.84(14) 144.17(12) 148.75(12) 54.93(9) 107.77(13) 106.67(11) 51.87(9) 50.88(9) 50.21(8) 116.29(14) 107.87(13) 63.21(11) 63.74(11) 122.63(13) 120.60(12) 117.00(13) 66.25(12) 66.37(12) 160.27(14) 103.75(12) 94.45(11) 156.00(14) 98.48(12) 122.75(15) 54.57(9) 99.17(12) 59.56(10) 54.31(9) 55.95(09) 57.05(9) 105.92(12) 53.26(8) 50.59(7) 156.28(11) 151.00(12) 91.71(11) 63.43(10) 160.07(13) 104.91(12) 56.97(9) 128.52(14) 99.35(12) 130.37(12) Ga24 - Mo6 Mo4 Ga20 Ga19 Ga2 Ga16 Ga7 Ga12 Ga25 2.598(3) 2.640(3) 2.688(3) 2.778(3) 2.827(3) 2.839(4) 2.870(4) 2.978(4) 3.455(4) 164.93(13) 130.62(14) 57.05(9) 65.57(8) 110.38(11) 127.48(12) 55.19(8) 118.47(10) 60.26(9) 112.20(12) 128.67(10) 56.48(9) 56.53(8) 123.01(12) 49.60(7) 172.32(14) 89.03(10) 87.30(11) 88.41(10) 85.58(11) 109.85(11) 95.44(11) 89.26(11) 85.77(11) 100.56(10) 62.60(9) 170.04(13) 85.09(10) 104.05(12) 90.76(10) 79.74(11) 172.75(12) 133.21(11) 56.71(10) 54.48(9) Ga25 - Mo4 Mo5 Ga15 Ga17 Ga7 Ga29 Ga21 Ga22 Ga1 Ga30 Ga16 Ga19 2.661(3) 2.674(3) 2.852(4) 2.879(4) 2.941(4) 2.943(4) 2.965(4) 2.965(4) 2.978(5) 2.988(3) 3.038(4) 3.290(4) 148.79(14) 109.60(12) 59.93(9) 55.43(8) 146.03(11) 143.20(13) 110.35(12) 104.72(10) 56.65(8) 53.76(8) 97.65(11) 54.89(8) 141.47(12) 108.81(12) 56.87(8) 59.45(9) 53.85(8) 106.47(11) 144.64(13) 110.12(10) 51.15(8) 98.24(12) 126.46(14) 104.35(10) 63.02(10) 97.96(10) 115.21(12) 159.72(13) 57.27(9) 53.89(9) 109.58(10) 116.56(14) 84.64(11) 163.30(11) 56.57(11) 62.45(9) 61.37(10) 138.40(13) 102.56(12) 159.46(13) 56.64(8) 118.32(11) 60.94(9) 97.63(11) 75.96(10) 57.09(10) 62.80(10) 60.12(10) 90.79(11) 158.75(11) 101.36(10) 106.42(11) 56.64(10) 117.46(14) 102.30(11) 103.62(10) Ga26 - Mo1 Ga15 Ga1 Ga28 Mo6 Ga30 Ga31 Ga12 Ga19 Ga33 Ga16 Ga32 2.772(4) 2.786(5) 2.790(4) 2.855(4) 2.855(4) 2.856(5) 2.886(4) 2.912(4) 3.126(5) 3.235(5) 3.287(4) 3.390(5) 54.97(9) 105.83(13) 55.75(9) 143.98(12) 150.05(15) 142.96(14) 108.83(11) 108.87(12) 51.38(9) 51.03(8) 49.49(8) 112.43(13) 100.07(13) 105.38(13) 154.59(15) 94.49(13) 124.20(13) 56.41(10) 98.18(13) 54.74(9) 58.02(10) 120.18(15) 109.87(13) 64.70(11) 63.62(11) 123.24(15) 114.98(13) 63.50(11) 156.68(14) 63.34(11) 107.65(11) 102.69(13) 161.17(15) 55.86(9) 124.83(12) 63.21(10) 52.93(9) 99.36(12) 56.74(9) 56.45(9) 53.69(9) 50.69(9) 156.06(15) 93.03(10) 150.80(13) 61.02(11) 62.71(11) 100.60(12) 102.06(13) 136.00(13) 127.88(13) 105.87(13) 55.43(10) 126.52(12) 131.33(14) 98.46(12) 100.75(11) 60.03(10) 102.79(12) 102.06(12) 129.68(14) 132.78(13) 55.24(9) 120.33(13) 64.16(10) 100.27(12) 50.84(9) 255 8. Anhang ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Ga27 - Mo2 Mo1 Ga9 Ga16 Ga6 Ga28 Ga3 Ga17 Ga32 Ga21 2.635(3) 2.637(3) 2.667(4) 2.715(4) 2.793(4) 2.802(3) 2.814(3) 2.844(4) 3.276(5) 3.392(4) 167.51(13) 58.91(9) 122.99(12) 131.78(13) 57.58(9) 110.99(11) 60.15(9) 51.57(8) 124.30(12) 118.90(11) 59.37(9) 58.00(8) 134.41(13) 56.68(6) 116.20(12) 115.95(11) 52.01(8) 178.05(13) 88.64(12) 89.31(11) 88.63(10) 116.09(13) 65.74(12) 66.90(9) 89.59(12) 91.53(11) 90.93(10) 65.85(11) 115.62(14) 111.35(10) 90.65(12) 101.89(9) 149.77(14) 147.38(13) 53.98(9) 167.24(13) 73.56(10) 96.11(11) 107.99(11) 59.83(7) 135.78(13) 53.92(7) Ga28 - Mo2 Mo1 Ga6 Ga12 Ga16 Ga4 Ga27 Ga26 Ga33 Ga17 2.622(3) 2.632(3) 2.681(4) 2.702(4) 2.764(4) 2.769(3) 2.802(3) 2.855(4) 3.208(4) 3.380(4) 169.51(12) 120.65(13) 60.44(10) 130.49(12) 57.29(7) 58.01(8) 115.21(13) 117.08(12) 52.74(8) 59.48(9) 120.18(13) 58.79(9) 112.74(9) 131.21(13) 60.54(9) 52.57(8) 125.98(12) 176.37(14) 90.90(13) 90.67(11) 88.29(11) 117.74(12) 67.56(11) 67.91(10) 86.08(12) 92.69(11) 89.67(11) 63.13(10) 115.38(13) 113.11(12) 168.46(11) 89.19(11) 71.58(11) 109.73(11) 136.06(12) 102.29(11) 97.63(11) 146.97(13) 60.56(8) 148.84(14) 54.65(7) 53.79(9) Ga29 - Mo3 Mo5 Ga21 Ga5 Ga23 Ga18 Ga20 Ga25 Ga1 Ga31 Ga22 Ga10 2.683(3) 2.685(3) 2.823(4) 2.833(3) 2.901(4) 2.907(4) 2.934(3) 2.943(4) 2.966(4) 3.054(5) 3.078(4) 3.298(4) 147.61(13) 144.41(15) 54.76(7) 60.43(10) 54.79(8) 110.45(12) 142.14(11) 105.60(11) 56.51(8) 108.51(12) 51.12(8) 61.22(10) 107.58(12) 146.50(13) 111.09(10) 55.57(8) 56.51(8) 106.51(12) 142.32(13) 52.35(8) 96.62(11) 157.81(13) 86.18(13) 102.53(12) 64.10(10) 61.84(10) 58.22(10) 117.81(13) 107.08(12) 140.45(11) 105.73(10) 99.44(11) 127.68(12) 95.97(10) 112.84(9) 57.91(8) 56.23(7) 55.30(7) 66.23(11) 105.04(12) 116.47(13) 55.98(11) 58.41(9) 157.84(11) 105.15(12) 57.63(9) 162.88(12) 118.92(14) 105.81(12) 125.34(13) 52.46(9) 106.63(11) 119.41(12) 161.89(14) 96.80(11) 76.35(10) Ga30 - Mo4 Mo6 Ga10 Ga8 Ga26 Ga31 Ga25 Ga12 Ga7 Ga1 Ga17 Ga18 2.696(4) 2.714(3) 2.833(4) 2.851(4) 2.856(5) 2.915(5) 2.988(3) 3.001(4) 3.007(4) 3.022(4) 3.043(4) 3.153(4) 150.04(14) 109.36(13) 54.95(9) 139.65(14) 144.67(12) 55.55(8) 112.43(12) 54.31(9) 102.71(11) 57.43(9) 51.51(8) 55.91(9) 111.21(11) 61.62(10) 57.55(9) 145.57(13) 53.94(8) 111.81(12) 107.23(13) 144.54(14) 98.53(11) 129.42(14) 110.99(13) 63.73(11) 100.68(11) 100.35(11) 57.14(10) 119.52(13) 157.51(12) 77.85(12) 97.36(12) 157.19(14) 103.19(12) 59.12(9) 100.62(13) 111.03(13) 60.95(10) 54.43(10) 60.00(11) 115.98(13) 59.56(10) 162.00(14) 56.59(10) 84.30(12) 139.11(12) 90.50(11) 102.87(12) 102.08(12) 60.51(11) 115.02(14) 141.41(14) 158.48(14) 58.76(9) 59.41(10) 57.03(9) 100.36(11) 256 8. Anhang ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Ga31 - Mo6 Mo3 Ga19 Ga5 Ga26 Ga23 Ga30 Ga14 Ga1 Ga10 Ga29 Ga22 2.715(3) 2.735(3) 2.804(4) 2.857(3) 2.886(4) 2.909(4) 2.915(5) 2.950(5) 2.993(4) 3.035(4) 3.054(3) 3.169(4) 148.33(14) 55.52(9) 110.10(11) 61.20(9) 144.93(13) 57.50(9) 112.52(11) 108.00(12) 53.46(8) 145.12(14) 97.41(11) 110.33(13) 53.99(7) 144.73(14) 59.78(9) 141.98(13) 54.40(8) 103.56(10) 110.36(12) 54.89(8) 50.94(8) 129.76(13) 66.62(11) 102.22(13) 107.26(11) 58.49(9) 118.86(13) 99.72(11) 158.93(14) 77.90(11) 155.52(14) 104.93(9) 96.72(11) 100.58(11) 111.37(11) 58.32(8) 57.17(8) 54.96(8) 85.88(12) 58.98(11) 103.87(13) 56.62(10) 104.66(11) 115.36(14) 144.47(13) 117.12(14) 61.30(11) 55.62(11) 157.98(13) 58.17(10) 104.05(12) 162.40(13) 61.50(11) 56.81(10) 90.03(12) 135.55(14) Ga32 - Mo2 Mo1 Ga33 Ga33 Ga15 Ga3 Ga17 Ga23 Ga1 Ga21 Ga9 Ga27 2.635(3) 2.639(3) 2.766(4) 2.789(5) 3.041(4) 3.063(4) 3.210(5) 3.214(5) 3.262(5) 3.265(5) 3.266(5) 3.276(5) 153.21(14) 58.67(9) 148.57(13) 103.34(13) 103.79(12) 55.10(9) 54.46(10) 98.41(12) 127.99(17) 51.10(8) 51.57(8) 148.10(16) 58.05(9) 53.12(8) 53.45(7) 125.85(17) 123.89(16) 98.93(13) 53.80(9) 104.43(11) 105.53(12) 90.08(13) 149.05(19) 149.25(19) 65.03(13) 66.84(13) 63.34(13) 114.51(17) 104.82(12) 103.34(12) 102.82(13) 105.70(11) 117.62(17) 112.93(18) 66.82(14) 65.27(13) 149.88(18) 153.36(18) 53.34(8) 128.30(15) 82.22(12) 147.61(14) 96.43(10) 52.25(9) 77.31(11) 84.22(12) 126.37(13) 98.37(13) 53.64(9) 74.43(9) 52.58(7) 107.64(10) 50.81(10) 74.85(12) 92.48(11) 52.00(10) Ga33 - Mo1 Mo2 Ga32 Ga32 Ga4 Ga8 Ga1 Ga28 Ga17 Ga26 Ga21 Ga6 2.637(3) 2.649(4) 2.766(4) 2.789(5) 3.037(4) 3.070(5) 3.193(5) 3.208(4) 3.234(5) 3.235(5) 3.289(6) 3.303(4) 153.48(13) 148.02(15) 58.13(9) 104.64(11) 103.24(12) 98.68(14) 52.43(8) 129.07(17) 55.22(10) 53.48(10) 51.20(8) 58.18(9) 147.91(13) 53.62(8) 52.63(9) 99.82(14) 105.51(13) 54.68(10) 127.12(18) 122.73(17) 104.19(12) 89.92(13) 105.42(13) 103.52(14) 65.92(13) 153.16(20) 64.13(13) 117.36(17) 114.24(17) 149.71(19) 152.74(18) 146.01(20) 66.21(13) 105.31(13) 117.32(17) 68.03(13) 64.37(14) 102.72(13) 52.51(8) 99.22(15) 52.55(8) 54.45(9) 84.83(13) 125.14(12) 75.26(8) 147.75(16) 76.13(10) 96.56(12) 127.77(13) 81.67(13) 52.09(9) 99.73(15) 51.20(11) 51.45(10) 130.57(13) 144.37(14) 257 8. Anhang ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Tab. 8.19: Angaben zur Strukturbestimmung von V2Cu3Ga8 Rel. Molmasse Kristallsystem Raumgruppe Zellabmessungen 850.28 g/mol kubisch I –4 3 d (Nr. 220) a = 11.786(1) Å Zellvolumen Anzahl der Formeleinheiten Röntgendichte Messtemperatur Diffraktometer Röntgenstrahlung V = 1637.23 Å3 8 6.899 g/cm3 20°C STOE IPDS II Mo Kα1 Graphit-Monochromator 3048.0 h, k, l ±16; ±16; ±16 59° 90 Platten à 4 min bei 2° ϕ-Inkrement ω = 0° / 90° I / σ(I)-Verhältnis 6.0 16122 1782 382 382 310 Polyeder 0.2 * 0.2 * 0.2 mm3 numerisch; Equivalent-Methode 0.1228 (0.0268) 35.54 mm-1 0,000196 + 1.48; -2.20 (0.39) e/ Å3 1 / [σ2 * F02 + (0,0366 * P) 2 + 100.70 * P] mit P = (F02 + 2 * Fc2) / 3 25 R1(F) = 0.0468; wR2(I) = 0.1171 F ( 0 0 0) Meßbereich max. 2θ Mess- / Scanmodus Messwerte davon unbeobachtet unabhängige Reflexe davon mit I > 0 davon mit I > 2σ(I) Kristallform Kristallabmessungen Absorptionskorrektur Interner Standard Schwächungskoeffizient Extinktionskoeffizient (SHELX98) Restelektronendichte Wichtungsfunktion Zahl der Parameter R- Werte 258 8. Anhang ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Tab. 8.20: Ortskoordinaten und Auslenkungsparameter in V2Cu3Ga8 Atom Wyck. Symm. x y z Ueq V Cu Ga1 Ga2 16c 24d 48e 16c .3. 2.. 1 .3. 0.5135(1) 1/4 0.3788(2) 0.3862(2) 0.0135(1) -0.2503(2) -0.1295(1) 0.8862(2) 0.0027(7) 0.0051(6) 0.0099(5) 0.0099(9 Atom U11 U22 V Cu Ga1 Ga2 0.0027(7) 0.0051(9) 0.0055(8) 0.0099(9) 0.4864(1) 1/2 0.38172() 0.6131(2) 0.0027(7) 0.0075(1) 0.0123(8) 0.0099(9) U33 U12 U13 U23 0.0027(7) 0.0027(1) 0.0118(1) 0.0099(9) 0.0049(5) 0.0029(8) 0.0010(5) 0.0016(5) 0.0049(5) 0 0.0038(6) 0.0016(5) -0.0049(5) 0 -0.0032(5) -0.0016(5) 259 8. Anhang ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Tabelle 8.21: Abstände und Winkel in V2Cu3Ga8 V- Ga2 Ga1 Ga1 Ga1 Ga2 Ga1 Ga1 Ga1 Cu Cu Cu 2.503(4) 2.519(2) 2.519(2) 2.519(2) 2.599(4) 2.624(2) 2.624(2) 2.624(2) 2.796(2) 2.796(2) 2.796(2) 77.07(0) 77.07(0) 77.07(0) 180.00(6) 116.67(7) 116.67(7) 116.67(7) 59.42(6) 59.42(6) 59.42(6) 115.15(7) 115.15(7) 102.93(0) 165.78(1) 73.57(7) 67.34(8) 55.94(7) 59.60(6) 136.45(4) 115.15(7) 102.93(10) 73.57(7) 67.34(8) 165.78(13) 136.45(14) 55.94(7) 59.60(6) 102.93(10) 67.34(8) 165.78(13) 73.57(7) 59.60(6) 136.45(14) 55.94(7) 63.33(7) 63.33(7) 63.33(7) 120.58(6) 120.58(6) 120.58(6) 101.41(9) 101.41(9) 126.32(6) 129.29(5) 57.27(6) 101.41(9) 129.29(5) 57.27(6) 126.32(6) Cu - Ga1 Ga1 Ga1 Ga1 Ga2 Ga2 Ga1 Ga1 V V Cu 2.505(3) 2.505(3) 2.601(3) 2.601(3) 2.639(2) 2.639(2) 2.652(2) 2.652(2) 2.796(2) 2.796(2) 2.938(5) 110.71(13) 67.89(7) 177.14(10) 74.89(8) 64.37(7) 106.84(5) 111.07(6) 56.43(3) 119.11(9) 124.65(7) 177.14(10) 67.89(7) 64.37(7) 74.89(8) 111.07(6) 106.84(5) 119.11(9) 56.43(3) 124.65(7) 113.63(13) 112.78(10) 106.28(7) 71.79(5) 71.79(5) 58.03(6) 126.40(7) 56.81(6) 106.28(7) 112.78(10) 71.79(5) 71.79(5) 126.40(7) 58.03(6) 56.81(6) 104.86(9) 175.37(8) 72.51(9) 54.77(9) 120.37(8) 127.57(5) 72.51(9) 175.37(8) 120.37(8) 54.77(9) 127.57(5) 110.36(15) 129.82(7) 55.00(3) 55.18(7) Ga1 - Cu V Cu V Cu Ga2 Ga1 Ga1 Ga1 Ga1 Ga2 2.505(3) 2.519(2) 2.601(3) 2.624(2) 2.652(2) 2.742(2) 2.852(3) 2.852(3) 3.080(3) 3.080(3) 3.129(4) 67.63(7) 175.77(9) 118.06(10) 107.86(11) 60.19(5) 129.64(8) 57.67(7) 123.73(4) 122.22(9) 54.50(6) 109.14(10) 169.93(9) 65.40(6) 127.33(9) 129.45(13) 58.08(7) 118.41(9) 54.78(7) 51.24(8) 64.70(7) 68.00(11) 122.57(9) 54.44(11) 123.42(12) 54.87(5) 54.87(5) 121.44(8) 104.54(6) 57.90(10) 54.58(7) 131.77(7) 51.66(6) 119.56(9) 123.93(11) 124.27(9) 122.39(15) 122.91(7) 53.34(4) 53.34(4) 53.55(6) 91.38(1) 97.07(7) 86.69(9) 176.63(9) 90.63(8) 89.82(1) 91.49(14) 88.47(15) 175.80(10) Ga2 - V V Cu Cu Cu Ga1 Ga1 Ga1 Ga1 Ga1 Ga1 2.503(4) 2.599(4) 2.639(2) 2.639(2) 2.639(2) 2.742(2) 2.742(2) 2.742(2) 3.129(4) 3.129(4) 3.129(4) 180.00(8) 65.81(7) 65.81(7) 65.81(7) 121.24(6) 121.24(6) 121.24(6) 51.68(8) 51.68(8) 51.68(8) 114.19(7) 114.19(7) 114.19(7) 58.76(6) 58.76(6) 58.76(6) 128.32(8) 128.32(8) 128.32(8) 104.37(8) 104.37(8) 128.43(6) 55.45(5) 125.67(5) 53.94(7) 117.46(15) 50.61(4) 104.37(8) 125.67(5) 128.43(6) 55.45(5) 117.46(15) 50.61(4) 53.94(7) 55.45(5) 125.67(5) 128.43(6) 50.61(4) 53.94(7) 117.46(15) 95.55(8) 95.55(8) 88.91(7) 89.49(1) 172.91(13) 95.55(8) 89.49(1) 172.91(13) 88.91(7) 260 8. Anhang ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Tab. 8.22: Angaben zur Strukturbestimmung von V11Cu9Ga46 Rel. Molmasse Kristallsystem Raumgruppe Zellabmessungen 4339.32 g/mol kubisch P m –3 n (Nr. 223) a = 23.362(3) Å Zellvolumen Anzahl der Formeleinheiten Röntgendichte Messtemperatur Diffraktometer Röntgenstrahlung V = 12750.75 Å3 12 6.781 g/cm3 20°C STOE IPDS Mo Kα1 Graphit-Monochromator 23280.0 h, k, l ±26; ±26; ±26 48° 400 Platten à 4 min bei 0.25° ϕ-Inkrement I / σ(I)-Verhältnis 6.0 77338 97 1797 1797 969 Polyeder 0.1 * 0.1 * 0.1 mm3 numerisch; Equivalent-Methode 0.1720 (0.0437) 35.54 mm-1 0,000001 + 0.97; -1.84 (0.25) e/ Å3 1 / [σ2 * F02 + (0,02840 * P) 2 + 0.0 * P] mit P = (F02 + 2 * Fc2) / 3 170 R1(F) = 0.0291; wR2(I) = 0.0586 F (0 0 0) Meßbereich max. 2θ Mess- / Scanmodus Messwerte davon unbeobachtet unabhängige Reflexe davon mit I > 0 davon mit I > 2σ(I) Kristallform Kristallabmessungen Absorptionskorrektur Interner Standard Schwächungskoeffizient Extinktionskoeffizient (SHELX98) Restelektronendichte Wichtungsfunktion Zahl der Parameter R- Werte 261 8. Anhang ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Tab. 8.23: Orstkoordinaten und Auslenkungsparameter in V11Cu9Ga46 262 Atom Wyck. Symm. x y V1 V2 V3 V4 V5 V6 V7 V8 Cu1 Cu2 Cu3 Cu4 Ga1 Ga2 Ga3 Ga4 Ga5 Ga6 Ga7 Ga8 Ga9 Ga10 Ga11 Ga12 Ga13 Ga14 Ga15 Ga16 6b 6d 8e 12f 12h 16i 24k 48l 12f 24k 24k 48l 2a 6c 16i 24j 24k 24k 24k 48l 48l 48l 48l 48l 48l 48l 48l 48l 0 1/4 1/4 0.2620(1) 0.6274(1) 0.6117(1) 0.7333(1) 0.6112(1) 0.3781(1) 0.6184(1) 0.7390(1) 0.7415(1) 0 1/4 0.6798(1) 0.9064() 0.5900() 1/2 0.5867(1) 0.5572(1) 0.6756(1) 0.5595(1) 0.6825(1) 0.6777(1) 0.8043(1) 0.5616(1) 0.8018(1) 0.6821(1) 1/2 1/2 1/4 0 1/2 0.6117(1) 1/2 0.6413(1) 0 1/2 1/2 0.6253(1) 0 0 0.6798(1) 0.5935(1) 0.6675(1) 0.6655(1) 1/2 0.5646(1) 0.5721(1) 0.5722(1) 0.5698(1) 0.5613(1) 0.5612(1) 0.5642(1) 0.5578(1) 0.6889(1) mmm.. -4m.2 .32 mm2.. mm2.. .3. m.. 1 mm2.. m.. m.. 1 m-3. -4m.2 .3. ..2 m.. m.. m.. 1 1 1 1 1 1 1 1 1 z 1/2 0 1/4 0 0 0.3882(1) 0.2436(1) 0.1131(1) 0 0.2397(1) 0.1215(1) 0.2492(1) 0 1/2 0.3202(1) 1/4 0 0.0916(1) 0.4077(1) 0.3058(1) 0.1776(1) 0.1801(1) 0.0612(1) 0.3161(1) 0.1866(1) -0.0593(1) 0.3101(1) 0.1835(1) Ueq 0.0078(8) 0.0106(8) 0.0104(7) 0.0099(8) 0.0182(8) 0.0088(6) 0.0097(4) 0.0096(3) 0.0222(6) 0.0124(4) 0.0140(4) 0.0152(3) 0.0203(1) 0.0170(6) 0.0136(4) 0.0199(3) 0.0185(4) 0.0194(4) 0.0196(3) 0.0145(3) 0.0131(2) 0.0142(3) 0.0134(2) 0.0134(3) 0.0133(3) 0.0143(2) 0.0147(2) 0.0128(2) 8. Anhang ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Tab. 8.24: Auslenkungsparameter in V11Cu9Ga46 Atom U11 U22 U33 U12 U13 U23 Ga1 V1 V2 V3 V4 V5 V6 V7 V8 Cu1 Cu2 Cu3 Cu4 Ga2 Ga3 Ga4 Ga5 Ga6 Ga7 Ga8 Ga9 Ga10 Ga11 Ga12 Ga13 Ga14 Ga15 Ga16 0.020(1) 0.011(3) 0.014(2) 0.010(1) 0.009(2) 0.018(2) 0.008(1) 0.009(1) 0.008(1) 0.019(1) 0.010(1) 0.016(1) 0.015(1) 0.016(1) 0.013(1) 0.023(1) 0.021(1) 0.011(1) 0.023(1) 0.011(1) 0.011(1) 0.012(1) 0.013(1) 0.013(1) 0.012(1) 0.014(1) 0.015(1) 0.014() 0.020(1) 0.011(2) 0.009(1) 0.010(1) 0.010(2) 0.018(2) 0.009(1) 0.010(1) 0.011(1) 0.021(2) 0.014(1) 0.012(1) 0.015(1) 0.017(1) 0.014(4) 0.024(5) 0.021(1) 0.024(1) 0.011(1) 0.016(1) 0.014(1) 0.016(1) 0.014(1) 0.013(1) 0.014(1) 0.016(1) 0.013(1) 0.012(1) 0.020(1) 0.002(2) 0.009(1) 0.010(1) 0.011(2) 0.018(2) 0.009(1) 0.010(1) 0.009(1) 0.026(2) 0.013(1) 0.014(1) 0.015(1) 0.017(1) 0.014(4) 0.012(1) 0.013(1) 0.023(1) 0.024(1) 0.016(1) 0.014(1) 0.014(1) 0.013(1) 0.014(1) 0.014(1) 0.013(1) 0.016(1) 0.013(1) 0 0 0 0.000(1) 0 0 0.001(1) 0 -0.001(1) 0 0 0 0.001(1) 0 -0.000(4) -0.004(1) -0.002(1) 0 0 -0.001(5) 0 -0.002(1) 0.0024(4) -0.0003(5) -0.0020(5) -0.0026(5) -0.0007(5) -0.0003(4) 0 0 0 0.0003(1) 0 0 -0.002(1) -0.0001(8) 0.001(1) 0 0.0007(7) 0.0003(7) -0.0009(6) 0 0.0002(4) -0.0004(5) 0 0 -0.0034(7) -0.0019(4) 0.0000(4) 0.0005(4) 0.0019(4) 0.0029(4) 0.0023(4) 0.0002(4) -0.0031(4) -0.0016(4) 0 0 0 0.0003(1) 0 0 -0.0019(7) 0 0.0003(6) 0 0 0 -0.0007(5) 0 0.0002(4) -0.0004(5) 0 -0.0046(7) 0 -0.0045(4) 0 0.0016(4) 0.0014(4) -0.0019(5) -0.0007(4) 0.0018(4) -0.0007(4) -0.0005(4) 263 8. Anhang ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Tabelle 8.25: Abstände und Winkel in V11Cu9Ga46 V1 - V2 - V3 - V4 - 264 Ga14 Ga14 Ga14 Ga14 Ga14 Ga14 Ga14 Ga14 Cu1 Cu1 V5 V5 2.496(1) 2.496(1) 2.496(1) 2.496(1) 2.496(1) 2.496(1) 2.496(1) 2.496(1) 2.847(3) 2.847(3) 2.976(3) 2.976(3) 180.00(4) 67.08(5) 73.97(5) 109.54(4) 112.92(5) 106.03(5) 70.46(4) 123.54(3) 56.46(3) 54.77(2) 125.23(2) 112.92(5) 106.03(5) 70.46(4) 67.08(5) 73.97(5) 109.54(4) 56.46(3) 123.54(3) 125.23(2) 54.77(2) 109.54(4) 73.97(5) 180.00(4) 70.46(4) 106.03(5) 56.46(3) 123.54(3) 54.77(2) 125.23(2) 67.08(5) 70.46(4) 180.00(4) 112.92(5) 123.54(3) 56.46(3) 54.77(2) 125.23(2) 106.03(5) 112.92(5) 180.00 56.46(3) 123.54(3) 54.77(2) 125.23(2) 109.54(4) 73.97(5) 123.54(3) 56.46(3) 125.23(2) 54.77(2) 67.08(5) 56.46(3) 123.54(3) 125.23(2) 54.77(2) Ga11 Ga11 Ga11 Ga11 Ga11 Ga11 Ga11 Ga11 Cu3 Cu3 Cu3 Cu3 2.682(1) 2.682(1) 2.682(1) 2.682(1) 2.682(1) 2.682(1) 2.682(1) 2.682(1) 2.851(2) 2.851(2) 2.851(2) 2.851(2) 173.97(5) 64.50(5) 110.22(2) 74.89(5) 107.99(5) 110.22(2) 72.34(5) 56.43(4) 54.26(3) 131.16(4) 118.61(4) 110.22(2) 64.50(5) 110.22(2) 72.34(5) 74.89(5) 107.99(5) 118.61(4) 131.16(4) 54.26(3) 56.43(4) 72.34(5) 107.99(5) 74.89(5) 173.97(5) 110.22(2) 56.43(4) 118.61(4) 131.16(4) 54.26(3) 173.97(5) 110.22(2) 107.99(5) 74.89(5) 54.26(3) 131.16(4) 118.61(4) 56.43(4) 64.50(5) 72.34(5) 110.22(2) 131.16(4) 54.26(3) 56.43(4) 118.61(4) 110.22(2) 173.97(5) 131.16(4) 118.61(4) 56.43(4) 54.26(3) 64.50(5) 118.61(4) 56.43(4) 54.26(3) 131.16(4) Ga16 Ga16 Ga16 Ga16 Ga16 Ga16 Ga3 Ga3 Cu4 Cu4 Cu4 Cu4 2.637(1) 2.637(1) 2.637(1) 2.637(1) 2.637(1) 2.637(1) 2.841(2) 2.841(2) 2.919(1) 2.919(1) 2.919(1) 2.919(1) 65.46(5) 74.02(5) 175.11(5) 110.31(3) 110.31(3) 108.62(3) 71.38(3) 123.67(4) 54.29(3) 119.73(3) 56.63(4) 110.31(3) 110.31(3) 74.02(5) 175.11(5) 71.38(3) 108.62(3) 129.78(3) 119.73(3) 54.29(3) 56.18(4) 110.31(3) 175.11(5) 65.46(5) 71.38(3) 108.62(3) 119.73(3) 56.63(4) 123.67(4) 54.29(3) 65.46(5) 74.02(5) 71.38(3) 108.62(3) 56.63(4) 129.78(3) 56.18(4) 123.67(4) 110.31(3) 108.62(3) 71.38(3) 56.18(4) 123.67(4) 56.63(4) 129.78(3) 108.62(3) 71.38(3) 54.29(3) 56.18(4) 129.78(3) 119.73(3) 180.00(8) 127.70(2) 127.70(2) 52.30(2) 52.30(2) Ga8 Ga8 Ga8 Ga8 Ga10 Ga10 Ga10 Ga10 Cu1 Cu2 Cu2 2.565(2) 2.565(2) 2.565(2) 2.565(2) 2.570(2) 2.570(2) 2.570(2) 2.570(2) 2.713(4) 2.767(2) 2.767(2) 62.81(8) 72.14(8) 103.67(13) 173.32(12) 69.88(4) 115.42(3) 102.71(3) 128.16(6) 57.97(4) 120.78(9) 103.67(13) 72.14(8) 115.42(3) 102.71(3) 173.32(12) 69.88(4) 128.16(6) 120.78(9) 57.97(4) 62.81(8) 102.71(3) 115.42(3) 69.88(4) 173.32(12) 128.16(6) 57.97(4) 120.78(9) 69.88(4) 173.32(12) 102.71(3) 115.42(3) 128.16(6) 120.78(9) 57.97(4) 116.62(13) 65.53(7) 82.08(8) 58.31(7) 123.30(8) 57.78(4) 82.08(8) 65.53(7) 58.31(7) 57.78(4) 123.30(8) 116.62(13) 58.31(7) 57.78(4) 123.30(8) 8. Anhang ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ V5 - Ga11 Ga11 Ga11 Ga11 Ga14 Ga14 Ga14 Ga14 V2 V1 2.523(2) 2.523(2) 2.523(2) 2.523(2) 2.553(2) 2.553(2) 2.553(2) 2.553(2) 2.864(3) 2.976(3) 69.12(8) 118.63(14) 80.53(9) 173.58(13) 112.39(4) 67.70(3) 103.50(4) 59.32(7) 120.68(7) 80.53(9) 118.63(14) 112.39(4) 173.59(13) 103.50(4) 67.70(3) 59.32(7) 120.68(7) 69.12(8) 67.70(3) 103.50(4) 173.58(13) 112.39(4) 59.32(7) 120.68(7) 103.50(4) 67.70(3) 112.39(4) 173.58(13) 59.32(7) 120.68(7) 65.39(8) 105.98(13) 72.05(8) 127.01(7) 52.99(7) 72.05(8) 105.98(13) 65.39(8) 127.01(7) 127.01(7) 52.99(7) 52.99(7) Ga8 Ga8 Ga8 Ga12 Ga12 Ga12 Ga7 Ga7 Ga7 Ga3 2.558(1) 2.558(1) 2.558(1) 2.566(2) 2.566(2) 2.566(2) 2.714(2) 2.714(2) 2.714(2) 2.753(4) 118.98(3) 118.98(3) 158.41(14) 66.56(4) 66.94(4) 123.19(12) 66.74(6) 67.09(6) 95.83(7) 118.98(03) 66.94(4) 158.41(14) 66.56(4) 66.74(6) 67.09(6) 123.19(12) 95.83(7) 66.56(04) 66.94(4) 158.41(14) 67.09(6) 123.19(12) 66.74(6) 95.83(7) 100.49(9) 100.49(9) 78.39(5) 129.91(6) 129.26(6) 62.58(7) 100.49(9) 129.91(6) 129.26(6) 78.39(5) 62.58(7) 129.26(6) 78.39(5) 129.91(6) 62.58(7) 66.09(8) 66.09(8) 140.98(5) Ga13 Ga13 Ga12 Ga12 Ga15 Ga15 Ga9 Ga9 Cu2 Cu3 Cu4 Cu4 2.563(2) 2.563(2) 2.572(2) 2.572(2) 2.608(2) 2.608(2) 2.653(2) 2.653(2) 2.687(3) 2.856(3) 2.937(1) 2.937(1) 67.86(8) 168.64(10) 110.97(4) 101.66(8) 67.90(5) 70.83(5) 112.39(9) 128.96(8) 56.67(6) 54.87(4) 122.50(8) 110.97(4) 168.64(10) 67.90(5) 101.66(8) 112.39(9) 70.83(5) 128.96(8) 56.67(6) 122.50(8) 54.87(4) 67.78(8) 68.22(5) 101.92(9) 118.71(8) 76.81(5) 61.13(6) 132.95(7) 124.03(8) 56.49(4) 101.92(9) 68.22(5) 76.81(5) 118.71(8) 61.13(6) 132.95(7) 56.49(4) 124.03(8) 62.40(7) 170.92(7) 109.23(3) 129.31(8) 124.52(8) 116.75(7) 54.36(4) 109.23(3) 170.92(7) 129.31(8) 124.52(8) 54.36(4) 116.75(7) 78.88(8) 58.16(5) 56.13(6) 54.94(4) 133.80(8) Ga14 Ga13 Ga10 Ga16 Ga15 Ga4 Ga11 Ga9 Ga6 Ga5 2.488(2) 2.545(2) 2.554(2) 2.586(2) 2.604(2) 2.612(2) 2.652(2) 2.674(2) 2.707(2) 2.758(2) 114.83(7) 68.48(5) 158.98(7) 118.60(7) 122.71(7) 66.67(5) 96.36(6) 66.97(5) 65.80(5) 157.17(7) 68.17(6) 123.65(7) 68.63(5) 63.77(5) 94.81(6) 124.68(7) 65.80(6) 100.66(6) 65.19(6) 130.31(7) 100.29(6) 62.50(5) 77.95(6) 130.04(7) 68.60(6) 78.18(6) 99.21(6) 62.70(5) 130.06(8) 128.98(7) 68.61(5) 157.41(7) 95.93(6) 65.83(6) 123.23(7) 129.19(7) 140.88(7) 67.22(6) 65.65(5) 61.51(5) 130.47(7) 79.32(6) Cu1 - Ga14 Ga14 Ga14 Ga14 Ga10 Ga10 Ga10 Ga10 V4 V1 2.546(2) 2.546(2) 2.546(2) 2.546(2) 2.577(2) 2.577(2) 2.577(2) 2.577(2) 2.713(4) 2.847(3) 68.86(7) 109.57(11) 72.28(7) 175.13(8) 102.94(3) 112.70(3) 67.26(3) 125.22(6) 54.78(6) 72.28(7) 109.57(11) 112.70(3) 67.26(3) 175.13(8) 102.94(3) 125.22(6) 54.78(6) 68.86(7) 67.26(3) 112.70(3) 102.94(3) 175.13(8) 125.22(6) 54.78(6) 102.94(3) 175.13(8) 67.26(3) 112.70(3) 125.22(6) 54.78(6) 81.84(8) 65.35(7) 116.16(11) 58.08(6) 121.92(6) 116.16(11) 65.35(7) 81.84(8) 58.08(6) 58.08(6) 121.92(6) 121.92(6) V6 - V7 - V8 - 265 8. Anhang ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Cu2 - Ga10 Ga10 Ga8 Ga8 Ga9 Ga9 Ga12 Ga12 V7 V4 2.584 (2) 2.584 (2) 2.585 (2) 2.585 (2) 2.595 (2) 2.595 (2) 2.676 (2) 2.676 (2) 2.687 (3) 2.767 (2) 81.54(7) 114.05(7) 69.27(4) 63.19(4) 113.39(7) 170.00(7) 106.55(4) 123.39(6) 57.29(6) 69.27(4) 114.05(7) 113.39(7) 63.19(4) 106.55(4) 170.00(7) 123.39(6) 57.29(6) 71.33(7) 175.18(6) 103.85(4) 64.93(5) 101.61(7) 122.13(7) 57.09(6) 103.85(4) 175.18(6) 101.61(7) 64.93(5) 122.13(7) 57.09(7) 80.98(7) 117.01(7) 76.01(4) 60.26(5) 120.45(7) 76.01(4) 117.01(7) 60.26(5) 120.45(7) 64.81(6) 57.31(6) 121.86(8) Cu3 - Ga11 Ga11 Ga13 Ga13 Ga9 Ga9 Ga11 Ga11 V2 V7 2.528(2) 2.528(2) 2.585(2) 2.585(2) 2.598(2) 2.598(2) 2.620(2) 2.620(2) 2.851(2) 2.856(3) 80.36(7) 173.25(6) 106.20(3) 113.67(7) 64.18(4) 117.45(7) 75.88(5) 59.46(4) 122.15(6) 106.20(3) 173.25(6) 64.18(4) 113.67(7) 75.88(5) 117.45(7) 59.46(4) 122.15(6) 67.20(7) 71.37(4) 113.47(7) 63.70(5) 99.29(7) 122.22(6) 55.93(5) 113.47(7) 71.37(4) 99.29(7) 63.70(5) 122.22(6) 55.93(5) 80.87(7) 106.08(3) 170.23(7) 123.60(5) 57.97(5) 170.23(7) 106.08(3) 123.60(5) 57.97(5) 66.22(6) 58.53(4) 119.57(6) Cu4 - Ga3 Ga16 Ga15 Ga13 Ga9 Ga12 Ga16 Ga16 V3 V7 2.540(2) 2.548(2) 2.550(2) 2.556(2) 2.591(2) 2.627(2) 2.628(2) 2.647(2) 2.919(1) 2.937(1) 77.96(5) 105.03(6) 173.27(7) 108.93(5) 64.78(6) 76.50(5) 118.18(6) 62.26(5) 119.43(8) 176.75(7) 108.05(6) 64.38(4) 112.41(6) 113.49(6) 75.32(5) 57.20(3) 121.31(6) 68.90(5) 113.08(5) 68.25(5) 68.77(4) 104.05(5) 125.20(5) 56.22(5) 71.95(5) 109.44(5) 103.20(5) 67.08(4) 123.33(5) 55.10(6) 76.94(4) 172.96(7) 107.64(6) 121.52(5) 56.93(5) 109.77(6) 172.26(6) 127.03(5) 54.71(6) 65.44(5) 56.47(3) 124.83(6) Ga1 - Ga7 Ga7 Ga7 Ga7 Ga7 Ga7 Ga7 Ga7 Ga7 Ga7 Ga7 Ga7 2.957(2) 2.957(2) 2.957(2) 2.957(2) 2.957(2) 2.957(2) 2.957(2) 2.957(2) 2.957(2) 2.957(2) 2.957(2) 2.957(2) 93.53(6) 180.00(6) 119.94(0) 60.06(0) 119.94(0) 86.47(6) 60.06(0) 60.06(0) 119.94(0) 60.06(0) 119.94(0) 86.47(6) 60.06(0) 60.06(0) 60.06(0) 180.00(6) 119.94(0) 60.06(0) 119.94(0) 119.94(0) 119.94(0) 60.06(0) 119.94(0) 60.06(0) 93.53(6) 119.94(0) 119.94(0) 60.06(0) 119.94(0) 60.06(0) 119.94(0) 93.53(6) 119.94(0) 180.00(6) 60.06(0) 60.06(0) 86.47(6) 119.94(0) 60.06(0) 119.94(0) 60.06(0) 86.47(6) 180.00(6) 119.94(0) 93.53(6) 119.94(0) 86.47(6) 119.94(0) 119.94(0) 180.00(6) 60.06(0) 60.06(0) 119.94(0) 60.06(0) 60.06(0) 60.06(0) Ga2 - Ga5 Ga5 Ga5 Ga5 Ga6 Ga6 Ga6 Ga6 Ga4 Ga4 Ga4 Ga4 2.852(2) 2.852(2) 2.852(2) 2.852(2) 2.912(2) 2.912(2) 2.912(2) 2.912(2) 3.091(2) 3.091(2) 3.091(2) 3.091(2) 95.10(6) 117.10(4) 117.10(4) 62.77(2) 179.77(5) 62.77(2) 85.13(4) 58.55(2) 121.45(2) 121.45(2) 58.55(2) 117.10(4) 117.10(4) 62.77(2) 85.13(4) 62.77(2) 179.77(5) 121.45(2) 58.55(2) 58.55(2) 121.45(2) 95.10(6) 85.13(4) 62.77(2) 179.77(5) 62.77(2) 58.55(2) 121.45(2) 58.55(2) 121.45(2) 179.77(5) 62.77(2) 85.13(4) 62.77(2) 121.45(2) 58.55(2) 121.45(2) 58.55(2) 117.36(3) 94.64(6) 117.36(3) 58.68(2) 121.32(2) 58.68(2) 121.32(2) 117.36(3) 94.64(6) 121.32(2) 58.68(2) 58.68(2) 121.32(2) 117.36(3) 121.32(2) 58.68(2) 121.32(2) 58.68(2) 266 8. Anhang ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Ga3 - Cu4 Cu4 Cu4 V6 Ga12 Ga12 Ga12 V3 Ga16 Ga16 Ga16 Ga8 2.540(2) 2.540(2) 2.540(2) 2.753(4) 2.769(2) 2.769(2) 2.769(2) 2.841(2) 3.200(2) 3.200(2) 3.200(2) 3.944(2) 103.93(6) 103.93(6) 114.57(5) 59.13(4) 126.60(4) 128.63(4) 65.43(5) 52.99(4) 51.13(4) 116.77(8) 154.74(7) 103.93(6) 114.57(5) 126.60(4) 128.63(4) 59.13(4) 65.43(5) 51.13(4) 116.77(8) 52.99(4) 91.90(4) 114.57(5) 128.63(4) 59.13(4) 126.60(4) 65.43(5) 116.77(8) 52.99(4) 51.13(4) 90.87(4) 55.44(4) 55.44(4) 55.44(4) 180.00(5) 128.66(4) 128.66(4) 128.66(4) 40.19(3) 91.00(5) 91.00(5) 124.56(4) 91.85(3) 91.90(3) 175.90(7) 95.63(6) 91.00(5) 124.56(4) 175.90(7) 91.85(3) 91.90(3) 45.80(3) 124.56(4) 91.90(3) 175.90(7) 91.85(3) 45.51(4) Ga4 - V8 V8 Ga13 Ga13 Ga5 Ga5 Ga15 Ga15 Ga6 Ga6 Ga2 Ga16 2.612(2) 2.612(2) 2.908(1) 2.908(1) 2.914(1) 2.914(1) 2.940(1) 2.940(1) 2.945(1) 2.945(1) 3.091(2) 3.277(2) 152.68(9) 113.07(5) 54.60(4) 59.59(4) 139.98(5) 55.57(4) 112.50(5) 57.93(4) 141.61(5) 103.66(4) 50.55(4) 54.60(4) 113.07(5) 139.98(5) 59.59(4) 112.50(5) 55.57(4) 141.61(5) 57.93(4) 103.66(4) 102.13(6) 133.25(7) 160.86(5) 59.44(4) 59.18(3) 101.84(4) 99.26(4) 105.29(3) 113.37(4) 81.89(4) 59.44(4) 160.86(5) 101.84(4) 59.18(3) 105.29(3) 99.26(4) 113.37(4) 55.02(4) 113.27(8) 107.43(3) 97.25(4) 61.66(5) 83.45(4) 56.64(4) 102.20(4) 97.25(4) 107.43(3) 83.45(4) 61.66(5) 56.64(4) 141.17(5) 134.47(7) 58.76(4) 158.89(4) 112.77(4) 55.81(4) Ga5 - V8 V8 Ga2 Ga14 Ga14 Ga13 Ga13 Ga4 Ga4 Ga6 Ga6 Ga11 2.758(2) 2.758(2) 2.852(2) 2.858(2) 2.858(2) 2.886(2) 2.886(2) 2.914(1) 2.914(1) 3.003(2) 3.003(2) 3.454(2) 146.82(9) 106.40(5) 52.54(4) 108.45(6) 110.85(6) 53.55(4) 54.76(4) 149.39(6) 55.86(4) 143.66(7) 97.93(6) 106.40(5) 108.45(6) 52.54(4) 53.55(4) 110.85(6) 149.39(6) 54.76(4) 143.66(7) 55.86(4) 48.99(4) 113.47(5) 113.47(5) 121.78(5) 121.78(5) 64.81(4) 64.81(4) 59.59(4) 59.59(4) 155.19(2) 57.69(5) 124.62(6) 95.16(4) 101.69(2) 157.87(5) 58.61(4) 99.62(6) 77.69(5) 95.16(4) 124.62(6) 157.87(5) 101.69(2) 99.62(6) 58.61(4) 52.19(3) 59.42(6) 104.25(6) 60.18(4) 162.75(6) 104.37(3) 50.38(4) 60.18(4) 104.25(6) 104.37(3) 162.75(6) 76.88(5) Ga6 - V8 V8 Ga14 Ga14 Ga15 Ga15 Ga2 Ga4 Ga4 Ga5 Ga5 Ga10 2.707(2) 2.707(2) 2.872(2) 2.872(2) 2.888(2) 2.888(2) 2.912(2) 2.945(1) 2.945(1) 3.003(2) 3.003(2) 3.311(2) 147.59(9) 52.86(4) 111.05(6) 109.28(6) 55.37(4) 106.12(5) 148.14(6) 54.85(4) 57.50(4) 143.99(7) 48.96(4) 111.04(6) 52.86(4) 55.37(4) 109.28(6) 106.12(5) 54.85(4) 148.14(6) 143.99(7) 57.50(4) 98.65(6) 60.18(5) 128.69(7) 98.98(4) 111.30(5) 158.12(5) 100.60(2) 58.18(4) 100.11(6) 54.07(4) 98.98(4) 128.69(7) 111.30(5) 100.60(2) 158.12(5) 100.11(6) 58.18(4) 80.47(5) 55.79(5) 120.01(5) 60.53(4) 101.67(5) 159.90(6) 106.45(3) 77.74(5) 120.01(5) 101.67(5) 60.53(4) 106.45(3) 159.90(6) 52.74(4) 63.69(4) 63.69(4) 57.64(4) 57.64(4) 154.88(2) 267 8. Anhang ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Ga7 - V6 V6 Ga8 Ga8 Ga8 Ga8 Ga1 Ga7 Ga7 Ga7 Ga7 Ga12 2.714(2) 2.714(2) 2.903(2) 2.903(2) 2.916(2) 2.916(2) 2.957(2) 2.960(2) 2.960(2) 2.960(2) 2.960(2) 3.341(2) 148.26(10) 114.43(6) 54.05(3) 53.90(3) 106.99(6) 105.68(5) 148.76(8) 56.96(4) 56.96(4) 140.46(8) 99.67(6) 54.05(3) 114.43(6) 106.99(6) 53.90(3) 105.68(5) 56.96(4) 148.76(8) 140.46(8) 56.96(4) 48.86(5) 62.68(5) 128.62(6) 98.48(5) 115.79(5) 59.65(5) 104.59(8) 164.46(8) 104.57(4) 53.29(4) 98.48(5) 128.62(6) 115.79(5) 104.59(8) 59.65(5) 104.57(4) 164.46(8) 81.30(5) 54.54(5) 115.38(5) 155.93(8) 104.24(4) 59.21(5) 96.61(8) 77.89(5) 115.38(5) 104.24(4) 155.93(8) 96.61(8) 59.21(5) 52.91(4) 59.97(0) 59.97(0) 59.97(0) 59.97(0) 154.54(2) Ga8 - V6 V4 Cu2 Ga8 Ga12 Ga12 Ga7 Ga7 Ga10 Ga8 Ga15 Ga3 2.558(1) 2.565(2) 2.590(2) 2.673(2) 2.813(2) 2.827(2) 2.903(2) 2.916(2) 2.941(2) 3.020(2) 3.858(2) 3.944(2) 167.99(10) 115.10(6) 119.88(5) 56.90(5) 56.71(5) 59.20(6) 59.01(6) 135.72(8) 115.49(5) 99.36(7) 43.98(7) 64.94(5) 58.60(4) 133.27(6) 123.77(5) 108.93(7) 115.05(7) 55.15(7) 53.93(4) 92.60(6) 146.38(7) 123.53(4) 129.75(6) 59.00(5) 93.12(5) 153.49(6) 55.27(5) 54.34(4) 92.95(4) 92.72(4) 91.99(3) 174.87(4) 103.74(4) 62.73(3) 91.07(3) 90.00 90.22(2) 136.57(2) 88.88(6) 113.24(5) 71.31(5) 94.35(5) 171.90(4) 48.58(4) 44.59(3) 71.31(5) 112.88(5) 93.92(5) 88.46(3) 94.15(4) 44.58(3) 61.15(6) 147.76(6) 58.66(3) 158.19(5) 96.46(4) Ga9 - Cu4 Cu2 Cu3 V7 V8 Ga10 Ga11 Ga16 Ga13 Ga12 Ga9 Ga13 2.591(2) 2.595(2) 2.598(2) 2.653(2) 2.674(2) 2.714(2) 2.724(2) 2.738(2) 3.023(2) 3.246(2) 3.370(2) 3.843(2) 104.86(6) 107.35(6) 68.13(5) 114.07(6) 125.40(5) 128.26(6) 57.04(4) 53.49(4) 52.02(4) 118.67(3) 92.90(4) 98.90(4) 61.58(6) 114.70(6) 58.21(5) 125.14(6) 130.37(6) 114.75(5) 53.11(5) 49.51(3) 155.57(5) 65.90(6) 115.40(6) 125.56(6) 56.65(5) 129.85(6) 54.12(4) 116.37(5) 49.57(4) 91.45(5) 176.27(7) 119.72(6) 122.55(6) 125.17(6) 53.20(5) 50.47(6) 50.56(4) 142.37(6) 56.58(5) 58.85(5) 57.07(4) 130.50(6) 128.08(6) 127.22(4) 41.30(4) 94.62(4) 93.05(4) 172.90(5) 89.60(5) 90.05(4) 97.85(4) 93.85(5) 90.54(5) 173.01(5) 88.86(3) 45.62(4) Ga10 - V8 V4 Cu1 Cu2 Ga9 Ga15 Ga10 Ga14 Ga8 Ga6 Ga10 Ga15 2.554(2) 2.570(2) 2.577(2) 2.584(2) 2.714(2) 2.779(2) 2.782(2) 2.837(2) 2.941(2) 3.311(2) 3.375(2) 3.904(2) 173.48(8) 110.21(7) 119.43(6) 60.92(5) 58.28(5) 118.24(4) 54.65(4) 131.23(6) 53.09(4) 129.23(4) 87.32(5) 63.61(8) 64.94(5) 123.51(6) 124.19(6) 57.23(4) 119.36(8) 54.97(7) 122.21(5) 48.96(4) 91.46(4) 98.31(5) 121.84(6) 136.00(6) 57.33(3) 55.86(6) 118.56(7) 82.75(5) 49.08(4) 97.96(4) 58.60(5) 124.88(6) 122.17(4) 119.04(6) 55.45(5) 171.88(6) 49.23(3) 140.86(6) 91.07(5) 178.74(3) 87.76(4) 92.32(4) 114.01(4) 89.95(4) 134.85(5) 89.17(3) 102.45(5) 84.77(5) 55.78(4) 171.28(3) 43.79(4) 90.98(3) 88.93(3) 65.16(2) 90.00 45.38(2) 268 8. Anhang ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Ga11- V5 Cu3 Cu3 V8 V2 Ga9 Ga13 Ga14 Ga11 Ga11 Ga11 Ga5 2.523(2) 2.528(2) 2.620(2) 2.652(2) 2.682(2) 2.724(2) 2.747(2) 2.828(1) 2.863(2) 3.166(2) 3.261(2) 3.454(2) 99.55(6) 110.19(6) 110.27(8) 66.69(7) 123.31(6) 134.37(6) 56.65(7) 55.44(4) 120.22(7) 49.73(4) 82.73(6) 103.68(5) 118.70(6) 66.28(4) 59.17(5) 125.64(6) 120.20(6) 123.86(4) 53.38(5) 49.82(3) 169.88(6) 113.43(6) 65.04(4) 125.24(5) 57.53(5) 135.18(6) 56.89(3) 50.73(5) 117.47(4) 84.58(5) 174.89(6) 59.63(4) 56.22(5) 53.88(4) 117.20(4) 129.49(4) 129.08(4) 51.70(4) 125.40(5) 122.56(5) 123.33(4) 57.75(3) 53.83(2) 52.56(3) 123.26(4) 89.25(4) 87.75(4) 176.45(3) 89.81(4) 91.14(3) 111.33(4) 99.05(4) 89.98(3) 87.19(5) 173.57(3) 54.03(4) Ga12 - V6 V7 Cu4 Cu2 Ga3 Ga8 Ga8 Ga12 Ga15 Ga9 Ga7 Ga8 2.569(2) 2.572(2) 2.627(2) 2.676(2) 2.769(2) 2.813(2) 2.827(2) 2.868(3) 2.905(2) 3.246(2) 3.341(2) 3.947(2) 172.13(8) 118.04(8) 111.85(7) 61.97(7) 56.54(4) 56.36(4) 117.27(7) 130.07(6) 127.54(5) 52.74(7) 85.26(6) 68.80(5) 61.56(6) 124.82(6) 124.30(7) 117.53(6) 56.11(4) 56.48(5) 52.71(5) 120.29(5) 91.38(5) 101.65(6) 56.08(5) 122.10(6) 119.95(6) 124.67(4) 54.62(4) 51.03(4) 170.69(5) 139.81(5) 124.57(5) 135.42(6) 56.07(5) 57.59(3) 118.01(6) 50.88(4) 82.39(5) 98.33(5) 89.92(4) 89.62(4) 177.80(3) 90.74(5) 87.54(5) 114.71(5) 132.49(4) 102.80(6) 88.01(3) 84.84(5) 172.59(6) 55.79(4) 42.59(4) 91.54(3) 172.35(6) 84.15(4) 55.41(4) 100.14(5) Ga13 - V8 2.545(2) Cu4 2.556(2) V7 2.563(2) Cu3 2.585(2) Ga11 2.747(2) Ga13 2.861(2) Ga16 2.876(2) Ga5 2.886(2) Ga15 2.888(2) Ga4 2.908(1) Ga9 3.023(2) Ga9 3.843(2) 113.77(6) 169.43(7) 118.43(7) 60.01(5) 118.46(4) 56.58(5) 60.65(4) 116.35(6) 56.77(4) 134.51(6) 43.89(4) 70.04(5) 108.82(6) 129.25(6) 125.88(4) 57.98(4) 150.35(6) 55.45(4) 91.57(5) 54.56(4) 93.06(5) 67.40(6) 126.10(7) 56.07(4) 128.01(6) 110.87(5) 56.79(6) 114.27(7) 55.97(5) 146.66(6) 58.77(5) 56.40(3) 128.75(5) 97.99(5) 124.13(6) 157.97(6) 54.52(5) 93.08(4) 90.02(3) 90.36(5) 75.59(5) 174.48(6) 114.45(5) 92.42(5) 45.13(3) 173.60(3) 60.29(3) 88.42(3) 105.05(3) 94.83(3) 135.04(2) 113.68(5) 90.61(4) 69.04(4) 91.54(4) 45.31(4) Ga14 - V8 V1 Cu1 V5 Ga14 Ga11 Ga10 Ga5 Ga6 Ga14 Ga14 Ga9 170.20(6) 113.42(8) 114.82(8) 120.55(4) 59.46(5) 56.86(5) 61.66(4) 60.17(5) 117.79(4) 136.39(4) 43.67(4) 68.76(6) 72.24(7) 56.46(3) 127.87(4) 125.51(5) 112.07(4) 110.66(4) 54.77(2) 53.01(2) 145.68(4) 107.76(5) 125.22(6) 125.52(6) 56.88(6) 155.20(5) 92.82(4) 55.57(3) 53.86(3) 90.25(6) 57.31(4) 55.64(7) 126.00(6) 95.51(5) 158.35(6) 127.01(7) 53.97(4) 90.01(6) 91.06(3) 176.11(3) 61.15(3) 105.39(4) 90.00 90.00 136.05(2) 89.75(4) 74.81(5) 117.27(4) 177.18(3) 92.62(3) 45.01(3) 115.46(4) 70.89(5) 89.02(3) 93.76(3) 44.80(3) 2.488(2) 2.496(1) 2.546(2) 2.553(2) 2.758(2) 2.828(1) 2.837(2) 2.858(2) 2.872(2) 2.879(2) 3.003(2) 3.849(1) 269 8. Anhang ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Ga15 - Cu4 V8 V7 Ga15 Ga10 Ga6 Ga13 Ga12 Ga16 Ga4 Ga8 Ga10 2.550(2) 2.604(2) 2.608(2) 2.702(2) 2.779(2) 2.888(2) 2.888(2) 2.905(2) 2.925(2) 2.940(1) 3.858(2) 3.904(2) 111.55(6) 69.43(5) 128.22(3) 128.79(6) 151.10(7) 55.65(4) 57.14(4) 56.88(4) 90.95(5) 93.75(5) 152.48(5) 167.21(8) 118.65(4) 56.52(5) 58.80(4) 113.96(6) 136.60(6) 55.40(4) 55.82(4) 99.76(5) 87.08(5) 58.80(4) 133.56(7) 113.81(5) 55.31(6) 55.30(5) 126.15(5) 111.84(6) 92.85(6) 96.97(5) 90.83(3) 62.11(3) 91.58(3) 91.64(3) 173.30(3) 106.49(3) 89.78(2) 45.38(2) 71.48(5) 169.89(6) 95.90(5) 87.79(4) 110.07(4) 49.39(3) 45.45(4) 101.09(6) 149.80(6) 111.28(5) 60.71(4) 114.27(5) 55.98(4) 93.84(5) 88.68(5) 59.85(5) 140.42(5) 136.10(5) Ga16 - Cu4 V8 Cu4 V3 Cu4 Ga9 Ga16 Ga13 Ga15 Ga16 Ga3 Ga4 2.547(2) 2.586(2) 2.628(2) 2.637(1) 2.647(2) 2.738(2) 2.852(2) 2.876(2) 2.925(2) 3.175(2) 3.200(2) 3.277(2) 118.75(6) 101.23(7) 68.51(4) 104.66(5) 58.58(4) 125.74(4) 121.84(6) 118.34(6) 53.77(4) 50.91(4) 169.87(5) 109.65(6) 172.74(6) 109.46(6) 60.22(4) 115.48(4) 55.25(5) 56.00(5) 130.37(5) 126.49(7) 51.27(4) 67.34(4) 112.95(5) 123.60(6) 57.60(5) 136.68(6) 54.35(4) 119.98(3) 50.51(4) 82.48(4) 67.07(4) 127.02(4) 57.27(2) 121.95(5) 121.65(4) 52.99(3) 57.28(4) 121.48(4) 122.79(6) 56.96(5) 54.94(4) 136.46(6) 50.92(4) 124.04(6) 82.20(4) 175.64(3) 86.38(5) 87.57(5) 91.00(4) 89.01(5) 111.49(4) 90.37(5) 90.34(5) 91.66(6) 94.51(5) 64.21(4) 270 8. Anhang ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Tab. 8.26: Angaben zur Strukturbestimmung von Pt2Sn2Zn3 Rel. Molmasse Kristallsystem Raumgruppe Zellabmessungen Zellvolumen Anzahl der Formeleinheiten Röntgendichte Messtemperatur Röntgenstrahlung F ( 0 0 0) Meßbereich max. 2θ Scantyp Scanbreite Max. Messzeit pro Reflex Messwerte davon unbeobachtet unabhängige Reflexe davon mit I > 0 davon mit I > 2σ(I) Kristallform Kristallabmessungen Absorptionskorrektur Interner Standard Schwächungskoeffizient Extinktionskoeffizient (SHELX97) Restelektronendichte Wichtungsfunktion Zahl der Parameter R- Werte 832.70 g/mol hexagonal P 63 / m m c (Nr. 194) a = 4.3367(5) Å c = 15.532(3) Å V = 252.97 Å3 2 10.813 g/cm3 20°C Mo Kα1 692.0 h, k, l ±8; ±8; ±29 85° Ω/ 2θ 0.70° + 0.35 * tan θ 45s 7255 547 402 402 324 hexagonales Prisma 0.1 * 0.1 * 0.05 mm3 empirisch; Ψ - scan 0.0994 (0.0302) 78.59 mm-1 0,020185 + 3.29; -1.49 (0.49) e/ Å3 1 / [σ2 * F02 + (0,0260 * P) 2 + 1.00*P] mit P = (F02 + 2 * Fc2) / 3 14 R1(F) = 0.0250; wR2(I) = 0.0591 271 8. Anhang ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Tab. 8.27: Ortskoordinaten und Auslenkungsparameter in Pt2Sn2Zn3 272 Atom Wyck. Symm. x y z Ueq Pt1 Pt2 Zn1 Zn2 Sn 2a 2c 2d 4e 4f -3m. -6m2 -6m2 3m. 3m. 0 1/3 2/3 0 1/3 0 2/3 1/3 0 2/3 0 1/4 1/4 0.33197(7) 0.42802(4) 0.0134(1) 0.0146(1) 0.0204(3) 0.0168(2) 0.0139(1) Atom U11 U22 U33 U12 U13 U23 Pt1 Pt2 Zn1 Zn2 Sn 0.0135(1) 0.0142(1) 0.0139(4) 0.0182(3) 0.0134(1) 0.0135(1) 0.0142(1) 0.0139(4) 0.0182(3) 0.0134(2) 0.0133(2) 0.0155(2) 0.0333(9) 0.0142(4) 0.0150(2) 0.0067(1) 0.0071(1) 0.0069(2) 0.0090(2) 0.0067(1) 0 0 0 0 0 0 0 0 0 0 8. Anhang ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Tab. 8.28: Abstände (in Å) und Winkel (in °) in Pt2Sn2Zn3 Pt1 Zn2 Zn2 Sn Sn Sn Sn Sn Sn 2.6098(1) 2.6098(1) 2.7420(4) 2.7420(4) 2.7420(4) 2.7420(4) 2.7420(4) 2.7420(4) 180.00 65.94(1) 114.06(1) 65.94(1) 114.06(1) 114.06(1) 65.94(1) 114.06(1) 65.94(1) 114.06(1) 65.94(1) 65.94(1) 114.06(1) 180.00(2) 104.52(1) 75.48(1) 75.48(1) 104.52(1) 75.48(1) 104.52(1) 104.52(1) 75.48(1) 180.00(2) 75.48(1) 104.52(1) 104.52(1) 75.48(1) 180.00(2) Zn1 Zn1 Zn1 Sn Sn Zn2 Zn2 Zn2 Zn2 Zn2 Zn2 2.5038(3) 2.5038(3) 2.5038(3) 2.7650(8) 2.7650(8) 2.8089(6) 2.8089(6) 2.8089(6) 2.8089(6) 2.8089(6) 2.8089(6) 120.00 120.00 90.00 90.00 63.53(1) 63.53(1) 63.53(1) 153.05(2) 63.53(1) 153.05(2) 120.00 90.00 90.00 63.53(1) 63.53(1) 153.05(2) 63.53(1) 153.05(2) 63.53(1) 90.00 90.00 153.05(2) 153.05(2) 63.53(1) 63.53(1) 63.53(1) 63.53(1) 180.00 63.05(2) 116.95(2) 116.95(2) 63.05(2) 63.05(2) 116.95(2) 116.95(2) 63.05(2) 63.05(2) 116.95(2) 116.95(2) 63.05(2) 53.91(4) 127.06(1) 101.06(3) 101.06(3) 127.06(1) 101.06(3) 127.06(1) 127.06(1) 101.06(3) Zn1 Pt2 Pt2 Pt2 Zn2 Zn2 Zn2 Zn2 Zn2 Zn2 2.5038(3) 2.5038(3) 2.5038(3) 2.8089(6) 2.8089(6) 2.8089(6) 2.8089(6) 2.8089(6) 2.8089(6) 120.00 120.00 63.53(1) 63.53(1) 153.05(2) 63.53(1) 63.53(1) 153.05(2) 120.00 63.53(1) 63.53(1) 63.53(1) 153.05(2) 153.05(2) 63.53(1) 153.05(2) 153.05(2) 63.53(1) 63.53(1) 63.53(1) 63.53(1) 53.91(4) 101.06(3) 127.06(1) 101.06(3) 127.06(1) 127.06(1) 101.06(3) 127.06(1) 101.06(3) 127.06(1) 101.06(3) 53.91(4) 53.91(4) 101.06(3) Zn2 Zn2 Pt1 Zn1 Pt2 Zn1 Pt2 Pt2 Zn1 Sn Sn Sn 2.5463(2) 2.6098(1) 2.8089(6) 2.8089(6) 2.8089(6) 2.8089(6) 2.8089(6) 2.8089(6) 2.9145(8) 2.9145(8) 2.9145(8) 180.00 63.05(2) 63.05(2) 63.05(2) 63.05(2) 63.05(2) 63.05(2) 120.79(2) 120.79(2) 120.79(2) 116.95(2) 116.95(2) 116.95(2) 116.95(2) 116.95(2) 116.95(2) 59.21(2) 59.21(2) 59.21(2) 126.09(4) 101.06(3) 52.94(1) 52.94(1) 101.06(3) 176.16(4) 81.32(1) 81.32(1) 52.94(1) 101.06(3) 101.06(3) 52.94(1) 57.74(2) 127.94(1) 127.94(1) 52.94(1) 126.09(4) 101.06(3) 81.32(1) 176.16(4) 81.32(1) 101.06(3) 126.09(4) 127.94(1) 127.94(1) 57.74(2) 52.94(1) 127.94(1) 57.74(2) 127.94(1) Sn 2.7420(4) 2.7420(4) 2.7420(4) 2.7650(8) 2.9145(8) 2.9145(8) 2.9145(8) 3.3568(9) 3.3568(9) 3.3568(9) 104.52(1) 104.52(1) 114.06(1) 126.93(1) 54.85(2) 126.93(1) 52.26(1) 52.26(1) 114.17(3) 104.52(1) 114.06(1) 126.93(1) 126.93(1) 54.85(2) 52.26(1) 114.17(3) 52.26(1) 114.06(1) 54.85(2) 126.93(1) 126.93(1) 114.17(3) 52.26(1) 52.26(1) 59.21(2) 59.21(2) 59.21(2) 131.77(2) 131.77(2) 131.77(2) 96.14(3) 96.14(3) 169.02(4) 91.18(2) 91.18(2) 96.14(3) 91.18(2) 91.18(2) 169.02(4) 91.18(2) 169.02(4) 91.18(2) Pt2 Pt1 Pt1 Pt1 Pt2 Zn2 Zn2 Zn2 Sn Sn Sn 273 8. Anhang ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Tab. 8.29: Angaben zur Strukturbestimmung von Mo3Ga1.9Si4.1 Rel. Molmasse Kristallsystem Raumgruppe Zellabmessungen Zellvolumen Anzahl der Formeleinheiten Röntgendichte Meßtemperatur Diffraktometer Röntgenstrahlung F ( 0 0 0) Meßbereich h, k, l max. 2θ Mess- / Scanmodus I / σ(I)-Verhältnis Meßwerte davon unbeobachtet unabhängige Reflexe davon mit I > 0 davon mit I > 2σ(I) Kristallform Kristallabmessungen Absorptionskorrektur Interner Standard Schwächungskoeffizient Extinktionskoeffizient (SHELX98) Restelektronendichte Wichtungsfunktion Zahl der Parameter R- Werte 274 328.39 g/mol hexagonal P 62 2 2(Nr. 180) a = 4.7110(1) Å c = 6.5371(6) V = 125.64 Å3 3 11.486 g/cm3 20°C STOE IPDS Mo Kα1 Graphit-Monochromator 387 ±8; ±8; ±12 85° 100 Platten à 2 min bei 2° ϕ-Inkrement 6.0 2128 9 310 310 310 hexagonale Bipyramide 0.15 * 0.15 * 0.15 mm3 numerisch; Equivalent-Methode 0.0806 (0.0315) 30.83 mm-1 0,01902 + 1.99; -1.28 (0.35) e/ Å3 1 / [σ2 * F02 + (0,0169 * P) 2] + 0.03*P mit P = (F02 + 2 * Fc2) / 3 12 R1(F) = 0.0266; wR2(I) = 0.0569 8. Anhang ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Tab. 8.30: Ortskoordinaten und Auslenkungsparameter in Mo3Ga1.9Si4.1 Atom Wyck. Symm. x y z Ueq Mo Ga* Si* 3c 6i 6i 1/2 0.1659(8) 0.1613(9) 0 0.332(2) 0.323(2) 0 0 0 0.0043(1) 0.0035(3) 0.0035(3) Atom U11 U22 U33 U12 U13 U23 Mo Ga* Si* 0.0029(2) 0.0026(3) 0.0026(3) 0.0032(2) 0.0040(4) 0.0040(4) 0.0068(2) 0.0044(3) 0.0044(3) 0.0016(1) 0.0020(2) 0.0020(2) 0 -0.0002(1) -0.0002(1) 0 0 0 222 ..2 ..2 * Mischbesetzung: 31% Gallium, 69% Silizium Tab. 8.31: Abstände und Winkel in Mo3Ga1.9Si4.1 Si - Si Si Mo Mo Si Mo Mo Mo Si Si 2.561(1) 2.561(1) 2.572(3) 2.573(3) 2.690(2) 2.712(1) 2.713(1) 2.735(1) 2.734(1) 2.736(1) 149.55(1) 125.71(1) 63.80(1) 74.77(1) 58.32(1) 105.35(0) 105.24(1) 75.04(2) 121.68(1) 63.79(01) 125.68(1) 74.77(1) 105.36(0) 58.32(1) 105.22(1) 121.68(1) 75.02(2) 148.66(3) 105.68(2) 74.72(0) 122.10(1) 74.33(2) 57.89(1) 104.89(2) 105.66(2) 122.11(1) 74.71(0) 74.33(2) 104.90(2) 57.88(1) 60.28(1) 60.26(1) 179.98(1) 120.56(3) 120.52(3) 120.55(3) 119.74(1) 60.28(1) 179.20(4) 119.72(1) 179.17(4) 60.26(1) Mo - Si Si Si Si Si Si Si Si Si Si Mo Mo 2.572(3) 2.572(3) 2.573(3) 2.573(3) 2.712(1) 2.712(1) 2.713(1) 2.713(1) 2.735(1) 2.735(1) 3.209(1) 3.209(1) 64.21(1) 124.86(3) 149.69(2) 57.90(1) 122.10(1) 74.20(2) 105.80(2) 105.15(1) 74.85(1) 55.15(2) 155.67(1) 149.69(2) 124.86(3) 122.10(1) 57.90(1) 105.80(2) 74.20(2) 74.85(1) 105.15(1) 54.62(1) 103.84(0) 64.23(1) 74.20(2) 105.80(2) 57.88(1) 122.12(1) 74.84(1) 105.16(1) 155.69(1) 55.14(2) 105.80(2) 74.20(2) 122.12(1) 57.88(1) 105.16(1) 74.84(1) 103.83(1) 54.63(1) 180.00 59.45(3) 120.55(3) 119.74(1) 60.26(1) 90.20(1) 129.34(1) 120.55(3) 59.45(3) 60.26(1) 119.74(1) 89.80(1) 50.66(1) 180.00(1) 60.28(1) 119.72(1) 129.34(1) 90.20(1) 275 8. Anhang ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Tab. 8.32: Angaben zur Strukturbestimmung von Cu33Ga16 Rel. Molmasse Kristallsystem Raumgruppe Zellabmessungen 196,72 g/mol kubisch P 4 –3 m (Nr. 215) a = 8.668(1) Å Zellvolumen Anzahl der Formeleinheiten Röntgendichte Meßtemperatur Diffraktometer Röntgenstrahlung F ( 0 0 0) Meßbereich max. 2θ Mess- / Scanmodus I / σ(I)-Verhältnis Meßwerte davon unbeobachtet unabhängige Reflexe davon mit I > 0 davon mit I > 2σ(I) Kristallform Kristallabmessungen V = 651.24 Å3 1 8.677 g/cm3 20°C STOE IPDS I Mo Kα1 Graphit-Monochromator 1540 h, k, l ±13; ±13; ±131 66° 100 Platten à 15 min bei 2° ϕ-Inkrement 4.0 9324 25 509 509 407 Würfel 0.05 * 0.05 * 0.05 mm3 Absorptionskorrektur numerisch; Equivalent-Methode Interner Standard Schwächungskoeffizient Extinktionskoeffizient (SHELX97) Restelektronendichte Wichtungsfunktion 0.2438 (0.0651) 44.85 mm-1 0,002492 + 5.73; -1.66 (0.56) e/ Å3 1 / [σ2 * F02 + (0,0684 * P) 2 + 26.78 * P] mit P = (F02 + 2 * Fc2) / 3 20 R1(F) = 0.0856; wR2(I) = 0.2150 Zahl der Parameter R- Werte 276 8. Anhang ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Tab. 8.33: Ortskoordinaten und Auslenkungsparamter in Cu33Ga16 Atom Wyck. Symm. x y z Ueq Cu1 Cu2 Cu3 Cu4 Cu5 Ga1 Ga2 Ga3 1a 4e 4e 12i 12i 4e 6f 6g -43m .3m .3m ..m ..m .3m 2.mm 2.mm 0 0.8280(4) 0.3315(4) 0.0389(4) 0.5278(4) 0.6280(4) 0.6581(4) 0.1426(4) 0 0.8280(4) 0.3315(4) 0.3089(3) 0.8205(3) 0.6280(4) 0 1/2 0 0.8280(4) 0.3315(4) 0.3089(3) 0.8205(3) 0.6280(4) 0 1/2 0.038(2) 0.029(1) 0.029(1) 0.031(1) 0.026(1) 0.030(1) 0.027(1) 0.027(1) Atom U11 U22 U33 U12 U13 U23 Cu1 Cu2 Cu3 Cu4 Cu5 Ga1 Ga2 Ga3 0.038(3) 0.030(1) 0.029(1) 0.027(1) 0.026(2) 0.030(1) 0.034(2) 0.015(1) 0.038(3) 0.023(1) 0.029(1) 0.034(9) 0.026(1) 0.030(1) 0.024(1) 0.034(1) 0.038(3) 0.030(1) 0.029(1) 0.034(1) 0.026(1) 0.030(1) 0.024(1) 0.034(1) 0 0.009(1) 0.006(1) -0.002(1) 0.002(1) 0.011(1) 0 0 0 0.009(1) 0.006(1) -0.002(1) 0.002(1) 0.011(1) 0 0 0 0.009(1) 0.006(1) -0.002(1) -0.002(1) 0.011(1) -0.004(1) -0.007(2) 277 8. Anhang ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Tab. 8.34: Winkel und Abstände in Cu33Ga16 Cu1 - Cu2 2.581(6) Cu2 2.581(6) Cu2 2.581(6) Cu2 2.581(6) Ga2 2.965(4) Ga2 2.965(4) Ga2 2.965(4) Ga2 2.965(4) Ga2 2.965(4) Ga2 2.965(4) 109.47 109.47 109.47 125.26 125.26 125.26 54.74 54.74 54.74 109.47 109.47 54.74 54.74 125.26 54.74 125.26 125.26 109.47 125.26 54.74 54.74 125.26 125.26 54.74 54.74 125.26 54.74 125.26 54.74 125.26 90.00 90.00 90.00 90.00 180.00 90.00 90.00 180.00 90.00 180.00 90.00 90.00 Cu2 - Cu4 Cu4 Cu4 Ga2 Ga2 Ga2 Cu1 Cu5 Cu5 Cu5 Ga1 2.481(3) 2.481(3) 2.481(3) 2.572(3) 2.572(3) 2.572(3) 2.581(6) 2.605(5) 2.605(5) 2.605(5) 3.004(8) 118.40(07) 118.40(7) 167.57(29) 64.93(5) 64.93(5) 97.32(16) 61.86(8) 61.86(8) 135.36(28) 82.68(16) 118.40(7) 64.93(5) 167.57(29) 64.93(5) 97.32(16) 61.86(8) 135.36(28) 61.86(8) 82.68(16) 64.93(5) 64.93(5) 167.57(29) 97.32(16) 135.36(28) 61.86(8) 61.86(8) 82.68(16) 109.19(15) 109.19(15) 70.25(15) 125.39(8) 125.39(8) 57.07(10) 109.75(5) 109.19(15) 70.25(15) 125.39(8) 57.07(10) 125.39(8) 109.75(15) 70.25(15) 57.07(10) 125.39(8) 125.39(8) 109.75(15) 127.32(15) 127.32(15) 127.32(15) 180.00(38) Cu3 - Cu5 Cu5 Cu5 Cu4 Cu4 Cu4 Ga1 Ga1 Ga1 Ga3 Ga3 Ga3 2.523(4) 2.523(4) 2.523(4) 2.553(5) 2.553(5) 2.553(5) 2.617(5) 2.617(5) 2.617(5) 2.636(3) 2.636(3) 2.636(3) 115.54(11) 115.54(11) 59.49(9) 126.10(27) 59.49(9) 119.52(14) 119.52(14) 58.55(15) 176.07(29) 65.88(4) 65.88(4) 115.54(11) 126.10(27) 59.49(9) 59.49(9) 119.52(14) 58.55(15) 119.52(14) 65.88(4) 176.07(29) 65.88(4) 59.49(9) 59.49(9) 126.10(27) 58.55(15) 119.52(14) 119.52(14) 65.88(4) 65.88(4) 176.07(29) 80.83(21) 80.83(21) 102.66(11) 175.35(25) 102.66(11) 123.05(11) 57.83(10) 123.05(11) 80.83(21) 102.66(11) 102.66(11) 175.35(25) 57.83(10) 123.05(11) 123.05(11) 175.35(25) 102.66(11) 102.66(11) 123.05(11) 123.05(11) 57.83(10) 73.69(23) 73.69(23) 57.67(9) 57.67(9) 117.52(26) Cu4 - Cu2 Ga3 Cu5 Cu5 Cu3 Cu5 Cu5 Ga2 Ga2 Ga3 2.481(3) 2.510(3) 2.519(3) 2.519(3) 2.553(5) 2.616(3) 2.616(3) 2.714(2) 2.714(2) 2.822(4) 153.57(22) 120.26(9) 120.26(9) 143.68(24) 61.40(14) 61.40(14) 59.15(9) 59.15(9) 98.72(19) 67.86(9) 67.86(9) 62.74(14) 100.64(13) 100.64(13) 128.74(9) 128.74(9) 54.85(15) 115.86(18) 59.66(9) 156.06(17) 75.63(12) 62.69(10) 148.26(18) 95.10(11) 59.66(9) 75.63(12) 156.06(17) 148.26(18) 62.69(10) 95.10(11) 135.27(9) 135.27(9) 101.03(12) 101.03(12) 117.60(18) 86.59(20) 119.32(13) 55.26(8) 55.26(8) 119.32(13) 62.01(11) 62.01(11) 278 8. Anhang ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Cu5 - Ga2 Ga1 Cu4 Cu4 Cu3 Cu2 Cu4 Cu4 Ga2 Ga3 Ga3 2.473(4) 2.515(5) 2.519(3) 2.519(3) 2.523(4) 2.605(5) 2.616(3) 2.616(3) 2.727(4) 2.807(2) 2.807(2) 132.62(19) 108.62(13) 108.62(13) 164.79(22) 60.79(16) 64.36(10) 64.36(10) 63.34(17) 126.15(9) 126.15(9) 106.64(15) 106.64(15) 62.59(20) 71.84(18) 90.49(13) 90.49(13) 164.03(20) 56.54(9) 56.54(9) 82.16(21) 60.84(14) 138.75(10) 159.60(16) 82.35(12) 62.16(10) 55.92(8) 117.75(15) 60.84(14) 138.75(10) 82.35(12) 159.60(16) 62.16(10) 117.75(15) 55.92(8) 134.42(24) 121.26(11) 121.26(11) 101.45(20) 58.99(9) 58.99(9) 56.74(9) 56.74(9) 124.13(20) 96.19(11) 96.19(11) Ga1 - Cu5 Cu5 Cu5 Ga3 Ga3 Ga3 Cu3 Cu3 Cu3 Cu2 2.515(5) 2.515(5) 2.515(5) 2.533(3) 2.533(3) 2.533(3) 2.617(5) 2.617(5) 2.617(5) 3.004(8) 91.05(19) 91.05(19) 67.56(6) 67.56(6) 148.49(26) 127.51(5) 58.87(11) 127.51(5) 55.48(14) 91.05(19) 148.49(26) 67.56(6) 67.56(6) 127.51(5) 127.51(5) 58.87(11) 55.48(14) 67.56(6) 148.49(26) 67.56(6) 58.87(11) 127.51(5) 127.51(5) 55.48(14) 119.73(3) 119.73(3) 61.54(5) 61.54(5) 152.65(27) 93.00(14) 119.73(3) 152.65(27) 61.54(5) 61.54(5) 93.00(14) 61.54(5) 152.65(27) 104.18(17) 61.54(5) 104.18(17) 93.00(14) 114.35(15) Ga2 - Cu5 Cu5 Cu2 Cu2 Cu4 Cu4 Cu4 Cu4 Cu5 Cu5 Ga2 Cu1 2.473(4) 2.473(4) 2.572(3) 2.572(3) 2.714(2) 2.714(2) 2.714(2) 2.714(2) 2.727(4) 2.727(4) 2.739(7) 2.965(4) 125.68(21) 172.18(21) 62.14(15) 126.23(8) 126.23(8) 60.38(7) 60.38(7) 74.37(8) 74.37(8) 62.84(11) 117.16(11) 62.14(15) 172.18(21) 60.38(7) 60.38(7) 126.23(8) 126.23(8) 74.37(8) 74.37(8) 62.84(11) 117.16(11) 110.04(30) 55.91(7) 55.91(7) 116.04(13) 116.04(13) 109.78(7) 109.78(7) 124.98(15) 55.02(15) 116.04(13) 116.04(13) 55.91(7) 55.91(7) 109.78(7) 109.78(7) 124.98(15) 55.02(15) 103.51(13) 167.84(20) 75.17(14) 55.16(8) 134.14(12) 96.08(10) 83.92(10) 75.17(14) 167.84(20) 134.14(12) 55.16(8) 96.08(10) 83.92(10) Ga3 - Ga3 Cu4 Cu4 Ga1 Ga1 Cu3 Cu3 Cu5 Cu5 Cu5 Cu5 Cu4 2.471(7) 2.510(3) 2.510(3) 2.533(3) 2.533(3) 2.636(3) 2.636(3) 2.807(2) 2.807(2) 2.807(2) 2.807(2) 2.822(4) 69.01(11) 69.01(10) 141.73(14) 141.73(14) 128.44(15) 128.44(15) 96.56(9) 96.56(9) 96.56(9) 96.56(9) 56.14(8) 138.02(21) 106.33(8) 106.33(8) 162.55(21) 59.43(15) 129.63(8) 129.63(8) 56.22(6) 56.22(6) 78.49(7) 106.33(8) 106.33(8) 59.43(15) 162.55(21) 56.22(6) 56.22(6) 129.63(8) 129.63(8) 78.49(7) 76.54(29) 60.78(13) 60.78(13) 112.42(15) 55.90(10) 55.90(10) 112.42(15) 162.13(18) 60.78(13) 60.78(13) 55.90(10) 112.42(15) 112.42(15) 55.90(10) 85.59(15) 103.12(30) 55.13(8) 55.13(8) 115.45(13) 115.45(13) 110.27(7) 109.08(18) 98.70(12) 144.22(15) 62.59(9) 103.51(13) 134.14(12) 55.16(8) 96.08(10) 83.92(10) 115.45(13) 115.45(13) 55.13(8) 55.13(8) 110.27(7) 279 9. Zusammenfassung und Ausblick ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ 9. Zusammenfassung und Ausblick Gegenstand der Untersuchungen war die Synthese und Charakterisierung intermetallischer Verbindungen zwischen hochschmelzenden Übergangsmetallen und niedrigschmelzenden Metallen wie Zinn, Zink und Gallium. Ergebnisse früherer Arbeiten konnten hier erfolgreich vervollständigt und erweitert werden. Dabei hat sich die Metallschmelze als äußerst vorteilhaftes Reaktionsmedium erwiesen. So konnten nicht nur neue Verbindungen zum Teil phasenrein synthetisiert und charakterisiert werden, sondern auch Erkenntnisse über die lösungsvermittelnden und strukturdirigierender Eigenschaften von Metallen und anderen Elementen gewonnen werden. Ein Schwerpunkt war die Untersuchung des Systems Molybdän-Gallium-Zink. Dort konnte gezeigt werden, dass erst der Zusatz von geringen Mengen Gallium in der Zinkschmelze eine Löslichkeit des Molybdän bewirkt, und dass damit letztendlich auch Verbindungen zwischen Molybdän und Zink zugänglich sind, während diese beiden Metalle im binären System nicht mit einander reagieren. Auch das Mitreagieren des Gallium als weitere Minderkomponente hat sich als vorteilhaft erwiesen. In den unterschiedlichen Stapelvarianten der Verbindungen MoZn6-xGax ist der unterschiedliche Anteil an Gallium sowohl in der Schmelze als auch in der Kristallstruktur verantwortlich für einen Strukturwechsel. Durch Variation der Reaktionsbedingungen wie unterschiedlichem Galliumgehalt und dem Ersatz von Molybdän durch Vanadium, Niob und Tantal konnten sämtliche Stapelvarianten der Metalle, die in dichtesten Kugelpackungen kristallisieren, in Form von Polyederpackungen synthetisiert werden. Dass die La-Stapelvariante des hexagonalen ÜM(Zn,Ga)6 nicht mit Molybdän, und auch das hexagonale Mo(Zn,Ga)6 des Mg-Typs sowie das rhomboedrische Mo(Zn,Ga)6 des Sm-Typs nicht mit den Metallen der 5. Gruppe gebildet wird, zeigt, dass auch dem Übergangsmetall eine gewisse Bedeutung bei der Art der Stapelvariante zukommt. An der Bildung dieser Verbindungen sind demnach maßgeblich elektronische Faktoren beteiligt. Die Änderung der Strukturen in Abhängigkeit von der Valenzelektronenkonzentration zeigen dabei auffällige Parallelen zu den Elementstrukturen der Metalle und den Hume-RotheryPhasen. Im System Mo-Ga-Zn gelang mit der Synthese des Mo7Ga26Zn26 zum ersten Mal die Substitution des Zink im Mo7Sn12Zn40-Typ. Dass dies ausgerechnet mit Gallium – wenn auch nur partiell – gelang, zeigt zum Einen die große strukturchemische Flexibilität des Galliums, 280 9. Zusammenfassung und Ausblick ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ das innerhalb der Struktur sowohl das große Hauptgruppenmetall Zinn, als auch das kleinere Zink ersetzen kann, ohne das grundsätzliche Strukturprinzip in diesem Typ zu verletzen. Zum Anderen kann aus der nur partiellen Substitution geschlossen werden, dass dieser Strukturtyp ausschließlich auf zinkreiche Verbindungen beschränkt ist. Eine weitere Erhöhung des Galliumgehalts in den Schmelzen führt ab einem bestimmten Mengenverhältnis Mo-Ga-Zn sehr rasch zur Bildung der galliumreichen Verbindung Mo8Ga41, in der ein anderes Strukturkonzept verwirklicht wird. Während im Mo7Ga26Zn26 das Gallium noch in das Motiv der dichtesten bzw. lokal dichtesten Packung integriert wird – immerhin beträgt das Zn-GaVerhältnis hier 1:1 – findet man eine ähnliche „Zink-Akzeptanz“ im Mo8Ga41 nicht. An dieser Stelle findet eine Art Zäsur statt und die gesamte Strukturchemie dieser galliumreichen Verbindungen wird dominiert vom Galliumgerüst mit Motiven der kubisch-innenzentrierten Kugelpackung. Die Struktur von V7Ga12Zn39 mit der etwas abweichenden Koordinationssphäre der Vanadiumposition, die in den Hohlräumen benachbarter „Superikosaeder“ angeordnet ist, scheint letztendlich zu bestätigen, dass dieser Strukturtyp nicht nur primär durch geometrisch Faktoren gebildet wird, sondern auch, dass Motive wie Selbstähnlichkeit oder große molekulare Baugruppen wie „Superikosaeder“ bereits in der flüssigen Phase kurz vor dem Erstarrungspunkt vorhanden sind, wobei sie während der Kristallisation Teile der Schmelze einschließen, die dann ihrerseits in einem günstigen Motiv ausordnen. Bereits in der zinnhaltigen Verbindung V7Sn12Zn40 wurde ein abweichendes Verhalten gerade dieser Umgebung festgestellt, die sich durch erhebliche Defizite und einer ungewöhnlichen Koordination der Zinkatome bemerkbar machte, das auf die geringe Größe des Vanadium zurückzuführen ist. Das Baumotiv des „Superikosaeders“ bleibt auch in V7Ga12Zn39 unverändert, und es wurde lediglich eine geringe Volumenkontraktion dieses mehrschaligen Polyeders im Vergleich zum Mo7Sn12Zn40 beobachtet, was direkt mit den unterschiedlichen Atomvolumina der Metalle korreliert. Letztendlich resultiert daraus ein etwas geringeres Volumen des „Superikosaeders“ und damit auch ein kleineres Volumen des von diesen Clustern eingeschlossenem Volumen. Nach dieser Vostellung bildet sich in V7Ga12Zn39 in diesen Hohlräumen das VZn12-Kuboktaeder mit kleinerer Koordinationszahl und höherer Packungsdichte statt des 14er-Polyeder im Mo7Sn12Zn40-Typ. In den galliumreichen Verbindungen mit Übergangsmetallen wie Vandium oder Molybdän zeigt sich ein ganz anderes Strukturmotiv als in zink- oder zinnreichen Verbindungen, in 281 9. Zusammenfassung und Ausblick ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ denen Gallium nur als Minderkomponente vorhanden ist. Die Strukturen vom (MoGa5)nGaTyp zeigen eine hohe kubisch-innenzentrierte Pseudosymmetrie, bei der das Übergangsmetall in einem nahezu vollständig kubisch-primitivem Ga-Gitter nach unterschiedlichem Muster angeordnet sind. Mit dem triklinen Mo6Ga31 konnte nun ein weiterer Vertreter dieser Strukturfamilie synthetisiert werden, was zeigt, dass gleiche Baugruppen (wie im monoklinen Mo6Ga31) nach unterschiedlichen geometrischen Prinzipien angeordnete sein können. Trotz der niedrigen kristallographischen Symmetrie besitzt die Struktur eine hohe kubisch innenzentrierte Pseudosymmetrie, die in der Anordnung der Würfel aus Zentaur-Polyeder untereinander begründet ist. Im kubischen V11Cu9Ga46 liegen ebenfalls Baueinheiten von Würfeln aus Zentaur-Polyeder als grundlegendes Strukturmotiv vor, die in Form dieser Cluster die Atomanordnung des Cr3Si-Typs imitieren. Zwischen diesen Clustern sind weitere Ga8-Würfel vorhanden, die in einer bestimmten Art von Vanadium und Kupfer aufgefüllt werden, dass eine bemerkenswerte Separation auch zwischen diesen beiden Metallen vorliegt. Sie äussert sich darin, dass die Vanadiumatome für sich betrachtet eine kubisch-innenzentrierte Anordnung bilden, und Kupferatome ausschließlich in linearer Anordnung V-Cu-V innerhalb von Ga8-Würfeln koordiniert sind. Der Würfel aus Zentaur-Polyeder scheint ein grundlegendes Strukturprinzip in galliumreichen Verbindungen mit hochschmelzenden Übergangsmetallen zu sein. Mit den Metallen Molybdän und Vanadium existieren mittlerweile fünf verschiedene Strukturtypen, in denen diese Baugruppe ein wesentlicher Bestandteil ist. Einzelne Vertreter sind selbst mit Rhenium und Wolfram bekannt. Alle Strukturen lassen sich nach hierarchischen Prinzipien beschreiben, in dem Sinne, dass die Zentren innerhalb der Cluster stets hochsymmetrische Positionen innerhalb der Kristallstruktur besetzen. Da die Außenseite dieser Polyeder nur aus quadratisch angeordneten Galliumatomen besteht, die das Motiv des Würfels in ihrer geometrischen Anordnung bereits aufweisen, scheint es für verschiedene Ver- knüpfungsmuster und unterschiedliche Kondensationsgrade dieser Cluster kaum Grenzen zu geben. Es ist daher nicht auszuschließen, dass weitere Vertreter mit neuen Strukturen möglich sind. Versuche, entsprechende Verbindungen auch mit Niob oder Tantal zu synthetisieren, waren bisher erfolglos. Umsetzungen dieser Metalle mit Kupfer und Gallium führten bisher nur zu binären Randverbindungen. Hier ergeben sich vermutlich ähnliche Schwierigkeiten wie bei Synthese von V2Cu3Ga8 und V11Cu9Ga46. Das Problem liegt offenbar nicht darin, die 282 9. Zusammenfassung und Ausblick ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ Metalle zur Reaktion zu bringen, sondern vielmehr ein präparatives Fenster zu finden, das wie im Falle der Vanadiumverbindungen einen Zugang zu den erwünschten Verbindungen ermöglicht, auch wenn binäre Verbindungen in diesen Systemen leicht zugänglich sind. Im System Platin-Zinn-Zink konnte mit dem Pt2Sn2Zn3 die erste ternäre Verbindung mit diesen Metallen phasenrein synthetisiert und charakterisiert werden. Die Verbindung ist in PtSn-Zn-Schmelzen unterschiedlicher Zusammensetzung äusserst leicht zugänglich. Pt2Sn2Zn3 kristallisiert in einem neuen und hochsymmetrischen Strukturtypen, wobei charakteristische Strukturmerkmale der binären Randphasen des PtSn2 und des γ-Messing im System Pt-Zn nach einem bemerkenswert einfachen Prinzip nebeneinander in der Struktur vorliegen. Versuche, isotype Verbindungen mit anderen Edelmetallen oder anderen Hauptgruppenmetalen zu sythetisieren, waren bislang trotz zahlreicher Versuche erfolglos. Offenbar existieren in diesem Strukturtypen äusserst günstige Bedingungen bezüglich Radienverhältnisse der Atome untereinander und der Valenzelektronenkonzentration, die auf die Elemente Platin, Zinn und Zink optimal zugeschnitten sind. Demnach sind für diesen Strukturtypen sowohl elektronische als auch geometrische Faktoren maßgeblich verantwortlich. Bisher beschränkten sich die Untersuchungen der in dieser Arbeit vorgestellten Verbindungen vor allem auf röntgenographischen Charakterisierungen. Im Hinblick auf eine mögliche Ausordnung der Metalle Zink und Gallium in den Strukturen der Verbindungen ÜM(Zn,Ga)6 sind Neutronenbeugungsexperimente geplant, anhand derer sich eindeutig zwischen den beiden Metallen unterscheiden lässt. Darüber hinaus gilt es immer noch festzustellen, ob die in den Ordnungs- und Defektvarianten der dichtesten Kugelpackung und im Mo7Sn12Zn40-Typ innewohnende Selbstähnlichkeit bereits in der flüssigen Phase kurz vor der Erstarrungstemperatur zumindest in Domänen vorliegt. Dazu sind TEM-Untersuchungen an abgeschreckten Schmelzen notwendig, die allerdings eine entsprechend anspruchsvolle Reaktionsführung voraussetzt. Synthesen mit Wolfram in dieser Richtung waren bisher nicht erfolgreich. Möglicherweise sind MoZn6-analoge Verbindungen über reaktivere Wolframverbindungen wie Carbonyle oder Halogenide möglich, die allerdings wegen möglicher gasförmiger Reaktionsprodukte in offenen oder druckfesten Systemen durchgeführt werden müssten. Dadurch kann sich der präparative Aufwand erheblich erhöhen. Ähnliche Überlegungen gelten für Rhenium. Die 283 9. Zusammenfassung und Ausblick ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ beiden Metalle besitzen als direktem Ausdurck ihrer enormen Stabilität extrem hohe Schmelzpunkte, die noch einmal 560° (Re) bzw. etwa 800° (W) oberhalb der Schmelztemperatur des Molybdän liegen. Ein möglicher Kandidat als Alternative zu Molybdän ist Ruthenium, das zwar ein etwas geringeres Atomvolumen, dafür aber einen niedrigeren Schmelzpunkt als Molybdän besitzt. Das Metall wäre zudem ein sensibler Sensor dafür, in wie weit die Elektronenzahl des Übergangsmetalls für die Stabilität dieser Strukturfamilie mitverantwortlich ist. Die in dieser Arbeit vorgenommene Unterteilung in zinkreich und galliumreiche Verbindung trägt der Beobachtung Rechnung, dass Zink in Verbindungen mit hochschmelzenden Übergangsmetallen eher dichteste Packungen ausbildet, die weitgehend metallische und ungerichtete Wechselwirkungen aufweisen. In galliumreichen Verbindungen ist dagegen eher eine Tendenz zu mehr gerichteten Bindungen und einem partiell kovalentem Galliumnetzwerk zu beobachten. Besonders das System Molybdän-Gallium-Zink zeigt dabei unterschiedliche Abstufungen, die von dichtesten Packungen in den zinkreichen Verbindungen des Mo(Zn,Ga)6 über ikosaedrische Packungen im Mo7Ga26Zn26-Typ bis zu den Strukturen des (MoGa5)nGa mit hoher kubisch-innenzentrierter Pseudosymmetrie reichen. Bezüglich des Raumbedarfs zeigt Gallium in diesen Strukturen eine bemerkenswerte Flexibilität, die möglicherweise von keinem anderen Metall in intermetallischen Verbindungen erreicht wird. In intermetallischen Verbindungen zwischen hochschmelzenden Übergangsmetallen der 5. bis 8. Gruppe des Periodensystems und niedrigschmelzenden Metallen wie Aluminium, Zink, Gallium und Zinn scheinen sich hochsymmetrische, komplexe Strukturen, die nach hierarchischem Prinzip beschrieben werden können, bevorzugt zu bilden. Ein Ziel ist es, analoge Systeme mit Gallium und anderen Metallen zu erschließen, die diese Annahme bestätigen. 284 9. Zusammenfassung und Ausblick ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ 10. [1] Literaturangaben P. Villars, L. D. Calvert (Hrsg.), Pearson’s Handbook of Crystallographic Data for Intermetallic Phases; American Society for Metals, Metals Park, Ohio, 1995 [2] H. G. von Schnering, R. Nesper, Angew. Chem. 1987, 99, 1097-1119 [3] A. D. Becke, K. E. Edgecombe, J. Chem. Phys. 1990, 92, 5397-5403 [4] K. Wilke, Kristallzüchtung; Verlag Harri Deutsch, Thun, 1988 [5] J. Hulliger, Angew. Chem. 1994, 106, 151-189 [6] P. Lebeau, J. Eigueras, Compt. Rend. Acad. Sci. Paris, 1898, 127, 393 [7] H. Hillebrecht, V. Kuntze, K. Gebhardt, Z. Krist. 1997, 212, 840-847 [8] V. Kuntze, Dissertation, Bonn, 1999 [9] C. Kittel, Introduction to Solid State Physics, 2. Aufl. Wiley, New York, 1956, S. 293, zitiert in [2] [10] J. D. Corbett, Angew. Chem. 2000, 112, 682-704 [11] A. F. Holleman, N. Wiberg, Lehrbuch der anorganischen Chemie, W. de Gruyter, Berlin 1995 [12] B. D. Sharma, J. Donohue, Z. Krist., 1962, 117, 293-300 [13] J. Donohue, The Structure of the Elements, Wiley, New York, 1972 [14] V. Heine, D Weaire, Solid State Phys. 1970, 24, 247 [15] M. Pötzschke, K. Schubert, Z. Metallkde. 1962, 53, 474-488 [16] M. Pötzschke, K. Schubert, Z. Metallkde. 1962, 53, 548-561 [17] R. Nesper, Angew. Chem. 1991, 103, 805-834 [18] H. G. Meißner, K. Schubert, Z. Metallkde. 1965, 56, 475-484 [19] H. Hillebrecht, Habilitationsschrift, Freiburg, 1997 [20] M. Ade. Dissertation, Freiburg, 1997 [21] J. Adam, J. B. Rich, Acta Cryst. 1954, 7, 813-816 [22] E. Zintl, A. Harder, W. Haucke, Z. phys. Chem. 1937, 35B, 354-362 [23] E. Hellner, F. Laves, Z. Naturforsch. 1947, 2A, 177-183 [24] D. A. Davies, E. A. Owen, Brit. J. Appl. Phys. 1964, 15, 1309-1314 [25] J. L. Jorda, R. Flückiger, J. Muller, J. Less Common Met. 1977, 55, 249-264 [26] G. W. Webb, J. J. Engelhrdt, IEEE Trans. Magn. 1975, 11, 208 [27] D. A. Ashby, R. D. Rawlings, J. Less Common Met. 1976, 50, 111 [28] A. Iandelli, J. Less Common Met. 1991, 169, 187-196 [29] Th. Heumann, H.-W. Schleicher, H. Venker, Z. Metallkde. 1969, 60, 438-441 285 9. Zusammenfassung und Ausblick ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ [30] R. Lux, Diplomarbeit, Bonn, 1999 [31] J. G. White, Acta Cryst. 1965, 18, 217 [32] W. B. Pearson, The Crystal Chemistry and Physics of Metals and Alloys, Wiley, New York, 1972 [33] K. Schubert, H.G. Meissner, M. Pötzsche, W. Roßteutscher, E. Stolz, Naturwissenschaften, 1962, 49,57 [34] L. Pauling, Die Natur der chemischen Bindung, 3. Auflage, Verlag Chemie Weinheim, 1968 [35] F. Laves, Phase Sability in Metals and Alloys, McGraw-Hill, New York, 1967 [36] H. Bärnighausen, MATCH Communicatis in Mathematical Chemistry, 1980, 9, 139 [37] U. Müller, Anorganische Strukturchemie, Teubner Verlag Stuttgart, 3. Auflage, 1996 [38] Riedel, Anorganische Chemie, 5. Auflage, de Gruyter, Berlin-NewYork, 2002 [40] B.T. Matthias, E.A. Wood, E. Corenzwit, V.B. Bala, J. Phys. Chem. Solids, 1956, I, 188 [41] K. Yvon, Acta Cryst. 1974, B30, 853-861 [42] K. Yvon, Acta Cryst. 1975, B31, 117-120 [43] C.J. Toussaint, H. Venker, Acta Cryst. 1968, B24, 743 [44] T. Nasch, W. Jeitschko, J. Solid State Chem. 1999, 143, 95-103 [45] K. Lohberg, Z. Metallkde. 1940, 32, 38 [46] W. Roßteutscher, K. Schubert, Z. Metallkde, 1965, 56, 730-734 [47] K. Schubert, Kristallstrukturen zweikomponentiger Phasen, Springer-Verlag, Berlin, 1964 [48] A. L. Mackay. Acta Cryst. 1962, 15, 916-918 [49] M. Cooper, K. Robinson, Acta Cryst. 1966, 20, 614-617 [50] H. Peipst, Z. Phys. Chem. 1961, 216, 304-333 [51] W. Carrillo-Cabrena, N. Caroca-Canales, H. G. Schnering, Z. anorg. allg. Chem. 1994, 620, 247-257 [52] D. P. Shoemaker, R. E. Marsh, F. J. Ewing, L. J. Pauling, Acta Cryst. 1952, 5, 637-644 [53] E. Hellner, Struct. Bond. 1979, 37, 61-120 [54] Jander, Jahr, Maßanalyse, 14. Auflage, Walter de Gruyter, Berlin-New York, 1986 [55] D. Shechtman, I. Blech, D. Gratias, J. W. Cahn, Phys. Rev. Lett. 1984, 53, 183 [56] W. Steurer, Z. Krist. 1990, 190, 179-234 [57] M. El-Boragy, K. Schubert, Z. Metallkd. 1972, 63, 53-53 [58] H. Hillebrecht, V. Kuntze, 12th Int. Conf. Solid Comp. Trans. Met., St. Malo, 1997 [59] Yu. Grin, K. Peters, H. G. von Schnering, Z. Krist. 1997, 212, 6 286 9. Zusammenfassung und Ausblick ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ [60] Lu Hsueh-shan, Liang Ching-kwei, Chinese Physics, Peking, transl. W. Xuebao, 1965, 21, 1281-1293 [61] A. Wood, V. B. Compton, B. T. Matthias, E. Corenzwit, Acta Cryst. 1958, 11, 604 [62] J. D. Bornand, R. E. Siemens, L. L. Oden, J. Less-Common Met. 1973, 30, 205 [63] K. Girgis, W. Petter, G. Pupp, Acta Cryst. 1975, B31, 113-116 [64] R. Horyn, R. Andruszkiewicz, J. Less-Common Met. 1983, 91, L5-L7 [65] M. Wolcyrz, R. Andruszkiewicz, K. Lukaszewicz, Acta Cryst. 1989, C45, 991-993 [66] V. Kuntze, Diplomarbeit, Freiburg, 1996 [67] T. B. Massalski (Hrsg.), Binary Alloy Phase Diagramms, ASM, Metals Park, Ohio, 1986 [68] H. Bärnighausen, persönliche Mitteilung [69] R. Andruszkiewicz, R. Horyn, J. Less-Common Met. 1986, 119, 91-97 [70] V. Kuntze, H. Hillebrecht, Z. Krist. 1998, Suppl. 15, 34 [71] R. Stokhuizen, J. K. Brandon, P. C. Chieh, W. B. Pearson, Acta Cryst. 1974, B30, 2910-2911 [72] L. Arnberg, S. Westman, Acta Cryst., 1978, A34, 399-404 [73] F. A. Siderquko et al. Fizika Metallov I Metallovedeninie, 1959, 8, 465 [74] R. G. Maier, Y. Uzel, H. Kandler, Z. Naturforsch. 1966, 21, 531-540 [75] K. Girgis, F. Laves, R. Reinmann, Naturwissenschaften, 1966, 53, 610 [76] E. M. Savitskii, P. J. Kripyakevisch, W. W. Baron, Yu. V. Efimov, Inorg. Mat. 1967, 3(1), 35-42 [77] L. Hsueh-Shan, L. Ching-Kwei, Chinese Physics, Peking, transl. from W. Xuebao, 1965, 21, 1281-1293 [78] Th. Hahn (cd.), Int. Tables for Crystallography, 1983 [79] E. E. Galloni, A. E. Roffo, J. Chem. Phys. 1941, 9, 875-877 [80] J. E. Joergensen, S. E. Rasmussen, Acta Cryst. 1982, B38, 346-347 [81] J. K. Brandon, R. Y. Brizard, P. C. Chieh, R. K. McMillan, W. B. Pearson, Acta Cryst. 1974, B30, 1412-1417 [82] J. Zemann, Acta Cryst. 1958, 11, 55 [83] ]K. Schubert, H. Pfisterer, Z. Metallkde. 1949, 40, 405-411 [84] H.-J. Schaller, Z. Metallkde. 1979, 70, 318-321 [85] K. L. Shelton, P. A. Merewether, B. J. Skinner, Canadian Mineralogist, 1981, 19, 599-605 287 9. Zusammenfassung und Ausblick ¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ [86] J. S. Charlton, M. Cordey-Hayes, I. R. Harris, J. Less- Common Met. 1970, 20, 105-112 [87] B. Künnen, D. Niepmann, W. Jeitschko, J. Alloys Comp. 2000, 309,1-9 [88] K. Schubert, H. Pfisterer, Z. Metallkde. 1949, 40, 405-411 [89] H. R. Christen, Grundlagen der allgemeinen und anorganischen Chemie, Salle + Sauerländer, Frankfurt/Main, 7. Auflage, 1982 [90] H. Nowotny, E. Bauer, A. Stempfl, H. Bittner, Monatsh. Chem. 1952, 83, 221-236 [91] W. Carl, K. Schubert, J. Less- Common Met. 1969, 19, 279-283 [92] A. Johannson, S. Westmann, Acta Chem. Scand. 1970, 24, 3471-3479 [93] U. Häussermann, M. Elding-Pontén, Ch. Svenson, S.Lidin, Chem. Eur. J. 1998, 4, No.6, 1007-1015 [94] R. Andruszkievicz, R. Horyn, J. Less Common Met. 1986, 119, 91-97 [95] Th. Degen, Programm DIFFRAC97, Institut für Anorganische Chemie, Universität Bonn, 1997 [96] P.-E. Werner, L. Eriksson, M. Westdahl, J. Appl. Cryst. 1985, 18, 367 [97] G. M. Sheldrick, Institut für Anorganische Chemie, Universität Göttingen, 1997 [98] X-SHAPE basiert auf dem Programm HABITUS, W. Herrendorf, Institut für Anorganische Chemie, Universität Gießen [99] DIAMOND 2.1c, Informationssystem für Kristallstrukturen, K. Brandenburg, Institut für Anorganische Chemie, Universität Bonn, 1998 288