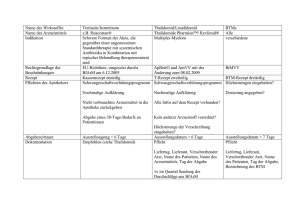
Protokoll zur 52
Werbung

BUNDESINSTITUT FÜR ARZNEIMITTEL UND MEDIZINPRODUKTE Ergebnisprotokoll 71. Sitzung des Sachverständigenausschusses für Verschreibungspflicht nach § 53 Abs. 2 AMG vom 14.01.2014 Tagungsort: Bundesinstitut für Arzneimittel und Medizinprodukte D-53175 Bonn, Kurt-Georg-Kiesinger-Allee 3 Teilnehmer: Der Vorsitzende Die Sachverständigen des Ausschusses für Verschreibungspflicht Vertreter des Bundesministeriums für Gesundheit (BMG) Vertreter des BfArM Hinweis: Der Ausschuss unabhängiger Sachverständiger nach § 53 Absatz 2 des Arzneimittelgesetzes berät das BMG und das BMEL im Hinblick auf Fragen zur Verschreibungspflicht von Arzneimitteln und gibt hierzu fachliche Empfehlungen ab. Mit diesen Ausschussempfehlungen wird der - in jedem Einzelfall erforderlichen – Entscheidung des Verordnungsgebers nicht vorgegriffen. Änderungen der Arzneimittelverschreibungsverordnung erfolgen jeweils durch Rechtsverordnung des BMG bzw. des BMEL; diese Verordnungen bedürfen grundsätzlich der Zustimmung des Bundesrates. Tagesordnung 1. Eröffnung der Sitzung 2. Annahme der Tagesordnung 3. Geschäftsordnung des Ausschusses 4. Chinin Antrag auf Unterstellung unter die Verschreibungspflicht für die Anwendung beim Menschen 5. Ketotifen Antrag auf Entlassung aus der Verschreibungspflicht für Ketotifen 0,25 mg/ml Augentropfen Lösung 6. Levonorgestrel zur Notfallkontrazeption Auftrag des BMG zur Aktualisierung des Votums vom 1.Juli 2003 1 7. Verpflichtende Dosierungsangaben auf dem Rezept Auftrag des BMG 8. Verschiedenes TOP 1 Eröffnung der Sitzung Der Vorsitzende begrüßt die verfahrenstechnische Hinweise. Anwesenden. Es folgen verschiedene TOP 2 Annahme der Tagesordnung Die Sachverständigen stimmen dem Vorschlag des Vorsitzenden zu, den TOP 6 zu Levonorgestrel vorzuziehen. Mit dieser Änderung wird die Tagesordnung angenommen. TOP 3 Geschäftsordnung des Ausschusses Ein Vertreter des BfArM informiert darüber, dass die Vorstellung eines Entwurfs für eine aktualisierte Geschäftsordnung auf die 72. Sitzung verschoben wurde. TOP 4 Chinin Ein Vertreter des BfArM führt in die Thematik ein (s. Anlage 1). Es wurde dem BfArM zwischenzeitlich bekannt, dass der Antrag auf ausnahmslose Unterstellung von Chinin unter die Verschreibungspflicht nur für die Anwendung beim Menschen gelten soll. Ein Sachverständiger erkundigt sich danach, ob die dargestellten Nebenwirkungen auch in niedriger Dosierung auftreten könnten. Außerdem habe eine frühere Befragung von Referenzapotheken ergeben, dass es inzwischen keinen Missbrauch mit Chinin mehr gäbe. Der Vertreter des BfArM antwortet darauf, durch Chinin ausgelöste Thrombozytopenien seien dosisunabhängig und könnten daher auch bei niedriger Dosierung auftreten. Die Nebenwirkungen auf das kardiale Reizleitungssystem mit der Gefahr von Herzrhythmusstörungen, schweren Hautreaktionen wie StevensJohnson-Syndrom sowie Sehstörungen und Tinnitus träten ebenfalls auch unter den niedrigen Dosen auf, wie sie zur Behandlung nächtlicher Wadenkrämpfe angewendet würden. Bezogen auf die Frage nach dem Missbrauch laute die Antwort, dass nach eigenen Recherchen die Wirkungsverstärkung von Loperamid durch Chinin als Thema in den einschlägigen Internetforen vertreten sei. Auf eine entsprechende Frage nach der eher niedrigen Anzahl vorliegender Nebenwirkungsmeldungen antwortet der Vorsitzende, dass es sich um Spontanberichte handele. Da außerhalb von klinischen Studien, d.h. im Spontanberichtssystem, von einer hohen, aber unbekannten Zahl von nicht gemeldeten Nebenwirkungen auszugehen sei, seien quantitative Häufigkeitsabschätzungen problematisch. Dem BfArM lägen aber qualitativ 2 beurteilbare, schwerwiegende Meldungen vor. Die Herzrhythmusstörungen könnten potenziell tödlich verlaufen. Deshalb sei aus seiner Sicht die Unterstellung unter die Verschreibungspflicht die angemessene Maßnahme. Ein Vertreter des BfArM informiert darüber, dass das Bundesinstitut für Risikobewertung Chinin in Lebensmitteln als problematisch betrachte und eine Neubewertung durch das betreffende Wissenschaftsgremium der europäischen Kommission, das Scientific Committee on Food, angefordert habe. Chinin in Lebensmitteln werde vor allem für Schwangere, Menschen mit vorbestehenden Herzrhythmusstörungen oder solche unter Medikation mit bestimmten Arzneimitteln als Risiko angesehen. Nach Ansicht eines Sachverständigen würde sich die Anzahl der Nebenwirkungsmeldungen sehr relativieren, wenn man sie in Relation zu den hohen Expositionszahlen aus Deutschland setze. Ein anderer Sachverständiger führt aus, in dem Cochrane-Review seien 1586 Patienten betrachtet worden, davon sei nur bei 1140 Patienten Chinin gegen Placebo getestet worden. Aus anderen Studien sei bekannt, dass auch Dehnübungen der Wadenmuskulatur zu einer signifikanten Verbesserung führten. Für ihn bestehe ein großer Unterschied zwischen den beiden Anwendungsgebieten von Chinin. Bei einer lebensbedrohlichen Malaria müssten Herzrhythmusstörungen, Thrombozytopenie und andere Nebenwirkungen, anders als bei der Behandlung nächtlicher Wadenkrämpfe, in Kauf genommen werden. Nicht erwähnt worden sei das Risiko für Phototoxizität unter Chinin. Inzwischen sei bekannt, dass das Long QT-Syndrom vererbt würde. Dies sei aber für den Patienten nicht erkennbar, dennoch könne der Patient einen plötzlichen Herztod erleiden. Aufgrund dieser Risiken plädiere er dafür, Chinin zur Behandlung nächtlicher Wadenkrämpfe der Verschreibungspflicht zu unterstellen. Auf eine entsprechende Frage antwortet ein Vertreter des BfArM, dass Informationen zur Entwicklung der Anzahl von Nebenwirkungsmeldungen in Frankreich und Großbritannien nach Unterstellung von Chinin unter die Verschreibungspflicht in der europäischen UAW-Datenbank EudraVigilance nicht zu recherchieren seien. Der externe Sachverständige hält seinen Vortrag (s. Anlage 2). Anschließend werden Fragen an ihn gerichtet. Ein Sachverständiger erkundigt sich, ob Daten zur Dosisabhängigkeit von QTVerlängerungen unter Chinin bekannt seien. Der externe Sachverständige antwortet, es gebe eine Dosisabhängigkeit, deren Ausprägung sei aber individuell verschieden bzw. sie sei von verschiedenen Faktoren des einzelnen Patienten abhängig. Aus seiner Sicht seien aber deutlich höhere Dosen als 10 g erforderlich. Interessant sei auch, dass mit nächtlichen Wadenkrämpfen eine erhöhte Sensitivität für kardiale Nebenwirkungen verbunden sei. Dasselbe gelte für den Schmerzzustand an sich. Er denke, dass das kardiale Risiko keine Rolle spiele. Ein Sachverständiger erläutert, dass die betroffene Firma einen Vorschlag für eine Packungsgrößenbegrenzung unterbreitet habe, der eine Anwendung über 5 Tage ermögliche. Ein Problem sehe er insofern, als ein verlängertes QT-Intervall mit den entsprechenden Folgen sehr schnell und sicher bereits innerhalb der ersten 5 Tage 3 aufträte, falls ein Patient zusätzlich zu Chinin ein weiteres Arzneimittel mit die QTZeit verlängernder Wirkung einnähme. Außerdem sei aus einer publizierten Studie zu Immunthrombozytopenien bekannt, dass die im Vortrag aufgeführten klinischen Symptome als Hinweise auf eine Thrombozytopenie entweder fehlen oder vom Patienten übersehen werden könnten. So sei es möglich, dass die Thrombozytopenie erst diagnostiziert würde, wenn der Patient bereits eine bedrohliche Blutung entwickelt habe. Ein Sachverständiger führt aus, dass beim plötzlichen Herztod sicherlich nicht der Chininspiegel im Blut gemessen werde. Daher sei davon auszugehen, dass solche Todesfälle nicht aufgeklärt und nicht gemeldet würden. Aus seiner Sicht stünden die schweren Nebenwirkungen von Chinin in keinem Verhältnis zu dem Krankheitsbild der nächtlichen Wadenkrämpfe. Auf eine entsprechende Frage antwortet der externe Sachverständige, dass Überdosierungen bei den der Firma bekannten Nebenwirkungsmeldungen keine Rolle gespielt hätten. Er halte im Übrigen das Risiko für sehr gering, dass ein Patient mit nächtlichen Wadenkrämpfen gar nicht zu seinem Arzt ginge. Bei niedriger Dosierung seien QT-Verlängerungen nicht zu erwarten. Dies rechtfertige die Freistellung einer ‚Notfallpackung‘ für 5 Tage als Soforthilfe. Ein Sachverständiger führt aus, nächtliche Wadenkrämpfe träten bei den davon Betroffenen nicht jede Nacht, sondern in größeren Zeiträumen und vor allem in unregelmäßigen Abständen auf. Daher sei es nicht sinnvoll, 5 Tage hintereinander Chinin einzunehmen. Chinin könne nicht als Notfallmedikament angesehen werden. Chinin sei in den zitierten Studien des Cochrane-Reviews bis zu 60 Tage angewendet worden, informiert ein anderer Sachverständiger und erkundigt sich nach Resorptionszeiten und Wirkungseintritt nach Einnahme. Der externe Sachverständige antwortet, es sei möglich, mit einer Dauereinnahme eine Frequenzminderung der nächtlichen Krämpfe zu erreichen. Zu einer prophylaktischen Wirkung seien ihm aber keine Daten bekannt, insofern würde er diese Therapie tatsächlich in erster Linie als Akuttherapie ansehen. Ein Sachverständiger möchte die Gründe für die Rücknahme der Indikation in England und Frankreich erfahren. Der externe Sachverständige verweist auf den unterschiedlichen Umgang mit Arzneimittelrisiken durch Patienten wie auch Behörden in verschiedenen Ländern sowie darauf, dass das BfArM Zugang zu Studiendaten erhalten habe, die in den anderen Ländern nicht vorlägen. Daraus resultiere seine Annahme, dass die deutsche Behörde ein größeres Zutrauen in den Nutzen des Arzneimittels habe. Der Sachverständige verlässt den Raum. Auf eine diesbezügliche Frage antwortet ein Vertreter des BfArM, dass die Regelungen in der Arzneimittelverschreibungsverordnung unabhängig von den lebensmittelrechtlichen Regelungen zu Chinin seien. Ein Vertreter des BfArM erläutert hinsichtlich der Bezugnahme des externen Sachverständigen auf die Packungsgrößenbegrenzungen anderer Arzneimittel, dass die Limitierung der Packungsgröße für die OTC-verfügbaren Triptane erfolgte, um 4 das Risiko eines Übergebrauchs zu minimieren. Die Begrenzung der Packungsgröße für Paracetamol begründe sich aus den Rückmeldungen der deutschen Giftnotrufzentralen, nach denen Paracetamol in hohen Dosen über 10 g vermehrt für Suizidversuche verwendet werde. In beiden Fällen sei es um die Verhinderung des nicht bestimmungsgemäßen Gebrauchs gegangen, insofern sei die Rationale mit der für Chinin nicht vergleichbar. Ein Sachverständiger erkundigt sich, wie schnell Chinin im Notfall wirkt. Ein Vertreter des BfArM informiert, dass die dem BfArM vorliegenden Studien eine Anwendung von Chinin über 14 Tage untersuchten. Der Sachverständige stellt fest, es handele sich offenbar nicht um ein Notfallmedikament. Der BfArM-Vertreter bestätigt dies. Ein weiterer Sachverständiger unterstützt den Antrag auf Unterstellung. Ein Arzneimittel mit QT-verlängernder Wirkung würde nach heutigem Stand nicht mehr zugelassen. Die Verlängerung der QT-Zeit werde als Surrogatparameter für gravierende kardiale Nebenwirkungen angesehen, die nach einer Zulassung mit den Mitteln der Pharmakovigilanz kaum noch aufzudecken seien. Außerdem müsse die Ursache nächtlicher Wadenkrämpfe durch den Arzt abgeklärt werden. Häufige Ursachen der Krämpfe seien unerkannte Grundleiden wie Niereninsuffizienz oder die Therapie z.B. mit Diuretika. Ein Sachverständiger widerspricht der Darstellung des externen Sachverständigen, es gäbe bei einer Thrombozytopenie Frühwarnsymptome, dies sei keineswegs der Fall. Es gebe schwere Thrombozytopenien bei Patienten ohne klinische Zeichen wie Petechien, dafür aber schwere Blutungen. Chinin erfülle bei einer so variabel verlaufenden Erkrankung nicht die Definition eines Notfallmedikamentes. Nach Aussage eines Sachverständigen treten QT-Verlängerungen bereits bei weniger als den vom externen Sachverständigen genannten 10 g Chinin auf. In der Malariatherapie sehe man häufig auch schon bei Tagesdosen von 1,5-2 g schwere Nebenwirkungen. Diese Menge würde bereits mit 5 Tabletten der vorgeschlagenen ‚Notfallpackung‘ erreicht. Auf Nachfrage der Sachverständigen erläutert ein Vertreter des BfArM, im Rahmen des laufenden Stufenplanverfahrens solle das Anwendungsgebiet auf „second-line“ eingeschränkt werden. Die Anwendung von Chinin würde nur noch dann erlaubt sein, wenn zuvor alle anderen diagnostischen und therapeutischen Maßnahmen wie beispielsweise Physiotherapie ausgeschöpft worden seien. Daher sollten beide Maßnahmen, Stufenplanverfahren und die Unterstellung unter die Verschreibungspflicht, zusammen betrachtet werden. Ein Sachverständiger bezweifelt, dass die Unterstellung unter die Verschreibungspflicht angemessen sei, da die Expositionszahlen so hoch und die Gesamtzahl gemeldeter Nebenwirkungen so niedrig seien. Darauf antwortet ein Vertreter des BfArM, eine relativ niedrige Zahl von Nebenwirkungsmeldungen könne im Fall von Chinin keinesfalls als Beleg für seine Unbedenklichkeit angesehen werden. Vielmehr werde ein über Jahrzehnte apothekenpflichtig erhältliches Arzneimittel von den Patienten und den Ärzten als harmlos wahrgenommen mit der Folge, dass auftretende Nebenwirkungen kausal nicht mit Chinin in Verbindung gebracht würden. 5 Ein Sachverständiger erklärt, er würde für die Unterstellung stimmen, weil die erforderliche Abklärung der Kontraindikationen, insbesondere hinsichtlich der QTVerlängerung, für den Patienten zu komplex sei. Außerdem seien nächtliche Wadenkrämpfe sehr gut durch physikalische Maßnahmen wie Dehnungsübungen zu behandeln. Nach Aussage eines Sachverständigen sei in einem kleinen Glas polnischer Limonade, die Patienten problemlos beschaffen könnten, relativ viel Chinin enthalten. Der Vorsitzende erinnert daran, dass der Ausschuss nur für den Bereich der Arzneimittel zuständig sei. Abstimmung: Der Sachverständigenausschuss für Verschreibungspflicht empfiehlt mehrheitlich, Chinin – zur Anwendung bei Menschen – ausnahmslos der Verschreibungspflicht zu unterstellen. TOP 5 Ketotifen Ein Vertreter des BfArM führt in die Thematik ein (s. Anlage 1). Zu diesem Punkt der Tagesordnung gibt es keine Wortmeldung. Abstimmung: Der Sachverständigenausschuss für Verschreibungspflicht empfiehlt einstimmig, Ketotifen – zur Anwendung am Auge in einer Konzentration von bis zu 0,025% – aus der Verschreibungspflicht zu entlassen. TOP 6 Levonorgestrel zur Notfallkontrazeption Ein Vertreter des BfArM führt in die Thematik ein (s. Anlage 1). Auf die Bitte eines Sachverständigen um Erläuterung der Hinweise in der Fachinformation von levonorgestrelhaltigen Arzneimitteln zur Notfallkontrazeption zur möglichen Wirkungsabschwächung mit zunehmendem Körpergewicht erläutern Vertreter des BfArM, dass diese Hinweise als vorläufig anzusehen seien. Auf europäischer Ebene solle ein Referral-Verfahren eingeleitet werden, das die Datenlage zu allen Wirkstoffen untersuchen wird, die zur Notfallkontrazeption angewendet werden. Ziel dieses Verfahrens sei, auf der Grundlage wissenschaftlicher Evidenz harmonisierte Hinweise in die Produktinformationen aller betroffenen Arzneimittel aufzunehmen bzw. die bestehenden Hinweise anzupassen (Redakt. Anmerkung: das Artikel-31-Referral wurde im Januar 2014 gestartet). 6 Ein Vertreter des BfArM führt aus, dass die Informationstexte von PiDaNa 1,5 mg Tablette® dem europäisch harmonisierten Referenztext eines in Frankreich zugelassenen Arzneimittels entsprächen. Die Tatsache, dass es in Europa ein weiteres levonorgestrelhaltiges Arzneimittel - mit dem Referenzland UK und ohne einen Hinweis zu Wirkungsabschwächung in den Informationstexten - gibt, mache ein Referral erforderlich. Dieses Referral würde auch den Wirkstoff Ulipristal einschließen. Als ein Ergebnis des Verfahrens sei eine Festlegung der Gewichtsgrenzen für die Wirksamkeit der einzelnen Wirkstoffe zu erwarten, ausgedrückt entweder in kg Körpergewicht oder dem Body-Mass-Index. Nachfolgend würden dann die Informationstexte aller betroffenen Arzneimittel angepasst. Zur Anwendung höherer Dosen als 1,5 mg Levonorgestrel lägen keine Studiendaten vor. Auf die entsprechende Frage eines Sachverständigen antwortet ein Vertreter des BfArM, die Rate der Schwangerschaftsabbrüche sei nach den bisher vorliegenden Daten in den Ländern, in denen Notfallkontrazeptiva rezeptfrei erhältlich sind, nicht bzw. kaum rückläufig. Die Gründe für diese Beobachtung seien nicht geklärt. Eine mögliche Erklärung dafür sei, dass eine Notfallkontrazeption mehr von eher vorsichtigen Frauen mit einem geringen Schwangerschaftsrisiko angewendet werde, während die Gruppe der Frauen mit einem durch Risikoverhalten erhöhten Schwangerschaftsrisiko, z.B. durch mehrfachen ungeschützten Verkehr während eines Zyklus, davon seltener Gebrauch machte. Ein Sachverständiger stellt fest, dass ein Vergleich verschiedener Länder bezüglich der Rate von Schwangerschaftsabbrüchen oder Veränderungen der Zahlen aus seiner Sicht nicht zulässig sei. Hauptursache der fehlenden Vergleichbarkeit sei der länderspezifisch, auch innereuropäisch, sehr unterschiedliche Umgang mit der Aufklärung von Kindern und Jugendlichen in Familie und Gesellschaft. Direkte Folge dieser traditionell großen Unterschiede sei, dass in anderen Ländern beispielsweise eine der Bundeszentrale für gesundheitliche Aufklärung (BZgA) vergleichbare Organisation sowie ein mit der Situation in Deutschland vergleichbarer Sexualkundeunterricht an den Schulen fehle. Ein Sachverständiger regt an, jeder Packung eines Notfallkontrazeptivums eine schriftliche Information der BZgA beizufügen. Nach einer Freistellung könne man auf diese Weise gerade wenig aufgeklärten jungen Mädchen viele Informationen vermitteln. Außerdem würde er dafür plädieren, dass nach einer Freistellung nicht für diese Arzneimittel geworben werden dürfe und rege an, die Freistellung an eine solche Auflage zu binden, falls dies möglich sei. Ein Vertreter des BfArM antwortet darauf, dass es im Rahmen der europäischen Verfahren möglich sei, sogenanntes Schulungsmaterial zu beauflagen, das zusammen mit dem Arzneimittel abgegeben wird. Die Möglichkeit der Umsetzung in diesem Fall würde vom BfArM geprüft. Ein weiterer Sachverständiger äußert den Wunsch, die pharmazeutischen Unternehmer würden im Rahmen einer freiwilligen Selbstverpflichtung auf Werbung für Notfallkontrazeptiva verzichten. Aus den Reihen der Sachverständigen kommt die Anregung, das Heilmittelwerbegesetz dahingehend zu ergänzen, dass Werbung für Notfallkontrazeptiva nicht erlaubt sei. Es gebe bereits jetzt sehr gute, von BZgA und pro familia entwickelte Broschüren für diese Notfallsituation, die über die Apotheken verteilt würden. 7 Ein Sachverständiger antwortet darauf, die betreffenden Firmen könnten zwar um größtmögliche Zurückhaltung bezüglich der Werbung gebeten werden, es gebe aber kein Weisungsrecht von Seiten der Industrieverbände. Das Heilmittelwerbegesetz müsse sich am europäischen Recht orientieren und es sei daher nicht möglich, es beliebig zu ergänzen oder zu ändern. Man solle nach einer Freistellung zuerst beobachten, ob überhaupt eine Situation eintritt, in der Maßnahmen ergriffen werden müssten. Ein Vertreter des BMG bestätigt, das Heilmittelwerberecht sei europäisch harmonisiert und seitens der Juristen würden kaum Möglichkeiten für die vorgeschlagene Gesetzesänderung gesehen. Ein Sachverständiger stellt wegen der aus seiner Sicht schlechteren Wirksamkeit die Frage, ob es das Ziel sei, mit Levonorgestrel nur die zweitbeste Substanz frei zu stellen, die dann gegenüber Ulipristal präferiert würde, weil sie leichter zu bekommen sei. Er erkundigt sich außerdem, ob der Ausschuss frei sei, über die verschiedenen Präparationen der Substanz zu entscheiden oder nur über die 1,5 mg Dosis, so dass im Fall einer Ablehnung der 1,5 mg immer noch die zweimal 0,75 mg Dosis zugelassen bzw. frei gestellt bliebe. Außerdem sei die Formulierung aus dem Positionsvorschlag des BfArM „… 1,5 mg und in einer Gesamtmenge von 1,5 mg je Packung“ falsch, da das „und“ durch ein „oder“ zu ersetzen sei. Ein Vertreter des BfArM erinnert daran, dass die Sachverständigen grundsätzlich nur eine Empfehlung zu Wirkstoffen abgeben. Die Freistellung von Levonorgestrel würde durch die Empfehlung eingeschränkt auf - die einmalige orale Anwendung - eine Einzeldosis von 1,5 mg, wobei die Formulierung sowohl die Anwendung in Form einer Tablette wie auch die von 2 Tabletten à 0,75 mg einschließt - eine Gesamtmenge von 1,5 mg je Packung. Das Bindewort „und“ sei beabsichtigt, da es die Packungsgrößenbegrenzung zur Folge habe und damit der intendierten einmaligen Anwendung entspräche. Ein Sachverständiger kommentiert, kürzlich sei in den Medien ausführlich über die Risiken und Nebenwirkungen des bei Schweinen angewendeten Gestagens Altrenogest informiert worden. Es seien offensichtlich bei der EMA in London zu verschiedenen Gestagenen unterschiedliche Meinungen vorhanden. Beim Tier angewendet, würden sie sehr kritisch gesehen, während sie zur Anwendung beim Menschen von der Verschreibungspflicht frei gestellt werden könnten. Da es sich um Nutztiere handele, würden sehr strenge Grenzwerte gelten, während dies beim Menschen nicht der Fall sei. Aus seiner Sicht würde mit zweierlei Maß gemessen. Dazu informiert ein anderer Sachverständiger, hier werde eine Studie des BUND angesprochen, die nicht in allen Punkten fachlich unstrittig sei. Die EMA habe über die Festlegung von MRLs und damit die Wartezeiten zu entscheiden (redakt. Anmerkungen: MRL(„Maximum Residue Limits“) - Rückstandshöchstmengen für Wirkstoffe in Lebensmitteln tierischen Ursprungs. Wartezeiten - zeitlicher Mindestabstand zwischen letzter Arzneimittelgabe und Schlachtung, um eine Belastung des Menschen durch Wirkstoffrückstände im Fleisch zu vermeiden). Es handele sich daher um sehr unterschiedliche Sachverhalte, die nicht miteinander vermischt werden sollten. 8 Bezüglich der vorgeschlagenen Position zu LNG schlage er vor, sie um „…in einer Einzeldosis von bis zu 1,5 mg…“ zu ergänzen, damit eindeutig auch die 0,75 mgTablette eingeschlossen sei. Ein Vertreter des BfArM stimmt dem zu. Der Zusatz werde in die Position aufgenommen, die später zur Abstimmung komme. Ein Vertreter des BfArM informiert darüber, dass zu dem anderen, zentral zugelassenen Notfallkontrazeptivum EllaOne® mit dem Wirkstoff Ulipristal bei der EMA ein Verfahren zur Entlassung aus der Verschreibungspflicht anhängig sei. Ein Vertreter des BMG erkundigt sich, wie wahrscheinlich es denn sei, dass eine Anwenderin LNG im Fall einer Freistellung häufiger anwenden würde und ob die nach der Apothekenbetriebsordnung übliche Beratung als ausreichend anzusehen wäre. Darauf antwortet ein Vertreter des BfArM, dass es bei häufigerer Einnahme zu Zyklusstörungen mit resultierenden Blutungsstörungen komme, die von den Frauen nicht erwünscht seien. Daher sei eine solche häufigere Anwendung aus seiner Sicht nicht wahrscheinlich. Ein Vertreter des BMG erkundigt sich danach, ob keine schweren Nebenwirkungen bei Anwendung von Levonorgestrel bekannt seien. Ein Vertreter des BfArM antwortet, entsprechende Recherchen in den vorliegenden klinischen Studien sowie der UAW-Datenbank des BfArM hätten ergeben, dass keine ursächlich auf Levonorgestrel zurück zu führenden schweren Nebenwirkungen berichtet worden seien. Der Vorsitzende ergänzt, ein völliges Fehlen von Arzneimittelrisiken sei von keinem wirksamen Arzneimittel bekannt. Ein anderer Sachverständiger erinnert daran, dass eine Vielzahl von Arzneimitteln rezeptfrei verfügbar sei, die erheblich toxischer seien als Levonorgestrel, z.B. verdreifache Diclofenac das Mortalitätsrisiko. Ein Vertreter des BfArM erinnert daran, dass es sich außerdem um eine Einmalanwendung in einer niedrigen Dosis handele. Dies sei nicht zu vergleichen mit der Daueranwendung von Hormonpräparaten, die mit dem bekannten Thromboembolierisiko verbunden sei. Bei Einmalanwendung seien alle Anwendungserfahrungen in Übereinstimmung mit den Ergebnissen der vorgestellten Daten zu Levonorgestrel positiv. Ein Sachverständiger erkundigt sich nach Daten zur Altersverteilung der Anwenderinnen der Notfallkontrazeption. Der Vertreter des BfArM informiert darüber, dass nach dem GKV-Arzneiverordnungsreport (redakt. Anmerkung: Daten der gesetzlichen Krankenkassen über zu ihren Lasten ausgestellte Rezepte, d.h. Anzahl selbst bezahlter Rezepte unbekannt) von ca. 400.000 jährlich ausgestellten Rezepten nur ca. 50.000 an unter 20-jährige Anwenderinnen abgegeben würden. Ein Sachverständiger ergänzt, dass nach den Zahlen eines Bundeslandes die Verteilung der Verordnungszahlen aussehe wie folgt: Auf die Altersgruppe der unter 15-jährigen entfielen ca. 2%, 15-16 Jahre 20%, 17-18 Jahre 37% und auf die Altersgruppe 19-20 Jahre 27%. 9 International liege der Anwendungsschwerpunkt in den rund 80 Ländern, in denen die Notfallkontrazeption seit Jahren bzw. Jahrzehnten rezeptfrei erhältlich sei, in der Altersgruppe der 20-24-Jährigen. Auf die entsprechende Frage des Vorsitzenden antwortet ein Vertreter des BfArM, bei der als ‚umstritten‘ bezeichneten Studie handele es sich um eine Subgruppenanalyse randomisierter Studien, bei denen Levonorgestrel mit Ulipristal verglichen wurde, mit Fokus auf dem Körpergewicht der Anwenderinnen. Es sei keine prospektiv geplante Subgruppenanalyse, sondern eine retrospektive Metaanalyse von Studiendaten. Aus seiner Sicht sei der gezeigte Effekt, d.h. ein mit höherem Körpergewicht zunehmendes Schwangerschaftsrisiko, für Levonorgestrel signifikant. Bei höherem Gewicht und Body-Mass-Index gebe es für Ulipristal einen Trend zu höheren Schwangerschaftsraten. Man könne über Details der Subgruppenanalyse durchaus diskutieren. So seien Studien einbezogen worden, in denen Ulipristal z.B. nicht in der in Europa zugelassenen Darreichungsform verwendet worden sei, sondern in einer davon abweichenden Form, die vermutlich zu dem in Europa zugelassenen Arzneimittel nicht bioäquivalent sei. Diese Fragen würden in dem anstehenden europäischen Referral fachlich diskutiert. (redakt. Anmerkung: Nach der Metaanalyse wurden insgesamt 60 von 3445 Frauen trotz Notfallkontrazeption schwanger. 27 dieser Frauen waren normalgewichtig, 13 hatten ein höheres Körpergewicht (BMI < 29.9 kg/m2) und 20 waren korpulent (BMI (≥ 30 kg /m2. Die Ergebnisse der Metaanalyse sind teilweise publiziert: Glasier et al. Contraception 84, 363 – 367 [2011]). Ein Sachverständiger schlägt vor, eine Empfehlung des Ausschusses für eine Freistellung zu verknüpfen mit speziellem Informationsmaterial und vielleicht auch spezieller Beratung durch den Apotheker. Er und ein weiterer Sachverständiger hielten das Argument des Zeitgewinns durch die schnellere Verfügbarkeit nach einer Entlassung aus der Verschreibungspflicht nicht für so schwerwiegend. Jede Frau könne sich schon vorab, ohne einen bereits eingetretenen Notfall, beim Arzt beraten lassen und dieser könne dann ein Rezept für ein Notfallkontrazeptivum ausstellen. Ein anderer Sachverständiger spricht sich dafür aus, dass der Apotheker eine korrekte Beratung vornehmen solle und erkundigt sich, ob man die wichtigsten Inhalte, über die der Apotheker beraten solle, auf einem Informationsblatt festlegen könne. Ein Sachverständiger antwortet, die überwiegende Zahl der Verordnungen würde im Rahmen einer nächtlichen Notfallkonsultation am Wochenende erfolgen und diese würden auch überwiegend im Nachtdienst der Apotheken eingelöst. Es sei unrealistisch anzunehmen, dass zu jeder Tageszeit und in jeder Apotheke Deutschlands eine umfassende gynäkologische Beratung erfolgen könne. Bisher erfolge die Beratung durch den Arzt. Die Bundesapothekerkammer habe jedoch bereits seit 2005, als Reaktion auf das erste Votum des Ausschusses zur Freistellung von Levonorgestrel im Jahr 2003 und in Vorbereitung auf die bisher nicht erfolgte Umsetzung durch das BMG, ein Curriculum verabschiedet sowie Informationshilfen und eine mit der BZgA und pro familia abgestimmte Broschüre erstellt. Diese Materialien seien verfügbar, nach einem erneuerten positiven Votum würden sie zügig aktualisiert. Im Falle einer Entlassung von LNG-Notfallkontrazeptiva aus der Verschreibungspflicht würden die Landesapothekerkammern mit diesen Unterlagen ihrer Pflicht zur Schulung der 10 Apothekerinnen und Apotheker hinsichtlich der kompetenten Beratung zur Notfallkontrazeption nachkommen. Insofern würde die berechtigte Forderung nach Informationen, die Qualitätsstandards genügen, erfüllt. Ein weiterer Sachverständiger weist darauf hin, Vertreter der Apotheker hätten in zwei Anhörungen dargelegt, sie seien in der Lage und bereit, ausführliche Beratungen durchzuführen. Auf die Frage nach dem möglichen Bezug der Arzneimittel über das Internet antwortet ein Vertreter des BfArM, Patienten könnten eine Vielzahl verschreibungspflichtiger und apothekenpflichtiger Arzneimittel über das Internet beziehen. Dies könnten die Strafverfolgungsbehörden zwar eindämmen, aber nicht vollständig unterbinden. Im Zusammenhang mit der Notfallkontrazeption sei es nicht wahrscheinlich, dass eine betroffene Frau das Arzneimittel im Internet bestellen und sich auf Auftragsbearbeitung und postalische Zusendung an einem der nächsten Werktage verlassen würde, anstatt in die nächste Apotheke zu gehen. Auf Nachfrage von Sachverständigen weisen Vertreter des BfArM darauf hin, dass der Ausschuss im Fall einer Entlassung von Levonorgestrel aus der Verschreibungspflicht zwar keine rechtlich bindenden Auflagen aussprechen könne, dass aber der Wunsch nach Beratung durch die Apotheken sowie die zuvor gegebenen Informationen über die geplanten Schulungen von Apothekern durch dieses Protokoll publik gemacht würden. Daraufhin erfolgen keine weiteren Wortmeldungen. Abstimmung: Der Sachverständigenausschuss für Verschreibungspflicht empfiehlt mehrheitlich, Levonorgestrel – in Zubereitungen zur Notfallkontrazeption ohne Zusatz weiterer arzneilich wirksamer Bestandteile zur einmaligen oralen Anwendung in einer Einzeldosis von bis zu 1,5 mg und in einer Gesamtmenge von 1,5 mg je Packung – aus der Verschreibungspflicht zu entlassen. TOP 7 Verpflichtende Dosierungsangaben auf dem Rezept Ein Vertreter des BMG führt in die Thematik ein (s. Anlage 1). Nach Ansicht eines Sachverständigen dürfte es aufgrund der geringen Größe von Rezepten schwierig werden, Dosierungsempfehlungen zu mehreren Arzneimitteln in lesbarer Form auf dem Rezept zu dokumentieren. Vertreter des BMG informieren, dass die Vertragspartner in der kassenärztlichen Versorgung über neue Formulare zu entscheiden hätten. Das BMG selbst sei möglichen Lösungen gegenüber offen. Mehrere Sachverständige sehen einen erhöhten Verwaltungsaufwand für die Ärzte. Jede Praxissoftware sei in der Lage, Medikationspläne auszudrucken, die erheblich übersichtlicher seien als Angaben auf dem Rezept. Die Übertragung von Informationen in ein neues Formular und später auf die Arzneimittelpackungen sei 11 mit Fehlermöglichkeiten behaftet. Hinzu kämen die Schwierigkeiten, die sich aus notwendigen Änderungen der Dosierung ergäben. Daher sei ein Medikationsplan als Dokumentationsmittel vorzuziehen. Der Vorschlag sei daher, von der Dosierungsangabe auf dem Rezept in den Fällen abzusehen, in denen eine schriftliche Dosierungsanweisung des Arztes bzw. ein Medikationsplan vorliegt. Dies würde auch den Umgang mit Dosierungsänderungen während der Verbrauchszeit einer Arzneimittelpackung erleichtern, wie beispielsweise bei Kortikoiden. Ein Sachverständiger macht auf mögliche Schwierigkeiten der praktischen Umsetzung aufmerksam. Auch in Spezialsprechstunden von Fachärzten wäre diese Vorschrift für chronisch kranke Patienten mit häufig wechselnden Dosierungen schwer umzusetzen. Aus Sicht eines Sachverständigen sollte die Verbreitung von Medikationsplänen gefördert werden. Insbesondere sollten schnellstmöglich die technischen Möglichkeiten für deren regelmäßige Erstellung und Aktualisierung geschaffen werden. Ein Medikationsplan sei sehr gut geeignet, die Qualität der Medikationsanamnese bei Krankenhausaufnahme und der Informationsübermittlung bei Entlassung zu verbessern. Darüber hinaus würden Dosierungsfehler etwa bei niereninsuffizienten Patienten besser erkennbar. Ein Vertreter des BMG erläutert, Regelungen zu Art und Inhalt der Verschreibung seien in der Arzneimittelverschreibungsverordnung vorgesehen. Angaben zur Dosierung gehörten zum Inhalt der Verschreibung, mithin sei die rechtliche Grundlage für die beabsichtigte Ergänzung gegeben. Ein Sachverständiger plädiert für die Einführung eines Auswahlkästchens zum Ankreuzen „Medikationsplan liegt vor“ auf dem Rezept. Gerade in der Geriatrie wäre eine breite Versorgung der Patienten mit Medikationsplänen sehr wünschenswert und eine große Verbesserung. Dieser Vorschlag wird von anderen Sachverständigen unterstützt. Ein Sachverständiger bringt den Antrag zur Abstimmung ein, auf dem Rezept ein Auswahlkästchen zum Ankreuzen „Medikationsplan liegt vor“ aufzunehmen. Nur wenn dies angekreuzt sei, dürfe auf eine zusätzliche Dosierungsangabe auf dem Rezept verzichtet werden. Abstimmung: Der Sachverständigenausschuss für Verschreibungspflicht empfiehlt mehrheitlich die Aufnahme folgender Ergänzungen in die AMVV: Bei Arzneimitteln, die zur Anwendung beim Menschen bestimmt sind, sind Dosierungsangaben auf in Deutschland ausgestellten und eingelösten Rezepten verpflichtend einzutragen, es sei denn, es liegt dem Patienten ein Medikationsplan, der das verordnete Arzneimittel umfasst, oder eine entsprechende schriftliche Dosierungsanweisung der ärztlichen Person vor. 12 TOP 8 Verschiedenes Informationen zur Zulassung von Nexium Control 20 mg in der EU (Entlassung von Esomeprazol aus der Verschreibungspflicht) und der daraus folgenden Änderung der AMVV Ein Vertreter des BMG führt in die Thematik ein. Das BMG informiert die Sachverständigen über seine Absicht, im Rahmen der nächsten Änderungsverordnung die Position zu Esomeprazol, in Anlehnung an die Position zu Omeprazol, zu ändern in: Esomeprazol - ausgenommen zur Behandlung von Sodbrennen und saurem Aufstoßen in einer Einzeldosis von 20 mg und in einer Tageshöchstdosis von 20 mg für eine maximale Anwendungsdauer von 14 Tagen und in einer maximalen Packungsgröße von 280 mg Wirkstoff. Da es zu dieser Information keine Wortmeldungen gibt, beschließt der Vorsitzende die Sitzung und bedankt sich bei den Mitgliedern für ihre Beiträge. Termin der nächsten Sitzung: Dienstag, der 01.07.2014 Beginn: 10.00 Uhr Sitzungsort: Bonn Kurt-Georg-Kiesinger-Allee 3 Anlagen Anlage 1: Voten und Begründungen zu Positionen, deren Änderung zugestimmt wird (zu TOP4, 5, 6 und 7) Anlage 2: Präsentation zu TOP 4 externer Sachverständiger 13