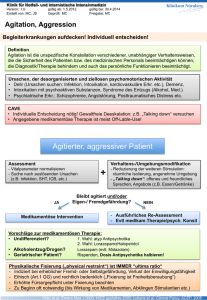
Psychopharmaka im Kindes
Werbung

Diplomarbeit „Wenn Kinderseelen Hilfe brauchen“ Psychopharmaka im Kindes- und Jugendalter eingereicht von Anna Scherz zur Erlangung des akademischen Grades Doktor(in) der gesamten Heilkunde (Dr. med. univ.) an der Medizinischen Universität Graz ausgeführt am Institut für experimentelle und klinische Pharmakologie unter der Anleitung von Univ.-Prof.i.R. Mag.pharm. Dr. Eckhard Beubler und Univ.-Prof. Dr.med.univ. Josef Donnerer Graz, 5. September 2016 Eidesstattliche Erklärung Ich erkläre ehrenwörtlich, dass ich die vorliegende Arbeit selbstständig und ohne fremde Hilfe verfasst habe, andere als die angegebenen Quellen nicht verwendet habe und die den benutzten Quellen wörtlich oder inhaltlich entnommenen Stellen als solche kenntlich gemacht habe. Graz, am 5. September 2016 Anna Scherz eh 2 Vorwort Im Laufe meines Lebens bin ich bereits vielen Menschen mit vielen verschiedenen Lebensgeschichten und Erkrankungen begegnet. Als ich mich für eine berufliche Ausbildung entscheiden musste, stand für mich ohne Zweifel fest, das Studium der Medizin zu wählen, mit dem Wunsch nach Studienabschluss im Bereich der Kinder- und Jugendheilkunde zu arbeiten. Aus diesem Grund und da ich schon privat mit der Kinder- und Jugendpsychiatrie im Berührung kam, absolvierte ich einen Teil meines klinisch-praktischen Jahres in der Abteilung für Kinder- und Jugendpsychiatrie im Kepler Universitätsklinikum Linz. Dort konnte ich in direkten Kontakt mit Kindern und Jugendlichem mit psychiatrischen Erkrankungen treten und einige dieser Kinder werden mir noch lange in Erinnerung sein. Zu dieser Zeit begann ich mich mit psychiatrischen Erkrankungen und ihren therapeutischen Möglichkeiten auseinanderzusetzen und bemerkte das große Defizit, welches die zugelassen Medikamente betrifft. Aus diesem Grund entstand auch die Motivation meine Diplomarbeit über das Thema „Psychopharmaka im Kindes- und Jugendalter“ zu schreiben, um eine Übersicht über die medikamentösen Möglichkeiten zu erstellen. 3 Danksagung Ich möchte meinem Betreuer, Univ.-Prof.i.R. Mag.pharm. Dr. Eckhard Beubler, danken, der mir die Bearbeitung dieses Themas ermöglicht hat. Ein weiterer Dank gilt meiner Familie, die mich während meines Studium und beim Verfassen dieser Diplomarbeit im Rahmen ihrer Möglichkeiten immer unterstützt hat. 4 Zusammenfassung Viele Medikamente werden in der Kinderheilkunde im „Off-Label-Use“ verwendet, so auch Psychopharmaka zur Unterstützung und Ergänzung bei der psychotherapeutischen Behandlung. In der Öffentlichkeit wird der Gebrauch von Psychopharmaka eher skeptisch gesehen und zum Teil heftig diskutiert. Dies liegt unter anderem daran, dass sich Kinder noch in der Entwicklung befinden und viele Eltern Angst haben, dass sich solche Medikamente langfristig auf ihr Kind auswirken und die natürliche Entwicklung schädigen. Das Gebiet der Kinder- und Jugendpsychiatrie selbst ist noch „ jung“ in der Medizin und somit gibt es wenig klinische Studien zur Wirkung von Psychopharmaka im Kindes- und Jugendalter. Darum stützt sich die Anwendung oftmals auf die Erfahrung der behandelnden Ärztin / des behandelnden Arztes. Die zentrale Fragestellung in dieser Diplomarbeit ist, welche Indikationen es für Psychopharmaka im Kindes- und Jugendalter gibt und ob es Unterschiede in den Anwendungsgebieten zum Erwachsenen gibt. Abstract In paediatrics a lot of drugs are used in the so-called “off-label-use”, such as psychiatric medication in addition to psychotherapy of psychiatric disorders of children. In the public opinion these drugs are often frowned upon and their necessity is more often than not argued about because children are still developing and therefore a lot of parents are afraid about negative long-term effects. Paediatric psychiatry is one of the most recent domains of medicine and therefore few studies about the impact of psychiatric medication exist. A lot depends on the practical experience of doctors. The aim of this diploma thesis is the find out which indications of paediatric disorders require psychiatric medications, how they influence the patients and if there is a distinction between juveniles and adults. 5 Inhaltsverzeichnis Vorwort ................................................................................................................... 3 Danksagung ........................................................................................................... 4 Zusammenfassung ................................................................................................. 5 Abstract .................................................................................................................. 5 Glossar und Abkürzungen ...................................................................................... 8 Tabellenverzeichnis .............................................................................................. 10 1. Einleitung.......................................................................................................... 11 2. Allgemeines zur Psychopharmakotherapie ...................................................... 14 2.1. Grundlagen und Definitionen ..................................................................... 14 2.2. Entwicklungspsychopharmakologie ........................................................... 15 2.3. Rechtliche und ethische Aspekte ............................................................... 16 3. Antidepressiva .................................................................................................. 17 3.1. Trizyklische Antidepressiva ........................................................................ 18 3.2. Selektive Serotonin-Wiederaufnahmehemmer ........................................... 21 3.3. Selektive Noradrenalin-Wiederaufnahmehemmer (NRIs) .......................... 24 3.4. Serotonin-Noradrenalin-Wiederaufnahmehemmer (SNRIs) ....................... 25 3.5. Monoamin-Oxidase-Hemmer ..................................................................... 26 3.6. α2-Adrenozeptor-Antagonisten ................................................................... 27 3.7. Andere antidepressiv wirkende Arzneimittel .............................................. 27 4. Antipsychotika .................................................................................................. 29 4.1. Klassifikationen und Einteilungen............................................................... 29 4.2. Wirkungen .................................................................................................. 31 4.3. Klinische Psychopharmakologie................................................................. 32 4.4. Psychiatrische Indikationen für Antipsychotika........................................... 34 5. Sedativa/Hypnotika und Anxiolytika ................................................................. 36 6 5.1. Klassifikation .............................................................................................. 36 5.2. Benzodiazepine.......................................................................................... 37 5.3. Antidepressiva........................................................................................... 38 5.4. Niedrigpotente Antipsychotika .................................................................... 38 5.5. Andere Arzneimittel .................................................................................... 39 6. Stimulanzien und bei ADHS verwendete Medikamente ................................... 41 6.1. Klassifikation .............................................................................................. 41 6.2. Wirkungsmechanismen .............................................................................. 42 6.3. Klinische Psychopharmakologie................................................................. 42 7. Stimmungsstabilisatoren .................................................................................. 45 7.1. Wirkungsmechanismus .............................................................................. 45 7.2. Klinische Psychopharmakologie ausgewählter Arzneistoffe ...................... 46 8. Psychische Erkrankungen im Kindes- und Jugendalter ................................... 49 8.1. Aggressives Verhalten und Störungen des Sozialverhaltens ..................... 49 8.2. Angststörungen und Phobien ..................................................................... 50 8.3. Autismus .................................................................................................... 51 8.4. ADHS ......................................................................................................... 52 8.5. Enuresis / Enkopresis ................................................................................ 53 8.6. Depressive Störungen und Manie .............................................................. 54 8.7. Schizophrenie ............................................................................................ 55 8.8. Schlafstörungen ......................................................................................... 56 8.9. Tic-Störungen............................................................................................. 56 8.10. Zwänge .................................................................................................... 57 8.11. Essstörungen ........................................................................................... 58 9. Conclusio.......................................................................................................... 60 10. Literaturverzeichnis ........................................................................................ 61 7 Glossar und Abkürzungen - = keine bis schwache Wirkung + = leichte Wirkung ++ = mittlere Wirkung +++ = starke Wirkung AACAP = American Academy of Child and Adolescent Psychiatry ADHS = Aufmerksamkeitsdefizit-Hyperaktivitäts-Syndrom AN = Anorexia nervosa („Magersucht“) AV-Kanal = atrioventrikulärer Septumdefekt, angeborener Herzfehler, Kombination aus Ventrikelseptumdefekt und Vorhofseptumdefekt BMI = Body-Mass-Index BN = Bulimia nervosa („Ess-Brech-Sucht“) CYP = Cytochrom P450, eine Hämoprotein mit enzymatischer Aktivität DGBS = Deutsche Gesellschaft für Bipolare Störungen DGKJP = Deutsche Gesellschaft für Kinder- und Jugendpsychiatrie DGPPN = Deutsche Gesellschaft für Psychiatrie und Psychotherapie, Psychosomatik und Nervenheilkunde Dyspepsie = Symptomkomplex unterschiedlicher Ursache mit Oberbauchbeschwerden EMA = European Medicines Agency = Europäische Arzneimittel- Agentur EPS = Extrapyramidal Syndrom, eine Gruppe von Nebenwirkungen 8 Hypothyreose = Unterfunktion der Schilddrüse i.d.R = in der Regel MAO = Monoamin-Oxidase MDMA = 3,4-Methylendioxy-N-methylamphetamin, auch „Ecstasy“, gehört zur Gruppe der Amphetamine NRI = (selektiver) Noradrenalin-Reuptake-Inhibitor = (selektiver) Noradrenalin- Wiederaufnahme-Hemmer „Off-Label-Use“ = Anwendung von Medikamenten außerhalb des Zulassungsbereichs Pankreatitis = Entzündung der Bauchspeicheldrüse PEG = Polyethylenglykol, als Macrogel als Laxans verwendet Pharmakokinetik = Teilbereich der Pharmakologie, beschreibt die Einwirkung des Organismus auf das eingenommene Arzneimittel SNRI = Serotonin-Noradrenalin- Reuptake-Inhibitor = SerotoninNoradrenalin- Wiederaufnahme-Hemmer SSRI = selektiver Serotonin-Reuptake-Inhibitor = selektiver Serotonin-Wiederaufnahme-Hemmer SSV = Störung des Sozialverhaltens TDM = therapeutisches Drug-Monitoring (Bestimmung der Konzentration eines Wirkstoffes im Blut zu Therapiekontrolle) UAWs = unerwünschte Arzneimittelwirkungen u.ä. = und ähnliche(s) WHO = World Health Organisation = Weltgesundheitsorganisation 9 Tabellenverzeichnis Tab. 1. Wirkungsspektrum ausgewählter trizyklischer Antidepressiva (Mod. nach Bezchlibnyk-Butler u. Virani 2007 [6]) (S. 18) Tab. 2. Tagesdosen ausgewählter trizyklischer Antidepressiva (Mod. nach Taurines et al. 2014 [7]) (S. 18) Tab. 3. Wirkungsspektrum ausgewählter SSRIs (Mod. Nach Bezchlibnyk-Butler u. Virani 2007 [6]) (S. 20) Tab. 4. Tagesdosen ausgewählter SSRIs (Mod. nach Taurines et al. 2014 [7]) (S. 21) Tab. 5. Übersicht ausgewählter Antipsychotika nach ihrer antipsychotischen Potenz (Mod. nach Möller et al. 2001 [24]) (S. 29) Tab. 6. Psychiatrische Indikationen und geeignete Antipsychotika zur Therapie (Dosierungsempfehlungen für Kinder und Jugendliche) (Mod. nach Gerlach et al. 2016 [2]) (S. 33) Tab. 7. Dosierungsempfehlungen der bei ADHS verwendeten Arzneimittel im Kindes- und Jugendalter (Mod. nach Gerlach et al. 2016 [2]) (S. 43) 1. Einleitung „Wenn Kinderseelen Hilfe brauchen“ – ein auf den ersten Blick relativ harmloser Ausspruch, der aber bei genauerer Betrachtung ein komplexes und vielschichtiges Thema beinhaltet. Kinder befinden sich im Wachstum und in einer ständigen Entwicklung, sowohl psychisch als auch physisch. Aus diesem Grund ist eine genaue Differenzierung zwischen „normalen“ und „krankhaftem“ Verhalten erforderlich bevor irgendeine Therapie, egal ob psychotherapeutisch oder medikamentös, gestartet wird. Zusätzlich spielt das soziale Umfeld eine große Rolle, da dieses einen großen Einfluss auf Entwicklung und Reifung eines Menschen hat und im Falle einer Therapie mit eingebunden werden soll. Dies trifft vor allem in der Kinder- und Jugendpsychiatrie zu, da in diesen Fällen die Psyche mit ihren Störungen behandelt werden soll, aber eine psychische Auffälligkeit nicht immer gleichbedeutend mit einer Therapieindikation ist. Oft glauben Eltern, dass ihr Kind an einer psychiatrischen Erkrankung „leidet“, dies aber aus Sicht der Ärztin / des Arztes nicht der Fall ist, oder umgekehrt. Darum benötigt es eine genaue Diagnosestellung und die Aufklärung der Eltern, dass es beim Einsatz von Psychopharmaka strenge Indikationen und Kontrollen gibt. Zu wissen ist auch, dass noch andere Arten von Therapien existieren, wie zum Beispiel die Psychotherapie, die mit der medikamentösen Behandlung verbunden werden, im Sinne eines ganzheitlichen Konzeptes. Im Rahmen dieses Konzeptes erfahren die Kinder Unterstützung, um sich altersgerecht (weiter- )entwickeln zu können, weswegen eine Formulierung von zu behandelnden Zielsymptomen wichtig ist. Ein Erfahrungsbericht aus meiner eigenen medizinischen Ausbildungszeit soll dies veranschaulichen: „M.S. kam mit Trisomie 21 (Down-Syndrom) zu Welt. Bei seiner Geburt stellten die Ärzte einen Herzfehler, genauer einen AV-Kanal, fest, der operativ behandelt wurde. Bis auf eine medikamentös substituierte Hypothyreose ist er sonst körperlich gesund. In der geistigen Entwicklung zeigten sich die für Trisomie bekannten Einschränkungen, dennoch entwickelte sich M. bis zu seinem 12. 11 Lebensjahr für seine Familie zufriedenstellend. Vom Charakter her zeigte sich M. als ein fröhliches Kind, das gerne lachte und reges Interesse an seinem Umfeld zeigte. Im Kindergarten sowie in der Schule besuchte der Junge eine IntegrationsGruppe bzw. -Klasse, die die geistige Entwicklung fördern und unterstützen sollte. Gleichzeitig sollte M. dadurch die Möglichkeit haben, sich in soziale Gruppen zu integrieren. Kurz nach seinem 12. Geburtstag beobachtete die Familie jedoch eine Veränderung seines Verhaltens. Der Bub zog sich immer mehr zurück, interagierte von sich aus nicht mehr mit der Umwelt, lachte auch nicht mehr so oft wie früher und machte generell einen eher abweisenden Eindruck. Zusätzlich entwickelte er Ein- und Durchschlafstörungen und Tendenzen zur Autoaggressivität (Kratzen mit Fingernägel am Unterarm bis die Haut gerötet war u.ä.). Da die Eltern sehr besorgt um ihr Kind waren, suchten sie einen Arzt für Kinder- und Jugendpsychiatrie auf und fragten diesen um Rat. Nachdem sich dieser die Vorgeschichte anhörte und einige Untersuchungen zum Ausschluss einer organischen Erkrankung durchführte (EKG, EEG, MRT des Schädels), fand ein ausführliches Beratungsgespräch bezüglich medikamentöser und psychotherapeutischer Optionen statt. In diesem distanzierte sich der Arzt aber von einer Psychopharmakotherapie mit der Begründung, dass M. sich noch mitten in seiner Entwicklung befinde und die beginnende Pubertät ihren Teil zum veränderten Verhalten beitragen kann und aus seiner Sicht eine Medikamentengabe noch nicht zwingend indiziert sei. Er riet den Eltern dazu, den Jungen immer wieder in die Kommunikation und Interaktion zu „zwingen“ und den sozialen Rückzug nicht zu fördern. Sollte dies im Laufe der nächsten Monate keine Besserung bewirken, könnte man noch immer eine Behandlung mit Psychopharmaka starten. Da die Eltern einer solchen Behandlung eher skeptisch gegenüberstanden, wurde eine psychotherapeutische und tiergestützte Therapie begonnen, die die Geschwister und Eltern mit einbezog. Im Laufe der nächsten 5 Jahre trat M. wieder vermehrt mit seiner Umwelt in Kontakt, auch das Lernen besserte sich nach einem Schulwechsel wieder. Als der Junge ungefähr 17 Jahre alt war, meinte die Familie, dass „er wieder der alte M. ist, den sie kennen“ und sie froh sind keine Medikamente benötigt zu haben, auch wenn der Weg lang und teilweise frustrierend war. Mittlerweile befindet sich M. in 12 einer Tagesstätte, hat viel Freude im Leben und macht in seiner Entwicklung immer wieder große Fortschritte. “ Dieses Fallbeispiel zeigt einen Jungen mit Symptomen einer Depression, die bei schwerer Ausprägung in vielen Fällen eine medikamentöse Therapie erfordert. In diesem Fall wurde aber auf eine Psychotherapie gesetzt, da die Familie bereit war, sich die Zeit zu nehmen M. aus seinem „Schneckenhaus“ herauszuholen. Wäre dies nicht der Fall gewesen, hätte man sehr wahrscheinlich eine zusätzliche Therapie mit Antidepressiva gestartet, um einerseits dem Jungen besser helfen zu können und um andererseits das soziale Umfeld etwas zu entlasten. Doch was tun, wenn es heißt „ihr Kind braucht Psychopharmaka“? Welche Medikamente gibt es und wie werden sie eingesetzt? Der Einsatz von Psychopharmaka bei Kindern und Jugendlichen ist sowohl in der Öffentlichkeit als auch teilweise in der Fachwelt umstritten, es kommt immer wieder zu Diskussionen, wann und wie diese Medikamente verwendet werden dürfen bzw. sollen. Ziel dieser Diplomarbeit ist eine Übersicht über die verwendeten Psychopharmaka und eine kurze Beschreibung ihrer Anwendungsgebiete. 13 2. Allgemeines zur Psychopharmakotherapie 2.1. Grundlagen und Definitionen Die Pharmakologie im Allgemeinen beschäftigt sich mit der Wechselwirkung zwischen einem Stoff und einem Lebewesen. Sobald ein Stoff mit einem Lebewesen in Wechselwirkung tritt, wird er als Wirkstoff oder Pharmakon bezeichnet. Der Begriff „Pharmakon“ ist im Gegenteil zu den Bezeichnungen „Arzneistoff“ und „Gift“ nicht wertend. Ein Arzneistoff nützt dem Körper, da er Krankheiten heilt, lindert oder verhindert. Sobald dieser in eine zur Anwendung geeignete Arzneiform (Tablette, Lösung, Salbe etc.) gebracht wurde, wird er als Arzneimittel bezeichnet [1], das Fach dazu als Galenik. Bevor ein Arzneimittel aber zum Einsatz kommen darf, muss dessen therapeutische Wirksamkeit und Unbedenklichkeit nachgewiesen werden. Die Wirksamkeit („efficacy“) wird meist mit Hilfe von klinischen Versuchen geprüft, wobei das Hauptaugenmerk auf Morbidität und/oder Mortalität liegt. Die Unbedenklichkeit („safety“) wird anhand des Risikos von unerwünschten Arzneimittelwirkungen (UAWs) ermittelt, die während oder in zeitlichen Zusammenhang mit der Behandlung entstehen [2]. Als Teilgebiet der Neuropharmakologie beschäftigt sich die Psychopharmakologie mit Medikamenten, die Einfluss auf psychische Prozesse des Menschen nehmen, mit dem Ziel psychopathologische Syndrome und psychische Erkrankungen zu mildern oder gar ganz zu beseitigen. Unterteilt werden diese Arzneimittel grob nach ihrem therapeutischen Effekt, da aber die meisten Psychopharmaka ein breites Wirkungsspektrum haben, können viele Arzneistoffe mehreren Kategorien zugeteilt werden. Es gibt folgende Kategorien: - Antidementiva (Nootropika) - Antidepressiva (älter: Thymoleptika) - Anitpsychotika (Neuroleptika) - Anxiolytika (Ataraktika) und Hypnotika (Sedativa) - Psychostimulanzien (Psychoanaleptika, Psychotonika) - Stimmungsstabilisatoren (Phasenprophylaktika) - Arzneimittel zur Behandlung von Abhängigkeit und Entzugssymptomen 14 2.2. Entwicklungspsychopharmakologie Die Entwicklungspsychopharmakologie befasst sich mit allen Fragestellungen bezüglich der Anwendung von Neuro-/ Psychopharmaka im Kindes- und Jugendalter, der Arzneimittelsicherheit und den Rahmenbedingungen einer medikamentösen Behandlung. Somit werden auch Einflüsse der alters- und geschlechtsabhängigen geistigen und körperlichen Reifung und Entwicklung berücksichtigt. Dabei ist ein wichtiger Aspekt die Zugrundelegung einer normalen Entwicklung. Da man davon ausgehen kann, dass bei einem Säugling ein Arzneimittel anders wirkt als bei einem Jugendlichen, muss man die Behandlung immer in Bezug zum Alter und zum biologischen und psychosozialen Entwicklungsstand des Patienten sehen. Beispielsweise haben Kinder zwar eine höhere gastrointestinale Resorptionsrate als Erwachsene, anderseits ist das Bindungsvermögen von lipophilen Arzneistoffen an Plasmaproteine und Fettgewebe bei Kindern niedriger. Dies kann erklären warum bei gleicher, auf das Körpergewicht bezogener Dosis, die Bioverfügbarkeit und das Risiko für das Auftreten von UAWs bei Kindern erhöht ist. Weiters haben Kinder meist eine höhere glomeruläre Filtrationsrate, wodurch Medikamente schneller renal ausgeschieden werden (Vgl. [2]). Berücksichtigt man die Entwicklungspsychopharmakologie, ist eine individuelle Dosisanpassung durch das therapeutische Drug-Monitoring (TDM) möglich. Bei diesem wird die Konzentration eines Arzneimittels im Blut bestimmt, mit dem Ziel, Informationen über die Pharmakokinetik zu erhalten und so die Dosis adaptieren zu können. Dies beruht auf der Annahme, dass die Wirkstoffkonzentration im Blut ein besseres Maß für die Konzentration am Wirkort selbst (z.B. ZNS) darstellt als die Dosierung alleine [3]. Außerdem wird davon ausgegangen, dass eine Beziehung zwischen Konzentration und klinischem Effekt (therapeutische Wirkung, UAWs) besteht. Da aber noch zu wenig über altersspezifische therapeutische Blutspiegel bekannt ist, wurde Ende 2008 das internationale „Kompetenznetz Therapeutisches Drug Monitoring Kinder- und Jugendpsychiatrie e.V.“ gegründet, an dem zahlreiche Kliniken und Praxen aus Deutschland, Österreich und Schweiz beteiligt sind. In einer Datenbank werden Angaben zur Patientin/ zum Patienten (Alter, Nieren-/Leberfunktion, Drogen-/Nikotinabusus etc.), zur Medikation (Dosis, Komedikation), Indikation, Zielsymptome, Diagnostik, 15 klinische Wirksamkeit und UAWs gemeinsam mit Angaben zu Blutspiegel der verordneten Medikamente gesammelt. Somit sollen Zusammenhänge zwischen Dosierung und Wirkung besser erkannt und therapeutische Blutspiegelbereiche für Neuro-/Psychopharmaka im Kindes- und Jugendalter optimiert werden. Dadurch ergeben sich auch die weiteren Ziele, nämlich die Förderung der Patientensicherheit in Zusammenhang mit Überdosierung, UAWs, rasche Dosisoptimierung und damit verbunden eine verkürzte Hospitalisierungsdauer [4]. 2.3. Rechtliche und ethische Aspekte Aufgrund der aktuellen rechtlichen und ethischen Bedingungen bei der Zulassungsprüfung von Medikamenten, gibt es momentan nur wenige klinische Studien zur Wirkung von Neuro-/ Psychopharmaka im Kindes- und Jugendalter. Daher werden viele Arzneimittel zurzeit im sogenannten Off-Label-Use verwendet, da es an entsprechenden Zulassungen fehlt. Dies wiederum bedeutet, dass in der Therapie von Kinder und Jugendlichen eine sorgfältige und genaue Aufklärung aller an der Behandlung beteiligten Personen erforderlich ist. Zusätzlich ist man auf die Rückmeldung von Eltern bzw. vom direkten Umfeld bezüglich Compliance, Wirkung und das Auftreten von UAWs angewiesen. Ebenso gehört es zur Therapie mit Psychopharmaka regelmäßige (ambulante) Kontrollen durchzuführen, welche Laboruntersuchungen (Blutbild, Hormonstatus), EKG, EEG, Blutdruck sowie Größe und Gewicht beinhalten. Zu jeder Zeit soll das Kind bzw. der Jugendliche in die Behandlung miteinbezogen werden (Aufklärung u.ä.), da mit zunehmender Reife Jugendliche das Recht haben über ihre Pharmakotherapie mitzuentscheiden. Im akuten Notfall (z.B. Selbst- oder Fremdgefährdung) kann sich die Entscheidung zur symptomatischen medikamentösen Therapie ergeben, und erfordert nicht immer eine Aufklärung und Einwilligung von der Patientin / dem Patienten und der / des Sorgeberechtigten. Grundsätzlich erfordert jede Diagnostik und etwaige Behandlung die Einwilligung der Patienten und der Sorgeberechtigten, ist diese nicht gegeben so ist auch keine Diagnostik oder Therapie jeglicher Art möglich. 16 3. Antidepressiva Der Begriff „Antidepressiva“ fasst eine chemisch und pharmakologisch heterogene Klasse von Neuro- und Psychopharmaka zusammen. Wurden früher diese Pharmaka hauptsächlich bei Depressionen eingesetzt, finden sie heutzutage eine breite therapeutische Anwendung z.B. bei Angst-/ Zwang-/ Essstörungen und beim Panik- und Aufmerksamkeitsdefizit-Hyperaktivitäts-Syndrom. Zusätzlich finden sich trizyklische Antidepressiva auch in der Schmerztherapie durch ihre Na+-Kanal-blockierende Wirkung. Die Wirkung sowie das Auftreten von unerwünschten Arzneimittelwirkungen während einer Therapie mit Antidepressiva hängen davon ab, in welchem Ausmaß die Wiederaufnahme von Serotonin, Noradrenalin und Dopamin gehemmt und zentrale wie periphere NeurotransmitterRezeptoren antagonisiert werden. So tritt eine sedierende Wirkung bei Blockade des Histamin-H1-Rezeptors und ein anxiolytischer Effekt durch Blockade eines serotonergen 5-HT2-Rezeptors auf. Obwohl die Erhöhung der Neurotransmitter in der Synapse innerhalb kurzer Zeit eintritt, kann man eine antidepressive (klinische) Wirkung erst nach 2-4 Wochen erkennen [1]. Die Antidepressiva lassen sich einerseits entsprechend ihrer primären Wirkung auf molekulare Zielstrukturen einteilen und andererseits nach vorhandener bzw. nicht vorhandener sedativ-hypnotischer Wirkung [5]. Einteilung nach Wirkung auf molekulare Zielstrukturen: o Hemmer der Wiederaufnahme von Monoaminen - nichtselektive Hemmer von Dopamin, Noradrenalin und/oder Serotonin (trizyklische Antidepressiva) (Amitriptylin, Clomipramin, Doxepin, Imipramin, Nortriptylin, Opipramol, Trimipramin) - selektive Noradrenalin-Wiederaufnahmehemmer (Maprotilin, Reboxetin) - selektive Serotonin-Wiederaufnahmehemmer (SSRI) (Citalopram, Escitalopram, Fluoxetin, Fluvoxamin, Paroxetin, Sertralin) - Serotonin- und Noradrenalin-Wiederaufnahmehemmer (Duloxetin, Venlafaxin) 17 o Selektive Hemmer der Monoamin-Oxidase, Typ A (MAO-A-Hemmer) (Moclobemid) o α2-Adrenozeptor-Antagonisten (Mianserin, Mirtazapin) o Andere Antidepressiva (Johanniskraut-Extrakte) Einteilung nach sedativ-hypnotischer Wirkung: o Ohne intiiale Sedierungspotenz sind z.B. Moclobemid, Clomipramin, Desipramin, Nortryptilin, Citalopram, Escitalopram, Fluoxetin, Fluvoxamin, Paroxetin, Sertralin, Reboxetin, Venlafaxin o Mit primär sedativ-hypnotischer Wirkung z.B. Amitriptylin, Doxepin, Maprotilin, Mianserin 3.1. Trizyklische Antidepressiva Nach den Fachinformationen können trizyklische Antidepressiva bei folgenden Störungen/ Erkrankungen eingesetzt werden: - depressive Symptomatiken, - Zwangserkrankungen (Clomipramin), - Phobien und Panikstörungen (Clomipramin), - generalisierte Angststörungen (Opipramol), - langfristige Schmerzbehandlung (Amitriptylin, Clomipramin, Imipramin), - Kataplexie/ Narkolepsie (Clomipramin), - somatoforme Störungen (Opipramol), - Enuresis (Imipramin, Amitriptylin), - Pavor nocturnus (Imipramin, Clomipramin), - Unruhe, Angst und Schlafstörungen in Zusammenhang mit depressiven Erkrankungen (Doxepin, Trimipramin) oder leichten Entzugssyndromen (Doxepin) - sowie ausgewählte Essstörungen (Bulimia nervosa) und ADHS. Generell sollen Antidepressiva Stimmung, Antriebslage, Konzentration, Aufmerksamkeit, Selbstwertgefühl und Selbstvertrauen positiv beeinflussen und Schuldgefühle, Gefühle der Wertlosigkeit und negativistisches Denken in den 18 Hintergrund rücken. Als positiven Nebeneffekt verbessern Antidepressiva Schlafstörungen und steigern den Appetit. Wirkungsspektrum ausgewählter trizyklischer Antidepressiva: Tab. 1. Wirkungsspektrum ausgewählter trizyklischer Antidepressiva (Mod. nach [6]) Antidepressiv Aktivierend Sedierend anxiolytisch Amitriptylin +++ - ++ ++ Clomipramin +++ +++ - + Doxepin ++ - +++ ++ Imipramin +++ ++ + ++ (-) keine oder schwache Wirkung, (+) leichte Wirkung, (++) mittlere Wirkung, (+++) starke Wirkung Bezüglich der Dosierung ist anzumerken, dass initial mit einer niedrigen Dosis begonnen und dann alle 4-5 Tage je nach klinischer Wirkung gesteigert werden soll. Tabelle 2 führt die Tagesdosis in Milligramm von ausgewählten Wirkstoffen und ihren Indikationen an, wenn diese im Kindes- und Jugendalter eingesetzt werden. Tab. 2. Tagesdosen ausgewählter trizyklischer Antidepressiva (Mod. nach [7]) Amitriptylin Clomipramin Doxepin Indikation Tagesdosis in mg Depression 25 – 150 (2-3 Einzeldosen) Enuresis 10 – 50 (einmalig zur Schlafenszeit) Zwangsstörung Max. 3mg/kg KG oder 1x 200 abends Enuresis nocturna 10 – 50 (einmalig zur Schlafenszeit) Depression 50 – 150 (einmalig zur Nacht oder 2 Einzeldosen tagsüber) Imipramin Enuresis nocturna 25 – 75 (einmalig zur Schlafenszeit, je nach KG) KG = Körpergewicht 19 Besondern bei trizyklischen Antidepressiva besteht die Gefahr einer Überdosierung und einem damit verbundenen letalen Ausgang bei Intoxikationen, da sie eine geringe therapeutische Breite haben. Eine Überdosierung zeichnet sich durch verstärkte unerwünschte anticholinerge Effekte aus, wie Myoklonien, Atemdepression, Obstipation, zerebrale Krampfanfälle, Tachykardien und Herzrhythmusstörungen. Im Falle eines zentralen anticholinergen Syndrom (Fieber, Mydriasis, Herzrhythmusstörungen, Tachykardie, delirante Symptome, zerebrale Krampfanfälle, Somnolenz bis Koma) besteht die Therapie im sofortigen Absetzen der anticholinerg wirkenden Stoffe und einer intensivmedizinischen Überwachung [1]. Wie bei allen Medikamenten existieren auch für Antidepressiva Wechselwirkungen mit Arznei-, Genuss-, Sucht- und Nahrungsmitteln, darum wird ein regelmäßiges therapeutisches Drug-Monitoring empfohlen, um Blutspiegelschwankungen und Unter- bzw. Überdosierungen frühzeitig zu erkennen. Eine Erhöhung der Plasmaspiegel (Gefahr der Intoxikation) bewirken andere Antidepressiva, das Antikonvulsivum Valproinsäure, Kontrazeptiva und Methylphenidat; zu einer Erniedrigung der Plasmaspiegel kommt es bei Carbamazepin (Antikonvulsivum). Antipsychotika und Anticholinergika wiederum verstärken die anticholinergen Effekte [8]. Bei Verschreibung eines trizyklischen Antidepressivums ist besondere Vorsicht geboten, wenn eine Kombinationstherapie mit anderen Neuro-/ Psychopharmaka besteht, in der Anamnese zerebrale Krampfanfälle waren (trizykl. Antidepressiva senken die Krampfschwelle!), bei bipolaren Störungen (Induktion eine manischen Episode möglich) oder bei Suizidalität (Antriebssteigerung vor Stimmungsbesserung). Andere Anwendungseinschränkungen sind akute Alkohol-, Sucht-, Schlafmittel- Nierenschädigungen, oder akute Psychopharmakavergiftungen, Delirien, Blutbildungsstörungen, Leber- und Hypokaliämie, Bradykardie, Schilddrüsenüberfunktionen, Diabetes mellitus und paranoide Schizophrenien (laut Fachinformationen). 20 3.2. Selektive Serotonin-Wiederaufnahmehemmer Selektive Serotonin-Wiederaufnahmehemmer (SSRIs) werden verwendet in der Therapie von: - depressiver Symptomatik, - Zwangsstörungen (Citalopram, Fluoxetin, Paroxetin, Fluvoxamin ab 8. Lebensjahr, Sertralin ab 6. Lebensjahr), - Bulimia nervosa (Fluoxetin), - Panikstörungen und/oder Agoraphobie (Citalopram, Paroxetin), soziale Phobie (Citalopram, Paroxetin) und generalisierte Angststörung (Paroxetin), - posttraumatische Belastungsstörung (Paroxetin), - sowie aggressives und impulsives Verhalten, Mutismus, ADHS, TouretteSyndrom, Trennungsangst, Autismus, unklare Schmerzzustände und Anorexia nervosa. Wirkungsspektrum ausgewählter SSRIs: Tab. 3. Wirkungsspektrum ausgewählter trizyklischer Antidepressiva (Mod. nach [6]) Antidepressiv Aktivierend Sedierend anxiolytisch Citalopram +++ ++ - ++ Fluoxetin +++ + - ++ Fluvoxamin +++ + - ++ Paroxetin +++ - - ++ Sertralin +++ - - ++ (-) keine oder schwache Wirkung, (+) leichte Wirkung, (++) mittlere Wirkung, (+++) starke Wirkung In den letzten Jahren hat die Bedeutung der SSRIs in der Behandlung von depressiven Symptomen im Kindes- und Jugendalter zugenommen, was wahrscheinlich nicht nur auf die gute Wirksamkeit sondern auch auf die gute Verträglichkeit und relativ leichte Handhabbarkeit zurückzuführen ist. Ein zusätzlicher Vorteil ist, dass SSRIs kaum psychomotorische und kognitive Funktionen negativ beeinflussen, sodass eine Fahrtauglichkeit weiterhin besteht. 21 Aktuell gibt es die beste Studienlage zu Fluoxetin, wobei einige Studien zeigten, dass eine der besten Therapien bei depressiver Symptomatik aus einer Kombination von Fluoxetin und einer kognitiven Verhaltenstherapie besteht. [9] [10] Wie alle Neuro- /Psychopharmaka sollen auch SSRI mit einer niedrigen Dosis begonnen und dann sukzessive aufdosiert werden, um ein pharmakologisches Delir zu vermeiden. Eine antidepressive Wirkung stellt sich bei den SSRIs nach 1-4 Wochen ein, die Therapie selbst soll nach Remission der Symptome noch 6-9 Monate fortgeführt werden [11]. Tabelle 4 führt die Tagesdosis in Milligramm von ausgewählten Wirkstoffen und ihren Indikationen an. Zu beachten ist jedoch, dass in Tabelle 4 nur Richtwerte für den Einsatz in Kindes- und Jugendalter angegeben sind. Tab. 4. Tagesdosen ausgewählter trizyklischer Antidepressiva (Mod. nach [7]) Citalopram Fluoxetin Fluvoxamin Indikation Tagesdosis in mg Depression 20 – 40 (einmalig morgens) Angststörung 10 – 20 (einmalig morgens) Depression 10 – 20 (-40) (einmalig morgens) Bulimie, Zwangsstörung 20 – 60 (einmalig morgens) Zwangsstörung 50 – 200 (-300) (2 Einzeldosen, höhere ev. abends) Paroxetin Sertralin Depression 20 – 40 (einmalig morgens) Angst- u. Zwangsstörung 10 – 50 (einmalig morgens) Angststörungen 25 – 50 (einmalig morgens) Depression u. Zwangsstörung 25 – 200 (einmalig morgens) Eine Absetzung oder Umstellung der Medikation ist langsam vorzunehmen, da ein abruptes Absetzen zu Schwindel, Gangstörungen, gastrointestinalen Beschwerden, Sensibilitätsstörungen und Verschlechterung des psychischen Befindens führen kann. [12] [13] Im Falle einer Überdosierung ist die Toxizität eher gering, Todesgefahr besteht nur bei extrem hohen Dosierungen z.B. 6000mg bei Fluoxetin. Zeichen einer etwaigen 22 Überdosierung sind Übelkeit, Erbrechen, Erregung, Tachykardie und sehr selten zerebrale Krampfanfälle. SSRIs sind im Allgemeinen gut verträglich, UAWs treten nur selten und meist vorübergehend am Therapiebeginn auf. Unter den wichtigsten UAWs finden sich Kopfschmerzen, Appetitlosigkeit, Übelkeit, Schwitzen, Gewichtsabnahme, Mundtrockenheit, sexuelle Funktionsstörungen, allergische Reaktionen und selten extrapyramidal-motorische Störungen. Kardiale UAWs treten im Vergleich zu trizyklischen Antidepressiva selten auf. SSRIs weisen keine sedierende Wirkung auf, können aber bei bipolaren Störungen eine manische Episode auslösen. Kontrovers diskutiert wird eine erhöhte Suizidalität unter der Therapie mit SSRIs, da am Anfang eine antriebssteigernde Wirkung ohne Stimmungsbesserung bestehe. Die konnte zwar in einigen (Meta-)Analysen [14][15] nicht bestätigt werden, dennoch gilt eine relative Anwendungseinschränkung bei akuter Suizidalität. Weitere Einschränkungen der Anwendung sind (Hypo-)Manie, Diabetes mellitus, Leber- und Nierenfunktionsstörungen, Störungen der Thrombozytenfunktion und erhöhtes Blutungsrisiko. Eine seltene aber lebensbedrohliche UAW bzw. Wechselwirkung ist das Serotonin-Syndrom, das durch Herzrhythmusstörungen, zerebrale Krämpfe und komatöse Erscheinungen charakterisiert ist. Die Therapie besteht aus Absetzen der Medikation, Kühlung des Patienten und vermehrter Flüssigkeitszufuhr (oral oder intravenös), wenn nötig im intensivmedizinischen Bereich. Wie bei allen Medikamenten gibt es auch bei den SSRIs Wechselwirkungen mit Arznei-, Sucht-, Genuss- oder Nahrungsmitteln. Alkohol kann unerwünschte Arzneimittelwirkungen ebenso verstärken gleichzeitiger wie Einnahme Beta-Blocker von oder Antikonvulsiva andere Antidepressiva. (Carbamazepin, Bei Phenytoin, Valproinsäure) können deren Plasmaspiegel steigen, was das Risiko für UAWs erhöht. Bei Einnahme von Fluvoxamin und Sertralin wird vom Trinken von Grapefruitsaft abgeraten, da sonst die Plasmaspiegel steigen. Rauchen wiederum vermindert die Plasmaspiegel von SSRIs (laut Fachinformationen). 23 3.3. Selektive Noradrenalin-Wiederaufnahmehemmer (NRIs) Zu den selektiven Noradrenalin-Wiederaufnahmehemmern gehören Maprotilin und Reboxetin. Anwendungsgebiete von Maprotilin: ängstlich-agitierte Depression mit Schlafstörungen, Enuresis, Pavor nocturnus und Schulverweigerung. Indikationen von Reboxetin: akute depressive Erkrankungen (im Erwachsenenalter) und ADHS. Zu Maprotilin liegen kaum empirisch gesicherte Daten zur Anwendung im Kindesund Jugendalter vor, weder zu Wirksamkeit und Sicherheit, noch zu Dosierungsempfehlungen. Zur Depressionsbehandlung bei Erwachsenen ist eine ähnliche Wirkung wie bei SSRIs festgestellt worden [16][17]. Durch eine zu Therapiebeginn starke Sedierung und damit eingeschränkte Reaktionsfähigkeit empfiehlt sich eine Mundtrockenheit, abendliche Einnahme. Gewichtszunahme, UWAs Übelkeit, von Diarrhö Maprotilin und sind erhöhte Anfallsbereitschaft. Vorsicht ist geboten bei gleichzeitiger Einnahme zentraldämpfender Substanzen, bei akuten Delirien, Leber- und Nierenfunktionsstörungen und Stoffwechselerkrankungen (Diabetes mellitus, Hyperthyreose) (für genauere Informationen siehe Fachinformationen). Für Reboxetin wurde eine Wirksamkeit in der Therapie von ADHS, Aggressivität, Angst oder Depression sowie Enuresis nachgewiesen [18][19]. Als UAWs unter einer Reboxetin-Therapie gelten Schlafstörungen, Agitiertheit und Nervosität, Schwindel, Mundtrockenheit, Miktionsbeschwerden, kardiovaskuläre (Tachykardie und Hypotonie) und gastrointestinale Beschwerden, sexuelle Funktionsstörungen und zerebrale Anfälle bekannt. Bei zerebralen Krampfanfällen oder kardialen Erkrankungen in der Anamnese, einer bipolaren Störung oder bei Einnahme blutdrucksenkender Arzneimittel oder anderen Antidepressiva ist Reboxetin eher zurückhaltend einzusetzen. Wechselwirkungen mit Arznei-, Genuss- und Nahrungsmitteln sind in den Fachinformationen aufgelistet. 24 3.4. Serotonin-Noradrenalin-Wiederaufnahmehemmer (SNRIs) Zu dieser Klasse der Antidepressiva zählen Duloxetin und Venlafaxin, die beide für die Behandlung einer akuten Episode einer Depression beim Erwachsenen geeignet sind. Zusätzlich wird Venlafaxin zur Rezidivprophylaxe einer schweren Depression und bei sozialen Angststörungen verwendet, Duloxetin findet eine weitere Anwendung in der Therapie von generalisierten Angststörungen. Hierbei muss beachtet werden, dass die obigen aufgeführten Indikationen für den Erwachsenen gelten und die Datenlage für die Anwendung im Kindes- und Jugendalter noch zu gering ist. Laut S3-Leitlinie der ‚Deutschen Gesellschaft für Kinder- und Jugendpsychiatrie, Psychosomatik und Psychotherapie‘ (DGKJP) soll Venlafaxin nicht bei Kindern und Jugendlichen mit depressiven Störungen eingesetzt werden [11]. Sollte dennoch Duloxetin eingenommen werden, so ähneln die UAWs bei der Therapie von Kindern und Jugendlichen denen der Erwachsenen. Dazu zählen Übelkeit, Kopfschmerz, Mundtrockenheit, Somnolenz und ein vorübergehender Blutdruckanstieg. Unter der Therapie von Venlafaxin können häufig Schwitzen, Mundtrockenheit, gastrointestinale Beschwerden und Kopfschmerzen auftreten. Seltener sind Blutdruckregulationsstörungen, Akkomodationsstörungen Schwindel, und Sedierungen, sexuelle aber Dysfunktion, auch Agitiertheit, Schlafstörungen und erhöhte Nervosität. Reduziert werden diese UAWs durch den Einsatz eines Retardpräparates, dennoch können sie beim abrupten Absetzen auftreten. Wechselwirkungen können mit anderen Antidepressiva (Erhöhung der Plasmaspiegel, verstärkte antidepressive Wirkung aber auch erhöhtes Risiko für UAWs) ebenso auftreten wie mit Anticholinergika (Risiko anticholinerger UAWs erhöht), Antipsychotika (Erhöhung des Plasmaspiegels und des Risikos extrapyramidaler UAWs und QT-Verlängerung), Lithiumsalzen (Risiko für UAWs wie Serotonin-Syndrom erhöht – engmaschige Kontrollen!) oder Psychostimulanzien (unter Amphetamin Risiko für UAWs/ Serotonin-Syndrom erhöht) [8]. 25 Absolute Kontraindikation für die Anwendung von Serotonin-NoradrenalinWiederaufnahmehemmer ist die gleichzeitige Gabe irreversibler, nichtselektiver MAO-Hemmer aufgrund des Risikos für ein Serotonin-Syndrom. Zu den weiteren Gegenanzeigen für Duloxetin Leberfunktionseinschränkungen zählen führen, Lebererkrankungen, die zu Nierenfunktionseinschränkungen und unkontrollierbarer Bluthochdruck (Fachinformation). 3.5. Monoamin-Oxidase-Hemmer Heutzutage werden im Erwachsenenbereich nur selektive MAO-Hemmer (Moclobemid) bei schweren Episoden einer Depression verwendet. Nichtselektive MAO-Hemmer finden kaum noch Anwendung, da es bei gleichzeitiger Einnahme tyraminreicher Nahrungsmittel zum Cheese-Effekt kommt. Beim Cheese-Effekt kommt es zu hypertensiven Krisen mit Schwitzen, Gesichtsrötung, stark pochendem Herzschlag, Übelkeit und Erbrechen, da Tyramin (blutdrucksteigerndes Sympathomimetikum) normalerweise durch beide MAOEnzyme abgebaut wird. Bei der Anwendung eines selektiven MAO-Hemmers, steht somit immerhin ein Enzym zum Tyramin-Abbau zur Verfügung [1]. Da es im Kindes- und Jugendalter zur Behandlung von Depressionen besser verträgliche Alternativen (v.a. SSRIs) gibt, wird Moclobemid nicht empfohlen. In der Studie von Avci et al. 1999 [20] war es kaum besser als das Placebo. Unerwünschte Kopfschmerz, Arzneimittelwirkungen Übelkeit, im Mundtrockenheit, Erwachsenenalter Schlafstörungen sind und häufig Schwindel. Seltener können Angst, Agitiertheit, Unruhe, Parästhesien, orthostatische Hypotonie, Erbrechen, Obstipation, Diarrhö, Ausschlag oder Reizbarkeit vorkommen. Bei bipolar affektiver Störung können manische Episoden ausgelöst, und bei schizophrener Psychose die Symptome verstärkt werden. Die wichtigsten Anwendungseinschränkungen sind: gleichzeitige Kombination mit SSRIs, da das Risiko für das Auftreten eines Serotonin-Syndroms erhöht wird, und die Verabreichung bei akuten Intoxikationen mit psychotropen Wirkstoffen. Zu Therapiebeginn mit Moclobemid sind engmaschige Kontrollen empfohlen, da es zu suizidalen Impulsen kommen kann. Informationen zu den Wechselwirkung sind in der Fachinformation zu finden. 26 3.6. α2-Adrenozeptor-Antagonisten Mianserin und Mirtazapin sind nach Fachinformationen bei depressiven Störungen im Erwachsenenalter indiziert. Im Kindes- und Jugendalter wird Mianserin zur Therapie von Enuresis, Pavor nocturnus, Schulverweigerung und Mutismus verwendet. Mirtazapin findet im Off-Label-Use in der Behandlung von Angsterkrankungen und Schlafstörungen Gebrauch und ist nach S3-Leitlinie bei depressiven Störungen [11] nicht empfohlen. Da beide Arzneimittel eine ausgeprägte sedierende Wirkung zeigen, empfiehlt sich eine abendliche Einnahme, wobei beide Medikamente langsam aufdosiert werden sollen. In Hinblick auf die UAWs können Gewichtszunahme, Mundtrockenheit, Übelkeit und Diarrhö auftreten. Des Weiteren besteht die Möglichkeit von orthostatischer Hypotonie, Tremor, Dyskinesien, Blutbildveränderungen (Agranulozytose, Leukopenie), erhöhte Anfallsbereitschaft, Exantheme und Ödeme. Im Gegensatz zu anderen Antidepressiva führen Mianserin und Mirtazapin nicht zu ausgeprägten sexuellen Dysfunktionen. Der sedierende Effekt kann durch Alkohol oder Benzodiazepine verstärkt werden. Wird Mirtazapin mit SSRIs, Lithiumsalzen oder Psychostimulanzien kombiniert, kann sich sowohl die antidepressive Wirkung als auch das Risiko für UAWs verstärken. Akute Intoxikationen mit psychotropen Substanzen, (Hypo-)Manien, erhöhte Krampfbereitschaft, Herz-Kreislauf-Erkrankungen, Diabetes mellitus, Suizidalität und Leber- und Nierenfunktionsstörungen stellen Anwendungseinschränkungen dar [2]. 3.7. Andere antidepressiv wirkende Arzneimittel Andere antidepressiv wirkende Arzneimittel sind Bupropion und JohanniskrautExtrakte. Obwohl Johanniskraut-Extrakte (sogenannte Phytopharmaka) zur Behandlung von depressiver Symptomatik ab dem 12. Lebensjahr zugelassen ist, sprechen mögliche UAWs gegen den Einsatz [11]. Zu den UAWs von 27 Johanniskraut-Extrakten zählen dermatologische (Photosensibilisierung) und gastrointestinale Beschwerden [21], grundsätzlich sind das UAW-Profil und mögliche Wechselwirkungen mit anderen Medikamenten noch nicht vollständig untersucht. Über eine Enzyminduktion in der Leber kann bei Einnahme von Johanniskraut-Extrakten die Sicherheit oraler Kontrazeptiva herabgesetzt sein. 28 4. Antipsychotika Unter dem Begriff „Antipsychotika“, auch als Neuroleptika oder Psycholeptika bezeichnet, werden Medikamente verstanden, die hauptsächlich zur symptomatischen Behandlung von Erkrankungen aus dem schizophrenen Formenkreis sowie bei psychotischen Symptomen im Rahmen anderer Störungen eingesetzt werden. Typischerweise dämpfen Antipsychotika psychomotorische Erregungszustände und verringern affektive Spannungen, Angst, formale Denkstörungen und Wahnwahrnehmungen (Vgl. [2]). Wurden sie früher vor allem für die obigen genannten Zustände verwendet, finden sie mittlerweile eine zusätzliche Anwendung bei Kindern und Jugendlichen mit manischen Syndromen (zur Abschwächung der manischen Symptome und manche Antipsychotika als Stimmungsstabilisatoren), Tic-Störungen, Reizbarkeit, Agitiertheit und aggressiven Verhaltensweisen. 4.1. Klassifikationen und Einteilungen Die Antipsychotika lassen sich auf drei Arten klassifizieren, nach strukturchemischen Eigenschaften, nach der antipsychotischen Potenz und in Antipsychotika der ersten und zweiten (und dritten) Generation. Einteilung nach strukturchemischen Eigenschaften: Das älteste bekannte Antipsychotikum Chlorpromazin hat eine trizyklische Struktur und eine offene Seitenkette, wie auch Levomepromazin und Promethazin. Ebenso eine trizyklische Struktur aber eine Piperazin-Seitenkette besitzen Fluphenazin, Perazin, Perphenazin und Zuclopenthixol. Beide Typen können auch als Phenothiazine zusammengefasst werden. Zur Gruppe der sog. Butyrophenone zählen Haloperidol und Pipamperon. Als Diphenylbutylpiperiden-Typen werden Fluspirilen und Pimozid bezeichnet. Clozapin (Prototyp der „atypischen“ Antipsychotika), Olanzapin und Quetiapin unterscheiden sich trotz ihrer trizyklischen Struktur in ihrem Wirkprofil (v.a. bei den UAWs) von den Phenothiazinen. 29 Weitere Antipsychotika sind Sulpirid und Amisulrid (sog. Benzamide) sowie Risperidon, Ziprasidon und Aripiprazol. Einteilung nach der antipsychotischen Potenz: Für die Einteilung nach der antipsychotischen Potenz gibt es mehrere Definitionen. Die Definition nach Hasse [22] [23] ist mit dem Auftreten von extrapyramidal-motorischen unerwünschten Arzneimittelwirkungen, kurz EPS für „extrapyramidal side effects“, verbunden. Nach dieser definiert sich die antipsychotische Potenz als jene Dosierung, die notwendig ist um die neuroleptische Schwelle (Auftreten von EPS z.B. mittels Mikrografie erfassbar) zu überschreiten. Demnach werden bei hochpotenten Antipsychotika EPS im niedrigen Dosisbereich, bei niederpotenten Antipsychotika erst bei hohen Dosen ausgelöst. Eine etwas neuere Definition richtet sich nach der Rezeptorblockade von Dopamin-D2-Rezeptoren im ZNS. Jene Antipsychotika mit einer hohen Affinität werden als hochpotent bezeichnet, jene mit niedriger Affinität als niederpotent. Klinisch können Antipsychotika als niedrig-, mittel- und hochpotente Wirkstoffe eingeteilt werden. Für einen besseren Vergleich der Wirksamkeit wird die sogenannte Chlorpromazin-Äquivalenzdosis verwendet, wobei für Chlorpromazin der Referenzwert 1 festgelegt wurde. Ein Wirkstoff mit der ChlorpromazinÄquivalenzdosis von 2 ist doppelt so stark antipsychotisch wirksam wie Chlorpromazin [1]. In Tab. 5. sind einige ausgewählte Antipsychotika in ihrer Potenz zusammengefasst, wobei dies vor allem beim Erwachsenen und im Kindes- und Jugendalter aufgrund der geringen Studienlage nur mit Vorbehalt gilt. Zu beachten ist, dass so ein Vergleich nur bei typischen Antipsychotika sinnvoll ist, da sich diese hinsichtlich ihrer Wirkung und den UAWs ähnlich sind. Hochpotente Wirkstoffe werden vor allem zur Behandlung von Positivsymptomen wie Wahn und Halluzinationen eingesetzt. Niedrigpotente Antipsychotika werden, da sie im üblichen Dosisbereich hauptsächlich sedierend und wenig antipsychotisch wirken, bei Unruhe, Angst, Agitiertheit und Schlafstörungen verwendet (Vgl. [2]). 30 Tab. 5. Übersicht ausgewählter Antipsychotika nach der antipsychotischen Potenz (Mod. nach [24]) Wirkstoff ChlorpromazinÄquivalenzdosis Hochpotente Antipsychotika Haloperidol, Olanzapin, Risperidon 50 Flupenazin 40 Perphenazin 15 Mittelpotente Antipsychotika Chlorpromazin, Clozapin, Melperon, Quetiapin 1 Niedrigpotente Antipsychotika Pipamperon 0,8 Levomepromazin 0,5 Amisulprid, Sulprid 0,2 Einteilung nach „Generationen“: Ursprünglich differenzierte man zwischen typischen und atypischen Antipsychotika wegen der Annahme, dass atypische Antipsychotika keine EPS verursachen. Da aber atypische Antipsychotika vor allem im hohen Dosenbereich ihre atypischen Eigenschaften verlieren und der Begriff „Atypikum“ mittlerweile erheblich erweitert wurde, ist diese Klassifikation wenig sinnvoll. Dennoch ist sie im Sprachgebrauch noch weit verbreitet. Weniger mit unklarer Bedeutung belastet ist die Einteilung in Antipsychotika der ersten und der zweiten (und dritten) Generation [2] 1. Generation: Chlorpromazin, Haloperidol, Perphenazin 2. und 3. Generation: Aripiprazol, Clozapin, Olanzapin, Paliperidon, Quetiapin, Risperidon, Ziprasidon 4.2. Wirkungen Alle klinisch wirksamen Antipsychotika sind Antagonisten der Dopamin-D2Rezeptorfamilie, was bedeutet, dass sie zwar an diese Rezeptoren binden, aber 31 keine Wirkung wie der Neurotransmitter Dopamin auslösen. Die daraus resultierende Hemmung der mesolimbischen Bahnen könnte demzufolge die antipsychotische Wirkung erklären, da nach der gängigen, aber nicht unumstrittenen Dopamin-Hypothese der Schizophrenie Positivsymptome wie Wahngedanken und Halluzinationen durch eine erhöhte Konzentration des Neurotransmitters Dopamin im mesolimbischen Trakt des Gehirns verursacht werden. Da sich die Wirkung der Antipsychotika der 1. Generation auf das gesamte dopaminerge System erstreckt, kommt es zum Auftreten von UAWs, so wirken Neuroleptika im nigrostriatalen System störend auf körperliche Bewegungsabläufe, bei denen Dopamin eine wichtige Rolle spielt. Auch wirken klassische Neuroleptika nicht auf die sogenannten Negativsymptome der Schizophrenie, sondern können sie sogar verschlimmern, da diese gemäß der Dopaminhypothese durch eine verminderte Dopaminkonzentration im mesokortikalen System des Gehirns verursacht werden ([2]). Die Antipsychotika der 2. Generation („atypischen Neuroleptika“) haben eine mit den klassischen Neuroleptika vergleichbare antipsychotische Wirkung, verursachen aber weniger extrapyramidal-motorische Nebenwirkungen und wirken zusätzlich auch auf die sogenannten Negativsymptome der Schizophrenie. Diese Eigenschaften werden auf Besonderheiten ihres Rezeptorbindungsprofils zurückgeführt, das sich je nach Wirkstoff signifikant unterscheiden kann [2]. Da Antipsychotika wahrscheinlich auch mit anderen Neurotransmittern wie Acetylcholin, Histamin, Serotonin und Noradrenalin interagieren, nimmt man an, dass das Wirkungsprofil und das Auftreten der UAWs wesentlich vom Bindungsprofil an die Neurotransmitter-Rezeptoren abhängen. Beispielsweise wird der sedierende Effekt der Histamin-H1-Rezeptorblockade zugewiesen. 4.3. Klinische Psychopharmakologie Indikationen von Antipsychotika bei Kindern und Jugendlichen sind Schizophrenie, schizoaffektive Störungen (v.a. paranoide und paranoid-halluzinatorische Zustände), akutes psychotischen Syndrom, Unruhe, Angst und Anspannung, Einschlaf- und Impulskontrollstörungen, (auto-)aggressives Verhalten, Tic- 32 Störungen, Entzugssyndrome (bei Medikamenten oder Substanzmissbrauch), Alkoholdelir und bipolare Störungen. Sowohl die „American Academy of Child and Adolescent Psychiatry” (AACAP) [24] als auch die deutschen Leitlinien empfehlen aufgrund der besseren Wirksamkeit und Verträglichkeit und der geringeren Rezidivrate den Einsatz von Antipsychotika der zweiten Generation. Hochpotente Antipsychotika werden zur symptomatischen Behandlung von (auto-)aggressiven Anspannungszuständen empfohlen, Verhaltensweisen, niedrig dosiert Unruhe- und unterhalb der antipsychotischen Schwelle bei Ängsten, depressiv-ängstlichen Zuständen und Schlafstörungen. Mittelpotente finden vorrangig Anwendung zur unterstützenden Sedierung oder bei geringgradiger Verwirrtheit. Niedrigpotente Antipsychotika und Antipsychotika der zweiten Generation werden zur Therapie von Angst- oder Schlafstörungen herangezogen, da bei diesen vor allem die sedierenden Effekte hilfreich sind (Vgl. [2]) Die Dosisanpassung soll langsam und in kleinen Schritten erfolgen und sich am individuellen Response (Wirkung und UAWs) orientieren. Vor allem am Behandlungsbeginn können hoch- und niedrigpotente Antipsychotika kombiniert werden, um sowohl eine Sedierung als auch eine Anspannungslösung zu erreichen. Bei der Wahl des Antipsychotikums soll auch das UAW-Profil berücksichtigt werden, da sonst ev. lebensbedrohliche Zustände auftreten können. Bei eingeschränkter Compliance können Retard- oder Depotpräparate erwogen werden, da die UWAs aber problematischer sein können und die Feinjustierung schwierig und zeitaufwändig ist, eignen sich diese nicht zur Akuttherapie. Bei diesen soll anfangs oral aufdosiert werden, um dann idealerweise auf eine Depotformulierung mit demselben Wirkstoff umzusteigen. In Bezug auf die UAWs haben Kinder und Jugendliche ein höheres Risiko bestimmte UAWs zu entwickeln als Erwachsene z.B. stärkere Sedierung, EPS, nach Absetzen der Antipsychotika auftretende Dyskinesien, Prolaktin- Spiegelerhöhungen, Gewichtszunahme und metabolische Veränderungen [26]. Im Gegensatz dazu treten Spätdyskinesien und Diabetes seltener auf, was aber auch dazu zurückzuführen sein kann, dass es einerseits unzureichend lange Beobachtungen bzw. zu kleine Fallzahlen bei Studien bezüglich dieser zwei UAWs 33 gibt und andererseits Erwachsene durch ein höheres Lebensalter und Komorbiditäten vulnerabler sind. Als EPS zusammengefasst sind Frühdyskinesien, Parkinsonoid, Akathisie (Sitzunruhe, Trippelbewegungen), Spätdyskinesien und das maligne neuroleptische Syndrom, wobei letzteres eine dramatische aber seltene UAW ist, die in 20% der Fälle tödlich verläuft (Haupttodesursache ist ein durch Rhabdomyolyse bedingtes Nierenversagen). Kennzeichen des malignen neuroleptischen Syndroms sind Zunahme von EPS begleitet von Fieber, Veränderungen der kardiovaskulären Parameter (Tachykardie, Rhythmusstörungen) und häufig fluktuierende Bewusstseinszustände (bis Stupor). Seltenere Symptome sind Muskelkrämpfe, Myoklonien und pyramidale Symptome. Als Blutbildveränderungen gesteigerte können erhöhte Aktivität Erythrozyten-Sedimentationsrate, der Leukozytose Kreatininkinase, und erhöhte Transaminasen auftreten sowie im Urin eine Myoglobinurie mit Dunkelfärbung. Therapeutische Maßnahmen Volumensubstitution, sind Behandlung des das Absetzen Fiebers und der Antipsychotika, Verlegung auf eine Störungen des internistische Intensivstation. Weitere UAWs: Hyperprolaktinämie mit Libidoverlust, Menstruationszyklus, Spannungsgefühle in der Brust, Galaktorrhö bei weiblichen Patienten, beim männlichen Patienten Gynäkomastie und Potenzprobleme; Leukozytopenie, Agranulozytose, EKG-Veränderungen (QTc-Intervall- Verlängerung, ST-Streckensenkung, Abflachung der T-Welle) und Arrhythmien, Gewichtszunahme, metabolische Störungen (erhöhte Glukose- und Lipidwerte). Seltenere UAWs und Wechselwirkungen mit Arznei-, Genuss- und Nahrungsmitteln sind in den Fachinformationen der Arzneimittel (z.B. Austria Codex) zu finden, eine Auflistung würde den Rahmen dieser Arbeit übersteigen. 4.4. Psychiatrische Indikationen für Antipsychotika Psychiatrische Indikationen für Antipsychotika und Dosierungsempfehlungen für den Einsatz im Kindes- und Jugendalter sind in Tabelle 6 angeführt. 34 Tab. 6. psychiatrische Indikationen und geeignete Antipsychotika zur Therapie (Dosierungsempfehlungen für Kinder und Jugendliche) (Mod. nach [2]) (i.v. intravenös, i.m. intramuskulär, p.o. per oral) Erkrankungen aus dem Hochpotente Antipsychotika schizophrenen Akut: Haloperidol (5-10mg i.v.) oder Formenkreis Olanzapin (10mg i.m. oder als Schmelztbl) Langfristig: Antipsychotika der 2. Generation Motorische Agitation, Mittel- bis hochpotente oder sedierende Erregungszustände Antipsychotika Akut: Haloperidol (5-10mg i.v), Olanzapin (5-10mg i.m.), Ziprasidon (10mg i.m.), Chlorprothixen (50mg i.m.) oder Levomepromazin (50mg i.m.) Mittelfristig: Chlorprothixen (3x 30mg p.o.) Psychomotorische Mittel- bis niedrigpotente Antipsychotika der 1. oder Anspannung sedierende Antipsychotika der 2. Generation (Aggressivität, ängstliche Akut: Chlorprothixen (50mg i.m. oder 3x30mg p.o.) Unruhe) Mittelfristig: Levomepromazin (bis 4x50mg p.o.) Schizoaffektive Erkrank. Antipsychotika der 2. Generation - Manische Phasen und - Olanzapin (je 20mg p.o.), Quetiapin (langsame maniforme Enthemmung aufdosieren über mehrere Tage auf ca. 400mg/Tag) - Phasenprophylaxe - Olanzapin (niedrig dosiert) Impulskontrollstörungen Sedierende Antipsychotika oder Antipsychotika der 2. Generation Längerfristig: Risperidon (0,25-2mg/Tag) oder Pipamperon (4x30mg p.o.) Tics Tiaprid (150-300mg/Tag p.o. auf 3 Dosen verteilt) Risperidon (0,5-6mg/Tag verteilt auf 2-3 Dosen, schrittweise aufdosieren!) Bewegungsdrang und v.a. sedierende Antipsychotika der 2. Generation innere Anspannung bei mittelfristig z.B. Melperon 4x25mg/Tag p.o. AN Einschlafstörungen Niedrigpotente Antipsychotika der 2. Generation z.B. Levomepromazin 25-50mg p.o. abends 35 5. Sedativa/Hypnotika und Anxiolytika Die Wirkstoffklasse Sedative/Hypnotika und Anxiolytika umfasst eine sehr heterogene Gruppe von Neuro-/Psychopharmaka, deren Wirkungsspektrum von Anxiolyse über Sedierung und Schlaf bis hin zur Narkose und letaler Gefährdung (wenn die Atmung betroffen ist) reichen kann. Anxiolytika wirken vorwiegend bei Spannungs-, Angst- und Furchtzuständen und werden darum meist zur symptomatischen Therapie von Angsterkrankungen verwendet. Sedativa wiederum besitzen v.a. entspannende und beruhigende Effekte, während Hypnotika Schlaf entweder induzieren oder aufrechterhalten. Zu beachten ist, dass Sedativa/Hypnotika eine steile Dosis-Wirkungs-Kurve haben, d.h. ihr anxiolytischer Effekt geht schnell in eine hypnotische und narkotische Wirkung über [2]. 5.1. Klassifikation Zu der heterogen Gruppe von Sedativa/Hypnotika und Anxiolytika gehören: - Barbiturate (als typische Vertreter dieser Klasse; nicht mehr im Gebrauch) - Benzodiazepine (ebenfalls typische Vertreter) - Antidepressiva mit serotonerger und/oder antihistaminerger Wirkung - niedrigpotente Antipsychotika mit sedierender Wirkung - andere Neuro-/Psychopharmaka wie Buspiron, Pregabalin, Melatonin und Opipramol - β-Adrenozeptor-Antagonisten (β-Blocker) - zentral wirksame Antihistaminika - Phytopharmaka - best. Antiepileptika mit stimmungsstabilisierenden Effekten - sowie Choralhydrat (erstes synthetisch hergestellte Hypnotikum, 1869 als Schlafmittel eingeführt und noch immer verwendet) Der Wirkungsmechanismus von Sedativa/Hypnotika und Anxiolytika ist weitgehend unbekannt, da sowohl die Ätiologie als auch die Pathophysiologie der Angsterkrankungen und Schlafstörungen teilweise ungeklärt sind und wahrscheinlich multifaktoriell bedingt sind. Dennoch wurde ihre Wirksamkeit für 36 den Erwachsenen sowie teilweise für Kinder und Jugendliche in klinischen Studien bestätigt. 5.2. Benzodiazepine Benzodiazepine können nach der Dauer ihrer Wirksamkeit eingeteilt werden in: - kurz wirksam (Midazolam, Triazolam), - mittellang wirksam (Bromazepam, Flunitrazepam, Lorazepam, Oxazepam) - lang wirksam (Clonazepam, Diazepam, Flurazepam) Da Benzodiazepine ein großes pharmakologisches Wirkungsspektrum besitzen, gibt es eine Vielzahl von Indikationen, bei Prämedikation für chirurgische Eingriffe, Muskelspasmen, Anfallskontrolle und Alkoholentzugssyndrom. In der Kinder- und Jugendpsychiatrie werden sie aufgrund ihres breiten Wirkungsspektrums bei Angsterkrankungen, Unruhe und Spannungszuständen, psychosomatischen Symptomen, als Initialbehandlung ängstlich-agitierter Depression in Kombination mit Antidepressiva, in Kombination mit Antipsychotika in der Akutbehandlung schizophrener Psychosen und Manien, bei akuter Suizidalität, Notfalltherapie aggressiver Erregungszustände, funktionellen Schlafstörungen und als Notfalltherapie eines Anfallgeschehens eingesetzt. Eine Anwendungsdauer über 4 Wochen soll genauso vermieden werden wie eine hohe Dosierung, da Gedächtnisstörungen das und Risiko einer Abhängigkeitsentwicklung, einer verminderten Wahrnehmungs- von und Reaktionsfähigkeit besteht. Obwohl Benzodiazepine in placebokontrollierten Doppelblindstudien mit Kindern und Jugendlichen keine Wirksamkeit bei Angsterkrankungen zeigten [27], werden sie in der Akutbehandlung (v.a. in Kombination mit Antidepressiva oder Antipsychotika) verwendet, um eine rasche Angstreduktion und Entspannung zu erreichen, damit eine weitere kognitivverhaltenstherapeutische und/oder medikamentöse Therapie möglich ist. UAWs können am Therapiebeginn auftreten und sind dann meist dosisabhängige, überschießende Wirkeffekte Konzentrationsstörungen und wie Schläfrigkeit, verminderte Tagesmüdigkeit, Aufmerksamkeit. Unruhe, Schlafstörungen, Angstzustände, Halluzinationen und Albträume werden als 37 paradoxe Reaktionen bezeichnet. Seltenere UAWs und Wechselwirkungen sind in den jeweiligen Fachinformationen beschrieben. 5.3. Antidepressiva Bei den Antidepressiva werden jene Arzneimittel als Sedativa/Hypnotika und Anxiolytika verwendet, die eine serotonerge und/oder antihistaminerge Wirkkomponente haben (Clomipramin, Doxepin, Fluoxetin, Fluvoxamin, Imipramin, Sertralin). Indikationen für diese Medikamente sind Angsterkrankungen (Panikstörungen, Phobien), Beruhigung, Schlafinduktion und Angsterleben bei Zwangs- und depressiven Störungen. Mittel der ersten Wahl bei Angsterkrankungen sind (laut amerikan. Leitlinien, [27]) SSRIs, zweite Wahl sind trizyklische Antidepressiva aufgrund fehlender Evidenz für die Wirksamkeit und des Risikos für UAWs. Eine in placebokontrollierten Studien nachgewiesene Wirksamkeit bei der Therapie von generalisierten Angststörungen, emotionaler Störung mit Trennungsangst und/oder sozialer Phobie existiert von Fluoxetin, Fluvoxamin, Paroxetin und Sertralin [27]. Niedrig dosierte, sedierende Antidepressiva sind wegen dem Risiko schwerer UAWs (z.B. Arrhythmien, orthostatische Hypotension, sedierender Überhang, anticholinerge Effekte) bei Schlafstörungen von Jugendlichen nur bei komorbider Depression oder anderem therapeutischen Versagen indiziert. 5.4. Niedrigpotente Antipsychotika Indikationen von niedrigpotenten Antipsychotika mit sedierender Komponente (Quetiapin, Sulpirid und Thioridazin) sind generalisierte Angststörung und andere Angsterkrankungen sowie ängstlich-depressive Symptome und Einschlafstörungen. In Ausnahmefälle können hochpotente Antipsychotika ohne stark sedierendem Effekt (Clozapin, Flupentixol, Risperidon) verabreicht werden. Laut Leitlinien der AACAP (American Academy for Child and Adolescent Psychiatry) und Jugendpsychiatrie) der DGKJP werden (deutsche niedrigpotente Gesellschaft Antipsychotika für aber Kinderweder und bei 38 Angsterkrankungen noch bei Schlafstörungen empfohlen, da es kaum kontrollierte Studien beim Erwachsenen und noch weniger bei Kindern und Jugendlichen für diese Anwendungsbereiche gibt. Schizophrenen Patienten mit komorbider Schlafstörung können von Antipsychotika der 2. Generation (Quetiapin oder Olanzapin) profitieren, da zusätzlich zur antipsychotischen Wirkung auch ein sedierender Effekt besteht. 5.5. Andere Arzneimittel Buspiron: Partialagonist eines Serotonin-Rezeptors, Antagonist der Dopamin-D2Rezeptorfamilie; in der Therapie der generalisierten Angststörungen bei Kinder und Jugendlichen wurde aber in zwei Studien [28] keine Wirksamkeit nachgewiesen, obwohl beim Erwachsenen ein anxiolytischer Effekt besteht. Nach AACAP als Monotherapie oder in Kombination mit SSRIs bei Angsterkrankungen empfohlen. Im niedrigen Dosisbereich gut verträglich, häufigste UWAs sind Kopfschmerz, Benommenheit und Dyspepsie. Absolute Kontraindikationen sind Myasthenia gravis, Anfallserkrankungen in der Anamnese, schwere Nieren- und Leberfunktionsstörungen und akutes Engwinkelglaukom. Opipramol: Laut AACAP zur Therapie von Angsterkrankungen im Kindes- und Jugendalter nicht empfohlen. Nachgewiesene Wirksamkeit bei Angsterkrankungen beim Erwachsenen [29]. Bezüglich der UAWs gute Verträglichkeit. Keine Anwendung bei akutem Engwinkelglaukom, Epilepsie, Pylorusstenose, Störung der Blutbildung, gleichzeitiger Einnahme von MAO-Hemmern, akute Intoxikationen (mit Alkohol, Schlafmittel, Analgetika, Psychopharmaka), AV-Blockierungen oder Reizleitungsstörungen des Herzens. Beta-Blocker: Da sie auf Angstsymptome wie Palpationen, Zittern u.ä. wirken, werden sie beim Erwachsenen mit Angsterkrankungen verwendet. Nach Leitlinien der AACAP bei Kindern und Jugendlichen nicht empfohlen. Kontraindikation sind Asthma bronchiale und Erkrankungen des Herz-Kreislauf-Systems (AV-Block, Bradykardie, Hypotonie usw.). Antihistaminika: Verwendete Antihistaminika sind zentral wirksame HistaminRezeptor-Antagonisten und führen über die Hemmung der Wirkung von Histamin 39 zu verminderter Wachsamkeit, verlangsamter Reaktionszeit und Schläfrigkeit. Als Indikationen gelten akute und chronische Angstzustände, Schlafstörungen und akute Unruhe-/Erregungszustände. Obwohl die Wirksamkeit kaum bestätigt wurde, werden Antihistaminika häufig bei Kindern im Vorschulalter verwendet. Die Leitlinie der DGKJP empfiehlt sie zur vorübergehenden Entlastung bei nichtorganischer Insomnie (z.B. Diphenylhydramin). Die AACAP spricht sich gegen eine Verwendung bei Kinder und Jugendlichen mit Angsterkrankungen aus. UAWs: häufig Sedierung, anticholinerge Effekte. 40 6. Stimulanzien und bei ADHS verwendete Medikamente Unter (Psycho-)Stimulanzien versteht man Neuro-/Psychopharmaka mit erregender Wirkung auf das zentrale Nervensystem und die Psyche. Die Weltgesundheitsorganisation WHO definiert sie als Substanzen, die die Aktivität der Nerven erhöhen, beschleunigen oder verbessern, was eine vorübergehende Leistungssteigerung, unterdrücktes Hungergefühl und Zunahme des Wachzustandes durch Unterdrückung von Schlaf und Müdigkeit bewirkt. Daraus ergeben sich die Indikationen ADHS, Narkolepsie und Übergewicht (als Appetitzügler). Missbräuchliche Verwendung ist die kognitive Leistungssteigerung im Sinne eines Neuro-Enhancement beim Gesunden. 6.1. Klassifikation Die eingesetzten Medikamente können nach ihren strukturellen und pharmakologischen Unterschiede in Psychostimulanzien (Methylphenidat und Amphetamin) und Nicht-Psychostimulanzien (Atomoxetin, Clonidin, Guanfacin) eingeteilt werden. Neben den „klassischen“ Psychostimulanzien aus der ADHSTherapie gibt es auch Naturprodukte und missbräuchlich verwendete Substanzen. Arzneimittel: - Amphetamin und Methylphenidat (Indikation: ADHS, Narkolepsie), - Benzphetamin, Diethylpropion, Norephedrin (Ind.: Appetitzügler = Anorektikum) Naturprodukte: - Cathinon (Alkaloid des Kathstrauches Catha edulis und des Spindelbaumgewächses Maytenus krukovii; als „Kath“ wegen psychostimulierender Wirkung gekaut) - Ephedrin (aus Meerträubel Ephedra vulgaris gewonnen, andere Namen Mormonentee oder Ma-Huang; eingesetzt bei Hypotonie, Narkolepsie, Augenheilkunde und Asthma bronchiale) - Koffein (in Kaffeebohnen und Tee) und Phenylethylamine (Käse, Rotwein) Missbräuchlich verwendete Substanzen sind Kokain, Methamphetamin und Methylen-dioxy-methamphetamin (MDMA, „Ecstasy“). 41 6.2. Wirkungsmechanismen Da die Wirkung der verwendeten (Nicht-)Psychostimulanzien nur ansatzweise geklärt ist, werden aufgrund der präklinischen Daten verschiedene molekulare Angriffspunkte und Wirkmechanismen Methylphenidat sind sowohl Wiederaufnahme als auch Hemmer indirekte angenommen. der Dopamin- Agonisten Amphetamin und peripherer und Noradrenalinund zentraler dopaminerger und noradrenerger Rezeptoren (durch Wiederaufnahmehemmung erhöhte Konzentration dieser Neurotransmitter im synaptischen Spalt). Atomoxetin hemmt vorwiegend die Noradrenalin-Wiederaufnahme (indirekter Agonist peripherer und zentraler noradrenerger Rezeptoren) und ist ein Antagonist des glutamatergen NMDA-Rezeptors. Die indirekte Stimulation zentraler dopaminerger Rezeptoren wird für die euphorisierende und motorische Wirkung verantwortlich gemacht, die indirekte Stimulation zentraler noradrenerger Adrenozeptoren für die stimulierende und antriebssteigernde Wirkung. Durch die Stimulation peripherer Adrenozeptoren (indirekt sympathomimetisch) kommt es zur Steigerung von Blutdruck und Herzfrequenz, zur Erweiterung der Atemwege, zur allgemeinen Leistungssteigerung und zur Erhöhung des Energieverbrauches (Vgl. [2]. Clonidin und Guanfacin sind zentral wirksame α2-Adrenorezeptor-Agonisten und beide stimulieren postsynaptische α2-Adrenorezeptoren im präfrontalen Kortex und präsynaptische Autorezeptoren im Loecus caeruleus (Clonidin die Subtypen α2A, α2B und α2C; Guanfacin nur α2A), der genaue Mechanismus wie sie die Symptome des ADHS beeinflussen ist aber noch nicht geklärt [30]. 6.3. Klinische Psychopharmakologie Bevor eine Therapie mit (Nicht-)Psychostimulanzien begonnen wird, wird eine genaue klinische Untersuchung mit Durchführung eines körperlichen, neurologischen und psychiatrischen Status (Größe, Gewicht, Blutdruck, EKG, ev. EEG) empfohlen. Während der Behandlung sollte zusätzlich, zur regelmäßigen Kontrolle der anfangs erhobenen Werte, eine fortlaufende begleitende Psychoedukation aller beteiligten Personen angeboten werden. 42 Methylphenidat und Amphetamin: Die Wirksamkeit und Sicherheit dieser Medikamente wurde bereits bewiesen [31]. Eine klinische Wirkung tritt bereits nach der ersten Dosis ein. Indikationen von Methylphenidat: v.a. bei ADHS im Rahmen einer therapeutischen multimodalen Behandlung ab dem 6. Lebensjahr, zusätzlich bei aggressiven Verhaltensweisen und bei aggressiven oder hyperaktivem Verhalten bei Kindern mit Autismus-Spektrum-Störungen; weiteres Lachinkontinenz und Narkolepsie. Indikation von Amphetamin: als Teil einer multimodalen Therapie von ADHS bei Kindern und Jugendlichen zwischen 6 und 17 Jahren, wenn eine vorangegangene Therapie mit Methylphenidat nicht erfolgreich war (Fachinformationen). Bezüglich der UAWs scheinen sie bei Methylphenidat und Amphetaminen ähnlich zu sein. Häufig kommen reduzierter Appetit, Gewichtsverlust, Kopfschmerzen, Anstieg von Puls und Blutdruck, Irritabilität und Einschlafstörungen (bei Einnahme spät am Tag) vor. Selten kann zu Therapiebeginn eine Dysphorie entstehen (ev. Zeichen einer Überdosierung). Psychotische Reaktionen treten i.d.R. nur selten auf, sind meist reversibel und verschwinden mit Absetzen der Medikation innerhalb weniger Tage. Arznei-, Genuss- und Nahrungsmittelwechselwirkungen kommen bei AmphetaminPräparaten häufiger vor als bei Methylphenidat, vor allem bei gleichzeitiger Einnahme von SSRIs oder Monoamin-Oxidase-Hemmer mit Amphetamin ist Vorsicht geboten, da der Plasmaspiegel des Stimulans steigen kann. Eine genaue Auflistung der Wechselwirkungen findet sich in den Fachinformationen. Atomoxetin: Anwendungsgebiet ist die Behandlung von ADHS ab dem 6. Lebensjahr. Atomoxetin gilt normalerweise als Medikament zweiter Wahl, kann aber erste Wahl bei Gefahr eines Substanzmissbrauches oder komorbider Angstoder Tic-Störung sein. Eine klinische Wirkung tritt erst nach mehrwöchiger regelmäßiger Einnahme ein (volle Wirkung meistens nach 12 Wochen). Häufige UAWs sind Kopfschmerzen, Übelkeit, Bauchschmerzen, Appetitlosigkeit, Launenhaftigkeit und Somnolenz. Bei gleichzeitiger Einnahme von Medikamenten die das Herz-Kreislauf-System beeinflussen, kann es zum verstärkten Auftreten kardialer UAWs kommen [1]. 43 Clonidin und Guanfacin: In den USA werden Clonidin und Guanfacin als retardierte Formulierungen als Mono- oder Begleitherapie von ADHS von Kindern und Jugendlichen zwischen 6 und 17 Jahren verwendet. Guanfacin kann als retardiertes Präparat für die Therapie von ADHS bei Kindern und Jugendlichen zwischen 6 und 17 Jahren eingesetzt werden, wenn eine Therapie mit Psychostimulanzien nicht möglich ist, nicht vertragen wurden und sich als unwirksam erwiesen hat. Im Off-Label-Use bei Aggressionen bei ADHS und autistischen Störungen, Tic-Störungen und Alkohol- und Opioidentzugssymptome (Clonidin). Als UAWs treten auf Puls- und Blutdrucksenkungen, Somnolenz, Sedierung, Abgeschlagenheit, Schmerzen im Oberbauch, Obstipation und Kopfschmerzen. Vorsicht bei Synkopen und Arzneimittel, die die SinusknotenFunktion oder AV-Knoten-Überleitung beeinträchtigen (Gefahr einer Bradykardie oder eines AV-Blockes). Tabelle 7 bietet einen Überblick über die Dosierungen der Arzneimittel im Kindesund Jugendalter. Tab. 6.3.1. Dosierungsempfehlungen der bei ADHS verwendeten Arzneimittel im Kindes- und Jugendalter (Mod. nach [2]) Internationaler Freiname bzw. Dosierung (mg/kg Dosierung/Tag (mg) geschützter Markenname Köpergewicht) Amphetamin-Präparate: - Dexamphetamin 0,1-0,5 - Lisdexamphetamin Atomoxetin 30, max. 70 0,5-1,2 Clonidin retardiert Guanfacin retardiert 5-20, max. 40 18-60, max. 100 bei >70kg 0,1-0,4 0,05±0,08; 1-4 max. 0,12 Methylphenidat: - schnell freisetzend 0,3-1,0 5-40, max. 60 - retardiert: Concerta® 0,3-1,0 18-54mg (Concerta®) - retardiert: andere 0,3-1,0 10-40, max. 60mg 44 7. Stimmungsstabilisatoren Der Begriff „Stimmungsstabilisatoren“ umfasst eine heterogene chemische und pharmakologische Gruppe von Neuro-/ Psychopharmaka, die starke Stimmungsschwankungen dämpfen bis beseitigen sowie die Affektlabilität während und zwischen den Episoden einer bipolaren Störung positiv beeinflussen sollen. Ein idealer Stimmungsstabilisator soll in manischen als auch in gemischten und depressiven Phasen wirken. Klassische Vertreter sind Lithiumsalze und Valproinsäure, weiters werden Antiepileptika mit stimmungsstabilisierenden Wirkungen wie Carbamazepin, Gabapentin, Lamotrigin, Oxcarbazepin und Topiramat sowie Antipsychotika der zweiten Generation (Aripiprazol, Olanzapin, Risperidon, Quetiapin und Ziprasidon) dazugezählt. 7.1. Wirkungsmechanismus Wie bei anderen Neuro-/ Psychopharmaka ist die Wirkungsweise von Stimmungsstabilisatoren nicht vollständig geklärt, was unter anderem auf die in großen Teilen unklare Ätiologie von bipolaren Erkrankungen zurückzuführen ist. Dazu gibt es verschiedene Theorien, so werden neben einer hohen Heritabilität und einer gestörten neuronalen Entwicklung auch im zentralen Nervensystem erniedrigte Glukokortikoid-Rezeptor-Dichten (erhöhte Spiegel von Kortisol sollen zur Schädigung von Neuronen und verminderter Neurogenese beitragen) sowie eine gestörte glutamaterge Neurotransmission diskutiert [32]. Stimmungsstabilisatoren haben keine selektive Wirkung auf NeurotransmitterRezeptoren, vielmehr besitzen sie eine große Bandbreite zellulärer und molekularer Effekte. So verändern sie über Einwirkung auf die neuronale Erregbarkeit Second-Messenger-Systeme (v.a. den Inositolphosphat- Stoffwechselweg) oder die Calcium-Homöostase. Diese Systeme können aber auch durch Modulation von Neurotransmitter-System (Dopamin, GABA, Glutamat, Noradrenalin und neuroprotektiver Serotonin) beeinflusst Mechanismen und werden. Durch Prozesse wird die die Aktivierung zelluläre Überlebensfähigkeit und neuronale Plastizität verändert. 45 Eine Darstellung von molekularen und zellulären Effekten von Lithiumsalzen und anderen Stimmungsstabilisatoren in präklinischen Untersuchungen wurde von Schloesser et. al (2012)[32] und Grunze und Bauer (2012)[33] vorgenommen. 7.2. Klinische Psychopharmakologie ausgewählter Arzneistoffe Da eine detaillierte Darstellung aller Stimmungsstabilisatoren und der Ergebnisse klinischer Studien den Rahmen dieser Arbeit sprengen würde, werden die wichtigsten Arzneistoffe nur kurz vorgestellt. Lithiumsalze: Auch wenn sich Lithiumsalze in der Akuttherapie und Rezidivprophylaxe von bipolaren Störungen als wirksam und sicher erwiesen haben, gibt es zurzeit wenig Studien im Kindes- und Jugendalter, die eine eindeutige Wirksamkeit belegen. Dennoch werden sie in der Phasenprophylaxe der bipolaren Störung und Episoden einer Major Depression, manischen Episoden und akuten Depressionen z.B. bei Therapieresistenz oder Unverträglichkeit von Antidepressiva eingesetzt. Zu wissen ist aber, dass ein therapeutischer Effekt erst nach 1-2 Wochen eintritt, sodass in der Behandlung einer akuten manischen Episode initial eine zusätzliche Therapie mit stimmungsstabilisierenden Antipsychotika empfohlen ist. Lithiumsalze sollen regelmäßig und zur selben Zeit eingenommen und langsam aufdosiert werden. Sollte nach Absetzen der Medikation eine erneute Behandlung notwendig sein, kann mit der zuletzt wirksamen Dosierung gestartet werden, eine erneute Aufdosierung ist nur bei körperlichen Veränderung oder Nierenerkrankungen notwendig. Häufige UAWs sind: Übelkeit, Erbrechen, Kopf- und Bauchschmerz, gesteigerter Appetit mit Gewichtszunahme, Hypothyreose, Akne und ein hochfrequenter, oft feinschlägiger Tremor. Bei Zeichen einer Intoxikation (grobschlägiger Tremor, Rigor, Ataxie, Hyperreflexie, Schwindel, Dysarthrie, Verwirrtheit bis zu delirantem Verhalten) muss das Lithium-Präparat sofort abgesetzt und eine intensivmedizinische Therapie begonnen werden. Antipsychotika, Carbamazepin, kochsalzarme Diäten und Phenytoin können den Lithium-Serumspiegel steigern und damit das Risiko einer Intoxikation erhöhen. 46 Carbamazepin: Carbamazepin ist ein Antiepileptikum, dass nicht nur in der antiepileptischen Therapie und in der Behandlung von Schmerzzuständen (v.a. Neuralgien) angewendet wird, sondern auch Verwendung in der Behandlung der Manie oder Mischzuständen im Erwachsenenalter findet. Hinweise auf eine Wirksamkeit bei Kindern und Jugendlichen mit bipolaren Störungen gibt es nur in 2 offenen Studien [34][35]. Vor und während der Therapie wird empfohlen ein großes Blutbild (inkl. Thrombozytenzahl und Differentialblutbild) zu erstellen, da als UAWs Blutbildveränderungen Thrombozytopenie) gastrointestinale vorkommen Beschwerden, (Leukozytose, können. Häufige Kopfschmerz Leukopenie, UAWs und Eosinophilie, sind Sedierung, Schwindel. Sollten Hautreaktionen auftreten (Symptome des Lyell-Syndroms oder Stevens-JohnsonSyndroms), muss die Therapie beendet werden. Carbamazepin wird durch das CYP3A4-Enzym metabolisiert und induziert dieses auch, deshalb ist besondere Vorsicht geboten, wenn andere Arzneimittel eingenommen werden, die durch dieses Enzym metabolisiert werden oder es beeinflussen. In diesen Fällen wird ein therapeutisches Drug-Monitoring empfohlen, um die Dosen der Medikamente anpassen (reduzieren oder erhöhen) zu können. Lamotrigin: Ebenfalls ein Antiepileptikum, das zur Behandlung von bipolaren Störungen und zur Prophylaxe depressiver Episoden beim Erwachsenen benutzt wird. Trotz der dürftigen Datenlage zum Einsatz bei Kindern und Jugendlichen gibt es Hinweise auf eine Wirksamkeit [36][37]. Aufgrund der Gefahr seltener Hautreaktionen (Lyell-, Stevens-Johnson-Syndrom) soll Lamotrigin langsam eindosiert und die Erhaltungsdosis nicht überschritten werden (Dosierungsschemata sind in Biederman et al. 2010 [37] dargestellt). Häufige UAWs sind Infektionen, gastrointestinale Beschwerden, Schwindel, Somnolenz und Grippesymptome. Oxcarbazepin: Da es ähnlich zu anderen Antiepileptika nur eine spärliche Datenlage zur Wirksamkeit bei bipolaren Störungen bei Erwachsenen, Kindern und Jugendlichen gibt, wurde in den Leitlinien zur Diagnostik und Therapie bipolarer Störungen keine Empfehlung formuliert [38]. Dennoch existieren Hinweise auf positive Effekte bei Anwendung im Kindes- und Jugendalter [39][40]. Auftretende UAWs (Schwindel, Übelkeit, Somnolenz und Exantheme) ähneln denen unter Carbamazepin, scheinen aber weniger schwerwiegend zu sein. 47 Topiramat: Bisher gibt es keine Empfehlungen für den Einsatz von Topiramat bei bipolaren Störungen [38]. In den existierenden Studien war aber die Gewichtsabnahme unter Topiramat alleine und die reduzierte Gewichtszunahme bei Kombination mit Antipsychotika [41][42] auffällig. Häufige (in Studien vorkommende) UAWs sind: Übelkeit, Appetitverlust, Insomnie, Schwindel, Koordinations-/ Aufmerksamkeitsstörungen, gastrointestinale Beschwerden und Somnolenz. Obwohl Topiramat überwiegend nichtenzymatisch metabolisiert und renal ausgeschieden wird, gibt es einige Wechselwirkungen mit anderen Arzneimitteln. Eine Steigerung der Dosis ist bei Kombination mit enzyminduzierenden Antiepileptika (Carbamazepin, Phenytoin, Phenobarbital) erforderlich. In Kombination mit Valproinsäure kam es zur Hyperammonämie (mit/ohne Enzephalopathie), die aber nach Absetzten eines der beiden Arzneimittel verschwand, und zur Hypothermie. Valproinsäure: Nach S3-Leitlinie zur Diagnostik und Therapie von bipolaren Störungen [38] im Erwachsenenalter empfohlen in der Behandlung der Manie als Monotherapie und zur Phasenprophylaxe bipolarer Störungen. In einigen Studien [43][44][45] zur Wirksamkeit bei Kindern und Jugendlichen war Valproinsäure im Vergleich zu anderen Medikamenten (Lithium, Quetiapin, Risperidon) nicht überlegen. Bei der Behandlung von Störungen des Sozialverhaltens weisen zwei Studien [46][47] einen positiven Effekt bezüglich der Impulskontrolle auf, jedoch sind die Ergebnisse aufgrund methodischer Schwächen mit Vorsicht zu betrachten. Beobachtete UAWs sind gastrointestinale Beschwerden, Sedierung, Gewichtszunahme, Schwindel, Anstieg des Ammoniak-Spiegels, Thrombozytopenie und (bei Kindern häufiger als beim Erwachsenen) eine lebensbedrohliche Pankreatitis. 48 8. Psychische Erkrankungen im Kindes- und Jugendalter Nachdem in den vorigen Kapiteln die verwendeten Medikamente mit ihren Wirkungen und Indikationen dargestellt wurden, werden nun die häufigsten psychischen Erkrankungen im Kindes- und Jugendalter kurz vorgestellt, die eine medikamentöse Behandlung mittels Psychopharmaka erfordern können. 8.1. Aggressives Verhalten und Störungen des Sozialverhaltens Aggressives Verhalten kann isoliert oder als Teil einer psychiatrischen Erkrankung auftreten. Die Behandlungsbedürftigkeit ist abhängig von dem individuellen Leidensdruck des Kindes bzw. der Umwelt. Aggressives Verhalten kann gegen sich selbst (Selbstverletzungen wie Kratzen oder Schneiden, Suizidalität) oder gegen andere gerichtet sein. In vielen Fällen ist Aggressivität Folge bzw. Symptom einer psychiatrischen Erkrankung z.B. einer Psychopathie, einer Störung der Impulskontrolle (ADHS), einer kognitiven Einschränkung, einer Störung des Sozialverhalten oder als Folge einer Traumatisierung. Selten tritt die Aggression isoliert auf. Das Erscheinungsbild reicht von verbal, tätlich, impulsiv bis hin zur geplanten bzw. persönlichkeitsassozierten Aggressivität. Desweiteren kann sie als Stimmungsschwankungen, Gereiztheit, Nervosität oder als offene Gewalt bis hin zur akuten Selbstgefährdung (Suizid) zum Ausdruck gebracht werden. Eine Störung des Sozialverhaltens (SSV) ist charakterisiert durch aggressives, dissoziales oder aufsässiges Verhalten, das über einen Zeitraum von mindestens 6 Monaten wiederholt und andauernd auftritt und dem Entwicklungsalter nicht entspricht. Man kann vier Arten unterscheiden: 1. auf den familiären Rahmen beschränkte Störung des Sozialverhaltens, 2. SSV bei fehlenden sozialen Bindungen, 3. SSV bei vorhandenen sozialen Bindungen und 4. SSV mit oppositionellem aufsässigen Verhalten. Abhängig davon, ob eine Grunderkrankung existiert, werden verschiedenste Medikamente in der Therapie verwendet. Allen gemeinsam ist aber, dass die Therapie meistens längerfristig und eine zusätzliche Psychotherapie sinnvoll ist. Als indiziert bei Aggressivität gelten u.a. Antipsychotika (bei 49 Impulskontrollstörungen und aggressiver Gespanntheit), Psychostimulanzien (bei Kombination mit ADHS), Stimmungsstabilisatoren (bei bipolaren Erkrankungen) und Benzodiazepine zur Akutbehandlung. 8.2. Angststörungen und Phobien Ängste existieren in vielen Formen und in jedem Lebensalter und sind normalerweise nicht behandlungsbedürftig. Angststörungen und Phobien hingegen sind behandlungsbedürftige Formen der „normalen“ Ängste, die durch Vermeidungsverhalten und übermäßige Angst gekennzeichnet sind, die normale Entwicklung des Kindes beeinträchtigen oder zu Problemen in der Familie und anderen Lebensbereichen führen. Angststörungen sind übermäßig ausgeprägte Angstreaktionen, wobei die Angst selbst nicht auf bestimmte Objekte oder Situationen beschränkt ist. Nach der ICD10-Klassifikation können Angststörungen in 1. Panikstörungen, 2. generalisierte Angststörungen, 3. sonstige gemischte Angststörungen und 4. Emotionale Störung mit Trennungsangst des Kindes eingeteilt werden. Phobien hingegen sind auf bestimmte Objekte oder Situationen beschränkt, was dazu führt, dass Betroffene diese Objekte oder Situationen vermeiden, was wiederum die Ausprägung der Einschränkungen im täglichen Leben bestimmt. Nach ICD-10 kann man unterscheiden: 1. Agoraphobie, 2. soziale Phobien, 3. spezifische (isolierte) Phobien, 4. Phobische Störungen des Kindesalters, 5. Störung mit sozialer Überempfindlichkeit des Kindesalters und 6. Posttraumatische Belastungsstörung [48]. Sowohl bei den Angststörungen als auch bei Phobien, muss vor Beginn einer Therapie die Diagnose mittels multiaxialer Diagnostik und Verhaltensanalyse gesichert werden. Die Therapie selbst ist multimodal, wobei am bedeutsamsten die Psychotherapie, vor allem in Form der Verhaltenstherapie (Konfrontation von angstbesetzen Situationen und Objekten), ist. Sollte die Psychotherapie nicht ausreichen, kann eine begleitende symptomatische Therapie mit Medikamenten gestartet werden. Sie ist meistens bei akuter Krisenintervention, schweren Symptomen oder chronischen Verläufen indiziert. Die Pharmakotherapie lindert 50 jedoch nur subjektiv die Angstbeschwerden ohne dass eine Verhaltensänderung erreicht wird. Verwendete Medikamente sind v.a. selektive Serotonin- Wiederaufnahmehemmer (SSRIs). Andere medikamentöse Möglichkeiten wären Antipsychotika, trizyklische Antidepressiva und das Antidepressivum Venlafaxin. 8.3. Autismus Als Autismus-Spektrum-Störungen werden der frühkindliche Autismus, das Asperger-Syndrom und der atypische Autismus zusammengefasst. Die Unterscheidung dieser anhand des klinischen Bildes gestaltet sich als relativ schwierig, auch gleichen sie sich hinsichtlich ihrer Therapie. Allen gemeinsam sind folgende Diagnosekriterien: 1. Schwierigkeiten in der sozialen Interaktion („Beziehungsstörung“), 2. Schwierigkeiten in der Kommunikation (ev. mit Sprachentwicklungsverzögerung) und 3. repetitive und stereotype Verhaltensweisen und Sonderinteressen. Dennoch gibt es vor allem zwischen dem frühkindlichen Autismus und dem Asperger-Syndrom Unterschiede. So tritt beim frühkindlichen Autismus die Beziehungsstörung häufig früher und in stärkerer Ausprägung auf als beim Asperger-Syndrom, außerdem haben Kinder mit Asperger-Syndrom meistens eine normale Sprachentwicklung. Als Ursache diskutiert werden biologisch wirksame Umweltrisikofaktoren (z.B. virale Infektionen sowie Einnahme bestimmter Medikamente in der Schwangerschaft), immunologische und genetische Mechanismen. Neben der geistigen Behinderung treten bei Kinder und Jugendlichen mit Autismus-Spektrum-Störungen gehäuft andere psychiatrische und neurologische komorbide Erkrankungen auf. Dazu zählen die Epilepsie, Angststörungen, Zwangsstörungen, Schlafstörungen, Enuresis/Enkopresis und soziale Phobien. Da es keine medikamentöse Basistherapie gibt, mit der Autismus-SpektrumStörungen „geheilt“ werden können, richtet sich die Pharmakotherapie darauf, die Begleiterkrankungen zu behandeln. So befinden sich momentan Antipsychotika (z.B. Risperidon, Aripiprazol), SSRIs (Fluoxetin, Sertralin, Citalopram u.a), Psychostimulanzien (v.a. Methylphenidat) und Noradrenalin- Wiederaufnahmehemmer (z.B. Atomoxetin) im Einsatz. In der klinischen Praxis 51 werden in der Regel verhaltenstherapeutische Maßnahmen mit pharmakologischen Interventionen kombiniert. 8.4. ADHS Die Abkürzung ADHS steht für Aufmerksamkeitsdefizit-Hyperaktivitäts-Syndrom, wobei die Kardinalsymptome Unaufmerksamkeit bzw. erhöhte Ablenkbarkeit und Hyperaktivität (erhöhte motorische Unruhe) verschieden stark ausgeprägt sein können. So ist dem ADHS das reine Aufmerksamkeitsdefizit-Syndrom (ADS) genauso zu zuordnen wie eine vorwiegend hyperkinetische Störung (HKS). Kinder mit ADHS zeigen üblicherweise die Symptome, die je nach Umgebung und Situation variieren können, schon früh in ihrer Entwicklung. Zu den am häufigsten existierenden komorbiden Störungen bei ADHS zählen die Störung des Sozialverhaltens, Lese-Rechtschreib-Störungen, Depressionen, Tic- und Angststörungen sowie Impulskontrollstörungen. Aufgrund der Symptomatik besteht die Gefährdung der psychischen Entwicklung sowie in der schulischen / beruflichen Bildung und der sozialen Integration. Da erhöhte Unruhe und Unaufmerksamkeit mit einem schulischen Alltag eher schwer vereinbar sind, kommen die meisten Kinder erst im Grundschulalter zum ersten Mal in ärztliche Betreuung. Für eine medikamentöse Therapie ist dann eine gründliche klinisch-neurologische Untersuchung mit differentialdiagnostischer Abklärung notwendig, um somatische Ursachen (z.B. Hyperthyreose) auszuschließen. Wie bei allen psychiatrischen Erkrankungen im Kindes- und Jugendalter besteht die Therapie von ADHS aus multimodalen Ansätzen. Das Umfeld der Betroffenen wird genauso aufgeklärt und beraten wie das Kind, wobei dieses zusätzlich eine (verhaltenstherapeutische) Psychotherapie neben einer Pharmakotherapie erhalten sollte. Indiziert bei ADHS sind Psychostimulanzien wie Methylphenidat und Amphetamine und Nicht-Psychostimulanzien wie Atomoxetin. Zu Beachten ist aber, dass Kinder im Vorschulalter nur in Ausnahmefällen (starke Beeinträchtigung der Entwicklung durch Symptome) medikamentös behandelt werden sollen und dann Methylphenidat vorzuziehen ist. Sollten Komorbiditäten vorhanden sein, werden diese entsprechend (symptomatisch) behandelt. 52 8.5. Enuresis / Enkopresis Als Enuresis wird das Einnässen, als Enkopresis das Einkoten bezeichnet, wobei beim nächtlichen Einnässen (Enuresis nocturna) und bei der Enkopresis eine primäre Form (noch nie trocken bzw. sauber) von einer sekundären Form (Rückfall nach 6 Monaten) unterschieden wird. Die Enuresis kann man in folgende Untergruppen unterteilen: nächtliches Einnässen mit/ohne Blasendysfunktion und Einnässen tagsüber mit Dranginkontinenz, Detrusor-Sphinkter-Dyskoordination und Harninkontinenz bei Miktionsaufschub. Eine Pharmakotherapie ist nur indiziert bei der Enuresis nocturna, bei der Dranginkontinenz und selten bei der Lachinkontinenz. Im Falle des nächtlichen Einnässens wird meistens Desmopressin, ein Analogon zum antidiuretischen Hormon, verordnet. Weitere mögliche Wirkstoffe sind trizyklische Antidepressiva wie Imipramin und Clomipramin oder ein selektiver NoradrenalinWiederaufnahmehemmer wie Reboxetin. Bei der Dranginkontinenz indiziert sind Anticholinergika. Bei der Enkopresis wiederum lässt sich zwischen vorhandener und nicht vorhandener Stuhlretention unterscheiden. Ist das Einkoten begleitet von einer Obstipation, so ist initial eine medikamentöse Entleerung des Stuhles mithilfe von Laxanzien (Polyethylenglykol oral oder Klistiere) erforderlich. Danach soll für mindestens 6 Monate eine Erhaltungstherapie mit Laxanzien erfolgen, Mittel der ersten Wahl ist dabei Polyethylenglykol (PEG). Weitere mögliche Wirkstoffe zur Erhaltungstherapie sind Lactulose oder Gleitmittel wie Paraffinum subliquidum, oder aber eine Steigerung der Ballaststoff- bzw. Flüssigkeitszufuhr. Sowohl bei der Enkopresis als auch bei der Enuresis stehen aber verhaltenstherapeutische Maßnahmen im Vordergrund. Bei der Enkopresis bestehen diese beispielsweise aus Toilettentraining, bei Enuresis aus der apparativen Verhaltenstherapie. Sollten beide Fälle existieren, so wird die Enkopresis vor der Enuresis therapiert. Zusätzlich gilt es zu beachten, dass das Einnässen tagsüber vor dem Einnässen nachts therapiert wird. Da die Enkopresis und die Enuresis ein hohes Risiko für psychiatrische Komorbiditäten besitzen, gilt es diese auch zu diagnostizieren und entsprechend zu behandeln. 53 8.6. Depressive Störungen und Manie Depressive Störungen können nach ICD-10 in depressive Episoden und in rezidivierende depressive Störungen eingeteilt werden. Typische Charakteristika einer depressiven Episode sind gedrückte Stimmung, Interessenverlust, Freudlosigkeit und eine Verminderung des Antriebes. Weitere Symptome können sein: vermindertes Denk- und Konzentrationsvermögen, vermindertes Selbstvertrauen, Gefühle von Wertlosigkeit, negatives Denkmuster und leicht reizbare Stimmung. Häufig bestehen auch somatische Beschwerden wie Kopfoder Bauchschmerzen. Eine depressive Episode dauert mindestens 2 Wochen und ist wenig situationsgebunden. Kennzeichen einer rezidivierenden depressiven Störung sind rezidivierende depressive Episoden, die jeweils zwischen 3 und 12 Monaten andauern und häufig durch belastende Lebensumstände ausgelöst werden. Ziel einer Psychopharmakotherapie ist die Verbesserung der Stimmungslage, Steigerung des Antriebes usw. Meistens kann die Behandlung ambulant erfolgen. Bei schwerer Symptomatik, akuter Suizidalität, ungenügender Unterstützung durch das soziale Umfeld oder Funktionseinschränkung durch die Symptomatik ist eine stationäre Therapie indiziert. Bei der medikamentösen Therapie verwendete Pharmaka sind Antidepressiva, wobei das SSRI Fluoxetin die erste Wahl darstellt, in Monotherapie oder in Kombination mit Benzodiazepinen (bei akuter Suizidalität) oder Antipsychotika (bei motorischer Unruhe und Getriebenheit sowie Schlafstörungen). Krankheitsmerkmale und gleichzeitig Zielsymptome von manischen Episoden sind gehobene oder gereizte Stimmung, deutliche Antriebssteigerung, gesteigertes Selbstwertgefühl und Selbstüberschätzung, Rededrang, Ideenflucht, Verlust normaler sozialer Schlafbedürfnis, Hemmungen, gesteigerte Libido, erhöhte Ablenkungen, vermindertes Wahrnehmungsveränderungen und Wahnvorstellungen. Bipolare Störungen sind gekennzeichnet durch oft raschen Wechsel der beiden Pole Depression und Manie. Ziel der Pharmakotherapie ist die Stabilisierung der Stimmung und des Antriebes, das Erreichen der Verhaltenskontrolle und das Auftreten von weiteren Phasen zu verhindern (Phasenprophylaxe). Als Mittel der ersten Wahl zur Behandlung der akuten Manie gilt das Antipsychotikum der zweiten Generation Aripiprazol, zweite Wahl sind 54 Olanzapin, Quetiapin und Risperidon. Zur Phasenprophylaxe kommt ebenfalls Aripiprazol als erste Wahl zum Einsatz, gefolgt von Lithiumsalzen als zweite Wahl und den stimmungsstabilisierenden Antiepileptika Lamotrigin und Valproinsäure. 8.7. Schizophrenie Die Schizophrenie ist eine psychotische Störung, die durch eine Vielzahl von möglichen Symptomen gekennzeichnet ist. Zu diesen Symptomen gehören die positive (Plussymptome) und negative (Minussymptome) psychotische sowie kognitive und häufig affektive Symptomatik. Als Plussymptome werden Halluzinationen, Wahn (inhaltliche Denkstörung), Zerfahrenheit im Denken (formale Denkstörung) und Handeln und motorische Störungen bezeichnet. Zu den Minussymptomen zählen Mangel an Spontanität, Sprachverarmung, sozialer/emotionaler Rückzug, reduzierte nonverbale Kommunikation (expressive Defizite) sowie Apathie und Störung der Willensbildung. Nach ICD-10 können 4 Subtypen unterschieden werden: 1. Paranoide Schizophrenie (Wahn, Halluzinationen), 2. Hebephrene Schizophrenie (affektive Veränderungen im Vordergrund), 3. Katatone Schizophrenie (v.a. psychomotorische Störungen) und 4. Undifferenzierte Schizophrenie (Symptome nicht passend für andere Subtypen). Zur Therapie der Schizophrenie wird eine Kombination aus antipsychotischen und psychosozialen Interventionen empfohlen. Die psychosozialen Interventionen beinhalten kognitiv-behaviorale Therapie, Familientherapie, Psychoedukation und Rehabilitation. Die Pharmakotherapie besteht zum Großteil aus dem Einsatz von Antipsychotika, wobei für die Auswahl der Leitsatz „primum non nocere“ („zuerst einmal nicht schaden“) gilt. Während die initial niedrige Dosis langsam gesteigert wird, werden unerwünschte Arzneimittelwirkungen beobachtet und deren subjektiver und objektiver Beeinträchtigungsgrad beachtet. Nicht empfohlen werden Olanzapin (starke Gewichtszunahme) und Clozapin (AgranulozytoseRisiko) als Medikament der ersten Wahl. Bei Therapieresistenz ist Clozapin Mittel der ersten Wahl. 55 8.8. Schlafstörungen Eine Schlafstörung definiert sich als das subjektive Leiden unter Schwierigkeiten beim Ein- bzw. Durchschlafen, der Schlaftiefe/-dauer oder der Qualität des Schlafes. Nach ICD-10 können Schlafstörungen unterteilt werden in nichtorganische Insomnie, Hypersomnie, Störung des Schlaf-Wach-Rhythmus, Somnambulismus (Schlafwandeln), Pavor nocturnus (Nachtschreck) und Albträume. Bei der Untersuchung bzw. Diagnostik ist es wichtig herauszufinden, ob eine organische Ursache für eine Schlafstörung oder eine begleitenden psychiatrische Erkrankung existiert bevor eine Therapie gestartet wird. Bei der Diagnostik sind außerdem die altersspezifischen Richtwerte eines gesunden Schlafverhaltens zu berücksichtigen, so benötigt ein 10 Jahre altes Kind im Durschnitt 2 Stunden mehr Schlaf als ein Erwachsener. Die Therapie nichtorganischer Schlafstörungen beruht hauptsächlich auf Beratung zur Schlafhygiene und verhaltenstherapeutischen Behandlungsansätzen. Indikationen für eine medikamentöse Therapie sind psychiatrische Erkrankungen, Insomnie, Hypersomnie, Pavor nocturnus (Nachtschreck) und Schlafwandeln. Wird eine medikamentöse Therapie gestartet, können bestimmte (sedierende) Antihistaminika, Antipsychotika, Benzodiazepine oder Phytopharmaka verordnet werden. Die Wahl des Pharmakons hängt dabei von der Art der Schlafstörung und etwaigen psychiatrischen Komorbiditäten ab. 8.9. Tic-Störungen Tics sind plötzlich einsetzende, kurz andauernde, sich wiederholende unwillkürliche Bewegungen oder Lautäußerungen, die keinem erkennbaren Zweck dienen und sich im Laufe der Zeit verändern können. Stress und emotionale Erregungen wirken sich negativ auf Häufigkeit und Intensität aus, das Konzentrieren auf eine Sache und/oder Handlung oder Schlaf wiederum positiv auf die Tics (Häufigkeit verringern). Eine kurzzeitige willkürliche Unterdrückung der Tics ist möglich. Die Bewegungen und Lautäußerungen haben ein breites Spektrum, sie reichen von einfachen bis hin zu komplexen motorischen und 56 vokalen Tics. Zu den komplexen motorischen Tics zählen die Kopropraxie (Ausführen obszöner Gesten) und die Echopraxie (Imitation von Gesten anderer Menschen), zu vokalen Tics die Koprolalie (Ausstoßen obszöner Wörter), die Palilalie (Wiederholung eigener gerade gesprochener Silben oder Wörter) und die Echolalie (Wiederholung von gesprochenen Wörtern anderer). Die Symptome der Tic-Störungen können sich in verschiedenen Lebensjahren manifestieren und reduzieren sich häufig im jungen Erwachsenenalter, auch ohne Behandlung. Die bekannteste Tic-Störung ist das Tourette-Syndrom, wobei bei diesem eine Kombination von motorischen und vokalen Tics für eine Zeit von mindestens 1 Jahr besteht und die Symptome vor dem 18. Lebensjahr zum ersten Mal aufgetreten sind. Komorbiditäten sind ADHS oder Zwangsstörungen, andere (psychiatrische) Symptome oder Störungen z.B. affektive Störungen, Lernstörungen, Schlafstörungen, Autismus-Spektrum-Störungen. Wie bei anderen psychiatrischen Erkrankungen im Kindes- und Jugendalter haben auch hier psychotherapeutische Interventionen und Methoden in der Therapie Vorrang. Eine pharmakologische Therapie ist dann indiziert, wenn die Beeinträchtigung des alltäglichen Lebens durch die Tics über ein akzeptables Maß hinausgeht, der subjektive Leidensdruck der Betroffenen sehr hoch ist oder ein chronischer Verlauf (über 12 Monate) vorliegt. Ziel der Medikation ist es, die Tics auf ein erträgliches Maß zu reduzieren. Zu diesem Zweck werden vor allem Dopamin-Antagonisten verwendet (1. Wahl: Tiaprid, Sulpirid; 2. Wahl: Risperidon und Aripiprazol). 8.10. Zwänge Zwangsstörungen sind wiederkehrende und anhaltende Verhaltensweisen, Ideen, Gedanken und Impulse, die sich gegen inneren Widerstand aufdrängen und als unsinnig, übertrieben und quälend empfunden werden und schließen Zwangsgedanken und Zwangshandlungen mit ein. Zwangsgedanken Verschmutzung, beinhalten Infektionen, Ideen, Gedanken und Vorstellungen. Symmetrie, Genauigkeit oder das Sammeln 57 bestimmter Gegenstände sind häufige Inhalte dieser. Manchmal können auch Bilder mit aggressivem, sexuellem oder religiösem Inhalt dabei sein. Zwangshandlungen sind sich ständig wiederholende Handlungen, bei deren Nichtausführung es zum Anstieg von Angst und Anspannung kommt. Diese Handlungen erscheinen teils ritualisiert und teils stereotyp. Nach der ICD-10-Klassifikation müssen Zwangsgedanken/-handlungen für mindestens 2 Wochen die meiste Zeit des Tages bestehen, als quälend oder störend oder den Alltag beeinträchtigend empfunden werden und es muss ein Widerstand gegen die Symptomatik bestehen. Bezüglich der Therapie von Zwangsstörungen wird eine Kombination aus Psychoedukation, kognitiv-verhaltenstherapeutischer Therapie und einer Pharmakotherapie empfohlen. Bei der medikamentösen Therapie haben sich vor allem die selektiven Serotonin-Wiederaufnahmehemmer (SSRIs; z.B. Sertralin und Fluvoxamin) als effektiv gezeigt und gelten daher als Mittel der ersten Wahl. Als Medikament der zweiten Wahl gilt das trizyklische Antidepressivum Clomipramin. Spricht das Kind nicht auf eine Monotherapie mit einem SSRI oder Clomipramin an, kann eine Augmentation mit Antipsychotika (Risperidon, Aripiprazol) überlegt werden, wobei aber das dadurch erhöhte Risiko für unerwünschte Arzneimittelwirkungen zu beachten ist. 8.11. Essstörungen Die zwei häufigsten und bekanntesten Formen der Essstörungen sind die Anorexia nervosa (AN, „Magersucht“) und die Bulimia nervosa (BN, „Ess-BrechSucht“). Obwohl bei beiden Störungen eine Gewichtsphobie und/oder eine Körperschemastörung mit dysfunktionalen Gedanken bezüglich Gewicht und Figur auftreten kann, gibt es dennoch Unterschiede. Bei der AN steht vor allem das gestörte Essverhalten mit einer daraus resultierenden Kachexie im Vordergrund. Bezüglich der Kachexie existieren zwei Möglichkeiten, das Köpergewicht zu beurteilen. Einerseits über die Errechnung des Body-Mass-Index (BMI, kg/m²), der Gewichtsschwellenwert für die Diagnose der AN liegt bei 17,5 kg/m², andererseits kann man die 10. Altersperzentile als 58 Gewichtsgrenze heranziehen. Die Anorexia nervosa kann in zwei Typen auftreten, der ‚restriktive Typ‘, der ausschließlich fastet oder exzessiv körperlich aktiv ist und der bulimische (‚binge/purging‘) Typus, der durch zusätzliche Heißhungerattacken, den Gebrauch von Laxanzien oder selbstinduziertes Erbrechen gekennzeichnet ist. Die Bulimia nervosa wird charakterisiert durch wiederkehrende Heißhungerattacken mit Kontrollverlust. Große Mengen hochkalorischer Nahrung werden aufgenommen, um dann mit selbstinduziertem Erbrechen, Fasten, Diäten und durch Einnahme von Laxanzien und/oder Diuretika der Gewichtszunahme entgegen zu wirken. In seltenen Fällen kann die BN Teil einer Persönlichkeitsstörung z.B. Borderline-Störung sein. Die medikamentöse Therapie der AN beschäftigt sich vorwiegend mit den Folgen der reduzierten Nahrungsaufnahme (z.B. Substitutionstherapie von Vitaminen, Spurenelementen und Enzymen). Eine weitere Indikation für eine Pharmakotherapie kann in der erhöhten körperlichen Aktivität und einer inneren Unruhe bei AN und in den bereits erwähnten Begleiterkrankungen liegen. Wichtig ist, dass vor dem Beginn einer Therapie mit Pharmakotherapie zuerst der antidepressive Effekt einer Gewichtsrehabilitation abgewartet werden soll. In der Akutphase werden Hyperaktivität und Unruhe mit niederpotenten Antipsychotika und Benzodiazepinen behandelt. Nach Erreichen eines „normalen“ Körpergewichtes kann eine bestehende depressive oder zwanghafte Symptomatik mit einem anfangs niedrig dosiertem SSRI (z.B. Fluoxetin) therapiert werden. In der Akut- und Langzeitbehandlung der BN kann ein SSRI (Fluoxetin oder Fluvoxamin) gegeben werden. Bei beiden Essstörungen können komorbide psychische, meist depressive, ängstliche oder zwanghafte Störungen auftreten und sollen in der Therapie beachtet werden. 59 9. Conclusio In Anbetracht der aktuellen Datenlage kann man festhalten, dass bei Kindern und Jugendlichen zu großen Teilen dieselben Medikamente wie beim Erwachsenen verwendet werden. Eine Einschränkung in den Anwendungen liegt aber sicher in den wenigen Studien zu Wirksamkeit und Sicherheit, was zur Folge hat, dass es noch zu wenige Zulassungen und damit verbunden wenig Dosierungsempfehlungen gibt. Vieles ist von Beobachtungen und Erfahrungen von Ärztinnen und Ärzten abhängig – Guidelines werden nur in relativ großen Zeitabständen aktualisiert. Dennoch existieren Empfehlungen zur Indikation insofern, dass von manchen Medikationen abgeraten wird (aufgrund schwerer beobachteter UAWs u.ä.) oder als erste Wahl einer Behandlung die Psychotherapie einen großen Stellenwert einnimmt. Bei vielen Erkrankungen und Störungen wird erst dann eine medikamentöse Intervention begonnen, wenn der objektive Schweregrad und/oder der subjektive Leidensdruck sehr groß ist. Selbst dann müssen das Kind bzw. der Jugendliche und die Sorgeberechtigten einer Behandlung nach sorgfältiger Aufklärung zustimmen. Während der Therapie müssen dann regelmäßige Kontrollen erfolgen, um UAWs und Wechselwirkungen zu erkennen, damit keine Folgeschäden oder lebensbedrohliche Situationen entstehen. Trotzdem hängen vielmals die therapeutischen Erfolge von der weiteren Entwicklung der Kinder und Jugendlichen ab, genauso wie der Zeitpunkt des Erkrankungsbeginns nicht zu unterschätzen ist. Auch weiß man noch zu wenig über die Ätiologie psychiatrischer Erkrankungen. In diesem Sinn benötigt es noch viele Studien und Untersuchungen zum Thema „Psychopharmaka im Kindes- und Jugendalter“, um noch genauere Indikationen stellen und eventuell bessere Medikamente entwickeln zu können. Trotz den vielen Mängeln wäre es aber dennoch unverantwortlich einem Kind / Jugendlichem eine medikamentöse Therapie vorzuenthalten, da es vor allem bei psychotherapeutischen Maßnahmen in Kombination mit Arzneimittel schon viele positive Rückmeldungen gibt. 60 10. Literaturverzeichnis [1] Mutschler E, Geisslinger G, Kroemer H K et al.: Mutschler Arzneimittelwirkungen, 9. Auflage, Wissenschaftlicher Verlagsgesellschaft mbH, Stuttgart, 2008. [2] Gerlach M, Mehler-Wex C, Walitza S et al.: Neuro-/ Psychopharmaka im Kindes- und Jugendalter, 3. Auflage, Springer Verlag, Berlin, 2016. [3] Bauman P, Hiemke C, Ulrich S et al.: The AGNP-TDM expert group consensus guidelines: Therapeutic drug monitoring in psychiatry. Pharmacopsychiatry 2004;37:243-265. [4] Informationen zum Kompetenznetzwerk TDM KJP e.V.: http://www.tdm-kjp.de/ [letzter Zugriff am 24.08.2016] [5] Müller WE, Möller HJ: Einteilung nach klinisch-therapeutischen Wirkprofilen, sedierende vs. eher nicht sedierende Antidepressiva. In: Riederer P, Laux G, Pöldinger W (Hrsg.): Antidepressiva, Phasenprophylaktika und Stimmungsstabilisierer. Neuro-/Psychopharmaka. Ein Therapie-Handbuch. Bd. 3., 2. Auflage, Springer Verlag, Wien, 2002. [6] Bezchlibnyk-Butler KZ, Virani AS (Hrsg.): Clinical handbook of psychotropic drugs for children and adolescents, 2. Auflage, Hogrefe & Huber, Seattle, 2007. [7] Taurines R, Warnke A, Greenhill L, Gerlach M: Antidepressants. In: Gerlach M, Warnke A, Greenhill L (Hrsg.): Psychiatric drugs in children and adolescents. Basic pharmacology and practical applications, Springer, Wien, 2014, pp 83-155. [8] Bandelow B, Bleich S, Kropp S (Hrsg.): Handbuch Psychopharmaka, 3. Auflage, Hogrefe, Göttingen, 2011. [9] March JS, Silva S, Petrycki S et al.: Fluoxetine, cognitive-behavioral therapy, and their combination for adolescents with depression: Treatment for Adolescents With Depression Study (TADS) randomized controlled trial. JAMA 2004;292:807820. 61 [10] Pathak S, Kratochvil CJ, Rogers GM et al.: Comarative efficacy of cognitive behavioral therapy, fluoxetine and their combination in depressed adolescents: initial lessons from the treatment for adolescents with depression study. Curr Psychiat Rep 2005;7:429-434. [11] Deutsche Gesellschaft für Kinder- und Jugendpsychiatrie, Psychosomatik und Psychotherapie, DGKJP: Behandlung von depressiven Störungen bei Kindern und Jugendlichen, Evidenz- und konsensusbasierte Leitlinie (S3), 2013, AWMFRegisternummer 028-043. http://www.awmf.org/leitlinien/detail/ll/028-043.html [letzter Zugriff am 24.08.2016] [12] Haddad P: The SSRI discontinuation syndrome. J Psychopharmacol 1998;12:305-313. [13] Fava GA, Bernadi M, Tomba E et al.: Effects of gradual discontinuation of selective serotonin reuptake inhibitors in panic disorder with agoraphobia. Int J Neuropsychop 2007;10:835-838. [14] Bridge JA, Jyengar S, Salary CB et al.: Clinical response and risk for suicidal ideation and suicide attempzs in pediatric antidepressant treatment. JAMA-J Am Ned Assoc 2007;297:1683-1696. [15] Gibbons RD, Brown CH, Hur K et al.: Suicidal thoughts and behaviour with antidepressant treatment: Reanalysis of the randomized placebo-controlled studies of fluoxetine and venlafaxine. Arch Gen Psychiat 2012;69:580-587. [16] De Jonghe F, Ravelli DP, Tuynman-Qua H: A randomized, double-blind study of fluoxetine and maprotiline in the treatment of major depression. Pharmacopsychiatry 1991;24:62-67. [17] Szegedi A, Wetzel H, Angersbach D et al.: Response to treatment in minor and major depression: results of double-blind comparative study with paroxetine and maprotiline. J Affect Disord 1997;45:167-178. [18] Quintero J, López-Munoz F, Alamo C et al.: Reboxetine for ADHD in children non-responders or with poor tolerance to methylphenidate: a prospective longterm open-label study. Atten Defic Hyperact Disord 2011;2:107-133. 62 [19] Toren P, Ratner S, Weizman A et al.: Reboxetine maintenance treatment in children with attention-deficit/hyperactivity disorder: a long-term follow-up study. J Child Adol Psychop 2007;17:803-812. [20] Avci A, Diler RS, Kibar M et al.: Comparrison of moclobemide and placebo in young adolescents with major depressive disorder. Ann Med Sci 1999;8:31-40. [21] Sarris J: St. John’s wort for the treatment of psychiatric disorders. Psychiat Clin Am 2013;36:65-72. [22] Haase HJ: About prevalence and interpretation of the psychomorot Parkinson syndrome in megaphen or largactil treatment duration. Nervenarzt 1954;25;486492. [23] Haase HJ, Janssen PAJ: The action of neuroleptic drugs. Year Book Medical, Chicago, 1965. [24] Möller HJ, Müller WE, Bandelow B: Neuroleptika. Pharmakologische Grundlagen, klinisches Wissen und therapeutischen Vorgehen. Wissenschaftliche Verlagsgesellschaft, Stuttgart, 2001. [25] AACAP Official Action: Paractice parameter for the assessment and treatment of children and adolescents with schizophrenia. J Am Acad Child Psy 2001; 40(Suppl):4-S23. [26] Correl CU: Antipsychotic use in children and asolescents: Minimizing adverse effects to maximize outcome. J Am Acad Child Psy 2008;47:9-20. [27] AACAP Official Action: Practice parameter for the assessment and treatment of children and adolescents with anxiety disorders. J Am Acad Child Psy 2007;46:267-283. [28] Strawn JR, Sakolsky DJ, Rynn MA: Psychopharmacologic treatment of children and andolescents with anxiety disorders. Child Adol Psych Cl 2012;21:527-539. [29] Möller HJ, Volz HP, Reimann IR et al.: Opipramol for the treatment of generalized anxiety. A placebo controlled trial including an alprazolam treated group. J Clin Psychopharmacol 2001;21:59-65. 63 [30] Sallee F, Connor DF, Newcorn JH: A review of the rational and clinical utilization of α2-adrenoceptor agonists for the treatment of attention- deficit/hyperactivity and related disorders. J Child Adol Psychop 2013;23:308-319. [31] AACAP Official Action: Practice parameter for the use of stimulant medications in the treatment of children, adolescents and adults. J Am Child Psy 2002;41(Suppl 2):26S-49S. [32] Schloesser RJ, Martinowich K, Manji HK: Mood-stabilizing drugs: mechanism of action. Trends Neurosci 2012;35:36-46. [33] Grunze H, Bauer M: Medikamente zur Behandlung bipolarer affektiver Störungen. In: Gründer G, Benkert O (Hrsg.): Handbuch der Psychopharmakatherapie, 2. Auflage, Springer, Berlin, 2012, pp 629-657. [34] Kowatch RA, Suppes T, Carmody TJ et al.: Effect size of lithium, divalproex sodium, and carbamazepine in children and adolescents with bipolar disorder. J Am Acad Child Psy 2000;39:713-720. [35] Joshi G, Wozniak J, mick E at al.: A prospective open-label trial if extendedrelease carbamazepine monotherapy in children with bipolar disorder. J Child Adoll Psychop 2012;20.7-14. [36] Chang E, Saxena K, Howe M: An open-label study of lamotrigine adjunct or monotherapy for the treatment of adolescents with bipolar disorders. J Am Acad Child Adolesc Psychiatry 2006;45:298-304. [37] Biederman J, Joshi G, Mick E et al.: A prospective open-label trial of lamotrigine monotherapy in children and adolescents with bipolar disorders. CNS Neurosci Ther 2010;16:91-102. [38] DGBS e.V., DGPPN e.V.: S3-Leitlinie zur Diagnostik und Therapie Bipolarer Störungen. Langversion 1.0. 2012. https://www.dgppn.de/fileadmin/user_upload/_medien/download/pdf/kurzversionleitlinien/s3-leitlinie-bipolar.pdf [letzter Zugriff am 24.08.2016] [39] Davanzo P, Nikore V, Yehya N et al.: Oxcarbazepine treatment of juvenileonset bipolar disorder. J Child Adolesc Psychopharmacol 2004;14:344-345. 64 [40] Teitelbaum M: Oxcarbazepine in bipolar disorder. J Am Acad Child Adolesc Psychiatry 2001;40:993-994. [41] Wozniak J, Mick E, Waxmonsky J et al.: Comparison of open-label, 8-week trials of olanzapine monotherapy and topiramate augmentation of olanzapine for the treatment of pediatric bipolar disorder. J Child Adolesc Psychopharmacol 2009;19:539-554. [42]Tramontina S, Zeni CP, Pheula G et al.: Topiramate in adolescents with juvenile bipolar disorder presenting weight gain due to atypical antipsychotics or mood stabilizers: An open clinical trial. J Child Adol Psychop 2007;17:129-134. [43] Findling RL, McNamara NK, Youngstrom EA et al.: Double-blind 18-month trial of lithium versus divalproex maintenance treatment in pediatric bipolar disorder. J Am Acad Child Psy 2005;44:409-417. [44] DelBello MP, Kowatch RA, Adler Cm at al.: A double-blind, randomized pilot study comparing quetiapine and divalproex for adolescent mania. J Am Acad Child Adolesc Psychiatry 2006;45:305-313. [45] Geller B, Luby JL, Joshi P et al.: A randomized controlled trial of risperidone, lithium, or divalproex sodium for initial treatment of bipolar I disorder, maniac or mixed phase, in children and adolescents. Arch Gen Psychiat 2012;69:515-528. [46] Khanzode L, Saxena K, Kraemer H et al.: Efficacy profiles of psychopharmacology: divalproex sodium in conduct disorder. Child Psychiatry Hum Dev 2006;37:55-64. [47] Steiner H, Petersen M, Saxena K et al.: Divalproex sodium for the treatment of conduct disorder: a randomized controlled clinical trial. J Clin Psychiatry 2003;264:1183-1191. [48] Dilling H, Mombour W, Schmidt MH: Internationale Klassifikation psychischer Störungen. ICD-10 Kapitel V (F) Klinisch-diagnostische Leitlinien, 9. Auflage, Huber, Bern, 2013. Weitere gelesende Werke: 65 o Rothenberger A, Steinhausen HC: Medikamente für die Kinderseele. Ein Ratgeber zu Psychopharmaka im Kindes- und Jugendalter. Hogrefe, Göttingen, 2005. o Kasper S, Volz HP (Hrsg.): Psychiatrie und Psychotherapie compact. Das gesamte Facharztwissen. 2. Auflage, Thieme, Stuttgart, 2009. o Poustka F, van Goor-Lambo G: Fallbuch Kinder- und Jugendpsychiatrie. Erfassung und Bewertung belastender Lebensumstände von Kindern nach Kapitel V (F) der ICD-10. Ein Lese- und Lernbuch. 2. Auflage, Huber, Bern, 2008. o Mayatepek E: Pädiatrie, 1. Auflage, Elsevier, München, 2007. o Fachinformationen im AustriaCodex 66