12.6 Fetoplazentare Einheit
Werbung

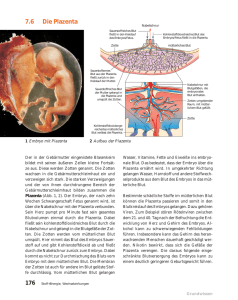
439 12.6 Fetoplazentare Einheit sche Wirkung von Progesteron auf, die Entwicklung des Embryos wird gestört und der Embryo stirbt ab. Das Medikament wird als Einmaldosis unter Aufsicht eines ermächtigten Arztes verabreicht. 36 – 48 h danach wird ein Prostaglandinpräparat verabreicht. Dieses erhöht die Rate der erfolgreichen Schwangerschaftsunterbrechungen auf ca. 95 – 97 % und beschleunigt die Ausstoßung des Embryos durch Erweichung der Zervix. 12.6 Fetoplazentare Einheit 12.6 12.6.1 Plazentation 12.6.1 Plazentation ▶ Definition. Aufgrund seines raschen Wachstums braucht der sich in den ersten Wochen durch einfache Diffusion ernährende Embryo schnell ein leistungsfähigeres Austauschsystem. Dies wird durch die Entwicklung der Plazenta erreicht. Für den uteroplazentaren Kreislauf essenzielle Bestandteile der Plazenta sind der intervillöse Raum und die Zotten, deren Entwicklung in den nachfolgenden Abschnitten beschrieben wird. Durch die Entwicklung der Plazenta entsteht für den rasch wachsenden Embryo ein leistungsfähiges Austauschsystem. Nachfolgend wird die Entwicklung der für den uteroplazentaren Kreislauf essenziellen Plazentabestandteile beschrieben. Intervillöser Raum: Die in der 2. Woche nach der Befruchtung im Synzytiotrophoblasten entstehenden Vakuolen vergrößern sich beständig und konfluieren schließlich zu Lakunen (s.o.). Durch seine lytische Aktivität arrodiert der Synzytiotrophoblast maternale Gefäße, woraufhin sich die Lakunen mit mütterlichem Blut füllen. Am Ende der Schwangerschaft kommunizieren die Lakunen untereinander und bilden ein einziges zusammenhängendes System, das durch den Synzytiotrophoblasten begrenzt und intervillöser Raum genannt wird (Abb. 12.12a). Intervillöser Raum: Als intervillösen Raum (Abb. 12.12a) bezeichnet man die miteinander verbundenen, mit mütterlichem Blut gefüllten Lakunen, die aus Vakuolen im Synzytiotrophoblasten hervorgegangen sind. Zotten: Etwa 2 Wochen nach der Befruchtung dringen Zellen des Zytotrophoblasten in den Synzytiotrophoblasten ein. Dadurch entstehen die primären Trophoblastzotten, die frei in den von mütterlichem Blut durchströmten Lakunen enden. Durch in die Zotten vordringendes mesenchymales Gewebe entwickeln sich zunächst die Sekundärzotten, durch weitere Differenzierung des Zottenmesoblastes zu Bindegewebe und Blutgefäßen entstehen schließlich die sog. Tertiärzotten (Abb. 12.12a). Die Reifung der Tertiärzotten dauert bis zum Ende der Schwangerschaft. Dabei wird die Zottenwandung immer dünner und die Vaskularisierung nimmt zu. Durch eine kontinuierliche Reduktion von Zottendurchmesser und Trophoblastdicke verringert sich die fetomaternale Diffusionsstrecke beim Stoffaustausch (s. u.). Zotten: Etwa 2 Wochen nach der Befruchtung dringen Zellen des Zytotrophoblasten in den Synzytiotrophoblasten ein. Dadurch entstehen die primären Trophoblastzotten, die frei in den von mütterlichem Blut durchströmten Lakunen enden. Infolge weiterer Differenzierungs- und Reifungsprozesse entstehen daraus sog. Tertiärzotten (Abb. 12.12a). Über die Zottenwand erfolgt der fetomaternale Stoffaustausch (s. u.). 12.6.2 Uteroplazentarer Kreislauf 12.6.2 Uteroplazentarer Kreislauf Das sauerstoff- und nährstoffarme fetale Blut strömt über die Aa. umbilicales in das Gefäßsystem der Plazentazotten, die in den intervillösen Raum hineinragen. Dort werden sie permanent von mütterlichem, nährstoff- und sauerstoffreichem Blut aus den Aa. uterinae umspült. Gas- und Stoffaustausch erfolgen über die Zottenwand, die den kindlichen vom mütterlichen Kreislauf trennt (Plazentaschranke, s. u.). Das angereicherte Blut gelangt aus den Zotten über die Nabelschnurvene in den kindlichen Kreislauf und versorgt diesen mit Sauerstoff und Nährstoffen. Das O2- und nährstoffarme fetale Blut strömt über die Aa. umbilicales in die Plazentazotten, die von mütterlichem, nährstoff- und O2-reichem Blut umspült werden. Nach erfolgtem Gas- und Stoffaustausch über die Zottenwand (Plazentaschranke, s. u.) fließt das Blut über die Nabelschnurvene zurück in den kindlichen Kreislauf. ▶ Merke. Die Nabelschnur enthält 1 Nabelvene (V. umbilicalis), die sauerstoffreiches Blut von der Plazenta zum Fetus transportiert, und 2 Nabelarterien (Aa. umbilicales), die sauerstoffarmes Blut vom Fetus zur Plazenta befördern. ▶ Merke. Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. ▶ Definition. Unter Plazentation versteht man die Bildung der Plazenta – von der Entstehung der Primärzotten aus dem Trophoblasten bis zur Ausbildung der Tertiärzotten. Fetoplazentare Einheit 440 12 Sexualentwicklung und Reproduktionsphysiologie Plazenta a b c a Schematische Darstellung eines Querschnitts durch die Plazenta. b Fetale Seite der Plazenta. Unter dem weißlich trüben Amnionepithel, das für die Fruchtwasserbildung zuständig ist, erkennt man die sich verzweigenden Nabelschnurgefäße. c Maternale Seite der Plazenta. Die Oberfläche besteht aus 15 – 20 Kotyledonen, die von einer dünnen Dezidua-Schicht bedeckt sind. Die Furchen zwischen den einzelnen Kotyledonen kennzeichnen die Ansätze der Plazentasepten (vgl. a). 12.6.3 Aufgaben der Plazenta 12.6.3 Aufgaben der Plazenta Stoffaustausch Stoffaustausch Für den Transport der verschiedenen Gase, Nähr- und Abfallstoffe über die Plazentaschranke stehen unterschiedliche Mechanismen zur Verfügung (s. auch S. 7): Diffusion (z. B. für O2 oder CO2) erleichterte Diffusion mithilfe eines membranständigen Transportproteins (z. B. für Glukose oder Laktat) aktiver, ATP verbrauchender Transport (u. a. für Aminosäuren oder Elektrolyte) Pinozytose (z. B. für Proteine, Fette oder Immunglobuline). Über die Plazenta werden Gase, Nähr- und Abfallstoffe zwischen Mutter und Kind ausgetauscht. All diese Substanzen müssen die aus mehreren Schichten bestehende Zottenwand (sog. Plazentaschranke) passieren, die verhindert, dass mütterliches und kindliches Blut miteinander in Berührung kommen. Für den Transport der verschiedenen Stoffe stehen unterschiedliche Mechanismen zur Verfügung (s. auch S. 7): Diffusion zum passiven Transport von Gasen, wie z. B. O2 oder CO2 erleichterte Diffusion mithilfe eines membranständigen Transportproteins zum Transport von Stoffen, wie z. B. Glukose oder Laktat aktiver, ATP verbrauchender Transport u. a. von Aminosäuren oder Elektrolyten Pinozytose zur Beförderung hochmolekularer Stoffe, wie z. B. Proteine, Fette oder Immunglobuline über die Zottenwand. Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. 12.12 Endokrine Funktion Endokrine Funktion Die Plazenta deckt einen Großteil des Hormonbedarfs während der Schwangerschaft. Die Plazenta deckt einen Großteil des Hormonbedarfs während der Schwangerschaft. Humanes Choriongonadotropin (HCG) Humanes Choriongonadotropin (HCG) Verlauf: HCG wir in der Frühschwangerschaft in rasch ansteigenden Mengen vom Trophoblasten synthetisiert (s. S. 437). Der HCG-Spiegel im Blut verdoppelt sich zunächst ca. alle 48 Stunden bis zum Erreichen des Maximums in der 10. Schwangerschaftswoche (SSW). Danach ist ein stetiger Abfall zu verzeichnen, bis nach ca. 18 Schwangerschaftswochen ein Plateau erreicht ist, das bis zum Geburtstermin bestehen bleibt. Verlauf: Der HCG-Spiegel im Blut verdoppelt sich bis zur 10. SSW ca. alle 48 h und fällt anschließend bis zum Erreichen eines Plateaus in der 18. SSW kontinuierlich ab. Das Plateau bleibt bis zur Geburt erhalten. Funktion: HCG stimuliert die Progesteron-(und auch Östrogen-)synthese und -sekretion durch das Corpus luteum graviditatis, bis die Plazenta in der 8.– 10. SSW selbst die Bildung der Steroidhormone übernimmt (s. auch S. 437). in der fetalen NNR die Produktion von DHEA (Dehydroepiandrosteron, s. S. 373), DHEA-S u. a. Steroiden. die Leydig-Zwischenzellen des männlichen Hodens und fördert damit die Testosteronsekretion. Funktion: HCG stimuliert die Progesteron-(und auch Östrogen-)synthese und -sekretion durch das Corpus luteum graviditatis. in der fetalen NNR die Produktion von DHEA, DHEA-S u. a. Steroiden. die Leydig-Zwischenzellen (Testosteronsekretion↑). Humanes Plazentalaktogen (HPL) Humanes Plazentalaktogen (HPL) Verlauf: HPL ist ab etwa der 8. SSW im mütterlichen Blut nachweisbar. Im Verlauf der Schwangerschaft nimmt die Konzentration stetig zu, bis ca. in der 36. SSW ein Plateau erreicht wird. Verlauf: Die Konzentration nimmt ab ca. der 8. SSW bis zum Erreichen eines Plateaus in der 36. SSW stetig zu. Funktion: HPL gleicht strukturell dem hypophysären Wachstumshormon und beeinflusst wie dieses Wachstum und Entwicklung. verursacht durch Lipolyse einen Anstieg freier Fettsäuren, die vom maternalen Organismus als Energiesubstrat verwendet werden können. Die eingesparte Glukose steht dem Fetus zur Verfügung. stimuliert die Entwicklung der Brüste und bereitet im Zusammenspiel mit den Steroidhormonen die Laktation vor (s. S. 448). Funktion: HPL beeinflusst Wachstum und Entwicklung wirkt lipolytisch stimuliert die Entwicklung der Brüste und bereitet im Zusammenspiel mit den Steroidhormonen die Laktation vor (s. S. 448). Corticotropin-Releasing-Hormon (CRH) Corticotropin-Releasing-Hormon (CRH) Verlauf: Die im maternalen Blut messbare Konzentration steigt etwa ab Mitte des zweiten Trimenons an und erreicht mit Beginn der Wehentätigkeit Maximalwerte. Verlauf: Die Konzentration steigt ca. ab Mitte des 2. Trimenons an. Funktion: CRH stimuliert die ACTH-Sekretion der fetalen Hypophyse mit der Folge einer verstärkten Kortisolbildung in der fetalen NNR (→ Kortisol fördert die Reifung der fetalen Lungen). fördert die Produktion von DHEA und DHEA-S (Vorstufen der Steroidhormonsynthese, s. u.) in der fetalen NNR. fördert die Prostaglandinsynthese in Plazenta, Dezidua, Amnion und dem dazwischen liegenden Chorion. Funktion: CRH stimuliert die ACTH-Sekretion der fetalen Hypophyse →Kortisolbildung in der fetalen NNR↑ (fetale Lungenreifung↑) fördert die Produktion von DHEA und DHEA-S (s. u.) in der fetalen NNR fördert die Prostaglandinsynthese. Steroidhormone Steroidhormone Die Plazenta ist bei der Produktion der Steroidhormone auf die Zulieferung der Vorstufen aus dem mütterlichen und kindlichen Kreislauf angewiesen, da die Plazenta – anders als Hoden, Nebennierenrinde oder Ovar – nicht über das steroidale Enzym 17α-Hydroxylase verfügt, das die Umwandlung der C21-Steroide in C19-Steroide gewährleistet. Die Plazenta ist bei der Produktion der Steroidhormone auf die Zulieferung der Vorstufen aus dem mütterlichen und kindlichen Kreislauf angewiesen. Östrogene Östrogene Synthese: Das in der Schwangerschaft hauptsächlich synthetisierte Östrogen ist Östriol. Die Vorstufen der Östriolsynthese (DHEA, DHEA-S) werden in der fetalen Nebennierenrinde gebildet und schließlich von der Plazenta zu Östron, Östradiol und v. a. Östriol umgewandelt. Synthese: Das in der Schwangerschaft hauptsächlich synthetisierte Östriol entsteht in der Plazenta durch Umwandlung von Vorstufen aus der fetalen NNR. Verlauf: Die Östron-, Östradiol- und Östriolproduktion steigt bis zum Geburtstermin hin kontinuierlich an. Verlauf: Die Östrogensynthese steigt bis zur Geburt kontinuierlich an. Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. 441 12.6 Fetoplazentare Einheit 12 Sexualentwicklung und Reproduktionsphysiologie Funktion: S. S. 417. Funktion: S. S. 417. Progesteron Progesteron Synthese: Anders als bei der Östrogensynthese ist der Fetus nicht an der Produktion beteiligt; das Progesteron wird ausschließlich aus mütterlichem Cholesterin synthetisiert. Synthese: Nachdem die Konzentration des HCG (s.o.) ab der 10. SSW allmählich nachlässt, wird die Progesteronproduktion von der Plazenta übernommen („luteoplazentärer Shift“). Anders als bei der Östrogensynthese ist der Fetus nicht an der Produktion beteiligt, das Progesteron wird ausschließlich aus mütterlichem Cholesterin synthetisiert. Verlauf: Die Progesteronspiegel steigen bis zum dritten Trimenon kontinuierlich an. Verlauf: Die Progesteronspiegel im Blut steigen bis zum dritten Trimenon kontinuierlich an. Funktion: S. S. 418. Funktion: S. S. 418. 12.6.4 Fetaler Kreislauf 12.6.4 Fetaler Kreislauf Fetaler Kreislauf und postpartale Umstellungsreaktionen s. S. 158. Informationen zum fetalen Kreislauf und den Umstellungsreaktionen nach der Geburt finden Sie ab S. 158. 12.7 Schwangerschaftsbedingte 12.7 Schwangerschaftsbedingte Veränderungen des mütterlichen Organismus Siehe Tab. 12.6 und S. 448 (Veränderungen der Brustdrüse). 12.6 Veränderungen des mütterlichen Organismus Neben den bereits angesprochenen Vorgängen im mütterlichen Organismus kommt es infolge der hormonellen Umstellung während der Schwangerschaft zu einer Reihe weiterer Veränderungen (Tab. 12.6; zu Veränderungen der Brustdrüse s. S. 448). Veränderungen des mütterlichen Organismus während der Schwangerschaft genitale Veränderungen Vulva, Vagina, Perineum verstärkte Vaskularisierung und Durchblutung → livide Verfärbung der Vagina (Chadwick-Zeichen) und bei entsprechender Disposition evtl. schmerzhafte Varizenbildung durch den erhöhten venösen Druck Hypertrophie der vaginalen glatten Muskelzellen → Anpassung an die zu erwartende Dehnung verstärkte Besiedelung mit Laktobazillen → vermehrte Umwandlung von Glykogen in Milchsäure mit Zunahme der Scheidensekretion Uterus mit Zervix Gewichts- und Größenzunahme: – Hypertrophie und Verlängerung der Muskelzellen mit gleichzeitig gesteigerter Ausbildung von Gap junctions zwischen den einzelnen Myometriumzellen (s. S. 417) → Vervielfachung des Gesamtgewichts der Gebärmutter um den Faktor 12 – 20 (am Beginn der Schwangerschaft ca. 70 – 80 g; am Ende der Schwangerschaft ohne Inhalt ca. 1000 – 1500 g) – von außen – über die Bauchdecke der Schwangeren – messbare Größenzunahme; der Höhenstand des Fundus uteri lässt annäherungsweise auf das Wachstum des Kindes in der Gebärmutter rückschließen starke Ausdehnung der Muskulatur im Bereich des Isthmus uteri → der funktionell eigentlich dem Verschlussapparat des Uterus zugehörige Bereich wird etwa ab dem dritten Schwangerschaftsmonat als „unteres Uterinsegment“ in das Corpus uteri mit einbezogen im Bereich des Gebärmutterhalses kommt es bis zum Geburtstermin durch proteolytische Spaltung und vermehrte Wassereinlagerung (s. u.) innerhalb des Bindegewebes zur Reorganisation der Kollagenfibrillen („Auflockerung“) des Gewebes; sog. Zervixreifung) → ermöglicht die spätere Eröffnung des Muttermundes zum Zeitpunkt der Geburt in relativ kurzer Zeit (Prostaglandine, s. S. 418) Vermehrung von Blut- und Lymphgefäßen → Gewährleistung einer adäquaten Versorgung der sich vergrößernden Gebärmutter; Ödembildung (s.o.) und livide Verfärbung im Zervixbereich Hypertrophie und Hyperplasie der zervikalen Drüsen → Verschluss der Zervix durch einen Schleimpfropf kurz nach der Konzeption; Abgang des dicken Schleims zu Beginn der Wehentätigkeit bzw. kurz vor Geburtsbeginn, häufig unter Beimengung von Blut (sog. „Zeichnen“) Heruntergeladen von: Thieme E-Books & E-Journals. Urheberrechtlich geschützt. 442